Method Article
1分子FRETを用いた膜受容体の立体構造ダイナミクスの可視化
要約
この研究では、Gタンパク質共役型受容体(GPCR)の単一分子蛍光共鳴エネルギー移動(smFRET)実験を実行するための詳細な手順を示します 非天然アミノ酸(UAA)の取り込み による 部位特異的標識を使用します。このプロトコルは、smFRETサンプル調製、実験、およびデータ分析のためのステップバイステップガイドを提供します。
要約
細胞が外部シグナルに応答する能力は、細胞の発生、成長、および生存に不可欠です。環境からの信号に応答するには、細胞がそれを認識して処理できなければなりません。この課題は主に膜受容体の機能に依存しており、その役割はシグナルを細胞の生化学的言語に変換することである。Gタンパク質共役型受容体(GPCR)は、ヒトにおける膜受容体タンパク質の最大のファミリーを構成しています。GPCRの中でも、代謝型グルタミン酸受容体(mGluRs)は、絶対二量体として機能し、リガンド結合部位を含む大きな細胞外ドメインを有するユニークなサブクラスです。mGluRの構造研究における最近の進歩は、それらの活性化過程の理解を改善しました。しかし、活性化および調節中のmGluRを介した大規模な立体配座変化の伝播はよくわかっていません。単一分子蛍光共鳴エネルギー移動(smFRET)は、生体分子の構造ダイナミクスを単一タンパク質レベルで視覚化および定量化するための強力な手法です。mGluR2活性化の動的プロセスを視覚化するために、非天然アミノ酸(UAA)の取り込みに基づく蛍光立体配座センサーが開発され、受容体の天然構造の摂動なしに部位特異的タンパク質標識が可能になりました。ここで説明するプロトコルでは、新しいUAAラベリングアプローチ、サンプル調製、smFRETデータの取得と分析など、これらの実験の実行方法について説明します。これらの戦略は一般化可能であり、さまざまな膜タンパク質の立体構造ダイナミクスを調べるために拡張することができます。
概要
原形質膜を横切る情報の伝達は、膜受容体の機能に大きく依存しています1。受容体へのリガンド結合は、立体構造変化および受容体活性化をもたらす。このプロセスは、本質的にアロステリックであることがよくあります2。800を超えるメンバーを持つGタンパク質共役型受容体(GPCR)は、ヒトにおける膜受容体の最大のファミリーです3。ほぼすべての細胞プロセスにおける役割により、GPCRは治療薬開発の重要な標的となっています。GPCRシグナル伝達の標準モデルでは、アゴニストの活性化は受容体の立体構造変化をもたらし、続いてGαのヌクレオチド結合ポケットでGDPとGTPの交換を介してヘテロ三量体Gタンパク質複合体を活性化します。活性化されたGα-GTPおよびGβγサブユニットは、下流のエフェクタータンパク質の活性を制御し、シグナル伝達カスケードを伝播します4,5。このシグナル伝達プロセスは、本質的に、受容体の三次元形状を変化させるリガンドの能力に依存する。リガンドがこれを達成する方法の機構的理解は、新しい治療法を開発し、合成受容体とセンサーを設計するために重要です。
代謝型グルタミン酸受容体(mGluRs)は、クラスC GPCRファミリーのメンバーであり、グルタミン酸の遅い神経調節効果とニューロンの興奮性を調整するために重要です6,7。すべてのGPCRの中で、クラスCのGPCRは、それらが絶対二量体として機能するという点で構造的に独特である。mGluRには、ハエトリソウ(VFT)ドメイン、システインリッチドメイン(CRD)、膜貫通ドメイン(TMD)の3つの構造ドメインが含まれています8。活性化プロセス中の立体配座変化は複雑であり、12 nmの距離にわたって伝播する局所的およびグローバルな立体配座結合、および二量体の協調性が含まれます。中間的な立体配座、状態の時間的秩序、状態間の遷移速度は不明です。個々の受容体の立体構造をリアルタイムで追跡することにより、活性化中の一過性の中間状態と立体構造変化のシーケンスを特定することができます。これは、mGluR2 11の活性化中の立体構造変化の伝播を視覚化するために最近適用されたように、単一分子蛍光共鳴エネルギー移動9,10(smFRET)を適用することによって達成することができる。FRET実験の重要なステップは、目的のタンパク質にドナーおよびアクセプター蛍光色素を部位特異的に挿入することによるFRETセンサーの生成です。非天然アミノ酸(UAA)取り込み戦略が採用されました12,13,14,15システインレス変異体の作成または大きな遺伝的にコードされたタグの挿入を必要とする典型的な部位特異的蛍光標識技術の限界を克服するため。これにより、mGluR2のリガンド結合ドメインとシグナル伝達ドメインを結合した必須のコンパクトなアロステリックリンカーの立体構造再配列を観察することができました。このプロトコルでは、銅触媒によるアジ化環化反応を用いて蛍光色素を結合させるためのUAAによるmGluR2の部位特異的標識のアプローチなど、mGluR2でsmFRET実験を行うためのステップバイステップガイドを紹介します。さらに、このプロトコルは、膜タンパク質の直接捕捉およびデータ解析のための方法論を記述する。ここで概説したプロトコルは、他の膜タンパク質の立体構造ダイナミクスの研究にも適用できます。
プロトコル
プロトコルの全体的なワークフローを 図 1 に示します。
1.サンプルチャンバーの準備
- スライドとカバーガラスのクリーニング
注意: これらの手順は、スライドの表面とカバーガラスを洗浄し、アミノシラン化の準備をすることを目的としています。表面テザー分子で単一分子蛍光実験を実施するための重要な要件の1つは、不動態化表面です。最も信頼性が高く再現性のあるパッシベーション技術は、不活性ポリマー鎖を緻密な層としてガラス表面に共有結合させることを含む。ポリエチレングリコール(PEG)は、表面パッシベーションに使用される最も効率的なポリマーです16。PEG(PEG化)を用いたパッシベーション手順の詳細を以下に説明する:- スライドに開ける穴をマーカーでマークします(~6 mm離れて、端から離れています)。ドレメルを使用して、スライドガラスに小さな穴(直径1 mm)を開けます。掘削プロセス中にスライドを水に浸します。
- スライドをアセトンで洗って、マーカーから残留インクを取り除きます。
- アセトンから取り出し、スライドを水ですすぎ、高出力(700 W)の水中で5分間電子レンジで加熱します。
- 超音波処理するためにガラス染色瓶に入れる前に、水でスライドをきれいにします。カバーガラスを別の染色瓶に入れます。
- 23°Cのバス超音波処理器で30分間アセトンでスライドとカバーガラスを超音波処理します。
- その間に、次工程で用いるアミノシラン化溶液を調製するためのガラス製フラスコを洗浄する。フラスコを1M KOHで満たし、フラスコを30分間超音波処理し、KOHを水で徹底的に洗い流し、メタノール中でさらに30分間超音波処理する。アミノシラン化工程の時点までフラスコをメタノール中に置いておく。
- その間に、アミノシラン、mPEG、およびビオチン-PEGを冷凍庫(-20°C)から取り出し、暗所で室温(RT)にします。
- スライドとカバーガラスの瓶からアセトンを適切な化学廃棄物容器に処分し、水で十分にすすぎ、5 M KOHでスライドを30分間超音波処理します。
- スライドとカバーガラスを水ですすぎ、メタノールで2分間超音波処理します(2回繰り返します)。アミノシラン化ステップまでメタノールで満たされたジャーを残します。
注:この研究では、特に明記されていない限り、脱イオン水が使用されます。23°Cで動作するバス超音波処理器が使用されます。
- アミノシラン化
注意: このステップは、アミノシランをきれいなスライドとカバーガラスの表面に共有結合させることを目的としています。官能化されたmPEGおよびビオチン-PEGは、次のステップでこの表面に共有結合します。- 清潔なフラスコでアミノシラン化混合物を調製する(ステップ1.6)。メタノール(150 mL)、酢酸(7.5 mL、ガラスピペットを使用)、およびアミノシラン(2.5 mL)を混合して溶液を調製します。
- 化学ヒュームフードで溶液を穏やかに混合し、スライドジャーとカバーガラスジャーに注ぎます。カバーガラスには50 mL、スライドには100 mLを使用します。スライドとカバーガラスが溶液に完全に浸されていることを確認してください。
- 10分間インキュベートし、次に1分間ジャーを超音波処理し(超音波処理は表面から不純物を除去します)、さらに10分間インキュベートします。
- アミノシラン化溶液を廃棄物収集容器に廃棄する。瓶にメタノールを加え、蓋で瓶を閉め、手でそっと振る。メタノールを処分し、瓶に水を入れます。
- アミノシランボトルを冷凍庫(-20°C)に戻します。
- ペグ化
注意: これらの手順では、PEG化手順について説明します。- アミノシラン化の際には、ペグ化バッファーを調製します。84 mgの重炭酸ナトリウム(NaHCO3)を量り、10 mLの水(10 mM)に加えます。さらに、mPEGとビオチン-PEGの重量を量り、脇に置きます。6枚のスライドとカバーガラスには、96 mgのmPEGと1.2〜2.4 mgのビオチン-PEGを使用します。
注:ビオチン-PEGはバックグラウンドスポットの数を増やす可能性があるため、あまり多く追加しないことが重要です。スライドに適用する直前までPEG混合物を溶解しないでください。 - スライドを水ですすぎ、穏やかなエアブローで乾かしてから、加湿した組み立てボックスに入れます。
注:クリーンな航空会社を使用することが不可欠です。ガラスに残留物を残す可能性のある圧縮された缶詰の空気の使用は避けてください。 - PEG粉末混合物にペグ化バッファーを加え、ピペットでゆっくりと上下に複数回ピペットで溶解します。スライドあたり55 μLのペグ化バッファーを追加します(6枚のスライドの場合は、330 μLのペグ化バッファーを追加します)。
- 9,600 x g で23°Cで1分間遠心分離し、未溶解粒子を沈殿させます。次のステップで使用する上清を収集します。
注:ビオチン-PEGは、NHSグループの存在により急速に加水分解します。混合と遠心分離のステップを迅速に行うことが重要です。 - 各スライドに60 μLのPEG化溶液を塗布し、PEG化溶液をスライドとカバーガラスの間に挟むようにカバーガラスを上に置きます。
注意: スライドとカバーガラスの間に気泡を導入すると、不動態化効率が低下するため、避けてください。カバーガラスとスライドをピペットチップで調整して、気泡を取り除きます。 - スライドを平らで暗い引き出しに置きます。スライドは一晩保存できます。ただし、4〜6時間のインキュベーションでは、最適な不動態化が得られます。
注意: どちら側がペグされているかを覚えておくことが重要です。 - 保管する前に、ペグ化されていない側に印を付けてください。インキュベーション後、スライドとカバーガラスを静かに分解し、水で十分にすすいでください
- 空気を吹き付けてスライドとカバーガラスを乾かします。スライドとカバーガラスを滅菌チューブ(50 mL)に入れ、PEG化表面を互いに反対側に向けて保管します。実験当日まで−20°Cで保存する。
注意: 準備から4週間以内にスライドとカバーガラスを使用するのが最善です。PEG化表面は互いに反対側を向いている必要があります。PEG化スライドとカバーガラスを真空シールされたバッグに保管すると、貯蔵寿命を延ばすことができます。
- アミノシラン化の際には、ペグ化バッファーを調製します。84 mgの重炭酸ナトリウム(NaHCO3)を量り、10 mLの水(10 mM)に加えます。さらに、mPEGとビオチン-PEGの重量を量り、脇に置きます。6枚のスライドとカバーガラスには、96 mgのmPEGと1.2〜2.4 mgのビオチン-PEGを使用します。
2. 非天然アミノ酸を組み込んだmGluR2の発現、蛍光標識、抽出
注:このプロトコルは、UAA 4-アジド-L-フェニルアラニン(AZP)を含むmGluR2を発現するための細胞の調製、試薬、および治療の概要を示しています。この手順は、18mmのガラスカバーガラス上で増殖させたHEK293T細胞を対象としています。この手順は、必要に応じてスケールアップできます。
- シード
注:HEK293T細胞を、10%(v / v)ウシ胎児血清、100ユニット·mL-1ペニシリン-ストレプトマイシン、および15 mM HEPESバッファー(補足ファイル1)(pH 7.4)を添加したDMEMで、5%CO2下で37°Cで維持します。- 細胞を0.05%トリプシン-EDTAで継代する。HEK293T細胞をポリL/D-リジン(PLL/PDL)ガラスカバーガラスカバースリップ上に播種し、トランスフェクション時に≥80%のコンフルエントに達するようにします。
- トランスフェクション
- 0.1 M NaOH中のAZPの40 mMストック溶液を調製します。
- 細胞およびmGluR2発現を増殖させるためのAZP添加培地を調製します。40 mM AZPストック溶液を使用して、標準培地(+FBS、ペン/連鎖球菌、15 mM HEPES)を補足します。最終的なAZP濃度を0.6 mMにします。1 M HEPES溶液を追加します(40 mM AZPストック溶液の半分の容量を追加)。例えば、10 mLのAZP添加培地を調製するには、9.775 mLの標準培地、150 μLの40 mM AZPストック溶液、および75 μLの1 M HEPES溶液を組み合わせます。
- シリンジフィルター(0.2 μm、PES)を使用して培地をろ過(滅菌)します。
- トランスフェクションの前に、標準培地をAZP添加培地を含む培地と交換してください。
注意: 培地の交換中に細胞を乾燥させないように注意してください。 - メーカーのマニュアルに従って、トランスフェクション試薬(材料表)で細胞をトランスフェクションします。合計2 μgのDNA(1000 ngのtRNA/シンテターゼ+ 1000 ngのアンバーコドン含有タンパク質プラスミド)を使用して、HEK293T細胞を18 mmのカバーガラスにトランスフェクトします。使用した成分の濃度と量については 表1 を参照してください。
- トランスフェクションの24時間後に培地を新鮮なAZP添加培地に変更し、細胞をさらに24時間増殖させます。
- アルキンシアニン色素による標識
- ラベル貼付の20分前に、カバーガラスを温かい(37°C)記録バッファー(RB)(補足ファイル1)で2回洗浄し、AZPを含まない温かい(37°C)標準培地(+FBS、ペン/ストレプト、15 mM HEPES)に移動します。
- Cy3-アルキン、Cy5-アルキン、BTTES、硫酸銅(II)(CuSO4)、(+)L-アスコルビン酸ナトリウム、およびアミノグアニジンを含む標識溶液を調製します。
- ソリューションの作成と追加の順序に従います(表2)。
- 50 mM BTTESを準備します。
- 100 mMアミノグアニジンを調製します。
- 100 mMのアスコルビン酸Naを準備します。
- 655.5 μLのRBを準備します。
- Cy3/Cy5アルキン色素(DMSOストックで10 mM)をRBに追加します。
注:RBにアミノグアニジンを追加します。 - 20 mM CuSO 4を準備します。
- CuSO4とBTTESを新しいチューブに混ぜます(溶液が青色に変わります)。
- CuSO4 と BTTES の混合物を RB に追加します (2.3.3.6)。
- Na-アスコルビン酸塩を追加します。
- 下の 表2 に示す容量に従って、18mmのカバーガラスを確認してください。
- 溶液を完全に混合し、細胞を標識する前に氷上および暗所で10分間インキュベートします。
- カバーガラスにラベル付け溶液を追加する前に、メディアを取り外してRBで洗浄します。標識溶液を加え、暗所条件下で37°Cで15分間インキュベートします。
- 注:標識を改善するには、10分後にグルタミン酸(最終濃度~0.5 mM)を加え、さらに5分間インキュベートします。銅は細胞に対して非常に有毒であり、標識反応は in vivoで15分以上継続してはなりません。すべてのコンポーネントを新鮮に準備します。最後にNa-アスコルビン酸塩を追加します。調製中は反応液を4°Cに保ちます。但し、標識液を添加するに際し、細胞はインキュベーター内で37°Cで保存することになっている。
- 細胞を採取し、タンパク質を抽出する(細胞溶解)
- 標識溶液を取り出し、mGluR2トランスフェクト細胞を含むカバーガラス(18 mm)をRBで2回洗浄します。
- ピペットを使用して、カバーガラスから細胞を洗い流し、RB(1 mL)に再懸濁します。
注意: この時点以降、サンプルの光への露出をできるだけ最小限に抑えてください。 - 細胞を1,000 x g で4°Cで5分間回転させてペレット化し、上清を除去します。細胞ペレットを80〜130 μLの溶解溶液に再懸濁します。
注:細胞ペレットは目で見えるはずです。溶解量は、標識および洗浄プロセス中に失われるサンプルの量によって異なります。 - ピペッティングで穏やかに混ぜてペレットを砕きます。ホイルで包み、4°Cのロッカーに0.5〜1時間置き、細胞を溶解します。
- 不溶性画分を20,000 x g および4°Cで20分間遠心分離してペレット化します。上清を新鮮なコールドチューブ(目的の蛍光タグ付きタンパク質を含む溶解タンパク質)に移し、実験のために氷上に保管します。
3. 1分子フローチャンバーの組み立てと機能化
- 冷凍庫からスライドとカバーガラスを取り出し、暗闇の中でRTで温めます(~30分)。
- スライドとカバーガラスの間に両面テープのストリップを挟んで、両面テープを使用してチャンバーを組み立てます。PEG化表面がフローチャンバーの内部を形成していることを確認してください。
- ピペットチップを使用してカバースリップを押し、テープがカバースリップとスライドの両方に完全に接触していることを確認します。カバーガラスを壊さないように注意してください。スライドの端にエポキシを塗ります。
注意: ドリルで開けた穴にエポキシが充填されるほど多く追加しないでください。 - カバーガラス側を下に向けてフローチャンバーを加湿された暗い箱に入れ、エポキシを乾燥させます(~30分)。
注意: 乾燥期間中にエポキシが穴(10〜15μL)を覆うのを防ぐために、ドリルで開けた穴にT50バッファー(補足ファイル1)を追加します。 - 各チャンバーレーンに~40 μLをゆっくりと塗布し、500 nMニュートラアビジン(T50で希釈)で各チャンバーレーンをインキュベートします。
- 加湿した暗い箱の中でRTで2分間インキュベートします。レーンあたり~100 μLのT50バッファーで洗浄します。
- 各チャンバーレーンを20 nMビオチン化抗体11でインキュベートします。抗体の選択は、タンパク質のタグに依存します。
注:一次抗体がビオチン化されていない場合は、最初にビオチン化二次抗体と30分間インキュベートし、次に一次抗体とインキュベートします。 - 加湿した暗い箱の中でRTで30分間インキュベートします。レーンあたり~200 μLのT50で洗浄します。
注意: 準備プロセス中にレーンが乾かないようにしてください。
4. 単一分子バッファー
- トロロックスバッファ
注:Troloxバッファーは、イメージングバッファーを作成するための開始バッファーです。緩衝液の成分は実験に依存し、目的のタンパク質に応じて変化し得る。ここで説明するプロトコルで使用されるバッファーには、塩(NaCl、KCl、CaCl2、MgCl2)、緩衝剤(HEPES)、およびトロロックス(pH ~7.35)が含まれます。- 9〜10 mgのトロロックスを10 mLの単一分子記録バッファーに溶解します(SRB、 補足ファイル1)
注:トロロックスはバッファーをわずかに酸性にします。この段階で、水酸化ナトリウム(NaOH)溶液、10 M(pH 7.35)を使用してpHを調整します。微調整は、トロロックスが完全に溶解した後に行われます。しかしながら、この時点でpHを上げると、トロロックスの溶解度が増加する。 - ベンチトップロッカー(アルミホイルで包んだ)を使用してRTで溶液を4〜8時間混合し、トロロックスを完全に溶解します。
- pHを確認し、必要に応じて調整します。
- トロロックスが完全に溶解していることを確認してください。溶液をシリンジフィルターで滅菌し、4°Cで保存します。
注:バッファーは、2〜10日間のエージング後に使用する必要があります。トロロックスはまばたきを抑制するのに役立ち、単一分子研究で一般的に使用されています17。アンチブリンキング特性は、トロロックス18の酸化誘導体に由来します。したがって、成熟するには少なくとも数時間はRTに保つことをお勧めします。さらに、新鮮なトロロックス溶液のUV放射は酸化プロセスをスピードアップし、トロロックスバッファー18の「老化」を加速するために使用できます。
- 9〜10 mgのトロロックスを10 mLの単一分子記録バッファーに溶解します(SRB、 補足ファイル1)
- イメージングバッファーレシピ:トロロックスバッファー+界面活性剤(界面活性剤のCMC値の~2倍)+4 mMプロトカテク酸(PCA)を混合します。
注意: 洗剤濃度が高いとタンパク質変性が増加する可能性があるため、洗剤濃度はCMCの近くに保たれます。例えば、以下の混合物は、955 μLのトロロックス+5 μL 10%DDM+コレステロール(W%、10:1)+40 μLの100 mM PCAストック溶液を使用することができる。ここで、PCAは抗酸化剤として作用し、以前にsmFRET研究19で使用されていました。DDMは非イオン性であり、膜タンパク質を可溶化するために一般的に使用されており20,21、単一分子研究で使用されています。DDMは良い第一選択の洗剤です。ただし、複数の洗剤をテストし、結果が一貫していることを確認することをお勧めします。
5. 顕微鏡のセットアップとsmFRETデータの取得
- コンピュータと顕微鏡の電源を入れます。レーザーをオンにしてウォームアップします(Cy3励起の場合は532 nm、Cy5励起の場合は640 nm)。
注:ここでは、100倍のTIRF対物レンズ(N.A.1.49)、画像スプリッター、およびEMCCDカメラを備えた倒立顕微鏡を使用しました。セットアップには、4ラインレーザーコンバイナー、ダイクロイックミラー、ロングパス発光フィルター、発光ダイクロイックフィルター、ノッチフィルターが装備されています。 - EMCCDカメラの電源を入れ、カメラソフトウェアを開きます。カメラが-69°Cに達して安定するまで20分待ちます。
- サンプルチャンバーを顕微鏡ステージに取り付けます。タンパク質サンプルを徐々に追加して、視野あたり~400分子を達成します(ステップ2.4.5)。チャンバーを100 μLのイメージングバッファーで洗浄します。
- ゲイン、取得率、レーザー出力を調整して、ドナーチャネルとアクセプターチャネルの両方で単一分子蛍光シグナルが検出されるようにします。必要に応じて、サンプルチャンバー内のタンパク質の濃度を調整します。
注:視野内に400を超える分子があると、個々の分子を区別することがより困難になり、バックグラウンドノイズが高くなります。 - ドナーを励起し、視野内のドナー分子の少なくとも80%が光退色されるまでタイムトレースを取得します。
- 映画の終わりに、640 nmレーザーをオンにして、アクセプター分子の一部が光退色するまでアクセプターを直接励起し、多量体からの単一分子の識別を容易にします。
- 別の視野に移動し、上記の手順を繰り返して、条件ごとに少なくとも3つのムービー(テクニカルレプリケート)を収集します。
注意: 新しい関心領域(ROI)を選択し、焦点を合わせるときは、可能な限り低いレーザー出力を使用して、光退色を最小限に抑えます。取得中のステージドリフトに注意してください。新しいROIに移行した後に顕著なドリフトが観察された場合は、3分間待ってから取得を開始します。
6.データ分析
- ドナーとアクセプターのチャネルアライメント(ムービーマッピング)
- 蛍光ビーズ画像をドナーチャネルとアクセプターチャネルに記録します。
- 各分子22,23からのドナーおよびアクセプター蛍光を相関させるビーズデータを用いてマッピングファイルを生成する。
注:単一分子からの発光信号は、イメージスプリッター内の発光ダイクロイックフィルターによってドナー信号とアクセプター信号に分割されます。ドナー画像とアクセプター画像は、カメラに並べて投影されます。2つの領域間で単一分子のドナー強度とアクセプター強度を正確に関連付けるために、蛍光ビーズサンプルを使用してマッピングファイルを生成することがよくあります。このマッピングファイルを使用して、ドナーチャネルとアクセプターチャネルで検出されたすべての分子が相互にマッピングされます。次に、分析により、各分子の時間の経過に伴うドナー強度とアクセプター強度であるタイムトレースが生成されます。
- 単一分子FRETトレースの選択(粒子ピッキング)
注:個々の粒子トレースは、MATLABを使用したダウンストリーム分析のために検査および選択されます。正確な選択基準はシステムによって異なります。ここでは、品質パーティクルを構成するものに関する一般的なガイドラインを概説します。カスタムで変更されたすべてのコードは、GitHub (https://github.com/vafabakhsh-lab) で入手できます。- トレースの合計強度(ドナー+アクセプター)が経時的に安定しているトレースを選択します。ドナー強度とアクセプター強度に反相関変化があるトレースを選択します。
- シングルステップの光退色を示すドナー分子とアクセプター分子を選択します。長さが >5 秒のトレースを選択します。
注意: 漂白後の各チャンネルの背景はゼロになるはずです。トレースには、多くの点滅イベントがあってはなりません。これにより、分析の難易度が上がります。 - 式E =(I A− 0.088 × I D)/(I D + [IA− 0.088 × I D])24,25,26を使用してFRET効率を計算し、ここで、I DおよびIAはそれぞれ生のドナーおよびアクセプター強度である。
注:アクセプターチャネルへのドナー放出の漏れは、532nmレーザー26を使用して励起されたドナーのみの標識サンプルを使用して決定されます。リーク補正係数0.088は、使用するフィルタセットによってセットアップによって異なる場合があります。FRET効率を絶対距離に定量的かつロバストに変換するには、複数の要因についてドナー強度とアクセプター強度を補正する必要があり、27以前に広く議論されていることに注意することが重要です。
- 隠れマルコフモデリング(HMM)による立体配座状態の同定
- MATLAB で vbFRET28 プログラムを実行し、特定の条件に対して選択したトレースをインポートします。実行する可能性のある状態と反復の数の制約を設定します。
注:代表的な結果からの生データに基づいて、コンフォメーションセンサーによって占められる最大4つの個別のFRET状態があると仮定されました。したがって、1〜4つの州の範囲が指定されました。フィッティングの改善は、以前は>25回の反復で無視できるほど増加すると判断されていました。したがって、代表データの適合に25回の反復が使用されました。 - smFRETトレースを分析し、理想化されたトレースと分析セッションをエクスポートします。理想化されたトレースを、下流解析用に別のフォルダーに保存します。
注:理想化されたトレースから状態遷移と滞留時間データを抽出するために使用されるプログラムは、以前に公開された作業29で利用可能になりました。 - MATLABプログラムを使用して、状態遷移を抽出し、開始コンフォメーションを示すX座標と終了コンフォメーションを示すY座標を含むヒートマップとしてプロットします。
注:遷移は、ここで説明する代表的な結果におけるFRET値>0.1の変化として定義されます。遷移の閾値は、目的のタンパク質が占める仮定された立体配座状態(遷移閾値を最も近いFRET状態間の差よりも小さく設定する)、および実験セットアップで許容される分解能に依存します。複数の条件のヒートマップを調べることで、センサーが遷移して占有する最も一般的なコンフォメーション状態を特定できます。代表的な結果について、4つのFRET状態が同定された(FRET = 0.31、0.51、0.71、および0.89)。 - MATLABプログラムを使用して、識別された各立体配座状態の滞留時間を抽出します。データ集録中の各状態と時間分解能を示すFRET値の範囲を指定します。FRET範囲は、隣接するFRET状態によって均等に分割されます。特定の処理条件の滞留時間をエクスポートします。
注: ほとんどの場合、滞留時間データは 1 つの指数減衰関数によって適切に推定できます。この分析は、データ分析およびグラフ作成ソフトウェアで実行できます。
- MATLAB で vbFRET28 プログラムを実行し、特定の条件に対して選択したトレースをインポートします。実行する可能性のある状態と反復の数の制約を設定します。
- 州の占有率を定量化するためのsmFRET母集団ヒストグラムのガウスフィッティング
- 関心のある条件の母集団FRETヒストグラムをデータ解析およびグラフ作成ソフトウェアにインポートして、多重ピークフィッティング解析を行います。
- 存在するピークの数を示します(HMM分析に基づく4つのピークまたは状態)。フィッティングは、次のように
 定義される複数のガウス分布30を用いて行い、ここで、Aはピーク面積、xcはピーク中心、wは各ピークのピーク幅である。
定義される複数のガウス分布30を用いて行い、ここで、Aはピーク面積、xcはピーク中心、wは各ピークのピーク幅である。 - 継ぎ手パラメータを A > 0、 xc = FRET ± 0.02、および 0.1 ≤w≤ 0.24 として拘束します。個々の集団FRETヒストグラムの4つのFRETピークが同時に適合した。すべての条件の継ぎ手に定義された拘束を適用します。
- 占有状態(パーセンテージ)を、対象のピークの面積を総面積で割ったものとして計算し、すべてのピークの合計として定義します。
結果
UAAベースのFRETセンサーの発現と蛍光標識
本明細書では、mGluR2(548UAA)のCRD内へのUAA(AZP)の挿入および蛍光標識の例示的な結果が考察される11。前述のように、AZPをmGluR2に挿入するには、改変tRNA合成酵素と相補的tRNA(pIRE4-Azi)を含む改変翻訳機構と、突然変異誘発法を用いて作成された548位のアンバーコドンを含むmGluR2の共発現が必要です(図2A、B)。シアニン色素によるAZPの標識は、銅触媒による環化付加反応によって達成され(図2C)、548UAAの効果的な原形質膜標識をもたらします(図2D)。全長548UAAの翻訳および二量体受容体の完全性を検証するために、Cy5で標識された548UAAを発現するHEK293T細胞からの細胞ライセートに対してSDS-PAGE電気泳動を行った。250KDaで単一のバンドが観察され、これは全長二量体mGluR2と一致しました(図2E)。
データの取得と解析
C末端FLAGタグを有する548UAAを発現する細胞をCy3(ドナー)およびCy5(アクセプター)で標識し、次いでインビトロ研究のためにプロテアーゼ阻害剤の存在下で界面活性剤31で溶解した。細胞溶解が完了し、遠心分離によって不溶性画分が除去されたら、上清を抗FLAGタグ抗体で機能化したポリエチレングリコール(PEG)不動態化カバーガラス上に塗布し、全反射蛍光(TIRF)イメージングを行いました(図3)。サンプルは532 nmレーザーを使用して照射され、粒子はsmCameraソフトウェアを使用して下流分析のために選択されました。生のドナー、アクセプター、およびFRETトレースは、smCameraで選択されたすべての分子に対して生成され、MATLABを使用して選択されました(セクション6;図4)。8.8%のドナーブリードスルー補正を、ここで使用した実験セットアップのアクセプター強度に適用しました。この補正係数は、使用する実験セットアップ、ダイクロイックフィルター、および発光フィルターによって異なり、ドナー蛍光色素のみで標識された細胞を使用して標準的な実験条件下でドナーおよびアクセプターシグナルを測定し、ブリードスルー([アクセプター強度]/[ドナー強度])を計算することによって決定する必要があります。図4は、いくつかの代表的なFRETトレースと、対応するドナーおよびアクセプターシグナルを示しています。これらのトレースは、プロトコル(セクション6)で前述した基準を使用して選択されました。複数の状態およびドナーおよびアクセプター漂白イベント間の遷移を示す代表的な選択されたトレースを図4B−Dに示す。
立体配座状態の同定
548UAAが占める立体配座状態およびこれらの状態の相互関係を同定するために、隠れマルコフモデリング(HMM)解析を実施した。HMM解析は、MATLAB28 で実行されたvbFRETプログラムを使用して実行しました(図5A)。 図5 は、中間グルタミン酸濃度(5μM)からのデータを使用して、状態同定のプロセスを説明する。生のsmFRETトレースに基づいて、CRDには最大4つの潜在的なFRET状態が存在するという仮説が立てられました。したがって、州の数は1から4に制限されました。全体として、各トレースに対して25回のフィッティング反復が実行され、存在する状態の数が決定されました。これらの理想化された適合から、離散FRET状態間の遷移を抽出し、遷移密度ヒートマップとしてプロットすることができます(図5B)。ヒートマップは、点線で示されている0.31、0.51、0.71、および0.89の4つの個別のFRET状態を強調表示します。トランジションは、FRET >0.1 での変更として定義されました。理想化されたFRETトレースは、識別された各コンフォメーションの滞留時間に関する情報も提供します(図5C)。
ポピュレーションFRETヒストグラムの生成とピークフィッティング
さらなる分析のために手動で選択された様々なグルタミン酸濃度の存在下での548UAAの代表的な単一分子トレースを 図6A、Bに示す。smFRET実験の一般的な分析は、実験条件ごとに数百のsmFRETトレースから母集団ヒストグラムを生成することです(図6C)。母集団FRETヒストグラムは、漂白前のトレースのセグメントから作成されます。ヒストグラムが長いトレースの動作に偏らないようにするには、平均化する前に各トレースから正規化されたFRETヒストグラムを生成する必要があります。これにより、各トレースが最終的なヒストグラムに等しく寄与するようになります。このシステムでは、FRETヒストグラムは、グルタミン酸濃度の増加とともにより高いFRETへの一般的なシフトを示し、CRD間の距離の減少と活性立体配座へのシフトを示しています。しかし、グルタミン酸濃度に関係なく、FRET信号はかなり散発的なままであり、CRDの高度な固有ダイナミクスを示しています。より高いFRETへの一般的なシフトに加えて、コンフォメーションアンサンブルの再分布がヒストグラム(カラーカーブ)で明らかになります。個々の分子もこれらの立体構造状態(破線)を訪れているのを見ることができます(図6B)。州の占有確率を決定するには、ピークの面積を、4つの個々のピーク面積すべての合計として定義される総面積で割る必要があります。mGluR2のCRDのsmFRET実験から生成されたsmFRETヒストグラムは、それぞれ0.31、0.51、0.71、および0.89にピークを持つ4つの動的状態を示しました(状態1〜4でラベル付けされています)。

図1:作業プロトコルとデータ分析のフローチャート。 この図の拡大版を表示するには、ここをクリックしてください。

図2:クリックケミストリーによるmGluR2の部位特異的標識 。 (A)細胞内における非天然アミノ酸4-アジド-L-フェニルアラニン取り込みプロセスの概略図。(B)銅触媒アジド-アルキンクリック反応による、548位の非天然アミノ酸によるmGluR2の部位特異的蛍光標識を示す模式図。(C)蛍光標識したmGluR2(緑はドナー分子、赤色はアクセプター分子)とCy3とCy5分子がドッキングした立体構造。 (D)548UAAを発現するHEK293T細胞の代表的な共焦点顕微鏡画像で、ドナー(緑:Cy3)およびアクセプター(赤:Cy5)蛍光色素で標識した細胞表面集団をクリックケミストリーで標識します。スケールバー = 10 μm。 (E)548UAAを発現し、Cy5-アルキンで標識したHEK293T細胞からの細胞ライセートの非還元4%-20%ポリアクリルアミドゲル電気泳動の画像。ゲルは、633 nmの励起波長と670-BP30発光フィルター-レーンa:タンパク質ラダーで画像化されます。レーンB:細胞ライセート;レーンc:Cy5-アルキン色素。結果は個々の実験を代表するものです。パネル B、 D、 およびE は、Liauwら11から再利用されています。 この図の拡大版を表示するには、ここをクリックしてください。
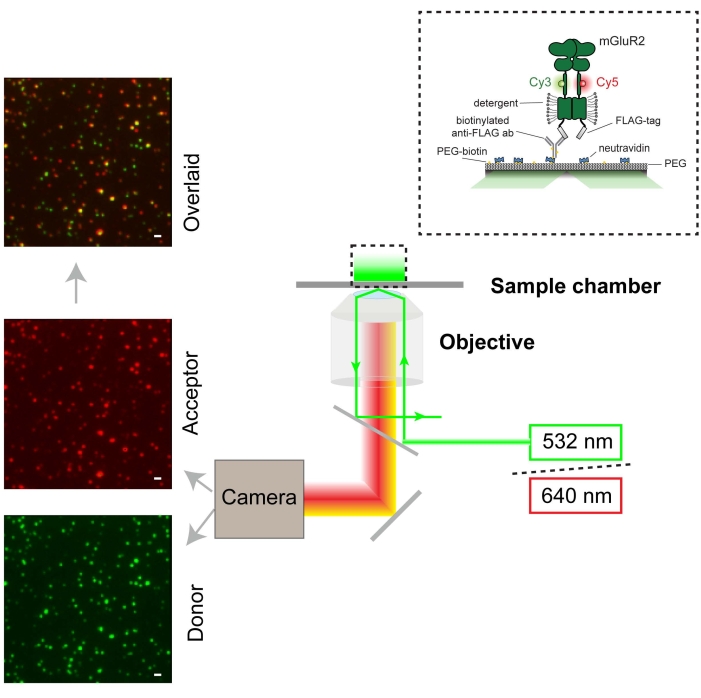
図3:smFRET実験と顕微鏡セットアップ(TIRF)の概略図。ドナーの単一分子蛍光画像は緑色(スケールバー= 1000 nm)で示され、アクセプターは赤色で示されています。ドナーをレーザーを用いて532nmで励起した。アクセプターは、ドナーからのFRETによって興奮します。この図の拡大版を表示するには、ここをクリックしてください。
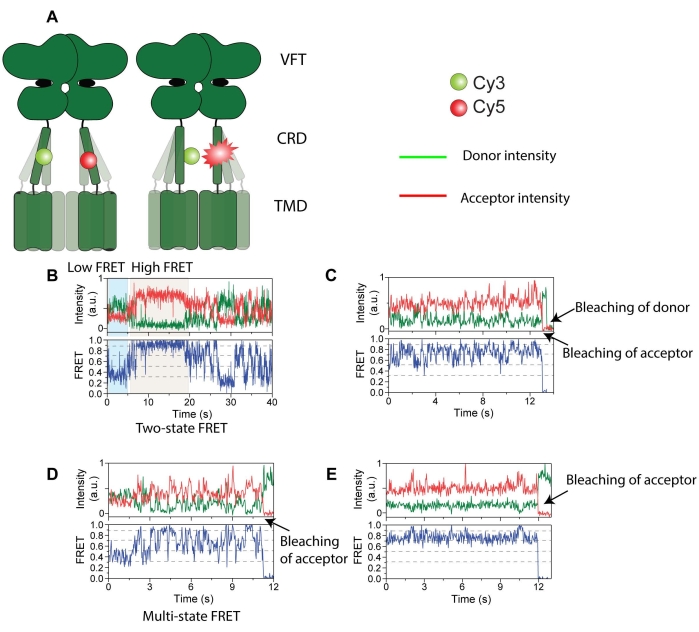
図4:mGluR2と標識されたドナー(緑)とアクセプター(赤)の強度トレース 。 (A)受容体動態とFRETプローブ間の距離の変化を示す漫画。(B)長寿命の高FRET状態。(C)最初にアクセプター光退色、続いてドナー光退色を伴う複数のFRET状態。(D)アクセプター光退色を伴う短寿命のFRET状態。(E)アクセプター光退色を伴う長寿命の安定なFRET状態。この図は、Liauw et al.11から最小限の修正を加えて再現されています。 この図の拡大版を表示するには、ここをクリックしてください。

図5:立体配座状態の識別。 (A)理想化されたフィット感を重ね合わせた代表的なFRETトレース(赤)と、対応するドナーおよびアクセプターシグナル。(B)548UAAによって受けた最も頻繁な立体配座遷移を強調する遷移密度ヒートマップ。破線は FRET の状態を示します。(C)各立体構造状態の平均滞留時間。この図は、Liauw et al.11から最小限の修正を加えて再現されています。 この図の拡大版を表示するには、ここをクリックしてください。

図6:1分子FRETは、mGluR2 CRDの4つの立体構造状態を明らかにし ます。 (A)左側にドナーチャネル(Cy3)、右側にアクセプターチャネル(Cy5)を持つ単一分子映画の代表的なフレーム。ダウンストリーム処理のために分析ソフトウェアによって選択された分子は、緑色の円で示されています。スケールバー= 3μm。 (B)異なるグルタミン酸濃度での548UAAの単一分子タイムトレースの例。ドナー(緑)とアクセプター(赤)の強度と対応するFRETを示します(青)。破線は、4 つの異なる FRET 状態を表します。(c)グルタミン酸濃度の範囲におけるsmFRET集団ヒストグラム。データは、 N = 3つの独立した実験の平均±SEMを表す。この図は、Liauw et al.11から最小限の修正を加えて再現されています。 この図の拡大版を表示するには、ここをクリックしてください。

図7:プロトコル全体の要約 。 (a)非天然アミノ酸を含むタンパク質を発現する細胞を増殖および標識するためのワークフロー。(B)mGluR2の立体構造状態を特定し、CRDドメインの動的特性を特徴付けるために使用される単一分子FRET実験および分析ワークフロー。 この図の拡大版を表示するには、ここをクリックしてください。
| コンポーネント | 容量/反応量(μL) |
| 還元血清培地。 | 100 |
| トランスフェクション試薬 | 4.4 |
| コンポーネント | 容量/反応量(μL) |
| 還元血清培地。 | 100 |
| P3000型 | 4 |
| コンストラクト/コンポーネント名 | 濃度 (ng/μL) | 容量/ウェル (12 ウェル) (μL) | ウェルズ (#) | 添加されたDNA(μL) |
| tRNA/シンテターゼ | 1000 | 1 | 1 | 1 |
| 琥珀コドン含有タンパク質 | 1000 | 1 | 1 | 1 |
表1:HEK 293 T細胞のトランスフェクション用試薬。
| 試薬 | 添加量(μL) | ストックコンク(mM) | 最終濃度 (mM) |
| 1x RB | 655.5 | ||
| ティッカー | 10.5 | 50 | 0.75 |
| CuSO4 | 5.25 | 20 | 0.15 |
| ナアスク | 17.5 | 100 | 2.5 |
| アミノG | 8.75 | 100 | 1.25 |
| Cy3-アルキン (10 mM) | 1.25 | 10 | 0.018 |
| Cy5-アルキン (10 mM) | 1.25 | 10 | 0.018 |
表2:標識溶液の組成(クリック化学)。
補足ファイル1:本研究で用いた各種緩衝液の組成。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
GPCRは、細胞膜上で作用してシグナル伝達を開始するタンパク質です。多くのGPCRは複数のドメインで構成されており、シグナリングはドメイン間の協調的相互作用に依存しています。これらの膜受容体の特性を調節するためには、複数のドメインの動的挙動を理解することが不可欠です。単一分子蛍光共鳴エネルギー移動(smFRET)は、タンパク質の立体構造とダイナミクスをリアルタイムで測定できる蛍光技術です11,32。ここでは、smFRET、単一分子プルダウン(SiMPull)、および全反射蛍光(TIRF)顕微鏡を組み合わせて、不動態化された表面に固定化された個々のタンパク質の再配列を直接視覚化するアプローチについて説明します5,11,33。FRETは距離に非常に敏感で、分子内変化(3-8 nm)のプローブに適したナノスケール定規として効果的に機能します。従来の生物物理学的アプローチと比較して、smFRETは、~10 msのタイムスケールでの大規模なコンフォメーションダイナミクスの研究に特に適しており、必要なサンプル量が少ない(実験あたり約1fmol)。さらに、核磁気共鳴(NMR)34や二重電子電子共鳴(DEER)分光法35によって提供されるような立体配座ダイナミクスのアンサンブル測定とは対照的に、smFRETは、立体構造状態とその時間順序の両方の明示的な割り当て、およびまれで一時的な中間状態の直接検出を可能にします。
現在、部位特異的蛍光標識の限界は、タンパク質の立体構造ダイナミクスを研究するためのsmFRETの広範な適用を妨げる技術的課題を提起しています。さらに、膜タンパク質を大量に精製し、その活性を維持することは困難である。一般的な標識戦略では、大きなタンパク質タグを利用するか、最小限のシステイン変異体を生成する必要があり、多くの場合、蛍光色素の結合を露出したシステイン残基のないタンパク質の末端に制限します。これらの制限を回避するために、非天然アミノ酸(UAA)取り込み戦略が適応および最適化され、銅触媒クリック反応を使用した非摂動性の残基特異的標識が可能になりました11、12、14。この戦略により、膜受容体の溶媒曝露領域全体に蛍光色素を結合させることができ、より幅広いコンフォメーションセンサーの生成が可能になります。このプロトコルでは、単一のタイプの共役化学が使用されます。これにより、ドナー-ドナーおよびアクセプター-アクセプターのみの集団が得られ、ダウンストリーム分析では省略されます。あるいは、2つの直交標識戦略を使用して、これを回避したり、目的のタンパク質が対称でない場合に起こりうる不均一性を克服することができます。
タンパク質を直接捕捉することで、時間がかかり、技術的に困難な従来の精製ステップをバイパスできます。銅の細胞毒性により、トランスシクロオクタン36 またはメチルテトラジン37 に基づく銅フリークリックケミストリーも採用されています。しかしながら、それらの試薬は高価であり、そして反応の非位置特異的38 の性質は、目的の蛍光タグタンパク質の低収率をもたらす。
ここでは、フローチャンバーの準備からデータ分析までの in vitro smFRET実験の詳細なガイドラインを紹介しました。smFRETデータはTIRFセットアップを使用して収集され、分析はカスタム記述されたMATLABコードを使用して実行されました。
いくつかの重要な考慮事項に注意する必要があります。まず、PEG不動態化表面をビオチンPEGで均質で密度の低いものに準備する必要があります。過剰なビオチン-PEGは、過剰なタンパク質プルダウンをもたらし、個々の分子からの蛍光シグナルの分離を困難にする可能性があります。第二に、タンパク質サンプル(細胞ライセート上清)は、表面飽和を避けるためにサンプルチャンバーに加える前に完全に希釈する必要があります。タンパク質の収量は、細胞密度、選択した界面活性剤、および界面活性剤濃度によって異なります。単一のドナーとアクセプターのペアの数を最適化するには、256 x 512ピクセルの視野で~400分子の密度をターゲットにする必要があります。第三に、トロロックスバッファーは、長期使用(月)のために-20°Cで保存する必要があります。トロロックスバッファーは、4°Cで保存した場合、2週間安定なままです。 最後に、抗体による機能化後にフローチャンバーに気泡を導入しないように注意する必要があります。フローチャンバーを乾燥させると、タンパク質の固定化とサンプルタンパク質の変性の効率が低下します。
ここで説明したmGluR2センサーの構造ダイナミクスは、smFRETを使用して個々の受容体レベルでうまく調べられ、受容体活性化のメカニズムへの洞察を提供しました。CRDは、グルタミン酸の有無に関係なく、4つの立体構造FRET状態の間で平衡状態に存在する高レベルの固有のダイナミクスを示すことがわかりました。より高いFRET状態またはよりコンパクトな受容体への移行は、グルタミン酸濃度依存的に起こることが示されました(図6)。興味深いことに、グルタミン酸の飽和レベルでも、CRDは動的なままでした。立体構造ダイナミクスを理解するためにここに提示された方法(図7に要約)は、他のクラスC GPCRだけでなく、イオンチャネル、イオノトロピック受容体、受容体チロシンキナーゼ(RTK)などの他の膜タンパク質にも適用できます32,39。
開示事項
著者は競合する利益を宣言しません。
謝辞
議論してくれたReza Vafabakhshラボのメンバーに感謝します。この作業は、国立衛生研究所の助成金R01GM140272(R.V.へ)、ノースウェスタン大学の生命科学のためのサールリーダーシップ基金、およびシカゴコミュニティトラストのサール基金(R.V.へ)の支援を受けたシカゴ生物医学コンソーシアムによって支援されました。B.W.L.は、国立総合医学研究所(NIGMS)のトレーニング助成金T32GM-008061の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| (+)-Sodium L-Ascorbate | Sigma Aldrich | Cat # 11140-250G | |
| 4-azido-L-phenylalanine | Chem-Impex International | Cat # 06162 | |
| 548UAA | Liauw et al. 2021 | Transfected construct | |
| Acetic Acid | Fisher Chemical | 64-19-7 | |
| Acetone | Fisher Chemical | 67-64-1 | |
| Adobe Illustrator (2022) | https://www.adobe.com/ | RRID:SCR_010279 | Software, algorithm |
| Aminoguanidine (hydrochloride) | Cayman Chemical | 81530 | |
| Aminosilane | Aldrich | 919-30-2 | |
| Bath Sonicator 2.8 L | Fisher Scientific | Ultrasonic Bath 2.8 L | |
| Biotin-PEG | Laysan Bio Inc | Item# Biotin-PEG-SVA-5000-100mg | |
| BTTES | Click Chemistry Tools | 1237-500 | |
| Copper (II) sulfate | Sigma Aldrich | Cat # 451657-10G | |
| Cover slip | VWR | 16004-306 | Sample chamber |
| Cy3 Alkyne | Click Chemistry Tools | TA117-5 | |
| Cy5 Alkyne | Click Chemistry Tools | TA116-5 | |
| DDM | Anatrace | Part# D310 1 GM | Detergent |
| DDM-CHS (10:1) | Anatrace | Part# D310-CH210 1 ML | Detergent with cholecterol |
| Defined Fetal Bovine Serum | Thermo Fisher Scientific | SH30070.03 | |
| Di01-R405/488/561/635 | Semrock | Notch filter | |
| DMEM | Corning | 10-013-CV | |
| EMCCD | Andor | DU-897U | Camera |
| ET542lp | Chroma | Long pass emission filter | |
| FF640-FDi01 | Semrock | Emission dichroic filter | |
| FLAG-tag antibody | Genscript | A01429 | |
| Fluorescent bead | Invitrogen T7279 | TetraSpeck microspheres | Spherical bead |
| Glass slides | Fisherfinest | 12-544-4 | sample chamber |
| Glutamate | Sigma Aldrich | Cat # 6106-04-3 | |
| HEK 293T | Sigma Aldrich | Cat # 12022001 | Cell line |
| HEPES | FisherBioReagents | 7365-45-9 | |
| Image splitter | OptoSplit II | ||
| KOH | Fluka | 1310-58-3 | |
| Laser | Oxxius | 4-line laser combiner | |
| Lipofectamine 3000 Transfection Reagent | Thermo Fisher Scientific | L3000015 | Transfection Reagent |
| Methanol | Fisher Chemical | 67-56-1 | |
| Microscope | Olympus | Olympus IX83 | |
| Milli-Q water | Barnstead | Water Deionizer | |
| m-PEG | Laysan Bio Inc | Item# MPEG-SIL-5000-1g | |
| NF03-405/488/532/635 | Semrock | Dichroic mirror | |
| OptiMEM | Thermo Fisher Scientific | 51985091 | Reduced Serum Medium |
| OptiMEM/Reduced serum medium | Thermo Fisher Scientific | ||
| OriginPro (2020b) | https://www.originlab.com/ | RRID:SCR_014212 | Data analysis and graphing software |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| pIRE4-Azi | Addgene | Plasmid # 105829 | Transfected construct |
| Poly-L-lysine hydrobromide | Sigma Aldrich | Cat # P2636 | |
| Protocatechuic acid (PCA) | HWI group | 99-50-3 | |
| smCamera (Version 1.0) | http://ha.med.jhmi.edu/resources/ | Camera software | |
| Sodium bicarbonate | FisherBioReagents | 144-55-8 | |
| Sodium hydroxide (NaOH) | Sigma | 1310-73-2 | |
| Syringe filter | Whatman UNIFLO | Cat#9914-2502 | Liquid filtration |
| Trolox | Sigma | 53188-07 |
参考文献
- Smock, R. G., Gierasch, L. M. Sending signals dynamically. Science. 324 (5924), 198-203 (2009).
- Changeux, J. P., Christopoulos, A. Allosteric modulation as a unifying mechanism for receptor function and regulation. Cell. 166 (5), 1084-1102 (2016).
- Tang, X. -. l., Wang, Y., Li, D. -. l., Luo, J., Liu, M. -. Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacologica Sinica. 33 (3), 363-371 (2012).
- Chung, K. Y., et al. Conformational changes in the G protein Gs induced by the β2 adrenergic receptor. Nature. 477 (7366), 611-615 (2011).
- Vafabakhsh, R., Levitz, J., Isacoff, E. Y. Conformational dynamics of a class C G-protein-coupled receptor. Nature. 524 (7566), 497-501 (2015).
- Niswender, C. M., Conn, P. J. Metabotropic glutamate receptors: Physiology, pharmacology, and disease. Annual Review of Pharmacology and Toxicology. 50, 295-322 (2010).
- Pin, J. P., Bettler, B. Organization and functions of mGlu and GABA(B) receptor complexes. Nature. 540 (7631), 60-68 (2016).
- Kniazeff, J., et al. Closed state of both binding domains of homodimeric mGlu receptors is required for full activity. Nature Structural & Molecular Biology. 11 (8), 706-713 (2004).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Schuler, B., Eaton, W. A. Protein folding studied by single-molecule FRET. Current Opinion in Structural Biology. 18 (1), 16-26 (2008).
- Liauw, B. W. -. H., Afsari, H. S., Vafabakhsh, R. Conformational rearrangement during activation of a metabotropic glutamate receptor. Nature Chemical Biology. 17 (3), 291-297 (2021).
- Noren, C. J., Anthonycahill, S. J., Griffith, M. C., Schultz, P. G. A general method for site-specific incorporation of unnatural amino acids into proteins. Science. 244 (4901), 182-188 (1989).
- Presolski, S. I., Hong, V. P., Finn, M. Copper-catalyzed azide-alkyne click chemistry for bioconjugation. Current Protocols in Chemical Biology. 3 (4), 153-162 (2011).
- Huber, T., Naganathan, S., Tian, H., Ye, S. X., Sakmar, T. P. Unnatural amino acid mutagenesis of GPCRs using amber codon suppression and bioorthogonal labeling. G Protein Coupled Receptors: Structure. 520, 281-305 (2013).
- Serfling, R., Coin, I., Pecoraro, V. Chapter Four - Incorporation of Unnatural Amino Acids into Proteins Expressed in Mammalian Cells. Methods in Enzymology. 580, 89-107 (2016).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549 (2014).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Cordes, T., Vogelsang, J., Tinnefeld, P. On the mechanism of Trolox as antiblinking and antibleaching reagent. Journal of the American Chemical Society. 131 (14), 5018-5019 (2009).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Lee, S., et al. How do short chain nonionic detergents destabilize G-protein-coupled receptors. Journal of the American Chemical Society. 138 (47), 15425-15433 (2016).
- Cao, A. -. M., et al. Allosteric modulators enhance agonist efficacy by increasing the residence time of a GPCR in the active state. Nature Communications. 12 (1), 1-13 (2021).
- Mancebo, A., Mehra, D., Banerjee, C., Kim, D. -. H., Puchner, E. M. Efficient cross-correlation filtering of one-and two-color single molecule localization microscopy data. Frontiers in Bioinformatics. 1, 739769 (2021).
- Mehra, D., Adhikari, S., Banerjee, C., Puchner, E. M. Characterizing locus specific chromatin structure and dynamics with correlative conventional and super-resolution imaging in living cells. Nucleic Acids Research. , (2022).
- Chen, H., Puhl, H. L., Koushik, S. V., Vogel, S. S., Ikeda, S. R. Measurement of FRET efficiency and ratio of donor to acceptor concentration in living cells. Biophysical Journal. 91 (5), 39-41 (2006).
- Gopich, I. V., Szabo, A. FRET efficiency distributions of multistate single molecules. The Journal of Physical Chemistry B. 114 (46), 15221-15226 (2010).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-A multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L., Wiggins, C. H. Learning rates and states from biophysical time series: A Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Zhang, J., et al. Specific structural elements of the T-box riboswitch drive the two-step binding of the tRNA ligand. Elife. 7, 39518 (2018).
- Goodman, N. R. Statistical analysis based on a certain multivariate complex Gaussian distribution (an introduction). The Annals of Mathematical Statistics. 34 (1), 152-177 (1963).
- Brown, R. B., Audet, J. Current techniques for single-cell lysis. Journal of the Royal Society Interface. 5, 131-138 (2008).
- Schamber, M. R., Vafabakhsh, R. Mechanism of sensitivity modulation in the calcium-sensing receptor via electrostatic tuning. Nature Communications. 13 (1), 2194 (2022).
- Jain, A., Liu, R., Xiang, Y. K., Ha, T. Single-molecule pull-down for studying protein interactions. Nature Protocols. 7 (3), 445-452 (2012).
- Huang, S. K., et al. Delineating the conformational landscape of the adenosine A(2A) receptor during G protein coupling. Cell. 184 (7), 1884-1894 (2021).
- Wingler, L. M., et al. Angiotensin analogs with divergent bias stabilize distinct receptor conformations. Cell. 176 (3), 468-478 (2019).
- Gordon, C. G., et al. Reactivity of biarylazacyclooctynones in copper-free click chemistry. Journal of the American Chemical Society. 134 (22), 9199-9208 (2012).
- Kim, E., Koo, H. Biomedical applications of copper-free click chemistry: In vitro, in vivo, and ex vivo. Chemical Science. 10 (34), 7835-7851 (2019).
- Pickens, C. J., Johnson, S. N., Pressnall, M. M., Leon, M. A., Berkland, C. J. Practical considerations, challenges, and limitations of bioconjugation via azide-alkyne cycloaddition. Bioconjugate Chemistry. 29 (3), 686-701 (2018).
- Geng, Y., et al. Structural mechanism of ligand activation in human calcium-sensing receptor. Elife. 5, 13662 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2037
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。