Method Article
הדמיה של הדינמיקה הקונפורמציונית של קולטני ממברנה באמצעות FRET של מולקולה בודדת
In This Article
Summary
מחקר זה מציג הליך מפורט לביצוע ניסויים של העברת אנרגיה בתהודה פלואורסצנטית של מולקולה בודדת (smFRET) על קולטנים מצומדים לחלבון G (GPCRs) באמצעות תיוג ספציפי לאתר באמצעות שילוב חומצות אמינו לא טבעיות (UAA). הפרוטוקול מספק מדריך שלב אחר שלב להכנת דגימות smFRET, ניסויים וניתוח נתונים.
Abstract
יכולתם של תאים להגיב לאותות חיצוניים חיונית להתפתחות התאים, לגדילתם ולהישרדותם. כדי להגיב לאות מהסביבה, תא חייב להיות מסוגל לזהות ולעבד אותו. משימה זו מסתמכת בעיקר על תפקודם של קולטני הממברנה, שתפקידם להמיר אותות לשפה הביוכימית של התא. קולטנים מצומדים לחלבון G (GPCRs) מהווים את המשפחה הגדולה ביותר של חלבוני קולטני ממברנה בבני אדם. בקרב GPCRs, קולטני גלוטמט מטאבוטרופיים (mGluRs) הם תת-מחלקה ייחודית המתפקדת כדימרים מחייבים ובעלת תחום חוץ-תאי גדול המכיל את אתר קשירת הליגנד. ההתקדמות האחרונה במחקרים מבניים של mGluRs שיפרה את ההבנה של תהליך ההפעלה שלהם. עם זאת, התפשטות של שינויים קונפורמיים בקנה מידה גדול באמצעות mGluRs במהלך ההפעלה והמודולציה אינה מובנת היטב. העברת אנרגיית תהודה פלואורסצנטית של מולקולה בודדת (smFRET) היא טכניקה רבת עוצמה להמחשה וכימות של הדינמיקה המבנית של ביומולקולות ברמת החלבון הבודד. כדי להמחיש את התהליך הדינמי של הפעלת mGluR2, פותחו חיישנים קונפורמיים פלואורסצנטיים המבוססים על שילוב לא טבעי של חומצות אמינו (UAA) שאפשרו תיוג חלבונים ספציפיים לאתר ללא הפרעה למבנה המקומי של קולטנים. הפרוטוקול המתואר כאן מסביר כיצד לבצע ניסויים אלה, כולל הגישה החדשנית לתיוג UAA, הכנת דגימות ואיסוף וניתוח נתוני smFRET. אסטרטגיות אלה ניתנות להכללה וניתן להרחיב אותן כדי לחקור את הדינמיקה הקונפורמציונית של מגוון חלבוני ממברנה.
Introduction
העברת המידע על פני קרום הפלזמה תלויה במידה רבה בתפקוד קולטני הממברנה1. קשירת ליגנד לקולטן מובילה לשינוי קונפורמציה ולהפעלת קולטן. תהליך זה הוא לעתים קרובות allosteric בטבע2. עם למעלה מ-800 חברים, קולטנים מצומדים לחלבון G (GPCRs) הם המשפחה הגדולה ביותר של קולטני ממברנה בבני אדם3. בשל תפקידם כמעט בכל התהליכים התאיים, GPCRs הפכו ליעדים חשובים לפיתוח טיפולי. במודל הקנוני של איתות GPCR, הפעלת אגוניסט גורמת לשינויים קונפורמיים של הקולטן המפעילים לאחר מכן את קומפלקס חלבון G ההטרוטרימרי באמצעות חילופי תמ"ג עבור GTP בכיס קשירת הנוקלאוטידים שלG α. יחידות המשנה המופעלות Gα-GTP ו-Gβγ שולטות בפעילות של חלבוני אפקטים במורד הזרם ומפיצות את מפל האיתות 4,5. תהליך איתות זה תלוי למעשה ביכולתם של ליגנדים לשנות את הצורה התלת-ממדית של הקולטן. הבנה מכניסטית של האופן שבו ליגנדות משיגות זאת היא קריטית לפיתוח טיפולים חדשים ולתכנון קולטנים וחיישנים סינתטיים.
קולטני גלוטמט מטאבוטרופיים (mGluRs) הם חברים במשפחת ה-GPCR מדרגה C והם חשובים להשפעות הנוירומודולטוריות האיטיות של גלוטמט וכוונון הרגישות העצבית 6,7. מבין כל ה-GPCRs, GPCRs מסוג C הם ייחודיים מבחינה מבנית בכך שהם מתפקדים כדימרים מחייבים. mGluRs מכילים שלושה תחומים מבניים: תחום מלכודת הזבובים של ונוס (VFT), תחום עשיר בציסטאין (CRD) ותחום טרנס-ממברנה (TMD)8. השינויים הקונפורמיים במהלך תהליך ההפעלה הם מורכבים וכוללים צימוד קונפורמציה מקומי וגלובלי המתפשט על פני מרחק של 12 ננומטר, כמו גם שיתוף פעולה עמום. תצורות הביניים, הסדר הזמני של המצבים וקצב המעבר בין מדינות אינם ידועים. על ידי ביצוע קונפורמציה של קולטנים בודדים בזמן אמת, ניתן לזהות את מצבי הביניים החולפים ואת רצף השינויים הקונפורמיים במהלך ההפעלה. ניתן להשיג זאת על ידי יישום העברת אנרגיית תהודה פלואורסצנטית של מולקולה בודדת 9,10 (smFRET), כפי שיושם לאחרונה כדי לדמיין את התפשטות השינויים הקונפורמיים במהלך ההפעלה של mGluR2 11. שלב מפתח בניסויי FRET הוא יצירת חיישני FRET על ידי החדרה ספציפית לאתר של התורם והמקבל פלואורופורים לחלבון המעניין. אסטרטגיית שילוב של חומצות אמינו לא טבעיות (UAA) אומצה12,13,14,15 כדי להתגבר על המגבלות של טכנולוגיות תיוג פלואורסצנטיות טיפוסיות ספציפיות לאתר הדורשות יצירת מוטנטים ללא ציסטאין או החדרת תג גדול המקודד גנטית. זה איפשר את הסידור מחדש הקונפורמי של המקשר האלוסטרי הקומפקטי החיוני, שהצטרף לתחומי קשירת הליגנד והאיתות של mGluR2, כדי להיות נצפה. בפרוטוקול זה מוצג מדריך שלב אחר שלב לביצוע ניסויי smFRET ב- mGluR2, כולל הגישה לתיוג ספציפי לאתר של mGluR2 עם UAA להצמדת פלואורופורים באמצעות תגובת מחזור אזיד מזורזת נחושת. יתר על כן, פרוטוקול זה מתאר את המתודולוגיה ללכידה ישירה של חלבוני ממברנה וניתוח נתונים. הפרוטוקול המתואר כאן ישים גם לחקר הדינמיקה הקונפורמציונית של חלבוני ממברנה אחרים.
Protocol
זרימת העבודה הכוללת של הפרוטוקול מתוארת באיור 1.
1. הכנת תא הדגימה
- ניקוי מגלשות וכיסויים
הערה: שלבים אלה נועדו לנקות את המשטחים של השקופיות כמו גם את הכיסויים ולהכין אותם לאמינוזילניזציה. אחת הדרישות הקריטיות לביצוע ניסויים פלואורסצנטיים של מולקולה בודדת על מולקולות הקשורות לפני השטח היא משטח פסיבי. טכניקת הפסיבציה האמינה והניתנת לשחזור כוללת חיבור קוולנטי של שרשראות פולימריות אינרטיות למשטח הזכוכית כשכבה צפופה. פוליאתילן גליקול (PEG) הוא הפולימר היעיל ביותר המשמש לפסיביות פני השטח16. הפרטים של הליך הפסיבציה באמצעות PEG (PEGylation) מתוארים להלן:- סמן חורים שיש לקדוח על השקופיות עם סמן (~ 6 מ"מ זה מזה והרחק מהקצה). השתמש ב-Dremel כדי לקדוח חורים קטנים (בקוטר 1 מ"מ) במגלשת הזכוכית. לטבול את המגלשות במים במהלך תהליך הקידוח.
- שטפו את השקופיות עם אצטון כדי להסיר שאריות דיו מהטוש.
- מוציאים מאצטון ושוטפים את המגלשות במים, ואז מחממים אותן במיקרוגל במשך 5 דקות במים בהספק גבוה (700 W).
- נקו את המגלשות במים לפני שתניחו אותן בצנצנת צביעה מזכוכית לבדיקה. מניחים את הכיסויים בצנצנת מכתים אחרת.
- סוניקו את השקופיות והכיסויים באצטון למשך 30 דקות בסוניק אמבטיה בטמפרטורה של 23 מעלות צלזיוס.
- בינתיים, נקה בקבוק זכוכית להכנת תמיסת האמינוזילניזציה המשמשת בשלב הבא. ממלאים את הבקבוקון ב-1 M KOH, מדליקים את הבקבוקון למשך 30 דקות, שוטפים היטב את ה-KOH במים, ולאחר מכן מסננים במשך 30 דקות נוספות במתנול. השאירו את הבקבוקון במתנול עד למועד שלב האמינוזילניזציה.
- בינתיים, הסירו את האמינוזילן, ה-mPEG והביוטין-PEG מהמקפיא (−20 מעלות צלזיוס) ואפשרו להם להגיע לטמפרטורת החדר (RT) בחושך.
- יש להשליך אצטון מהמגלשה ולכסות את הצנצנות במיכל הפסולת הכימית המתאים, לשטוף היטב במים, ולאחר מכן להניף את המגלשות ב-5 M KOH למשך 30 דקות.
- שטפו את המגלשות והכיסויים במים, ולאחר מכן הוסיפו מתנול למשך 2 דקות (חזרו פעמיים). השאירו את הצנצנות מלאות במתנול עד לשלב האמינוזילניזציה.
הערה: במחקר זה נעשה שימוש במים שעברו דה-יוניזציה, אלא אם צוין אחרת. נעשה שימוש בסוניק אמבטיה הפועל בטמפרטורה של 23 מעלות צלזיוס.
- אמינוזילניזציה
הערה: שלב זה נועד לקשר באופן קוולנטי את האמינוזילאן למשטח ההחלקה והכיסוי הנקיים. mPEG וביוטין-PEG פונקציונליים ייקשרו באופן קוולנטי למשטח זה בשלב הבא.- הכינו תערובת אמינוזילניזציה בבקבוק נקי (שלב 1.6). הכן את הפתרון על ידי ערבוב מתנול (150 מ"ל), חומצה אצטית (7.5 מ"ל, השתמש פיפטה זכוכית), ו aminosilane (2.5 מ"ל).
- מערבבים את התמיסה בעדינות במכסה האדים הכימיים, ואז יוצקים אותה לתוך צנצנות ההחלקה והכיסוי. השתמש ב-50 מ"ל עבור הכיסויים וב-100 מ"ל עבור השקופיות. ודא שהשקופיות והכיסויים שקועים לחלוטין בפתרון.
- דגירה במשך 10 דקות, ולאחר מכן sonicate את הצנצנות במשך 1 דקות (סוניקציה מסיר את הזיהומים מן פני השטח), ו דגירה במשך 10 דקות נוספות.
- יש להשליך תמיסת אמינוזילניזציה במיכל איסוף הפסולת. מוסיפים מתנול לצנצנות, סוגרים את הצנצנות עם מכסים ומנערים בעדינות ביד. יש להשליך את המתנול, ולמלא צנצנות במים.
- החזירו את בקבוק האמינוסילן למקפיא (−20 מעלות צלזיוס).
- PEGylation
הערה: שלבים אלה מתארים את הליך PEGylation.- במהלך aminosilanization, להכין את חיץ pegylation. שוקלים 84 מ"ג של סודיום ביקרבונט (NaHCO3) ומוסיפים אותו ל-10 מ"ל מים (10 מ"מ). בנוסף, שוקלים mPEG וביוטין-PEG ומניחים אותם בצד. עבור שש שקופיות וכיסויים, יש להשתמש ב-96 מ"ג mPEG וב-1.2-2.4 מ"ג ביוטין-PEG.
הערה: חשוב לא להוסיף יותר מדי ביוטין-PEG מכיוון שהוא יכול להגדיל את מספר כתמי הרקע. אין להמיס את תערובת PEG עד ממש לפני המריחה על שקופיות. - לשטוף את המגלשות עם מים, לייבש אותם עם מכה אוויר עדין, ולאחר מכן למקם אותם בתיבות הרכבה לחות.
הערה: חיוני להשתמש בחברת תעופה נקייה. הימנע משימוש באוויר משומר דחוס, אשר יכול להשאיר שאריות על הזכוכית. - יש להוסיף חיץ פגילציית לתערובת אבקת PEG ולפיפטה מעלה ומטה בעדינות מספר פעמים כדי להתמוסס. הוסף 55 μL של חיץ pegylation לכל שקופית (עבור שש שקופיות, להוסיף 330 μL של חיץ pegylation).
- צנטריפוגה ב-9,600 x גרם למשך דקה אחת ב-23 מעלות צלזיוס כדי לזרז חלקיקים לא פתורים. אסוף את הסופרנטנט לשימוש בשלב הבא.
הערה: ביוטין-PEG עובר הידרוליזה במהירות עקב נוכחותה של קבוצת NHS. חשוב לבצע את שלבי הערבוב והצנטריפוגה במהירות. - יש למרוח תמיסת PEGylation של 60 μL על כל שקופית ולאחר מכן להניח את מכסה הכיסוי על גביו, כך שתמיסת ה-PEGylation תהיה דחוקה בין השקופית למכסה הכיסוי.
הערה: הימנע מהכנסת בועות בין השקופית לכיסוי, מכיוון שהדבר יפחית את יעילות הפסיבציה. הסר את כל הבועות על ידי התאמת הכיסוי והשקופית עם קצה פיפט. - הניחו את השקופיות במגירה שטוחה וחשוכה. ניתן לאחסן שקופיות למשך הלילה; עם זאת, דגירה במשך 4-6 שעות גורמת לפסיביות אופטימלית.
הערה: חשוב לזכור איזה צד הוא pegylated. - סמן את הצד שאינו פגום לפני האחסון. לאחר הדגירה, יש לפרק בעדינות ולשטוף היטב את המגלשות והכיסויים במים
- ייבשו את המגלשות והכיסויים על ידי נשיפת אוויר. שמור את השקופיות והכיסויים בצינור סטרילי (50 מ"ל), כאשר משטח ה- PEGylated פונה זה לזה. יש לאחסן בטמפרטורה של −20°C עד ליום הניסוי.
הערה: מומלץ להשתמש בשקופיות ובכיסויים תוך 4 שבועות מההכנה. משטחי ה-PEGylated צריכים לפנות הרחק זה מזה. אחסון השקופיות והכיסויים של PEGylated בשקיות אטומות בוואקום יכול להאריך את חיי המדף שלהן.
- במהלך aminosilanization, להכין את חיץ pegylation. שוקלים 84 מ"ג של סודיום ביקרבונט (NaHCO3) ומוסיפים אותו ל-10 מ"ל מים (10 מ"מ). בנוסף, שוקלים mPEG וביוטין-PEG ומניחים אותם בצד. עבור שש שקופיות וכיסויים, יש להשתמש ב-96 מ"ג mPEG וב-1.2-2.4 מ"ג ביוטין-PEG.
2. ביטוי mGluR2 עם חומצת אמינו לא טבעית משולבת, תיוג פלואורסצנטי ומיצוי
הערה: פרוטוקול זה מתאר את ההכנה, הריאגנטים והטיפול בתאים לביטוי mGluR2 המכיל את UAA 4-azido-L-פנילאלנין (AZP). ההליך הוא עבור תאי HEK293T הגדלים על כיסויי זכוכית 18 מ"מ. ניתן להרחיב את ההליך לפי הצורך.
- זריעה
הערה: שמור על תאי HEK293T ב-DMEM בתוספת סרום בקר עוברי של 10% (v/v), 100 יחידות·mL−1 פניצילין-סטרפטומיצין, וחיץ HEPES של 15 mM (קובץ משלים 1) (pH 7.4) בטמפרטורה של 37 °C תחת 5% CO2.- מעבירים את התאים עם 0.05% טריפסין-EDTA. תאי זרע HEK293T על זכוכית פולי-L/D-ליזין (PLL/PDL) מכסים כך שהם מגיעים למפגש של ≥80% בזמן ההעברה.
- טרנספקציה
- הכן פתרון מלאי של 40 mM של AZP ב- 0.1 M NaOH.
- הכן מדיה עם תוסף AZP לגידול תאים ולביטוי mGluR2. תוסף מדיה סטנדרטי (+ FBS, עט/סטרפ, 15 mM HEPES) באמצעות תמיסת מלאי AZP של 40 mM. הביאו את ריכוז ה-AZP הסופי ל-0.6 מ"מ. הוסף תמיסת HEPES של 1 M (נוספה מחצית מהנפח של פתרון מלאי AZP של 40 mM). לדוגמה, כדי להכין 10 מ"ל של מדיה בתוספת AZP, שלב 9.775 מ"ל של מדיה סטנדרטית, 150 μL של 40 mM תמיסת מלאי AZP, ו- 75 μL של 1 M HEPES פתרון.
- לסנן (לעקר) את המדיה באמצעות מסנן מזרק (0.2 מיקרומטר, PES).
- החלף את המדיה הרגילה במדיה המכילה מדיה בתוספת AZP לפני ההעברה.
הערה: יש להיזהר שלא לייבש את התאים במהלך החלפת המדיה. - טרנספקט של התאים באמצעות מגיב טרנספקציה (טבלת חומרים) בהתאם למדריך היצרן. טרנספקט HEK293T תאים על מכסה 18 מ"מ באמצעות סך של 2 מיקרוגרם של DNA (1000 ng של tRNA / synthetase + 1000 ng של פלסמיד חלבון המכיל קודון ענבר). עיין בטבלה 1 לקבלת הריכוז והנפח של הרכיבים שבהם נעשה שימוש.
- שנו את המדיה 24 שעות לאחר ההעברה למדיה טרייה עם תוסף AZP ואפשרו לתאים לגדול למשך 24 שעות נוספות.
- תיוג עם צבעי אלקין ציאנין
- 20 דקות לפני התווית, יש לשטוף את הכיסויים במאגר הקלטה חם (37 °C) (RB) (קובץ משלים 1) פעמיים, ולהעביר אותם למדיה סטנדרטית חמה (37 °C) ללא AZP (+ FBS, עט/סטרפ, 15 mM HEPES).
- הכן את תמיסת הסימון המכילה Cy3-alkyne, Cy5-alkyne, BTTES, נחושת (II) סולפט (CuSO4), (+) נתרן L-אסקורבט, ואמינוגואנידין.
- עקוב אחר סדר הביצוע וההוספה של פתרונות (טבלה 2):
- הכן 50 mM BTTES.
- הכינו 100 mM אמינוגואנידין.
- הכינו 100 mM Na-ascorbate.
- הכן 655.5 μL של RB.
- הוסף צבע אלקיין Cy3/Cy5 (10 mM במלאי DMSO) ל-RB.
הערה: הוסף אמינוגואנידין ל-RB. - הכינו 20 מ"מ CuSO4.
- מערבבים CuSO4 ו- BTTES בצינור חדש (הפתרון יהפוך לכחול).
- הוסף את תערובת CuSO4 ו- BTTES ל- RB (2.3.3.6.)
- הוסף את Na-Ascorbate.
- עקוב אחר הנפח המופיע בטבלה 2 להלן לקבלת כיסוי של 18 מ"מ.
- מערבבים היטב את התמיסה ודוגרים על קרח ובחושך במשך 10 דקות לפני סימון התאים.
- לפני הוספת תמיסת הסימון לכיסויים, הסר את המדיה ושטוף אותם ב- RB. הוסיפו את תמיסת ההתוויה ודגרו במשך 15 דקות בטמפרטורה של 37°C בתנאים חשוכים.
- הערה: כדי לשפר את הסימון, יש להוסיף גלוטמט (ריכוז סופי ~ 0.5 מ"מ) לאחר 10 דקות ולדגור במשך 5 דקות נוספות. נחושת רעילה מאוד לתאים, ותגובת התיוג לא צריכה להימשך יותר מ-15 דקות in vivo. מכינים את כל הרכיבים טריים. הוסף Na-Ascorbate אחרון. יש לשמור על התגובה בטמפרטורה של 4°C בזמן ההכנה. עם זאת, עם הוספת תמיסת התוויה, התאים יאוחסנו בטמפרטורה של 37 מעלות צלזיוס בתוך האינקובטור.
- קצירת התאים ומיצוי החלבונים (תזה תאית)
- הסר את תמיסת ההתוויה ושטוף את הכיסוי (18 מ"מ) המכיל את התאים הטרנספקטיביים mGluR2 פעמיים עם RB.
- באמצעות פיפט, יש לשטוף את התאים מהכיסוי ולתלות אותם מחדש ב-RB (1 מ"ל).
הערה: צמצם את חשיפת הדגימה לאור ככל האפשר לאחר נקודה זו. - גלולה את התאים על ידי סיבוב ב 1,000 x g ב 4 מעלות צלזיוס במשך 5 דקות ולהסיר את supernatant. יש לתלות את גלולת התא ב-80-130 μL של תמיסת התזה.
הערה: כדור התא צריך להיות גלוי בעין. נפח התזה תלוי בכמות הדגימה שאבדה במהלך תהליך ההתוויה והכביסה. - מערבבים בעדינות על ידי פיפטינג כדי לשבור את הכדור. עוטפים בנייר כסף ומניחים על הנדנדה בטמפרטורה של 4 מעלות צלזיוס למשך 0.5-1 שעות כדי להניח את התאים.
- גלולה את החלק הבלתי מסיס על ידי צנטריפוגה ב 20,000 x g ו 4 °C במשך 20 דקות. מעבירים את הסופרנטנט לצינור קר טרי (החלבון הליזד שמכיל את החלבון המתויג פלואורסצנטי בעל עניין) ומאחסנים אותו על קרח לניסויים.
3. הרכבה ופונקציונליזציה של תא זרימה של מולקולה בודדת
- הסירו את המגלשה ואת המכסה מהמקפיא ותנו להם להתחמם ב-RT בחושך (~30 דקות).
- הרכיבו את התא באמצעות סרט הדבקה דו-צדדי על ידי כריכת רצועות של סרט הדבקה דו-צדדי בין המגלשה לכיסוי. ודא שמשטחי PEGylated יוצרים את פנים תא הזרימה.
- באמצעות קצה פיפט, לחץ על הכיסוי כדי לוודא שהקלטת יוצרת מגע מלא הן עם הכיסוי והן עם החלקה; היזהרו לא לשבור את הכיסוי. יש למרוח אפוקסי על קצות השקופיות.
הערה: אין להוסיף כל כך הרבה כי אפוקסי ממלא את החורים שנקדחו. - הניחו את תא הזרימה כשצד הכיסוי פונה כלפי מטה בקופסה חשוכה ולחה כדי לאפשר לאפוקסי להתייבש (~30 דקות).
הערה: הוסף מאגר T50 (קובץ משלים 1) דרך החורים שנקדחו כדי למנוע מהאפוקסי לכסות את החורים (10-15 μL) במהלך תקופת הייבוש. - דגירה של כל נתיב תא עם 500 ננומטר נויטרווידין (מדולל ב-T50) על ידי החלת ~40 μL באיטיות על כל נתיב.
- דגרו ב-RT במשך 2 דקות בתוך קופסה חשוכה ולחה. לשטוף עם ~ 100 μL של חיץ T50 לכל נתיב.
- לדגום כל נתיב תא עם נוגדן ביוטינילציה 20 ננומטר11. בחירת הנוגדן תלויה בתג שעל החלבון.
הערה: אם הנוגדן העיקרי אינו ביוטינילציה, יש לדגור תחילה עם הנוגדן המשני הביוטינילציה למשך 30 דקות ולאחר מכן לדגור עם הנוגדן הראשוני. - דגירה ב-RT במשך 30 דקות בתוך קופסה חשוכה ולחה. לשטוף עם ~ 200 μL של T50 לכל נתיב.
הערה: ודא שהנתיבים לעולם לא יתייבשו במהלך תהליך ההכנה.
4. מאגרי מולקולות בודדות
- חיץ טרולוקס
הערה: מאגר Trolox הוא המאגר ההתחלתי ליצירת מאגר הדמיה. מרכיבי המאגר תלויים בניסוי ועשויים להשתנות בהתאם לחלבון המעניין. המאגר המשמש בפרוטוקול המתואר כאן כולל מלחים (NaCl, KCl, CaCl 2, MgCl2), חומר אגירה (HEPES), וטרולוקס (pH ~ 7.35).- להמיס 9-10 מ"ג של Trolox ב-10 מ"ל של מאגר הקלטה של מולקולה בודדת (SRB, קובץ משלים 1)
הערה: Trolox הופך את החיץ למעט חומצי. התאם את ה- pH בשלב זה באמצעות תמיסת נתרן הידרוקסידי (NaOH), 10 M (pH 7.35). התאמת ה- pH העדינה תבוצע לאחר שהטרולוקס יתמוסס לחלוטין; עם זאת, הגדלת ה- pH בנקודה זו מגדילה את המסיסות של הטרולוקס. - ערבבו את התמיסה ב-RT באמצעות נדנדת ספסל למשך 4-8 שעות (עטופה ברדיד אלומיניום) כדי להמיס את הטרולוקס במלואו.
- בדוק את ה- pH והתאם במידת הצורך.
- ודא שהטרולוקס מומס במלואו. לעקר את התמיסה עם מסנן מזרק ולאחסן ב 4 מעלות צלזיוס.
הערה: יש להשתמש במאגר לאחר 2-10 ימי יישון. Trolox עוזר לדכא מצמוץ והוא נפוץ במחקרים של מולקולות בודדות17. התכונות נגד מצמוץ מגיעות מנגזרת מחומצנת של Trolox18; לפיכך, מומלץ לשמור אותו ב- RT לפחות כמה שעות כדי להבשיל. בנוסף, קרינת UV של תמיסת Trolox טרייה מאיצה את תהליך החמצון וניתן להשתמש בה כדי להאיץ את "ההזדקנות" של חיץTrolox 18.
- להמיס 9-10 מ"ג של Trolox ב-10 מ"ל של מאגר הקלטה של מולקולה בודדת (SRB, קובץ משלים 1)
- מתכון מאגר הדמיה: יש לערבב חיץ Trolox + חומר ניקוי (~ פי 2 מערך ה- CMC של חומר הניקוי) + 4 mM חומצה פרוטוקטכואית (PCA).
הערה: ריכוז חומרי הניקוי נשמר בקרבת CMC, שכן ריכוזי דטרגנטים גבוהים עלולים לגרום לדנטורציה מוגברת של חלבונים. לדוגמה, ניתן להשתמש בתערובת הבאה 955 μL Trolox + 5 μL 10% DDM + כולסטרול (W%, 10:1) + 40 μL של 100 mM PCA פתרון מניות. כאן, PCA פועל כסוכן נוגד חמצון ושימש בעבר במחקרי smFRET19. DDM אינו יוני, משמש בדרך כלל לסלול חלבוני ממברנה20,21, ושימש במחקרים של מולקולות בודדות. DDM הוא חומר ניקוי טוב לבחירה ראשונה; עם זאת, אנו ממליצים לבדוק מספר חומרי ניקוי ולוודא שהתוצאות עקביות.
5. הגדרת מיקרוסקופ ואיסוף נתוני smFRET
- הפעל את המחשב ואת המיקרוסקופ. הפעל את הלייזרים כדי להתחמם (532 ננומטר עבור עירור Cy3 ו-640 ננומטר עבור עירור Cy5).
הערה: כאן, נעשה שימוש במיקרוסקופ הפוך המצויד במטרה 100x TIRF (N.A. 1.49), מפצל תמונה ומצלמת EMCCD. ההתקנה מצוידת בשילוב לייזר בעל ארבע שורות, מראה דיכרואית, מסנן פליטת מעבר ארוך, מסנן דיכרואי פליטה ומסנן חריץ. - הפעל את מצלמת EMCCD ופתח את תוכנת המצלמה. המתן 20 דקות עד שהמצלמה תגיע ל-69°C- ותתייצב.
- הרכיבו את תא הדגימה על במת המיקרוסקופ. הוסף את דגימת החלבון בהדרגה כדי להשיג ~ 400 מולקולות לכל שדה ראייה (שלב 2.4.5). לשטוף את התא עם 100 μL של חיץ הדמיה.
- התאם את הרווח, קצב הרכישה וכוחות הלייזר כך שאותות פלואורסצנטיים של מולקולה בודדת יזוהו הן בערוץ התורם והן בערוצים המקבלים. התאימו את ריכוז החלבונים בתוך תא הדגימה במידת הצורך.
הערה: עם יותר מ-400 מולקולות בשדה הראייה, ההבחנה בין מולקולות בודדות הופכת לקשה יותר, ורעשי הרקע יהיו גבוהים יותר. - להלהיב את התורם ולרכוש עקבות זמן עד שלפחות 80% מהמולקולות התורמות בשדה הראייה עוברות פוטו-אקונומיקה.
- בסוף הסרט, הפעילו את הלייזר של 640 ננומטר כדי להלהיב ישירות את המקבל עד שחלק מהמולקולות המקבלות יעברו פוטו-אקונומיקה, מה שמקל על מולקולה בודדת מאפליה מרובה.
- עבור לשדה תצוגה אחר וחזור על השלבים לעיל כדי לאסוף לפחות שלושה סרטים (שכפולים טכניים) לכל תנאי.
הערה: השתמש בעוצמת הלייזר הנמוכה ביותר האפשרית בעת בחירת אזור עניין חדש (ROI) ומיקוד כדי למזער את הלבנת הפוטו. שימו לב לסחף הבמה במהלך הרכישה. אם נצפתה סחף ניכר לאחר המעבר להחזר השקעה חדש, המתן 3 דקות לפני תחילת הרכישה.
6. ניתוח נתונים
- יישור ערוצים של תורמים ומקבלים (מיפוי סרטים)
- הקלט את תמונות החרוזים הפלואורסצנטיים בערוצים התורמים והמקבלים.
- צור את קובץ המיפוי באמצעות נתוני החרוזים כדי לתאם את הפלואורסצנציה של התורם והמקבל מכל מולקולה22,23.
הערה: אות הפליטה ממולקולה בודדת מפוצל לאותות תורמים ומקבלים על ידי מסנן דיכרואיק פליטה בתוך מפצל התמונה. תמונות התורם ומקבל מוקרנות על המצלמה זו לצד זו. כדי לשייך במדויק את עוצמות התורם והמקבל של מולקולה בודדת בין שני האזורים, קובץ מיפוי נוצר לעתים קרובות באמצעות דגימות חרוזים פלואורסצנטיות. באמצעות קובץ מיפוי זה, כל המולקולות המתגלות בערוצי התורם והקבלה ממופות זו לזו. לאחר מכן הניתוח מייצר את עקבות הזמן, שהם עוצמות התורם ומקבל לאורך זמן, עבור כל מולקולה.
- בחירה של עקבות FRET של מולקולה בודדת (קטיף חלקיקים)
הערה: עקבות חלקיקים בודדים נבדקים ונבחרים לניתוח במורד הזרם באמצעות MATLAB. קריטריוני הבחירה המדויקים תלויים במערכת. הנחיות כלליות לגבי מה מהווה חלקיק איכותי מפורטות כאן. כל הקודים שהשתנו בהתאמה אישית זמינים ב- GitHub (https://github.com/vafabakhsh-lab).- בחר את העקבות שבהם העוצמה הכוללת של העקבות (תורם + מקבל) יציבה לאורך זמן. בחר את העקבות עם שינויים אנטי-קורלטיביים בעוצמות התורם והמקבל.
- בחר את מולקולות התורם והמקבל המציגות הלבנה חד-שלבית. בחר את העקבות שאורכם >5 שניות.
הערה: הרקע בכל ערוץ לאחר ההלבנה צריך להגיע לאפס. העקבות לא צריכים להיות הרבה אירועים מהבהבים; זה יגדיל את הקושי של ניתוח. - חשב את יעילות FRET באמצעות המשוואה E = (I A− 0.088 × I D)/(I D + [I A− 0.088 × I D])24,25,26, כאשר I D ו- I A הם עוצמות תורם גולמי ומקבל, בהתאמה.
הערה: דליפת הפליטה של התורם לערוץ המקבל נקבעת באמצעות דגימה המסומנת על ידי התורם בלבד באמצעות לייזר 532 ננומטר26. מקדם תיקון הדליפה, 0.088, עשוי להשתנות בהגדרות שונות בהתאם לערכות המסננים שבהן נעשה שימוש. חשוב לציין כי המרה כמותית וחזקה של יעילות FRET למרחקים מוחלטים דורשת תיקון של עוצמות התורם והמקבל עבור גורמים רבים ונדונו בהרחבה לפני27.
- זהה את המצב הקונפורמי על ידי מידול מרקוב מוסתר (HMM)
- הפעל את תוכנית vbFRET28 ב- MATLAB וייבא את העקבות שנבחרו עבור תנאי נתון. הגדר את האילוצים עבור מספר המצבים הפוטנציאליים והאיטרציות שיש לבצע.
הערה: בהתבסס על הנתונים הגולמיים מהתוצאות המייצגות, הועלתה ההשערה כי ישנם עד ארבעה מצבי FRET בדידים שנכבשו על ידי חיישן הקונפורמציה; לפיכך, נקבע טווח של אחת עד ארבע מדינות. שיפורים בהתאמה נקבעו בעבר כעלייה זניחה עם >25 איטרציות; לפיכך, 25 איטרציות שימשו להתאמת הנתונים המייצגים. - נתח את עקבות smFRET וייצא את העקבות האידיאליים ואת מפגש הניתוח. שמור את המעקבים האידיאליים בתיקיה נפרדת לניתוח במורד הזרם.
הערה: התוכניות המשמשות לחילוץ נתוני מעבר מצב וזמן שהייה מעקבים אידיאליים היו זמינות בעבודהשפורסמה בעבר 29. - באמצעות תוכניות MATLAB, חלץ מעברי מצבים והתווה אותם כמפת חום כאשר קואורדינטת X המציינת קונפורמציה התחלתית וקואורדינטת Y המציינת קונפורמציה סופית.
הערה: מעברים מוגדרים כשינויים בערך FRET >0.1 בתוצאות המייצגות שנדונו כאן. סף המעברים תלוי במצבים הקונפורמיים המשוערים שחלבון בעל עניין תופס (סף המעבר שנקבע להיות קטן מההפרש בין מצבי FRET הקרובים ביותר), וכן ברזולוציה המותרת על ידי מערך הניסוי. בחינת מפות חום עבור תנאים מרובים מאפשרת לזהות את המצבים הקונפורמיים הנפוצים ביותר שחיישן עובר דרכם, ובכך תופס. ארבעה מצבי FRET זוהו עבור התוצאות המייצגות (FRET = 0.31, 0.51, 0.71 ו- 0.89). - באמצעות תוכניות MATLAB, חלץ את זמני השהייה עבור כל מצב קונפורמציה מזוהה. הקצה טווח של ערכי FRET התוחמים כל מצב ורזולוציית זמן במהלך רכישת נתונים. טווחי FRET מחולקים באופן שווה במצבי FRET סמוכים. יש לייצא את זמני המגורים עבור תנאי טיפול מסוימים.
הערה: ברוב המקרים, ניתן להעריך היטב נתונים בזמן השהייה על-ידי פונקציית דעיכה מעריכית אחת. ניתוח זה יכול להתבצע בתוכנת ניתוח נתונים וגרפים.
- הפעל את תוכנית vbFRET28 ב- MATLAB וייבא את העקבות שנבחרו עבור תנאי נתון. הגדר את האילוצים עבור מספר המצבים הפוטנציאליים והאיטרציות שיש לבצע.
- התאמת גאוס של היסטוגרמות אוכלוסיית smFRET לכימות תפוסת המדינה
- ייבוא היסטוגרמות FRET של אוכלוסייה עבור תנאים מעניינים לתוך ניתוח נתונים ותוכנת גרפים לניתוח התאמת שיא מרובים.
- ציין את מספר הפסגות הקיימות (ארבע פסגות או מצבים בהתבסס על ניתוח HMM). ההתאמה בוצעה באמצעות התפלגויות גאוס מרובות30 המוגדרות כ
 - , כאשר A הוא אזור הפסגה, xc הוא מרכז הפסגה, ו - w הוא רוחב השיא עבור כל פסגה.
- , כאשר A הוא אזור הפסגה, xc הוא מרכז הפסגה, ו - w הוא רוחב השיא עבור כל פסגה. - הגבל את הפרמטרים המתאימים כ- A > 0, xc = FRET ± 0.02 ו- 0.1 ≤w≤ 0.24. ארבע פסגות FRET עבור היסטוגרמות FRET של אוכלוסייה בודדת הותאמו בו זמנית. החל את האילוצים המוגדרים עבור ההתאמות של כל התנאים.
- חישוב מצב התפוסה (אחוז) כשטח שיא הריבית חלקי השטח הכולל, המוגדר כסכום כל הפסגות.
תוצאות
הבעה ותיוג פלואורסצנטי של חיישן FRET מבוסס UAA
כאןנדונו תוצאות מופת של החדרה ותיוג פלואורסצנטי של UAA (AZP) בתוך ה-CRD של mGluR2 (548UAA). כפי שצוין קודם לכן, כדי להכניס AZP ל-mGluR2, יש צורך בביטוי משותף של מנגנון התרגום המהונדס, הכולל סינתזה tRNA שונה ו-tRNA משלים (pIRE4-Azi), ו-mGluR2 המכיל קודון ענבר במיקום 548, שנוצר באמצעות מוטגנזה, (איור 2A,B). התיוג של AZP על-ידי צבעי ציאנין מושג על-ידי תגובת ציקלואידציה מזורזת נחושת (איור 2C) ומביא לתיוג יעיל של קרום פלזמה של 548UAA (איור 2D). כדי לאמת את התרגום של 548UAA באורך מלא ואת שלמות הקולטן הדימרי, בוצעה אלקטרופורזה SDS-PAGE על ליזאט התא מתאי HEK293T המבטאים 548UAA המסומנים ב- Cy5. נצפתה רצועה אחת ב-250KDDA, אשר עלתה בקנה אחד עם ה-mGluR2 הדימרי באורך מלא (איור 2E).
איסוף וניתוח נתונים
תאים המבטאים 548UAA עם תג FLAG-terminal C סומנו עם Cy3 (תורם) ו- Cy5 (מקבל) ולאחר מכן שכבו עם חומר ניקוי31 בנוכחות מעכב פרוטאז למחקר במבחנה. עם השלמת התזה של התא והסרת החלק הבלתי מסיס על-ידי צנטריפוגה, הסופר-נטנט הוחל על כיסוי שעבר פוליאתילן גליקול (PEG) שעבר פעילות גופנית עם נוגדן נגד תג FLAG להדמיית השתקפות פנימית כוללת פלואורסצנטית (TIRF) (איור 3). הדגימה הוארה באמצעות לייזר של 532 ננומטר, וחלקיקים נבחרו לניתוח במורד הזרם באמצעות תוכנת smCamera. עקבות של תורם גולמי, מקבל ו-FRET נוצרו עבור כל המולקולות שנבחרו ב-smCamera ונבחרו באמצעות MATLAB (סעיף 6; איור 4). תיקון של 8.8% מתרומת דימום הוחל על עוצמות המקבל עבור מערך הניסוי המשמש כאן. מקדם תיקון זה ישתנה בהתאם למערך הניסוי, מסנני הדיכרואיים ומסנני הפליטה שבהם נעשה שימוש, ויש לקבוע אותו על ידי מדידת אותות התורם והמקבל בתנאי ניסוי סטנדרטיים תוך שימוש בתאים המסומנים בפלואורופור התורם בלבד וחישוב הדימום ([עוצמת המקבל]/[עוצמת התורם]). איור 4 מראה מספר עקבות FRET מייצגים ואותות תורמים ומקבלים תואמים. עקבות אלה נבחרו באמצעות קריטריונים שתוארו קודם לכן בפרוטוקול (סעיף 6). עקבות נבחרים מייצגים שמראים מעברים בין מצבים מרובים ואירועי הלבנה של תורמים ומקבלים מוצגים באיור 4B-D.
זיהוי מצבים קונפורמיים
כדי לזהות את המדינות הקונפורמיות 548UAA שנכבשו ואת היחסים של מדינות אלה ביחס זו לזו, נערך ניתוח מודלים של מרקוב נסתר (HMM). ניתוח HMM בוצע באמצעות תוכנית vbFRET שבוצעה ב-MATLAB28 (איור 5A). איור 5 משתמש בנתונים מריכוז גלוטמט ביניים (5μM) כדי להמחיש את תהליך זיהוי המצב. בהתבסס על עקבות smFRET גולמיים, הועלתה השערה כי עד ארבעה מצבי FRET פוטנציאליים קיימים עבור ה- CRD. לפיכך, מספר המדינות הוגבל לאחת עד ארבע. בסך הכל, בוצעו 25 איטרציות של התאמה עבור כל עקבות כדי לקבוע את מספר המדינות הנוכחיות. מתוך התאמות אידיאליות אלה, ניתן לחלץ מעברים בין מצבי FRET בדידים ולהתוות אותם כמפת חום של צפיפות מעבר (איור 5B). מפת החום מדגישה ארבעה מצבי FRET בדידים ב- 0.31, 0.51, 0.71 ו- 0.89, המסומנים על ידי קווים מנוקדים. מעברים הוגדרו כשינויים ב- FRET >0.1. עקבות FRET האידיאליים גם מניבים מידע על זמן השהייה עבור כל קונפורמציה מזוהה (איור 5C).
יצירת היסטוגרמה של FRET לאוכלוסייה והתאמת שיא
עקבות מייצגים של מולקולה בודדת עבור 548UAA בנוכחות ריכוזי גלוטמט משתנים שנבחרו באופן ידני לניתוח נוסף מוצגים באיור 6A,B. ניתוח כללי עבור ניסויי smFRET הוא ליצור היסטוגרמות אוכלוסייה ממאות עקבות smFRET עבור כל מצב ניסוי (איור 6C). היסטוגרמות FRET של אוכלוסייה נוצרות מקטע של עקבות לפני הלבנה. כדי למנוע הטיה של ההיסטוגרמה לכיוון התנהגות של עקבות ארוכים יותר, יש צורך ליצור היסטוגרמה FRET מנורמלת מכל עקבות לפני הממוצע. זה מבטיח שכל עקבות תורמים באופן שווה להיסטוגרמה הסופית. במערכת זו, ההיסטוגרמות של FRET מראות תזוזה כללית לכיוון FRET גבוה יותר עם עלייה בריכוז הגלוטמט, מה שמצביע על ירידה במרחק בין ה-CRDs ומעבר לכיוון הקונפורמציה הפעילה. עם זאת, ללא קשר לריכוז הגלוטמט, האות FRET נשאר ספורדי למדי, המציין רמה גבוהה של דינמיקה פנימית עבור CRD. בנוסף לתזוזה הכללית לכיוון FRET גבוה יותר, חלוקה מחדש של ההרכב הקונפורמי מתבררת בהיסטוגרמה (עקומות צבע). ניתן גם לראות מולקולות בודדות מבקרות במצבים הקונפורמיים האלה (קווים מקווקווים) (איור 6B). כדי לקבוע את ההסתברות לתפוסת המדינה, יש לחלק את שטח השיא בשטח הכולל, המוגדר כסכום של כל ארבעת אזורי השיא הבודדים. ההיסטוגרמה smFRET שנוצרה מניסוי smFRET של ה-CRD של mGluR2 הציגה ארבעה מצבים דינמיים עם שיאים ב-0.31, 0.51, 0.71 ו-0.89 (מסומנים במצבים 1-4), בהתאמה.

איור 1: תרשים זרימה של פרוטוקול העבודה וניתוח הנתונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: תיוג ספציפי לאתר של mGluR2 על-ידי כימיה של קליקים . (A) סכמטי של חומצת האמינו הלא טבעית 4-azido-L-פנילאלנין תהליך שילוב בתאים. (B) סכמטי המציג תיוג פלואורסצנטי ספציפי לאתר של mGluR2, עם חומצת האמינו הלא טבעית במיקום 548, על ידי תגובת לחיצה של אזיד-אלקיין המזורזת בנחושת. (C) מבנה תלת-ממדי של mGluR2 המסומן באופן פלואורסצנטי (מולקולת תורם בירוק, מולקולת מקבל באדום) עם מולקולות Cy3 ו-Cy5 מעוגנות. (D) תמונה מיקרוסקופית קונפוקלית מייצגת של תאי HEK293T המבטאת 548UAA כאשר אוכלוסיית פני השטח של התא מסומנת בפלואורופורים של תורם (ירוק: Cy3) ומקבל (אדום: Cy5) באמצעות כימיה של קליקים. פסי קנה מידה = 10 מיקרומטר. (E) תמונה של אלקטרופורזה בג'ל פוליאקרילאמיד שאינה מפחיתה 4%-20% של ליזאט תאים מתאי HEK293T המבטאים 548UAA ומסומנים על ידי Cy5-alkyne. הג'ל מצולם עם אורך גל עירור של 633 ננומטר ומסנן פליטה 670-BP30 - נתיב a: סולם חלבונים; נתיב ב': ליזאט תא; נתיב c: צבע Cy5-alkyne. התוצאות מייצגות ניסוי בודד. לוחות B, D ו- E נמצאים בשימוש חוזר מ- Liauw et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
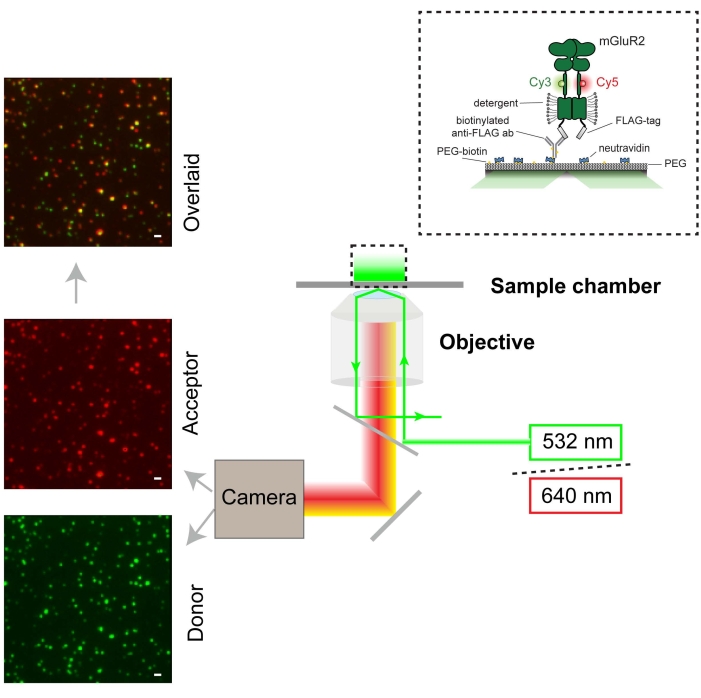
איור 3: ייצוג סכמטי של ניסויי smFRET ומערך המיקרוסקופים (TIRF). תמונת הפלואורסצנציה של המולקולה הבודדת של התורם מוצגת בירוק (סרגל קנה מידה = 1000 ננומטר) והמקבל באדום. התורם התרגש ב-532 ננומטר באמצעות לייזר. המקבל מתרגש מ-FRET מהתורם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
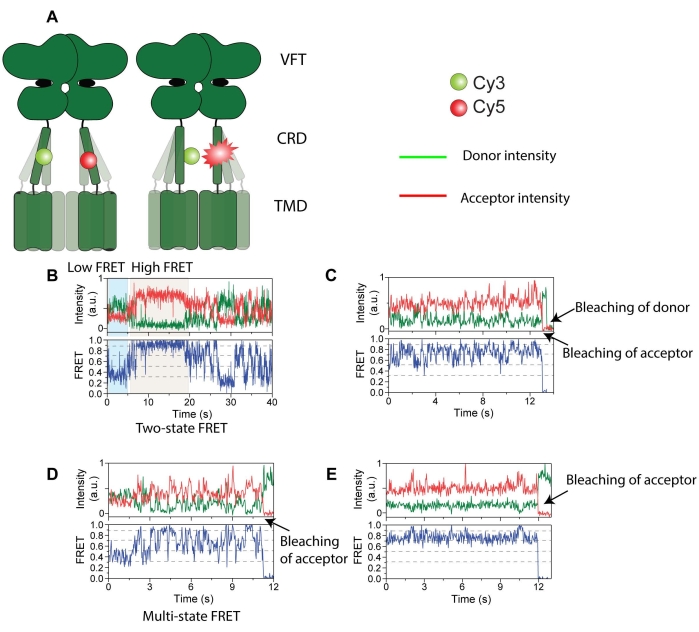
איור 4: עקבות עוצמה של תורם (ירוק) ומקבל (אדום) המסומנים mGluR2. (A) קריקטורה המציגה את דינמיקת הקולטן ואת השינוי במרחק בין בדיקות FRET. (B) מצב FRET גבוה בעל תוחלת חיים ארוכה. (C) מצבי FRET מרובים עם הלבנת תמונות מקבלת תחילה ואחריה הלבנת תמונות של תורמים. (D) מצב FRET קצר מועד עם הלבנת תמונות מקבלת. (E) מצב FRET יציב בעל תוחלת חיים ארוכה עם הלבנת תמונות מקבלת. נתון זה מועתק עם שינוי מינימלי מ Liauw et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: זיהוי מצב קונפורמי . (A) עקבות FRET מייצגים עם שכבת התאמה אידיאלית (אדומה) יחד עם אות התורם והמקבל המתאים. (B) מפת חום של צפיפות מעבר המדגישה את המעברים הקונפורמיים השכיחים ביותר שעברו 548UAA. קווים מקווקווים מציינים מצבי FRET. (C) זמני שהייה ממוצעים של כל מצב קונפורמי. נתון זה משוחזר עם שינוי מינימלי מ Liauw et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: FRET של מולקולה בודדת חושף ארבעה מצבים קונפורמיים של mGluR2 CRD . (A) מסגרת מייצגת מסרט בעל מולקולה בודדת עם ערוץ התורם (Cy3) משמאל וערוץ המקבל (Cy5) מימין. מולקולות שנבחרו על ידי תוכנת ניתוח לעיבוד במורד הזרם מסומנות על ידי עיגולים ירוקים. סרגל קנה מידה = 3 מיקרומטר. (B) עקבות זמן לדוגמה של מולקולה בודדת של 548UAA בריכוזי גלוטמט שונים. עוצמות התורם (ירוק) ומקבל (אדום) וה- FRET המתאים (כחול) מוצגות. קווים מקווקווים מייצגים ארבעה מצבי FRET נפרדים. (C) היסטוגרמות של אוכלוסיית smFRET במגוון ריכוזי גלוטמט. הנתונים מייצגים ממוצע ± SEM. של N = 3 ניסויים בלתי תלויים. נתון זה משוחזר עם שינוי מינימלי מ Liauw et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 7: סיכום הפרוטוקול הכולל . (A) תהליך עבודה לגידול ותיוג תאים המבטאים חלבון המכיל חומצת אמינו לא טבעית. (B) תהליך עבודה ניסיוני וניתוחי FRET של מולקולה בודדת המשמש לזיהוי מצבים קונפורמיים ולאפיון התכונות הדינמיות של תחום ה-CRD ב-mGluR2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| רכיב | נפח/תגובה (μL) |
| סרום מופחת בינוני | 100 |
| מגיב טרנספקציה | 4.4 |
| רכיב | נפח/תגובה (μL) |
| סרום מופחת בינוני | 100 |
| P3000 | 4 |
| שם מבנה/רכיב | ריכוז (ng/μL) | נפח/באר (12 בארות) (μL) | וולס (#) | תוספת דנ"א (μL) |
| tRNA/סינתאז | 1000 | 1 | 1 | 1 |
| קודון ענבר המכיל חלבון | 1000 | 1 | 1 | 1 |
טבלה 1: ריאגנטים להעברה של תא HEK 293 T.
| ריאגנטים | נפח להוספה (μL) | קונסול מניות (mM) | קונק סופי (mM) |
| 1x RB | 655.5 | ||
| BTTES | 10.5 | 50 | 0.75 |
| CuSO4 | 5.25 | 20 | 0.15 |
| NaAsc | 17.5 | 100 | 2.5 |
| אמינוג | 8.75 | 100 | 1.25 |
| Cy3-Alkyne (10 מ"מ) | 1.25 | 10 | 0.018 |
| Cy5-אלקיין (10 מ"מ) | 1.25 | 10 | 0.018 |
טבלה 2: הרכב תמיסת התיוג (לחץ על כימיה).
קובץ משלים 1: הרכב של מאגרים שונים ששימשו במחקר זה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
GPCRs הם חלבונים הפועלים על קרום התא כדי ליזום התמרת אותות. GPCRs רבים מורכבים ממספר תחומים, כאשר האיתות תלוי באינטראקציה השיתופית בין התחומים. כדי לווסת את המאפיינים של קולטני ממברנה אלה, חיוני להבין את ההתנהגות הדינמית של התחומים המרובים. העברת אנרגיית תהודה פלואורסצנטית חד-מולקולתית (smFRET) היא טכניקה פלואורסצנטית המאפשרת מדידה של קונפורמציה ודינמיקה של חלבונים בזמן אמת11,32. כאן, מתוארת גישה המשלבת smFRET, משיכה של מולקולה בודדת כלפי מטה (SiMPull) ומיקרוסקופיה פלואורסצנטית של השתקפות פנימית כוללת (TIRF) כדי לדמיין באופן ישיר את הסידור מחדש של חלבונים בודדים המשותקים על משטח פסיבי מתוארת 5,11,33. FRET רגיש מאוד למרחק ומתפקד ביעילות כסרגל ננומטרי המתאים לחקר שינויים תוך-מולקולריים (3-8 ננומטר). בהשוואה לגישות ביופיזיות מסורתיות, smFRET מתאים במיוחד לחקר דינמיקה קונפורמציונית גדולה בציר זמן של ~10 אלפיות השנייה ודורש נפח דגימה קטן (כ-1 fmole לכל ניסוי). יתר על כן, בניגוד למדידות אנסמבל של דינמיקה קונפורמציונרית, כגון אלה המסופקות על ידי תהודה מגנטית גרעינית (NMR)34 או ספקטרוסקופיית תהודה אלקטרונית-אלקטרונית כפולה (DEER)35, smFRET מאפשר הקצאה מפורשת של שני המצבים הקונפורמיים וסידור הזמן שלהם, כמו גם זיהוי ישיר של מצבי ביניים נדירים וחולפים.
נכון לעכשיו, המגבלות של תיוג פלואורסצנטי ספציפי לאתר מציבות אתגר טכני המונע את היישום הרחב יותר של smFRET כדי לחקור את דינמיקת הקונפורמציה של חלבונים. יתר על כן, קשה לטהר חלבונים הממברנה בכמויות גדולות ולשמר את פעילותם. אסטרטגיות תיוג נפוצות משתמשות בתגי חלבון גדולים או דורשות יצירת מוטנטים מינימליים של ציסטאין, ולעתים קרובות מגבילות את הצמדת הפלואורופור לטרמיני של חלבונים ללא שאריות ציסטאין חשופות. כדי לעקוף מגבלות אלה, אסטרטגיית שילוב של חומצות אמינו לא טבעיות (UAA) הותאמה ומוטבה, ואפשרה תיוג ספציפי לשאריות שאינן מפריעות באמצעות תגובת קליק מזורזת נחושת11,12,14. אסטרטגיה זו מאפשרת להצמיד פלואורופורים בכל האזורים החשופים לממסים של קולטן הממברנה ומאפשרת ליצור מערך רחב יותר של חיישנים קונפורמיים. בפרוטוקול זה נעשה שימוש בסוג יחיד של כימיה של הצמדה. התוצאה היא אוכלוסיות תורמים-תורמים ומקבלים-מקבלים בלבד, אשר מושמטות במהלך ניתוח במורד הזרם. לחלופין, ניתן להשתמש בשתי אסטרטגיות תיוג אורתוגונליות כדי למנוע זאת או להתגבר על הטרוגניות אפשרית כאשר החלבון המעניין אינו סימטרי.
לכידה ישירה של חלבון עוזרת לעקוף את שלבי הטיהור המסורתיים שגוזלים זמן רב ומאתגרים מבחינה טכנית. בשל הציטוטוקסיות של נחושת, נעשה שימוש גם בכימיה של קליקים ללא נחושת המבוססת על טרנס-ציקלוקטן36 או מתיל-טטרזין37 . עם זאת, ריאגנטים אלה הם יקרים, והאופי הלא-רגיו-ספציפי38 של התגובה גורם לתפוקה נמוכה של חלבון מתויג פלואורסצנטי בעל עניין.
כאן הוצגו הנחיות יסודיות לניסויים במבחנה של smFRET, החל מהכנת תאי זרימה ועד לניתוח נתונים. נתוני smFRET נאספו באמצעות הגדרת TIRF, והניתוח בוצע באמצעות קוד MATLAB שנכתב בהתאמה אישית.
יש לציין כמה שיקולים מרכזיים. ראשית, יש להכין את המשטח הפסיבי PEG להיות הומוגני ופחות צפוף עם ביוטין-PEG. עודף ביוטין-PEG עלול לגרום לירידה מוגזמת בחלבון, מה שמקשה על פתרון אותות פלואורסצנטיים ממולקולות בודדות. שנית, יש לדלל היטב את דגימת החלבון (תאית ליזאט סופרנאטנט) לפני שהיא מתווספת לתא הדגימה כדי למנוע רוויה על פני השטח. תפוקת החלבון תלויה בצפיפות התא, בחומר הניקוי המועדף ובריכוז חומרי הניקוי. כדי למטב את מספר הזוגות התורמים הבודדים והמקבלים, יש להתמקד בצפיפות של ~400 מולקולות בשדה ראייה של 256 x 512 פיקסלים. שלישית, יש לאחסן את מאגר Trolox בטמפרטורה של −20 מעלות צלזיוס לשימוש ארוך טווח (חודשים). חיץ Trolox נשאר יציב במשך 2 שבועות כאשר מאוחסן ב 4 °C (64 °F). לבסוף, יש להיזהר שלא להכניס בועות אוויר לתא הזרימה לאחר תפקוד עם הנוגדן. ייבוש תא הזרימה יגרום ליעילות מופחתת של אימוביליזציה של חלבונים ודדנטורציה של דגימת חלבון.
הדינמיקה הקונפורמציונית של חיישן mGluR2 המתוארת כאן נבחנה בהצלחה ברמת הקולטן הבודד באמצעות smFRET וסיפקה תובנה לגבי מנגנון הפעלת הקולטן. נמצא כי ה-CRD מדגים רמה גבוהה של דינמיקה פנימית, הקיימת בשיווי משקל בין ארבעה מצבי FRET קונפורמיים ללא קשר לנוכחות או היעדרות של גלוטמט. הודגם כי מעבר למצבי FRET גבוהים יותר או לקולטן קומפקטי יותר מתרחש באופן התלוי בריכוז גלוטמט (איור 6). באופן מעניין, אפילו ברמות רוויות של גלוטמט, ה-CRD נשאר דינמי. השיטה המוצגת כאן (המסוכמת באיור 7) להבנת הדינמיקה הקונפורמציונית ישימה ל-GPCRs אחרים מסוג C, כמו גם לחלבוני ממברנה אחרים כגון תעלות יונים, קולטנים יונוטרופיים וקולטן טירוזין קינאזות (RTKs)32,39.
Disclosures
המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
אנו מודים לחברי מעבדת רזא ופאבח'ש על הדיונים. עבודה זו נתמכה על ידי מענק המכונים הלאומיים לבריאות R01GM140272 (ל- R.V.), על ידי קרן המנהיגות של סירל למדעי החיים באוניברסיטת נורת'ווסטרן, ועל ידי הקונסורציום הביו-רפואי של שיקגו בתמיכת קרנות סירל בקרן הקהילה של שיקגו (ל- R.V.). B.W.L. נתמך על ידי מענק ההדרכה של המכון הלאומי למדעי הרפואה הכללית (NIGMS) T32GM-008061.
Materials
| Name | Company | Catalog Number | Comments |
| (+)-Sodium L-Ascorbate | Sigma Aldrich | Cat # 11140-250G | |
| 4-azido-L-phenylalanine | Chem-Impex International | Cat # 06162 | |
| 548UAA | Liauw et al. 2021 | Transfected construct | |
| Acetic Acid | Fisher Chemical | 64-19-7 | |
| Acetone | Fisher Chemical | 67-64-1 | |
| Adobe Illustrator (2022) | https://www.adobe.com/ | RRID:SCR_010279 | Software, algorithm |
| Aminoguanidine (hydrochloride) | Cayman Chemical | 81530 | |
| Aminosilane | Aldrich | 919-30-2 | |
| Bath Sonicator 2.8 L | Fisher Scientific | Ultrasonic Bath 2.8 L | |
| Biotin-PEG | Laysan Bio Inc | Item# Biotin-PEG-SVA-5000-100mg | |
| BTTES | Click Chemistry Tools | 1237-500 | |
| Copper (II) sulfate | Sigma Aldrich | Cat # 451657-10G | |
| Cover slip | VWR | 16004-306 | Sample chamber |
| Cy3 Alkyne | Click Chemistry Tools | TA117-5 | |
| Cy5 Alkyne | Click Chemistry Tools | TA116-5 | |
| DDM | Anatrace | Part# D310 1 GM | Detergent |
| DDM-CHS (10:1) | Anatrace | Part# D310-CH210 1 ML | Detergent with cholecterol |
| Defined Fetal Bovine Serum | Thermo Fisher Scientific | SH30070.03 | |
| Di01-R405/488/561/635 | Semrock | Notch filter | |
| DMEM | Corning | 10-013-CV | |
| EMCCD | Andor | DU-897U | Camera |
| ET542lp | Chroma | Long pass emission filter | |
| FF640-FDi01 | Semrock | Emission dichroic filter | |
| FLAG-tag antibody | Genscript | A01429 | |
| Fluorescent bead | Invitrogen T7279 | TetraSpeck microspheres | Spherical bead |
| Glass slides | Fisherfinest | 12-544-4 | sample chamber |
| Glutamate | Sigma Aldrich | Cat # 6106-04-3 | |
| HEK 293T | Sigma Aldrich | Cat # 12022001 | Cell line |
| HEPES | FisherBioReagents | 7365-45-9 | |
| Image splitter | OptoSplit II | ||
| KOH | Fluka | 1310-58-3 | |
| Laser | Oxxius | 4-line laser combiner | |
| Lipofectamine 3000 Transfection Reagent | Thermo Fisher Scientific | L3000015 | Transfection Reagent |
| Methanol | Fisher Chemical | 67-56-1 | |
| Microscope | Olympus | Olympus IX83 | |
| Milli-Q water | Barnstead | Water Deionizer | |
| m-PEG | Laysan Bio Inc | Item# MPEG-SIL-5000-1g | |
| NF03-405/488/532/635 | Semrock | Dichroic mirror | |
| OptiMEM | Thermo Fisher Scientific | 51985091 | Reduced Serum Medium |
| OptiMEM/Reduced serum medium | Thermo Fisher Scientific | ||
| OriginPro (2020b) | https://www.originlab.com/ | RRID:SCR_014212 | Data analysis and graphing software |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| pIRE4-Azi | Addgene | Plasmid # 105829 | Transfected construct |
| Poly-L-lysine hydrobromide | Sigma Aldrich | Cat # P2636 | |
| Protocatechuic acid (PCA) | HWI group | 99-50-3 | |
| smCamera (Version 1.0) | http://ha.med.jhmi.edu/resources/ | Camera software | |
| Sodium bicarbonate | FisherBioReagents | 144-55-8 | |
| Sodium hydroxide (NaOH) | Sigma | 1310-73-2 | |
| Syringe filter | Whatman UNIFLO | Cat#9914-2502 | Liquid filtration |
| Trolox | Sigma | 53188-07 |
References
- Smock, R. G., Gierasch, L. M. Sending signals dynamically. Science. 324 (5924), 198-203 (2009).
- Changeux, J. P., Christopoulos, A. Allosteric modulation as a unifying mechanism for receptor function and regulation. Cell. 166 (5), 1084-1102 (2016).
- Tang, X. -. l., Wang, Y., Li, D. -. l., Luo, J., Liu, M. -. Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacologica Sinica. 33 (3), 363-371 (2012).
- Chung, K. Y., et al. Conformational changes in the G protein Gs induced by the β2 adrenergic receptor. Nature. 477 (7366), 611-615 (2011).
- Vafabakhsh, R., Levitz, J., Isacoff, E. Y. Conformational dynamics of a class C G-protein-coupled receptor. Nature. 524 (7566), 497-501 (2015).
- Niswender, C. M., Conn, P. J. Metabotropic glutamate receptors: Physiology, pharmacology, and disease. Annual Review of Pharmacology and Toxicology. 50, 295-322 (2010).
- Pin, J. P., Bettler, B. Organization and functions of mGlu and GABA(B) receptor complexes. Nature. 540 (7631), 60-68 (2016).
- Kniazeff, J., et al. Closed state of both binding domains of homodimeric mGlu receptors is required for full activity. Nature Structural & Molecular Biology. 11 (8), 706-713 (2004).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Schuler, B., Eaton, W. A. Protein folding studied by single-molecule FRET. Current Opinion in Structural Biology. 18 (1), 16-26 (2008).
- Liauw, B. W. -. H., Afsari, H. S., Vafabakhsh, R. Conformational rearrangement during activation of a metabotropic glutamate receptor. Nature Chemical Biology. 17 (3), 291-297 (2021).
- Noren, C. J., Anthonycahill, S. J., Griffith, M. C., Schultz, P. G. A general method for site-specific incorporation of unnatural amino acids into proteins. Science. 244 (4901), 182-188 (1989).
- Presolski, S. I., Hong, V. P., Finn, M. Copper-catalyzed azide-alkyne click chemistry for bioconjugation. Current Protocols in Chemical Biology. 3 (4), 153-162 (2011).
- Huber, T., Naganathan, S., Tian, H., Ye, S. X., Sakmar, T. P. Unnatural amino acid mutagenesis of GPCRs using amber codon suppression and bioorthogonal labeling. G Protein Coupled Receptors: Structure. 520, 281-305 (2013).
- Serfling, R., Coin, I., Pecoraro, V. Chapter Four - Incorporation of Unnatural Amino Acids into Proteins Expressed in Mammalian Cells. Methods in Enzymology. 580, 89-107 (2016).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549 (2014).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Cordes, T., Vogelsang, J., Tinnefeld, P. On the mechanism of Trolox as antiblinking and antibleaching reagent. Journal of the American Chemical Society. 131 (14), 5018-5019 (2009).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Lee, S., et al. How do short chain nonionic detergents destabilize G-protein-coupled receptors. Journal of the American Chemical Society. 138 (47), 15425-15433 (2016).
- Cao, A. -. M., et al. Allosteric modulators enhance agonist efficacy by increasing the residence time of a GPCR in the active state. Nature Communications. 12 (1), 1-13 (2021).
- Mancebo, A., Mehra, D., Banerjee, C., Kim, D. -. H., Puchner, E. M. Efficient cross-correlation filtering of one-and two-color single molecule localization microscopy data. Frontiers in Bioinformatics. 1, 739769 (2021).
- Mehra, D., Adhikari, S., Banerjee, C., Puchner, E. M. Characterizing locus specific chromatin structure and dynamics with correlative conventional and super-resolution imaging in living cells. Nucleic Acids Research. , (2022).
- Chen, H., Puhl, H. L., Koushik, S. V., Vogel, S. S., Ikeda, S. R. Measurement of FRET efficiency and ratio of donor to acceptor concentration in living cells. Biophysical Journal. 91 (5), 39-41 (2006).
- Gopich, I. V., Szabo, A. FRET efficiency distributions of multistate single molecules. The Journal of Physical Chemistry B. 114 (46), 15221-15226 (2010).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-A multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L., Wiggins, C. H. Learning rates and states from biophysical time series: A Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Zhang, J., et al. Specific structural elements of the T-box riboswitch drive the two-step binding of the tRNA ligand. Elife. 7, 39518 (2018).
- Goodman, N. R. Statistical analysis based on a certain multivariate complex Gaussian distribution (an introduction). The Annals of Mathematical Statistics. 34 (1), 152-177 (1963).
- Brown, R. B., Audet, J. Current techniques for single-cell lysis. Journal of the Royal Society Interface. 5, 131-138 (2008).
- Schamber, M. R., Vafabakhsh, R. Mechanism of sensitivity modulation in the calcium-sensing receptor via electrostatic tuning. Nature Communications. 13 (1), 2194 (2022).
- Jain, A., Liu, R., Xiang, Y. K., Ha, T. Single-molecule pull-down for studying protein interactions. Nature Protocols. 7 (3), 445-452 (2012).
- Huang, S. K., et al. Delineating the conformational landscape of the adenosine A(2A) receptor during G protein coupling. Cell. 184 (7), 1884-1894 (2021).
- Wingler, L. M., et al. Angiotensin analogs with divergent bias stabilize distinct receptor conformations. Cell. 176 (3), 468-478 (2019).
- Gordon, C. G., et al. Reactivity of biarylazacyclooctynones in copper-free click chemistry. Journal of the American Chemical Society. 134 (22), 9199-9208 (2012).
- Kim, E., Koo, H. Biomedical applications of copper-free click chemistry: In vitro, in vivo, and ex vivo. Chemical Science. 10 (34), 7835-7851 (2019).
- Pickens, C. J., Johnson, S. N., Pressnall, M. M., Leon, M. A., Berkland, C. J. Practical considerations, challenges, and limitations of bioconjugation via azide-alkyne cycloaddition. Bioconjugate Chemistry. 29 (3), 686-701 (2018).
- Geng, Y., et al. Structural mechanism of ligand activation in human calcium-sensing receptor. Elife. 5, 13662 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved