Method Article
無傷の末梢神経信号の増幅のための筋腱板再生末梢神経インターフェース
要約
この原稿は、筋腱板再生末梢神経インターフェース(MC-RPNI)と呼ばれる生物学的末梢神経インターフェースを開発するための革新的な方法を提供します。 この外科的構成物は、関連する末梢神経の運動遠心性信号を増幅して、運動意図の正確な検出と外骨格デバイスの潜在的な制御を容易にすることができます。
要約
ロボット外骨格は、四肢の弱さを持つ個人の機能回復のための有望なモダリティとして、リハビリテーション医学の分野で最近高い評価を得ています。しかし、それらの使用は依然として研究機関に限定されており、運動検出方法は信頼性が低いため、静的な四肢サポートの手段として頻繁に機能します。末梢神経インターフェースは、この欠点に対する潜在的な解決策として生じている。ただし、これらの信号は本質的に振幅が小さいため、バックグラウンドノイズとの区別が難しく、全体的なモーター検出精度が低下する可能性があります。現在の界面は非生物的材料に依存しているため、異物組織の反応とともに固有の物質分解が時間の経過とともに発生し、その精度にさらに影響を与える可能性があります。 筋腱板再生末梢神経インターフェース(MC-RPNI)は、これらの注目すべき合併症を克服するために設計されました。無傷の末梢神経に円周方向に固定された遊離筋移植片のセグメントからなる構築物は、時間の経過とともに再生し、封じ込められた神経によって再神経支配されるようになる。ラットにおいて、この構築物は、複合筋活動電位(CMAP)の生成を通じて、末梢神経の運動遠心性活動電位を正常値の100倍まで増幅する能力を実証した。この信号増幅により、モーターの意図を高精度に検出し、外骨格デバイスの信頼性の高い利用が可能になります。
概要
米国だけでも、約1億3,000万人が神経筋および筋骨格系障害の影響を受けており、年間8,000億ドルを超える経済的影響が生じています1,2。このグループの障害は、通常、神経系内、神経筋接合部、または筋肉自体内の病理学に続発します3。病理学的起源の多様性にもかかわらず、大多数はある程度の四肢の弱さを共有しています1,3。残念ながら、この弱点は、特に重度の外傷の設定において、神経および筋肉組織の再生の制限を考えると、しばしば永続的です4,5,6。
四肢の衰弱治療アルゴリズムは、古典的にリハビリテーションおよび支援的手段に焦点を当てており、多くの場合、残りの無傷の手足(杖、車椅子など)の能力を利用することに依存しています。7.ただし、この戦略は、弱点が単一の四肢に限定されない人にとっては不十分です。ロボット技術の最近の革新により、四肢の衰弱とともに生きる人々に四肢の機能を回復する高度な外骨格デバイスが開発されました8,9,10,11,12,13。これらのロボット外骨格は、多くの場合、動きの開始と終了、または四肢の位置の維持を支援できる、動力付きのウェアラブルデバイスであり、ユーザーに合わせて個別に調整できるさまざまな量の力を提供します8、9、10、11、12、13.これらのデバイスは、ユーザにモータ支援を提供する方法に応じてパッシブまたはアクティブのいずれかに分類されます:アクティブデバイスは、ユーザへの電力を増強する電気アクチュエータを含み、パッシブデバイスは、必要に応じてユーザに放出するためにユーザの動きからのエネルギーを蓄える14。アクティブなデバイスはユーザーの電力能力を高める能力を持っているため、これらのデバイスは四肢の弱さの設定ではるかに頻繁に利用されます[14]。
この集団における運動意図を決定するために、現代の外骨格は一般に、遠位肢筋の筋電図(EMG)8,15,16,17または脳の表面脳波(sEEG)のいずれかから生成されたパターン認識アルゴリズムに依存している18,19,20.これらの検出モダリティが約束されているにもかかわらず、どちらのオプションにも、これらのデバイスの広範な利用を妨げる重大な制限があります。sEEGは経頭蓋的にマイクロボルトレベルの信号を検出するため18,19,20、これらの信号をバックグラウンドノイズと区別できないことに批判がしばしば焦点を当てています21。バックグラウンドノイズが所望の記録信号に類似している場合、これは低い信号対雑音比(SNR)を生成し、不正確なモータ検出および分類22,23をもたらす。正確な信号検出はさらに、安定した低インピーダンスの頭皮接触21に依存しており、これは粗い/太い髪の存在、ユーザーの活動、さらには発汗によっても大きな影響を受ける可能性があります22,24。対照的に、EMG信号は振幅が数桁大きいため、運動信号の検出精度が向上します15,18,25。しかしながら、近くの筋肉が信号を汚染し、デバイス16、17、25によって制御できる自由度を低下させ、深部筋肉の動きを検出できない25、26、27、28を減少させる可能性があるため、これにはコストがかかる。最も重要なことは、筋肉の重大な妥協があり、組織が完全に欠如している場合、EMGを制御方法として使用できないことです29。
ロボット外骨格の開発を進めるためには、意図したユーザの運動意図を一貫して正確に検出する必要があります。末梢神経系を利用するインターフェースは、その比較的単純なアクセスと機能的選択性を考慮して、有望なインターフェース技術として生まれました。現在の末梢神経インターフェース法は、侵襲的または非侵襲的であり得、典型的には、神経外電極30、31、32、33、筋膜内電極34、35、36および貫通電極37、38、39、40のうちの1つに分類される。.末梢神経信号は一般にマイクロボルトのレベルにあるので、これらの信号を同様の振幅バックグラウンドノイズ41,42と区別することは困難であり得、それは界面の全体的な運動検出精度能力を低下させる。これらの低い信号対雑音比(SNR)比は、デバイス39,43の劣化、またはデバイスの周囲の瘢痕組織を生成する局所異物反応および/または局所軸索変性37,44のいずれかから生じる電極インピーダンスの悪化に次ぐ、時間とともに悪化することが多い。これらの欠点は、一般的に新しい末梢神経インターフェースの再手術と移植で解決できますが、異物関連反応が引き続き発生するため、これは実行可能な長期的な解決策ではありません。
末梢神経と非生物的界面との相互作用から生じるこれらの局所組織反応を回避するためには、生物学的成分を組み込んだ界面が必要である。この欠点に対処するために、再生末梢神経インターフェース(RPNI)は、切断された人の残存肢に交差した末梢神経を補綴装置で統合するために開発されました45,46,47,48。RPNIの製造には、トランセクトした末梢神経を自家遊離筋移植のセグメントに外科的移植することが含まれ、血行再建術、再生、および神経支配が時間の経過とともに発生します。ミリボルトレベルの複合筋活動電位(CMAP)の生成により、RPNIは、封じ込められた神経のマイクロボルトレベルの信号を数桁増幅することができ、運動意図の正確な検出を容易にします45,48,49。過去10年間でRPNIはかなりの開発が行われており、動物50,51とヒト47の両方の試験で遠心性運動神経信号を増幅および伝達することに顕著な成功を収め、複数の自由度で高精度の補綴装置制御を容易にしました。
四肢の弱さがあるが末梢神経が無傷の個人も同様に、外骨格デバイスを制御するために末梢神経インターフェースを介した運動意図の高精度検出の恩恵を受けるでしょう。RPNIは、切断者などの横断末梢神経との統合のために開発されたため、外科的修正が必要でした。RPNIの経験から、筋腱板再生末梢神経インターフェース(MC-RPNI)が開発されました。RPNIと同様の遊離筋移植片のセグメントで構成され、代わりに無傷の末梢神経に円周方向に固定されています(図1)。時間が経つにつれて、それは再生し、側副軸索発芽を介して再神経支配され、これらの遠心性運動神経信号を増幅し、数桁大きいEMG信号に変換します52。MC-RPNIは生物学的起源であるため、現在使用されている末梢神経界面で起こる避けられない異物反応を回避します52。さらに、MC-RPNIは、RPNIで以前に実証されているように、遠位に解剖された神経から個々の筋肉への大きなクロストークなしで配置できるため、複数の自由度を同時に制御する能力を付与します。最後に、MC-RPNIは近位神経に配置されているため、遠位筋機能から独立して動作することができます。MC-RPNIは、現在の末梢神経インターフェースに対する利点を考えると、安全で正確で信頼性の高い外骨格制御方法を提供する大きな期待を寄せています。
プロトコル
すべての動物の手順と実験は、ミシガン大学の施設管理および動物使用委員会(IACUC)の承認を得て実施されました。生後3〜6ヶ月のフィッシャーF344およびルイスラット(~200-300g)の雄および雌が実験に最も頻繁に利用されるが、理論的には任意の系統を利用することができる。自家筋移植の代わりにドナーラットを利用する場合、ドナーラットは実験株に同質遺伝子でなければならない。ラットは、術前と術後の両方で食物と水に自由にアクセスできます。終末エンドポイント評価に続いて、安楽死は心臓内塩化カリウム注射による深部麻酔下で行われ、続いて両側気胸の二次的方法が続きます。
1.ラットの実験的調製
- 誘導チャンバーで0.8〜1.0 L / minの酸素中の5%イソフルランの溶液を利用して実験ラットを麻酔します。.適切な麻酔が達成され、角膜反射がないことが確認されたら、麻酔を維持するためにイソフルランを1.75%〜2.25%に下げたリブリーザーノーズコーンにラットを置きます。.
- 0.02〜0.03 mLのカルプロフェン(50 mg / mL)を0.2 mLの滅菌生理食塩水に注入し、肩甲骨の間の皮下面に27 Gの針を入れて、周術期および術後の鎮痛を行います。.
- 麻酔をかけたまま角膜潰瘍を防ぐために、両眼に滅菌眼軟膏を塗布します。
- 電気かみそりを使用して、両側の下肢の外側部分を剃り、股関節から太ももを越えて、足の背側表面まで伸びます。
- 最初にアルコール調製パッドで拭き取り、次にポビドンヨード溶液を塗布し、最後に新しいアルコール調製パッドで最後の洗浄を行って残りのポビドンヨード溶液を除去して、手術部位を滅菌します。無菌性を維持するために、この交互のクレンジングプロセスを3回繰り返します。
注:これは皮膚科の刺激物である可能性があります。ソリューションの大部分が削除されていることを確認します。
2.筋移植の準備
- 体温モニタリングに最適な口腔内体温プローブを備えた手術用顕微鏡の下の加熱パッドにラットを置きます。イソフルランを1.75%〜2.25%に維持し、酸素を0.8〜1.0 L / minに維持します。.
- #15メスで、足首のすぐ上から膝のすぐ下まで伸びる目的のドナー後肢の前方に沿って縦方向の切開を行います。
- 鋭い虹彩はさみを使用して下にある皮下組織を解剖し、足首関節のすぐ近位にある下にある筋肉組織と遠位腱を露出させます。前脛骨筋(TA)は、筋肉の最大かつ最も前方です。長指伸筋(EDL)は、この筋肉のすぐ深く後方にあります。EDL筋とその遠位腱を周囲の筋肉組織から隔離します。
- 足首関節のすぐ近位の遠位腱の下に鉗子または虹彩はさみの両方のタインを挿入することにより、正しい腱の分離を確実にします。鉗子または虹彩はさみのいずれかを開いて、腱に上向きの圧力をかけます。この動きは、すべてのつま先を同時に伸ばす必要があります。孤立した足首背屈、足首の外転、または一本のつま先の背屈が発生した場合は、間違った腱が孤立しています。
- 鋭い虹彩はさみで足首の高さでEDL筋の遠位腱切開を行い、腱の起点に向かって近位に働く周囲の組織から筋肉を解剖します。
- 近位腱が視覚化されたら、鋭い虹彩ハサミを使用して近位腱切開を行い、移植片を解放します。
- 筋肉移植片の両腱端をトリミングし、鋭い虹彩ハサミで希望の長さにカットします。
注:8〜13 mmのグラフトが成功裏に利用されています。ただし、使用される最も一般的な長さは10mmです。 - 筋移植片の片側で、トリミングされた全長に沿って縦方向の切開を行い、筋移植片内の神経の配置を容易にし、神経と筋内膜との接触を提供します。
- 組織の乾燥を防ぐために、準備した筋肉移植片を生理食塩水で湿らせたガーゼに入れます。
- ドナー部位の上にある皮膚を4-0クロミック縫合糸でランニング方式で閉じます。
3.一般的な腓骨神経の分離と準備
- 坐骨ノッチから線~5 mmまで伸び、膝関節のすぐ下まで伸びる外科的切開に印を付けます。このマーキングが、下に触診できる大腿骨より劣っており、角度が離れていることを確認してください。
- #15ブレードでマークされた切開線に沿って皮膚および皮下組織を切開します。坐骨神経がすぐ下にあるため、筋肉の深さ全体に伸びないように注意しながら、下にある上腕二頭筋筋膜を注意深く切開します。
- 先端が鈍い小さなはさみまたは止血剤を使用して、大腿二頭筋を注意深く解剖します。
注:坐骨神経は上腕二頭筋の下のこの空間を移動し、皮膚にマークされた切開とほぼ同じ方向に向けられています。3つの注目すべき坐骨神経枝があります:腓腹(神経の最も後方と最小)、脛骨(通常は最も前方ですが、この神経は常に膝関節の奥深くまで潜ります)、および総腓骨(通常、脛骨と腓骨の間に位置し、常に膝関節の上に移動します)。 - 総腓骨(CP)神経を特定し、マイクロ鉗子とマイクロハサミを使用して周囲の神経から慎重に隔離します。神経の中央2 cmから周囲の結合組織を取り除きます。このプロセスでは、挫傷がエンドポイントの結果を変える可能性があるため、鉗子でCP神経を押しつぶさないように注意してください。
- 解放されたCP神経の最中央部分にわたって、筋移植の所望の長さに一致する神経の長さに沿って上膜の25%を除去することにより、上神経窓を実行する。
- これを実行するには、近位上膜をマイクロ鉗子で保持し、マイクロ解剖ハサミですぐ下にある上膜に切り込み、神経に沿って遠位に移動する上膜の~25%を取り除きます。複数回の試行は不規則な上動脈除去を引き起こし、神経損傷のリスクを高める可能性があるため、このセグメントを1つに取り除くように注意してください。
注:上神経の下にある神経組織は、グーのような質感を持ちます。この神経の質に注目することで、正しい組織平面が除去されたことが保証されます。
4. MC-RPNIコンストラクトファブリケーション
- 生理食塩水で湿らせたガーゼから筋肉移植片を取り除き、上神経窓が作成されたCP神経の中央部分の下に置きます。神経を180°回転させて、上神経窓部分が無傷の筋肉に接触し、最終的な縫合線の下にならないようにします。
- 8-0を使用するナイロン縫合糸、CP神経の上神経をステップ2.8で作成した溝内の筋移植片の近位および遠位の両方に縫合し、単純な中断縫合糸を使用して上神経を筋内膜に固定します。
注意: これらのステッチを配置し、筋肉が通常の安静時の長さであることを確認します。筋肉を伸ばしすぎたり圧迫したりすると、後で再生およびシグナル伝達機能に影響を与える可能性があります。 - 固定された神経を囲む筋移植片の端を円周方向に巻き付け、単純な中断8-0を利用して所定の位置に縫合しますナイロンステッチ(長さに応じて~4-6)。
- 止血が達成されたら、ランニングファッションで5-0クロミック縫合糸で構造上の大腿二頭筋膜を閉じます。
- 4-0クロミック縫合糸でランニングファッションで上にある皮膚を閉じます。
- アルコール準備パッドで手術領域を洗浄し、抗生物質軟膏を塗布します。
- 吸入麻酔薬を終了し、ケージの仲間から隔離された清潔なケージにラットを置き、餌と水の アドリブで回復させます。
- ラットが適切に回復したら、ケージメイトと一緒にきれいなケージに戻します。
注:これらの構築物は、適切な神経信号増幅を生成するために、少なくとも3か月の成熟を必要とします。
結果
MC-RPNI外科的作製は、ラットが外科的麻酔からの出現を生き延びない場合、または手術から1週間以内に感染症を発症した場合、周術期の失敗と見なされます。以前の研究では、3ヶ月の成熟期間がこの構築物からの信頼性の高いシグナル増幅をもたらすことが示されている42、45、48、49。その時点またはその後に、構築物の外科的曝露および評価が起こり得る。MC-RPNIの作製が成功した場合、血行再建術を受けた筋肉は元のMC-RPNI移植部位で容易に見えるはずです(図2B)。成功したMC-RPNIは、近位神経刺激後にさらに収縮します(ビデオ1)。時には、重大な瘢痕化および萎縮性筋移植が存在する可能性があり(図2C)、通常は大きすぎる移植片、不適切な取り扱い、または周術期組織損傷に続発する血行再建術/再生の失敗を示しています。これらの萎縮性移植片は、一般に、近位神経刺激に対してある程度の収縮を有するが、より低い信号増幅をもたらす。全体として、曝露時にMC-RPNIが神経から外れているか、近位神経刺激時に収縮していないことが判明した場合、製造の失敗と見なされます。
これらの構築物の組織学的分析は、重大な線維症または瘢痕化なしに生存可能な神経および筋肉組織を示すはずです(図3)。免疫組織化学は、シナプス後アセチルコリン受容体のマーカーとしてのα-ブンガロトキシンと組み合わせて、一般的な神経マーカーとしてニューロフィラメントを有する神経支配神経筋接合部の存在を確認するためにも行うことができる(図4)。標的移植神経がMC-RPNIの筋肉成分を神経支配できない場合、免疫染色は、構築物を横断する側副運動神経芽も、神経支配された神経筋接合部も示さないであろう。
電気生理学的試験は、成熟後いつでもこれらの構築物に対して実施することができ、ヒト被験者47において、3ヶ月52およびRPNIで最大3年でMC-RPNIにおいて特異的に安定したシグナルを示す結果が発表された。電気生理学的検査の回路図は、関心のある領域と利用可能な機器によって異なりますが(図5)、評価は、フック電極を使用して近位神経に最大の刺激を与えた後、MC-RPNIで生成された複合筋活動電位(CMAP)を記録することによって最も一般的に実行されます(表1).記録電極はユーザーの好みに応じて異なる場合がありますが、エピミシアルパッチ/パッド、エピミシアルバイポーラプローブ、および貫通バイポーラ電極が実験的に使用され、成功しています。より近位神経刺激後のCP神経で記録された平均複合神経振幅(CNAP)は、119.47μV±14.87μVであった。 同様の近位CP神経刺激後のMC-RPNIで記録された平均CMAP振幅は、3.28 mV±0.49 mVであり、その結果、神経信号は11〜87倍に増幅され、全体の平均増幅係数は31.8±7.70でした。これらの生成されたCMAP波形は、外観が天然の筋肉に類似しており、含まれている神経によって再神経支配されていることをさらに裏付けています(図6B)。
MC-RPNIの製造が機能に悪影響を及ぼさないことを保証するために、遠位神経支配筋に対して電気生理学的および筋力試験を行うことができます。検査の大部分は、検査のために簡単にアクセスでき、総腓骨神経によって神経支配されているため、同側EDL筋で実施されています(反対側のEDLはMC-RPNI製造のために採取されているため、評価されていません)。近位CP神経刺激後に生理学的EDL筋によって生成されるCMAPは、通常、20〜30mV52の範囲です。MC-RPNIを移植したラットでこの試験を行った場合、EDL CMAPは有意差はなく、平均24.27 mV±1.34 mVです。さらに、これら2つのグループ間で生成されたCMAP波形を比較すると、それらは非常に類似しています(図6C)。遠位神経支配筋機能の追加尺度として、対象の筋肉の筋力試験を追求することができる(表2)。近位CP神経刺激に続いて、MC-RPNI被験者において生成される平均EDL最大破傷風力は、2451mN±115mNであり、対照被験者52においてEDL筋から得られた2497mN±122mNの平均力と同様である。
MC-RPNIの全体的な目的は、封じ込められた神経のマイクロボルトレベルの信号を数桁増幅し、SNR比を高めて、運動意図の正確な検出を容易にすることです。この増幅は、10〜20倍52の範囲で信頼性の高い方法で発生することが実証されており、最近の実験では50倍を超える増幅係数を達成しています。したがって、コンストラクトが同様のレベルの増幅を提供しない場合、それは次善と見なされます。最適ではない結果は、不完全な再生、したがって再神経支配が標準CMAPよりも低くなり、構築物の全体的な増幅能力を低下させる可能性があるため、通常、MC-RPNIの筋肉移植のレベルの問題に起因する可能性があります。生成された波形は通常減衰し、著しく異常な外観になります。筋移植が完全に失敗した場合、筋肉成分で測定された信号は存在しない(重要な瘢痕組織の二次性)か、上流の神経で生成されたCNAPを反映している可能性があります。
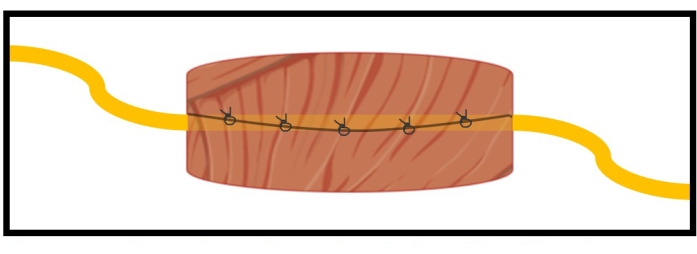
図1:MC-RPNIの概略図。標的末梢神経は、周囲の筋肉移植片内で黄色で見ることができます。MC-RPNIは、数桁大きい複合筋活動電位(CMAP)の生成により、封じ込められた神経の運動遠心性活動電位をマイクロボルトのレベルで増幅することができます。これにより、バックグラウンドノイズと簡単に区別できるモーターインテントの検出が容易になります。この図の拡大版を表示するには、ここをクリックしてください。
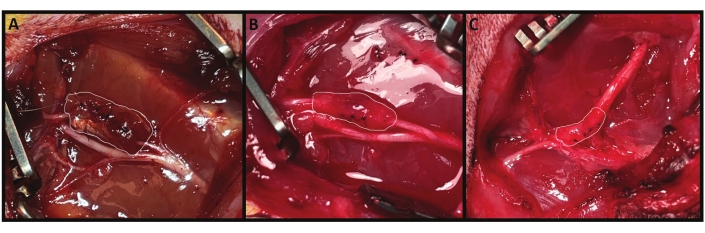
図2: 生体内のMC-RPNI。 MC-RPNIは、反対側の肢から採取した自家伸筋長指筋(EDL)を使用して製造されます。次に、総腓骨神経に円周方向に固定され、最初の製造時に白(A)で概説されたMC-RPNIの例があります。この同じMC-RPNIは、3か月後のエンドポイント評価時に再び(B)に示されています。MC-RPNIは周囲の筋肉と同様の色をしており、ボリュームのかなりの部分を保持しています。萎縮性筋移植の一例を(C)に示す。MC-RPNIは、周囲の瘢痕や結合組織に似た外観をしており、かなりの体積を失っています。 この図の拡大版を表示するには、ここをクリックしてください。
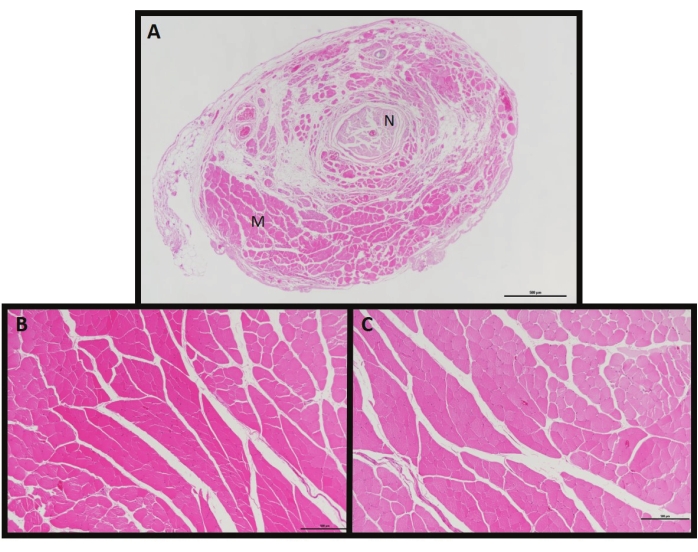
図3:MC-RPNI組織像。(A) MC-RPNI断面のH&Eで、Mは筋肉成分を示し、Nは神経を示します。(B)MC-RPNIを有するラットにおける同側遠位神経支配EDL筋の断面。(C)MC-RPNIを含まない対照ラットにおけるEDL筋の断面。 この図の拡大版を表示するには、ここをクリックしてください。

図4:MC-RPNIの免疫染色。 左上の画像は、MC-RPNI標本の縦断面を示しており、核は青色(DAPI)、神経組織は緑色(ニューロフィラメント)で示されています。別のMC-RPNIのクローズアップが右下に表示され、複数の神経筋接合部が存在します(アセチルコリン受容体の赤のα-ブンガロトキシン)。 この図の拡大版を表示するには、ここをクリックしてください。
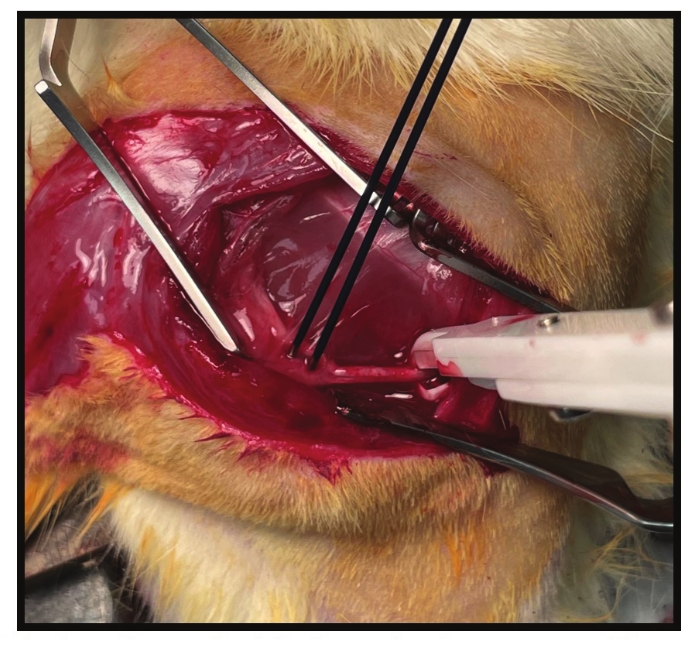
図5:エンドポイントの電気生理学的評価のセットアップ。 電気生理学的試験には、少なくとも3つの電極が必要です:(1)接地電極-写真にはありません。(2)神経刺激性バイポーラ電極;(3)バイポーラ記録電極。この設定では、バイポーラ刺激フック電極が、総腓骨神経に配置された画像の右側に白で見ることができます。記録バイポーラプローブ電極は、遠位MC-RPNIに配置されます。次に、最大のCMAPが達成されるまで、フック電極での近位神経刺激に続いてMC-RPNIから信号が記録されます。 この図の拡大版を表示するには、ここをクリックしてください。

図6:標準的な電気生理学的波形。 これらのグラフは、近位CP神経刺激後のMC-RPNIを移植したラットの電気生理学的分析中にキャプチャされた典型的な波形を示しています。(A)青色で、MC-RPNI近位のCP神経から記録されたCNAP(*)が描かれています。システム成果物は (**) で示されます。(B)(A)で生成されたCNAPに続いてMC-RPNIから記録された代表的なCMAPである。(C)同側遠位神経支配筋から記録された結果のCMAP波形。 この図の拡大版を表示するには、ここをクリックしてください。
| ラット ID | ラット重量(g) | 神経CNAP振幅(μV) | MC-RPNI CMAP 振幅 (MV) | 神経信号増幅因子 | 待機時間 (ミリ秒) |
| 1 | 421 | 123.3 | 1.4 | 11.35 | 0.8 |
| 2 | 368 | 65.6 | 1.6 | 24.39 | 1.05 |
| 3 | 390 | 110.7 | 4.5 | 40.65 | 1.45 |
| 4 | 482 | 217.2 | 3.61 | 16.62 | 0.95 |
| 5 | 417 | 144.6 | 1.39 | 9.61 | 0.9 |
| 6 | 417 | 156.1 | 3.4 | 21.78 | 0.95 |
| 7 | 381 | 82 | 7.2 | 87.8 | 0.9 |
| 8 | 393 | 87.9 | 2.3 | 26.17 | 1.15 |
| 9 | 378 | 87.8 | 4.2 | 47.84 | 1 |
| 10 | 459 | 該当なし | 5.3 | 該当なし | 1.55 |
| 11 | 380 | 該当なし | 2.1 | 該当なし | 0.75 |
| 12 | 415 | 該当なし | 2.4 | 該当なし | 1 |
表1:MC-RPNIのエンドポイント電気生理学的分析。製造後3ヶ月(ラット1〜9)および6(ラット10〜12)でエンドポイント分析を受けたラットから得られた結果の選択。近位総腓骨神経(CP)刺激に続いて、下流のCP神経で複合神経活動電位(CNAP)が記録され、下流のMC-RPNIで複合筋活動電位(CMAP)が記録されました。各テストの増幅係数は、右側の列に表示されます。注:ラット10-12の場合、MC-RPNIを坐骨神経からのCP神経の離陸に近づけすぎた結果として生じる解剖学的制限により、MC-RPNI近位のCNAPを測定することができませんでした。記録された平均CNAP振幅は119.47μV±14.87μVでしたが、平均CMAP振幅は3.28mV±0.49mVであり、平均増幅係数は31.8±7.70でした。
| ラット ID | マキシマルツイッチ(mN) | V | 最大テタニー(mN) | V | ヘルツ | ロー (ミリメートル) |
| 1 | 927.13 | 3 | 2668.29 | 3 | 80 | 30.64 |
| 2 | 768.22 | 3.5 | 2677.85 | 3.5 | 80 | 31.15 |
| 3 | 646.99 | 3 | 2164.84 | 3 | 80 | 28.36 |
| 4 | 863.62 | 3.5 | 3109.67 | 3.5 | 150 | 31.07 |
| 5 | 774.48 | 1.5 | 2723.24 | 2 | 80 | 28.83 |
| 6 | 558.19 | 4 | 1930.22 | 4 | 120 | 29.46 |
| 7 | 753.97 | 1 | 2605.64 | 1 | 100 | 31.13 |
| 8 | 768.38 | 2 | 2897.08 | 2 | 100 | 31.86 |
| 9 | 559.9 | 1.5 | 1984.17 | 1.5 | 100 | 31.11 |
| 10 | 600.6 | 5.5 | 2416.09 | 5.5 | 80 | 32.51 |
| 11 | 770.27 | 5.5 | 2496.89 | 5.5 | 80 | 31.89 |
| 12 | 672.22 | 2.5 | 1740.04 | 2.5 | 50 | 31.34 |
表2:MC-RPNIを移植したラットの筋力分析。 MC-RPNIが遠位神経支配筋機能に影響を与えるかどうかを判断するために、同側指伸筋(EDL)に対して筋力テストを実施しました。近位CP神経刺激に続いて、力の追跡が記録され、対象のテストに関連する活動力が計算されました。Lorは 、最大の力を生み出す最適な筋肉安静時長として定義されました。MC-RPNIを移植したラットから記録された平均最大けいれん力は722.0 mN±32.11 mNであり、記録された平均最大破傷風力は2451 mN±115 mNであり、対照動物から得られた値と同様でした(最大けいれん:822.2 mN ± 41.11 mN、最大テタニー:2497 mN ± 122 mN)。
ビデオ1:近位神経電気刺激後のMC-RPNI収縮。右側のフック電極による近位神経電気刺激に続いて、MC-RPNIの目に見える筋収縮が中央に見られます。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
MC-RPNIは、外骨格デバイスを正確に制御するために、無傷の末梢運動神経の遠心性活動電位の増幅を可能にする新しい構造です。具体的には、MC-RPNIは、EMG信号を記録できない重大な筋肉疾患および/または筋肉の欠如によって引き起こされる四肢の衰弱を有する個人に特別な利益を与える。すでに損なわれた筋肉機能を低下させることは、この集団では壊滅的なものになるでしょう。しかしながら、MC−RPNIは、遠位神経支配筋52 を損なうことなくこの神経信号増幅を提供する能力を有する(表1および 表2)。筋肉ベースまたは下位運動ニューロン疾患を有する個体において、末梢感覚神経は、典型的には、疾患プロセス53の影響を受けない。感覚が温存するため、神経の連続性を保ち、損傷を避けることが不可欠であり、MC-RPNIは、組織学(図3)、免疫組織化学(図4)、および筋機能の評価(表2)に基づいて、遠位神経支配標的全体への悪影響を回避しているようです。
MC-RPNIは、封じ込められた末梢神経の側副軸索発芽の概念に依存しており、この概念は、以前の研究52と、端側神経障害のよく説明された外科的技術54,55の両方で容易に実証されています。MC-RPNI製造中の筋肉移植片の適切な再神経支配を確実にし、遠位神経支配標的への悪影響を回避するには、神経の細心の注意を払うことが不可欠です。神経の解剖中、外傷は上神経または結合組織のみを簡潔に取り扱うことによって回避することができる。ただし、MC-RPNI製造における神経損傷の可能性は、上神経窓ステップ中に最も高くなります。神経線維の鋭い切断を避けるために、非実験ラットでの練習の機会が数回あった後、高出力手術用顕微鏡(少なくとも5倍)でのみこのステップを実行することをお勧めします。このステップを習得するには数回の試行が必要になる可能性があり、実験分析を目的としたラットで最初にこのステップを実行することは推奨されません。理論的には、連続性神経腫は、特に重大な神経外傷の存在下で、MC-RPNI製造後に発生する可能性のある合併症です。ただし、この複雑さは、開発の長年にわたって発生していません。
MC-RPNIで行われた実験の大部分は、その比較的アクセスの容易さと遠位神経支配標的の評価を考慮して、総腓骨神経で行われています。理論的には、運動成分を有する任意の末梢神経を代用することができる。筋肉組織には感覚成分(紡錘体線維、ゴルジ体腱器官など)があるため、純粋な感覚軸索を利用することができますが、これらの実験はこれまで行われておらず、結果の予測は困難です。MC-RPNIの筋移植成分については、移植片の長さはラットの年齢に応じて20〜150mgの範囲であり、同様のサイズの筋移植をうまく利用することができる。筋移植片の再生は血行再建能力に部分的に依存しており、大きくて厚い移植片は壊死や線維症を起こす可能性が高く、全体的なシグナル伝達能力に影響を与えます56。RPNIについて特に行われた研究では、300 mg56までの移植片における筋肉の再生とシグナル増幅の維持が成功していることが示されています。ラットの繁殖に関しては、実験目的で使用される他のラットの大部分が神経損傷に続発して自傷することが知られているため、ルイスとフィッシャーが推奨されます57,58。
全体として、MC-RPNI製造に関する現在の経験では、<5%の故障率を生み出しています。見られる最も一般的な構築不全は、通常、筋移植セグメントに起因し、曝露時にそれらは萎縮性または神経から外れていることが指摘される。MC-RPNIの剥がれは、通常、製造時の縫合が不十分であり、円周方向に包まれた筋肉移植片の「開放」と、最終的には封じ込められた神経の部分的な押し出しにつながります。ただし、これらのMC-RPNIは通常、移植片の一部が神経に固定されたままであるため、ある程度の信号増幅能力を保持します(低下はありますが)。萎縮性MC-RPNIは、典型的な骨格筋の外観を欠いており、淡いピンク色から灰色/白色の瘢痕組織と区別できないことが多いため、曝露時に明らかです(図2C)。筋肉組織の萎縮は、感染、筋移植片の大きすぎる/厚すぎる、急性失血貧血、製造中の筋肉および/または神経損傷、ならびに神経上膜固定縫合糸の失敗を含む多くの要因から生じ、神経への移植片のピストンを引き起こし、血行再建術を低下させる。電気生理学的検査では、萎縮性MC-RPNIは通常、信号増幅をほとんどまたはまったく生成しません。高感度電極を使用する場合、下にある神経のCNAPの記録は、萎縮性筋肉を介して記録できます。複数の実験対象で有意な萎縮が認められた場合は、プロトコルに戻り、どのステップに調整が必要かを判断する必要があります。もちろん、評価の実行時にシグナルが記録されない場合は、トラブルシューティングを行うことが重要であり、構造がエラーであると想定しないでください。信号の欠如は、損傷した電極(インピーダンス<16 Ωを推奨)、不適切な電極構成、または不十分な近位神経刺激(一部の神経は、下流のMC-RPNIでCMAPの生成を開始するために0.5〜5 mAの電気刺激を必要とする)に二次的である可能性があるため、デバイスセットアップのトラブルシューティングが最も重要です。
四肢の弱さを持つ人における外骨格使用のための人間と機械のインターフェースの現在の方法は、典型的には、末梢神経または筋肉組織からのEMGのいずれかから得られた記録に依存している。前述のように、MC-RPNIは、EMG記録が不可能な筋肉組織がひどく損傷または欠如している個人に、外骨格制御に関して大きな利益をもたらします29。MC-RPNIはまた、神経外電極30,31,32,33、筋膜内電極34,35,36および貫通電極37,38,39,40を含む現在の末梢神経インターフェースオプションよりも利点を提供する。.固有の神経信号は一般的にマイクロボルトのレベルであるため、MC-RPNIはこれらの神経信号を30倍以上増幅する能力を備えており、バックグラウンドノイズから運動意図を正確に検出し、信頼性の高い外骨格制御を可能にします。慢性的な使用では、現在の電極ベースの方法は、最終的に、生体内の材料の寿命と異物反応に固有の合併症を克服するのに苦労し、MC-RPNIはその生物学的起源を考えると回避することができます。時間が経つにつれて、これらの異物反応は、組織の損傷、瘢痕組織の形成、および最終的な軸索脱髄および変性をもたらす。6カ月までの実験では、神経損傷、瘢痕、遠位神経支配筋組織の線維化/変性の証拠は明らかにされておらず(図3)、3年間の観察期間にわたってヒト被験者で認められたRPNI安定性と組み合わせると47、MC-RPNIは数年から数十年のスケールで末梢神経とうまくインターフェースできると結論付けるのが妥当です。
MC-RPNIは、筋肉自体だけでなく神経系のレベルでも発生するものを含む、さまざまな病状における外骨格制御に利用されることを目的としています。例えば、筋肉ベースの病状は、外傷、筋ジストロフィー、炎症性ミオパチー、および重症筋無力症の範囲の状態を含み得る。これらの状態をもたらす可能性のある深刻な筋肉の損傷と衰弱にもかかわらず1,2,3、大多数は、MC-RPNIの再神経支配と運動意図の検出を促進する機能的な下部運動ニューロンを持っています。広範囲の筋肉疾患(筋ジストロフィーなど)を引き起こす状態の場合、遊離筋移植成分が影響を受け、増幅の可能性が制限される可能性があります。しかし、単一の運動単位(10-400 μV)59の検出でも末梢神経信号の増幅を提供できることを考えると、MC-RPNIは、この集団の外骨格制御を容易にするのに十分な運動単位をそのより小さく定義された領域内に含むと仮定するのが妥当です。しかしながら、構成物の重大な制限は、脳卒中、脊髄損傷、脊髄筋萎縮症(SMA)、および筋萎縮性側索硬化症(ALS)などの上位および/または下位運動ニューロンの有意な減少をもたらす病状にある。MC-RPNIを再神経支配するための適切な末梢神経線維集団がなければ、MC-RPNIは再生して信号増幅を提供することができず、構築不全につながります。適切なMC-RPNI機能に必要な機能的末梢神経線維の最小集団を決定するための実験が行われています。
MC-RPNIの前身であるRPNIは、トランセクトした末梢神経から発生する信号の増幅と記録を通じて、ヒト被験者の電動補綴物の正確な制御で計り知れない成功を収めています。最も注目すべきは、補綴装置の再手術や再校正なしに、数ヶ月から数年のスケールでこれを行うことができることです。外骨格制御のためのヒトと機械のインターフェースの現在の方法に関する一般的な不満は、クロストークによる信号汚染とEMG依存法での頻繁な再校正の必要性26,27,28、および二次手術を必要とする経時的な末梢神経界面の不安定性37,39,44.しかし、MC-RPNIは、その生物学的構成と戦略的配置能力を考えると、これらの合併症を回避することができます。人間の被験者での使用への道を開き、最終的には四肢の弱さを抱えて生きる人々に正確で信頼性の高い外骨格デバイスを広く利用するために、この構造の完全な理解を確立することが不可欠です。
開示事項
著者には開示がありません。
謝辞
著者らは、ジャナ・ムーンの専門的なラボ管理と技術支援、チャールズ・ファンのイメージングの専門知識に感謝しています。この論文の実験の一部は、SS(3135146.4)への形成外科財団の助成金、およびSSへの賞番号1F32HD100286-01の国立小児保健人間発達研究所、および国立衛生研究所の国立関節炎および筋骨格および皮膚疾患研究所(賞番号P30 AR069620)を通じて資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| #15 Scalpel | Aspen Surgical, Inc | Ref 371115 | Rib-Back Carbon Steel Surgical Blades (#15) |
| 2-N-thin film load cell (S100) | Strain Measurement Devices, Inc | SMD100-0002 | Measures force generated by the attached muscle |
| 4-0 Chromic Suture | Ethicon | SKU# 1654G | P-3 Reverse Cutting Needle |
| 5-0 Chromic Suture | Ethicon | SKU# 687G | P-3 Reverse Cutting Needle |
| 8-0 Monofilament Suture | AROSurgical | T06A08N14-13 | Black polyamide monofilament suture on a threaded tapered needle |
| Experimental Rats | Envigo | F344-NH-sd | Rats are Fischer F344 Strain |
| Fine Forceps - mirror finish | Fine Science Tools | 11413-11 | Fine tipped forceps with mirror finish ideal for handling delicate structures like nerves |
| Fluriso (Isofluorane) | VetOne | 13985-528-40 | Inhalational Anesthetic |
| Force Measurement Jig | Red Rock | n/a | Custom designed force measurement jig that allows for immobilization of hindlimb to allow for accurate muscle force recording |
| MATLAB software | Mathworks, Inc | PR-MATLAB-MU-MW-707-NNU | Calculates active force for each recorded force trace from passive and total force measurements |
| Nicolet Viasys EMG EP System | Nicolet | MFI-NCL-VIKING-SELECT-2CH-EMG | Portable EMG and nerve signal recording system capable of simultaneous 2 channel recordings from nerve and/or muscle |
| Oxygen | Cryogenic Gases | UN1072 | Standard medical grade oxygen canisters |
| Potassium Chloride | APP Pharmaceuticals | 63323-965-20 | Injectable form, 2 mEq/mL |
| Povidone Iodine USP | MediChoice | 65517-0009-1 | 10% Topical Solution, can use one bottle for multiple surgical preps |
| Puralube Vet Opthalmic Ointment | Dechra | 17033-211-38 | Corneal protective ointment for use during procedure |
| Rimadyl (Caprofen) | Zoetis, Inc. | NADA# 141-199 | Injectable form, 50 mg/mL |
| Stereo Microscope | Leica | Model M60 | User can adjust magnification to their preference |
| Surgical Instruments | Fine Science Tools | Various | User can choose instruments according to personal preference or from what is currently available in their lab |
| Triple Antibiotic Ointment | MediChoice | 39892-0830-2 | Ointment comes in sterile, disposable packets |
| Vannas Spring Scissors - 2mm cutting edge | Fine Science Tools | 15000-04 | Curved micro-dissection scissors used to perform the epineurial window |
| VaporStick 3 | Surgivet | V7015 | Anesthesia tower with space for isofluorane and oxygen canister |
| Webcol Alcohol Prep | Coviden | Ref 6818 | Alcohol prep wipes; use a new wipe for each prep |
参考文献
- Andersson, G. S. The burden of musculoskeletal diseases in the United States : prevalence, societal, and economic cost. American Academy of Orthopaedic Surgeons. , Rosemont, IL. (1942).
- Yelin, E. H., Weinstein, S., King, T. The burden of musculoskeletal diseases in the United States. Seminars in Arthritis and Rheumatism. 46 (3), 259-260 (2016).
- McDonald, C. M. Clinical Approach to the Diagnostic Evaluation of Hereditary and Acquired Neuromuscular Diseases. Physical Medicine and Rehabilitation Clinics of North America. 23 (3), 495-563 (2021).
- Sass, F. A., et al. Immunology Guides Skeletal Muscle Regeneration. International Journal of Molecular Sciences. 19 (3), 835(2018).
- Bruggeman, K. F., et al. Harnessing stem cells and biomaterials to promote neural repair. British Journal of Pharmacology. 176 (3), 355-368 (2019).
- Vijayavenkataraman, S. Nerve guide conduits for peripheral nerve injury repair: A review on design, materials and fabrication methods. Acta Biomaterialia. 106, 54-69 (2020).
- O'Dell, M. W., Lin, C. C., Harrison, V. Stroke rehabilitation: strategies to enhance motor recovery. Annual Review of Medicine. 60, 55-68 (2009).
- Ambrosini, E., et al. The combined action of a passive exoskeleton and an EMG-controlled neuroprosthesis for upper limb stroke rehabilitation: First results of the RETRAINER project. International Conference on Rehabilitation Robotics (ICORR). , 56-61 (2017).
- Veerbeek, J. M., et al. Effects of robot-assisted therapy for the upper limb after stroke. Neurorehabilitation & Neural Repair. 31 (2), 107-121 (2017).
- Heo, P., et al. Current hand exoskeleton technologies for rehabilitation and assistive engineering. Journal of Precision Engineering and Manufacturing. 13 (5), 807-824 (2012).
- Kwakkel, G., Kollen, B. J., Krebs, H. I. Effects of robot-assisted therapy on upper limb recovery after stroke: A systematic review. Neurorehabilitation & Neural Repair. 22 (2), 111-121 (2007).
- Brewer, B. R., McDowell, S. K., Worthen-Chaudhari, L. C. Poststroke Upper Extremity Rehabilitation: A Review of Robotic Systems and Clinical Results. Topics in Stroke Rehabilitation. 14 (6), 22-44 (2007).
- Kalita, B., Narayan, J., Dwivedy, S. K. Development of active lower limb robotic-based orthosis and exoskeleton devices: A systematic review. International Journal of Social Robotics. 13, 775-793 (2021).
- Bosch, T., et al. The effects of a passive exoskeleton on muscle activity, discomfort and endurance time in forward bending work. Applied Ergonomics. 54, 212-217 (2016).
- Secciani, N., et al. A novel application of a surface ElectroMyoGraphy-based control strategy for a hand exoskeleton system: A single-case study. International Journal of Advanced Robotic Systems. 16 (1), 1729881419828197(2019).
- Bützer, T., et al. PEXO - A pediatric whole hand exoskeleton for grasping assistance in task-oriented training. IEEE 16th International Conference on Rehabilitation Robotics (ICORR). , 108-114 (2019).
- Meeker, C., et al. EMG pattern classification to control a hand orthosis for functional grasp assistance after stroke. IEEE International Conference on Rehabilitation Robotics (ICORR). , 1203-1210 (2017).
- Witkowski, M., et al. Enhancing brain-machine interface (BMI) control of a hand exoskeleton using electrooculography (EOG). Journal of NeuroEngineering and Rehabilitation. 11 (1), 165(2014).
- Cantillo-Negrete, J., et al. Motor imagery-based brain-computer interface coupled to a robotic hand orthosis aimed for neurorehabilitation of stroke patients. Journal of Healthcare Engineering. 2018, 1624637(2018).
- Bhagat, N. A., et al. Design and optimization of an EEG-based brain machine interface (BMI) to an upper-limb exoskeleton for stroke survivors. Frontiers in Neuroscience. 10, 122(2016).
- Habibzadeh Tonekabony Shad, E., Molinas, M., Ytterdal, T. Impedance and noise of passive and active dry EEG electrodes: A review. IEEE Sensors Journal. 20 (24), 14565-14577 (2020).
- Tariq, M., Trivailo, P. M., Simic, M. EEG-based BCI control schemes for lower-limb assistive-robots. Frontiers in Human Neuroscience. 12, 312-312 (2018).
- Gwin, J. T., Ferris, D. High-density EEG and independent component analysis mixture models distinguish knee contractions from ankle contractions. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2011, 4195-4198 (2011).
- Tariq, M., Trivailo, P. M., Simic, M. Classification of left and right foot kinaesthetic motor imagery using common spatial pattern. Biomedical Physics & Engineering Express. 6 (1), 015008(2019).
- Ryser, F., et al. Fully embedded myoelectric control for a wearable robotic hand orthosis. iInternational Conference on Rehabilitation Robotics (ICORR). , 615-621 (2017).
- Reeves, J., Starbuck, C., Nester, C. EMG gait data from indwelling electrodes is attenuated over time and changes independent of any experimental effect. Journal of Electromyography and Kinesiology. 54, 102461(2020).
- Huang, J., et al. Control of upper-limb power-assist exoskeleton using a human-robot interface based on motion intention recognition. IEEE Transactions on Automation Science and Engineering. 12 (4), 1257-1270 (2015).
- Rodrigues, C., et al. Comparison of intramuscular and surface electromyography recordings towards the control of wearable robots for incomplete spinal cord injury rehabilitation. 2020 8th IEEE RAS/EMBS International Conference for Biomedical Robotics and Biomechatronics (BioRob). , 564-569 (2020).
- Rasool, G., et al. Spatial analysis of multichannel surface EMG in hemiplegic stroke. IEEE Transactions on Neural Systems and Rehabilitation Engineering : A Publication of the IEEE Engineering in Medicine and Biology Society. 25 (10), 1802-1811 (2017).
- Stieglitz, T., et al. Non-invasive measurement of torque development in the rat foot: measurement setup and results from stimulation of the sciatic nerve with polyimide-based cuff electrodes. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 11 (4), 427-437 (2003).
- Polasek, K. H., et al. Human nerve stimulation thresholds and selectivity using a multi-contact nerve cuff electrode. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 15 (1), 76-82 (2007).
- Kenney, L., et al. An implantable two channel drop foot stimulator: initial clinical results. Artificial Organs. 26 (3), 267-270 (2002).
- Ortiz-Catalan, M., et al. Patterned stimulation of peripheral nerves produces natural sensations with regards to location but not quality. IEEE Transactions on Medical Robotics and Bionics. 1 (3), 199-203 (2019).
- Boretius, T., et al. A transverse intrafascicular multichannel electrode (TIME) to interface with the peripheral nerve. Biosensors and Bioelectronics. 26 (1), 62-69 (2010).
- Petrini, F. M., et al. Six-month assessment of a hand prosthesis with intraneural tactile feedback. Annals of Neurology. 8 (1), 137-154 (2019).
- Jung, R., et al. Bionic intrafascicular interfaces for recording and stimulating peripheral nerve fibers. Bioelectronics in Medicine. 1 (1), 55-69 (2017).
- Christensen, M. B., et al. The foreign body response to the Utah Slant Electrode Array in the cat sciatic nerve. Acta Biomaterialia. 10 (11), 4650-4660 (2014).
- Zollo, L., et al. Restoring tactile sensations via neural interfaces for real-time force-and-slippage closed-loop control of bionic hands. Science Robotics. 4 (27), (2019).
- George, J. A., et al. Long-term performance of Utah slanted electrode arrays and intramuscular electromyographic leads implanted chronically in human arm nerves and muscles. Journal of Neural Engineering. 17 (5), 056042(2020).
- Wendelken, S., et al. Restoration of motor control and proprioceptive and cutaneous sensation in humans with prior upper-limb amputation via multiple Utah Slanted Electrode Arrays (USEAs) implanted in residual peripheral arm nerves. Journal of NeuroEngineering and Rehabilitation. 14 (1), 121(2017).
- Yang, Z., et al. Noise characterization, modeling, and reduction for in vivo neural recording. Proceedings of the 23rd Annual Conference on Neural Information Processing Systems (NIPS 09). , 2160-2168 (2009).
- Ursu, D. C., et al. In vivo characterization of regenerative peripheral nerve interface function. Journal of Neural Engineering. 13 (2), 026012(2016).
- Lotti, F., et al. Invasive intraneural interfaces: Foreign body reaction issues. Frontiers in Neuroscience. 11, 497-497 (2017).
- Stiller, A. M., et al. A meta-analysis of intracortical device stiffness and its correlation with histological outcomes. Micromachines. 9 (9), 443(2018).
- Kung, T. A., et al. Regenerative peripheral nerve interface viability and signal transduction with an implanted electrode. Plastic and Reconstructive Surgery. 133 (6), 1380-1394 (2014).
- Kubiak, C. A., Kemp, S. W. P., Cederna, P. S. Regenerative peripheral nerve interface for management of postamputation neuroma. JAMA Surgery. 153 (7), 681-682 (2018).
- Vu, P. P., et al. A regenerative peripheral nerve interface allows real-time control of an artificial hand in upper limb amputees. Science Translational Medicine. 12 (533), (2020).
- Svientek, S. R., et al. Fabrication of the composite regenerative peripheral nerve interface (C-RPNI) in the adult rat. Journal of Visualized Experiments: JoVE. (156), e60841(2020).
- Ursu, D., et al. Adjacent regenerative peripheral nerve interfaces produce phase-antagonist signals during voluntary walking in rats. Journal of NeuroEngineering and Rehabilitation. 14 (1), 33(2017).
- Vu, P. P., et al. Closed-loop continuous hand control via chronic recording of regenerative peripheral nerve interfaces. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (2), 515-526 (2018).
- Urbanchek, M. G., et al. Development of a Regenerative Peripheral Nerve Interface for Control of a Neuroprosthetic Limb. BioMed Research International. 2016, 5726730(2016).
- Kubiak, C. A., et al. Physiologic signaling and viability of the Muscle Cuff Regenerative Peripheral Nerve Interface (MC-RPNI) for intact peripheral nerves. Journal of Neural Engineering. 18 (4), (2021).
- Rocha, J. A., et al. Diagnostic investigation and multidisciplinary management in motor neuron disease. Journal of Neurology. 252 (12), 1435-1447 (2005).
- Haastert, K., et al. Nerve repair by end-to-side nerve coaptation: histologic and morphometric evaluation of axonal origin in a rat sciatic nerve model. Neurosurgery. 66 (3), 567-576 (2010).
- Hayashi, A., et al. Collateral sprouting occurs following end-to-side neurorrhaphy. Plastic and Reconstructive Surgery. 114 (1), 129-137 (2004).
- Hu, Y., et al. Regenerative peripheral nerve interface free muscle graft mass and function. Muscle & Nerve. 63 (3), 421-429 (2021).
- Carr, M. M., et al. Strain differences in autotomy in rats undergoing sciatic nerve transection or repair. Annals of Plastic Surgery. 28 (6), 538-544 (1992).
- Sporel-Özakat, R. E., et al. A simple method for reducing autotomy in rats after peripheral nerve lesions. Journal of Neuroscience Methods. 36 (2), 263-265 (1991).
- Lemon, R. N., Mantel, G. W. H., Rea, P. A. Recording and identification of single motor units in the free-to-move primate hand. Experimental Brain Research. 81 (1), (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。