Method Article
ラットの先天的および文脈的脅威コンディショニングを研究するための避けられない猫の臭気曝露プロトコル
要約
ネコの皮膚/毛皮の臭いへの曝露は、げっ歯類の神経回路と防御反応のメカニズムを調査するための信頼性の高い方法を提供し、ヒトの恐怖を媒介するメカニズムについての洞察を提供する可能性があります。ここでは、ラットの脅威応答における内受容皮質の役割を調査するためのプロトコルについて説明します。
要約
動物は、回避、凍結、リスク評価など、多くの防御行動を示すことにより、脅威となる状況に対応します。動物行動学的なアプローチによる動物モデルは、脅威対応の根底にある生物学的メカニズムについてより深い洞察を提供します。この論文では、ラットの自然嫌悪刺激と学習嫌悪刺激の両方に対する防御行動を測定する方法論について説明します。動物は、測定可能で持続的な防御状態を引き出すために、避けられない部屋で捕食者の臭いに個別にさらされました。実験デザインでは、ラットを慣れ親しんだ部屋に10分間置き、その後、同じ状況でさらに10分間猫の臭いにさらしました。翌日、ラットを、ネコの臭いへの曝露が発生したのと同じ状況の部屋に10分間再曝露した。セッションはビデオ録画され、防御行動は両日で評価されました。
行動試験は、脅威応答における内受容感覚皮質の役割を決定するために、可逆的な機能不活性化およびc-Fos免疫組織化学技術と組み合わされました。1日目にネコの臭いに曝露し、2日目にコンテクストチャンバーに再曝露したラットは、より高いレベルの防御行動を示し、そのネコの臭いは内受容感覚皮質の神経活動の強力な増加を誘発した。さらに、内受容感覚皮質のムシモール不活性化は、猫の匂いに反応する防御行動の発現を減少させ、文脈上の脅威記憶を損ないました。これらの結果は、この行動アッセイが防御行動の神経メカニズムを研究するための有用なツールであり、ヒトとそれに関連する障害の恐怖を媒介するメカニズムについての洞察を提供する可能性があることを示しています。
概要
防御行動は、動物の生存に対する潜在的な脅威を示す刺激に反応して発生します。これらの行動は哺乳類全体で高度に保存されており、脅威1,2,3に関連する刺激や状況に急速に関連しています。自然界では、ほとんどの動物にとって脅威となる刺激は捕食者です。したがって、匂いの手がかりなどの捕食者の手がかりの検出は、捕食を回避するのに特に有利です。捕食者の手がかりに対する行動反応は、げっ歯類で広く研究されています。
例えば、猫の自然な毛皮や皮膚の匂いなどの刺激は、嗅覚系と鋤鼻系を活性化し、高レベルの防御行動を誘発します4。これらの刺激は、ニューロンおよび内分泌活動の変化を伴い5,6,7,8、ラット7,8,9,10,11の文脈的脅威条件付けのための強力で無条件の嫌悪刺激である。研究によると、自然の捕食者の手がかりにさらされてから少なくとも24時間後、ラットは頑丈で長期にわたる条件付けされた不安様状態を示すことが示されています7,12,13。この現象は、心的外傷後ストレス障害(PTSD)14,15,16,17、全般性不安障害(GAD)5、およびパニック障害(PD)18,19のより現実的なモデルを開発するために特に興味深いものです。
実験室の設定では、恐怖行動は、飛行、回避(例:後退、隠れる)、または凍結として測定されます。さらに、不安は、捕食性刺激(リスク評価行動6,9,20として広く知られている一連の反応)を監視するためのストレッチ姿勢と用心深いスキャンとして測定することができる。研究によると、凍結行動は、逃れられない脅威に対するラットの主要な防御戦略であり、一方、脅威が曖昧であるか非局所的であるときにリスク評価が観察されることが示されています12,21,32。先天的または学習的な刺激が防御行動を引き出すことは知られていますが、より倫理学的な文脈で防御反応を確実に捉える実験室の行動パラダイムが不足しています。このギャップを埋めるために、私たちは、自然主義的な脅威刺激に対する脳の反応とともに、持続的な生得的および文脈的な脅威行動の測定を可能にする動物行動学的アプローチを備えたプロトコルを設計しました。
逃れられない捕食者の臭いにさらされるなどのストレスの多い経験は、ラットの行動的および生理学的反応に永続的な変化を引き起こします14,22,23。これらの変化は、PTSDなどの恐怖や不安関連障害で観察される症状プロファイルを反映しています。現在のモデルでは、安全な隠れ場所がない試験室を使用して、ネズミを避けられない脅威イベントにさらし、防御反応を強化しています。ラットは、ネコの臭いと試験の状況の両方に対して、しっかりとした凍結行動とリスク評価行動を示しました。これらの知見は、防御行動の根底にある生物学的メカニズムを探求し、ヒトの恐怖障害の治療のための新しい戦略を開発および改良するための信頼性のある有効な方法として、このプロトコルの使用を支持するものです。
プロトコル
以下の手順は、National Institutes of Health(米国)のGuide for the Care and Use of Laboratory Animals(NIH Publication No. 80-23, revised 1996)による施設ガイドラインの推奨に従って実施された。ポンティフィシア・カトリカ・デ・チリ大学の施設内バイオセーフティーおよび倫理委員会は、すべての手続きを承認しました。すべての実験セッションは、ラットの活動期(暗期)に実施されました。
1. 試験室と試験室の準備
注意: オーバーview 装置を図1に示します。試験室は、以前の研究24,25に従って開発および変更されました。
- 寸法が60 cm(長さ)x 40 cm(幅)x 40 cm(高さ)の透明な長方形のポリ(メタクリル酸メチル)試験チャンバーを使用します。試験チャンバーの側面と背面の壁を黒い紙で覆います。動物の行動を記録するために、試験チャンバーの前面が透明であることを確認してください。
- 試験室の右下隅の床にスチールブラケットを固定し、それを使用して試験手順用の猫用首輪を取り付けます。
- 試験の前後に5%(v / v)エタノールで試験チャンバーを洗浄して、対象のラットが残した匂いの手がかりを取り除き、ラットの嫌悪反応を避けます。エタノールが完全に蒸発するまで、各セッションの間に5分間待ちます。
- 試験チャンバーから20cm上方にある80Wの赤色電球で薄暗い静かな部屋で試験セッションを実施します。チャンバーの前にあるビデオカメラを使用して、動物の行動を記録します。
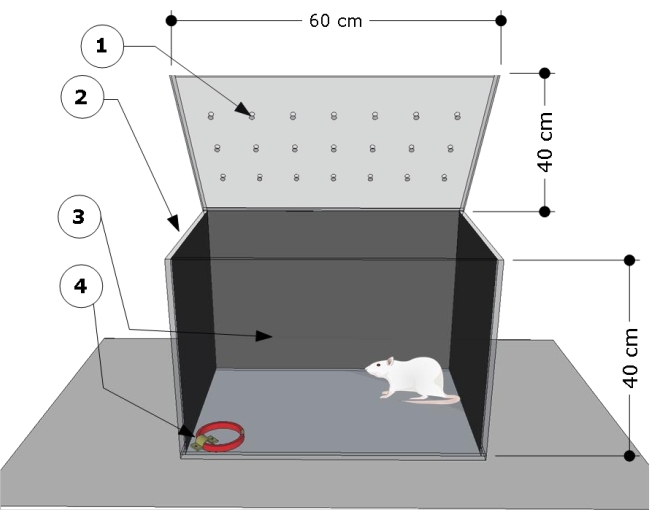
図1:試験チャンバーの概略図。 この装置は、(1)通気孔、(2)側面、(3)後壁を暗くしたテストコンパートメントと、(4)左隅の床にロックされたキャットカラーを取り付けるためのスチールブラケットで構成されています(寸法:幅15mm、厚さ5mm、長さ300mm)。チャンバーの寸法は漫画に示されています(60 L x 40 W x 40 H cm)。 この図の拡大版を表示するには、ここをクリックしてください。
2.ネコ臭対策
- 猫の臭いをよりよく閉じ込めるために、フェルトで裏打ちされた内面のある猫用首輪を入手してください。コントロールカラー(臭気なし)またはテストカラー(猫の臭い)として使用するための複数のカラーが利用可能であることを確認してください。
注:重要な点は、猫の首輪には、臭いを収集して閉じ込めるための内部裏地が必要であるということです。 - 飼いならされた卵巣摘出術を受けた雌猫に首輪を装着し、検査の1週間前に猫が首輪を着用できるようにします。テスト首輪を着用している間、雌猫を室内に留めておくようにしてください。
注:研究全体を通して同じ猫を使用してください。 - 着用した猫用首輪は密閉プラスチック容器に入れ、4°Cで保管してください。 着用した猫用首輪を、3日ごとに新鮮な猫の臭いがする首輪に交換してください。
3. 実験手順のためのラットの準備
- 体重270〜290 gの成体の雄Sprague-Dawleyラットを使用してください。それらを個々のケージに収容し、チャウと水を自由に利用できます。
- [オプション]外科的処置のためのラットの準備(オプション)
- 無菌条件下で手術を行います。70%エタノールの溶液で作業領域を洗浄および消毒し、すべての手術材料と器具を滅菌します。
- ケタミン(100 mg / kg)とキシラジン(20 mg / kg)の腹腔内混合物でラットに麻酔をかけます。.ラットがつま先のつま先つまみ刺激または角膜刺激に反応しない場合は、麻酔の適切な平面が達成されるまで待ちます。手術中ずっと麻酔状態を維持するために、45分ごとに麻酔カクテルを追加投与します。
- ラットの頭を耳の後ろから目の間まで優しく剃り、滅菌アルコール調製パッドと続いてポビドンヨード溶液で手術部位を消毒します。外科的処置中の角膜の乾燥を避けるために、潤滑剤の眼軟膏を塗布してください。
- ラットを定位固定装置に置き、耳のバーを外耳道に適切に配置して頭を保持します。次に、ラットの切歯を切歯バーにそっと挿入し、ノーズクランプを固定します。
- 滅菌済みの26Gステンレススチール製ガイドカニューレを定位固定装置ホルダーに留置します。メスを取り、頭皮に沿って正中線を切開します。切開部の周りに2つ以上のクランプを配置します(2〜3 cm)。
- ブレグマとラムダ頭蓋縫合糸の両方が見えるまで、頭蓋骨から組織を完全に取り除きます。
- 頭蓋骨の背腹軸と前後軸を切歯と耳のバーでそれぞれ位置合わせすることにより、頭部の対称的な位置を確認します。関心のある脳領域のガイドカニューレの座標を特定します。切歯バーを使用して、ブレグマとラムダを同じ水平面に保ちます。
- Paxinos と Watson26 または Swanson Atlas27 の定位固定座標に従って、関心のある領域へのガイドカニューレ移植部位の座標を計算します。
注:一次内受容感覚島皮質については、次の定位固定座標が使用されました:ブレグマ-0.51 mm、正中線5.0 mm、頭蓋表面からの深さ4.5 mm、垂直から内側に10°の角度が付けられています。 - ガイドカニューレの埋め込み座標を頭蓋骨に触れるまで下げて確認し、確認された部位の頭蓋骨に穴を開けます。ターゲット領域の周りに3つの追加の穴を開けて、頭蓋骨に3本のネジを配置します。
- カニューレを脳の関心のある領域に挿入し、ネジと歯科用アクリルを使用してカニューレを頭蓋骨に固定します。乾いた頭蓋骨に歯科用アクリルを注ぎ、カニューレを所定の位置に固定するためにネジを覆っていることを確認します。アクリルデンタルが固まるのを待ってから、ガイドカニューレを所定の位置に残して、脳定位固定アームを慎重に取り外します。
注:この手順では、埋め込まれたカニューレを固定し、実験者が関心のある領域で複数のマイクロインジェクションを実行できるようにします。 - ステンレス製のスタイレットをガイドカニューレに挿入して、障害物や汚染を防ぎます。
- 手術の最後に、抗生物質(エンロフロキサシン5%;19 mg / kg i.p.)と抗炎症薬(ケトフェン0.2 mg / kg i.p.)を単回投与します。.手術後3日間連続してこの手順を繰り返します。
- 実験を開始する前に、ラットが少なくとも1週間完全に回復するのを待ちます。
- 実験開始の少なくとも10日前から、ラットを逆の12/12時間の明暗サイクル(午後7:00に点灯)の下に保ちます(図2)。
注:実験者が外科的処置を行う必要がある場合は、ダークライトサイクルを逆転させる前に行う必要があります。これにより、手術後のストレスを軽減することができます。 - すべてのラットを20分/日、2〜3日間取り扱います。一度に1匹のネズミを連れて行き、動物を(尻尾ではなく)胴体でしっかりと保持し、この間、ネズミを撫でてください。動物がストレスの兆候を示している場合は、長期間取り扱ってください。
注意: この手順は、次の手順に影響を与える可能性のある取り扱いストレスを最小限に抑えるために重要です。 - 実験の3日前に、動物を試験室(猫の首輪を着用していない猫の臭いの部屋)に30分/日事前にさらして、動物が試験の状況に順応できるようにします。
注:実験者は香りのよい香水やローションを着用しないことをお勧めします。 - 動物をチャンバーに入れた後、約10〜15分待ってから、テストチャンバーにアームを導入し、猫の首輪を同じ機能を持つ別の猫の首輪と交換します。
注:このステップは、テストの最後の10分間のラットの行動パフォーマンスに影響を与える可能性のあるストレスを最小限に抑えるために、行動手順の各ステップをできるだけ忠実にシミュレートするために重要です。 - セッションの合間に5%(v / v)エタノールで試験チャンバーを清掃します。

図2:実験計画のタイムライン。 ラットを逆の暗光サイクルに10日間さらし、その後、最後の3日間、対照(未着用の)猫用首輪を含む試験室に30分間慣れさせました。0日目に、ラットを最初に馴染みのある試験室(CONTEXT)に10分間さらし、次に猫の匂いの有無にかかわらず首輪にさらに10分間(TEST)さらしました。1日目に、0日目に猫の臭いに曝露されたラット(TEST)を同じ試験チャンバーに10分間戻され(CONTEXT)、さらに10分間猫の臭いに再曝露されました(RETEST)。この数値は 8から修正されています。略語:R-Dark / light =逆のダークライトサイクル。 この図の拡大版を表示するには、ここをクリックしてください。
4.猫の臭気テスト手順
- 実験プロトコルの 0 日目に、猫の臭いに対する脅威の反応を評価します。
- 必要に応じて、以下に説明する方法に従って行動テストの前に皮質注射を投与します。.ビヘイビアプロトコルのみを実行する場合は、この手順をスキップして手順 4.3 に進みます。
- オクルーダーを取り外した後、1 μL Hamilton シリンジに結合した滅菌済みの 33 G 注射カニューレをガイドカニューレに挿入します。
- ハミルトンシリンジに滅菌生理食塩水(対照ラット)またはGABA-A受容体アゴニストであるムシモール(治療ラット)を充填し、0.5μL /半球を2分間注射します。.薬物の拡散を許すまで2分間待ち、注射カニューレをゆっくりと取り外し、すぐに閉塞器を挿入します。
注:この手順を静かで目覚めている動物で行い、薬物をゆっくりと注射して、注射カニューレのジッターとその結果としての隣接する脳領域への拡散を最小限に抑えます。. - 皮質注射/半球が完了したら、30分待ってから次のステップに進みます。
- 動物を試験室に20分間置きます。最初の10分間は、動物を着用していない馴染みのある首輪にさらします。次の10分以内に、猫の臭いが染み込んだ首輪(TEST)または着用していない馴染みのある首輪(CONTEXT)を紹介します(図3)。

図3:猫の臭いに遭遇すると、自然防御行動が増加する (A, B) ラットを最初に馴染みのある試験室(CONTEXT)に10分間さらし、次に猫の臭いのある首輪(猫の臭いグループ、黒い円)または猫の臭いのない首輪(無臭グループ、白丸)に同じコンテキストでさらに10分間(TEST)さらした。円は、ナイーブラットが示した凍結時間(B)とリスク評価(C)に費やした時間の割合を示しています。データは平均+SEMで表されます。 *p < 0.05。この数値は 8から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
- 試験チャンバーの前にビデオカメラを置き、実験条件を知らなくても実験者が後で行動を採点するために、動物の行動を記録します。
- 猫の匂いのセッションが終わったら、動物を自宅のケージに戻し、次のセッションまで動物施設に戻します。
- セッションの合間に5%(v / v)エタノールで試験チャンバーを清掃します。
- 猫の匂いセッション(1日目)の24時間後、テストの状況に対する防御反応を評価します。
- 必要に応じて、コンテキストを公開する前に手順 4.2 を繰り返します。
- ラットを装着していない馴染みのある首輪を同じ試験室に戻し、防御行動のスコアを付けて、10分間の文脈に応じた脅威の記憶を測定します(図4)。
- 試験チャンバーの前にビデオカメラを置き、実験条件を知らなくても実験者が後で行動を採点するために、動物の行動を記録します。
- 次の10分間で、着用していない馴染みのある首輪を交換し、猫の臭いがする首輪に動物を再度さらし、防御行動を測定します。
- 猫の臭いに2回目の暴露後、動物を自宅のケージに戻し、5%(v / v)エタノールで試験チャンバーを清掃します。ネズミを動物施設に戻します。
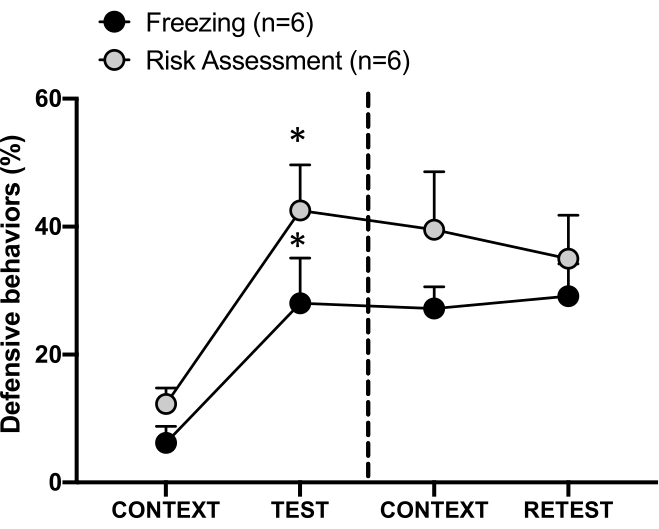
図4:ネコの匂いに遭遇すると、状況に応じた脅威学習が誘発されます。 円は、凍結に費やされた時間の割合 (黒い円) とリスク評価行動 (灰色の円) を示しています。破線は、生来の恐怖テスト(0日目、左)と文脈的恐怖テスト(1日目、右)を分けています。データは平均 + SEMで表されます。 *p < 0.05。この数値は 8から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
5. 免疫組織化学的手続き
- 実験完了の90分後に、ケタミン(0.45 mg / kg)とキシラジン(0.05 mg / kg)の腹腔内混合物で動物に麻酔をかけます。次に、4%パラホルムアルデヒドによる経心灌流によりラットを安楽死させます。
注:最初の猫の臭いへの曝露、コンテキストへの条件付き反応、または猫の臭いへの再曝露を評価する必要がある場合は、これらの実験状況のそれぞれ後にこの手順を実行してください。手袋と白衣を着用し、パラホルムアルデヒドは化学薬品のヒュームフードの下で注意して取り扱ってください。 - 灌流後、脳を同じ固定液に2時間固定し、脳が底に沈むまで、リン酸緩衝生理食塩水(PBS)中の0.02%アジ化ナトリウムを含む30%スクロースに移します。脳を4°Cで保存します。
- ドライアイスで脳を凍結し、スライド式ミクロトームで厚さ50μmの連続冠状切片に切断します。関心のある領域の脳切片を 3 セット収集し、1 セットをカニューレ配置の検証用に、2 セットを免疫組織化学的手順用に残します。
- フリーフローティング脳切片をPBS中の0.3%H2O2 で30分間インキュベートし、PBSで洗浄し、これらの切片をブロッキング溶液(0.4%Triton X-100、0.02%アジ化ナトリウム、PBS中の3%正常ヤギ血清)溶液に1時間移します。
- ブロッキング溶液で1:20,000に希釈したc-Fos抗体を含む一次抗体インキュベーション溶液に切片を移し、室温で一晩放置します。
- 切片をPBSで1時間洗い流した後、0.4% Triton X-100およびPBS中の1.5%正常ヤギ血清で1:1,000に希釈した二次抗体溶液でインキュベートします。
- 切片を40分間すすぎ、PBSで1:500に希釈したアビジン/ビオチンベースのペルオキシダーゼシステム( 材料表を参照)で1時間インキュベートします。
- 0.003%のH2O2 と0.05%の塩化ニッケルを含む3-3′ジアミノベンジジン塩酸塩(DAB)の0.05%溶液で切片をすすぎ、インキュベートして、濃い青色の反応生成物を得ます。
6. 細胞計数
- 低倍率(10倍)の対物レンズを使用して、カメラlucidaの下で切片を検査し、ニューロンの核におけるc-Fos点状染色を局在化します(図5)。
- 対象領域のサイズに関連するカウント グリッドを使用します。たとえば、Bregma 0.95から-0.26までのpICでは、0.25 mm x 1 mmの計数グリッドを使用します。Bregma -0.51 から -2.45 mm までは、0.5 mm x 1 mm の計数グリッドを使用します。
- Digit Manual Counterを使用して、セクションあたりのc-Fos免疫反応性(Fos-ir)細胞の数を定量化します。
- 関心のあるすべての冠状切片を2回カウントし、実験条件を知らない同じ観察者がカウントを行うことを確認します。
- 顕微鏡とデジタルカメラを組み合わせて写真を撮ります。

図5:猫の匂いは、一次内受容感覚皮質のニューロン活性化を誘発します。 (A)猫の匂いに曝露されたラット(無臭)に曝露されたラットでは、c-Fos-ir細胞(黒の矢印)がほぼ存在しない(無臭、左)の代表的な顕微鏡写真で、猫の匂いに曝露されたラットではc-Fos-ir細胞の数が著しく増加した(右)。(B)両方の実験条件でのpIC中のc-Fos-ir細胞の定量。データは平均 + SEMで表されます。 *p < 0.05。スケールバー = 200 μm。この数値は 8から修正されています。略語:pIC =一次内受容感覚皮質;c-fos-ir = c-Fos-免疫反応性。 この図の拡大版を表示するには、ここをクリックしてください。
7. データ分析
- ビデオ録画された実験から防御行動をスコアリングし、統計ソフトウェアを使用して分析します。
- 10分間に凍結に費やされた時間の割合として表されるタイミング発作によって凍結を評価します。式 (1) を使用して凍結率を計算します。
凍結 = (凍結に費やした秒数/600 秒) × 100 (1)
注:凍結は、少なくとも1秒28分の呼吸を除いて完全に動きがないことと定義されました。 - 警戒的なスキャン発作のタイミングを計ることによってリスク評価を採点し、10分間にリスク評価に費やされた時間の割合として表します。式 (2) を使用してリスク評価の割合を計算します。
% リスク評価 = (リスク評価に費やした秒数 / 600 秒) × 100 (2)
注:リスク評価行動は、少なくとも1秒29の警戒スキャン(天文台、左右の頭の動き、ロコモットなし)として定義されました。 - これらの行動パラメータを手動で採点し、実験条件(つまり、臭気や薬物の状態)を知らされていない実験者によってカウントされていることを確認します。データセットの正規性に応じて、パラメトリック検定またはノンパラメトリック検定を使用して 2 つ以上のグループを比較します。
注:この研究では、すべての統計的検定をSPSSソフトウェアを使用して実行しました。- Kruskal-Wallis H検定とMann-Whitney U検定を使用して、グループ間のペアワイズ比較を行います。
- フリードマン検定とそれに続くウィルコクソン符号順位検定を使用して、ペアワイズ比較を行い、グループ内比較を経時的に分析します。
注:すべての図で、有意水準はp < 0.05(*)およびp < 0.01(**)に設定されました。
- 特定の脳領域におけるc-Fos発現の解析では、mm2あたりのc-Fos-ir細胞の密度を計算してセクションあたりのc-Fos陽性細胞の数をカウントし、制御条件(無臭)と刺激条件(猫臭)の平均数を比較します。
- データの正規性に応じて、対応のないスチューデントの t検定またはマン・ホイットニー のU検定を使用します。
注:この研究では、マンホイット ニーU検定が使用されました。差は、Pが0.05(*)の場合<有意であると考えられました。
- データの正規性に応じて、対応のないスチューデントの t検定またはマン・ホイットニー のU検定を使用します。
結果
このプロトコルでは、凍結率とリスク評価パーセンテージを、ラットの恐怖と不安様状態の指標としてそれぞれ測定しました。実験計画のタイムラインを 図2に示します。0日目に猫の臭いに曝露された動物からの結果を 図3に示します。ラットは、ネコの臭気(TEST)に対して、身近な状況(CONTEXT)よりも、ネコの臭気(TEST)に対して有意に高いレベルの凍結(図2A、猫臭気グループ、Wilcoxon Signed-ranks 試験、Z = -2.201、p = 0.028)およびリスク評価(図2B、猫臭グループ、Wilcoxon Signed-ranks試験 Z = -2.336 p = 0.018)を示しました。低レベルの凍結(図2A、無臭グループ、Wilcoxon Signed-ranksテスト、 Z = -0.184、p = 0.854)およびリスク評価(図2B、無臭グループ、Wilcoxon Signed-ranksテスト、 Z = -1.753、p = 0.08)が、テストの後半で着用されていない首輪に曝露されたラットで観察されました。
追加の分析により、凍結のレベル(図2A、マンホイットニー検定、 U = 0.000、p = 0.004)とリスク評価(図2B、マンホイットニー検定、 U = 4.000、p = 0.025)のレベルは、テストの後半で猫臭グループの方が無臭グループよりも高かったことが明らかになりました。慣れ親しんだ状況(CONTEXT)への最初の10分間の2つのグループ間で、凍結(図2A、Mann-Whitney検定、 U = 11.000、p = 0.256)およびリスク評価(図2B、Mann-Whitney検定、 U = 15.00、p = 0.627)に有意差はありませんでした。これらの結果は、このプロトコルが猫の毛皮/皮膚の臭いに反応した防御行動のテストに適していることを示しています。
1日目のテストコンテキスト(CONTEXT)に対する条件付きの脅威対応を 図4に示します。ネコの臭いに曝露したラットは、最初の捕食者の臭い遭遇から24時間後に試験室に戻されました。1日目に、動物は0日目よりも試験状況に応じて高い凍結(Wilcoxon Signed-ranks試験、 Z = -2.366、p = 0.018)およびリスク評価(Wilcoxon Signed-ranks試験、 Z = -2.201、p = 0.028)レベルを示しました。さらに、CONTEXTとRETESTの間で、凍結(Wilcoxon符号順位検定、 Z = -0.841、p = 0.400)またはリスク評価(Wilcoxon符号順位検定、Z = -0.943、p = 0.345)のレベルに差はありませんでした。ラットは、RETESTとTESTで同じ凍結レベル(Wilcoxon Signed-ranks検定、 Z = -0.105、p = 0.917)とリスク評価(Wilcoxon Signed-ranks検定、Z = -0.980、p = 0.327)を示しました。これらの結果は、猫の毛皮/皮膚の臭いに1回さらされただけで、動物が捕食者の臭いに直面した状況に対する脅威反応が学習されたことを示しました。
図 5 と図 6 は、この記事で紹介したプロトコルを使用した 2 つの実験セットを示しています。我々は、感情処理8,30,31,32に関与する脳領域である一次内受容感覚皮質(pIC)が防御行動の発現に必要かどうかを検証した。ネコの匂いによるニューロンの活性化は、pICにおいて、分離された動物群のc-Fos-ir細胞を数えることにより評価しました:無臭条件とネコ臭条件。これらのラットは、TESTの完了から90分後に安楽死させました。猫の匂い群(Mann-Whitney検定、U = 3.000、p = 0.016)では、対照群(図5)と比較して、pICのc-Fos-irニューロンの数に有意な増加が観察されました。

図6:一次内受容感覚皮質のムシモールの不活性化は、文脈上の脅威記憶を損ないます。 (A、B)治療群には、pIC の 0 日目に生理食塩水を、1 日目にムシモールを注射しました (治療群)。対照ラットには、両日ともpICに生理食塩水を注射した。1日目に、動物を慣れ親しんだ試験室に戻して、CONTEXTに10分間さらし、さらに10分間猫の臭いに再さらしました(RETEST)。円は、凍結に費やされた時間の割合 (黒い円) とリスク評価行動 (白丸) を示しています。破線は、生来の恐怖テスト(0日目、左)と文脈的恐怖テスト(1日目、右)を分けています。データは平均 + SEMで表されます。 *p < 0.05。この数値は 8から修正されています。略語:pIC =一次内受容感覚皮質;Sal-Sal = 0日目と1日目に注射された生理食塩水。Sal-Mus = 0日目に生理食塩水、1日目にムシモールを注射。 この図の拡大版を表示するには、ここをクリックしてください。
また、pICの不活性化が文脈上の脅威記憶に及ぼす影響も測定しました(図6)。治療群(sal-musラット)は、0日目にpICに生理食塩水注射を受け、1日目にGABA-Aアゴニストムシモールを投与されました。この群の動物は、0日目と比較して、身近な状況に応じて、1日目の凍結(図6A、Wilcoxon Signed-ranksテスト、Z = -0.140、p = 0.889)またはリスク評価(図6B、Wilcoxon Signed-ranksテスト、Z = -0.700、p = 0.484)レベルに差を示さなかった。興味深いことに、フリーズ(図6A、Wilcoxon符号順位検定、Z = -2.100、p = 0.036)は、リスク評価(図6B、Wilcoxon符号順位検定、Z = -0.980、p = 0.327)では、TESTと比較してRETEST中に有意に減少しました。この最後の発見は、1日目にpICを沈黙させると、捕食者の匂いに対する恐怖反応が選択的に損なわれたが、不安反応は損なわれなかったことを示しています。まとめると、これらの結果は、上記の実験プロトコルが捕食性の脅威に対する先天的および学習的な防御反応の研究に適していることを裏付けています。
ディスカッション
ここで説明するプロトコルは、先天的および学習的な嫌悪刺激によって引き起こされる防御行動を評価するための革新的なアプローチを提供します。安全な隠れ場所のない試験室(図1)と、卵巣摘出されたメスのイエネコの皮膚/毛皮の臭いを染み込ませた首輪を使用して、ラットの強力で持続的な脅威状態を誘発し、適応および不適応防御反応の根底にある神経回路を調査するのに役立つ可能性があります。
特定の防御反応の表示は、脅威刺激の特徴と動物が遭遇する状況/環境の両方に依存することはよく知られている21,33。回避、リスク評価、および凍結は、脅迫的な刺激によって引き起こされる可能性のある動物の防御反応の膨大なレパートリーの一部である9,19。しかし、優勢な防御反応の選択は、脅威33からの距離や試験室21、33内の安全な場所の存在などの環境条件に依存する。たとえば、ネズミが隠れ箱のあるアリーナに置かれると、猫の臭いがあると、ストレッチ/アテンドポーズ、隠れ箱から頭を出す、回避などの防御行動を示します6,24,25。対照的に、凍結行動、警戒スキャン、およびストレッチ/アテンド姿勢は、脱出が不可能であり、脅威までの距離が過度に短くない状況で強く引き出されます33,34。
研究によると、制御不能なストレッサーへの曝露は、ストレッサーが制御可能なときに発生するものとは異なるさまざまな行動結果を生み出すことが示されています35,36,37,38。例えば、避けられないが、逃れることができないテールショックは、背側縫線核35のセロトニンの大幅な増加と、嫌悪経験36の24時間後に測定された不安様行動をもたらす。さらに、制御不能なストレッサーは、動物36,37およびヒト38の恐怖条件付けを強化します。このプロトコルを開発した当初の理論的根拠は、ラットを嫌悪刺激を制御できない状況にさらすことで、したがって、強力で持続的な脅威反応を示し、1回および短時間の猫の匂いにさらされた後に強化された文脈学習を発達させることでした。
ここで説明する実験デザインでは、隠れ箱がないことは、凍結(すなわち、呼吸28を除く完全な不動)とリスク評価(すなわち、警戒スキャンおよびストレッチ/アテンドポーズ29)行動を交互に繰り返す強力で持続的な防御状態を呼び起こしました。これは、通常、げっ歯類の恐怖および不安様状態の行動症状としてそれぞれ考えられています(図3).特に、ラットがテストコンテキストに再曝露された24時間後に同じ防御反応のパターンが起こり、以前に報告された7,10,11,14,15,34,39(図4)のように、10分間の猫の毛皮/皮膚の臭いへの曝露が長期にわたるコンテキスト脅威学習を誘発するのに十分であることを示しています。
内部にフェルトの裏地が付いた猫用首輪は、匂いや匂いを効率的に収集して捕捉するために使用され、強力な防御反応を呼び起こす脅威刺激の信頼性の高いサンプルを取得しました。研究者たちは、猫の糞便、尿、トリメチルチアゾリン(TMT、キツネの糞便の成分)などの嫌悪刺激を同様の研究で使用しています。それにもかかわらず、これらの刺激は、文脈学習を誘発する能力が低いため、捕食者の直接の存在をあまり予測できないように思われる40,41。以前の調査結果2,4,8,9,10,11,20,34,39によれば、猫の匂いは、ラットの持続的な防御反応と文脈上の脅威記憶を誘発することができる信頼できる生来の嫌悪刺激です。長年にわたり、この種の行動行動動物モデルは、PTSDなどの不適応な恐怖記憶に関連するもののようなストレスおよびストレス関連障害13,14,15,16,17,23,42を研究するための研究者の関心をますます引きつけてきました。
このプロトコルは、例えば、分子生物学や細胞生物学のアプローチ、覚醒状態や行動している動物の電気生理学など、さまざまな実験手法と組み合わせて使用することを意図しており、未解決の質問に答え、適応型および不適応型の脅威対応についての理解を深める機会を提供します。本研究では、感情処理に関与する脳領域であるpICが防御行動の発現に必要であるという考えを検証しました。行動実験は、c-Fos免疫組織化学と組み合わせて、猫の匂いとGABA-A受容体アゴニストであるムシモールの脳内注入に応答するpICのニューロン活動のパターンをマッピングし、pICを可逆的に沈黙させ、捕食者の匂いに対する先天的および学習された脅威反応への関与を決定しました。これらの知見から、猫の匂いがpICの神経活動の増加を誘発し(図5)、pICをサイレンシングすると文脈上の脅威記憶が著しく欠損すること(図6)が明らかになりました。
ここで説明するプロトコルは、実装と実行が技術的に簡単ですが、いくつかの問題が発生する可能性があります。たとえば、着用していない首輪が着用した猫の首輪に接触すると、猫の臭いの相互汚染が発生する可能性があります。したがって、すべての手順では首輪を別々に保管する必要があり、手袋は、着用した首輪を試験チャンバーに配置した後に交換する必要があります。実験者が同じ試験室を使用して臭気条件と無臭条件を実施したい場合、実験は異なる日に行う必要があります。これらの実験には、2つの同一の試験室を使用することができ34、ラットは社会的コミュニケーションを避けるために別々の部屋で飼育されるべきである43。また、不慣れな環境での新たな刺激にさらされることによるストレスも問題となる可能性があります。したがって、動物は、新しい状況でラットが一般的に示すストレスと防御性を軽減するために、試験環境と手順に少なくとも3日間慣れる必要があります。また、慣れ期間に必要な時間は、テスト期間よりも長くする必要があります。たとえば、テストに10分かかる場合、慣れ期間には20分または30分を割り当てる必要があります。
最後に、防御行動は、ラットが活動しているサイクルの暗い段階で好ましく評価する必要があります。ラットは、ラットと実験者の両方が活動期にある間に実験手順を実行できるように、逆の明暗サイクルの下で維持されなければならない34。明暗サイクルの変化は、落ち着くのに10日もかからず、経験に基づいて、この状態のほとんどのラットは猫の臭いに適切に反応します。しかし、Sprague-DawleyラットはWistarラット44よりも長期にわたる脅威条件付けと不安に対して脆弱ではないことを示すいくつかの研究があります。したがって、Sprague-Dawley系統ラットの代わりにWistarラットを使用すると、より堅牢な結果が得られる可能性があります。
結論として、猫の匂いは、ラットの信頼できるニューロン、内分泌、および行動反応を引き出す、動物学的に関連する脅威刺激です。逃れられない部屋で猫の匂いに遭遇すると、ラットの恐怖/不安反応が強力かつ長期化し、その結果、迅速かつ持続的な文脈的脅威学習がもたらされます。上記のプロトコルは、恐怖と適応的および不適応的な脅威記憶の符号化メカニズムを研究するための有用なツールになる可能性があります。
開示事項
この原稿の著者には、開示すべき競合する金銭的利益やその他の利益相反はありません。
謝辞
著者らは、実験室の手順を支援してくれたMarcela Gonzalez氏、プロトコルデザインに貢献してくれたMabel Matamala氏、イラストレーションを支援してくれたMiguel Rojas氏に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
参考文献
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682 (2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283 (2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J., Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. , 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, 45 (2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16 (2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91 (2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1997).
- Swanson, L. W. . Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377 (1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292 (2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132 (2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041 (2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved