Method Article
פרוטוקול חשיפה בלתי נמנע לריח חתולים לחקר התניה מולדת והקשרית של איומים בחולדות
In This Article
Summary
חשיפה לריח עור/פרווה של חתול מספקת שיטה אמינה לחקירת מעגלים עצביים ומנגנונים של תגובות הגנה במכרסמים ועשויה להציע תובנה לגבי מנגנונים המתווכים פחד בבני אדם. כאן, אנו מתארים פרוטוקול לחקירת תפקיד קליפת המוח האינטרוספטיבית בתגובות איום בחולדות.
Abstract
בעלי חיים מגיבים למצבים מאיימים על ידי הפגנת מספר התנהגויות הגנתיות, כולל הימנעות, הקפאה והערכת סיכונים. מודל בעלי חיים עם גישה אתולוגית מציע תובנה עמוקה יותר לגבי המנגנונים הביולוגיים העומדים בבסיס תגובות האיום. מאמר זה מתאר מתודולוגיה למדידת התנהגויות הגנתיות כלפי גירויים מולדים ונלמדים בחולדות. בעלי חיים נחשפו באופן אינדיבידואלי לריח טורף בתא בלתי נמנע כדי לעורר מצב מדיד, מתמשך והגנתי. תכנון הניסוי כלל הצבת חולדה בתא מוכר למשך 10 דקות ולאחר מכן חשיפה לריח חתול למשך 10 דקות נוספות באותו הקשר. למחרת, החולדות נחשפו מחדש למשך 10 דקות לאותו תא הקשר שבו התרחשה חשיפה לריח חתולים. המפגשים הוקלטו בווידאו והתנהגויות הגנתיות הוערכו בשני הימים.
המבחן ההתנהגותי היה משולב עם השבתה תפקודית הפיכה וטכניקות אימונוהיסטוכימיה c-Fos כדי לקבוע את תפקיד קליפת המוח האינטרוספטיבית בתגובות לאיום. חולדות שנחשפו לריח חתול ביום הראשון ונחשפו שוב לתא ההקשר ביום השני הראו רמות גבוהות יותר של התנהגויות הגנתיות, וריח החתול עורר עלייה חזקה בפעילות העצבית של קליפת המוח האינטרוספטיבית. יתר על כן, השבתת המוסימול של קליפת המוח האינטרוספטיבית הפחיתה את הביטוי של התנהגויות הגנתיות בתגובה לריח חתול ופגעה בזיכרון האיום ההקשר. תוצאות אלה מראות כי בדיקה התנהגותית זו היא כלי שימושי לחקר מנגנונים עצביים של התנהגויות הגנתיות ועשויה להציע תובנה לגבי מנגנונים המתווכים פחד בבני אדם והפרעות הקשורות אליו.
Introduction
התנהגויות הגנתיות מתרחשות בתגובה לגירויים המאותתים על איום פוטנציאלי להישרדותו של בעל חיים. התנהגויות אלה נשמרות מאוד בקרב יונקים וקשורות במהירות לגירויים או נסיבות הקשורות לאיום 1,2,3. בטבע, הגירויים המאיימים עבור רוב בעלי החיים הם טורפים; לכן, זיהוי רמזים לטורפים, כמו למשל רמזי ריח, הוא יתרון במיוחד למניעת טריפה. תגובות התנהגותיות לרמזים של טורפים נחקרו באופן נרחב במכרסמים.
לדוגמה, גירויים, כגון פרוות חתול טבעית או ריחות עור, מפעילים את מערכת הריח והוומרונזאלית, וגורמים לרמות גבוהות של התנהגויות הגנתיות4. גירויים אלה מלווים בשינויים בפעילות העצבית והאנדוקרינית 5,6,7,8, והם גירויים חזקים, בלתי מותנים ומרתיעים להתניה הקשרית של איום בחולדות 7,8,9,10,11. מחקרים הראו שלפחות 24 שעות לאחר החשיפה לרמזים טבעיים של טורפים, חולדות מציגות מצבים דמויי חרדה מותנים חזקים ומתמשכים 7,12,13. תופעה זו מעניינת במיוחד לפיתוח מודלים מציאותיים יותר של הפרעת דחק פוסט-טראומטית (PTSD)14,15,16,17, הפרעת חרדה כללית (GAD)5 והפרעת פאניקה (PD)18,19.
בתנאי מעבדה, התנהגות פחד נמדדת כבריחה, הימנעות (למשל, נסיגה, הסתתרות) או קיפאון. בנוסף, ניתן למדוד חרדה כתנוחות מתיחה וסריקה ערנית המכוונת לניטור גירוי טורף - קבוצה של תגובות הידועות בשם התנהגויות הערכת סיכון 6,9,20. מחקרים הראו שהתנהגות הקפאה היא אסטרטגיית ההגנה העיקרית בחולדות לאיום בלתי נמנע, בעוד שהערכת סיכונים נצפית כאשר האיום מעורפל או לא מקומי 12,21,32. למרות שידוע שגירוי מולד או נלמד יכול לעורר התנהגויות הגנתיות, חסרות פרדיגמות התנהגותיות מעבדתיות הלוכדות באופן אמין תגובות הגנתיות בהקשר אתולוגי יותר. כדי למלא את הפער הזה, עיצבנו פרוטוקול עם גישה אתולוגית המאפשרת מדידה של התנהגויות איום מולדות והקשריות מתמשכות יחד עם תגובות מוח לגירויי איום טבעיים.
חוויות מלחיצות, כגון חשיפה לריח טורף בלתי נמנע, גורמות לשינויים מתמשכים בתגובה ההתנהגותית והפיזיולוגית בחולדות 14,22,23. שינויים אלה משקפים את פרופיל הסימפטומים שנצפה בהפרעות הקשורות לפחד וחרדה כגון PTSD. במודל הנוכחי, נעשה שימוש בתא בדיקה ללא אזור מסתור בטוח כדי לחשוף חולדות לאירוע איום בלתי נמנע ובכך לשפר את תגובות ההגנה. חולדות הפגינו התנהגויות חזקות של הקפאה והערכת סיכונים בתגובה הן לריח החתול והן להקשר הבדיקה. ממצאים אלה תומכים בשימוש בפרוטוקול זה כשיטה אמינה ותקפה לחקר מנגנונים ביולוגיים העומדים בבסיס התנהגויות הגנתיות ולפיתוח ושכלול אסטרטגיות חדשות לטיפול בהפרעות פחד בבני אדם.
Protocol
ההליך הבא נערך על פי המלצות ההנחיות המוסדיות של המכונים הלאומיים לבריאות (ארה"ב) מדריך לטיפול ושימוש בחיות מעבדה (פרסום NIH מס' 80-23, מתוקן 1996). הוועדה המוסדית לבטיחות ביולוגית ואתיקה באוניברסיטה הקתולית של צ'ילה אישרה את כל ההליכים. כל מפגשי הניסוי נערכו במהלך השלב הפעיל של החולדה (השלב האפל).
1. הכנת חדר הבדיקות ותא הבדיקה
הערה: הסקירה הכללית של המנגנון מוצגת באיור 1. תא הבדיקה פותח והותאם על פי מחקרים קודמים24,25.
- השתמש בתא בדיקה מלבני שקוף מפולי (מתיל מתאקרילט) במידות הבאות: 60 ס"מ (אורך) x 40 ס"מ (רוחב) x 40 ס"מ (גובה). כסו את הקירות הצדדיים והאחוריים של תא הבדיקה בכל נייר שחור. ודא שהחלק הקדמי של תא הבדיקה שקוף כדי לתעד את התנהגויות בעלי החיים.
- קבע תושבת פלדה לרצפה בפינה הימנית התחתונה של תא הבדיקה, והשתמש בה כדי לחבר את צווארוני החתול להליכי הבדיקה.
- נקו את תא הבדיקה עם אתנול של 5% (v/v) לפני ואחרי הבדיקות כדי להסיר כל רמזי ריח שהשאירו החולדות הנבדקות ולהימנע מתגובת הסלידה של החולדה. אפשר 5 דקות בין כל מפגש עד שהאתנול יתאדה במלואו.
- בצע את מפגש הבדיקה בחדר שקט מואר במעומעם על ידי נורה אדומה של 80 וואט הממוקמת 20 ס"מ מעל תא הבדיקה. השתמש במצלמת וידאו הממוקמת מול החדר כדי לתעד את התנהגות החיות.
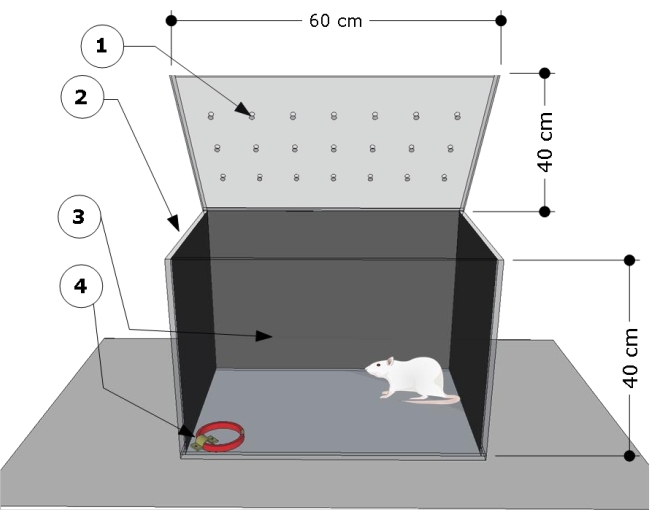
איור 1: סקירה סכמטית של תא הבדיקה. המכשיר מורכב מתא בדיקה עם: (1) חורי אוורור, (2) דפנות צדדיות ו-(3) אחוריות כהות, ותושבת פלדה נעולה ברצפה הפינה השמאלית (4) לחיבור צווארון החתול (מידות: רוחב 15 מ"מ, עובי 5 מ"מ, אורך 300 מ"מ). מידות החדר מצוינות בקריקטורה (60 L x 40 W x 40 H ס"מ). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. הכנת ריח חתול
- השג קולר חתול עם פנים פנימיות מרופדות לבד כדי ללכוד טוב יותר את ריח החתול. ודא את זמינותם של מספר קולרים לשימוש כקולר בקרה (ללא ריח) או צווארון בדיקה (ריח חתול).
הערה: הנקודה המכרעת היא שקולר החתול חייב להיות בעל בטנה פנימית לאיסוף ולכידת ריחות. - הניחו קולר על חתולה ביתית עם שחלות ואפשרו לחתול לענוד את הקולר במשך שבוע לפני הבדיקה. נסו להשאיר את החתולה בתוך הבית בזמן שאתם עונדים את קולר הבדיקה.
הערה: השתמשו באותו חתול לאורך כל המחקר. - שמור את צווארון החתול השחוק במיכל פלסטיק אטום ואחסן אותו בטמפרטורה של 4 מעלות צלזיוס. החלף את צווארון החתול השחוק בקולר המכיל ריח חתול טרי כל שלושה ימים.
3. הכנת חולדות להליך הניסוי
- השתמש בחולדות Sprague-Dawley זכרים בוגרים במשקל 270-290 גרם. שיכנו אותם בכלובים נפרדים עם צ'או ומים זמינים אד ליביטום.
- [אופציונלי] הכנת חולדות להליך כירורגי (לא חובה)
- בצע את הניתוח בתנאים סטריליים. יש לנקות ולחטא את אזור העבודה בתמיסה של 70% אתנול ולעקר את כל החומרים והמכשירים הכירורגיים.
- הרדמו את החולדה בתערובת תוך-צפקית של קטמין (100 מ"ג/ק"ג) וקסילזין (20 מ"ג/ק"ג). המתן עד להשגת מישור ההרדמה הנכון כאשר החולדה אינה מגיבה לגירוי צביטה בבוהן או לגירוי בקרנית. כדי לשמור על מצב ההרדמה לאורך כל הניתוח, יש לתת מנה נוספת של קוקטייל ההרדמה כל 45 דקות.
- יש לגלח בעדינות את ראש החולדה מאחורי האוזן אל בין העיניים, ולחטא את אזור הניתוח עם פד סטרילי להכנת אלכוהול ואחריו תמיסת פובידון-יוד. יש למרוח משחת עיניים סיכה כדי למנוע התייבשות בקרנית במהלך ההליך הכירורגי.
- הנח את החולדה במנגנון סטריאוטקסי, והחזק את הראש על ידי מיקום נכון של מוטות האוזניים בתעלות האוזן. לאחר מכן, הכנס בעדינות את החותכות של החולדה למוט החותך ואבטח את האף clamp.
- הנח צינורית מנחה סטרילית מנירוסטה 26 גרם במחזיק הסטריאוטקסי. קח אזמל ובצע חתך בקו האמצע לאורך הקרקפת. הנח 2 או יותר clamps סביב החתך (2-3 ס"מ).
- נקה את הגולגולת לחלוטין מרקמה עד שתפרי הגולגולת של ברגמה ולמבדה נראים לעין.
- ודא את המיקום הסימטרי של הראש על ידי יישור הציר האחורי והקדמי-אחורי של הגולגולת באמצעות מוטות החותך והאוזניים, בהתאמה. זהה את הקואורדינטות של צינורית ההנחיה לאזור המוח המעניין. שמור את הברגמה והלמבדה באותו מישור אופקי באמצעות מוט החותך.
- חשב את הקואורדינטות של אתר השתלת הצינורית המנחה לאזור העניין בעקבות הקואורדינטות הסטריאוטקסיות של פקסינוס ווטסון26 או אטלס סוונסון27.
הערה: עבור קליפת המוח האינטרוספטיבית הראשונית, נעשה שימוש בקואורדינטות הסטריאוטקסיות הבאות: ברגמה -0.51 מ"מ, קו אמצע 5.0 מ"מ, עומק משטח הגולגולת 4.5 מ"מ, זווית של 10° מדיאלית מאנכי. - בדוק את קואורדינטות השתלת הצינורית המנחה על ידי הורדתה עד שהיא נוגעת בגולגולת, ולאחר מכן קדח חור דרך הגולגולת באתר המאומת. קדחו 3 חורים נוספים סביב אזור היעד כדי להכניס 3 ברגים לתוך הגולגולת.
- הכנס את הצינורית לאזור המוח המעניין והשתמש בברגים ובאקריליק דנטלי כדי לעגן את הצינורית לגולגולת. יוצקים אקריליק דנטלי על הגולגולת היבשה ומוודאים שהוא מכסה את הברגים כדי לקבע את הצינורית במקומה. הניחו לשיניים האקריליות להתקשות ולאחר מכן הסירו את הזרוע הסטריאוטקסית בזהירות, והשאירו את צינורית ההנחיה במקומה.
הערה: הליך זה משתק את הצינורית המושתלת ומאפשר לנסיינים לבצע מיקרו-הזרקות מרובות באזור העניין. - הכנס סגנון נירוסטה לתוך צינורית ההנחיה כדי למנוע חסימה וזיהום.
- בסיום הניתוח יש לתת מנה אחת של אנטיביוטיקה (אנרופלוקסצין 5%; 19 מ"ג/ק"ג i.p) ואנטי דלקתית (קטופן 0.2 מ"ג/ק"ג i.p). חזור על שלב זה במשך שלושה ימים רצופים לאחר הניתוח.
- אפשרו לחולדות להתאושש לחלוטין לפחות שבוע לפני תחילת הניסויים.
- החזיקו את החולדות במחזור אור/חושך הפוך של 12/12 שעות (אורות דולקים בשעה 19:00) במשך עשרה ימים לפחות לפני תחילת הניסויים (איור 2).
הערה: אם הנסיין צריך לבצע הליך כירורגי כלשהו, יהיה צורך לעשות זאת לפני היפוך מחזור האור הכהה. זה מאפשר הפחתת מתח לאחר הניתוח. - טפלו בכל החולדות במשך 20 דקות ביום למשך 2-3 ימים. קחו חולדה אחת בכל פעם, החזיקו את החיה בחוזקה בפלג גוף עליון (לא בזנב), ולטפו אותם במהלך תקופה זו. אם בעלי חיים מראים סימני לחץ, טפל בהם לתקופות ממושכות.
הערה: שלב זה הוא קריטי כדי למזער את לחץ הטיפול שעלול להשפיע על השלבים הבאים. - חשפו מראש את בעלי החיים לתא הבדיקה (תא ריח חתול עם קולר חתול שלא נלבש) למשך 30 דקות ביום במשך שלושה ימים לפני הניסויים כדי לאפשר לבעלי החיים להתאקלם בהקשר הבדיקה.
הערה: מומלץ שהנסיין לא ילבש בשמים או קרמים ריחניים. - לאחר הנחת החיה בתא, המתן כ-10-15 דקות, הכניס זרוע לתא הבדיקה והחלף את צווארון החתול בקולר חתול אחר עם אותן תכונות.
הערה: שלב זה הוא קריטי כדי לדמות, ככל האפשר, כל שלב בהליכים ההתנהגותיים כדי למזער לחץ, מה שעלול להשפיע על הביצועים ההתנהגותיים של החולדה ב-10 הדקות האחרונות של הבדיקה. - נקה את תא הבדיקה עם אתנול של 5% (v/v) בין הפגישות.

איור 2: ציר הזמן של תכנון הניסוי. החולדות נחשפו למחזור הפוך של אור כהה במשך 10 ימים ולאחר מכן הורגלו לתא הבדיקה המכיל קולר חתול ביקורת (לא שחוק) למשך 30 דקות בשלושת הימים האחרונים. ביום ה-0, החולדות נחשפו תחילה לתא בדיקה מוכר (CONTEXT) למשך 10 דקות ולאחר מכן נחשפו לקולר עם או בלי ריח חתול לתקופה נוספת של 10 דקות (TEST) באותו הקשר. ביום הראשון, חולדות שנחשפו לריח חתול (TEST) ביום 0 הוחזרו לאותו תא בדיקה למשך 10 דקות (CONTEXT) ונחשפו מחדש לריח חתול (RETEST) לתקופה נוספת של 10 דקות. נתון זה שונה מ-8. קיצור: R-כהה/בהיר = מחזור כהה-אור הפוך. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
4. נהלי בדיקת ריח חתול
- ביום 0 של פרוטוקול הניסוי, העריכו את תגובות האיום לריח החתול.
- במידת הצורך, יש לתת זריקות קליפת המוח לפני הבדיקות ההתנהגותיות לפי השיטה המתוארת להלן. אם אתה מבצע פרוטוקול התנהגותי בלבד, דלג על שלב זה והמשך לשלב 4.3.
- הכנס צינורית הזרקה סטרילית של 33 G המחוברת למזרק המילטון של 1 מיקרוליטר לתוך צינורית ההנחיה לאחר הסרת האוטם.
- מלאו את מזרק המילטון במי מלח סטריליים (חולדות ביקורת) או אגוניסט קולטן GABA-A, מוסימול (חולדות טיפול), והזריקו 0.5 מיקרוליטר לחצי כדור במשך 2 דקות. המתן 2 דקות כדי לאפשר דיפוזיה של התרופה, הסר לאט את צינורית ההזרקה והכנס מיד את החוסמים.
הערה: בצע שלב זה בחיה שקטה וערה והזריק את התרופות לאט כדי למזער את הריצוד של צינורית ההזרקה וכתוצאה מכך דיפוזיה לאזורי מוח סמוכים. - לאחר השלמת ההזרקה/חצי הכדור בקליפת המוח, המתן 30 דקות והמשך לשלב הבא.
- הניחו את בעלי החיים בתא הבדיקה למשך 20 דקות. במהלך 10 הדקות הראשונות, חשפו את החיות לקולר מוכר שלא נלבש. הציגו את הקולר הספוג בריח חתול (TEST) או קולר מוכר שלא נלבש (CONTEXT) ב-10 הדקות הבאות (איור 3).

איור 3: מפגש עם ריח חתול מגביר התנהגויות הגנה מולדות. (A, B) חולדות נחשפו תחילה לתא הבדיקה המוכר (CONTEXT) למשך 10 דקות, ולאחר מכן נחשפו לקולר עם ריח חתול (קבוצת ריח חתול, עיגולים שחורים) או ללא ריח חתול (קבוצה ללא ריח, עיגולים פתוחים) למשך תקופה נוספת של 10 דקות (TEST) באותו הקשר. העיגולים מראים את אחוז הזמן שהושקע בהקפאה (B) והערכת סיכונים (C) שמציגות חולדות נאיביות. הנתונים מבוטאים כאמצעים +SEM. *p < 0.05. נתון זה שונה מ-8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- הציבו מצלמת וידאו מול תא הבדיקה והקליטו את התנהגות החיה לצורך ניקוד התנהגותי מאוחר יותר על ידי נסיין עיוור לתנאי הניסוי.
- בתום מפגש ריח החתול, החזירו את בעלי החיים לכלובי הבית שלהם והחזירו אותם למתקן החי עד למפגש הבא.
- נקה את תא הבדיקה עם אתנול של 5% (v/v) בין הפגישות.
- עשרים וארבע שעות לאחר מפגש ריח החתול (יום 1), העריכו את התגובות ההגנתיות להקשר הבדיקה.
- במידת הצורך, חזור על שלב 4.2 לפני חשיפת ההקשר.
- החזירו את החולדות לאותו תא בדיקה עם הקולר המוכר שלא נלבש, וציינו התנהגויות הגנתיות כדי למדוד זיכרון איום הקשרי במשך 10 דקות (איור 4).
- הציבו מצלמת וידאו מול תא הבדיקה והקליטו את התנהגות החיה לצורך ניקוד התנהגותי מאוחר יותר על ידי נסיין עיוור לתנאי הניסוי.
- במהלך 10 הדקות הבאות, החליפו את הקולר המוכר שלא נלבש, חשפו מחדש את החיה לקולר עם ריח חתול ומדדו התנהגויות הגנתיות.
- לאחר החשיפה השנייה לריח החתול, החזירו את בעל החיים לכלוב הביתי שלו, ונקו את תא הבדיקה עם אתנול 5% (v/v). החזירו את החולדה למתקן החיות.
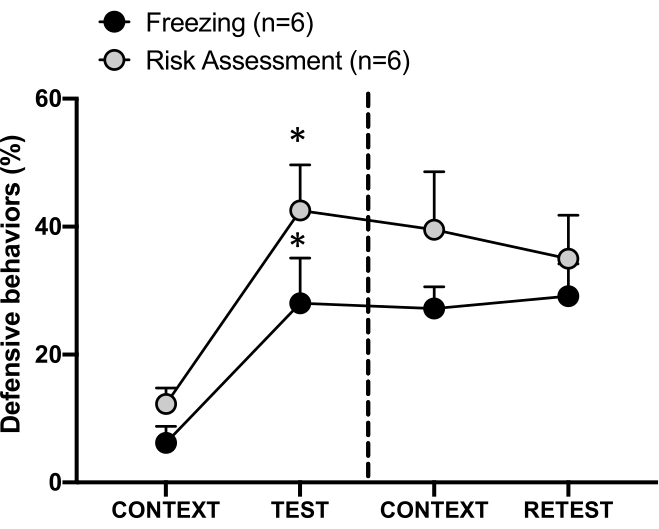
איור 4: מפגש עם ריח חתול גורם ללמידה הקשרית של איומים. העיגולים מראים את אחוז הזמן שהושקע בהקפאה (עיגולים שחורים) והתנהגות הערכת סיכון (עיגולים אפורים). הקו המקווקו מפריד בין מבחן הפחד המולד (יום 0, משמאל) לבין מבחן הפחד ההקשרי (יום 1, מימין). הנתונים מבוטאים כאמצעים + SEM. *p < 0.05. נתון זה שונה מ-8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
5. פרוצדורות אימונוהיסטוכימיות
- יש להרדים את בעל החיים בתערובת תוך-צפקית של קטמין (0.45 מ"ג/ק"ג) וקסילזין (0.05 מ"ג/ק"ג) 90 דקות לאחר השלמת הניסויים. לאחר מכן, המתת חסד של החולדה על ידי זלוף טרנס-קרדיאלי עם 4% פרפורמלדהיד.
הערה: אם יש צורך להעריך את החשיפה הראשונה לריח חתול, תגובה מותנית להקשר או חשיפה חוזרת לריח חתול, בצע שלב זה לאחר כל אחד ממצבי הניסוי הללו. ללבוש כפפות ומעיל מעבדה ולטפל בפרפורמלדהיד בזהירות מתחת למכסה אדים כימי. - לאחר הזלוף, קבעו את המוח באותה תמיסה מקבעת למשך שעתיים ואז העבירו אותו ל-30% סוכרוז עם 0.02% נתרן אזיד במי מלח עם פוספט (PBS) עד שהמוח שוקע לתחתית. יש לאחסן את המוח בטמפרטורה של 4 מעלות צלזיוס.
- הקפיאו את המוח באמצעות קרח יבש וחתכו אותו למקטעים עטרתיים סדרתיים בעובי 50 מיקרומטר על מיקרוטום הזזה. אסוף שלושה סטים של חלקי מוח של אזור העניין, והשאיר אחד לאימות מיקום הצינורית ושני סטים להליך האימונוהיסטוכימי.
- דגרו את חלקי המוח הצפים בחופשיות ב-0.3% H2O2 ב-PBS למשך 30 דקות, שטפו ב-PBS והעבירו את החלקים הללו לתמיסת החסימה (0.4% טריטון X-100, 0.02% נתרן אזיד, 3% סרום עיזים רגיל ב-PBS) למשך שעה.
- העבירו את החלקים לתמיסת הדגירה העיקרית של הנוגדנים המכילה נוגדן c-Fos מדולל 1:20,000 בתמיסת חסימה והשאירו אותם למשך הלילה בטמפרטורת החדר.
- שטפו את החלקים ב-PBS למשך שעה אחת ולאחר מכן דגרו אותם בתמיסת נוגדנים משנית מדוללת 1:1,000 ב-0.4% Triton X-100 ו-1.5% סרום עיזים רגיל ב-PBS.
- שטפו את החלקים במשך 40 דקות ודגרו אותם למשך שעה אחת במערכת פרוקסידאז מבוססת אבידין/ביוטין (ראה טבלת החומרים), מדוללת 1:500 ב-PBS.
- שוטפים ודוגרים את החלקים בתמיסה של 0.05% של 3-3′ diaminobenzidine hydrochloride (DAB) המכילה 0.003% H2O2 ו-0.05% ניקל כלוריד לקבלת תוצר תגובה כחול כהה.
6. ספירת תאים
- בחנו קטעים תחת מצלמה lucida באמצעות מטרה בהספק נמוך (פי 10) כדי למקם את הצביעה הפיסקטיפורמית c-Fos בגרעיני הנוירונים (איור 5).
- השתמש ברשת ספירה הקשורה לגודל אזור העניין. עבור ה-pIC, למשל, מ-Bregma 0.95 עד -0.26, השתמש ברשת ספירה של 0.25 מ"מ x 1 מ"מ; מברגמה -0.51 עד -2.45 מ"מ, השתמש ברשת ספירה של 0.5 מ"מ x 1 מ"מ.
- כמת את מספר תאי c-Fos immunoreactive (Fos-ir) לכל קטע באמצעות מונה ידני ספרתי.
- ספרו פעמיים את כל חלקי העטרה המעניינים וודאו שאותו צופה, עיוור לתנאי הניסוי, מבצע את הספירה.
- צלם תמונה באמצעות מיקרוסקופ בשילוב עם מצלמה דיגיטלית.

איור 5: ריח חתול מעורר הפעלה עצבית בקליפת המוח האינטרוספטיבית הראשונית. (A) פוטומיקרוגרף מייצג של ה-pIC שמראה היעדר כמעט מוחלט של תאי c-Fos-ir (ראשי חץ שחורים) בחולדות שנחשפו לקולר חתול לא שחוק (ללא ריח, משמאל) בהשוואה למספר מוגבר להפליא של תאי c-Fos-ir בחולדות שנחשפו לריח חתול (מימין). (B) כימות של תאי c-Fos-ir ב-pIC בשני תנאי הניסוי. הנתונים מבוטאים כאמצעים + SEM. *p < 0.05. פסי קנה מידה = 200 מיקרומטר. נתון זה שונה מ-8. קיצורים: pIC = קליפת המוח האינטרוספטיבית הראשונית; c-fos-ir = c-Fos-immunoreactive. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
7. ניתוח נתונים
- ציון התנהגויות הגנתיות מהניסויים שהוקלטו בווידיאו ונתח אותן באמצעות תוכנה סטטיסטית.
- העריכו את ההקפאה לפי התקפי תזמון, המתבטאים כאחוז מהזמן שהושקע בהקפאה במהלך 10 דקות. חשב את אחוז ההקפאה באמצעות Eq (1).
הקפאה = (שניות בהקפאה/600 שניות) × 100 (1)
הערה: הקפאה הוגדרה כחוסר תנועה מוחלט למעט נשימה למשך 1 שניות28 לפחות. - ציין הערכת סיכונים על ידי תזמון סריקות ערניות והביע אותה כאחוז מהזמן המושקע בהערכת סיכונים במהלך 10 דקות. חשב את אחוז הערכת הסיכון באמצעות Eq (2).
% הערכת סיכונים = (שניות שהושקעו בהערכת סיכונים/600 שניות) × 100 (2)
הערה: התנהגות הערכת סיכונים הוגדרה כסריקה ערנית (תצפית, תנועות ראש מצד לצד, ללא קטר) למשך 1 שניות29 לפחות. - ציין את הפרמטרים ההתנהגותיים הללו באופן ידני וודא שהם נספרים על ידי נסיין עיוור לתנאי הניסוי (כלומר, ריח ותנאי תרופות). בהתאם לנורמליות של מערכי הנתונים, השתמש במבחנים פרמטריים או לא פרמטריים להשוואה בין שתי קבוצות או יותר.
הערה: במחקר זה, כל הבדיקות הסטטיסטיות בוצעו באמצעות תוכנת SPSS.- השתמש במבחן Kruskal-Wallis H עם מבחן Mann-Whitney U להשוואה זוגית בין קבוצות.
- נתח השוואות תוך-קבוצתיות לאורך זמן עם מבחן פרידמן ואחריו מבחן הדירוג החתום של Wilcoxon להשוואות זוגיות.
הערה: בכל האיורים, רמות המובהקות נקבעו ל-p < 0.05 (*) ו-p < 0.01 (**).
- לניתוח ביטוי c-Fos באזורים ספציפיים במוח, ספרו את מספר התאים החיוביים ל-c-Fos בכל קטע על ידי חישוב הצפיפות של תאי c-Fos-ir למ"מ2, והשוו את המספר הממוצע בין תנאי בקרה (ללא ריח) למצבים מגורים (ריח חתול).
- בהתאם לנורמליות הנתונים, השתמש במבחן t של סטודנט לא מזווג או במבחן U של מאן-וויטני.
הערה: במחקר זה נעשה שימוש במבחן Mann-Whitney U; ההבדלים נחשבו משמעותיים אם P < 0.05 (*).
- בהתאם לנורמליות הנתונים, השתמש במבחן t של סטודנט לא מזווג או במבחן U של מאן-וויטני.
תוצאות
בפרוטוקול זה, אחוזי ההקפאה והערכת הסיכון נמדדו כאינדיקטורים למצבים דמויי פחד וחרדה בחולדות, בהתאמה. ציר הזמן של תכנון הניסוי מוצג באיור 2. התוצאות של החיות שנחשפו לריח חתול ביום 0 מוצגות באיור 3. חולדות הראו רמות גבוהות יותר באופן משמעותי של הקפאה (איור 2A, קבוצת ריח חתול, מבחן Wilcoxon Signed-ranks, Z = -2.201, p = 0.028) והערכת סיכון (איור 2B, קבוצת ריח חתול, מבחן Wilcoxon Signed-ranks Z = -2.336 p = 0.018) בתגובה לריח חתול (TEST) מאשר להקשר מוכר (CONTEXT). רמות נמוכות של הקפאה (איור 2A, קבוצה ללא ריח, מבחן Wilcoxon Signed-ranks, Z = -0.184, p = 0.854) והערכת סיכון (איור 2B, קבוצה ללא ריח, מבחן Wilcoxon Signed-ranks, Z = -1.753, p = 0.08) נצפו בחולדות שנחשפו לקולר לא שחוק במהלך החלק השני של הבדיקה.
ניתוח נוסף גילה שרמות ההקפאה (איור 2A, מבחן מאן-וויטני, U = 0.000, p = 0.004) והערכת הסיכון (איור 2B, מבחן מאן-וויטני, U = 4.000, p = 0.025) היו גבוהות יותר בקבוצת ריח החתול מאשר בקבוצת ללא ריח במהלך החלק השני של הבדיקה. לא היו הבדלים משמעותיים בהקפאה (איור 2A, מבחן מאן-וויטני, U = 11.000, p = 0.256) ובהערכת הסיכון (איור 2B, מבחן מאן-וויטני, U = 15.00, p = 0.627) בין שתי הקבוצות במהלך 10 הדקות הראשונות של החשיפה להקשר מוכר (CONTEXT). תוצאות אלה מוכיחות כי הפרוטוקול מתאים לבדיקת התנהגויות הגנתיות בתגובה לפרוות חתול/ריח עור.
תגובת האיום המותנית להקשר הבדיקה (CONTEXT) ביום הראשון מוצגת באיור 4. חולדות שנחשפו לריח חתול הוחזרו לתא הבדיקה 24 שעות לאחר מפגש הריח הראשון של הטורף. ביום הראשון, בעלי חיים הראו רמות הקפאה גבוהות יותר (מבחן Wilcoxon Signed-ranks, Z = -2.366, p = 0.018) והערכת סיכון (מבחן Wilcoxon Signed-ranks, Z = -2.201, p = 0.028) בתגובה להקשר הבדיקה מאשר ביום 0. בנוסף, לא היו הבדלים ברמות ההקפאה (מבחן Wilcoxon Signed-ranks, Z = -0.841, p = 0.400) או הערכת הסיכון (מבחן Wilcoxon Signed-ranks, Z = -0.943, p = 0.345) בין CONTEXT ל-RETEST. החולדות הראו את אותן רמות הקפאה (מבחן Wilcoxon Signed-ranks, Z = -0.105, p = 0.917) והערכת סיכון (מבחן Wilcoxon Signed-ranks, Z = -0.980, p = 0.327) במהלך RETEST ו-TEST. תוצאות אלה הראו כי חשיפה בודדת של 10 דקות לריח פרווה/עור של חתול הביאה לתגובת איום נלמדת להקשר שבו בעלי החיים התעמתו עם ריח טורף.
איור 5 ואיור 6 מציגים שתי קבוצות של ניסויים המשתמשים בפרוטוקול המוצג במאמר זה. בדקנו אם קליפת המוח האינטרוספטיבית הראשונית (pIC), אזור במוח שמעורב בעיבוד רגשות 8,30,31,32, הכרחית לביטוי התנהגויות הגנתיות. הפעלה עצבית הנגרמת על ידי ריח חתול הוערכה ב-pIC על ידי ספירת תאי c-Fos-ir בקבוצות בעלי חיים מופרדות: תנאי ריח וריח חתול. חולדות אלה הומתו 90 דקות לאחר השלמת הבדיקה. נצפתה עלייה משמעותית במספר תאי העצב c-Fos-ir ב-pIC בקבוצת ריח החתול (מבחן מאן-וויטני, U = 3.000, p = 0.016) בהשוואה לקבוצת הביקורת (איור 5).

איור 6: השבתת Muscimol של קליפת המוח האינטרוספטיבית הראשונית פוגעת בזיכרון האיום ההקשר. (א, ב) לקבוצת הטיפול הוזרקו מי מלח ביום 0 ו-muscimol ביום 1 ב-pIC (קבוצת הטיפול). חולדות ביקורת קיבלו הזרקת מי מלח ב-pIC בשני הימים. ביום הראשון, בעלי החיים הוחזרו לתא הבדיקה המוכר ונחשפו ל-CONTEXT למשך 10 דקות ונחשפו מחדש לריח חתול (RETEST) לתקופה נוספת של 10 דקות. העיגולים מראים את אחוז הזמן שהושקע בהקפאה (עיגולים שחורים) והתנהגות הערכת סיכונים (מעגלים פתוחים). הקו המקווקו מפריד בין מבחן הפחד המולד (יום 0, משמאל) לבין מבחן הפחד ההקשרי (יום 1, מימין). הנתונים מבוטאים כאמצעים + SEM. *p < 0.05. נתון זה שונה מ-8. קיצורים: pIC = קליפת המוח האינטרוספטיבית הראשונית; Sal-Sal = מי מלח מוזרקים ביום 0 וביום 1; סאל-מוס = מי מלח מוזרקים ביום 0 ומוסימול ביום 1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
מדדנו גם את ההשפעה של השבתת ה-pIC על זיכרון האיום ההקשרי (איור 6). קבוצת הטיפול (חולדות סל-מוס) קיבלה זריקת מי מלח ב-pIC ביום 0 ו-GABA-A אגוניסט מוסימול ביום הראשון. קבוצת חיות זו לא הראתה הבדלים כלשהם בהקפאה (איור 6A, מבחן Wilcoxon Signed-ranks, Z = -0.140, p = 0.889) או הערכת סיכון (איור 6B, מבחן Wilcoxon Signed-ranks, Z = -0.700, p = 0.484) ביום הראשון בתגובה להקשר המוכר בהשוואה ליום 0, מה שמצביע על ליקוי בזיכרון האיום ההקשר. מעניין שהקפאה (איור 6A, מבחן Wilcoxon Signed-ranks, Z = -2.100, p = 0.036), אך לא הערכת סיכון (איור 6B, מבחן Wilcoxon Signed-ranks, Z = -0.980, p = 0.327), הופחתה משמעותית במהלך RETEST בהשוואה ל-TEST. ממצא אחרון זה מצביע על כך שהשתקת ה-pIC ביום הראשון פגעה באופן סלקטיבי בתגובת הפחד, אך לא החרדה, לריח הטורף. יחד, תוצאות אלה תומכות בכך שפרוטוקול הניסוי המתואר לעיל מתאים לחקר תגובות הגנתיות מולדות ונלמדות לאיומים טורפים.
Discussion
הפרוטוקול המתואר כאן מציע גישה חדשנית להערכת התנהגויות הגנתיות המעוררות על ידי גירויים מרתיעים מולדים ונלמדים. תא בדיקה ללא אזור מסתור בטוח (איור 1) וקולר ספוג בריח עור/פרווה מחתולת בית נקבה שעברה שחלות שימשו כדי לעורר מצב איום חזק ומתמשך בחולדות שעשוי להיות שימושי לחקירת מעגלים עצביים העומדים בבסיס תגובות הגנתיות אדפטיביות ולא מסתגלות.
ידוע היטב כי הצגת תגובות הגנה ספציפיות תלויה הן בתכונות של גירוי האיום והן במצב/סביבה בה נתקל בעל החיים21,33. הימנעות, הערכת סיכונים והקפאה הם חלק מרפרטואר עצום של תגובות הגנה של בעלי חיים שניתן לעורר על ידי גירויים מאיימים 9,19. עם זאת, בחירת תגובת ההגנה הדומיננטית תלויה בתנאי הסביבה כגון המרחק מהאיום33 או נוכחות של מקום בטוח בתוך תא הבדיקה 21,33. לדוגמה, כאשר חולדות מוצבות בזירה עם קופסת מסתור, בנוכחות ריח חתול, הן מציגות התנהגויות הגנתיות כגון תנוחות מתיחה/נוכחות, ראש מחוץ לקופסה והימנעות 6,24,25. לעומת זאת, התנהגות קפואה, סריקה ערנית ותנוחות מתיחה/נוכחות מעוררות חזק במצבים שבהם הבריחה אינה אפשרית, והמרחק לאיום אינו קצר מדי33,34.
מחקרים הראו כי חשיפה לגורם לחץ בלתי נשלט מייצרת מגוון השלכות התנהגותיות שונות מאלו המתרחשות כאשר גורם הלחץ ניתן לשליטה 35,36,37,38. לדוגמה, הלם זנב בלתי נמנע, אך לא ניתן להימנע, מוביל לעלייה גדולה בסרוטונין בגרעין הראפ הגבי35 ולהתנהגויות דמויות חרדה שנמדדו 24 שעות לאחר החוויה המרתיעה36. יתר על כן, גורמי לחץ בלתי נשלטים מגבירים את התניה של פחד אצל בעלי חיים36,37 ובני אדם38. הרציונל הראשוני שלנו לפיתוח הפרוטוקול היה לחשוף חולדות למצב שבו הן אינן יכולות לשלוט בגירוי המרתיע, ולכן מציגות תגובות איום חזקות ומתמשכות ולפתח למידה הקשרית משופרת לאחר חשיפה בודדת וקצרה לריח חתול.
בתכנון הניסוי המתואר כאן, היעדר קופסת מסתור עורר מצב הגנתי חזק ומתמשך שנע לסירוגין בין התנהגויות קפיאה (כלומר, חוסר תנועה מוחלט למעט נשימה28) לבין הערכת סיכונים (כלומר, סריקה ערנית ותנוחות מתיחה/נוכחות29), הנחשבות בדרך כלל כביטויים התנהגותיים של פחד ומצבים דמויי חרדה במכרסמים, בהתאמה (איור 3). יש לציין כי אותו דפוס של תגובות הגנתיות התרחש 24 שעות לאחר מכן כאשר החולדות נחשפו מחדש להקשר הבדיקה, מה שמצביע על כך שחשיפה בודדת של 10 דקות לפרוות חתול/ריח עור מספיקה כדי לגרום ללמידה הקשרית ארוכת טווח של איומים, כפי שדווח בעבר 7,10,11,14,15,34,39 (איור 4).
קולר חתול עם בטנת לבד פנימית שימש לאיסוף ולכידת ריחות/ריחות ביעילות וכך להשיג דגימה אמינה של גירוי האיום כדי לעורר תגובה הגנתית חזקה. חוקרים השתמשו בגירויים מרתיעים כמו צואת חתולים, שתן או טרימתילתיאזולין (TMT, מרכיב בצואת שועלים) בעבודה דומה. אף על פי כן, נראה כי גירויים אלה פחות מנבאים את נוכחותו המיידית של טורף מכיוון שהם פחות מסוגלים לעורר למידה הקשרית40,41. על פי ממצאים קודמים 2,4,8,9,10,11,20,34,39, ריח חתול הוא גירוי מרתיע מולד אמין שיכול לגרום לתגובות הגנתיות מתמשכות וזיכרון איום קונטקסטואלי בחולדות. במהלך השנים, סוג זה של מודל התנהגותי אתולוגי של בעלי חיים תפס יותר ויותר את העניין של חוקרים לחקור הפרעות מתחומתח 13,14,15,16,17,23,42 כמו אלה הקשורים לזיכרונות פחד לא מסתגלים כמו PTSD.
פרוטוקול זה נועד לשמש בשילוב עם מגוון טכניקות ניסיוניות, כולל, למשל, גישות ביולוגיה מולקולרית ותאית ואלקטרופיזיולוגיה בבעלי חיים ערים ומתנהגים, המציעות הזדמנות לענות על שאלות פתוחות ולשפר את ההבנה שלנו לגבי תגובות איום אדפטיביות ולא מסתגלות. במחקר הזה בדקנו את הרעיון שה-pIC, אזור במוח שמעורב בעיבוד רגשות, הכרחי לביטוי התנהגויות הגנתיות. ניסויים התנהגותיים שולבו עם אימונוהיסטוכימיה c-Fos כדי למפות דפוסים של פעילות עצבית ב-pIC בתגובה לריח חתול ועירויים תוך מוחיים של אגוניסט הקולטן GABA-A, muscimol, כדי להשתיק באופן הפיך את ה-pIC ולקבוע את מעורבותו בתגובות איום מולדות ונלמדות לריח טורף. הממצאים האלה חשפו שריח חתול עורר עלייה בפעילות העצבית ב-pIC (איור 5), ושהשתקת ה-pIC הובילה למחסור חמור בזיכרון האיום ההקשרי (איור 6).
למרות שהפרוטוקול המתואר כאן פשוט מבחינה טכנית ליישום ולביצוע, עלולים להיווצר כמה סיבוכים. לדוגמה, זיהום צולב של ריח חתול עלול להתרחש אם הצווארון הלא נלבש בא במגע עם צווארון החתול השחוק. לפיכך, יש לשמור את הצווארונים בנפרד במהלך כל ההליכים, ולהחליף כפפות לאחר הצבת הצווארון השחוק בתא הבדיקה. אם הנסיין רוצה לבצע תנאי ריח וללא ריח באמצעות אותו תא בדיקה, יש לבצע את הניסויים בימים שונים. שני תאי בדיקה זהים יכולים לשמש לניסויים אלה34, ויש להחזיק את החולדות בחדרים נפרדים כדי להימנע מתקשורת חברתית43. הלחץ שנוצר מחשיפה לגירויים חדשים בסביבות לא מוכרות עשוי גם הוא להוות בעיה. לפיכך, על בעלי החיים להיות בעלי חיים לפחות שלושה ימים של התרגלות לסביבת הבדיקה ולנהלים כדי להפחית את הלחץ וההתגוננות המופגנים בדרך כלל על ידי חולדות במצבים חדשים. בנוסף, הזמן הנדרש לתקופת ההתרגלות צריך להיות ארוך יותר מתקופת הבדיקה. לדוגמה, אם המבחן נמשך 10 דקות, יש להקצות 20 או 30 דקות לתקופת ההתרגלות.
לבסוף, רצוי להעריך התנהגויות הגנתיות במהלך השלב החשוך של המחזור, כאשר החולדות פעילות. יש לשמור על החולדות תחת מחזור אור/חושך הפוך כדי לאפשר את ביצוע הליכי הניסוי בזמן שגם החולדה וגם הנסיין נמצאים בשלבים הפעילים שלהם34. השינוי במחזור האור/חושך לוקח לא יותר מ-10 ימים להתיישב, ובהתבסס על ניסיון, רוב החולדות במצב זה מגיבות כראוי לריח החתול. עם זאת, ישנם כמה מחקרים המראים כי חולדות Sprague-Dawley פחות פגיעות להתניה וחרדה ארוכת טווח מאשר חולדות Wistar44. לפיכך, ייתכן שהשימוש בחולדות Wistar במקום בחולדות מזן Sprague-Dawley יכול להניב תוצאות חזקות יותר.
לסיכום, ריח חתול הוא גירוי מאיים רלוונטי מבחינה אתולוגית המעורר תגובות עצביות, אנדוקריניות והתנהגותיות אמינות בחולדות. המפגש עם ריח חתול בתא בלתי נמנע מוביל לתגובת פחד/חרדה חזקה וממושכת בחולדות, מה שמביא ללמידה מהירה ומתמשכת של איומים קונטקסטואליים. הפרוטוקול המתואר לעיל יכול להיות כלי שימושי לחקר מנגנוני קידוד זיכרון פחד ואיומים אדפטיביים ולא מסתגלים.
Disclosures
למחברי כתב היד הזה אין אינטרסים פיננסיים מתחרים או ניגודי אינטרסים אחרים לחשוף.
Acknowledgements
המחברים מודים למרסלה גונזלס על עזרתה בהליכי מעבדה, למייבל מטמאלה על תרומתה לעיצוב הפרוטוקול, ולמיגל רוחאס על עזרתו באיור.
Materials
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
References
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682(2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283(2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. , Elsevier Academic Press. Amsterdam. 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, Chapter 9, Unit 9 45(2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16(2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , Chapter 8, Unit 8.19 (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91(2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , Academic Press. San Diego. (1997).
- Swanson, L. W. Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , Elsevier. (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377(1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292(2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132(2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041(2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved