Method Article
単核RNAシーケンシングのための成体マウス腎臓からの核分離
* これらの著者は同等に貢献しました
要約
ここでは、髄質腎細胞タイプの表現を改善し、酵素組織解離による遺伝子発現アーティファクトを回避する凍結マウス腎臓から高品質の核を単離するためのプロトコルを提示します。
要約
腎臓は、水、電解質、酸塩基恒常性などの多様な生物学的プロセスを調節します。腎臓の生理学的機能は、臓器の皮質鞍軸を横切る複雑な構造に配置された複数の細胞型によって実行されます。近年のシングルセルトランスクリプトミクスの進歩により、腎生理学や疾患における細胞種特異的な遺伝子発現の理解が加速しています。しかし、シングルセルRNAシーケンシング(scRNA-seq)に頻繁に利用される酵素ベースの組織解離プロトコルは、ほとんどが新鮮な(アーカイブされていない)組織を必要とし、転写ストレス応答を導入し、腎臓皮質の豊富な細胞型の選択を支持し、髄質の細胞の過小評価をもたらします。
ここでは、これらの問題を回避するプロトコルを紹介します。このプロトコルは、凍結腎臓組織からの4°Cでの核分離に基づいています。核は、皮質、外側髄質、および内側髄質で構成されるマウス腎臓の中央部分から単離されます。これにより、髄質細胞の利益のために、全腎臓サンプルに典型的な皮質細胞の過剰表現が減少し、データが皮質小脳鞍軸全体を十分な存在量で表すようになります。このプロトコルは、シンプルで迅速、かつ適応性があり、腎臓研究における単一核トランスクリプトミクスの標準化に向けた一歩を踏み出します。
概要
腎臓は非常に複雑な組織構造を示します。それらは、皮質膠底軸に沿った機能的および解剖学的に異なるセグメントで構成され、細胞外液量の調節、電解質バランス、または酸塩基恒常性などの生物学的機能を媒介します1。
シングルセルトランスクリプトミクスの進歩により、複雑な組織の詳細な特性評価が可能になり、腎生理学、発生、および疾患におけるセグメントおよび細胞種特異的遺伝子発現の理解が加速しました2,3,4。
しかしながら、scRNA-seqに頻繁に利用される酵素ベースの解離プロトコルは、いくつかの欠点および制約を示す。プロトコルに応じて、それらは転写ストレス応答と組織解離バイアスを生成し、解離しやすい皮質細胞型に向かっています5,6。胚性腎臓に低温活性プロテアーゼを使用するプロトコルは、ストレス関連の転写変化を軽減することができますが、皮質細胞に対する解離バイアスを克服することができず、さまざまな種類の病気の腎臓組織に容易に適応できない可能性があります7。さらに、シングルセルアプローチは凍結組織サンプルと容易に互換性がなく、その用途は主にアーカイブされていない新鮮な組織に限定されるため、組織収集は制限因子6になります。
単一核RNAシーケンシング(snRNA-seq)は、これらの制限を回避することができます8,9。ここでは、凍結した成体マウス腎臓組織の中央スライスからの核単離のためのプロトコルを提示します(図1)10。私たちのプロトコルはシンプルで、強い局所組織変化を伴わない実験モデルのために、多様な腎細胞タイプのバランスの取れた表現を備えたRNAシーケンシングライブラリを取得するための標準化されたアプローチを提供します。後者の場合、私たちのプロトコルは腎臓全体でも実行できます。
プロトコル
すべての動物実験は、動物福祉法(TierSchG)および動物福祉実験動物規則(TierSchVersV)に従って実施され、地方自治体および当施設の動物福祉担当者(MDC)によって承認されました。
1.ティッシュの準備
- 得られる腎臓ごとに、ウェルあたり2 mLの1xリン酸緩衝生理食塩水(PBS)を含む6ウェルプレートを準備します。ウェルおよび腎臓あたり2 mLのRNA安定化溶液を含む6ウェルプレートを調製します。両方のプレートを氷上で予冷します。
- 生後3〜6か月のオスのC57BL / 6マウスを安楽死させます。.マウスを解剖トレイに置き、四肢を固定し、70%エタノールで腹部を滅菌します。
- 鉗子とはさみを使用して腹部を胸郭まで開きます。腸や他の臓器を横に持ち上げ、尿管、腎動脈、静脈をハサミで慎重に切って腎臓を取り除きます。事前に準備した氷冷の1x PBSで腎臓を洗浄し、すべての白い組織が除去されるまで腎臓から腎筋膜と残りの脂肪を取り除きます(図2A)。
- 腎臓を冷たい解剖プレートの上に置き、鋭いメスまたはかみそりの刃を使用して、1〜2 mmの中央のスライスを取得します。組織片に皮質鞍軸全体が含まれていることを確認してください(図2B)。マイクロダイセクションハサミと鉗子を使用して、センターピースの側面から皮質を慎重にトリミングします。解剖された組織片内では、皮質、外側髄質、および内側髄質の3つのセグメントがはっきりと見えるはずです(図2C)。
注:効果的な組織溶解に十分なバッファー量を確保し、cDNAライブラリ内のアンビエントバックグラウンドRNAを最小限に抑えるために、スライスの厚さは2 mmまたは重量20 mgを超えてはなりません。アンビエントRNAは、単一の核に関連していないため、配列容量を浪費します。 - 腎臓片を事前に調製したRNA安定化溶液に移し、RNA分解を避けるために4°Cで24時間インキュベートします。24時間後、RNA安定化溶液を取り出し、さらに使用するまで組織を-80°Cで保存します。ティッシュペーパーで余分な溶液を慎重に取り除きます。
2. 原子核の分離
- クリーニングと準備の手順
- ベンチトップとピペットを70%エタノールとRNase除染溶液で洗浄します。
- 丸底の2 mLティッシュグラインダーチューブと、対応する乳棒AとBをRNase除染溶液で洗浄し、続いて70%エタノールとRNaseフリー水(サンプルごとに1つのグラインダーチューブと乳棒セット)を洗浄します。完全に乾かします。
- 遠心分離機を4°Cに予冷します。
- 3本の15 mL収集チューブ、1.5 mL収集チューブ、5 mL蛍光活性化細胞選別(FACS)収集チューブ、および氷上で各サンプルのドライグラインダーチューブにラベルを付けて予冷します。
- バッファー調製
- リボヌクレオシド-バナジル錯体ストック溶液を、製造元の指示に従って緑黒色透明溶液に再構成されるまで65°Cに温めます。11名
- 表1Aに記載のように4%ウシ血清アルブミン( BSA)を含有する1x PBSを調製する。さらに、0.04%BSAを含む1x PBSを調製します(表1B)。0.2 μmの界面活性剤を含まない酢酸セルロース(SFCA)メンブレンシリンジフィルターを使用して両方の溶液をろ過し、さらに使用するまで氷上に保管します。
- 核溶解バッファー1(NLB1、表1C)を調製する。核溶解バッファー2用のEZ溶解バッファー4 mL(NLB2、表1D)と核懸濁バッファー用の0.04 % BSA / PBS2 mLを15 mLチューブに追加します。 RNase阻害剤溶液は、以下のプロトコルに示すように、使用前にNLB2およびNSBに直接追加してください。さらに使用するまで氷上に保管してください。
- 10%スクロースを含むEZ溶解バッファーを調製します(スクロースグラジエントバッファー、 表1F)。よく混合し、0.2 μmのSFCAメンブレンシリンジフィルターを使用してバッファーを新しい15 mLチューブにろ過します。さらに使用するまで氷上に保管してください。
- 組織の均質化と細胞溶解
注:RNAの分解を最小限に抑えるために、すべてのステップは氷上で実行されます。グラインダーチューブ、ペトリ皿、およびすべてのバッファーは事前に冷却する必要があります。すべての再懸濁ステップは、核懸濁液を注意深くピペッティングすることによって行われます。せん断力や核の損傷を避けるために、サンプルをボルテックスしないでください。- 凍結した腎臓片を取り、NLB1 mLを含む氷上の60 mmポリスチレンペトリ皿に移します。
- かみそりの刃またはメスを使用して組織を完全に細かく刻みます(図3A)。
- 1 mLピペットチップの先端を切り取り、ミンチ組織とバッファーをグラインダーチューブに移します。必ずすべてのティッシュ片を移してください。必要に応じて、ペトリ皿をバッファーで5〜10回洗浄します。
- 乳棒Aをグラインダーチューブ内でゆっくりと上下に25倍動かして、氷上で懸濁液を均質化します。急速な動きによって引き起こされる気泡を避けてください(図3B)。
- ホモジネートを予冷した15 mLの収集チューブ内の100 μmストレーナーに通し、別の1 mLのNLB1でフィルターを洗浄します。
- グラインダーチューブを冷たいEZ核溶解バッファーで洗浄し、バッファーを廃棄します。
- ホモジネートをグラインダーチューブに戻し、乳棒Bをグラインダーチューブ内でゆっくりと上下に15倍動かして、氷上で懸濁液を均質化します。急速な動きによって引き起こされる気泡を避けてください(図3C)。
- ホモジネートを予冷した15 mL収集チューブに移します。グラインダーチューブを別の2 mLのNLB1で洗浄し、すべての組織片を収集チューブに移してください。ホモジネート(総容量4 mL)を氷上で5分間インキュベートし、細胞を溶解します。
- 核精製
- ホモジネートを40 μmのストレーナーに通し、予冷した15 mLの収集チューブに入れます。スイングバケットローターを備えた遠心分離機で、収集チューブを500 x g 、4°Cで5分間回転させます。それまでの間、RNase阻害剤溶液をNLB2に加える(表1D)。
- ペレットを乱すことなく上清を除去します。ペレットを4 mLのNLB2に注意深く再懸濁します。
- ショ糖グラジエントバッファーの1 mLクッションで懸濁液を慎重に下敷きにします。スイングバケットローターを備えた遠心分離機で、500 x g で4°Cで5分間遠心分離します。それまでの間、RNase阻害剤溶液をNSBに追加します(表1E)。
- 遠心分離後、遠心分離機から収集チューブをそっと取り外し、収集チューブを取り扱うときに2つの層を乱さないように注意してください。2つの層の間に細胞の破片が見えます。破片から始めて慎重に上澄みを取り除きます。核ペレットを乱すことなく残りの上清を取り除き、ペレットを1 mLのNSBに注意深く再懸濁します。
注:再懸濁量は、分離に使用される組織の量と、最後の遠心分離ステップ後に得られたペレットサイズによって異なります。体積は、予想される核の数に適合させる必要があるかもしれません。 - ホモジネートを20 μmストレーナーに通し、予冷した5 mL FACS収集チューブに入れます。
3. 核の選別
- NSB1 mLあたり20 μLの4′,6-ジアミジノ-2-フェニルインドール(DAPI)を最終濃度2 μMまでFACS収集チューブ内のホモジネートに加え、慎重に混合します。氷上で5分間インキュベートします。
- 予冷した1.5 mL収集チューブを20 μLの4%BSA / 1x PBSで調製し、0.5 μLのRNase阻害剤溶液を最終濃度1 U / μLまで加えます。 すぐにソートに進みます。
- セルソーターを使用して核を分類します。
- FACS収集チューブをソーターに挿入する前に、核懸濁液を短時間混合します。
- 前方散乱(FSC)と側方散乱(SSC)に基づいて最初のゲートP1を設定し、破片と凝集体を除外します(図4A)。
- 空または損傷した核とマルチプレットを除外するには、DAPI面積とDAPI高さ(DAPI-AとDAPI-H)に基づいて後続のゲートを設定します(図4B)。
- 3.2で調製した1 U/μL RNase阻害剤溶液を用いて、4% BSA /1x PBSを含む1.5 mL収集チューブに単一核を選別します。
4. 品質管理
- 蛍光顕微鏡または自動計数チャンバーで少なくとも2つの独立したカウントで最終核濃度を測定し、懸濁液の品質を評価します(図5)。
注:最適な濃度は700〜1,200核/ μLです。 700核/μLなどのより低い細胞濃度は、結果として得られるcDNAライブラリに含まれる周囲バックグラウンドRNA(個々の核に関連しない転写物)が少ないため、好ましい場合があります。 - 配列決定された単一核の所望の回収に必要な核懸濁液の量を計算する。核の凝集とRNAの分解を避けるために、すぐにライブラリ調製に進みます。
結果
プロトコルの性能を判断するために、ライブラリ調製に10x Genomics Chromiumシングルセル3'遺伝子発現キットv3.1を使用し、Seuratパッケージ12,13でsnRNA-seqデータを分析しました。
図6は、代表的なsnRNA-seqライブラリの結果を示す。核の質を評価するために、ミトコンドリアリードの割合で着色された転写物(一意の分子識別子(UMI)で定義)の数に対して遺伝子の数をプロットしました(図6A)。良質の核は一般に、より高いリード数を示し、UMIと遺伝子番号を相関させ、ミトコンドリアリード画分が低い。
その後の分析のために、500未満または4000を超えるカウントされた遺伝子、またはミトコンドリアRNAの5%を超える核を除外した(n=828)。最低3つの核で発現する遺伝子のみが含まれていました。残りの6,000個の核から合計約20,000個の遺伝子が検出され、核あたり1,600個の遺伝子の中央値と2,800個のUMIの中央値が検出されました(図6B)。
クラスタリングは、非常に多様な遺伝子に基づいていました。合計18個のクラスターを特定しました。細胞同一性は、既知のマーカー遺伝子(図示せず)に基づいてアノテーションした。1つの細胞タイプのサブクラスターを1つのクラスターにまとめ、足細胞、近位尿細管(PT)、細い四肢(tL)、太い上行肢(TAL)、遠位回旋細管(DCT)、接続尿細管(CNT)、収集管主細胞およびインターカレート細胞(CD-PC、A-IC、B-IC)、骨盤深部髄質上皮(DMEP)および内皮の合計11の異なる細胞タイプをもたらしました。クラスター富化マーカーの遺伝子発現パターンはドットプロット(図6C)で視覚化され、細胞型クラスターはt分布確率的隣接埋め込み(t-SNE)プロット(図6D)で視覚化されました。
サンプル中の細胞型分布を評価するために、各細胞型の割合を計算し(図6E)、PTとTALの比率を決定するために使用しました。PTは主に腎臓皮質に位置し、PTの細胞は解離しやすく、腎臓全体のサンプルに非常に豊富に含まれているため、腎臓の単一細胞データセットで頻繁に過剰に表現されています。一方、TALは外側延髄14全体に広がっています。したがって、PT画分とTAL画分の比率は、腎臓単一細胞データセットにおける髄質細胞タイプの濃縮のための良い尺度を表しています。一般に、単一細胞全腎臓データセットのPT/TAL比は、8(低温プロテアーゼ処理された腎臓組織全体からの未発表データ)から酵素的に解離した組織の45までの範囲でした10、14、15。ここに提示されたsnRNA-seqデータセットでは、PT/TAL比2に達することができました。この結果は、snRNA-seqと組み合わせた組織解離中の過剰な皮質の除去が、腎細胞タイプの表現を著しく改善する結果をもたらすことを示しています。
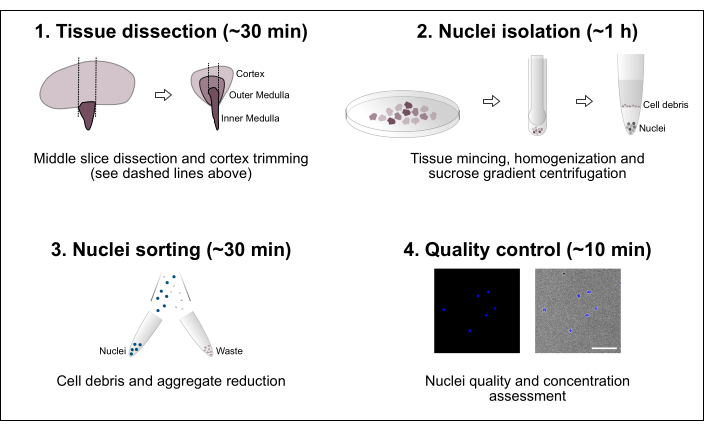
図1:ワークフローの概略図。 このプロトコルは、組織解剖、核の分離、核の選別、最終的な純度と濃度の評価を含む4つの主要なステップで構成されています。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
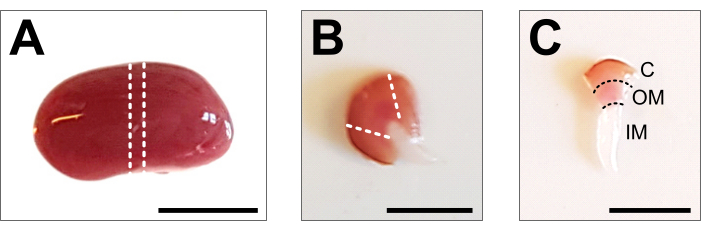
図2:腎臓の解離と組織の準備 。 (A)解剖した腎臓全体の代表画像。点線は、すべての腎細胞型を表す1〜2 mmの中央スライスを取得するために必要なカットを示しています。(B)得られた中間スライスの代表画像。点線は、側面からの皮質トリミングのカットを示しています。(C)皮質をトリミングした中枢腎臓片の代表的な画像。皮質(C)、外側髄質(OM)、内側髄質(IM)がはっきりと見えます。スケールバー= 500μm。 この図の拡大版を表示するには、ここをクリックしてください。
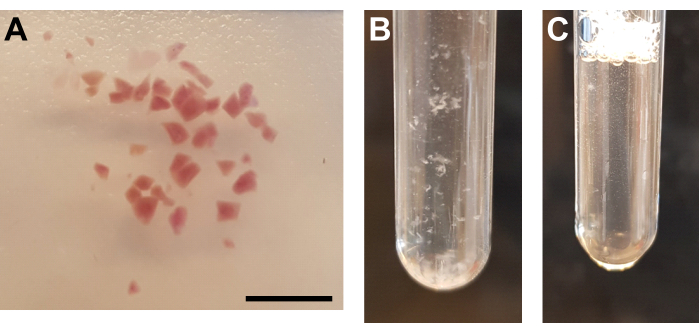
図3:組織の均質化と核精製 。 (a)十分に細切された腎臓組織を示す代表的な画像。スケールバー= 500μm。 (B)最初の均質化工程後のホモジネート(乳棒A、2mLグラインダーチューブで25ストローク)。(c)第2のホモジナイズ工程後のホモジネート(乳棒B、2mLグラインダーチューブで15ストローク)。 この図の拡大版を表示するには、ここをクリックしてください。

図4:核選別のためのゲーティング戦略。(A )デブリや凝集体を排除するために、前方散乱(FSC)対側方散乱(SSC)に基づいて最初のゲートP1を設定しました。(B)DAPI面積(DAPI-A)とDAPI-高さ(DAPI-H ) に基づく後続のゲートは、空または損傷した核と多重項を除外しました。 この図の拡大版を表示するには、ここをクリックしてください。
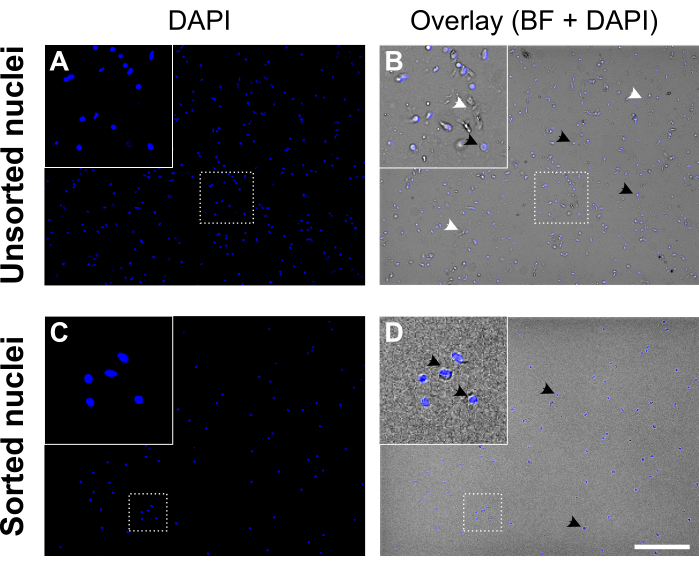
図5:核選別前後の核懸濁液。 (A、 C)DAPI染色された核(青色)。(B, D)DAPIと明視野(BF)チャネルのオーバーレイ。選別前(上のパネル)には、核懸濁液には細胞の破片と凝集体が含まれています(白い矢印でラベル付けされています)。選別後(下のパネル)、核懸濁液ははるかにきれいに見えます。DAPI染色された核の例は、黒い矢印で標識されています。良質の核は無傷の膜で丸く滑らかに見え、よく分離されていますが、質の悪い核はしわが寄って核膜の喪失を示します。スケールバー = 250 μm。 この図の拡大版を表示するには、ここをクリックしてください。
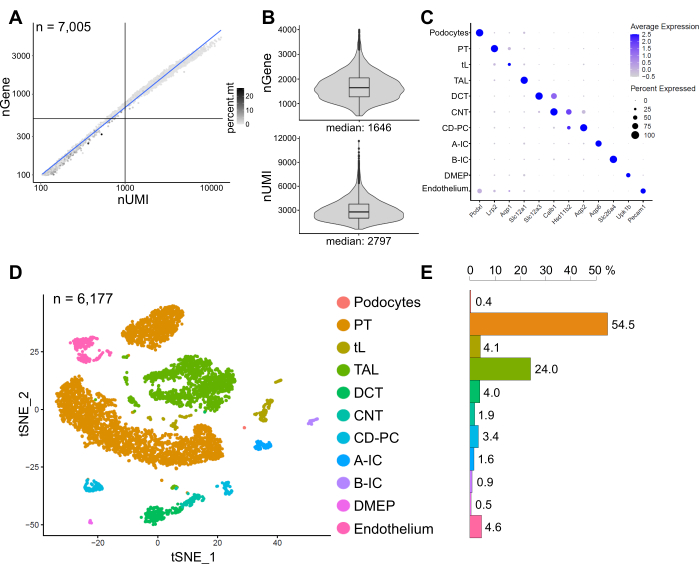
図6:代表的なsnRNA-seqデータセットの品質管理と解析。 (A)ミトコンドリアリードの割合によって着色された一意の分子識別子(nUMI)の数に対してプロットされた遺伝子の数(nGene)(percent.mt)。低品質の核はプロットの左下の象限(n = 828)に対応し、その後の分析から除外した。(B)snRNA-seqデータセットの核あたりに検出されたnGeneとnUMIの分布と中央値、6,177核(>500遺伝子)。ライブラリは、核あたり~8,200のマッピングされたリードの中央値の深さまで配列決定されました。(C)個々の細胞型(y軸)のクラスター富化マーカーの遺伝子発現パターンを示すドットプロット(x軸)。ドットのサイズは、示された遺伝子を発現する細胞の割合に対応する。色は平均表現に対応しています。(D)同定された細胞型のT分布確率的近傍埋め込み(t-SNE)プロット。(E)snRNA-seqデータセットにおける細胞型分布。PT、近位尿細管;tL、細い手足。TAL、太い上行肢、DCT、遠位回旋細管;CNT、尿細管を接続する;CD-PC、管主要細胞を収集する;A-IC、タイプAインターカレートセル;B-IC、タイプBインターカレートセル;DMEP、骨盤の深部髄質上皮。 この図の拡大版を表示するには、ここをクリックしてください。
| 試薬 | 最終濃度 | 容量(mL) | ||
| (A) 4 % BSA / PBS | ||||
| リン酸緩衝生理食塩水(PBS)、10%ウシアルブミン | 4% | 2 | ||
| PBS(リン酸緩衝生理食塩水)1X(カルシウムまたはマグネシウムなし) | - | 3 | ||
| (B) 0.04 % BSA / PBS | ||||
| 4 % BSA / PBS | 0.04 % | 0.5 | ||
| PBS(リン酸緩衝生理食塩水)1X(カルシウムまたはマグネシウムなし) | - | 49.5 | ||
| (C)核溶解バッファー1(NLB1) | ||||
| 核EZ溶解バッファー | - | 4 | ||
| リボロックRNase阻害剤 (40 U/μL) | 1 U/μL | 0.1 | ||
| リボヌクレオシド-バナジル錯体(200 mM) | 10ミリメートル | 0.2 | ||
| (d)核溶解バッファー2(NLB2) | ||||
| 核EZ溶解バッファー | - | 4 | ||
| リボロックRNase阻害剤 (40 U/μL) | 1 U/μL | 0.1 | ||
| (E) 核懸濁バッファー(NSB) | ||||
| 0.04 % BSA / PBS | - | 2 | ||
| リボロックRNase阻害剤 (40 U/μL) | 1 U/μL | 0.05 | ||
| (F)スクロースグラジエントバッファー(10%スクロース) | ||||
| ショ糖の重量1 g | ||||
| 6 mlの核EZ溶解バッファーに溶解 | ||||
| 核EZ溶解バッファーで最大10 mLまで充填 | ||||
| 0.2 μmシリンジフィルターを通して新しいチューブにろ過します | ||||
表1:溶液レシピ: (A)4%BSA/1x PBSの調製。0.2 μmのSFCAメンブレンシリンジフィルターを使用してろ過し、使用するまで氷上に保ちます。(B)0.04%BSA / 1 x PBSの調製。0.2 μmのSFCAメンブレンシリンジフィルターを使用してろ過し、使用するまで氷上に保ちます。(c)核溶解バッファー1(NLB1)の調製。示された量はサンプルごとに提供されます。使用するまで氷の上に保管してください。(d)核溶解バッファー2(NLB2)の調製。示された量はサンプルごとに提供されます。プロトコルに記載されているように、使用直前にリボロックRNase阻害剤をNLB2に追加してください。.使用するまで氷の上に保管してください。(e)核懸濁緩衝液(NSB)の調製。示された量はサンプルごとに提供されます。プロトコルに記載されているように、使用直前にリボロックRNase阻害剤をNSBに追加します。使用するまで氷の上に保管してください。(f)スクロース勾配緩衝液の調製。0.2 μmのSFCAメンブレンシリンジフィルターを使用してろ過し、使用するまで氷上に保ちます。
ディスカッション
シングルセルトランスクリプトミクスは、腎生理学および疾患における細胞種特異的遺伝子発現の理解を促進します。ここでは、snRNA-seqのために凍結マウス腎臓組織から高品質の単一核を標準化された方法で単離するための簡単で再現性のある方法を提供しました。
snRNA-seqでは、ライブラリ生成の入力として高品質の核を使用し、組織処理中のRNA分解を回避することが重要です。したがって、解剖直後のRNA安定化溶液中での組織片のインキュベーションは、細胞RNAの保護と安定化に不可欠であり、サンプルを-80°Cで無期限に保存することができます。このプロトコルをアーカイブ材料などのRNA安定化溶液処理なしで凍結組織に適用する場合は、試運転が必要であり、RNA安定化溶液中で事前にインキュベートしないと、急速凍結組織でRNA完全性が著しく低下することが観察されたため、RNA品質を評価する必要があります。
一般に、適切なサンプル処理は、無傷の単一核の回収を最大化するために重要です。すべての再懸濁ステップは、せん断応力や物理的損傷を避けるために慎重にピペッティングして実行する必要があります。最終的な核の再懸濁および核の選別のためのバッファーには、核の損失と凝集を避けるためにBSAが含まれている必要があります。
このプロトコルのバッファー容量は、非常に小さな組織サンプル(~15 mg)用に最適化されています。高品質の懸濁液を生成するには、完全な細胞溶解と十分な洗浄を確保することが重要です。組織ブロックまたは腎臓全体のサンプルが大きいと、核濃度が過剰になり、凝集や凝集、周囲RNAの豊富さ、および全体的な懸濁液の品質の低下につながります。より大きなサンプルまたは他の組織を処理する場合は、最小限の周囲RNAレベルに最適なバッファー量を決定するために試運転を行うことを強くお勧めします。核とRNAの品質と濃度は、過負荷が全体的なパフォーマンスを低下させるため、慎重に調べる必要があります。
さらに、大量の細胞破片は、単一の核に関連しない高レベルの周囲RNAを引き起こし、シーケンシング結果に悪影響を及ぼします。スクロースクッションを介した遠心分離による核懸濁液の清澄化は、この問題をある程度軽減するが、例えば免疫細胞に存在する高密度で小さな核に対するカウンター選択による細胞型表現の偏りにつながる可能性がある16。これが懸念される場合は、スクロース勾配を省略する必要があります。対照的に、DAPI染色に基づくフローサイトメトリーは、高品質の単一核懸濁液を作製するために細胞破片の量を減らすために重要であることがわかりました。
単一核の単離は、単一細胞アプローチと比較して大きな利点があります8。適切に凍結された組織と互換性があり、組織コレクションをより柔軟にし、転写ストレス応答を導入する可能性のある酵素ベースの組織解離の必要性を回避します6,17。さらに、腎皮質の容易に解離可能な細胞型の選択を支持する解離バイアスを克服し、これはいくつかの酵素ベースのアプローチにおいて髄質細胞型の過小評価につながる可能性がある5、6、10。
腎臓組織全体の代わりに中央腎臓片を使用すると、リソースがさらに節約され、前述のように豊富な細胞タイプの過剰表現が補正されます10。ただし、調査するマウスモデルまたは表現型によっては、単一の中央スライスではなく腎臓全体のサンプルを使用することが有益な場合があります。腎臓全体のサンプルは、真の細胞比率、または腎臓全体に発生する変化をより代表している可能性がありますが、トリミングされた中央スライスは、髄質表現型またはサンプル材料が限られている場合に有利であることが証明されました。したがって、この決定は非常にユーザー固有であり、慎重に検討する必要があります。
開示事項
著者は開示するものは何もありません。
謝辞
ベルリンのヘルムホルツ協会にあるマックスデルブリュック分子医学センターの科学ゲノミクスプラットフォームに技術サポートを提供していただきありがとうございます。
JLとKMSOは、ドイツ研究財団(DFG)の研究トレーニンググループGRK 2318と研究ユニットFOR 2841の支援を受けました。KMSOは共同研究助成金1365の支援を受けました。ABは、NRに授与されたDFGのゴットフリートヴィルヘルムライプニッツ賞からの資金提供によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Cell sorter | - | - | For fluorescence-activated cell sorting (FACS); e.g. BD FACSAria Cell Sorter. |
| Centrifuge 5810 R | Eppendorf | 5811000015 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | Needs to contain DAPI light cube to count nuclei. Alternatively, nuclei can be counted manually under fluorescence microscope. |
| 4′,6-Diamidino-2-phenyl-indol-dihydrochlorid (DAPI) | Biotrend | 40043/b | Stock solution prepared with a concentration of 100 µM. Used for nuclei staining in a final concentration of 2 µM. |
| D(+)-Sucrose ≥99.9%, ultrapure DNAse-, RNAse-free | VWR | 0335-500G | |
| DNA LoBind Microcentrifuge Tubes (1.5 mL) | Eppendorf | 22431021 | |
| Ethanol, 70 % | - | - | |
| FACS tubes | pluriSelect | 43-10100-46 | |
| KIMBLE Dounce tissue grinder set 2 mL complete | Sigma-Aldrich | D8938-1SET | |
| Minisart Syringe Filters 0.2 µm | Sartorius | 16534-GUK | |
| Nuclease-free Water | Invitrogen | AM9937 | |
| Nuclei EZ Prep Nuclei Isolation Kit | Sigma-Aldrich | NUC-101 | Nuclei EZ Lysis Buffer (Product No. N3408) needed for buffer preparation. |
| PBS (Phosphate-Buffered Saline) 1X without calcium or magnesium | Corning | 21-040-CV | |
| Petri dishes, polystyrene 60 mm | Sigma-Aldrich | P5481 | |
| Phosphate-Buffered Saline (PBS) with 10% Bovine Albumin | Sigma-Aldrich | SRE0036 | |
| pluriStrainer Mini 100 µm | pluriSelect | 43-10100-46 | |
| pluriStrainer Mini 20 µm | pluriSelect | 43-10020-40 | |
| pluriStrainer Mini 40 µm | pluriSelect | 43-10040-40 | |
| Polystyrene Centrifuge Tube (15 mL) | Falcon | 352099 | |
| Razor blades | - | - | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher | EO0384 | |
| Ribonucleoside-vanadyl complex | New England Biolabs | S1402S | Follow manufacturer's instructions (https://international.neb.com/products/s1402-ribonucleoside-vanadyl-complex#Product%20Information). Upon use the 200 mM stock solution is reconstituted to a green-black clear solution by incubating at 65 °C. |
| RNAlater Stabilization Solution | Invitrogen | AM7020 | |
| RNase AWAY | Fisher Scientific | 11952385 |
参考文献
- Thomas, R. S. Kidney modeling and systems physiology. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 1 (2), 172-190 (2009).
- Potter, S. S. Single-cell RNA sequencing for the study of development, physiology and disease. Nature Reviews Nephrology. 14 (8), 479-492 (2018).
- Park, J., Liu, C. L., Kim, J., Susztak, K. Understanding the kidney one cell at a time. Kidney International. 96 (4), 862-870 (2019).
- Clark, A. R., Greka, A. The power of one: advances in single-cell genomics in the kidney. Nature Reviews Nephrology. 16 (2), 73-74 (2020).
- Lake, B. B., et al. A single-nucleus RNA-sequencing pipeline to decipher the molecular anatomy and pathophysiology of human kidneys. Nature Communications. 10 (1), 2832(2019).
- Wu, H., Kirita, Y., Donnelly, E. L., Humphreys, B. D. Advantages of single-nucleus over single-cell RNA sequencing of adult kidney: Rare cell types and novel cell states revealed in fibrosis. Journal of the American Society of Nephrology. 30 (1), 23-32 (2019).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell RNA-seq artifacts: a molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Muto, Y., et al. Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney. Nature Communications. 12 (1), 2190(2021).
- Hinze, C., et al. Kidney single-cell transcriptomes predict spatial corticomedullary gene expression and tissue osmolality gradients. Journal of the American Society of Nephrology. 32 (2), 291(2021).
- Berger, S. L. Isolation of cytoplasmic RNA: ribonucleoside-vanadyl complexes. Methods in Enzymology. 152, 227-234 (1987).
- Butler, A., Hoffman, P., Smibert, P., Papalexi, E., Satija, R. Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nature Biotechnology. 36 (5), 411-420 (2018).
- Stuart, T., et al. Comprehensive Integration of single-cell data. Cell. 177 (7), 1888-1902 (2019).
- Park, J., et al. Single-cell transcriptomics of the mouse kidney reveals potential cellular targets of kidney disease. Science. 360 (6390), 758-763 (2018).
- Kirita, Y., Wu, H., Uchimura, K., Wilson, P. C., Humphreys, B. D. Cell profiling of mouse acute kidney injury reveals conserved cellular responses to injury. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15874-15883 (2020).
- Schneeberger, S., et al. The neuroinflammatory interleukin-12 signaling pathway drives Alzheimer's disease-like pathology by perturbing oligodendrocyte survival and neuronal homeostasis. bioRxiv. , 441313(2021).
- Nguyen, Q. H., Pervolarakis, N., Nee, K., Kessenbrock, K. experimental considerations for single-cell RNA sequencing approaches. Frontiers in Cell and Developmental Biology. 6, 108(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved