Method Article
アペレットヒト産物からのガンマデルタ(γδ)T細胞の増殖と濃縮
要約
提示は、ガンマデルタ(γδ)T細胞薬剤産物の拡張のためのプロトコルである。リンパ球は溶出により単離され、γδ濃縮はゾレドロン酸とインターロイキン-2で濃縮される。α-βT細胞は、臨床グレードの磁気分離装置を使用して枯渇する。γδ細胞をK562由来、人工抗原提示細胞と共培養し、拡大する。
要約
Vγ9Vδ2 T細胞はTリンパ球のマイナーサブセットであるが、この集団は主要な組織適合性複合体(MHC)に依存しない方法で抗原を認識し、癌免疫療法の理想的な候補となる強力な細胞分解エフェクター機能を開発する能力のために求められている。末梢血中のγ-Δ(γδ)T細胞の低頻度に起因し、急性骨髄性白血病患者(AML)のヒトを初めて使用する薬剤製品として、高純度γδT細胞を大幅に拡大する有効なプロトコルを開発しました。健康なドナーアフェーゼを同種細胞源として使用して、リンパ球は、サイズおよび密度によって細胞を分離するカウンターフロー遠心分離法のための検証済み装置を用いて単離される。
リンパ球が豊富な分画が利用され、γδT細胞はゾレドロン酸(FDA承認)およびインターロイキン(IL)-2で7日間優先的に活性化される。γδT細胞の優先的な拡大に続いて、臨床グレードの磁気細胞分離装置およびTCRαβビーズが、T細胞受容体(TCR)αβT細胞の汚染を枯渇させるために使用される。高エンリッチ化されたγδT細胞は、CD3およびCD28、41BBL(CD137L)およびIL15-RAをゾレドロン酸およびIL-2と共に発現するために遺伝子操作されたK562細胞に由来する人工抗原提示細胞(aAPC)を用いて2回目の拡張を行う。aAAPcとの共培養で全日7濃縮γδT細胞を播種すると、健康なドナー血液から >平均229,000倍の倍率の拡大を伴う高純度γδT細胞の製造が容易になる。
概要
白血病再発は、AML1,2,3患者における造血細胞移植(HCT)後の死亡の主な原因である。より良い白血病を含まない生存率は、移植片対宿主病(GVHD)4のリスクを増加させることなく、HCT後の血中γδT細胞の回復の増加とともに報告された。γδ T細胞がMHC非依存的な方法で抗原を認識し、強力な細胞分解性およびTh1様エフェクター機能を開発する能力は、このT細胞の小さな亜集団を再発の危険で同種移植を受けているAML患者の治療に理想的にする。Vγ9Vδ2 T細胞は、周辺のT細胞の0.5%から5%の範囲のTリンパ球のマイナーサブセットであることを考えると、我々は臨床試験のための潜在的に治療用量を達成するために、この稀な血液細胞集団を拡大するための堅牢なシステムを確立することに着手した。
他の人はゾレドロン酸、さらにはaAPCを用いてγδT細胞を拡大することに成功しているが、我々は潜在的に229,749倍のγδT細胞を拡大することができるプロセスを開発した。拡大は二機体性である:まず、リンパ球は分離器具を用いた溶出によって得られる。装置は逆流遠心によってサイズ、形および密度に基づいて細胞の分離を可能にする閉鎖されたシステムを提供する。リンパ球の濃縮後、Vγ9Vδ2 T細胞の選択的拡張は、ゾレドロン酸およびIL-2で7日間の処理によって達成される。この処理の直後に、TCR-αβ T細胞は、マイクロビーズ技術を用いて枯渇し、その後、K562由来のaAPCを有するγδT細胞の増殖を可能にする。
プロセス検証のために、aAPCとの相2共培養拡張に使用されたのは、106 ×のゾレドロン酸拡張γδT細胞に対してのみ使用された。この第2段階の拡張では、γδ T細胞は、遺伝子組み換えK562由来aAPC(K562VL6(K562VL6(scFv-CD3-41BBL;scFv-CD28-IL15-RA)の現在のグッドマニュファクチャリングプラクティス(cGMP)準拠の作業セルバンク(WCB)を使用して活性化されます。この二相膨張の理論的根拠は、単球におけるファルネシル二リン酸合成酵素(FDPS)を阻害するゾレドロン酸の能力に基づいており、Vγ2Vδ2細胞を直接刺激するイソペンテニルピロリン酸の蓄積をもたらす。拡張の第2段階では、K562由来のaAPC(K562VL6(K562VL6(scFv-CD3-41BBL;scFv-CD28-IL15-RA))は、すべてのT細胞に強い刺激を与えます。しかし、細胞産物はγδT細胞について既に濃縮されており、γδT細胞の強健な膨張をもたらす。
特定の装置およびフラスコを使用することで、プロセスは機能的に閉鎖されたシステムであり、汚染のリスクを減少させる。さらに、1 L閉系バイオリアクターは、摂食の必要性を最小限に抑え、培地の総体積1Lにおける細胞の最大成長および拡張を促進する。Moffitt法の利点は、同種投与のための高純度のドナー由来γδT細胞産物を製造する迅速、再現性、および高い実現可能なGMPシステムを提供することにある。この方法は、Vγ2Vδ2 T細胞受容体を発現するヒトγδT細胞を、部分的かつ完全寛解の癌患者における微生物および腫瘍に対する免疫を媒介する養子免疫療法として使用することを目的とするあらゆる臨床試験に適用することができる。また、γδキメラ抗原受容体陽性(CAR+)T細胞の開発および生産のための堅牢なプラットフォームを提供する。
プロトコル
注:IRBの承認を得て、ドナーからインフォームド・コンセントを得ました。
1. リンパ球の分離
- アペレシス製品をクリーンルームに移します。
注: プロセス検証は、原料材料収集規則に準拠した外部の商用ベンダーからの通常のドナーアペレシスを使用して実行されました。 - 滅菌試験、細胞数、細胞のフェノタイピング用のサンプルを収集します。
- 1%のヒト血清アルブミン(HSA)と生理食塩水の二次媒体(0.9%塩化ナトリウム注入USP)またはダルベッコのリン酸緩衝生理食塩水(DPBS)を有するハンクスバランス塩溶液の一次培地を使用したカウンターフロー遠心分離装置上のElutriate。溶出遠心速度を900× g に設定し、流量と時間に基づいて分数を収集します。
- 分数2からサンプルを収集し、次のテストを実行します: 2 mL の滅菌試験。アクリジンオレンジ/ヨウ化プロピジウム(AO/PI)を使用した細胞数および生存率の0.5 mL;5 ×フローサイトメトリーによる細胞フェノタイピング用106 細胞。
- 1L閉系バイオリアクターで10×106 細胞/cm2 で培養中の純粋なリンパ球分画(画分2)を、ゾレドロン酸5μmol/L、IL-2の300 IU/mLを含む1L閉系バイオリアクターで拡張します。
- 5%CO2で37°Cに設定インキュベーターで7日間インキュベート。
2. α-β(αβ) T細胞枯渇
- 1 L閉系バイオリアクターフラスコから細胞を収穫する。滅菌溶接1L転写パックを閉系バイオリアクターの赤線に、適切な製薬ポンプを使用して細胞を移送パックに移す。
- 次のサンプルを取る:使用済み中型の無菌性のための10 mL;AO/PIを使用した細胞数および生存率のための細胞の0.5 mL;5 × 106 細胞のフローサイトメトリー
- リン酸緩衝生理食塩分(PBS)または(PBS/エチレンアミンテトラ酢酸(EDTA))緩衝液+0.5%HSAおよびビオチン化TCRαβ特異的抗体中の108 細胞/mL×〜5個で細胞を再懸濁させる。
- 冷蔵庫にシェーカーを入れ、2~8°Cで約15分間揺れながらインキュベートします。
- 合計600 mLのPBS/EDTAバッファー+ 0.5% HSA で細胞を洗浄します。遠心分離機は2〜8°Cで15分間200〜500× g で非結合抗体を除去した。 PBS/EDTA バッファー内の約 5 × 108 細胞/mL + 0.5% HSA を抗ビオチン特異的マイクロビーズ (7.5 mL/1 バイアル) で再中断します。
- 冷蔵庫にシェーカーを入れ、2~8°Cで約15分間揺れながらインキュベートします。インキュベーション後、2〜8°Cで15分間200〜500× g で細胞を遠心分離し、バインドされていないマイクロビーズを除去します。PBS/EDTA バッファー + 0.5% HSA で~6 個の × 107 個のセル/mL を再中断し、転送パック バッグに移します。
- メーカーの指示に従って臨床グレードの磁気細胞分離装置にチューブセットを取り付け、PBS/EDTAバッファーとトランスファーパックを機器にセル製品と一緒に置き、機器の指示に従ってスパイクします。
- ラベル付きαβ T細胞の枯渇のための 枯渇1.2 プロトコルを選択します。
- 遠心分離機は、標的分画(エンリッチ化したγδT細胞)を、10%ヒトAB血清を添加した培地中で細胞を再懸濁する。
- 0.5 mLサンプルを採取し、AO/PI染色で細胞数と生存率を実行します。細胞を約1×106 個の細胞/mLの最終濃度にします。フローサイトメトリーフェノタイピングポスト枯渇のための製品の5×106 細胞のサンプルを取る。
3. aAPCとの共同文化
- X線発生装置で100Gyで5×107 aAPC/フラスコを照射します。
- aAPCを共培養でγδT細胞と10:1の比率で使用します。照射したaAAPC(5×107 細胞/フラスコ)とγδT細胞(5×106 細胞/フラスコ)を1L閉式バイオリアクターフラスコに1Lの培養培地1Lを1Lに1%ヒトAB血清で添加する。10フラスコまで播種します。
- 培養中の細胞を37°C、5%CO2のインキュベーターで10日間培養します。
- ストリップ、グルコース、乳酸メーターを使用して、3〜4日ごとにグルコースおよび乳酸塩レベルを監視します。
- グルコースが250mg/dLに低下した場合、フラスコ内の体積を200mLに減らし、1L転写パックを閉系バイオリアクターの赤線に無菌溶接して製薬ポンプを使用します。
- 残りの200mLの細胞を混合し、AO-PI染色による細胞の計数および生存率測定のための0.5 mLサンプルを取る。細胞数が109≥場合は、1つのフラスコを2つのフラスコに分割し、各フラスコを10%のヒトAB血清で補ったAIM-Vで最大1 Lに充填します。細胞数が109<の場合、10%のヒトAB血清を添加した新鮮な1リットルの培養培地で細胞を供給する。
- すべてのフラスコに対してステップ3.6を繰り返し、37°Cおよび5%CO2のインキュベーターに戻します。3 日から 4 日ごとに手順 3.4 ~ 3.7 を繰り返します。
4. 細胞の収穫
- 共培養で10日間の終わりに、すべてのバイオリアクターフラスコを収穫する。一度に1つのバイオリアクターフラスコを収穫し、適切なサイズの移動パックにすべての細胞をプールします。滅菌溶接は、閉系バイオリアクターの赤線に転送パックを溶接し、そして、移送パックに細胞を転送するために、製薬ポンプを使用します。
- 以下の品質管理サンプルを除去する:血液培養およびグラム染色による無菌性のための薬剤製品(DP)の1%;AO/PIを使用したセルカウントおよび生存率の場合は0.5 mL。5-10 ×フローサイトメトリー用106 細胞(gating戦略の 図1 を参照)。0.5 mL の内毒素;グラム染色のための0.5 mL;106 細胞は、マイコプラズマ試験のために使用済み培地の10 mLにスパイクしました。
- 室温で15分間200〜500× g で細胞を遠心分離し、上清を捨てます。
- バランスのとれた結晶溶液+0.5%HSAの溶液で細胞を室温で15分間200〜500× g で洗浄します。バランスのとれた結晶溶液+ 0.5%HSAの目標体積100〜300mLで再懸濁します。
5. リリーステスト
- 以下のγΔT細胞DPの品質管理試験を行う:純度および同一性(生/死)、CD45、CD3、TCR αβ、TCR γδ、CD20、CD56、CD16;AO/PI染色による生存率;内毒素;ポリメラーゼ連鎖反応(PCR)によるマイコプラズマ試験;グラム染色と好気性および嫌気性血液培養による滅菌;フローサイトメトリーによる残留K562アッセイ(CD3-CD16-CD56-CD71+)。
結果
γδT細胞プロセスを、γδT細胞薬剤産物の製造に対して特徴付け、最適化した。プロセス最適化には、1)溶出を用いたリンパ球濃縮、2)γδT細胞薬物物質(DS)ゾレドロン酸による細胞特異的拡張、3)γδT細胞DSのTCRαβの枯渇、4)K562由来のaAPcを用いたγΔT細胞DSの二次拡張、および5)最終DPおよび製剤を含むプロセス最適化後、3人の健康なドナーから得られた材料を使用して、細胞処理の適合性を確認するために、スケールで確認実行を行った。すべてのデータを分析し、 表1、 表2、表 3にまとめた。逆流後遠心分離画2(F2)から分離された細胞は、平均99.23%のCD45+ 細胞(総ライブゲートの頻度として報告される)と95.80%の優れた平均生存率を有する純粋なリンパ球集団を生み出した(表1)。
ゾレドロン酸によるγδT細胞特異的膨張は、溶出後のリンパ球画分(F2)に存在するナチュラルキラー(NK)細胞の初期割合に依存した。TCRαβ枯渇を伴うγδT細胞DSの濃縮は一貫していた(表2)。3つの健常ドナーから製造されたγδT細胞DPは、0.05%のCD20+B細胞±平均0.11%、0.00%±0.00%のTCRαβ+T細胞を有し、TCRαβ+T細胞の≤1%の放出基準を満たしていた。最終製品のNK細胞の平均割合は17.06%±26.19%で、<35%の放出基準を満たしています。また、最終製品におけるT細胞およびNK細胞系分陰細胞の平均割合は0.48%±0.42%であった(表3)。細胞表面染色およびフローサイトメトリック解析は、図2A-Dに示すように、DSおよびDPの同一性、純度、およびプロセス不純物を特徴付けるために利用された。
二次拡張は、aAPC(K562CL6(Cd3-CD137L:CD28-IL-15RA))の共培養からWCB及びγδT細胞DSを10:1の比率で行い、表 4に示すように全ての放出基準を満たすγδT細胞DPを生成した。また、細胞を染色し、0日目カウンターフロー遠心分離F2細胞でフローサイトメトリーにより評価し、 7日目ゾレドロン酸拡張T細胞、7-TCRαβT細胞枯渇、分化(CD)3、TCRαβ、TCRδγ、CD45RA、CD45RO、CD45RO、CCケモカイン受容体7(CCR7)、プログラムされた細胞死タンパク質-1(PD-1)、17日目の最終DP 細胞傷害性Tリンパ球関連タンパク質4(CTLA4)、リンパ球活性化遺伝子3(LAG3)、およびT細胞免疫グロブリンおよびムシンドメイン含有タンパク質3(TIM3)。 図 3 に示すデータは、3 つの独立した実行から平均化され、細胞が枯渇していないことを示しています。モフィットCTFはまた、K562由来のaAPCに関連するDP不純物を決定するために残留K562アッセイを開発しました(図4)。
細胞タイプのパーセンテージを特徴付けるために使用されるフローサイトメトリック・ゲージ戦略は、1)TおよびNK細胞系系負母集団(CD3-CD56-CD16-)における格子化である。2)CD71+上のゲート(エリスロイド系統およびAMLで発現するトランスフェリン受容体は、残留K562細胞の検出を可能にする)。この格言戦略は、AAPC(K562CL6(scFv-CD3-CD137;scFv-CD28-IL15-RA)WCB(図4の「残余K562」と呼ばれます)であるCD3-CD16-CD56-CD71+セルの評価を可能にしました。この格子は、DPの残差K562の周波数にDPの総生存数(TVC)数(%CD71+×DPC=DP内の残留K562セル)を掛け合わせて、最終DPにおける残留K562の列挙を可能にする。すべてのフローサイトメトリックデータは、生細胞の頻度として報告されます。表5および図4は、T細胞およびNK細胞系系陰性の割合と残余K562細胞の割合を示す。これらの集団間の差の統計的有意性を決定するために2尾のt検定を行い、WCBとγδT細胞DPとWCB細胞とγδT細胞の間に有意な差があることを明らかにした(t = 0.0019 T細胞とNK細胞系系線陰性;t < 0.0001 の残差 K562、t = 0.0314 の T 細胞および NK 細胞系系分量陰性;t < 0.0001 の残差 K562) (表 5) を参照してください。

図1:フローサイトメトリックゲージ戦略の概略表現 略語: aAPC = 、人工抗原提示細胞;SSC-A = ピークの側散乱領域;FSC-A = ピークの前方散乱領域。SSC-H = ピークの側面散乱高さ;FSC-H = ピークの前方散乱高さ。CD = 分化のクラスター。 この図の大きなバージョンを表示するには、ここをクリックしてください。
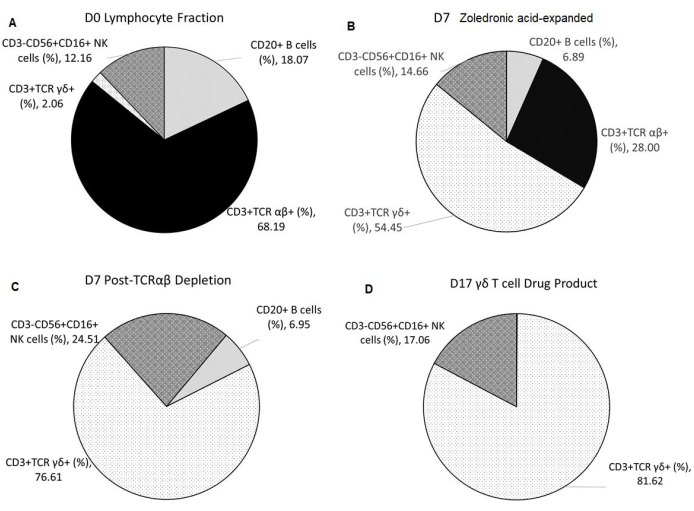
図2:出発物質、中間体、最終薬剤製品の組成 表示されるすべてのデータは、3 つの独立した実行から平均化されます。(A)健常ドナーからのアフェレシスは、逆流遠心分離装置を用いて溶出を受け、出発物質として用いられるF2(リンパ球リッチ分画)をもたらす。(B) F2は、ゾレドロン酸の5 μmol/Lおよび1LのIL-2の300 IU/mLを10%ヒトAB血清で補充して7日間Vγ9Vδ2 T細胞特異的拡張を行う。(C)TCRαβT細胞枯渇はゾレドロン酸膨張生成物に対して行われる。(D) 高純度γδT細胞薬剤は、照射されたaAAPCを1:10比で2回目の10日間拡張した後、ゾレドロン酸5μmol/L、IL-2の300 IU/mLを1LのIL-2で10%のヒトAB血清で補った後に収穫される。略語: NK = ナチュラルキラー;CD = 分化のクラスター;TCR= T細胞受容体;IL = インターロイキン;aAPC = 人工抗原提示細胞 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:出発物質、中間体、最終医薬品のバイオマーカー CD3、TCRαβ、TCR γδ、CD45RA、CD45RO、CCR7、PD-1、CTLA4、LAG3、TIM3の細胞を回収して染色する。表示されるすべてのデータは、3 つの独立した実行から平均化されます。(A)ステム状(CD3+、TCRδ+、CD45RA+、CD45RO-およびCCR7+)を総生細胞数として示す。(B)中枢記憶(CD3+、TCRγδ+、CD45RA-、CD45RO+、およびCCR7+)を、CD3+ TCRγδ+ 細胞の割合として示した。略語: CD = 分化のクラスター;TCR= T細胞受容体;IL = インターロイキン; .CCR7 = CCケモカイン受容体 7;PD-1 = プログラムされた細胞死タンパク質-1;CTLA4 = 細胞傷害性 T リンパ球関連タンパク質 4;LAG3 = リンパ球活性化遺伝子 3;TIM3=T細胞免疫グロブリンおよびムチンドメイン含有タンパク質3. この図の大きなバージョンを表示するには、ここをクリックしてください。
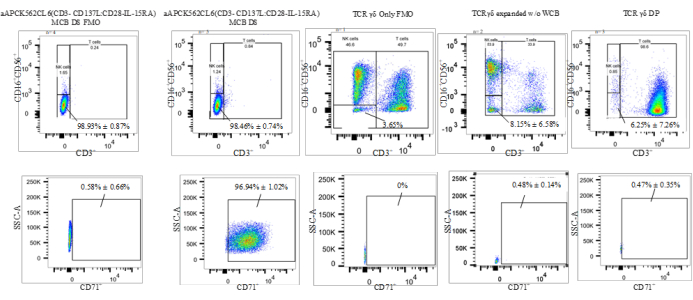
図4:K562残留アッセイの代表的なデータ(CD3-CD16-CD56-CD71+)。 略語: aAPC = 人工抗原提示細胞;NK = ナチュラルキラーセル;SSC-A = ピークの側散乱領域;CD = 分化のクラスター;IL = インターロイキン;TCR = T細胞受容体;MCB =マスターセルバンクFMO = 蛍光から 1 を引いたもの;DP = 医薬品;WCB = 作動セルバンク。この図の大きなバージョンを表示するには、ここをクリックしてください。
| プロセスステップ | パラメーター | ドナー | 平均 | セントデヴ。 | |||
| 実行 1 | 実行 2 | 実行 3 | |||||
| ポストエンリッチメント (リンパ球画分 F2) | TVCすべてのプロセス検証は109 TVCでシードされました | 1.00 X 109 | 1.00 X 109 | 1.00 X 109 | 1.00 X 109 | 0.00 | |
| 生存率 (%) | 98.6 | 96.6 | 92.2 | 95.8 | 3.27 | ||
| CD20+ B細胞 (%) | 15.6 | 23.4 | 15.2 | 18.07 | 4.62 | ||
| CD3+ T セル (%) | 80.04 | 66.7 | 76.1 | 74.28 | 6.85 | ||
| TCR αβ+ (%) | 77.59 | 58.03 | 68.96 | 68.19 | 9.8 | ||
| TCR γδ+ (%) | 2.48 | 1.59 | 2.1 | 2.06 | 0.45 | ||
| CD3-CD56+CD16+ NK細胞 (%) | 6.57 | 19.4 | 10.5 | 12.16 | 6.57 | ||
| T細胞とNK細胞系系陰性(%) | 13 | 13.7 | 13.4 | 13.37 | 0.35 | ||
表1:生細胞の頻度として報告された溶出によるリンパ球濃縮の概要。 略語: TVC = 実行可能な合計数;TCR = T細胞受容体;CD = 分化のクラスター;NK =ナチュラルキラーセル。
| プロセスステップ | パラメーター | ドナー | 平均 | セントデヴ。 | |||
| 実行 1 | 実行 2 | 実行 3 | |||||
| 7日間ポストゾレドロン酸拡張(プレ- TCRαβ枯渇) | テレビC | 3.69 X 109 | 1.79 X 109 | 1.42 X 109 | 2.3 X 109 | 1.22 X 109 | |
| 生存率 (%) | 99.2 | 82.6 | 89.8 | 90.53 | 8.32 | ||
| CD20+ B 細胞 | 2.1 | 11.5 | 7.08 | 6.89 | 4.7 | ||
| CD3+ T セル (%) | 95.7 | 64.1 | 91.9 | 83.9 | 17.25 | ||
| TCR αβ+ (%) | 13.88 | 38.14 | 31.98 | 28 | 12.61 | ||
| TCR γδ+ (%) | 81.44 | 24.93 | 56.98 | 54.45 | 28.34 | ||
| CD3-CD56+CD16+ NK細胞 (%) | 3.59 | 33.1 | 7.28 | 14.66 | 16.08 | ||
| T細胞とNK細胞系系陰性(%) | 0.67 | 2.7 | 0.82 | 1.4 | 1.13 | ||
| ポスト- TCRαβ枯渇 | テレビC | 1.81 x 109 | 4.95 X 108 | 3.80 X 108 | 8.95 X108 | 7.94 X 108 | |
| 細胞生存率 (%) | 98.8 | 87.6 | 89.8 | 92.07 | 5.93 | ||
| CD20+ B 細胞 | 2.26 | 12 | 6.59 | 6.95 | 4.88 | ||
| CD3+ T セル (%) | 95.8 | 45.3 | 89.7 | 76.93 | 27.56 | ||
| TCR αβ+ (%) | 0 | 0.001 | 0.001 | 0.001 | 0.001 | ||
| TCR γδ+ (%) | 95.61 | 45.07 | 89.16 | 76.61 | 27.51 | ||
| CD3-CD56+CD16+ NK細胞 (%) | 3.85 | 59.9 | 9.79 | 24.51 | 30.79 | ||
| T細胞とNK細胞系系陰性(%) | 0.34 | 1.72 | 0.45 | 0.84 | 0.77 | ||
| TCR αβ+ テレビC | 0.00 | 4.95 x 103 | 3.8 X 103 | 2.92 X 103 | 2.59 X 103 | ||
| TCR γδ+ TVC | 1.73 X 109 | 2.23 X 108 | 3.39 X 108 | 7.64 X 108 | 8.39 X 108 | ||
| CD3-CD56+CD16+ NK TVC | 6.97 X 107 | 2.97 X 108 | 3.72E+07 | 1.35 X 108 | 1.42 X 108 | ||
表2:ゾレドロン酸と器具濃縮を伴うγδT細胞拡張の要約は、生細胞の頻度として報告される。 略語:TVC = 実行可能な合計数。TCR = T細胞受容体;CD = 分化のクラスター;NK =ナチュラルキラーセル。
| 製品属性 | パラメーター | ドナー | 平均 | セントデヴ。 | |||
| 実行 1 | 実行 2 | 実行 3 | |||||
| 0日目 γδ T 細胞 | 2.48 X 107 | 1.59 X 107 | 2.10 X 107 | 2.06 X 107 | 4.47 X 107 | ||
| 7日目ポストエンリッチメントγδT細胞 | 1.73 X 109 | 2.23 X 108 | 3.39 X 108 | 7.64 X 108 | 8.39 X 108 | ||
| 7日目の折り畳み拡張 | 69.76 | 14.03 | 16.14 | 33.31 | 31.58 | ||
| 収穫時のTVC* | 8.14 X 1010 | 1.67 X 1010 | 6.84 X 1010 | 5.55 X 1010 | 3.42 X 1010 | ||
| 細胞生存率 (%) | 92.8 | 85.5 | 87.3 | 88.53 | 3.80 | ||
| CD20+ B細胞 (%) | 0.12 | 0.06 | 0.15 | 0.11 | 0.05 | ||
| CD3+ T セル (%) | 97.8 | 52 | 97.5 | 82.43 | 26.36 | ||
| TCR αβ+ (%) | 0 | 0.001 | 0 | 0.00 | 0.00 | ||
| TCR γδ+ (%) | 97.51 | 50.13 | 97.21 | 81.62 | 27.27 | ||
| CD3-CD56+CD16+ NK細胞 (%) | 2.16 | 47.3 | 1.71 | 17.06 | 26.19 | ||
| T細胞およびNK細胞系系陰、CD71+ 残留K562(%) | 0.018 | 0.61 | 0.82 | 0.48 | 0.42 | ||
| 収穫時の総γδT細胞 | 7.93 X 1012 | 8.38 X 1011 | 6.65 X 1012 | 5.14 X 1012 | 3.78 X 1012 | ||
| γδT細胞の総フォールド拡張(0日目から収穫まで) | 3.20 X 105 | 5.27 X 104 | 3.17 X 105 | 2.30 X 105 | 1.53 X 105 | ||
| *プロセス検証は、5 X 106 γδ T細胞および50 X106照射aAPCを有するフラスコに縮小された。報告された数字は、D7薬物物質から24フラスコが播種された場合の予想フルスケールランに対するものである。 | |||||||
表3:γδ+ T細胞共培養の要約をaAPCと拡大し、γδ+ T細胞収穫を生細胞の頻度として報告した。 *プロセス検証は、1つの閉系バイオリアクター(1L容量)に縮小され、5×106γδT 細胞、50×106 個のaAPCを照射しました。報告された数字は、24個のフラスコがD7薬物物質から播種された場合の予想本格的な実行のためのものです。略語: aAPC = 人工抗原提示細胞;TVC = 合計実行可能な数。TCR = T細胞受容体;CD = 分化のクラスター;NK =ナチュラルキラーセル。
| テスト パラメータ | 受け入れ条件 | 業績 | ||
| 検証 1 | 検証 2 | 検証 3 | ||
| 生存 率 | ≥ 70% | 92.80% | 85.50% | 87.30% |
| マイコ プラズマ | - | - | - | - |
| 不妊 | ノー・グロース・ファイナル(14日間) | ノー・グロース・ファイナル(14日間) | ノー・グロース・ファイナル(14日間) | ノー・グロース・ファイナル(14日間) |
| グラム染色 | 生物は見られない(NOS) | NOS | NOS | NOS |
| エンドトキシン | ≤ 2 EU/mL | <0.50 EU/mL | <0.50 EU/mL | <0.50 EU/mL |
表4γδT細胞の品質管理放出試験結果の概要
| 残留K562アッセイ | K562 | WCB | γδのみ | γδ + WCB 製品 | ||||
| T および NK 細胞系統 のネグ% | 残留K562% | T および NK 細胞系統 のネグ% | 残留K562% | T および NK 細胞系統 のネグ% | 残留K562% | T および NK 細胞系統 のネグ% | 残留K562% | |
| 99.4 | 98.8 | 98.7 | 96.83 | 3.49 | 0.58 | 0.48 | 0.07 | |
| 99.2 | 98.31 | 99.5 | 98.21 | 12.8 | 0.38 | 3.87 | 0.71 | |
| 98.9 | 98.6 | 97.6 | 95.55 | 該当する | 該当する | 14.4 | 0.63 | |
| 99.2 | 98.9 | 97.9 | 96.53 | 該当する | 該当する | 該当する | 該当する | |
| 98.7 | 98.3 | 98.6 | 97.6 | 該当する | 該当する | 該当する | 該当する | |
| 平均 | 99.08 | 98.58 | 98.46 | 96.94 | 8.15 | 0.48 | 6.25 | 0.47 |
| セントデヴ。 | 0.28 | 0.27 | 0.74 | 1.02 | 6.58 | 0.14 | 7.26 | 0.35 |
表5:T細胞およびNK細胞系系線-陰性および残存K562パーセントが生細胞の頻度として報告される。 略語: NK = ナチュラルキラー細胞;WCB = 作動セルバンク。
ディスカッション
Moffit細胞療法ラボは、臨床試験でDPとして使用するための高純度γδT細胞の二倍体膨張を有するプロトコルを開発しました。このプロトコルは、ゾレドロン酸およびWCB aAPCによって正常に活性化および拡張される非常に純粋なγδT細胞DPをもたらす閉じたシステムにおけるcGMPガイドラインの下での製造方法を提供する。このプロトコルは、AML患者のための同種γδT細胞DPの製造のためにFDAによって承認されている。健康なドナーを用い、ドナーγδT細胞の小集団を2.06±0.45%から54.45%±28.34%にわずか7日間で拡大することに成功しました。ゾレドロン酸による7日間の拡張後、ドナー2はNK個体数の増加を示した。
ゾレドロン酸は、単球におけるファルネシル二リン酸合成酵素(FDPS)を阻害し、これは、T細胞および天然NK細胞の増殖の有意な増加と相関しているイソペンテニルピロリン酸(IPP)の蓄積をもたらす7,8,9。このNK個体数の増加は、aAAPcがNK細胞のさらなる拡大に寄与するだけとなるため、aAAPCとの第2段階の拡大を妨げる。このため、ドナー基準は、NK集団の多いドナーを除外するように変更された。αβT細胞の枯渇後、γδT細胞をさらに27.51%±76.61まで濃縮した。このユニークなプロトコルは、γδT細胞内のCD8、CD28、およびCD127L受容体を標的とするモビット製造aAPCを利用する第2の拡張を含む。この第2のaAPCを用いた膨張期は、CD3+TCRγδ+T細胞、≤1%TCRαβT、<35%CD3-CD16+CD56+NK細胞に対して≥65%のDPを生み出した。K562由来のaAPCを使用したため、これらのaAAPCが最終製品の1%<で構成されていることを実証する必要がありました。
Moffit CTFは、最終DPの残存K562細胞の割合を測定するために放出基準に使用されるフローサイトメトリックアッセイを開発した。このフローサイトメトリックアッセイは、細胞表面抗原を利用してK562細胞を同定するという問題をすべて軽減します。活性化T細胞はCD71を発現することができるので、CD3-CD56-およびCD16-集団をgatingし、その後、K562細胞となるCD71+細胞を調べることによって、すべてのT細胞およびNK細胞を除外する戦略を考案した。このプロトコルは、γΔT細胞DPが0.48±0.42%の残留K562細胞を生成し、pcrによる≥70%生存率、マイコプラズマ否定性、グラム染色によって見られない生物、≤2 EU/mLの内毒素、および成長なしの最終的な(14日間)血液培養滅菌の全ての放出基準を満たすことを示している。
開示事項
著者らは開示する利益相反はない。
謝辞
私たちは、このプロトコル開発のための資金を提供するためのモフィット癌センターからの細胞免疫療法 -研究者開始試験賞の壁内資金機会に感謝します。また、クラウディオ・アナセッティ博士の貴重な支援と指導に感謝します。最後に、ジャスティン・ブーシェ博士の洞察と原稿のレビューに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Hanks Balanced Salt Solution | R&D | 285-GMP | |
| Human Albumin 25% | Grifolis | 65483-16-071 | |
| Plasmalyte A | Fisher | 2B2543Q | |
| Zoledronic Acid (Zometa) | Hos pira | 4215-04--8 | FDA approved drug |
| DMSO | WAK-CHEMIE MEDICAL GMBH | WAK-DMSO-10 | |
| CS10 | BIOLIFE SOLUTIONS | 210374 | |
| 3 mL syringe | BD | 309657 | |
| 10 mL syringe | BD | 309604 | |
| 20 mL syringe | BD | 302830 | |
| 50 mL syringe | BD | 309653 | |
| 100 mL syringe | JMS | 992861 | |
| 18g Needle | Fisher | 305198 | |
| Cryovials 1.8 mL | Fisher | 375418 | |
| 5 mL pipette | Fisher | 1367811D | |
| 50 mL pipette | Fisher | 1367610Q | |
| 10 mL pipette | Fisher | 1367811E | |
| 100 mL pipette | Fisher | 07-200-620 | |
| 15 mL conical | Fisher | 05-539-12 | |
| 50 mL conical | Fisher | 05-539-7 | |
| 250 mL conical | Fisher | 430776 | |
| 600 mL Transfer Pack | TERUMO BCT INC | 1BBT060CB71 | |
| 4" Plasma Transfer Set | INDEPENDENT MEDICSL ASSOCIATES | 03-220-90 | |
| Elutra Tubing Set | TerumoBCT | 70800 | |
| 100 MCS GREX | WILSON WOLF MFG CORP | 81100-CS | |
| Ashton Sterile Pumpmatic Liquid dispensing system | Fisher Scientific | 22-246660 | |
| Acacia Pump boot | MPS Medical In | 17789HP3MLL | |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec Inc | 130-070-525 | |
| Dornase Alpha | Genentech, Inc | 50242-100-40/186-0055 | FDA approved drug |
| 1000 mL 0.22 um Filter | Fisher | 157-0020 | |
| Blood Filter 170um | B.Braun | V2500 | |
| CliniMACs Tubing set | Miltenyi Biotec Inc | 130-090-719 | |
| CliniMACS TCRα/β Kit | Miltenyi Biotec Inc | 130-021-301 | |
| Y-Type blood set | Fenwal | FWL4C2498H | |
| 75 mL Flask | Fisher | 430641U | |
| IL-2 | Prometheus | 65483-116-071 | FDA approved drug |
| AIM-V | Fisher | 0870112BK | |
| Human AB serum | Gemini Bio-Product | 100H41T | |
| 3 Liter Transfer pack | Independent Medical Associates | T3109 | |
| 1000 pipette tips | Fisher Scientific | 5991040 | |
| CF-250 | KOLBio | CF-250 | |
| Elutra | TERUMOBCT | ||
| CliniMACS | Miltenyi Biotec Inc | ||
| GatheRex Liquid Handling, Cell Harvest Pump | WILSON WOLF MFG CORP | ||
| HERAcell Vios CO2 Incubator | Thermo Scientific |
参考文献
- Bejanyan, N., et al. Survival of patients with acute myeloid leukemia relapsing after allogeneic hematopoietic cell transplantation: a center for international blood and marrow transplant research study. Biology of Blood and Marrow Transplantation. 21 (3), 454-459 (2015).
- Bejanyan, N., et al. Clinical outcomes of AML patients relapsing after matched-related donor and umbilical cord blood transplantation. Bone Marrow Transplantation. 49 (8), 1029-1035 (2014).
- Schmid, C., et al. Treatment, risk factors, and outcome of adults with relapsed AML after reduced intensity conditioning for allogeneic stem cell transplantation. Blood. 119 (6), 1599-1606 (2012).
- Siegers, G. M., et al. Anti-leukemia activity of in vitro-expanded human gamma delta T cells in a xenogeneic Ph+ leukemia model. PLoS One. 6 (2), 16700 (2011).
- Airoldi, I., et al. γδ T-cell reconstitution after HLA-haploidentical hematopoietic transplantation depleted of TCR-αβ+/CD19+ lymphocytes. Blood. 125 (15), 2349-2358 (2015).
- Acuto, O., et al. The human T cell receptor: appearance in ontogeny and biochemical relationship of alpha and beta subunits on IL-2 dependent clones and T cell tumors. Cell. 34 (3), 717-726 (1983).
- Xiao, L., et al. Large-scale expansion of Vγ9Vδ2 T cells with engineered K562 feeder cells in G-Rex vessels and their use as chimeric antigen receptor-modified effector cells. Cytotherapy. 20 (3), 420-435 (2018).
- Peters, C., Kouakanou, L., Oberg, H. H., Wesch, D., Kabelitz, D. In vitro expansion of Vγ9Vδ2 T cells for immunotherapy. Methods in Enzymology. 631, 223-237 (2020).
- Xu, Y., et al. Allogeneic Vγ9Vδ2 T-cell immunotherapy exhibits promising clinical safety and prolongs the survival of patients with late-stage lung or liver cancer. Cellular & Molecular Immunology. 18 (2), 427-439 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved