Method Article
Expansión y enriquecimiento de células T gamma-delta (γδ) a partir de productos humanos aféridos
En este artículo
Resumen
Se presenta un protocolo para la expansión del producto farmacológico de células T Gamma-Delta (γδ). Los linfocitos se aíslan por elutriación y se enriquecen con γδ con ácido zoledrónico e interleucina-2. Las células T alfa-beta se agotan utilizando un dispositivo de separación magnética de grado clínico. Las células γδ se cocultivan con células artificiales presentadoras de antígenos derivadas de K562 y se expanden.
Resumen
Aunque las células T Vγ9Vδ2 son un subconjunto menor de linfocitos T, esta población es buscada por su capacidad para reconocer antígenos de una manera independiente del complejo de histocompatibilidad mayor (MHC) y desarrollar una fuerte función efectora citolítica que la convierte en un candidato ideal para la inmunoterapia contra el cáncer. Debido a la baja frecuencia de células T Gamma-Delta (γδ) en la sangre periférica, desarrollamos un protocolo efectivo para expandir en gran medida un producto farmacológico de células T γδ altamente puro para el primer uso en humanos de células T γδ alogénicas en pacientes con leucemia mieloide aguda (LMA). Utilizando la aféresis sana de donantes como fuente de células alogénicas, los linfocitos se aíslan utilizando un dispositivo validado para un método de centrifugación de contraflujo de separar las células por tamaño y densidad.
Se utiliza la fracción rica en linfocitos, y las células T γδ se activan preferentemente con ácido zoledrónico (aprobado por la FDA) e interleucina (IL)-2 durante 7 días. Tras la expansión preferencial de las células T γδ, se utilizan un dispositivo de separación de células magnéticas de grado clínico y perlas TCRαβ para agotar las células T αβ receptoras de células T contaminantes (TCR)αβ. Las células T γδ altamente enriquecidas luego experimentan una segunda expansión utilizando células presentadoras de antígenos artificiales (aAPCs) modificadas de células K562, genéticamente modificadas para expresar fragmento variable de cadena única (scFv) para CD3 y CD28, 41BBL (CD137L) e IL15-RA-junto con ácido zoledrónico e IL-2. La siembra de células T γδ enriquecidas con todo el día-7 en cocultivo con las aAPC facilita la fabricación de células T γδ altamente puras con una expansión media del pliegue de >229.000 veces a partir de sangre sana de donantes.
Introducción
La recaída de la leucemia es la principal causa de mortalidad tras el trasplante de células hematopoyéticas (HCT) en pacientes con LMA1,2,3. Se notificó una mejor supervivencia libre de leucemia con el aumento de la recuperación de las células T γδ sanguíneas después de la HCT sin un mayor riesgo de enfermedad de injerto contra huésped (EICH)4. La capacidad de las células T γδ para reconocer antígenos de manera independiente del MHC y desarrollar fuertes funciones efectoras citolíticas y similares a Th1 hacen que esta subpoblación menor de células T sea ideal para el tratamiento de pacientes con LMA sometidos a trasplante alogénico con riesgo de recaída5. Dado que las células T Vγ9Vδ2 son un subconjunto menor de linfocitos T que oscila entre el 0,5% y el 5% de las células T en la periferia6, nos propusimos establecer un sistema robusto para expandir esta rara población de células sanguíneas para lograr dosis potencialmente terapéuticas para ensayos clínicos.
Aunque otros han expandido con éxito las células T γδ utilizando ácido zoledrónico e incluso aAPCs, hemos desarrollado un proceso que potencialmente puede expandir las células T γδ en 229.749 veces. La expansión es bifásica: en primer lugar, los linfocitos se obtienen por elutriación utilizando el instrumento de separación. El equipo proporciona un sistema cerrado que permite la separación de células en función de su tamaño, forma y densidad por centrifugación de contraflujo. Después del enriquecimiento para los linfocitos, la expansión selectiva de las células T Vγ9Vδ2 se logra mediante el tratamiento con ácido zoledrónico e IL-2 durante 7 días. Inmediatamente después de este tratamiento, las células T T TCR-αβ se agotan utilizando la tecnología de microperlas, lo que permite la posterior expansión de las células T γδ con aAPCs derivadas de K562.
Para la validación del proceso, solo se utilizaron 5 × 106 células T γδ expandidas con ácido zoledrónico para la expansión de cocultivo de fase 2 con aAPI. En esta segunda fase de expansión, las células T γδ se activan utilizando un Banco de Células de Trabajo (WCB) compatible con las Buenas Prácticas de Fabricación (cGMP) de aAPCs derivados de K562 genéticamente modificados (K562VL6(scFv-CD3-41BBL;scFv-CD28-IL15-RA)) fabricados en Moffitt. La justificación de esta expansión bifásica se basa en la capacidad del ácido zoledrónico para inhibir la farnesil difosfato sintasa (FDPS) en los monocitos, lo que lleva a la acumulación de isopentenil pirofosfato, que estimula directamente las células Vγ2Vδ2. En la segunda fase de expansión, los aAPC derivados de K562 (K562VL6(scFv-CD3-41BBL;scFv-CD28-IL15-RA)) proporcionan una estimulación robusta a todas las células T. Sin embargo, el producto celular ya ha sido enriquecido para las células T γδ, lo que resulta en una expansión robusta de las células T γδ.
Con el uso de equipos y matraces específicos, el proceso es un sistema funcionalmente cerrado, disminuyendo así el riesgo de contaminación. Además, el biorreactor de sistema cerrado de 1 L facilita el crecimiento máximo y la expansión de las células en un volumen total de 1 L de medio con una necesidad mínima de alimentación. La ventaja del método Moffitt es que proporciona un sistema GMP rápido, reproducible y altamente factible para producir un producto de células T γδ altamente puro y derivado de donantes para la administración alogénica. Este método se puede aplicar a cualquier ensayo clínico que tenga como objetivo utilizar células T γδ humanas que expresan receptores de células T Vγ2Vδ2 como inmunoterapia adoptiva para mediar la inmunidad contra microbios y tumores en pacientes con cáncer con remisión parcial y completa. Además, proporciona una plataforma robusta para el desarrollo y la producción de células T con receptores de antígeno quimérico γδ (CAR+) positivas.
Protocolo
NOTA: Se obtuvo la aprobación del IRB y se obtuvo el consentimiento informado de los donantes.
1. Aislamiento de linfocitos
- Transfiera el producto de aféresis a una sala limpia.
NOTA: La validación del proceso se realizó utilizando aféresis normal de donantes de un proveedor comercial externo que cumple con las regulaciones de recolección de materias primas celulares. - Recolecte muestras para pruebas de esterilidad, recuento de células y fenotipado celular.
- Elutriado en el dispositivo de centrifugación de contraflujo utilizando un medio primario de Hanks Balanced Salt Solution con albúmina sérica humana al 1% (HSA) y un medio secundario de solución salina (0,9% de cloruro de sodio Inyectable USP) o solución salina tamponada con fosfato de Dulbecco (DPBS). Ajuste la velocidad de centrifugación de elutriación a 900 × g y recoja las fracciones en función del caudal y el tiempo.
- Recoger muestras de la fracción 2 y realizar las siguientes pruebas: 2 ml para pruebas de esterilidad; 0,5 ml para el recuento celular y la viabilidad utilizando yoduro de naranja acridina/propidio (AO/PI); 5 × 106 células para fenotipado celular por citometría de flujo.
- Expandir una fracción de linfocitos puros (fracción 2) de células en cultivo a 10 × 106 células/cm2 en un biorreactor de sistema cerrado de 1 L con 5 μmol/L de ácido zoledrónico y 300 UI/ml de IL-2.
- Incubar durante siete días en una incubadora a 37 °C con un 5% de CO2.
2. Agotamiento de las células T alfa-beta (αβ)
- Recolecte células del matraz biorreactor de sistema cerrado de 1 L. Suelde estérilmente un paquete de transferencia de 1 L a la línea roja del biorreactor de sistema cerrado y use la bomba farmacéutica adecuada para transferir las células al paquete de transferencia.
- Tome las siguientes muestras: 10 ml para la esterilidad media gastada; 0,5 ml de células para el recuento celular y la viabilidad utilizando AO/PI; 5 × 106 células para citometría de flujo
- Resuspend las células a ~5 × 108 células/ml en solución salina tamponada con fosfato (PBS) o (PBS/ácido etilendiaminotetraacético (EDTA)) tampón + 0,5% HSA y anticuerpo biotinilado TCR αβ específico.
- Coloque el agitador en el refrigerador e incube las células a 2-8 ° C durante aproximadamente 15 minutos con agitación.
- Lavar las células con un total de 600 ml de tampón PBS/EDTA + 0,5% HSA. Centrífuga para eliminar el anticuerpo no unido a 200-500 × g durante 15 min a 2-8 °C. Resuspend ~ 5 × 108 células / ml en tampón PBS / EDTA + 0.5% HSA con microperlas específicas anti-biotina (7.5 mL / 1 vial).
- Coloque el agitador en el refrigerador e incube las células a 2-8 ° C durante aproximadamente 15 minutos con agitación. Después de la incubación, centrifugue las células a 200-500 × g durante 15 min a 2-8 ° C para eliminar las microperlas no unidas. Resuspenda ~ 6 × 107 celdas / ml en tampón PBS / EDTA + 0.5% HSA y transfiéralas a una bolsa de paquete de transferencia.
- Instale el conjunto de tubos en el dispositivo de separación de células magnéticas de grado clínico siguiendo las instrucciones del fabricante, coloque los paquetes con el búfer PBS / EDTA y el paquete de transferencia con el producto celular en el instrumento y púalo cuando el instrumento se lo indique.
- Seleccione el protocolo Depletion 1.2 para el agotamiento de las células T αβ marcadas.
- Centrifugar la fracción objetivo (células T γδ enriquecidas) y resuspender las células en medio suplementado con 10% de suero AB humano.
- Tome una muestra de 0,5 ml y realice un recuento celular y viabilidad con tinción AO/PI. Llevar las células a una concentración final de aproximadamente 1 × 106 células/ml. Tome una muestra de 5 × 106 células del producto para fenotipar la citometría de flujo después del agotamiento.
3. Cocultivo con aAPCs
- Irradiar 5 × 107 aAPCs/matraz a 100 Gy en el instrumento generador de rayos X.
- Utilice los aAPCs en co-cultivo en una proporción de 10:1 con las células T γδ. Coloque los aAPCs irradiados (5 × 107 células/matraz) y las células T γδ (5 × 106 células/matraz) en matractores biorreactores de sistema cerrado de 1 L con 1 L de medio de cultivo suplementado con suero AB humano al 10%. Siembra hasta 10 matraces.
- Expandir las células en cultivo durante 10 días en una incubadora a 37 °C y 5% de CO2.
- Controle los niveles de glucosa y lactato cada 3-4 días usando tiras, glucosa y un medidor de lactato.
- Si la glucosa desciende a 250 mg/dL, reduzca el volumen en el matraz a 200 ml utilizando una bomba farmacéutica soldando estérilmente un paquete de transferencia de 1 L a la línea roja del biorreactor del sistema cerrado.
- Mezcle las células en los 200 ml restantes y tome una muestra de 0,5 ml para el recuento de células y la medición de la viabilidad mediante tinción AO-PI. Si el recuento de células es ≥109, divida un matraz en dos matraces y llene cada matraz hasta 1 L con AIM-V suplementado con suero AB humano al 10%. Si el recuento de células es de <109, alimente las células con un litro fresco de medio de cultivo suplementado con 10% de suero AB humano.
- Repita el paso 3.6 para todos los matraces y devuélvalos a la incubadora a 37 °C y al 5% de CO2. Repita los pasos 3.4-3.7 cada 3 a 4 días.
4. Cosecha de células
- Al final de 10 días en cocultivo, cosechar todos los matraces de biorreactores. Cosecha 1 matraz de biorreactor a la vez y agrupa todas las células en un paquete de transferencia del tamaño adecuado. Suelde estérilmente el paquete de transferencia a la línea roja del biorreactor de sistema cerrado y use la bomba farmacéutica para transferir las células al paquete de transferencia.
- Retire las siguientes muestras de control de calidad: 1% del producto farmacéutico (DP) para la esterilidad por hemocultivo y tinción de gram; 0,5 ml para el recuento celular y la viabilidad utilizando AO/PI; 5-10 × 106 células para citometría de flujo (ver Figura 1 para la estrategia de gating); 0,5 ml para la endotoxina; 0,5 ml para la tinción de gram; 106 células se dispararon en 10 ml de medio gastado para la prueba de micoplasma.
- Centrifugar las células a 200-500 × g durante 15 min a temperatura ambiente y desechar el sobrenadante.
- Lave las células en una solución de solución cristaloide equilibrada + HSA al 0,5% a 200-500 × g durante 15 min a temperatura ambiente. Resuspenderlos en un volumen objetivo de 100-300 ml de solución cristaloide equilibrada + 0,5% HSA.
5. Pruebas de lanzamiento
- Realizar pruebas de control de calidad de la célula T γδ DP para lo siguiente: pureza e identidad por citometría de flujo (Vivo/Muerto, CD45, CD3, TCR αβ, TCR γδ, CD20, CD56, CD16); viabilidad por tinción AO/PI; endotoxina; Pruebas de micoplasma por reacción en cadena de la polimerasa (PCR); esterilidad por tinción de gram y hemocultivos aeróbicos y anaeróbicos; ensayo de K562 residual por citometría de flujo (CD3-CD16-CD56-CD71+).
Resultados
El proceso de células T γδ se caracterizó y optimizó para la producción del producto farmacéutico de células T γδ. La optimización del proceso incluyó 1) el enriquecimiento de linfocitos mediante elutriación, 2) la expansión específica de la sustancia farmacológica de células T γδ (DS) con ácido zoledrónico, 3) el agotamiento del DS de células T γδ de TCRαβ, 4) la expansión secundaria de la DS de células T γδ utilizando aAPC derivados de K562, y 5) la cosecha final de DP y la formulación del producto para su administración o criopreservación. Después de la optimización del proceso, las ejecuciones de confirmación se realizaron a escala utilizando el material derivado de tres donantes sanos para confirmar la idoneidad del procesamiento celular. Todos los datos fueron analizados y se resumen en la Tabla 1, Tabla 2 y Tabla 3. Las células separadas de la fracción de centrifugación post-contraflujo 2 (F2) produjeron una población de linfocitos puros con un promedio de 99,23% de células CD45+ (reportadas como la frecuencia de la compuerta viva total) y una excelente viabilidad promedio de 95,80% (Tabla 1).
La expansión específica de las células T γδ con ácido zoledrónico dependió del porcentaje inicial de células asesinas naturales (NK) presentes en la fracción de linfocitos (F2) después de la elutriación. El enriquecimiento de γδ T cell DS con agotamiento de TCRαβ fue consistente (Tabla 2). El DP de células T γδ fabricado a partir de tres donantes sanos tuvo un promedio de 0,11% ± 0,05% de células B CD20+ y 0,00% ± 0,00% de células T TCR αβ+, cumpliendo así con el criterio de liberación de ≤1% de células T T TCR αβ+. El porcentaje promedio de células NK en el producto final es de 17.06% ± 26.19% y cumple con el criterio de liberación de <35%. Además, el porcentaje promedio de células T y células NK con linaje negativo en el producto final fue de 0,48% ± 0,42% (Tabla 3). La tinción de la superficie celular y el análisis citométrico de flujo se utilizaron para caracterizar la identidad, pureza e impurezas de proceso del DS y DP, como se muestra en la Figura 2A-D.
La expansión secundaria, lograda a partir del cocultivo del aAPC (K562CL6(CD3-CD137L:CD28-IL-15RA)) WCB y γδ T cell DS en una proporción de 10:1, generó un DP de células T γδ que cumplió con todos los criterios de liberación, como se muestra en la Tabla 4. Además, las células fueron teñidas y evaluadas por citometría de flujo en células F2 de centrifugación de contraflujo de día 0, células T expandidas con ácido zoledrónico de día 7, agotamiento de células T de día 7-TCR αβ, DP de día 17 final para el siguiente grupo de biomarcadores de diferenciación (CD)3, TCRαβ, TCR γδ, CD45RA, CD45RO, receptor de quimiocina CC 7 (CCR7), proteína de muerte celular programada-1 (PD-1), proteína 4 asociada a linfocitos T citotóxicos (CTLA4), gen 3 activador de linfocitos (LAG3) y proteína 3 que contiene inmunoglobulina y mucina de células T (TIM3). Los datos que se muestran en la Figura 3 se promedian a partir de tres ejecuciones independientes y demuestran que las células no han alcanzado el agotamiento. El CTF de Moffitt también desarrolló un ensayo residual de K562 para determinar las impurezas de DP relacionadas con los aAPC derivados de K562 (Figura 4).
La estrategia de gating citométrico de flujo utilizada para caracterizar los porcentajes de los tipos celulares fue la siguiente: 1) gating en población negativa de linaje de células T y NK (CD3-CD56-CD16-); 2) puerta en CD71+ (receptor de transferrina expresado en linaje eritroide y LMA que permite la detección de células K562 residuales). Esta estrategia de gating permitió la evaluación de las células CD3-CD16-CD56-CD71+, que son las aAPC (K562CL6(scFv-CD3-CD137;scFv-CD28-IL15-RA)) WCB (denominadas "K562 residuales" en la Figura 4). Esta compuerta permite la enumeración de K562 residual en el DP final multiplicando la frecuencia de K562 residual por el recuento total viable (TVC) del DP (%CD71+ × DP TVC = Células K562 residuales en el DP). Todos los datos citométricos de flujo se informan como la frecuencia de las células vivas. La Tabla 5 y la Figura 4 proporcionan los porcentajes de células T y células NK negativas al linaje, así como las células K562 residuales. Se realizó una prueba t de dos colas para determinar la significación estadística de las diferencias entre estas poblaciones y reveló que había una diferencia significativa entre WCB y γδ T cell DP y entre WCB y γδ T cells (t = 0,0019 para células T y linaje de células NK negativo; t < 0,0001 para K562 residual y t = 0,0314 para células T y linaje de células NK negativo; t < 0,0001 para el residuo K562) (cuadro 5).

Figura 1: Representación esquemática de la estrategia de cierre citométrico de flujo. Abreviaturas: aAPC = , célula presentadora de antígeno artificial; SSC-A = área de dispersión lateral del pico; FSC-A = área de dispersión hacia adelante del pico; SSC-H = altura de dispersión lateral del pico; FSC-H = altura de dispersión hacia adelante del pico; CD = grupo de diferenciación. Haga clic aquí para ver una versión más grande de esta figura.
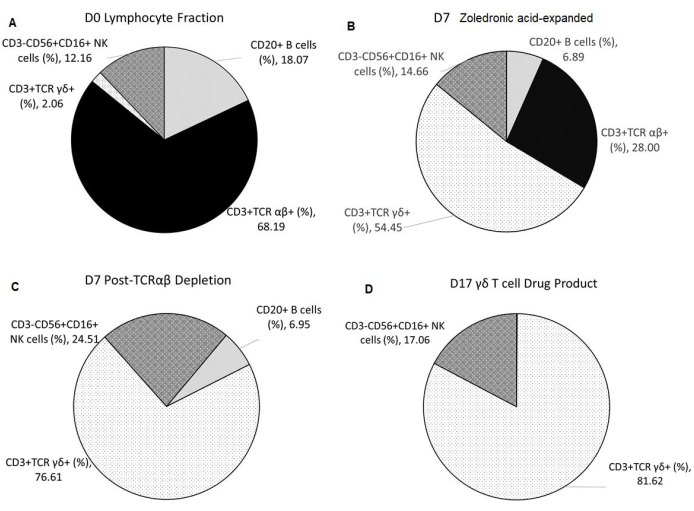
Figura 2: Composición del material de partida, productos intermedios y producto final del medicamento. Todos los datos mostrados se promedian a partir de tres ejecuciones independientes. (A) La aféresis de donantes sanos se somete a elutriación utilizando el dispositivo de centrifugación de contraflujo, lo que resulta en F2 (fracción rica en linfocitos), que se utiliza como material de partida. (B) F2 sufre expansión específica de células T Vγ9Vδ2 durante 7 días con 5 μmol/L de ácido zoledrónico y 300 UI/ml de IL-2 en 1 L de medio suplementado con 10% de suero AB humano. (C) El agotamiento de las células T T-T αβ T se realiza en el producto expandido con ácido zoledrónico. (D) Un producto farmacéutico de células T γδ altamente puro se cosecha después de una segunda expansión de 10 días con aAPCs irradiados en una proporción de 1:10 con 5 μmol/L de ácido zoledrónico y 300 UI/ml de IL-2 en 1 L de medio suplementado con 10% de suero AB humano. Abreviaturas: NK = asesino natural; CD = grupo de diferenciación; TCR= receptor de células T; IL = interleucina; aAPCs = células presentadoras de antígenos artificiales. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Biomarcadores de material de partida, productos intermedios y producto final del medicamento. Las células se recolectan y tiñen para CD3, TCRαβ, TCR γδ, CD45RA, CD45RO, CCR7, PD-1, CTLA4, LAG3 y TIM3 en células F2 de centrifugación de contraflujo de día 0, células T expandidas con ácido zoledrónico de día 7, agotamiento de células T de día 7-TCR αβ, día 17-producto farmacéutico final. Todos los datos mostrados se promedian a partir de tres ejecuciones independientes. (A) Similar al tallo (CD3+, TCR γδ+, CD45RA+, CD45RO-, y CCR7+) mostrado como un número total de células vivas. (B) Memoria central (CD3+, TCR γδ+, CD45RA-, CD45RO+ y CCR7+) representada como un porcentaje de células CD3+ TCR γδ+ . Abreviaturas: CD = grupo de diferenciación; TCR= receptor de células T; IL = interleucina; . CCR7 = receptor de quimiocina CC 7; PD-1 = proteína de muerte celular programada-1; CTLA4 = proteína 4 citotóxica asociada a linfocitos T; LAG3 = gen 3 activador de linfocitos; TIM3 = inmunoglobulina de células T y proteína que contiene el dominio mucina 3. Haga clic aquí para ver una versión más grande de esta figura.
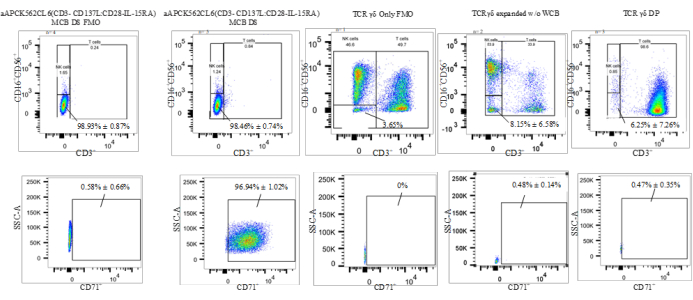
Figura 4: Datos representativos de un ensayo residual K562 (CD3-CD16-CD56-CD71+). Abreviaturas: aAPC = célula presentadora de antígeno artificial; NK = célula asesina natural; SSC-A = área de dispersión lateral del pico; CD = grupo de diferenciación; IL = interleucina; TCR = receptor de células T; MCB = banco de células maestras; FMO = fluorescencia menos uno; DP = producto farmacéutico; WCB = banco de células de trabajo. Haga clic aquí para ver una versión más grande de esta figura.
| Pasos del proceso | Parámetros | Donantes | Promedio | San Dev. | |||
| Ejecutar 1 | Ejecutar 2 | Ejecutar 3 | |||||
| Post-Enriquecimiento (fracción de linfocitos F2) | TVC Todas las validaciones de procesos se sembraron en 109 TVC | 1,00 x 109 | 1,00 x 109 | 1,00 x 109 | 1,00 x 109 | 0.00 | |
| Viabilidad (%) | 98.6 | 96.6 | 92.2 | 95.8 | 3.27 | ||
| Células B CD20+ (%) | 15.6 | 23.4 | 15.2 | 18.07 | 4.62 | ||
| Células T CD3+ (%) | 80.04 | 66.7 | 76.1 | 74.28 | 6.85 | ||
| TCR αβ+ (%) | 77.59 | 58.03 | 68.96 | 68.19 | 9.8 | ||
| TCR γδ+ (%) | 2.48 | 1.59 | 2.1 | 2.06 | 0.45 | ||
| Células NK CD3-CD56+CD16+ (%) | 6.57 | 19.4 | 10.5 | 12.16 | 6.57 | ||
| Linaje de células T y células NK negativo (%) | 13 | 13.7 | 13.4 | 13.37 | 0.35 | ||
Tabla 1: Resumen del enriquecimiento de linfocitos por elutriación reportado como frecuencia de células vivas. Abreviaturas: TVC = recuento total viable; TCR = receptor de células T; CD = grupo de diferenciación; NK = célula asesina natural.
| Pasos del proceso | Parámetros | Donantes | Promedio | San Dev. | |||
| Ejecutar 1 | Ejecutar 2 | Ejecutar 3 | |||||
| Expansión post zoledrónica de 7 días (agotamiento pre-TCRαβ) | TVC | 3,69 x 109 | 1,79 x 109 | 1,42 x 109 | 2,3 X 109 | 1,22 x 109 | |
| Viabilidad (%) | 99.2 | 82.6 | 89.8 | 90.53 | 8.32 | ||
| Células B CD20+ | 2.1 | 11.5 | 7.08 | 6.89 | 4.7 | ||
| Células T CD3+ (%) | 95.7 | 64.1 | 91.9 | 83.9 | 17.25 | ||
| TCR αβ+ (%) | 13.88 | 38.14 | 31.98 | 28 | 12.61 | ||
| TCR γδ+ (%) | 81.44 | 24.93 | 56.98 | 54.45 | 28.34 | ||
| Células NK CD3-CD56+CD16+ (%) | 3.59 | 33.1 | 7.28 | 14.66 | 16.08 | ||
| Linaje de células T y células NK negativo (%) | 0.67 | 2.7 | 0.82 | 1.4 | 1.13 | ||
| Agotamiento post-TCRαβ | TVC | 1,81 x 109 | 4,95 x 108 | 3,80 x 108 | 8,95 x 108 | 7,94 x 108 | |
| Viabilidad celular (%) | 98.8 | 87.6 | 89.8 | 92.07 | 5.93 | ||
| Células B CD20+ | 2.26 | 12 | 6.59 | 6.95 | 4.88 | ||
| Células T CD3+ (%) | 95.8 | 45.3 | 89.7 | 76.93 | 27.56 | ||
| TCR αβ+ (%) | 0 | 0.001 | 0.001 | 0.001 | 0.001 | ||
| TCR γδ+ (%) | 95.61 | 45.07 | 89.16 | 76.61 | 27.51 | ||
| Células NK CD3-CD56+CD16+ (%) | 3.85 | 59.9 | 9.79 | 24.51 | 30.79 | ||
| Linaje de células T y células NK negativo (%) | 0.34 | 1.72 | 0.45 | 0.84 | 0.77 | ||
| TCR αβ+ TVC | 0.00 | 4,95 x 103 | 3,8 x 103 | 2,92 x 103 | 2,59 x 103 | ||
| TCR γδ+ TVC | 1,73 x 109 | 2,23 x 108 | 3,39 x 108 | 7,64 x 108 | 8,39 x 108 | ||
| CD3-CD56+CD16+ NK TVC | 6,97 x 107 | 2,97 x 108 | 3.72E+07 | 1,35 x 108 | 1,42 x 108 | ||
Tabla 2: Resumen de la expansión de células T γδ con ácido zoledrónico y enriquecimiento instrumental reportado como frecuencia de células vivas. Abreviaturas:TVC = recuento total viable; TCR = receptor de células T; CD = grupo de diferenciación; NK = célula asesina natural.
| Atributos del producto | Parámetros | Donantes | Promedio | San Dev. | |||
| Ejecutar 1 | Ejecutar 2 | Ejecutar 3 | |||||
| Día 0 γδ Células T | 2,48 x 107 | 1,59 x 107 | 2,10 x 107 | 2,06 x 107 | 4,47 x 107 | ||
| Día 7 post enriquecimiento γδ Células T | 1,73 x 109 | 2,23 x 108 | 3,39 x 108 | 7,64 x 108 | 8,39 x 108 | ||
| Expansión de pliegues en el día 7 | 69.76 | 14.03 | 16.14 | 33.31 | 31.58 | ||
| TVC en la cosecha* | 8,14 x 1010 | 1,67 x 1010 | 6,84 x 1010 | 5,55 x 1010 | 3,42 x 1010 | ||
| Viabilidad celular (%) | 92.8 | 85.5 | 87.3 | 88.53 | 3.80 | ||
| Células B CD20+ (%) | 0.12 | 0.06 | 0.15 | 0.11 | 0.05 | ||
| Células T CD3+ (%) | 97.8 | 52 | 97.5 | 82.43 | 26.36 | ||
| TCR αβ+ (%) | 0 | 0.001 | 0 | 0.00 | 0.00 | ||
| TCR γδ+ (%) | 97.51 | 50.13 | 97.21 | 81.62 | 27.27 | ||
| Células NK CD3-CD56+CD16+ (%) | 2.16 | 47.3 | 1.71 | 17.06 | 26.19 | ||
| Lincetín de células T y células NK negativo, CD71+ Residual K562 (%) | 0.018 | 0.61 | 0.82 | 0.48 | 0.42 | ||
| Total de células T γδ en la cosecha | 7,93 x 1012 | 8,38 x 1011 | 6,65 x 1012 | 5,14 x 1012 | 3,78 x 1012 | ||
| Expansión total del pliegue de las células T γδ (desde el día 0 hasta la cosecha) | 3,20 x 105 | 5,27 x 104 | 3,17 x 105 | 2,30 x 105 | 1,53 x 105 | ||
| *La validación del proceso se redujo a matraz con 5 células T X 106 γδ y 50 AAPCs irradiadas X106. Los números reportados son para una ejecución proyectada a gran escala si se siembran 24 matraces de la sustancia farmacológica D7 que se utilizó. | |||||||
Tabla 3: Resumen del cocultivo de células T γδ+ con aAPCs y la cosecha expandida de células T γδ+ reportada como frecuencia de células vivas. *La validación del proceso se redujo a un biorreactor de sistema cerrado (capacidad de 1 L) con 5 × 106 células T γδ y 50 × 106 aAPCs irradiadas. Los números reportados son para una ejecución proyectada a gran escala si se siembran 24 matraces de la sustancia farmacológica D7. Abreviaturas: aAPCs = células presentadoras de antígenos artificiales; TVC = recuento total viable; TCR = receptor de células T; CD = grupo de diferenciación; NK = célula asesina natural.
| Parámetro de prueba | Criterios de aceptación | Resultados | ||
| Validación 1 | Validación 2 | Validación 3 | ||
| Viabilidad | ≥ 70% | 92.80% | 85.50% | 87.30% |
| Mycoplasma | Negativo | Negativo | Negativo | Negativo |
| Esterilidad | Sin final de crecimiento (14 días) | Sin final de crecimiento (14 días) | Sin final de crecimiento (14 días) | Sin final de crecimiento (14 días) |
| Tinción de Gram | No se ven organismos (NOS) | NOS | NOS | NOS |
| Endotoxina | ≤ 2 UE/ML | <0,50 UE/ml | <0,50 UE/ml | <0,50 UE/ml |
Tabla 4: Resumen de los resultados de las pruebas de liberación de control de calidad para las células T γδ.
| Ensayo residual K562 | K562 | WCB | γδ Sólo | γδ + Producto WCB | ||||
| Linaje de células T y NK neg. % | K562 residual % | Linaje de células T y NK neg. % | K562 residual % | Linaje de células T y NK neg. % | K562 residual % | Linaje de células T y NK neg. % | K562 residual % | |
| 99.4 | 98.8 | 98.7 | 96.83 | 3.49 | 0.58 | 0.48 | 0.07 | |
| 99.2 | 98.31 | 99.5 | 98.21 | 12.8 | 0.38 | 3.87 | 0.71 | |
| 98.9 | 98.6 | 97.6 | 95.55 | N/A | N/A | 14.4 | 0.63 | |
| 99.2 | 98.9 | 97.9 | 96.53 | N/A | N/A | N/A | N/A | |
| 98.7 | 98.3 | 98.6 | 97.6 | N/A | N/A | N/A | N/A | |
| Promedio | 99.08 | 98.58 | 98.46 | 96.94 | 8.15 | 0.48 | 6.25 | 0.47 |
| San Dev. | 0.28 | 0.27 | 0.74 | 1.02 | 6.58 | 0.14 | 7.26 | 0.35 |
Tabla 5: Porcentajes de K562 negativos y residuales de células T y células NK reportados como frecuencia de células vivas. Abreviaturas: NK = célula asesina natural; WCB = banco de células de trabajo.
Discusión
El Laboratorio de Terapia Celular Moffit ha desarrollado un protocolo con una expansión bifásica de células T γδ altamente puras para su uso como DP en ensayos clínicos. Este protocolo proporciona un método de fabricación bajo las directrices de cGMP en un sistema cerrado que produce un DP de células T γδ altamente puro que se activa y expande con éxito mediante el ácido zoledrónico y los aAPCs WCB. Este protocolo ha sido aprobado por la FDA para la fabricación de un DP alogénico de células T γδ para pacientes con LMA. Utilizando donantes sanos, ampliamos con éxito la pequeña población de células T γδ de donantes en solo 7 días de 2.06 ± 0.45% a 54.45 ± 28.34%. Después de la expansión de 7 días con ácido zoledrónico, se observó que el donante 2 tuvo un aumento en la población de NK.
El ácido zoledrónico inhibe la farnesil difosfato sintasa (FDPS) en los monocitos, lo que, a su vez, conduce a la acumulación de isopentenil pirofosfato (IPP), que se ha correlacionado con un aumento significativo en la proliferación de células T y células NK naturales7,8,9. Este aumento de la población de NK dificulta la 2ª fase de expansión con los aAPCs, ya que los aAPCs solo contribuirán a una mayor expansión de las células NK. Por esta razón, los criterios de donantes se modificaron para excluir a los donantes con poblaciones de NK altas. Después del agotamiento de las células T αβ, las células T γδ se enriquecieron aún más a 76,61 ± 27,51%. Este protocolo único incluye una segunda expansión utilizando los aAPC fabricados por Moffit para dirigirse a los receptores CD8, CD28 y CD127L en las células T γδ. Esta segunda fase de expansión con los aAPCs produjo un DP con ≥65% para células T CD3+TCR γδ+, ≤1% TCRαβ T y <35% células NK CD3-CD16+CD56+. Debido al uso de aAPC derivados de K562, fue necesario demostrar que estos aAPCs comprendían <1% del producto final.
El CTF de Moffit desarrolló un ensayo citométrico de flujo utilizado para los criterios de liberación para medir el porcentaje de células K562 residuales en el DP final. Este ensayo citométrico de flujo mitiga todos los problemas de la utilización de antígenos de superficie celular para identificar las células K562. Como las células T activadas pueden expresar CD71, ideamos una estrategia para excluir todas las células T y células NK mediante la activación de las poblaciones CD3-CD56- y CD16- y luego examinando las células CD71+, que serían exclusivamente células K562. Este protocolo demuestra que el DP de células T γδ produce 0,48 ± 0,42% de células K562 residuales y cumple con todos los criterios de liberación de ≥70% de viabilidad, negatividad de Mycoplasma por PCR, ningún organismo visto por tinción de gram, ≤2 EU/mL de endotoxina y sin esterilidad de cultivo sanguíneo final de crecimiento (14 días).
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a la Oportunidad de Financiamiento Intramural del Premio de Ensayos Iniciados por Investigadores de Inmunoterapias Celulares de Moffitt Cancer Center por proporcionar los fondos para el desarrollo de este protocolo. También agradecemos al Dr. Claudio Anasetti por su invaluable ayuda y orientación a través de este proyecto. Finalmente, agradecemos al Dr. Justin Boucher por sus ideas y revisión del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Hanks Balanced Salt Solution | R&D | 285-GMP | |
| Human Albumin 25% | Grifolis | 65483-16-071 | |
| Plasmalyte A | Fisher | 2B2543Q | |
| Zoledronic Acid (Zometa) | Hos pira | 4215-04--8 | FDA approved drug |
| DMSO | WAK-CHEMIE MEDICAL GMBH | WAK-DMSO-10 | |
| CS10 | BIOLIFE SOLUTIONS | 210374 | |
| 3 mL syringe | BD | 309657 | |
| 10 mL syringe | BD | 309604 | |
| 20 mL syringe | BD | 302830 | |
| 50 mL syringe | BD | 309653 | |
| 100 mL syringe | JMS | 992861 | |
| 18g Needle | Fisher | 305198 | |
| Cryovials 1.8 mL | Fisher | 375418 | |
| 5 mL pipette | Fisher | 1367811D | |
| 50 mL pipette | Fisher | 1367610Q | |
| 10 mL pipette | Fisher | 1367811E | |
| 100 mL pipette | Fisher | 07-200-620 | |
| 15 mL conical | Fisher | 05-539-12 | |
| 50 mL conical | Fisher | 05-539-7 | |
| 250 mL conical | Fisher | 430776 | |
| 600 mL Transfer Pack | TERUMO BCT INC | 1BBT060CB71 | |
| 4" Plasma Transfer Set | INDEPENDENT MEDICSL ASSOCIATES | 03-220-90 | |
| Elutra Tubing Set | TerumoBCT | 70800 | |
| 100 MCS GREX | WILSON WOLF MFG CORP | 81100-CS | |
| Ashton Sterile Pumpmatic Liquid dispensing system | Fisher Scientific | 22-246660 | |
| Acacia Pump boot | MPS Medical In | 17789HP3MLL | |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec Inc | 130-070-525 | |
| Dornase Alpha | Genentech, Inc | 50242-100-40/186-0055 | FDA approved drug |
| 1000 mL 0.22 um Filter | Fisher | 157-0020 | |
| Blood Filter 170um | B.Braun | V2500 | |
| CliniMACs Tubing set | Miltenyi Biotec Inc | 130-090-719 | |
| CliniMACS TCRα/β Kit | Miltenyi Biotec Inc | 130-021-301 | |
| Y-Type blood set | Fenwal | FWL4C2498H | |
| 75 mL Flask | Fisher | 430641U | |
| IL-2 | Prometheus | 65483-116-071 | FDA approved drug |
| AIM-V | Fisher | 0870112BK | |
| Human AB serum | Gemini Bio-Product | 100H41T | |
| 3 Liter Transfer pack | Independent Medical Associates | T3109 | |
| 1000 pipette tips | Fisher Scientific | 5991040 | |
| CF-250 | KOLBio | CF-250 | |
| Elutra | TERUMOBCT | ||
| CliniMACS | Miltenyi Biotec Inc | ||
| GatheRex Liquid Handling, Cell Harvest Pump | WILSON WOLF MFG CORP | ||
| HERAcell Vios CO2 Incubator | Thermo Scientific |
Referencias
- Bejanyan, N., et al. Survival of patients with acute myeloid leukemia relapsing after allogeneic hematopoietic cell transplantation: a center for international blood and marrow transplant research study. Biology of Blood and Marrow Transplantation. 21 (3), 454-459 (2015).
- Bejanyan, N., et al. Clinical outcomes of AML patients relapsing after matched-related donor and umbilical cord blood transplantation. Bone Marrow Transplantation. 49 (8), 1029-1035 (2014).
- Schmid, C., et al. Treatment, risk factors, and outcome of adults with relapsed AML after reduced intensity conditioning for allogeneic stem cell transplantation. Blood. 119 (6), 1599-1606 (2012).
- Siegers, G. M., et al. Anti-leukemia activity of in vitro-expanded human gamma delta T cells in a xenogeneic Ph+ leukemia model. PLoS One. 6 (2), 16700 (2011).
- Airoldi, I., et al. γδ T-cell reconstitution after HLA-haploidentical hematopoietic transplantation depleted of TCR-αβ+/CD19+ lymphocytes. Blood. 125 (15), 2349-2358 (2015).
- Acuto, O., et al. The human T cell receptor: appearance in ontogeny and biochemical relationship of alpha and beta subunits on IL-2 dependent clones and T cell tumors. Cell. 34 (3), 717-726 (1983).
- Xiao, L., et al. Large-scale expansion of Vγ9Vδ2 T cells with engineered K562 feeder cells in G-Rex vessels and their use as chimeric antigen receptor-modified effector cells. Cytotherapy. 20 (3), 420-435 (2018).
- Peters, C., Kouakanou, L., Oberg, H. H., Wesch, D., Kabelitz, D. In vitro expansion of Vγ9Vδ2 T cells for immunotherapy. Methods in Enzymology. 631, 223-237 (2020).
- Xu, Y., et al. Allogeneic Vγ9Vδ2 T-cell immunotherapy exhibits promising clinical safety and prolongs the survival of patients with late-stage lung or liver cancer. Cellular & Molecular Immunology. 18 (2), 427-439 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados