Method Article
クライオ電子線トモグラフィー用デュアルビーム走査電子顕微鏡を用いたガラス質生体試料からのラメラの調製(英語)
要約
集束イオンビームミリングを使用して、凍結した生物学的サンプルを急落させてクライオ電子線トモグラフィー用にガラス体オングリッドラメラを作成します。
要約
ここでは、 熱帯熱マラリア原虫に感染したヒト赤血球の急落凍結グリッドから凍結ラメラを調製するためのプロトコルを示しており、他の生物学的サンプルに容易に適合させることができます。サンプルの調製、粉砕、およびラメラの表示に関する基本原則はすべての機器に共通であり、クライオ電子顕微鏡(クライオEM)およびクライオ電子線トモグラフィー(クライオET)用のオングリッドクライオラメラ調製の一般的なガイドとしてプロトコルに従うことができます。細胞を支持する電子顕微鏡グリッドは、手動または自動プランジフリーザーを使用して液体窒素冷却液体エタンにプランジ凍結され、クライオステージを備えた光学顕微鏡でスクリーニングされます。凍結したグリッドは、集束イオンビームを備えたクライオ走査型電子顕微鏡(クライオFIB-SEM)に移されます。グリッドはフライス加工前に定期的にスパッタコーティングされ、フライス加工中の電荷蓄積の分散に役立ちます。あるいは、電子ビームロータリーコーターを使用して、カーボン - 白金の層をグリッドに適用することができ、その正確な厚さをより正確に制御することができる。クライオFIB-SEM内に入ると、有機白金化合物の追加コーティングがガス注入システム(GIS)を介してグリッドの表面に適用されます。この層は、粉砕時にラメラの前縁を保護し、その完全性は均一に薄いラメラを達成するために重要です。関心のある領域はSEMを介して識別され、ミリングは段階的に実行され、ラメラが電子透過性に達するとイオンビームの電流を減らして、過度の発熱を回避します。次に、複数のラメラを持つグリッドを極低温条件下で透過型電子顕微鏡(TEM)に転送し、傾斜系列を取得します。ラメラ調製のための堅牢で汚染のないワークフローは、細胞クライオEM、クライオET、サブトモグラム平均化などのダウンストリーム技術にとって不可欠なステップです。これらの技術の開発、特に高圧凍結サンプルのリフトアウトと粉砕は、現場で優先度が高いです。
概要
極低温での透過型電子顕微鏡(TEM)によって効果的にイメージングできるのは、厚さ<500 nmの生物学的サンプルの細胞内容物のみであり、標本の範囲をウイルス、原核生物、単純な単細胞生物、およびより大きな真核細胞のより薄い領域に限定します1。オングリッド集束イオンビーム(FIB)ミリングにより、極低温(<-150°C)で、より厚いプランジ凍結生物学的サンプルを電子透過性のラメラに薄くすることができます。得られたラメラは、可視化および断層撮影データ収集のためにTEMに移され、細胞内の細胞および分子的特徴の高解像度3D再構成を可能にする(レビューについては、Rigort et al., 20122、Oikonomou et al., 20163、およびWagnerら, 20204を参照)。
FIBミリングは、サンプルが定期的に薄くなり、下流の分析に備える材料科学の分野から生まれました5。これは、従来の走査型電子顕微鏡光学系と、FIB-SEMと呼ばれる集束イオンビーム(FIB)を生成して細かく制御できる光学系を含む2番目のカラムの2つの光学カラムを備えた走査型電子顕微鏡(SEM)で行われます。これにより、試料の特定の領域をガリウム源によって生成されたイオンによってアブレーションし、余分な物質を除去し、ラメラ6を残すことができる。フライス加工プロセスは、サンプルのトポグラフィーのSEMイメージングによってガイドされ、関心のある領域を特定し、フライス加工の進行状況を監視するために使用されます。生物学的用途の場合、基本的なセットアップはほぼ同じですが、粉砕は極低温で行われます。これには、標準的なFIB-SEMを、一定の温度と低い表面汚染率を維持する低温冷却ステージと、失透や汚染なしにサンプルの移動を容易にするエアロックを備えているように適合させる必要がありました。サンプルシャトルも変更され、TEMグリッド、プランシェット、キャピラリーなど、クライオFIB-SEM内にさまざまなキャリアを取り付けることができます。いくつかの主要な研究者グループは、これらの方法の開発とこの分野における継続的な技術的進歩の中心となっています7,8,9,10,11,12。市販のソリューションは、極低温での生物学的FIBミリングのためにより広く利用可能であり、最適化されたサンプルを考えると、ラメラのオングリッドミリングはより日常的になりつつあります。
さまざまな室温およびクライオ電子顕微鏡技術を使用して、多細胞生物全体から、適度な解像度での複雑なプロセスのコンテキストの理解、さらに詳細な決定まで、生命のあらゆるスケールにわたる細胞情報を視覚化できます。 in situ 分子構造13,14,15,16,17,18,19.古典的な室温技術には、TEMによる細胞形態の分析のための超ミクロトミーによる固定および染色された樹脂埋め込み細胞および組織の切片化が含まれる(レビューについては、Studer et al., 2008を参照のこと20).ナイフ(シリアルブロックフェースイメージング)または集束イオンビームのいずれかで材料を徐々に除去する前に、保存された細胞のブロックの表面を画像化するためにSEMによる二次電子散乱を利用する代替技術が開発されている21,22,23.この技術は、細胞または組織の硝子体の染色されていないブロック上のクライオFIB-SEMを用いて、極低温(クライオボリュームイメージングと呼ばれる)でも首尾よく実装されています24.あるいは、より厚いラメラ(~15 μmの厚さ)を粉砕し、STEMイメージングによって研究することもできます25.これらの技術を使用すると、多くの細胞を含むブロック全体を画像化して集団情報を収集したり、臓器/生物全体を画像化して3Dで再構築したりできます。ただし、細胞から高分解能の分子情報にアクセスするには、サンプルを天然に近い凍結水和状態で保存する必要があるため、極低温条件下で調製する必要があります。ガラス体切片のクライオ電子顕微鏡(CEMOVIS)は、生体材料の高圧凍結ブロックを極低温条件下でウルトラミクロトームで切片化する技術です。これにより、クライオセクション(厚さ40〜100 nm)のリボンが生成されます26これはEMグリッドに取り付けられ、TEMで画像化されます。ただし、ナイフと硝子体サンプルとの物理的相互作用により、クレバスおよび圧縮アーティファクトが発生し、細胞構造が大幅に歪む可能性があります27,28,29,30.厚い切片はこれらのアーチファクトの影響を受けやすく、~70 nmより厚い切片を使用することは実用的ではありません26.この制限は、断層撮影における生物学的構造の3Dビューを大きく制限する。極低温でのFIBフライス加工ではこれらの問題は発生しませんが、試験片の部品間で異なるフライス加工速度によって引き起こされる独自のアーティファクトがあり、カーテンと呼ばれるラメラ内の厚さが変動します。この問題は、フライス加工中にラメラの前端を保護するガス注入システム(GIS)を介して塗布された有機白金コートを適用することによって軽減されます31.オングリッドFIBフライス加工のサンプル厚さの上限は、ガラス質を維持しながら試料を急落凍結する能力によって定義されます32ただし、クライオリフトアウト技術と生物学的試料に適合したサンプルキャリアの導入により、FIBミリングを使用して高圧凍結サンプルを処理することもできます31,33,34,35.さらに、プランジ凍結サンプルは、必要な倍率で傾斜系列を収集するのに十分な表面積を提供する妥当なサイズのラメラを生成するのに十分な生物学的材料が必要であるため、薄すぎることはできません。この問題は、細菌や酵母などの小さな細胞の塊を粉砕することで軽減できます。最終的なラメラの厚さ(~100-300 nm)は、通常、サンプルの完全性と粉砕戦略によって決まります。薄いラメラは、サブトモグラム平均法などの高解像度の構造作業に適していますが、厚いラメラはCEMOVISで達成できるよりもはるかに大きな細胞量を含み、ネイティブに保存されたサンプルに近い細胞コンテキストを提供します。FIBミリングは、電子回折研究のためにプランジ凍結タンパク質結晶を薄くするためにも使用できます36.
硝子体細胞のFIB粉砕は、科学的な問題が その場で天然に近い標本の高解像度の分子詳細を必要とする場合、実行する時間と労力の価値があります。ラメラのルーチン生産のためのより多くの施設へのアクセスにより、律速ステップは多くの場合、粉砕前のサンプルの最適化であり、サンプルがガラス質であり、堅牢で均一に薄いラメラを生成するために適切な厚さを確保するために時間をかける必要があります。ここでは、マラリアの原因物質である 熱帯熱マラリア原虫 に感染したFIB粉砕プランジ凍結ヒト赤血球のサンプル最適化について説明しますが、このアプローチは任意のサンプルに適用できます。
プロトコル
ヒトの血液は、英国国立血液移植サービスを通じて匿名化されたドナーから入手され、受領後2週間以内に使用されます。その使用に倫理的な承認は必要ありません。
1. 熱帯熱マラリア原虫感染赤血球の準備と急落凍結
- 70%(v / v)等張密度勾配培地上で遠心分離(1,580 x g)によって成熟シゾントを単離します(ヒト赤血球で熱帯 熱マラリア原虫 の無性血液ステージを培養する方法の標準的な手順については、Blackman M.J.、1995、37を参照してください)。
- 風乾した薄い血液フィルムを100%メタノールでスライドガラスに固定し、シゾントの形態学的均一性を確認してから、6.7 mMリン酸緩衝液、pH 7.1中の10%ギムザ染色で染色します。
注:特定の出口で失速したシゾントの調製を強化するために、シゾントを化合物2およびE64阻害剤とさらに同期させることができます(これらの阻害剤の効果の説明については、 代表的な結果 と 図1 を参照してください)。
注意: 熱帯熱マラリア原虫 はヒト病原体であり、地域の健康と安全のガイドラインに従って、適切な封じ込め施設でのみ取り扱う必要があります。 - シゾント(240 x g)を穏やかに遠心分離してペレット化し、RPMI培地の細胞ペレットの2倍の容量に再懸濁し、50%ヘマトクリット懸濁液を生成します。
- 手動プランジ凍結リグで、グロー放電(グロー放電ユニット設定を使用、空気中30 mA、グリッドのカーボン側のみを処理する)2/4穴カーボンフィルムを備えた200メッシュ銅グリッドのカーボン側に2.5 μLのシゾントを塗布し、エッジが破れたグレード1のろ紙を使用してグリッドの背面から~20秒間吸い取ります。液体窒素冷却液体エタンに突入し、グリッドをストレージに移します(この研究で使用した機器の材料表を参照)。
注:実験はここで一時停止することができ、グリッドは液体窒素の下に無期限に保管することができます。
注意: 液体窒素は窒息剤であり、凍傷を引き起こします。酸素モニタリングを備えた適切な環境での取り扱いには注意してください。
注意: 液体エタンは重度の火傷を負い、可燃性です。発火源から離れたドラフトで使用します。
注:急落冷凍シゾントはもはや実行可能ではありません。これは、凍結されていない対照と比較して、空気解凍された急降下凍結シゾントのいくつかの金のグリッドでヒトの血液をインキュベートし、数日後に寄生虫の成長を観察しないことによって決定されました。したがって、シゾントの凍結グリッドは、通常の安全および除染手順(手袋、>70%エタノールによる表面/ツールの滅菌、および>70%エタノール中のグリッドの廃棄)を使用して、封じ込め施設の外で安全に取り扱うことができます。 - 光学顕微鏡用のクライオステージを使用してグリッドをスクリーニングし、グリッド全体の氷の勾配に特に注意を払います。氷の薄い領域で、個々のグリッドの正方形のセルカバレッジを確認します。
注:最適な正方形は、グリッド正方形の中央にある1セルの厚さである必要があります(図2)。これにより、グリッドバーに対してエッジの厚い氷に当たることなく、正方形の中心を横切ってラメラを粉砕できます。実験はここで一時停止することができ、グリッドは液体窒素の下に無期限に保存することができます。細胞が蛍光マーカーを保有している場合、グリッドをクライオクレムでスクリーニングして、目的のX/Y位置を特定することもでき、クライオFIB-SEMのグリッド位置と相関させてダイレクトミリングすることができます。
2.プランジ凍結細胞のオングリッドFIBミリング
- クライオFIB固有のオートグリッドリムの前面に黒い消えないマーカーペンでマークを付けて、カットアウェイセクションの中心とリムの反対側を示します(図3)。クリッピングステーションをセットアップし、グリッドをマークされたリングのカーボン側を下にしてクリップします。
- クライオFIB-SEMシャトル(シャトルに応じて通常2グリッド)のカーボン側を上にしてグリッドをロードし、アルゴン雰囲気(5 x 10-2 mbar)(60秒間5 mA- 厚さは可変)またはカーボン/プラチナ電子ビーム回転コート(~4 nmの厚さ)でプラチナスパッタコートをセルの表面に塗布します。
注:どちらのタイプのコーティングも、SEMイメージング中の電荷分散を助けます。電子ビームロータリーコーターの利点は、コーティングの正確な厚さを指定できることです。 - シャトルをクライオFIB-SEMにロードし、5 kV(13 pAまたは25 pA)のSEMによって各グリッド上の細胞分布を評価します。低倍率の概要(~100倍)を取得して、グリッド全体の氷の勾配を確認します。次に、高倍率(~5,000倍)の画像を撮影して個々のグリッドの正方形を調べ、目に見える細胞の特徴とミルへの表面汚染が少ないグリッドの領域を特定します。
- ガスインジェクションシステム(GIS)を使用して、各グリッドの表面に>2 μmの有機白金コートを塗布します。これを行うには、GIS針をグリッドの上のチャンバーに挿入し、有機白金源を設定温度に設定時間(たとえば、~27°Cで3〜10秒)加熱して蒸気の流れを生成します。
注:GIS針を介した有機白金コートの塗布角度、温度、およびタイミングは、均一なコーティングを最大化するように最適化する必要があります。これは、使用する特定のクライオFIB-SEMによって異なります(詳細については、 代表的な結果 を参照してください)。 - グリッドの平面がイオンビームの入射角から~10°になるようにサンプルを傾け、SEM画像とFIB画像の両方で見られるように適切なグリッド正方形の中心を移動します。
- 低電流(公称1.5 pA、30 kV)でイオンビームを使用してグリッドを調査し、グリッド正方形の中心にあるセルを視覚化するのに十分な高倍率(~7,000倍)に移動します。最初のフライス加工電流(300 pA)でサンプルに焦点を合わせ、非点収差を補正します。明るさとコントラストを調整し、厚さ3 μmの保護領域の上部と下部の2つの長方形パターンをフライス加工し、その中心が最終的なラメラの目的の位置になります。
注:パターンの選択した幅は、周囲のセル層のトポグラフィーとセルサイズによって異なります。7〜20μmはシゾントに適した幅ですが、ラメラが広いほどフライス加工に時間がかかります。最初のフライス加工ステップで選択したパターンの高さは、約6μmから始まるサンプルの厚さによって異なります。これはフライス加工中に調整する必要がある場合があります。フライス加工は、パターンの外側の上端と下端からラメラの面に向かって方向に行われます。これは並行して行うことができ、両方のパターンを同時にまたは順番にフライス加工し、最初にラメラの上から材料を除去し、次に下から材料を除去します。 - 最初の電流でフライス加工を開始します。イオンビームビューでライブの進行状況を監視し、SEM(5 kV、13または25 pA)で断続的に監視します。イオンビームが保護領域の上下のサンプルを突き破ったことを確認します。そうでない場合は、長方形のパターンの高さを増やして、より多くの材料を削除します。ラメラの上下の表面がイオンビームビューで完全に滑らかになったら停止します。
注:長方形のパターンの内側に焦点面に特徴が含まれていない場合、イオンビームは保護領域の上下のサンプルを突き破っています。グリッド バーなどの一部のフィーチャは、背景で焦点が合っていない状態で表示される場合があります。 - 次のフライス電流(100 pA)に変更します。明るさ/コントラストに焦点を合わせて調整します。2つの長方形パターン間のスペースを1.5 μmに減らし、パターンの高さを小さくして、フライス加工されていない材料のみをカバーします。ラメラの上下の表面が完全に滑らかになるまで、新しい電流でフライス加工を開始します。
- 厚さ0.3μmに達するまでこのプロセスを段階的に繰り返し、 表1のミリングスキームに従って毎回イオンビーム電流を減らします。
- 片方または両方のグリッド上で複数のラメラ(量はサンプルの厚さと利用可能な時間に依存します)を0.3 μmの厚さに粉砕し、各ラメラのX/Y/Z位置を記録し、セッションの最後に~1-2時間予約して、ラメラを最終的な厚さ(60-200 nm)に研磨します。
- グリッド全体の低倍率SEMの概要を取得し、グリッドの前面(イオンビーム源に近い)のラメラからグリッドの背面(イオンビーム源から最も遠い)のラメラまでの研磨ルートを計画します(図5)。
注:これにより、研磨されたラメラの表面へのアブレーションされた材料の再堆積が減少します。 - 2つの長方形パターン間のスペースを100〜200nmに減らし、30pAのイオンビーム電流で最終研磨ステップを開始します。2-3 kV(13 pA、ドウェル= 300 n、3072 x 2048、フルフレームの場合は~2秒)でSEMで進行状況を監視し、SEMによってラメラのコントラストが失われたとき、またはラメラ自体の有機白金コートが完全性を失い始めたときに研磨を停止します。
- グリッドを削除する前に、グリッド全体の低倍率SEM画像を取得し、各ラメラの画像を保存します。それらを使用して、後でTEMでグリッドをクロスチェックします。ここで実験を一時停止し、液体窒素の下にラメラ付きのグリッドを保管します-取り扱いには注意してください。
注:グリッドは、クライオFIB-SEMから取り外すときに軽くスパッタコーティングすることができ、高倍率でのTEMでのドリフトと帯電を制限するのに役立ちますが、スパッタコーティングが多すぎるとラメラ内の生物学的内容物が不明瞭になる可能性があるため、これは慎重に行う必要があります。この段階でラメラの蛍光をスクリーニングすることが可能です。しかしながら、十分なシグナルを得ることは、ラメラの厚さ内の標識タンパク質の存在量に依存するであろう。ラメラへの損傷を制限し、表面の汚染を防ぐために、グリッドの取り扱いには細心の注意を払う必要があります。
3. チルト級数集録とデータ処理の概要
- グリッドをTEMにロードし、フライス加工方向をステージの傾斜軸に垂直に合わせます。
注: グリッドの位置合わせは、オートグリッド リムのマークを使用して目視で行われます。~10°の誤差は許容範囲であり、そうしないと、グリッドが傾くと、ラメラの両側のトレンチの壁がラメラを覆い隠す可能性があります。 - グリッド全体の低倍率マップ(~150倍)を取得し、ラメラを見つけます。次に、各ラメラの中倍率マップ(ラメラのサイズに応じて~1,500倍)を取得し、関心のある領域を特定します。
- グリッドを±10°傾けて、ラメラの平面(グリッドではない)を光軸に垂直にします
注:プレチルトの方向は、低倍率および中倍率マップでのラメラの前端の位置(残りの有機白金コートを探す)によって決定できます。ここで使用するTEMの場合、ラメラの前端がマップ内で上を向いている場合はグリッドに+10°のプレチルトが必要であり、下を向いている場合は-10°のプレチルトが必要です。各グリッドは、どのようにピックアップされてオートローダに挿入されたかによって異なる場合があります。 - 線量対称チルトシリーズ38 (たとえば、-54°から+54°、3-5°刻み)を、関心領域に必要な視野と解像度の両方を可能にするピクセルサイズで取得します。-2〜-5μmの範囲の焦点ぼけ値を使用します。各増分で3〜10フレームのムービーを収集し、このために、ピクセルサイズに応じてこれらのパラメータを調整して、~150 e-/Å2 (300 kV TEMの場合)の総線量を蓄積します。
注意: ラメラの亀裂は、これらの領域がドリフトする可能性があるため、避ける必要があります。表面の汚染は、高傾斜で関心領域または焦点領域を覆い隠す可能性があるため、避ける必要があります。 - モーションは、MotionCor239などのプログラムを使用してムービーを修正します。補正された画像(累積e-/画像)40 に線量重み付けフィルタを適用し、CTFFIND441などのプログラムを用いて各画像の焦点ずれを推定する。
- at etomo(IMOD)42 などのプログラムでフィデューシャルレスアライメント(パッチトラッキング)を使用して、傾斜系列の画像のアライメントと角度関係を計算します。
- アライメントと回転情報を、デフォーカス値とともに、3次元CTF補正を適用できるプログラム、たとえばNovaCTF43に入力します。補正された断層写真を計算して、下流の分析に関連するビニング係数を含む出力断層図を取得します。
- 再構成を分析し、フィルタリング、セグメンテーション、サブトモグラム平均化などのダウンストリーム処理に備えます。
結果
急落凍結のための熱帯熱マラリア原虫の準備
化合物2およびE64阻害剤は、出口の異なる段階でシゾントを失速させるために使用され、その後の研究のために豊富なシゾントの集団を生成する。相補的な相関技術がなければ、プロセスが本質的に盲目であるため、特定の細胞内ターゲットまたは細胞タイプの粉砕が困難であるため、これは重要です。化合物2は、液胞破裂の前に退出を停止するプロテインキナーゼ阻害剤である。シゾントは化合物2上で4時間同期し、次いで化合物2を含まない培地で洗浄して阻害剤を除去することができ、その時点でシゾントは約30分後に成熟して排出されます。あるいは、化合物2同期シゾントを不可逆的な広域スペクトルシステインプロテアーゼ阻害剤であるE64に洗浄し、液胞破裂点後、宿主細胞破裂前に約1時間インキュベートして退去を停止させることができます。処理されたシゾントの形態と均質性は、急落凍結の前にギムザ染色血液塗抹標本によってチェックする必要があります(図1)。シゾントは、この公報に記載されている方法を使用して、これらの状態のいずれかで急降下凍結することができます。

図1:ギムザ染色血液塗抹標本による化合物2およびE64失速 した熱帯熱マラリア原虫 の形態。 (A)化合物2の存在下で、寄生性液胞(PV)は、ヘモゾイン結晶の単一のクラスター(暗褐色の円)を有するメロゾイト(紫色の円)で密集している。宿主赤血球(hRBC)(灰色のバンド)におけるPVと周囲のヘモグロビンとの間の境界は、hRBC膜と同様に明確に定義されている。(B)E64の存在下では、PV膜が破裂し、メロゾイトがhRBC内に広がります。各シゾントはまだヘモゾイン結晶の単一のクラスターを含んでいます。宿主細胞膜は漏出性があり、部分的に崩壊しているため、細胞周辺にはヘモグロビンは見えず、hRBC膜の境界は容易に見えません。スケールバー、5 μm。 この図の拡大版を表示するには、ここをクリックしてください。
プランジ凍結の最適化
熱帯熱マラリア原虫感染赤血球のブロッティング条件の最適化中に、金および銅の200メッシュグリッド上の2/2、3/3、3.5/1、および5/2(正方形)の穴状炭素を含む、さまざまな穴サイズのグリッドが試行されました。2/4穴の炭素膜を備えた200メッシュの銅ファインダーグリッドは、長いガラス質のラメラを粉砕するのに適切な厚いセル層を提供します。穴が大きいか小さいかは、一般に、それぞれセル層が薄すぎたり厚すぎたりします(図2A-C)。2/4ホールカーボンでは、グリッドを背面(非カーボン側)から吸い取ることによってシゾントが2μmの穴から引っ張られ、その結果、細胞がカーボン膜の上下に突き出ます。穴の間に4μmのカーボンが伸びると、結果として生じるラメラのほとんどの中央にカーボンのストリップが走り、強度が増します。ファインダーグリッドは相関およびスクリーニングの目的に最適です44が、メッシュ設計の数字/文字が大きすぎないように注意する必要があります。
手動プランジャーでのブロッティング時間は約20秒ですが、ブロッティングを停止する正確なポイントは、グリッドから引き出される液体の液滴がろ紙上に広がるのが止まったときに目で判断されました。ブロッティングプロセスを開始するために、液滴の表面張力を破るために破れたエッジが必要でした。この研究では自動プランジフリーザーは使用されていませんが、このサンプルの合理的な出発点は、手動プランジャーに使用されているのと同じ体積のセルとグリッドタイプを使用し、高湿度(~70%)と周囲温度(~25°C)の条件でグリッドを背面からブロストすることです。ブロッティング時間と条件は、使用する特定の自動化システムに合わせて最適化する必要があります。
熱帯熱マラリア原虫の急落凍結グリッドは、試料が電子に伝達されないため、TEMではなくクライオステージを備えた光学顕微鏡によってスクリーニングされました。より薄いサンプルの場合、サンプルをクライオFIB-SEMに移す前に、TEM(~150倍の倍率で全グリッドアトラス)でグリッドをスクリーニングすることができ、これは国の施設にアクセスするための前提条件となる可能性があります。グリッド全体および個々のグリッド正方形内の氷の厚さの勾配に特別な注意を払う必要があります。適切なグリッド正方形は、1セルの厚さであるか、その中心で炭素膜に当たる必要があります(図2C)。これにより、グリッドスクエアのエッジの周りのグリッドバーに対して厚い氷を粉砕することを回避し、イオンビームがセル層の上下を突破し、くさびではなく自由なラメラを生成します。再現性のあるブロッティングおよびプランジ凍結条件が最適化されると、通常、FIBミリングの前にスクリーニングは不要になります。
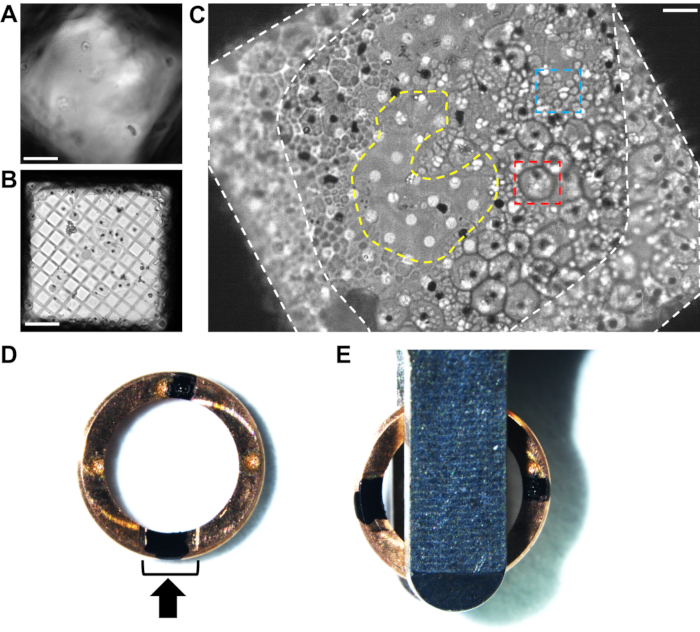
図 2.凍結した 熱帯熱マラリア原虫の グリッド上の細胞分布をクライオライト顕微鏡で解析。 (A)クライオライト顕微鏡によるグリッド正方形を横切る氷が厚すぎて、細胞と炭素膜を覆い隠している例。スケールバー、10 μm。 (B)穴のサイズ(5/2四方の穴のある炭素膜を備えた300メッシュの銅グリッド)が細胞に対して大きすぎるため、氷のない空の領域に囲まれた生物学的材料の非常に薄い層が得られる例。このようなグリッドは、非常に短く不安定なラメラを生成します。スケールバー、10 μm。 (C)2/4穴カーボン膜を有する200メッシュ銅グリッド上の良好な細胞分布の例。これらのシゾントをE64阻害剤で処理した。明確に定義された周辺を持つ大きな細胞(赤い箱、直径~5μm)は、まだ無傷の液胞膜を持っている感染した赤血球です。小細胞のクラスター(青いボックス、~1 μm)は、部分的に崩壊した宿主赤血球内に含まれる個々のメロゾイトです。各シゾントの中心には黒い斑点があり、ヘモゾイン結晶の位置を示しています(詳細については 図1 を参照してください)。細胞形態の違いは、クライオFIB-SEM内で一度見るのはそれほど簡単ではありません。したがって、クライオライト顕微鏡による事前スクリーニングは、再現性のあるブロッティング条件に達するまで有益です。グリッドバーの隣のグリッド正方形のエッジの周りのセルカバレッジ(白い破線の領域)は、ミリングするには厚すぎます。グリッドの正方形の中央にある薄い領域(黄色の破線の領域)は、ラメラを細胞の周囲の層に伸ばして、製粉するのに理想的な場所です。スケールバー、6 μm。 (D)12時位置と6時位置に、1つはカットアウェイセクション(黒ブラケット)内、もう1つは反対側の2つの黒いマークが付いたクライオFIB固有のオートグリッドリムの画像。黒い矢印はミリング方向を表します。(E)グリッドをオートローダーカセットにロードする場合、マークはローディングピンセットの両側に等距離にある必要があり、その結果、ラメラはステージの傾斜軸に垂直になります。 この図の拡大版を表示するには、ここをクリックしてください。
断層撮影用のクライオFIB固有のオートグリッドリムのマーキング
通常、グリッドはフライス加工の前にオートグリッドリムにクリップされ、取り扱いを容易にし、剛性を提供し、後続の転写ステップ中の損傷からラメラを保護します。CryoFIB固有のオートグリッドリムは、フライス加工中により多くのグリッド面にアクセスできるようにカットアウェイ機能を備えて設計されています。TEMのチルト軸に垂直にフライス加工方向を向けて、ラメラをその長さに沿って回転させることでチルト系列取得が進行するようにすることが重要です。これにより、ラメラを囲むトレンチの高い壁が、グリッドが傾いているときに生物学的情報を覆い隠さないことが保証されます。
通常、オートグリッドリムは、クライオFIB-SEMシャトル内および後でTEMをロードするときに視覚的な位置合わせに役立つようにマークされています。これらのサンプルでは、12時位置と6時位置に消えないマーカー( 材料表を参照)で2つのマークが適用され、1つはクリップリングのカットアウェイセクションの中央に、もう1つは真向かいに付けられました(図2D)。TEMにロードするとき( 材料表を参照)、両方のマークがローディングピンセットの両側に表示され、ピンセットの端に対して90°位置合わせされている必要があります(図2E)。イオンビームの近くにある特定のインクがフライス加工を妨げる可能性があるため、製造業者はオートグリッドリムに刻まれたドットを使用してグリッドを整列させることを推奨していることに注意する必要があります。
クリップされたグリッドは、クライオステージ用に変更されたカセットを使用して光学顕微鏡でスクリーニングすることができ、クリッピングプロセスがグリッドの炭素膜を破壊していないことを確認するのに役立ちます。サンプルカセットによっては、クリップされていないグリッドもフライス加工できますが、クライオFIB-SEMからTEMへの転送時には、ラメラが破損するため、グリッドの曲がりを制限するように細心の注意を払う必要があります。クリップされていないグリッドは、サイドエントリークライオホルダーによってTEMにロードできますが、フライス加工後にクリッピングを実行すると、ラメラが破損する可能性が高くなります。
有機白金コーティング
有機白金コーティングは、クライオFIB-SEMにロードされた後、一方または両方のグリッド上で実行されます。ガス注入システム(GIS)の針をサンプルの上のチャンバーに挿入して、加熱源からグリッドの表面を横切って有機白金蒸気の流れを一定時間導きます。蒸気は冷たい表面で凝縮し、固体層(~2μmの厚さ)を形成します。このコートの完全性は、均一に薄いラメラを粉砕できるようにするために重要です。有機白金コートの最適な塗布条件は、通常、機器の製造元によって事前に決定されていますが、それでもある程度の最適化が必要になる場合があります。ほとんどのシステムは、チャンバー上のポートの形状とステージの回転限界に応じて、GIS針をフライス加工方向に近づけるか、フライス加工方向に垂直に位置合わせします。グリッドをコーティングし、小さな領域をフライス加工し、ステージを傾け、SEMでコートの厚さを測定することで、さまざまな設定を試すことができます。
クライオFIB-SEM自体のセットアップだけでなく、1)サンプルのトポグラフィー、2)グリッド上の表面汚染、3)GIS針からの蒸気流の再現性など、他の多くの要因が有機白金コートの適用に影響を与える可能性があります。GIS フローは方向性があるため、不均一なトポグラフィーにより、セルの影にある領域や表面汚染がコーティングされていないか、コートが薄くなる可能性があります。これにより、研磨中に有機白金層が崩壊する可能性があります(図3)。粉砕する領域を選択する際には、周囲の地形、例えば、大きな表面汚染、セルの塊、またはグリッドの表面から数グリッドの正方形まで突き出た壊れた炭素は、蒸気の流れを妨げ、より薄い有機白金の影を作り、ラメラを弱める可能性があります。さらに、ラメラの前端近くの表面汚染の非常に小さな粒子も、フライス加工中に飛び出し、裸の氷の弱体化したパッチを残し、研磨中にラメラに穴が開く可能性があるため、避ける必要があります。最後に、フライス加工が始まり、有機白金コートが不安定に見える場合は、もう一度コーティングするか、バックアップグリッドに交換します。

図3:薄く均一に粉砕されたラメラを得るためには、高品質の有機白金コーティングが不可欠です 。 (A)有機白金コーティング(OP、黄色)が薄く塗布されすぎて、研磨中にラメラの前縁に穴が開いたラメラの前縁の穴(緑色の円)とラメラの幅全体にわたる不均一なフライス加工(スジ)につながるラメラの前縁の顕微鏡写真。有機白金の表面はイオンビームによってせん断され、コーティングの前縁の後ろに材料がスプレーされます(黄色の破線)。(B)有機白金コート(OP)をより厚く塗布し、より均一に薄くしたラメラを実現しました。コートの完全性はラメラの全幅にわたって維持され、有機白金コートとガラス化した生物学的材料との間の界面は明確に定義されています(黄色の破線)。カーボン層はラメラ(オレンジ)の後部を通って走っているのを見ることができます。スケールバー、1 μm。 この図の拡大版を表示するには、ここをクリックしてください。
クライオFIB-SEMにおけるグリッド品質の評価とフライス加工のプロセス
グリッドがクライオFIB-SEMに転送されると、炭素膜の完全性およびグリッド上の細胞の分布をSEMによってスクリーニングすることができる(図4A-C)。氷の勾配、グリッドバーの位置、ファインダーグリッド上のグリッド番号の位置は、30 kVの低倍率SEMで確認できますが(図4B)、高倍率でミリング位置を特定し、ミリングプロセスを監視しながら電圧を5 kVに戻して、表面トポグラフィーからのコントラストを高める必要があります。

図4:クライオFIB-SEMでグリッドの品質を評価し、粉砕する領域を特定します 。 (A)SEMを介した5kVでのグリッドの低倍率の概要。オートグリッドリムのカットアウェイセクションは、画像の下部に表示されます。スケールバー、0.5 mm。 (B)SEMによる30 kVでの同じグリッドで、より厚い氷(より暗いグリッドの正方形)とより薄い氷(より薄いグリッドの正方形)の領域を示しています。挿入図はボックス内の領域を示し、矢印は30kVで表示されるファインダーグリッド上の番号付けを示します。スケールバー、0.5 mm。 (C)炭素膜上のセルの分布とグリッドバーの位置を評価する2つのグリッド正方形の中倍率の概要。スケールバー、50 μm。 (D)高倍率での最初のカットのミリングパターンの配置(1.5 pAおよび30 kVでのイオンビームビュー)。赤色の領域(厚さ3μm)は保護され、黄色の領域はイオンビームによってアブレーションされます。白い破線は、最終的なラメラの位置を示します。スケールバー、10 μm。 (E)研磨された厚さ200 nmのラメラ(幅10 μm×長さ15 μm)のSEMを介した3 kVでの高倍率図。3 kVでのラメラ内のコントラストの損失は、適切な厚さに達したことを示しています。明るい白色の前縁は、フライス加工の前にGISを介してグリッドに適用される残りの有機白金層です。スケールバー、5 μm。 (F)30 kVおよび1.5 pAのイオンビームを使用して見た(E)と同じラメラ。黒い四角形を横切る細い白い線(白い矢印)は、ラメラの最前端に残っている有機白金コートです。スケールバー、10 μm。 この図の拡大版を表示するには、ここをクリックしてください。
ミリングする領域は、イオンビームビュー(図4D)で保護領域の両側に高倍率(シゾントの場合は~7,000倍)で一対の長方形パターンを配置することによって選択されます。表面汚染の粒子がミリング領域の近くに付着していないことは、保護有機白金コートの適用を覆い隠している可能性があるため、重要です。また、領域の地形が、最終的な厚さが達成された後のラメラの側面をサポートするのに適していることも重要です。
マラリアシゾント(細胞サイズ:直径~5μm×厚さ2μm、円盤状)の場合、幅7〜20μmのラメラを粉砕することができます。細胞層が適度に厚い場合、ラメラは通常、長さが~10-15μmになり、カーボン層の上下に複数の細胞を捕捉します(図4E-F)。8時間のセッションで5〜10個のラメラをフライス加工することが期待できます(6〜7時間のフライス加工と1〜2時間の研磨)。これは、サンプルの厚さとラメラの幅によって異なり、サンプルが厚く、ラメラが広いほど、フライス加工に時間がかかります。損傷したグリッドでも、ラメラのセットを生成するために必要なのはほんの一握りの優れたグリッド正方形であるため、フライス加工できます(図5A)。さらに、サンプルが予想よりも薄い場合、たとえば、培養物のオーバーブロッティングまたはヘマトクリット値の変動により、短いラメラを比較的迅速に粉砕できます。ただし、長さが短いと、TEMでのデータ収集に使用できる領域が制限されます(図5B)。

図5:フライス加工中に最終的なラメラの厚さに達した時期の決定 。 (A)クリッピング中の炭素損傷を示す5kVのSEMによるグリッドの低倍率の概要。損傷していない領域には、オーバーブロッティングのために非常に薄いサンプルが含まれていました。しかし、クライオFIBSEMの終日のセッションで、このグリッド(白い破線の輪郭内の領域)で6つのラメラを粉砕することは依然として可能でした。スケールバー、0.5 mm。 (B)このグリッド(3 kVのSEM)から生成された短いラメラ(幅~10 μmx長さ3 μm、有機白金層を除く)で、チルトシリーズを収集するための2つの領域を提供しました。スケールバー、25 μm。 (C)最終研磨ステップ中のラメラの一連のSEM画像(3 kV)は、ラメラが薄くなる(左から右に移動する)ときにラメラのコントラストがどのように失われるかを示しています。すべての画像のラメラの中央を横切る濃い黒い線は、グリッドからのカーボンフィルムのストリップです。この領域の前の細胞は炭素膜の上をガラス化し、この領域の後ろの細胞は炭素膜の下でガラス化した。ラメラの前縁の左側にある有機白金コートが構造的完全性を失いそうになったときに、フライス加工が停止しました。この停止点は、ラメラ全体が均一な厚さになる前であったため、ラメラの背面にはまだコントラストの高い素材があります。(D)(A)に示すグリッド上に粉砕されたラメラに基づく研磨ルートの一例。研磨ルートは、FIB源に近いラメラから開始し、FIB源から離れて、粉砕された材料のラメラの表面への再堆積を制限する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
研磨中、ラメラの最終的な厚さは、粉砕される領域のサンプルの構造、有機白金コートの完全性、および利用可能な時間に依存します。理想的には、3 kVのSEMによってラメラの表面全体にわたってコントラストが失われるまでサンプルを薄くする必要があり、均一に電子透過性であり、厚さが約150〜200 nmであることを示唆しています(図5C)。ただし、有機白金層に穴が開いたり、ラメラが曲がり始めたりする場合は、この時点より前にフライス加工を停止する必要があります。この場合、ラメラは前面でまだ十分に薄く、断層撮影に有用なままであり得る。逆に、ラメラが安定しているように見える場合は、コントラストの喪失段階を超えて薄くすることができ、ミリングパターンを互いに近づけることによってさらに薄くすることができます(~100nm以下)。これは、下流のワークフローに必要な厚さによって異なります。研磨ルートを計画するには、低倍率のSEM画像が必要であり、イオンビーム源の近くから始めて作業します(図5D)。研磨ルートの方向は、すでに仕上げられたラメラへのアブレーションされた材料の再堆積を防ぐために重要です。
傾斜系列データの収集と処理
TEMにロードされると、低倍率のフルグリッドモンタージュ(~150倍)がラメラの位置を特定し、フライス加工の最後に撮影された低倍率のSEM画像と相関させることができます。プランジ凍結シゾントの場合、グリッドのほとんどは電子に対して透明ではないため、ラメラの位置は黒い背景に白いノッチとして表示されます(図6A)。顕微鏡の傾斜軸に対するラメラの角度は、垂直軸から~10°以上離れていると傾斜系列の取得が困難になる可能性があるため、注意が必要です。各ラメラの位置にある中倍率のモンタージュ(~1,500倍)は、生物学的含有量の概要を示し、移動損傷、結晶氷、または過度の表面汚染をチェックします(図6B-D)。これは、表面の汚染が取得領域またはフォーカス領域を覆い隠さないことを確認するために、高傾斜でもチェックする必要があります。取得領域の選択は、生物学的特徴だけでなく、周囲の領域の氷の構造的完全性にも依存します。チルトシリーズを取得する前に、±10°のプレチルトをグリッドに適用して、ラメラの平面(グリッドではない)を光軸に垂直にします。プレチルトの方向は、中倍率のモンタージュにおけるラメラの前縁の位置(残った有機白金コートを探す)によって決定することができる。ここで使用したTEM(300 kVタイタンクリオス)では、ラメラの前端が地図上で上を向いている場合、+10°のプレチルトが必要であり、下を向いている場合、-10°のプレチルトが必要でした。各グリッドは、ピンセットでピックアップしてオートローダーに挿入する方向によって異なる場合があります(カットアウェイセクションが左または右を向いており、180°回転します)。最後の考慮事項はピクセルサイズです。通常、傾斜系列は、関心のある特徴のサイズ、結果として得られる断層撮影データの目標解像度、および取得領域のサイズを制限する可能性のあるラメラの表面積を考慮して、約2.5〜7 Å/ピクセルで収集されます。高解像度の情報を得るためにより小さなピクセルサイズを使用することは可能であり、これらのサンプルで正常に使用された最小は1.4 Å/ピクセルです(データは示されていません)。ドリフトは、より小さなピクセルサイズでより明確になり、解像度の最大化が研究で重要な薄い(<100 nm)ラメラにのみ実際に適しています。

図6:傾斜系列を取得するためのアクセス可能な関心領域の選択 (A)ラメラを含む領域を示す低倍率TEMマップのセクションは、黒い背景(赤い矢印)に6つの白いノッチとして表示されます。白い四角は壊れたカーボンフィルムです。(B)損傷して失透したラメラの中倍率マップ。ラメラ(FE)の前端で、有機白金コートが剥がれています(1)。ラメラの中央に結晶氷の透明なパッチがあります(2)。イオンビームは、グリッドバーの隣の氷が厚すぎるため、ラメラ(BE)の後端で突破できませんでした。ラメラのごく一部だけがBE(3)で周囲の氷から解放され、くさびを作ります。厚さはまた、棚がラメラ(4)の上で切断される原因となり、TEMの高傾斜で細胞の視界を遮る可能性が最も高い。(C)TEMで見たラメラ全体の中倍率モンタージュ。ラメラからチルトシリーズを採取する際に避けるべき典型的な問題または領域は、表面汚染(SC)で覆われている領域、有機白金コートで覆われている領域(OP、黄色)、亀裂の近く(CRおよび黒矢印)、生物学的材料の密度変化によるカーテンがある領域(CUおよび青括弧内の領域)、および有機白金コートの破断によって弱くなった領域(緑色の円)です。傾斜系列集録でアクセス可能な領域は、2つの黒い破線のボックス(ラベル1と2)内の領域のみです。表面の汚染によって関心領域や焦点領域が不明瞭にならないように、高傾斜でビューをチェックする必要があります。(D)はるかにきれいなラメラの中倍率のモンタージュですが、研磨中に有機白金コート(緑色の円)が薄くなるために亀裂(CR)が残っています。ここでは、関心のある領域は、ラメラ内で観察される細胞タイプによって強調表示され、この場合は個々のメロゾイトであり、ラメラの後方に向かって炭素層(オレンジ)の後ろに配置されます(黒い破線のボックス)。スケールバー、3 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図7:FIB粉砕ラメラからのクライオETデータの取得。 (A)最近熱帯熱マラリア原虫に侵入された赤血球を含むラメラの領域の顕微鏡写真。(B)では、同じ画像に、赤血球(赤)、多数の二重壁細胞内小胞(それぞれ内膜と外膜の紫と青)、およびメロゾイト(緑)の宿主細胞に由来する第2の膜(黄色)の境界を示す注釈が付けられています。黒いボックスは、傾斜系列が取得された領域を示します。スケールバー、500 nm。(C)メロゾイトの頂端で取得された8倍のビニング断層像(2.4 Å / pixel)からXY平面で見た平均20の中央スライスと、(D)その注釈で、細胞を囲む2つの膜(緑と黄色)と、電子密度の高いキノコ型の特徴(紫)に関連するメロゾイト(青)の頂点に積み重ねられた4つの膜を示します。赤い矢印は、頂点の膜スタックとキノコの形の特徴の接合部を示しています(パートF、iにも示されています)。黒い矢印は、メロゾイト原形質膜と寄生虫内の多層小胞の1つとの間の融合イベントを示します(パートF、iiにも示されています)。宿主赤血球膜(赤)を示し、黒破線は(E)に示すXZ平面で見た断面の位置を示す。断面(E)のフィーチャは、パーツ(D)と同じように色付けされ、色付きの矢印が膜を指しています。黒色矢印は、粉砕後にラメラに塗布されたスパッタコートの位置およびラメラの厚さを示す。部品(C-E)の場合、スケールバー、500nm。(F)(C)の部分の赤と黒の矢印で示された特徴のより詳細な図、メロゾイトの頂点における膜スタックの脂質二重層における定義(i)および多層小胞とメロゾイト原形質膜との融合イベントを示す。スケールバー、75ナノメートル。この図の拡大版を表示するには、ここをクリックしてください。
この作業の主な焦点は、メロゾイトの出口の経路を分析することです。 P. falciparum しかし、研究で使用された細胞の集団が完全に均質になることは決してないことを考えると、ラメラ内の細胞発生の他の段階がしばしば観察されました。次に示す例 (図 7)には、最近侵入された赤血球が含まれています P. falciparum 寄生虫(メロゾイト)。使用したラメラの厚さは240 nmで、TEMに挿入する前に、グリッドにアルゴン雰囲気で白金を軽くスパッタコーティングしていたため、通常予想されるよりもわずかにコントラストが低くなりました。赤血球膜は、細胞を取り巻く全体を追跡することができました。赤血球内には、3つの囲まれた膜結合構造、2つの小胞があり、それぞれが二重膜と電球型の特徴(最も広い部分で1.2 μm x 0.9 μm)で囲まれており、メロゾイト(図 7A-B).2つの小胞の内容物は、赤血球の内容物の内容物とは対照的に類似しているようであり、これらの小胞にヘモグロビンが含まれている可能性があることを示唆しています。浸潤後の宿主赤血球内の小胞の存在は以前に観察されている45.それらは、侵入中に宿主の赤血球に放出されるメロゾイトのロプトリーと呼ばれる分泌オルガネラからの脂質および他の病原性因子の分泌から生じると考えられています。メロゾイトは2つの密接に関連する膜に囲まれており、その最も内側はおそらくメロゾイトの天然原形質膜であり、その上に目に見える表面コーティングはなく、最も外側はメロゾイトが侵入するときにメロゾイトを包む宿主赤血球膜に由来する必要があります。メロゾイトの細胞質は、多くの多層小胞と、頂点の膜のスタックに隣接する電子密度の高いキノコ形の特徴を含んでいます。この領域(2.4 Å / pixel)で取得された傾斜系列は、キノコの形の特徴に接続されているように見える4つの膜のスタックが含まれていることを示しています(図 7C-E).驚くべきことに、この形態は、成熟したメロゾイトの頂端における細胞小器官および細胞構造の正常な配置とはかなり異なる。これを評価するために、成熟メロゾイトの頂端にわたる比較チルトシリーズ(2.74 Å / pixel)を、プランジ凍結および粉砕前にE64で処理されたシゾントから取得しました(図 8).これは、メロゾイトの頂端には、細胞の頂端にある3つの極性リングのセット内に囲まれ、ミクロネムと呼ばれる多数の小さな分泌オルガネラに囲まれた、ロプトリーと呼ばれる2つの顕著なクラブ状の分泌オルガネラが含まれていることを示しています。最も内側の極性リングは、侵入を促進するモータータンパク質を含む内膜複合体と呼ばれるメロゾイト原形質膜の下にある二重膜構造に付着しています。浸潤中に、分泌オルガネラの内容物がメロゾイト表面および宿主赤血球に排出され、メロゾイトの宿主赤血球への付着を促進し、侵入を促進するモーター複合体を開始することが示されている45.ここのデータは、侵入後、メロゾイトには、菱形、ミクロネム、または極環に似た観察可能な構造が含まれていないことを示しており、メロゾイトの頂端の形態が劇的に変化することを示唆しています。侵入前のロプトリーの融合は、固定された室温切片のTEMによって以前に示されています46これは、侵略後の状態のメロゾイトで観察されるキノコの形の特徴の生成と一致しています。この特徴に関連する膜のスタックはこれまで観察されておらず、新たに侵入したメロゾイトにIMCが存在する兆候がないため、膜スタックは侵入が完了した後に残ったIMC機械の残骸である可能性があると仮定しますが、これはまだ確認されていません。
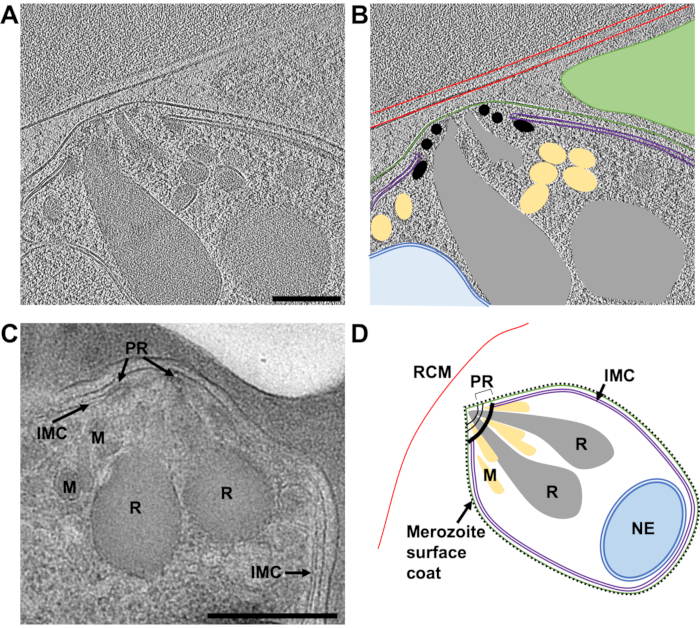
図8:FIB粉砕ラメラのクライオETによる成熟メロゾイトの頂端とプラスチック切片のTEM。 (A)成熟メロゾイトの頂端の典型的な形態を示す厚さ230 nmのラメラからの8倍ビニング断層図(2.74 Å /ピクセル)からの平均20の中央スライス。シゾントはプランジ凍結前にE64で処理されたため、PV膜が破裂し、メロゾイトが宿主赤血球内に含まれています。(B)は(A)と同じことを示すが、宿主赤血球膜(RCM、赤)、メロゾイト原形質膜(緑)、内膜複合体(IMC、紫)、極性リング(PR、黒)、ミクロネーム(M、黄色)、ホップトリー(R、灰色)、および核膜(NE、青)を示す注釈が付いている。断層撮影のこの領域で平面外にある隣接するメロゾイトは、緑色の三角形で示されます。スケールバー、200 nm。(C)クライオETによって観察された細胞の特徴は、プラスチック切片に保存されたシゾントのTEMからのものと一致しています。同様の細胞の特徴は、化合物2で処理されたシゾントからの成熟メロゾイトで示され、PV膜破裂の前に出口を停止します。スケールバー、500 nm。(D)部分(A-C)の細胞の特徴を示すメロゾイトの注釈付き概略図。この図の拡大版を表示するには、ここをクリックしてください。
| 長方形のミリングパターン間の保護領域の厚さ(μm) | 30 kV での公称イオンビーム電流 (pA) |
| 3 | 300 |
| 1.5 | 100 |
| 0.75 | 50 |
| 0.3 | 30 |
| 0.2 - 0.06 (最終研磨) | 30* |
表1:薄いラメラを製造するための製粉戦略。 段階的粉砕は、保護領域の厚さに対応するイオンビーム電流を減少させることによって行われる。これにより、サンプルの加熱が制限され、失透が防止されます。*研磨は、ラメラに両側から均等に熱を加えるために並行して実行する必要があり、最終的な厚さに達したときにラメラが曲がったり曲がったりするリスクを減らします。他のステップは、次のビーム電流に移動する前に、ラメラの上、次にラメラの下のパターンをフライス加工して、順番に実行できます。フライス盤位置を特定するためのグリッドの調査は、サンプルの加熱を最小限に抑えるために、1.5pAのビーム電流で実行する必要があります。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
クライオFIBミリングはより日常的になりつつありますが、ミリングに最適なサンプルの準備はそうではありません。したがって、このプロトコルの重要なステップのほとんどは、サンプルがクライオFIB-SEMに到達する前に発生します。粉砕を試みる前に、可能な限り最良のサンプルを生成するには、複数回の細胞調製、プランジ凍結、および光学顕微鏡および電子顕微鏡によるスクリーニングによるサンプルの最適化が必要です。可能な限り最高のサンプルを持つことは、成功の可能性を高めるだけでなく、機器の使用を最適化します。このため、ほとんどの国の施設では、マシンに時間を与える前に、十分な最適化が実行されたという証拠が必要です。クライオFIB-SEM内に入ると、有機白金コートの効果を最大化することが、均一に薄いラメラを生成するために重要です。最後に、忍耐と適切なサンプル処理は、繊細なラメラを含むグリッドを数日間作成して転送する必要があるユーザーからの前提条件スキルです。これは、自動フライス加工戦略47,48の導入によって変わる可能性がありますが、まだ、ほとんどの施設でフライス加工プロセス全体が依然として大部分が手動です。
この研究は 熱帯熱マラリア原虫 にのみ焦点を当てていますが、ここで紹介する方法は、他の細胞タイプのグリッド調製とミリングを最適化するために簡単に変更できます。考慮すべき重要な要素は、グリッドに適用されるセルの密度、グリッドタイプ(銅は一部のセルに有毒です)、炭素膜の穴のサイズと間隔、ブロッティング時間、およびブロッティングの方法(片面/両面、手動、または自動)。さらに、細胞がグリッド(通常は穴のある炭素膜を有する金のグリッド)上で増殖している場合、ブロッティングおよび凍結の前に光学顕微鏡によってコンフルエンシーをチェックすることができる。ミリング戦略は、セルがグリッド上にどのように堆積されるかによって異なります。マラリアに感染した赤血球の場合、グリッドは本質的に壊れていない細胞の層によってコーティングされており、一部の領域では厚く、他の領域では薄くなっています。粉砕は、氷の厚さが断層撮影に適したサイズのラメラを生成するこの勾配に沿った1つの領域の複数の点で実行されます。このアプローチは、複数のセルを通るスライスを含むラメラを生成できるため、より小さなセルに適しています。より大きな細胞または細胞の塊の場合、1つの細胞または細胞塊が1つのラメラを生成する場合があります。
グリッドハンドリングとサンプル転送は、このワークフローの主な課題の1つです。ラメラは、破損や亀裂、生物学を覆い隠すカーテンアーティファクト、過度の表面汚染、およびTEM内のグリッド配向の問題により失われる可能性があり、グリッドを再配置するための追加の処理手順が必要になります。損失の程度は日常的およびグリッドごとに異なりますが、時間の経過とともに練習と取り扱いの経験を通じて改善されます。この研究では、ラメラを破壊することなく、オートローダー内でグリッドの向きを何度も注意深く変更でき、表面の氷を洗い流すという利点があることがわかりました。このワークフローのもう一つの主な制限は、ラメラの製造にかかる時間です。生産が遅いため、適切に最適化されたサンプルを用意して、フライス加工を可能な限り効率的にすることが重要です。
ガラス体生物学的サンプルのFIB粉砕への多くの適応が最近導入されている。ゲームチェンジャーは、クライオFIB-SEMチャンバー内に極低温冷却リフトアウトツールを実装し、高圧凍結サンプルからより大きな材料ブロックを粉砕できるようにすることです。ブロックは、金属棒に取り付けるか、グリッパーでピックアップして、特別に変更されたEMグリッドを含む2番目のサンプル位置に移動することができます。次に、ブロックを有機白金でコーティングし、粉砕してラメラを生成することができます。高圧凍結材料からラメラを粉砕する能力は、相関蛍光顕微鏡によって領域を特異的に標的とする、はるかに大きな細胞および組織を処理できることを意味する12。FIBミリング法への他の最近の適応には、サンプル16のウェッジプレミリングによるカーテンアーチファクトの低減、マイクロ流体クライオ固定49 、および細胞分布を改善するための電子顕微鏡グリッドのフォトマイクロパターニング50が含まれる。また、ラメラの両側の微小膨張ギャップを粉砕することで、周囲のサンプルが最終的な薄さ51に達するにつれて、周囲のサンプルによる圧縮を緩和できることが実証されています。これは、この研究のサンプルなど、最終研磨ステップ中にラメラの曲がりが見られることがある連続セル層を粉砕する場合に特に役立ちます。
電子顕微鏡法の未来は、サブトモグラム平均化による in situ 分子構造の決定である可能性が高く、FIBミリングは、これらのタイプのワークフローのための硝子体生物学的サンプルの製造を容易にする重要なツールです。FIBミリングは生物学的応用にはまだ揺籃期にありますが、学術施設と国立施設の両方の研究者の努力と、研究をサポートするためのクライオFIB-SEM技術の開発への商業投資のおかげで、メソッド開発は急速に進んでいます。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、全体的または部分的にWellcome Trust(212916/Z/18/Z)から資金提供を受けました。オープンアクセスの目的で、著者は、この投稿から生じる著者が受け入れた原稿バージョンにCC BYパブリック著作権ライセンスを適用しました。
この方法が開発されたこのプロジェクトは、ヘレンR.サイビル、ローランドA.フレック、マイケルJ.ブラックマンに授与された医学研究評議会の助成金MR / P010288 / 1によって資金提供されました。 熱帯熱マラリア原虫 の培養は、マイケルJ.ブラックマンのグループのメンバーの支援を受けて、フランシスクリック研究所で栽培されました。著者らは、薄い血液塗抹標本中の化合物2およびE64処理シゾントの画像を提供してくれたSer Ying(Michele)Tan博士に感謝の意を表したい。ほとんどのラメラはeBICのスタッフのサポートを受けて製造されており、研究提案NT21004に関するSciosデュアルビームクライオFIB-SEMにアクセスできることに感謝しています。著者らはまた、CUI内でのFIBフライス盤技術の開発を継続する上での王立協会産業フェローシップスキーム(INF\R2\202061)の支援を認めています。著者らはまた、この方法の論文とプロジェクトの監督に関して有益な議論をしてくれたHelen R. Saibilに感謝したい。
資料
| Name | Company | Catalog Number | Comments |
| c-clips | Thermo Fisher Scientific | 1036171 | |
| Clipping station | Thermo Fisher Scientific | n/a | Direct quote from Thermo |
| Clipping station | Sub-angstrom | CSA-01 | |
| Compound 2 | n/a | n/a | Synthesised by Dr Simon A. Osborne, LifeArc |
| Cryo-FIB specific autogrid rims | Thermo Fisher Scientific | 1205101 | |
| E64 | Sigma | E3132 | |
| Emitech K100X glow discharge unit | Quorum | n/a | |
| Gibco RPMI 1640 media | Thermo Fisher Scientific | 12633012 | Formulation used for culturing is custom made (REF 041-91762 A) and includes Albumax, glutamine, HEPES and hypoxanthine supplements |
| Giemsa Stain | VWR International | 350864X | |
| Glass slides | Thermo Fisher Scientific | 11562203 | |
| Grid boxes | Sub-angstrom | PB | For clipped grids |
| Grid boxes | Thermo Fisher Scientific | n/a | For clipped grids - direct quote from Thermo Fisher Scientific |
| Grid boxes | Agar Scientific | AGG3727 | |
| Home-made manual plunge freezing rig | n/a | n/a | With an insulated ethane pot (high-density foam) and liquid nitrogen bath (polystyrene) on a bench top in a containment facility. |
| Human blood | n/a | n/a | UK National Blood and Transplant service |
| JEOL 4700F Z JSM with a Leica VCT500 stage cooling system | JEOL | n/a | FIB-SEM |
| Leica EM ACE600 with a VCT500 cryostage | Leica | n/a | sputter coater |
| Leica EM ACE900 | Leica | n/a | e-beam rotary coater. In a humidity controlled room. |
| Linkam cryo-stage for light microscope | Linkam | Model No. CMS196 | Cassettes for clipped and un-clipped grids. In a humidity controlled room. |
| Methanol | Sigma | 179957 | |
| Nikon Eclipse E200 light microscope | Nikon | n/a | with Linkam cryo-stage in a humidity controlled room. |
| Percoll | VWR International | 17-0891-01 | Solution for percoll cushion is 35 ml 10x PBS, 150 ml RPMI 1640 media and 315 ml Percoll |
| Quantifoil copper 200 mesh 2/4 holey carbon EM Finder grids | Quantifoil | N1-C17nCuH2-01 | 100 pack |
| Quantifoil copper 200 mesh 2/4 holey carbon EM grids | Quantifoil | N1-C17nCu20-01 | 100 pack |
| Quorum PP3010 prep-chamber | Quorum | n/a | sputter coater |
| Scios dual beam equipped with a Quorum PP3010 transfer stage. | FEI | n/a | FIB-SEM |
| Staedtler Lumocolor fine black permanent marker pen | Viking Direct | ND538522 | |
| TFS Titan Krios 300 kV TEM | Thermo Fisher Scientific | n/a | TEM equipped with a K2 or K3 camera. |
| Whatmann grade 1 filter paper | Sigma | WHA1001150 | |
| Zeiss Axio Scope A1 light microscope | Zeiss | n/a | with Linkam cryo-stage in a humidity controlled room. |
参考文献
- Baumeister, W. From proteomic inventory to architecture. FEBS Letters. 579 (4), 933-937 (2005).
- Rigort, A., Villa, E., Bäuerlein, F. J. B., Engel, B. D., Plitzko, J. M. Integrative approaches for cellular cryo-electron tomography: Correlative imaging and focused ion beam micromachining. Methods in Cell Biology. 111, 259-281 (2012).
- Oikonomou, C. M., Chang, Y. W., Jensen, G. J. A new view into prokaryotic cell biology from electron cryotomography. Nature Reviews Microbiology. 14, 205-220 (2016).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Giannuzzi, L. A., Stevie, F. A. A review of focused ion beam milling techniques for TEM specimen preparation. Micron. 30 (3), 197-204 (1999).
- Narayan, K., Subramaniam, S. Focused ion beams in biology. Nature Methods. 12 (11), 1021-1031 (2015).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Acadamy of Science of the United States of America. 109 (12), 4449-4454 (2012).
- Marko, M., Hsieh, C., Schalek, R., Frank, J., Mannella, C. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryo-electron microscopy. Nature Methods. 4 (3), 215-217 (2007).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: Focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23 (5), 771-777 (2013).
- Wang, K., Strunk, K., Zhao, G., Gray, J. L., Zhang, P. 3D structure determination of native mammalian cells using cryo-FIB and cryo-electron tomography. Journal of Structural Biology. 180 (2), 318-326 (2015).
- de Winter, D. A. M., et al. In-situ integrity control of frozen-hydrated, vitreous lamellas prepared by the cryo-focused ion beam-scanning electron microscope. Journal of Structural Biology. 183 (1), 11-18 (2013).
- Schaffer, M., et al. A cryo-FIB lift-out technique enables molecular-resolution cryo-ET within native Caenorhabditis elegans tissue. Nature Methods. 16 (8), 757-762 (2019).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Albert, S., et al. Proteasomes tether to two distinct sites at the nuclear pore complex. Proceedings of the National Acadamy of Science of the United States of America. 114 (52), 13726-13731 (2017).
- Guo, Q., et al. In situ structure of neuronal C9orf72 poly-GA aggregates reveals proteasome recruitment. Cell. 172 (4), 696-705 (2018).
- Schaffer, M., et al. Optimized cryo-focused ion beam sample preparation aimed at in situ structural studies of membrane proteins. Journal of Structural Biology. 197 (2), 73-82 (2017).
- Szwedziak, P., Wang, Q., Bharat, T. A. M., Tsim, M., Löwe, J. Architecture of the ring formed by the tubulin homologue FtsZ in bacterial cell division. eLife. 3, 04601 (2014).
- Carlson, L. A., et al. Cryo electron tomography of native HIV-1 budding sites. PLOS Pathogens. 6 (11), 1001173 (2010).
- Klein, S., et al. SARS-CoV-2 structure and replication characterized by in situ cryo-electron tomography. Nature Communications. 11 (1), 5885 (2020).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high pressure frozen samples: Bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. Journal of Structural Biology. 184 (2), 355-360 (2013).
- Murphy, G. E., et al. Correlative 3D imaging of whole mammalian cells with light and electron microscopy. Journal of Structural Biology. 176 (3), 268-278 (2012).
- Heymann, J. A. W., et al. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2012).
- Spehner, D., et al. Cryo-FIB-SEM as a promising tool for localizing proteins in 3D. Journal of Structural Biology. 211 (1), 107528 (2020).
- Kamino, T., Yaguchi, T., Ohnishi, T., Ishitani, T., Osumi, M. Application of a FIB-STEM system for 3D observation of a resin-embedded yeast cell. Journal of Electron Microscopy. 53 (5), 563-566 (2004).
- Han, H., Zuber, B., Dubochet, J. Compression and crevasses in vitreous sections under different cutting conditions. Journal of Microscopy. 230, 167-171 (2008).
- Matias, V. R. F., Al-amoudi, A., Dubochet, J., Beveridge, T. J. Cryo-transmission electron microscopy of frozen-hydrated sections of Escherichia coli and Pseudomonas aeruginosa. Journal of Bacteriology. 185 (20), 6112-6118 (2003).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150 (1), 109-121 (2005).
- Al-Amoudi, A., et al. Cryo-electron microscopy of vitreous sections. The EMBO Journal. 23 (18), 3583-3588 (2004).
- Bouchet-Marquis, C., Dubochet, J., Fakan, S. Cryoelectron microscopy of vitrified sections: A new challenge for the analysis of functional nuclear architecture. Histochemistry and Cell Biology. 125 (1-2), 43-51 (2006).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. Journal of Structural Biology. 172 (2), 180-190 (2010).
- Dubochet, J., Adrian, M., Chang, J. -. J., Lepault, J., McDowall, A. W. Cryoelectron microscopy of vitrified specimens. Cryotechniques in Biological Electron Microscopy. , 114-131 (1987).
- Hsieh, C., Schmelzer, T., Kishchenko, G., Wagenknecht, T., Marko, M. Practical workflow for cryo focused-ion-beam milling of tissues and cells for cryo-TEM tomography. Journal of Structural Biology. 185 (1), 32-41 (2014).
- Harapin, J., et al. Structural analysis of multicellular organisms with cryo-electron tomography. Nature Methods. 12 (7), 634-636 (2015).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. Journal of Structural Biology. 180 (3), 572-576 (2012).
- Duyvesteyn, H. M. E., et al. Machining protein microcrystals for structure determination by electron diffraction. Proceedings of the National Acadamy of Science of the United States of America. 115 (38), 9569-9573 (2018).
- Blackman, M. J. Purification of Plasmodium falciparum merozoites for analysis of the processing of merozoite surface protein-1. Microbes as Tools for Cell Biology. 45, 213-220 (1995).
- Hagen, W. J. H., Wan, W., Briggs, J. A. G. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197 (2), 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2 - anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14 (4), 331-332 (2017).
- Grant, T., Grigorieff, N. Measuring the optimal exposure for single particle cryo-EM using a 2.6 Å reconstruction of rotavirus VP6. eLife. 4, 06980 (2015).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192 (2), 216-221 (2015).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Turoňová, B., Schur, F. K. M., Wan, W., Briggs, J. A. G. Efficient 3D-CTF correction for cryo-electron tomography using NovaCTF improves subtomogram averaging resolution to 3.4 Å. Journal of Structural Biology. 199 (3), 187-195 (2017).
- Arnold, J., et al. Site-specific cryo-focused ion beam sample preparation guided by 3d correlative microscopy. Biophysical Journal. 110 (4), 860-869 (2016).
- Riglar, D. T., et al. Super-resolution dissection of coordinated events during malaria parasite invasion of the human erythrocyte. Cell Host & Microbe. 9 (1), 9-20 (2011).
- Hanssen, E., et al. Electron tomography of Plasmodium falciparum merozoites reveals core cellular events that underpin erythrocyte invasion. Cellular Microbiology. 15 (9), 1457-1472 (2013).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-electron tomography. eLife. 9, 52286 (2020).
- Fuest, M., et al. In situ microfluidic cryofixation for cryo focused ion beam milling and cryo electron tomography. Scientific Reports. 9 (1), 19133 (2019).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208 (3), 107389 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved