Method Article
使用双光束扫描电子显微镜从玻璃体生物样品制备薄片进行冷冻电子断层扫描
摘要
使用聚焦离子束铣削从冷冻生物样品中产生玻璃体网格片,用于冷冻电子断层扫描。
摘要
这里介绍的是从 恶性疟原虫感染的人红细胞的冷冻网格中制备冷冻薄片的方案,可以很容易地适用于其他生物样品。制备样品、研磨和观察薄片的基本原理对于所有仪器都是通用的,该协议可以作为用于冷冻电子显微镜 (cryoEM) 和冷冻电子断层扫描 (cryoET) 的并网冷冻薄片制备的一般指南。使用手动或自动冷冻机将支撑细胞的电子显微镜网格冷冻到液氮冷却的液态乙烷中,然后在配备冷冻台的光学显微镜上进行筛选。冷冻网格被转移到配备聚焦离子束(cryoFIB-SEM)的冷冻扫描电子显微镜中。网格在铣削前通常进行溅射镀膜,这有助于在铣削过程中分散电荷积聚。或者,可以使用电子束旋转镀膜机在网格上涂上一层碳铂,可以更精确地控制其确切厚度。一旦进入冷冻FIB-SEM,通过气体注入系统(GIS)将有机铂化合物的附加涂层涂覆到网格表面。该层在铣削时保护薄片的前边缘,其完整性对于实现均匀薄的薄片至关重要。通过SEM识别感兴趣的区域,并以逐步的方式进行铣削,当薄片达到电子透明度时减少离子束的电流,以避免产生过多的热量。然后将具有多个薄片的网格在低温条件下转移到透射电子显微镜(TEM)中进行倾斜串联采集。用于薄片制备的稳定且无污染的工作流程是下游技术的重要步骤,包括细胞冷冻电镜、冷冻电子管和亚断层图平均。开发这些技术,特别是用于高压冷冻样品的提出和研磨,是该领域的重中之重。
引言
只有 <500 nm 厚的生物样品的细胞内容物才能在低温下通过透射电子显微镜 (TEM) 进行有效成像,从而将标本的范围限制在病毒、原核生物、简单的单细胞生物和较大真核细胞的较薄区域1.网格聚焦离子束 (FIB) 铣削可在低温 (< -150 °C) 下将较厚的切入冷冻生物样品变薄为电子透明薄片。然后将产生的薄片转移到TEM进行可视化和断层扫描数据收集,从而能够对细胞内的细胞和分子特征进行高分辨率3D重建(有关评论,请参阅Rigort等人,2012 2,Oikonomou等人,20163和Wagner等人,20204)。
FIB铣削源于材料科学领域,在该领域,样品通常会变薄,为下游分析做准备5。它在扫描电子显微镜(SEM)中进行,扫描电子显微镜具有两个光学柱:常规扫描电子显微镜光学元件和第二列包含能够产生和精细控制聚焦离子束(FIB)的光学元件 - 称为FIB-SEM。这允许样品的特定区域被镓源产生的离子烧蚀,去除多余的材料并留下薄片6。研磨过程由样品形貌的SEM成像引导,用于定位感兴趣区域并监控研磨进度。对于生物应用,基本设置大致相同,但研磨是在低温下进行的。这要求标准FIB-SEM适应具有低温冷却阶段,以保持恒定的温度和低表面污染率,以及气闸以促进样品转移而不会失透或污染。样品穿梭也经过修改,允许在cryoFIB-SEM内安装一系列不同的载体,包括TEM网格、平板和毛细管。几个关键的研究人员小组一直是这些方法的发展和该领域持续技术进步的核心7,8,9,10,11,12。商业解决方案现在更广泛地用于低温下的生物FIB铣削,并且考虑到优化的样品,薄片的网格铣削正变得越来越常规。
一系列室温和冷冻电镜技术可用于可视化所有生命尺度的细胞信息,从中等分辨率的整个多细胞生物到更详细地了解细胞水平复杂过程的背景,再到确定 in situ 分子结构13,14,15,16,17,18,19.经典的室温技术包括通过超薄切片法切片固定和染色的树脂嵌入细胞和组织,以通过TEM分析细胞形态(回顾见Studer等人,200820).已经开发了利用SEM二次电子散射对保存细胞块的表面进行成像的替代技术,然后用刀(连续块面成像)或聚焦离子束逐渐去除材料21,22,23.该技术也已在低温下成功实施(称为冷冻体积成像),在玻璃体、未染色的细胞或组织块上使用 cryoFIB-SEM24.或者,可以通过STEM成像铣削和研究较厚的薄片(~15μm厚)25.使用这些技术,可以对包含许多细胞的整个块进行成像以收集群体信息,或者可以在3D中对整个器官/生物体进行成像和重建。然而,为了从细胞中获取高分辨率分子信息,样品需要以接近天然的冷冻水合状态保存,因此需要在低温条件下制备。玻璃体切片的冷冻电子显微镜(CEMOVIS)是一种在低温条件下用超薄切片机对生物材料的高压冷冻块进行切片的技术。这会产生冷冻切片带(40-100 nm 厚)26,它们连接到 EM 网格并在 TEM 中成像。然而,刀与玻璃体样品的物理相互作用会导致裂缝和压迫伪影,从而严重扭曲细胞结构27,28,29,30.较厚的切片更容易出现这些伪影,因此使用厚度超过~70 nm的部分是不切实际的26.这种限制极大地限制了断层图中生物结构的3D视图。低温下的FIB铣削不会遇到这些问题,但由于试样各部分的铣削速率不同而产生自己的伪影,导致薄片内的厚度变化 - 称为窗帘。通过气体注入系统(GIS)应用有机铂涂层可以缓解此问题,该系统在铣削过程中保护薄片的前边缘31.网格FIB铣削的样品厚度上限由在保持样品玻璃体的同时切入冻结试样的能力来定义32,尽管随着冷冻提取技术和适用于生物标本的样品载体的引入,FIB 研磨也可用于处理高压冷冻样品31,33,34,35.此外,切入冷冻样品不能太薄,因为必须有足够的生物材料来生成合理大小的薄片,该薄片将提供足够的表面积以所需的放大倍数收集倾斜系列。这个问题可以通过铣削较小细胞团块(如细菌或酵母)来缓解。最终薄片厚度(~100-300 nm)通常由样品完整性和铣削策略决定。较薄的薄片更适合高分辨率的结构工作,例如亚断层扫描平均,但较厚的薄片包含比CEMOVIS可以实现的更大的细胞体积,从而在接近天然保存的样品中提供更多的细胞环境。FIB研磨也可用于稀释冷冻蛋白质晶体以进行电子衍射研究36.
如果科学问题需要 原位近天然标本的高分辨率分子细节,则玻璃体细胞的FIB铣削值得花时间和精力进行。随着更多用于常规生产薄片的设施,限速步骤通常是在研磨之前优化样品,此时必须花时间确保样品是玻璃体的,并且厚度合适,以产生坚固且均匀薄的薄片。这里描述的是感染恶 性疟原 虫(疟疾病原体)的FIB研磨切入冷冻人红细胞的样品优化,但这种方法可以适用于任何给定的样品。
研究方案
人类血液是通过英国国家血液和移植服务从匿名献血者那里获得的,并在收到后 2 周内使用。其使用不需要道德批准。
1. 恶性疟原虫感染红细胞的制备和冷冻
- 通过在70%(v / v)等渗密度梯度培养基上离心(1,580 x g)分离成熟的裂殖子(有关如何在人红细胞中培养3D7 恶性疟原 虫无性血液阶段的标准程序见Blackman M.J.,199537)。
- 用 100% 甲醇将风干的血膜固定在载玻片上,以检查裂子的形态均匀性,然后在 6.7 mM 磷酸盐缓冲液中用 10% Giemsa 染色,pH 7.1。
注意:为了丰富在特定出口点停滞的裂殖子的制备,裂殖子可以与化合物2和E64抑制剂进一步同步(参见 代表性结果 和 图1 ,了解这些抑制剂的作用)。
注意: 恶性疟原 虫是一种人类病原体,只能在符合当地健康和安全准则的合适收容设施中处理。 - 轻轻离心裂殖剂(240 x g)以沉淀它们并重悬于RPMI培养基的2倍体积的细胞沉淀中,产生50%的血细胞比容悬浮液。
- 在手动冷冻装置上,将 2.5 μL 裂殖物涂在辉光放电的碳侧(使用 60 秒、空气中 30 mA 的辉光放电单元设置,仅处理网格的碳侧) 200 目铜网格,带有 2/4 孔碳膜,并使用边缘撕裂的 1 级滤纸从网格背面印迹 ~20 秒。投入液氮冷却的液态乙烷中,并将网格转移到存储中(本研究中使用的设备参见材料表)。
注意:实验可以在此处暂停,网格可以无限期地存储在液氮下。
注意:液氮是一种窒息剂,会导致冻伤;在合适的环境中小心处理氧气监测。
注意:液态乙烷会导致严重灼伤并且易燃;在远离火源的通风橱中使用。
注意:切入冷冻裂子不再可行。这是通过将人类血液与几个空气解冻的冷冻裂子的金网格孵育并确定的,与未冷冻的对照相比,几天后观察到没有寄生虫生长。因此,使用正常的安全和去污程序(手套、用 >70% 乙醇对表面/工具进行灭菌和用 >70% 乙醇)处理栅块)可以在安全壳设施外处理冷冻格栅。 - 使用光学显微镜的冷冻载物台筛选网格,特别注意网格上冰的梯度。在较薄的冰区,检查单个网格方块的细胞覆盖率。
注意:最好的正方形应该是网格正方形中心的一个单元格厚(图2)。这确保了薄片可以在正方形的中心铣削,而不会撞到网格杆边缘处较厚的冰。实验可以在这里暂停,网格可以无限期地储存在液氮下。如果细胞带有荧光标记物,也可以通过cryoLEEM筛选网格以定位感兴趣的X / Y位置,这可以与cryoFIB-SEM中的网格位置相关联以直接研磨。
2. 切入冷冻细胞的并网FIB铣削
- 用黑色不可磨灭的记号笔标记 cryoFIB 专用自动网格轮辋的正面,以指示剖面部分的中心和轮辋的另一侧(图 3)。设置夹紧站并将网格夹入碳面朝下的标记环中。
- 将网格加载到cryoFIB-SEM穿梭车(通常为2个网格,取决于穿梭车)碳面朝上,并在氩气气氛(5 x 10-2 mbar)(5 mA,持续60秒 - 厚度可变)或碳/铂电子束旋转涂层(~4 nm厚度)中涂覆铂溅射涂层到电池表面。
注意:两种类型的涂层都有助于在SEM成像过程中电荷分散。电子束旋转镀膜机的优点是可以指定涂层的确切厚度。 - 将穿梭车加载到cryoFIB-SEM中,并通过SEM在5 kV(13 pA或25 pA)下评估每个网格上的细胞分布。以低放大倍率概览(~100倍)查看整个网格的冰梯度。然后,拍摄更高放大倍率(~5,000x)的图像以查看单个网格正方形,并确定网格中具有可见细胞特征和低表面污染的区域。
- 使用气体注入系统(GIS)在每个网格的表面上涂上>2μm有机铂涂层。为此,将GIS针插入网格上方的腔室中,并将有机铂源加热至设定温度设定时间(例如,~27°C,持续3-10秒)以产生蒸汽流。
注意:应优化通过GIS针的有机铂涂层的涂覆角度,温度和时间,以最大限度地提高涂层的均匀性。这将取决于所使用的特定冷冻FIB-SEM(有关进一步说明,请参阅 代表性结果 )。 - 倾斜样品,使网格的平面与离子束的入射角成~10°,并移动合适的网格正方形的中心,以便在SEM和FIB图像中看到。
- 使用离子束在低电流(标称值为1.5 pA,30 kV)下测量网格,并以足够高的放大倍率(~7,000x)可视化网格正方形中心的细胞。在第一个铣削电流(300 pA)下聚焦样品并校正散光。调整亮度和对比度,然后标记出两个要铣削的矩形图案,一个在 3 μm 厚的保护区域的上方,一个在下方,其中心是最终薄片的所需位置。
注意:图案的选择宽度将取决于周围细胞层的地形和细胞大小。7-20 μm 是适合裂殖子的宽度,但较宽的薄片需要更长的时间来铣削。第一个铣削步骤选择的图案高度取决于样品厚度,从大约 6 μm 开始;这可能需要在铣削过程中进行调整。铣削从图案的外侧顶部和底部边缘定向地朝向薄片表面进行。这可以并行完成,其中两个图案同时或顺序铣削,首先从薄片上方去除材料,然后从下方去除材料。 - 在第一个电流下开始铣削;在离子束视图中监测实时进度,并通过 SEM(5 kV、13 或 25 pA)间歇性地监控。检查离子束是否穿透了受保护区域上方和下方的样品。如果没有,请增加矩形图案的高度以去除更多材料。当薄片上方和下方的表面在离子束视图中完全光滑时停止。
注意:当矩形图案的内部在焦平面中不包含任何特征时,离子束已经突破了受保护区域上方和下方的样品。某些功能(如网格条)在背景中可能会失焦。 - 更改为下一个铣削电流 (100 pA);对焦并调整亮度/对比度。将两个矩形图案之间的空间减小到 1.5 μm,并降低图案高度以仅覆盖未铣削的材料。以新的电流开始铣削,直到薄片上方和下方的表面完全光滑。
- 逐步重复此过程,直到厚度达到0.3μm,每次根据 表1中的铣削方案减少离子束电流。
- 在一个或两个网格上将几个薄片(量取决于样品的厚度和可用时间)研磨至0.3μm的厚度,记录每个薄片的X / Y / Z位置,并在会议结束时保留~1-2小时以将薄片抛光至其最终厚度(60-200nm)。
- 对整个网格进行低放大倍率SEM概览,并规划从网格前部的薄片(靠近离子束源)到网格背面的薄片(离离子束源最远)的抛光路线(图5)。
注意: 这减少了烧蚀材料重新沉积回抛光薄片表面的情况。 - 将两个矩形图案之间的空间减小到100-200nm,并在30pA的离子束电流下开始最后的抛光步骤。在 2-3 kV(13 pA,停留 = 300 n,3072 x 2048,全帧~2 s)下通过 SEM 监测 SEM 的进度,并在 SEM 在薄片中失去对比度或薄片本身的有机铂涂层开始失去完整性时停止抛光。
- 在移除网格之前,获取整个网格的低放大倍率SEM图像并保存每个薄片的图像。稍后在 TEM 中使用它们交叉检查网格。在此处暂停实验并将带有薄片的网格存放在液氮下 - 小心处理。
注意:从cryoFIB-SEM中取出时,可以对网格进行轻微溅射涂覆,这有助于限制高倍率下TEM中的漂移和充电,但应谨慎进行,因为过多的溅射涂层会掩盖薄片内的生物内容物。在这个阶段可以筛选薄片的荧光;然而,获得足够的信号将取决于薄片厚度内标记蛋白质的丰度。必须非常小心地处理网格,以限制对薄片的损坏并防止表面污染。
3. 倾斜串联采集和数据处理概述
- 将网格加载到TEM中,使铣削方向垂直于平台的倾斜轴对齐。
注意: 网格的对齐是使用自动网格边缘上的标记通过肉眼完成的。~10°的误差幅度是可以接受的,否则当网格倾斜时,薄片两侧的沟槽壁可能会遮挡薄片。 - 获取整个网格的低放大倍率图(~150x)并定位薄片;然后,获取每个薄片的中等放大倍率图(~1,500x,取决于薄片大小)并定位感兴趣的区域。
- 将网格预倾斜 ±10°,使薄片(不是网格)的平面垂直于光轴
注意:预倾斜的方向可以通过低倍率和中倍率图中薄片前缘的位置(寻找残留的有机铂涂层)来确定。对于此处使用的 TEM,如果薄片的前边缘在地图中指向上方,则网格需要 +10° 预倾斜,如果它们指向下方,则需要 -10° 预倾斜。每个网格可能由于拾取和插入自动加载器的方式而有所不同。 - 以允许感兴趣区域所需的视场和分辨率的像素大小获取剂量对称倾斜系列38 (例如,-54° 至 +54°,增量为 3-5°)。使用介于 -2 和 -5 μm 之间的散焦值范围。以每个增量收集3-10帧的电影,为此,根据像素大小调整这些参数,以累积~150 e-/Å2 的总剂量(对于300 kV TEM)。
注意:应避免薄片上的裂缝,因为这些区域可能会漂移。还应避免表面污染,因为它可能会在高倾斜时遮挡感兴趣的区域或焦点区域。 - 使用诸如MotionCor239之类的程序对影片进行运动校正。对校正后的图像(累积的e-/图像)40 施加剂量加权滤波器,并使用诸如CTFFIND441的程序估计每个图像的散焦。
- 在 etomo (IMOD)42 等程序中使用无基准对齐(补丁跟踪)来计算倾斜系列中图像的对齐和角度关系。
- 将对齐和旋转信息以及散焦值输入到可以应用三维CTF校正的程序(例如NovaCTF43)中。计算校正后的断层影像,以获得具有与下游分析相关的分箱因子的输出断层影像。
- 分析重建并为任何下游处理做好准备,例如过滤、分割或子断层图平均。
结果
恶性疟原虫裂松的制备方法,用于 深度冷冻
化合物 2 和 E64 抑制剂用于阻滞处于出口不同阶段的裂殖子,从而产生丰富的裂殖子群体以供后续研究。这很重要,因为如果没有互补的相关技术,铣削特定的亚细胞靶标或细胞类型具有挑战性,因为该过程基本上是盲目的。化合物 2 是一种蛋白激酶抑制剂,可在液泡破裂之前阻止出口。裂殖子可以在化合物2上同步4小时,然后用不含化合物2的培养基洗涤以去除抑制剂,此时裂殖子将在大约30分钟后成熟并排出。或者,可以将化合物2同步裂殖子洗涤到E64(一种不可逆的广谱半胱氨酸蛋白酶抑制剂)中,并在液泡破裂点后但在宿主细胞破裂之前孵育约1小时以阻止出口。在冷冻之前,应通过Giemsa染色的血涂片检查治疗裂子的形态和均匀性(图1)。可以使用本出版物中描述的方法在这两种状态下冷冻精神分裂症。

图 1:通过 Giemsa 染色的血涂片对化合物 2 和 E64 停滞的 恶性疟原虫 裂松的形态。 (A)在化合物2存在下,寄生液泡(PV)密密麻麻地堆积着具有单簇血红素晶体(深棕色圆圈)的裂殖子(紫色圆圈)。PV与宿主红细胞(hRBC)(灰带)中周围血红蛋白以及hRBC膜之间的边界已明确。(B)在E64存在下,PV膜破裂,裂殖子在hRBC内扩散。每个裂殖子仍然含有一簇血红素晶体。宿主细胞膜渗漏并部分塌陷,因此,细胞外周内不可见血红蛋白,hRBC膜的边界不容易看到。比例尺,5 μm。 请点击此处查看此图的大图。
小型冷冻优化
在优化恶性疟原虫感染红细胞的印迹条件期间,试验了一系列不同孔径的网格,包括金和铜 200 目网格上的 2/2、3/3、3.5/1 和 5/2(方形)孔状碳。带有 2/4 孔碳膜的 200 目铜取景器网格提供适当厚的细胞层来研磨长玻璃体薄片。更大或更小的孔通常分别导致细胞层太薄或太厚(图2A-C)。对于 2/4 孔碳,通过从背面(非碳侧)吸干网格将裂殖子拉过 2 μm 孔,导致细胞在碳膜上方和下方弹出。孔之间的4μm碳拉伸导致一条碳条穿过大部分产生的薄片的中间,增加了强度。查找网格最适合相关和筛选目的44,但必须注意确保网格设计中的数字/字母不会太大,因为这会阻塞需要铣削的区域。
手动柱塞上的印迹时间约为20秒,但是当从网格中抽出的液滴停止在滤纸上扩散时,通过肉眼判断停止印迹的确切点。需要撕裂的边缘来破坏液滴的表面张力以开始印迹过程。本研究未使用自动跳入式冷冻机,但该样品的合理起点是使用与手动柱塞相同的细胞体积和网格类型,确保在高湿度(~70%)和环境温度(~25°C)的条件下从背面吸干网格。印迹时间和条件需要针对所使用的特定自动化系统进行优化。
恶 性疟原虫 裂松的切入式冷冻网格由配备冷冻台的光学显微镜而不是TEM筛选,因为样品不能传递到电子。对于较薄的样品,在将样品转移到cryoFIB-SEM之前,可以通过TEM(全网格图谱,在~150倍放大倍率下)筛选网格,这可能是进入国家设施的先决条件。应特别注意整个网格以及单个网格正方形内的冰厚度梯度。好的网格正方形应该是一个单元格厚或撞击其中心的碳膜(图2C)。这样可以避免在较厚的冰中对网格正方形边缘周围的网格条进行铣削,并确保离子束突破细胞层的上方和下方,产生自由薄片而不是楔形。一旦优化了可重现的印迹和切入冷冻条件,通常不再需要在FIB铣削之前进行筛选。
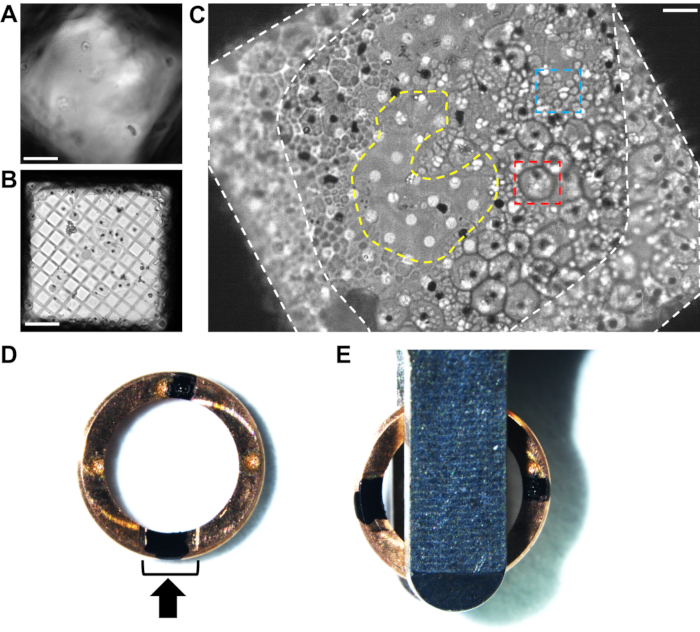
图2.通过冷冻光学显微镜分析冷冻恶 性疟原虫 裂松网格上的细胞分布。 (A)通过冷冻光学显微镜,冰在网格正方形上太厚,遮挡细胞和碳膜的例子。比例尺,10 μm。 (B)孔尺寸(300目铜网格和5/2方形孔碳膜)对于细胞来说太大的一个例子,导致一层非常薄的生物材料被没有冰的空区域包围。像这样的网格会产生非常短、不稳定的薄片。比例尺,10 μm。 (C)具有2/4孔碳膜的200目铜网格上良好细胞分布的示例。这些裂殖子用E64抑制剂处理。具有明确外围的大细胞(红盒,~5μm直径)是感染的红细胞,其仍然具有完整的液泡膜。小细胞簇(蓝框,~1μm)是包含在部分塌陷的宿主红细胞内的单个裂殖子。每个裂殖子的中心都有一个黑点,指示血红素晶体的位置(有关更多详细信息,请参见 图1 )。一旦进入冷冻FIB-SEM,细胞形态的差异就不那么容易看到;因此,在达到可重现的印迹条件之前,通过冷冻光学显微镜进行预筛选是有益的。网格条旁边的网格正方形边缘周围的单元格覆盖率(白色虚线区域)太厚,无法铣削。网格正方形中心的较薄区域(黄色虚线区域)是铣削的理想位置,将薄片延伸到周围的细胞层中。比例尺,6 μm。 (D) 冷冻FIB专用自动网格边缘的图像,带有两个黑色标记,一个在切割部分(黑色支架)内,另一个相对,位于12点钟和6点钟位置。黑色箭头表示铣削方向。(E)当网格加载到自动加载盒中时,标记需要与加载镊子的两侧等距,导致薄片垂直于载物台的倾斜轴。 请点击此处查看此图的大图。
标记用于断层扫描的 cryoFIB 专用自动网格轮辋
通常,在铣削之前,网格被夹在自动网格轮辋中,以便于操作并提供刚性,从而保护薄片在随后的传输步骤中免受损坏。CryoFIB 专用自动网格轮辋经过精心设计,具有剖面功能,有助于在铣削过程中接触到更多的网格面。重要的是将铣削方向垂直于TEM的倾斜轴定向,以便通过沿其长度旋转薄片来进行倾斜串联采集。这确保了薄片周围沟槽的高壁不会在网格倾斜时遮挡生物信息。
通常,自动网格轮辋被标记以帮助在cryoFIB-SEM穿梭车内以及稍后装载TEM时进行视觉对齐。对于这些样品,在12点钟和6点钟位置用不可磨灭的标记施加了两个标记(见 材料表),一个在夹环切割部分的中心,另一个正对(图2D)。加载到TEM中时(参见 材料表),两个标记都应在加载镊子的两侧可见,并与镊子边缘成90°对齐(图2E)。应该注意的是,制造商建议使用自动网格边缘上的雕刻点对齐网格,因为靠近离子束的某些油墨会干扰铣削。
可以通过光学显微镜对剪裁的网格进行筛选,并带有改进的盒进行冷冻台,这对于检查剪切过程是否没有破坏网格的碳膜是有益的。根据样品盒的不同,也可以铣削未夹紧的网格,但在从cryoFIB-SEM转移到TEM的过程中必须格外小心,以限制网格的任何弯曲,因为这会破坏薄片。未夹紧的网格可以通过侧入式冷冻支架加载到TEM中,但如果在铣削后进行夹紧,薄片很有可能会破裂。
有机铂涂层
有机铂涂层在加载到cryoFIB-SEM后,在一个或两个网格上进行。气体注入系统(GIS)的针头插入样品上方的腔室中,以引导有机铂蒸汽从加热源流过网格表面,持续设定的时间。蒸汽在冷表面上凝结并形成固体层(~2μm厚)。这种涂层的完整性对于能够均匀地研磨薄薄的薄片至关重要。有机铂涂层的最佳应用条件通常由仪器制造商预先确定,但仍可能需要进行一些优化。大多数系统要么将 GIS 指针靠近铣削方向对齐,要么垂直于铣削方向,具体取决于腔室上端口的几何形状和载物台的旋转极限。可以通过涂覆网格、铣削小区域、倾斜载物台以及通过 SEM 测量涂层厚度来试用不同的设置。
除了冷冻FIB-SEM本身的设置外,许多其他因素也会影响有机铂涂层的应用,包括1)样品的形貌,2)网格上的表面污染和3)来自GIS针的蒸汽流的可重复性。由于 GIS 流是定向的,因此不均匀的地形会导致像元阴影或表面污染的区域未涂覆或涂层较薄。这可能导致抛光过程中有机铂层塌陷(图3)。在选择要研磨的区域时,有必要注意周围的地形,例如,大的表面污染,细胞团块或破碎的碳从网格表面突出到几个网格正方形,可能会阻塞蒸汽流,产生更薄的有机铂的阴影,这可能会削弱薄片。此外,还应避免在薄片前缘附近出现非常小的表面污染颗粒,因为它们会在铣削过程中弹出,留下一块弱化的裸冰块,这可能导致在抛光过程中薄片上形成孔洞。最后,如果研磨已经开始并且有机铂涂层看起来不稳定,请再次涂层,更长时间,或交换到备用网格上。

图 3:优质的有机铂涂层对于获得薄而均匀研磨的薄片至关重要。 (A) 薄片前缘的显微照片,其中有机铂涂层(OP,黄色)涂得太薄,导致在抛光过程中在薄片前缘形成孔(绿色圆圈)和在薄片的整个宽度上不均匀地铣削(条纹)。有机铂表面已被离子束剪切掉,导致涂层前缘后面的材料喷洒(黄色虚线)。(B)有机铂涂层(OP)涂得更厚,导致薄片更均匀。涂层的完整性在薄片的整个宽度上得以保持,并且有机铂涂层与玻璃化生物材料之间的界面清晰(黄色虚线)。可以看到碳层穿过薄片(橙色)的后部。比例尺,1 μm。 请点击此处查看此图的大图。
评估冷冻FIB-SEM中的网格质量和铣削过程
一旦网格被转移到cryoFIB-SEM,碳膜的完整性和网格上细胞的分布就可以通过SEM进行筛选(图4A-C)。冰梯度、网格条的位置和网格编号在取景器网格上的位置可以通过低放大倍率 SEM 在 30 kV 下检查(图 4B),但电压应降低到 5 kV,同时以高倍率定位铣削位置并监控铣削过程以增加与表面形貌的对比度。

图 4:评估网格质量并定位要在 cryoFIB-SEM 中铣削的区域 。 (A) 通过 SEM 对 5 kV 电网进行低放大倍率概览。自动网格边缘的剖面部分在图像底部可见。比例尺,0.5毫米。 (B) 通过 SEM 在 30 kV 下显示同一网格,显示较厚的冰(较深的网格方块)和较薄的冰(较浅的网格方块)的区域。插图显示了框中的区域,箭头指示查找器网格上的编号,在 30 kV 时可见。比例尺,0.5 mm。 (C) 两个网格正方形的中等放大率概述,评估碳膜上细胞的分布和网格条的位置。比例尺,50 μm。 (D) 在高放大倍率下进行第一次切割的铣削图案排列(1.5 pA 和 30 kV 下的离子束视图)。红色区域(3μm厚)受到保护,而黄色区域将被离子束烧蚀。白色虚线表示最终薄片的位置。比例尺,10 μm。 (E) 通过抛光的 200 nm 厚薄片(10 μm 宽 x 15 μm 长)的 SEM 在 3 kV 下获得高放大倍率视图。在3 kV时薄片内的对比度损失表明已达到合适的厚度。亮白色前边缘是剩余的有机铂层,在铣削之前通过GIS施加到网格上。比例尺,5 μm。 (F) 使用离子束在 30 kV 和 1.5 pA 下观察来自 (E) 的相同薄片。穿过黑色方块(白色箭头)的细白线是薄片前缘剩余的有机铂涂层。比例尺,10 μm。 请点击此处查看此图的大图。
通过在离子束视图中以高倍率(裂子~7,000倍)在受保护区域的两侧布置一对矩形图案来选择要铣削的区域(图4D)。至关重要的是,在研磨区域附近不要附着任何表面污染颗粒,因为这些颗粒可能会掩盖有机铂金保护涂层的应用。同样重要的是,一旦达到最终厚度,该地区的地形适合支撑薄片的侧面。
对于疟疾裂殖子(细胞大小:~5 μm 直径 x 2 μm 厚,圆盘形),可以铣削 7-20 μm 宽的薄片。如果细胞层厚度合适,薄片通常会达到~10-15μm的长度,捕获碳层上方和下方的多个细胞(图4E-F)。可以预期在8小时(6-7小时的研磨和1-2小时的抛光)中研磨5-10片。这将根据样品的厚度和薄片的宽度而变化,较厚的样品和较宽的薄片需要更长的时间来研磨。即使是损坏的网格也可以铣削,因为它只需要少数几个好的网格方块即可生成一组薄片(图 5A)。此外,如果样品比预期薄,例如,由于过度印迹或培养物血细胞比容的变化,则可以相对较快地研磨较短的薄片;然而,它们的较短长度将限制TEM中可用于数据收集的区域(图5B)。

图 5:确定在铣削过程中何时达到最终薄片厚度。 (A) SEM 在 5 kV 下对网格的低放大倍率概览,显示削波期间的碳损伤。由于过度印迹,未损坏的区域含有非常薄的样品;然而,仍然有可能在这个网格(白色虚线轮廓内的区域)上铣削六个薄片,在一整天的冷冻FIBSEM上。比例尺,0.5毫米。 (B)从该网格(3 kV时的SEM)产生的短薄片(~10μm宽x 3μm长,不包括有机铂层),它仍然提供了两个区域来收集倾斜系列。比例尺,25 μm。 (C) 在最后抛光步骤中薄片的一系列 SEM 图像 (3 kV),显示了薄片变薄(从左向右移动)时对比度如何丧失。在所有图像中,横跨薄片中间的深黑色线是网格中的碳膜条。该区域前面的细胞在碳膜上方玻璃化,该区域后面的细胞在碳膜下方玻璃化。当薄片前缘左侧的有机铂涂层接近失去结构完整性时,铣削停止。这个停止点是在整个薄片被均匀厚度之前,这就是为什么薄片后部仍然有一些对比度更高的材料。(D)基于在(A)所示网格上铣削的薄片的抛光路线示例。抛光路线应从靠近FIB源的薄片开始,远离FIB源,以限制铣削材料在薄片表面上的再沉积。请点击此处查看此图的大图。
在抛光过程中,薄片的最终厚度将取决于被研磨区域中样品的结构、有机铂涂层的完整性以及可用时间。理想情况下,应将样品变薄,直到在 3 kV 下通过 SEM 在整个薄片表面上失去对比度,这表明它是均匀的电子透明且厚度约为 150-200 nm(图 5C)。但是,如果有机铂层形成孔或薄片开始弯曲,则可能需要在此点之前停止铣削。在这种情况下,薄片在前面可能仍然足够薄,并且仍然可用于断层扫描。相反,如果薄片看起来稳定,则可以薄过对比度损失阶段,通过将铣削图案移近(~100 nm或更小),使其更薄。这将取决于下游工作流程所需的厚度。需要低放大倍率的SEM图像来规划抛光路线,从靠近离子束源开始并逐渐消失(图5D)。抛光路线的方向对于防止烧蚀材料重新沉积到已经完成的薄片上非常重要。
收集和处理倾斜系列数据
一旦加载到TEM中,低放大倍率全网格蒙太奇(~150x)将识别薄片的位置,这可以与铣削结束时拍摄的低放大倍率SEM图像相关联。对于跳入冷冻裂子,大部分网格对电子不透明,因此薄片位置在黑色背景上显示为白色凹口(图6A)。应注意薄片相对于显微镜倾斜轴的角度,因为与垂直方向超过~10°会使倾斜系列采集变得困难。在每个薄片位置的中等放大蒙太奇(~1,500x)将概述生物含量,并检查转移损坏,结晶冰或过度的表面污染(图6B-D)。还应在高倾斜度下进行检查,以确保没有表面污染遮挡采集或聚焦区域。选择采集区域不仅取决于生物特征,还取决于周围区域冰的结构完整性,例如,避免裂缝,因为这些区域会漂移,或者过度遮挡的区域,其中薄片的厚度会有所不同。在获取倾斜系列之前,对网格施加±10°预倾斜,以使薄片(而不是网格)的平面垂直于光轴。预倾斜的方向可以通过中放大蒙太奇中薄片前缘的位置(寻找残留的有机铂涂层)来确定。对于这里使用的TEM(300 kV Titan Krios),如果薄片的前边缘在地图上指向上方,则需要+10°预倾斜,如果它们指向下方,则需要-10°预倾斜。每个网格可能由于它们在镊子中拾取并插入自动加载器的方向而不同(面向左侧或右侧的剖面部分产生 180° 旋转)。最后一个考虑因素是像素大小。通常,倾斜系列收集大约 2.5-7 Å/像素,同时考虑到感兴趣特征的大小、生成的断层扫描数据的目标分辨率和薄片的表面积,这可能会限制采集区域的大小。可以使用较小的像素尺寸来获得高分辨率信息,我们在这些样品上成功使用的最小像素尺寸为1.4 Å /像素(数据未显示)。漂移在较小的像素尺寸下会更明显,并且只真正适用于薄(<100 nm)薄片,其中最大化分辨率在研究中很重要。

图 6:选择要从中获取倾斜序列的可访问感兴趣区域 (A) 低放大倍率 TEM 图的一部分,显示包含薄片的区域,在黑色背景上显示为六个白色凹口(红色箭头)。白色方块是破碎的碳膜。(B) 受损和脱光薄片的中等放大倍率图。在薄片(FE)的前缘,有机铂涂层已折断(1)。薄片中心有一块清晰的结晶冰块(2)。离子束未能在薄片(BE)的后边缘突破,因为网格棒旁边的冰太厚。只有一小部分薄片不受BE(3)周围冰的影响,形成楔形。厚度还导致搁板在薄片上方被切割(4),这很可能会阻挡TEM中高倾斜细胞的视野。(C) 在TEM中查看的整个薄片的中放大蒙太奇。从薄片收集倾斜系列时要避免的典型问题或区域是:表面污染覆盖(SC),被有机铂涂层覆盖(OP,黄色),近裂缝(CR和黑色箭头),由于生物材料的密度变化而有帘子(CU和蓝色括号内的区域),以及因有机铂涂层断裂而减弱的区域(绿色圆圈)。唯一可用于倾斜系列采集的区域是两个黑色虚线框(标记为 1 和 2)内的区域。必须在高倾斜度下检查视图,以确保表面污染不会遮挡感兴趣区域或焦点区域。(D)更干净的薄片的中等放大蒙太奇,但在抛光过程中由于有机铂涂层变薄(绿色圆圈)仍然有裂缝(CR)。在这里,感兴趣的区域由薄片内观察到的细胞类型突出显示,在这种情况下,这些细胞类型是单个裂殖子,位于碳层(橙色)后面,朝向薄片(黑色虚线框)的后部。比例尺,3 μm。 请点击此处查看此图的大图。

图 7:从 FIB 铣削的薄片中获取冷冻电子断层扫描数据。 (A) 含有最近被恶性疟原虫裂殖子侵入的红细胞的薄片区域的显微照片。在(B)中,注释相同的图像以显示红细胞(红色),许多双壁细胞内囊泡(分别为内膜和外膜的紫色和蓝色)和被来自宿主细胞的第二层膜包围的裂殖子(绿色)的边界(黄色)。黑匣子显示获取倾斜系列的区域。比例尺,500 nm。(C) 在 XY 平面中从分离殖子顶端获取的 8 倍分档断层图(2.4 Å/像素)和 (D) 其注释中平均观察 20 个中心切片,显示围绕细胞的两层膜(绿色和黄色)和堆叠在裂殖子顶端的四层膜(蓝色)与电子致密蘑菇形特征(紫色)相关。红色箭头表示顶端膜堆和蘑菇形特征的连接处(也显示在F,i部分中)。 黑色箭头表示裂殖子质膜与寄生虫内多层囊泡之一之间的融合事件(也显示在F,ii部分中)。 显示宿主红细胞膜(红色),黑色虚线显示XZ平面中观察到的横截面的位置,如(E)所示。横截面(E)中的特征着色和标记与部分(D)相同,彩色箭头指向膜。黑色箭头表示铣削后涂在薄片上的溅射涂层的位置以及所示薄片的厚度。对于零件 (C-E),比例尺,500 nm。(F)部分(C)中红色和黑色箭头指示的特征的更详细视图,显示了裂殖子顶端膜堆脂质双层中的定义(i)以及多层囊泡与裂殖子质膜之间的融合事件。比例尺,75 nm。请点击此处查看此图的大图。
这项工作的主要重点是剖析裂殖子出口的途径 P. falciparum 但鉴于研究中使用的细胞群永远不可能完全同质,通常观察到薄片内细胞发育的其他阶段。此处显示的示例 (图7) 含有最近被 P. falciparum 寄生虫(裂殖子)。所使用的薄片厚度为240 nm,并且在插入TEM之前,网格在氩气气氛中轻轻溅射镀有铂,导致对比度略低于通常预期。红细胞膜可以在整个细胞周围追踪。红细胞内有三个封闭的膜结合结构,两个囊泡,每个囊泡被一个双层膜和一个灯泡形特征(最宽处为1.2μm x 0.9μm)包围,这与它是裂殖子(图7A-B).两个囊泡的内容物似乎与红细胞的内容物相似,这表明这些囊泡可能含有血红蛋白。先前已观察到入侵后宿主红细胞内存在囊泡45.它们被认为是由裂殖子中称为rhoptry的分泌细胞器分泌的脂质和其他毒力因子引起的,这些细胞器在入侵期间排放到宿主红细胞中。裂殖子被两个紧密相连的膜包围,其中最内层可能是裂殖子的天然质膜,其上没有可见的表面涂层,最外层必须来自宿主红细胞膜,该红细胞膜在入侵时包裹着裂殖子。裂殖子的细胞质包含许多多层囊泡和电子致密蘑菇形特征,与顶端的膜堆相邻。在该区域(2.4 Å/像素)上获得的倾斜系列表明它包含一堆四个膜,这些膜似乎与蘑菇形特征(图7C-E).引人注目的是,这种形态与成熟裂殖子顶端细胞器和细胞结构的正常排列完全不同。为了评估这一点,从在切入冷冻和研磨(图8).这表明裂殖子的顶端包含两个突出的棒状分泌细胞器,称为rhoptry,它们位于细胞顶端的一组三个极环内,并被许多称为微克星的较小分泌细胞器包围。最内侧的极环附着在裂殖子质膜下方的双膜结构上,称为内膜复合物,其中包含驱动入侵的运动蛋白。已经表明,在侵袭期间,分泌细胞器的内容物被排放到裂殖子表面并进入宿主红细胞,促进裂殖子附着到宿主红细胞并启动驱动侵袭的运动复合物45.这里的数据显示,在入侵后,裂殖子不包含类似于罗氏体、微缩子或极环的可观察到结构,这表明裂殖子顶端的形态发生了显着变化。先前已通过固定室温切片的TEM显示入侵前的Rhoptry融合46,这与我们在入侵后状态的裂殖子中观察到的蘑菇形特征的产生一致。以前没有观察到与该特征相连的膜堆,并且由于新入侵的裂殖子中不存在IMC的迹象,我们假设膜堆可能是入侵完成后残留的IMC机制的残余物,但这仍有待证实。
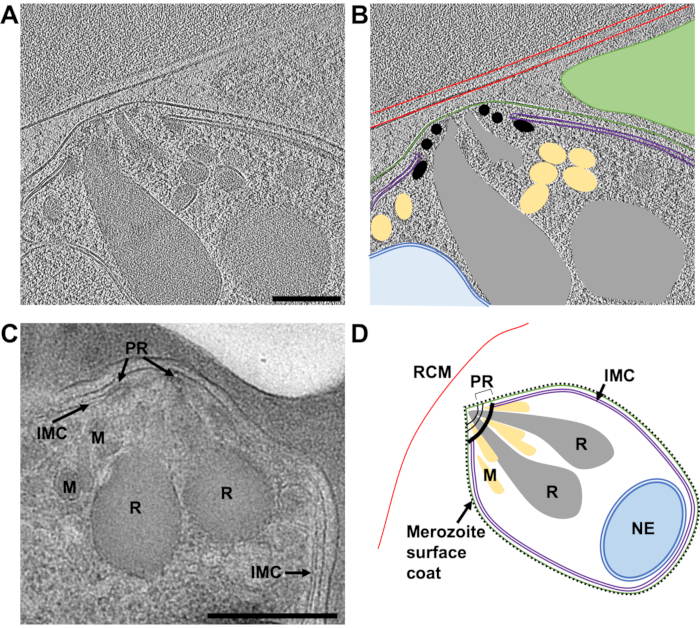
图 8:通过 FIB 铣削薄片的冷冻 ET 和塑料切片的 TEM 确定成熟裂殖子的顶端。 (A) 来自 230 nm 厚薄片的 8 倍分档断层扫描(2.74 Å/像素)的平均 20 个中心切片,显示了成熟裂殖子顶端的典型形态。裂殖子在低速冷冻前用E64处理,因此PV膜已经破裂,裂殖子包含在宿主红细胞内。(B)显示与(A)相同,但带有注释以指示宿主红细胞膜(RCM,红色),裂殖子质膜(绿色),内膜复合物(IMC,紫色),极环(PR,黑色),微粒(M,黄色),rhoptry(R,灰色)和核包膜(NE,蓝色)。在这个断层图区域中不在平面外的相邻裂殖子由绿色三角形表示。比例尺,200 nm。(C)冷冻电子断层扫描观察到的细胞特征与保存在塑料切片中的裂殖子的透射电镜特征一致。类似的细胞特征在经过化合物 2 处理的裂殖子的成熟裂殖子中也表现出来,在 PV 膜破裂之前阻止出口。比例尺,500 nm。(D)裂殖子的注释示意图,显示了部分(A-C)的细胞特征。请点击此处查看此图的大图。
| 矩形铣削图案之间的保护区域的厚度(μm) | 30 kV 时的标称离子束电流 (pA) |
| 3 | 300 |
| 1.5 | 100 |
| 0.75 | 50 |
| 0.3 | 30 |
| 0.2 - 0.06 (最终抛光) | 30* |
表 1:生产薄薄片的铣削策略。 通过减少与受保护区域厚度相对应的离子束电流来进行逐步铣削。这限制了样品加热,防止了失真。*抛光应平行进行,以从两侧均匀地将热量施加到薄片上,从而降低它们在达到最终厚度时弯曲或弯曲的风险。其他步骤可以按顺序完成,在移动到下一个光束电流之前,在薄片上方和薄片下方铣削图案。应在 1.5 pA 光束电流下测量网格以定位铣削位置,以尽量减少样品加热。 请按此下载此表格。
讨论
虽然冷冻FIB研磨变得越来越常规,但制备用于研磨的最佳样品却没有;因此,该协议中的大多数关键步骤都发生在样品到达cryoFIB-SEM之前。在尝试研磨之前,需要通过多轮细胞制备、冷冻以及光学和电子显微镜筛选来优化样品,以生产出最佳样品。拥有最好的样品不仅可以增加成功的机会,还可以优化设备的使用。出于这个原因,大多数国家设施要求证明在给予机器时间之前已经进行了充分的优化。一旦进入冷冻FIB-SEM,最大限度地提高有机铂涂层的有效性对于产生均匀薄的薄片至关重要。最后,耐心和良好的样品处理是用户的必备技能,用户需要坐上多天,生产然后转移含有细腻薄片的网格。随着自动铣削策略47,48 的引入,这种情况可能会改变,但到目前为止,大多数工厂的整个铣削过程仍然主要是手动的。
虽然这项工作仅集中在 恶性疟原虫 裂殖质上,但这里介绍的方法可以很容易地修改,以优化其他细胞类型的网格制备和研磨。需要考虑的重要因素是应用于网格的细胞密度、网格类型(铜对某些细胞有毒)、碳膜中孔的大小和间距、印迹时间和印迹方法(单/双面、手动或自动)。此外,如果细胞在网格上生长(通常是带有孔状碳膜的金网格),则可以在印迹和冷冻之前通过光学显微镜检查汇合度。铣削策略取决于单元在网格上的沉积方式。对于疟疾感染的红细胞,网格基本上被一层完整的细胞覆盖,在某些区域更厚,在其他区域更薄。沿着这个梯度在一个区域的多个点进行铣削,其中冰厚度产生适合断层扫描尺寸的薄片。这种方法适用于较小的细胞,因为您可以通过多个细胞产生包含切片的薄片。对于较大的细胞或细胞团块,一个细胞或细胞团块可能产生一个薄片。
网格处理和样品转移仍然是该工作流程的主要挑战之一。由于破损或裂缝、遮挡生物学的帘子伪影、过度的表面污染以及 TEM 内的网格方向问题,薄片可能会丢失,需要额外的处理步骤来重新定位网格。损耗程度因日复一日、因电网而异,但随着时间的推移,通过实践和处理经验可以得到改善。在这项研究中,发现网格可以在自动加载器中多次小心地重新定向,而不会破坏薄片,这有时具有洗掉表面冰的好处。此工作流程的另一个主要限制是生成薄片所需的时间。由于生产缓慢,因此拥有适当优化的样品至关重要,以使铣削尽可能高效。
最近引入了许多对玻璃体生物样品的FIB研磨的适应。改变游戏规则的是,在cryoFIB-SEM腔室内实施低温冷却的提出工具,可以从高压冷冻样品中研磨更大的材料块。这些块可以连接到金属棒上,也可以在夹持器中拾取并移动到第二个样品位置,其中包含经过特殊修改的EM网格。然后可以用有机铂涂覆块并研磨以生成薄片。从高压冷冻材料中研磨薄片的能力意味着可以处理更大的细胞和组织,特别是通过相关荧光显微镜12靶向区域。最近对FIB铣削方法的其他调整包括通过楔形预铣削样品16,微流体冷冻固定49 和电子显微镜网格的光微图案化来减少窗帘伪影,以改善细胞分布50。此外,已经证明,铣削薄片两侧的微膨胀间隙可以减轻周围样品在达到最终厚度时的压缩51。这在铣削连续细胞层时可能特别有用,例如本研究中的样品,在最后的抛光步骤中有时会看到薄片弯曲。
电子显微镜的未来很可能是通过亚断层图平均法确定 原位 分子结构,而FIB铣削是一种重要的工具,有助于为这些类型的工作流程生产玻璃体生物样品。虽然FIB研磨在生物应用中仍处于起步阶段,但由于学术界和国家设施研究人员的辛勤工作,以及对开发cryoFIB-SEM技术以支持研究的商业投资,方法开发正在快速进行。
披露声明
作者没有什么可透露的。
致谢
这项研究全部或部分由威康信托基金会资助(212916/Z/18/Z)。出于开放获取的目的,作者已对本提交的任何作者接受的手稿版本申请了CC BY公共版权许可。
开发该方法的这个项目由医学研究委员会授予Helen R. Saibil,Roland A. Fleck和Michael J. Blackman的MR / P010288 / 1赠款资助。 恶性疟原虫 的培养物在弗朗西斯·克里克研究所(The Francis Crick Institute)培育,得到了迈克尔·J·布莱克曼(Michael J. Blackman)小组成员的支持。作者要感谢Ser Ying (Michele) Tan博士在薄血涂片中提供了化合物2和E64处理的裂殖子的图像。大多数薄片是在eBIC工作人员的支持下生产的,我们非常感谢在研究提案NT21004上获得Scios双光束cryoFIB-SEM。作者还感谢皇家学会行业奖学金计划 (INF\R2\202061) 在 CUI 内继续开发 FIB 铣削技术方面的支持。作者还要感谢Helen R. Saibil对本方法论文和监督该项目的有益讨论。
材料
| Name | Company | Catalog Number | Comments |
| c-clips | Thermo Fisher Scientific | 1036171 | |
| Clipping station | Thermo Fisher Scientific | n/a | Direct quote from Thermo |
| Clipping station | Sub-angstrom | CSA-01 | |
| Compound 2 | n/a | n/a | Synthesised by Dr Simon A. Osborne, LifeArc |
| Cryo-FIB specific autogrid rims | Thermo Fisher Scientific | 1205101 | |
| E64 | Sigma | E3132 | |
| Emitech K100X glow discharge unit | Quorum | n/a | |
| Gibco RPMI 1640 media | Thermo Fisher Scientific | 12633012 | Formulation used for culturing is custom made (REF 041-91762 A) and includes Albumax, glutamine, HEPES and hypoxanthine supplements |
| Giemsa Stain | VWR International | 350864X | |
| Glass slides | Thermo Fisher Scientific | 11562203 | |
| Grid boxes | Sub-angstrom | PB | For clipped grids |
| Grid boxes | Thermo Fisher Scientific | n/a | For clipped grids - direct quote from Thermo Fisher Scientific |
| Grid boxes | Agar Scientific | AGG3727 | |
| Home-made manual plunge freezing rig | n/a | n/a | With an insulated ethane pot (high-density foam) and liquid nitrogen bath (polystyrene) on a bench top in a containment facility. |
| Human blood | n/a | n/a | UK National Blood and Transplant service |
| JEOL 4700F Z JSM with a Leica VCT500 stage cooling system | JEOL | n/a | FIB-SEM |
| Leica EM ACE600 with a VCT500 cryostage | Leica | n/a | sputter coater |
| Leica EM ACE900 | Leica | n/a | e-beam rotary coater. In a humidity controlled room. |
| Linkam cryo-stage for light microscope | Linkam | Model No. CMS196 | Cassettes for clipped and un-clipped grids. In a humidity controlled room. |
| Methanol | Sigma | 179957 | |
| Nikon Eclipse E200 light microscope | Nikon | n/a | with Linkam cryo-stage in a humidity controlled room. |
| Percoll | VWR International | 17-0891-01 | Solution for percoll cushion is 35 ml 10x PBS, 150 ml RPMI 1640 media and 315 ml Percoll |
| Quantifoil copper 200 mesh 2/4 holey carbon EM Finder grids | Quantifoil | N1-C17nCuH2-01 | 100 pack |
| Quantifoil copper 200 mesh 2/4 holey carbon EM grids | Quantifoil | N1-C17nCu20-01 | 100 pack |
| Quorum PP3010 prep-chamber | Quorum | n/a | sputter coater |
| Scios dual beam equipped with a Quorum PP3010 transfer stage. | FEI | n/a | FIB-SEM |
| Staedtler Lumocolor fine black permanent marker pen | Viking Direct | ND538522 | |
| TFS Titan Krios 300 kV TEM | Thermo Fisher Scientific | n/a | TEM equipped with a K2 or K3 camera. |
| Whatmann grade 1 filter paper | Sigma | WHA1001150 | |
| Zeiss Axio Scope A1 light microscope | Zeiss | n/a | with Linkam cryo-stage in a humidity controlled room. |
参考文献
- Baumeister, W. From proteomic inventory to architecture. FEBS Letters. 579 (4), 933-937 (2005).
- Rigort, A., Villa, E., Bäuerlein, F. J. B., Engel, B. D., Plitzko, J. M. Integrative approaches for cellular cryo-electron tomography: Correlative imaging and focused ion beam micromachining. Methods in Cell Biology. 111, 259-281 (2012).
- Oikonomou, C. M., Chang, Y. W., Jensen, G. J. A new view into prokaryotic cell biology from electron cryotomography. Nature Reviews Microbiology. 14, 205-220 (2016).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Giannuzzi, L. A., Stevie, F. A. A review of focused ion beam milling techniques for TEM specimen preparation. Micron. 30 (3), 197-204 (1999).
- Narayan, K., Subramaniam, S. Focused ion beams in biology. Nature Methods. 12 (11), 1021-1031 (2015).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Acadamy of Science of the United States of America. 109 (12), 4449-4454 (2012).
- Marko, M., Hsieh, C., Schalek, R., Frank, J., Mannella, C. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryo-electron microscopy. Nature Methods. 4 (3), 215-217 (2007).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: Focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23 (5), 771-777 (2013).
- Wang, K., Strunk, K., Zhao, G., Gray, J. L., Zhang, P. 3D structure determination of native mammalian cells using cryo-FIB and cryo-electron tomography. Journal of Structural Biology. 180 (2), 318-326 (2015).
- de Winter, D. A. M., et al. In-situ integrity control of frozen-hydrated, vitreous lamellas prepared by the cryo-focused ion beam-scanning electron microscope. Journal of Structural Biology. 183 (1), 11-18 (2013).
- Schaffer, M., et al. A cryo-FIB lift-out technique enables molecular-resolution cryo-ET within native Caenorhabditis elegans tissue. Nature Methods. 16 (8), 757-762 (2019).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Albert, S., et al. Proteasomes tether to two distinct sites at the nuclear pore complex. Proceedings of the National Acadamy of Science of the United States of America. 114 (52), 13726-13731 (2017).
- Guo, Q., et al. In situ structure of neuronal C9orf72 poly-GA aggregates reveals proteasome recruitment. Cell. 172 (4), 696-705 (2018).
- Schaffer, M., et al. Optimized cryo-focused ion beam sample preparation aimed at in situ structural studies of membrane proteins. Journal of Structural Biology. 197 (2), 73-82 (2017).
- Szwedziak, P., Wang, Q., Bharat, T. A. M., Tsim, M., Löwe, J. Architecture of the ring formed by the tubulin homologue FtsZ in bacterial cell division. eLife. 3, 04601 (2014).
- Carlson, L. A., et al. Cryo electron tomography of native HIV-1 budding sites. PLOS Pathogens. 6 (11), 1001173 (2010).
- Klein, S., et al. SARS-CoV-2 structure and replication characterized by in situ cryo-electron tomography. Nature Communications. 11 (1), 5885 (2020).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high pressure frozen samples: Bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. Journal of Structural Biology. 184 (2), 355-360 (2013).
- Murphy, G. E., et al. Correlative 3D imaging of whole mammalian cells with light and electron microscopy. Journal of Structural Biology. 176 (3), 268-278 (2012).
- Heymann, J. A. W., et al. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2012).
- Spehner, D., et al. Cryo-FIB-SEM as a promising tool for localizing proteins in 3D. Journal of Structural Biology. 211 (1), 107528 (2020).
- Kamino, T., Yaguchi, T., Ohnishi, T., Ishitani, T., Osumi, M. Application of a FIB-STEM system for 3D observation of a resin-embedded yeast cell. Journal of Electron Microscopy. 53 (5), 563-566 (2004).
- Han, H., Zuber, B., Dubochet, J. Compression and crevasses in vitreous sections under different cutting conditions. Journal of Microscopy. 230, 167-171 (2008).
- Matias, V. R. F., Al-amoudi, A., Dubochet, J., Beveridge, T. J. Cryo-transmission electron microscopy of frozen-hydrated sections of Escherichia coli and Pseudomonas aeruginosa. Journal of Bacteriology. 185 (20), 6112-6118 (2003).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150 (1), 109-121 (2005).
- Al-Amoudi, A., et al. Cryo-electron microscopy of vitreous sections. The EMBO Journal. 23 (18), 3583-3588 (2004).
- Bouchet-Marquis, C., Dubochet, J., Fakan, S. Cryoelectron microscopy of vitrified sections: A new challenge for the analysis of functional nuclear architecture. Histochemistry and Cell Biology. 125 (1-2), 43-51 (2006).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. Journal of Structural Biology. 172 (2), 180-190 (2010).
- Dubochet, J., Adrian, M., Chang, J. -. J., Lepault, J., McDowall, A. W. Cryoelectron microscopy of vitrified specimens. Cryotechniques in Biological Electron Microscopy. , 114-131 (1987).
- Hsieh, C., Schmelzer, T., Kishchenko, G., Wagenknecht, T., Marko, M. Practical workflow for cryo focused-ion-beam milling of tissues and cells for cryo-TEM tomography. Journal of Structural Biology. 185 (1), 32-41 (2014).
- Harapin, J., et al. Structural analysis of multicellular organisms with cryo-electron tomography. Nature Methods. 12 (7), 634-636 (2015).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. Journal of Structural Biology. 180 (3), 572-576 (2012).
- Duyvesteyn, H. M. E., et al. Machining protein microcrystals for structure determination by electron diffraction. Proceedings of the National Acadamy of Science of the United States of America. 115 (38), 9569-9573 (2018).
- Blackman, M. J. Purification of Plasmodium falciparum merozoites for analysis of the processing of merozoite surface protein-1. Microbes as Tools for Cell Biology. 45, 213-220 (1995).
- Hagen, W. J. H., Wan, W., Briggs, J. A. G. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197 (2), 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2 - anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14 (4), 331-332 (2017).
- Grant, T., Grigorieff, N. Measuring the optimal exposure for single particle cryo-EM using a 2.6 Å reconstruction of rotavirus VP6. eLife. 4, 06980 (2015).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192 (2), 216-221 (2015).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Turoňová, B., Schur, F. K. M., Wan, W., Briggs, J. A. G. Efficient 3D-CTF correction for cryo-electron tomography using NovaCTF improves subtomogram averaging resolution to 3.4 Å. Journal of Structural Biology. 199 (3), 187-195 (2017).
- Arnold, J., et al. Site-specific cryo-focused ion beam sample preparation guided by 3d correlative microscopy. Biophysical Journal. 110 (4), 860-869 (2016).
- Riglar, D. T., et al. Super-resolution dissection of coordinated events during malaria parasite invasion of the human erythrocyte. Cell Host & Microbe. 9 (1), 9-20 (2011).
- Hanssen, E., et al. Electron tomography of Plasmodium falciparum merozoites reveals core cellular events that underpin erythrocyte invasion. Cellular Microbiology. 15 (9), 1457-1472 (2013).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-electron tomography. eLife. 9, 52286 (2020).
- Fuest, M., et al. In situ microfluidic cryofixation for cryo focused ion beam milling and cryo electron tomography. Scientific Reports. 9 (1), 19133 (2019).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208 (3), 107389 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。