Method Article
菌体、円周体、口蓋味覚芽の全山染色、可視化、分析
要約
本論文では、全体および無傷の味覚芽(それらを内面化する神経線維を含む)を一貫して生み出し、味覚芽内の構造と周囲の乳頭の構造間の関係を維持する全真菌形態、周回、口蓋味覚芽の組織調製、染色、分析の方法について説明する。
要約
味覚芽は、口腔内の化学刺激のサブセットを検出するために特化した味覚伝達細胞のコレクションです。これらの伝達細胞は、脳にこの情報を運ぶ神経線維と通信します。味覚伝達細胞は成人期を通じて絶えず死んで置換されるため、味覚芽環境は複雑で動的であり、細胞の種類、その位置、およびそれらの間の物理的な関係の詳細な分析を必要とします。詳細な分析は、抗体透過性を著しく低下させた舌組織の不均一性および密度によって制限されている。これらの障害は、測定が近似され、細胞の関係が失われるように、セクション間で味覚芽を分割するプロトコルを切り離す必要があります。これらの課題を克服するために、本明細書に記載されている方法は、真菌形態乳頭、乳頭の乳頭の周り、および口蓋の3つの味覚領域から全体の味覚芽および個々の末端アーバーを収集、イメージング、および分析することを含む。全体の味覚芽を収集すると、バイアスと技術的な変動を減らし、味覚芽のボリューム、総味覚芽のインナレーション、トランスデューシング細胞数、および個々の末端アーバーの形態を含む機能の絶対数を報告するために使用することができます。この方法の利点を実証するために、本論文は、一般的な味覚芽マーカーとすべての味覚繊維のラベルを使用して、真菌形態と味覚芽の間の味覚芽とインナレーション量の比較を提供する。味覚ニューロンのまばらな細胞遺伝的標識(味伝達細胞の標識されたサブセットを有する)の使用のためのワークフローも提供される。このワークフローは、画像解析ソフトウェアを用いて、個々の味覚神経の構造、細胞型数、細胞間の物理的関係を解析します。これらのワークフローは、組織の調製と全体の味覚芽とその内側のアーバーの完全な形態の分析のための新しいアプローチを提供します。
概要
味覚芽は、口腔内に存在する化学的味覚刺激のサブセットを結合する50〜100特殊上皮細胞のコレクションである。味移調細胞は、一般に、分子マーカーと相関していた電子顕微鏡基準に基づいて、タイプ1、2、3、4、5、6、7、8、9として存在すると考えられている。II型細胞は、ホスホリパーゼC-β2(PLCβ2)2および一過性受容体電位カチオンチャネルを発現し、サブファミリーMメンバー51および甘味、苦味、及び旨味1、10を透過する細胞が含まれる。III型細胞は炭酸脱水酵素4(Car4)11とシナプトソーム関連タンパク質258を発現し、酸味11に主に反応する細胞を示す。塩分を伝達する細胞は、12、13、14ほど明確に線引いがされていないが、タイプI、タイプII、タイプIII細胞15、16、17、18、19を含む可能性がある。味覚芽環境は複雑で動的であり、味覚伝達細胞が成人期を通じて継続的にひっくり返り、基底前駆細胞3、20、21に置き換えられることを考えると。これらの味伝達細胞は、脳幹に味覚情報を渡す原発性およびペトロサル神経節から擬似単極神経線維に接続する。これらのニューロンは、形態に関する情報が最近までとらえどころが見えなくなっていたため、主に22,23を運ぶ味覚情報の種類に基づいて分類されている。II型細胞はカルシウム恒常性調節薬タンパク質1イオンチャネル25を介して神経線維と通信するが、一方、III型細胞は古典的なシナプス8,26を介して通信する。細胞型系統の導入を含む味覚芽細胞のさらなる特徴付け、それらの分化に影響を与える因子、および連結アーバーの構造は、すべて活発な調査の分野である。
味覚芽の研究は、いくつかの技術的な課題によって妨げられています。舌を構成する異種および緻密な組織は、免疫組織化学27、28、29の抗体透過性を有意に低下させる。これらの障害には、セクション間で味覚芽が分割され、測定が代表的なセクションに基づいて近似されるか、セクション間で合計されるという切片プロトコルが必要です。これまでは、代表的な薄いセクションを使用して、体積値とトランスデューシングセル数30の両方を近似していました。より厚いシリアル断面化は、すべての味覚芽セクションのイメージングと、各セクション31からの測定値の合計を可能にする。このような厚いセクションを切断し、全体の味覚芽を選択すると、小さな味覚芽32、33、34に向かってサンプリングバイアス。切除された味覚芽からの神経の内挿推定値は、ピクセル数13、35の分析に基づいており、36、37、38で定量化した場合。これらの測定値は、アーバーが分割されるため(通常はラベルが不十分)ため、個々の神経アーバーの構造と数を完全に無視します。最後に、上皮を剥がすと味覚芽全体が39、40に染色されますが、味覚芽神経線維を取り除き、細胞間の正常な関係を混乱させる可能性があります。したがって、味覚芽内の構造的関係の調査は、染色アプローチによって引き起こされるこの混乱のために制限されています。
全構造コレクションは、代表的なセクションの必要性を排除し、容積、細胞数、および構造形態41の絶対値測定の決定を可能にする。このアプローチは、精度を高め、バイアスを制限し、技術的な変動性を低減します。味覚芽は、34、42、および領域間で43、44、および全体の味覚芽分析の両方でかなりの生物学的変動性を示すので、この最後の要素は重要であり、完全な細胞数を制御と実験条件の間で比較することができます。さらに、無傷の味覚芽を収集する能力は、異なる形容細胞とそれに関連する神経線維との間の物理的関係の分析を可能にする。味移し細胞は互いに45と通信し、神経線維46と通信することができるので、これらの関係は正常な機能にとって重要である。したがって、機能喪失条件は、細胞の損失によるものではなく、セル関係の変化によるものと考えられます。ここでは、味覚芽とその内因、味覚細胞の数と形状の両方のボリューム分析を精製するための絶対的な測定の利点を達成するために全体の味覚芽を収集し、およびトランスデューシング細胞の関係と神経アーバー形態の分析を促進するための方法を提供します。また、この新しい組織準備のための全型実装方法の下流に提示される:1)味覚芽量と総インナービネーションを分析するための1と2)味覚ニューロンのまばらな細胞遺伝的標識(味覚変容細胞のサブセットを標識)と、その後の味覚神経アーバー形態の分析、味覚細胞型の数とその形状の分析 細胞とその神経樹立。これらのワークフローは、組織の準備と全体の味覚芽の分析とその内側のアーバーの完全な形態に対する新しいアプローチを提供します。
プロトコル
注:すべての動物は、米国公衆衛生サービスポリシーによる「人道的ケアと実験動物の使用」および「実験動物のケアと使用のためのNIHガイド」によって定められたガイドラインに従って世話を受けました。Phox2b-Creマウス(MMRRC株034613-UCD、NP91Gsat/Mmcd)またはTrkBCreERマウス(Ntrk2tm3.1(cre/ERT2)Ddg)をtdTomatoレポーターマウス(Ai14)で飼育した。アドビリン・クロイアー47は、Phox2b-flpo48およびAi65で飼育された。5-エチニル-2'-デオキシウリジン(EdU)注射の場合、EdUを調製し、ペレア・マルティネスららによって用量を計算した。
1. 材料の準備
- ソリューションの準備
- 2倍蒸留水(ddH2O)にリン酸一塩基ナトリウム5.244g、23.004gのリン酸二分ナトリウムを攪拌板に溶かします。pHを7.4に調整し、総体積を持って0.2Mリン酸ナトリウム緩衝液(PB)の1 Lを得る。
- パラホルムアルデヒドを発煙フードに溶かし、撹拌板で90°Cになるまで攪拌しながら加熱します。 4 M NaOH溶液を滴下してパラホルムアルデヒドをクリアし、真空のエルレンマイヤーフラスコとセラミックフィルターをフィルターペーパーで使用して溶液をフィルター処理します。0.2 M PBの等容量を加え、pHを7.4に調整して0.1 M PBで4%PFAを得る。
2. 組織の準備
- 組織コレクション
- 無菌生理液10mLと2,2,2-トリブロモエタノール5gとtert-アミルアルコール5mLを含むストック溶液の0.25mLを含む働く溶液を用いた麻酔薬の過剰摂取を使用した犠牲マウス。0.1 M PBで4%PFAを有する経心的にパーフューズ;舌と口蓋を取り除きます。
- 後舌を分離するコロナカットを使用して、周回味覚芽を分離します, 交間部のeminenceの後ろに;かみそり刃で味覚芽を切り落とす。そして、正中線で前舌を二分します。0.1 M PBで4%PFAで4°Cで一晩後固定。
- 4°Cで一晩30%スクロースで組織を凍結保護する。
注:この組織は、ドライアイス上のビーカーで冷やした2-メチルブタンを使用して最適な切断温度(OCT)化合物で凍結し、ここで一時停止する必要がある場合は-80°Cで保存することができます。
- 真菌形態の味覚芽
- ステップ2.2.8に備えて、ドライアイスのビーカーで2-メチルブタンを冷やす。
- 0.1 M PBで舌を解凍し、すすいでください。真菌形態の乳頭を含む舌の半分を、解剖顕微鏡の下のガラススライドに置きます。
- 鈍い終わりの鉗子と解剖はさみを使用して筋肉を取り除きます。鈍い終わりの鉗子を使用して、リングアル上皮が湾曲しているように組織を開いたままにし、上皮に平行に粗い解剖はさみの刃を保つことによって平らな配向を保障する。
- それは味覚芽が含まれているので、舌の腹側非角化上皮を捨てます。
- 角化上皮の下側に近い解剖のために細かい解剖はさみを使用してください。
注:残りの筋肉の厚さが均一で、表面が均一な抗体の浸透を確実にするために滑らかになるように、上皮の近くで解剖することが重要です。残りの筋肉の不均一な厚さの結果は、クライオスタット上で不均一な切断になり、筋肉が少ない領域で上皮が露出し、他の領域の筋肉の層が厚くなり、抗体の浸透を妨げる。 - 鈍い終わりの鉗子を使用して上皮の一部を組織型(筋肉側を下)に置き、平らに横たわるようにします。組織が平らになったら、組織にOCTの滴を加える。
注:舌の先端が湾曲していることを考えると、組織が平らに置かることができるように、上皮を切断する必要があるかもしれません。 - 組織モールドを、解剖範囲の下で(以前ドライアイスで冷却した)金属ベースに置きます。OCTが凍結するまで鉗子で組織を軽くタップし続け、組織ができるだけ平らに凍結するようにします。
- OCT が凍結したら、すぐに OCT を追加し、凍結するまで 2-メチルブタン (ドライアイスで冷却) のビーカーに金型を入れます。
- クライオスタットの切除
注:クライオスタットは、抗体の浸透を阻害する可能性がある残りの皮下組織の微細除去に使用されます(図1)。- OCT金型をクライオスタットに取り付け、20 μmのセクションをカットします。各セクションを収集し、それを上皮の基部に近く評価するために、それを光顕微鏡下で見る(図1E-H)。
- 上皮の下側から組織を剃った後、上皮を解凍し、シェーカー上で0.1 M PBで2回する。
- 味覚芽の周回
- カミソリの刃でコロナカットを使用して、前舌から乳頭周りを分離します。同じカミソリブレードで2つのパラサジタルカットを使用して、解剖スコープ下で乳頭に組織を横切り除去します。乳頭を鉗子を使用して組織カビに入れ、乳頭周回の片端が組織の底に面するようにします。
注:乾燥氷の上のビーカーで冷やされた2-メチルブタンを使用して10月に組織を凍結し、手順をここで一時停止する必要がある場合は-80°Cで保存することができます。 - 凍結スタットの90μmの浮遊部分にティッシュを切りなさい。
- カミソリの刃でコロナカットを使用して、前舌から乳頭周りを分離します。同じカミソリブレードで2つのパラサジタルカットを使用して、解剖スコープ下で乳頭に組織を横切り除去します。乳頭を鉗子を使用して組織カビに入れ、乳頭周回の片端が組織の底に面するようにします。
- 味覚に芽を味わう
- 硬口蓋前を柔らかい口蓋と硬い口蓋の接合部に切り出す(図2)。はさみを使用して、下の組織から柔らかい口蓋を分離し、残りの骨片が切り取られるようにします。追加の筋肉と結合組織を削除します。.
注:一度除去すると、残っているすべての組織は、口蓋の下側に軽く付着している腺と緩い結合組織で構成されます。 - 鈍い終わりの鉗子で口蓋を保持し、カミソリの刃でそっとそれらを掻き取ることによって残りの腺と緩い結合組織を取り除きます。
注:乾燥氷の上のビーカーで冷やされた2-メチルブタンを使用して10月に組織を凍結し、手順をここで一時停止する必要がある場合は-80°Cで保存することができます。
- 硬口蓋前を柔らかい口蓋と硬い口蓋の接合部に切り出す(図2)。はさみを使用して、下の組織から柔らかい口蓋を分離し、残りの骨片が切り取られるようにします。追加の筋肉と結合組織を削除します。.
3. 免疫染色染色
- 0.1 M PB、3 x 15分で組織を洗います。組織をブロッキング溶液(ロバ血清3%、非イオン界面活性剤0.5%( 材料表参照)、0.1M PB)を一晩4°Cで1mLチューブに入れます。
- ブロッキング溶液を除去し、抗体溶液中の一次抗体(ウサギ抗PCLβ2)の組織(0.1M PB、非イオン界面活性剤0.5%)を4°Cで5日間インキュベートする。
- 0.1 M PBで洗浄し、各洗浄を4 x 15分、2次ロバ抗ウサギ488抗体(1:500)を抗体溶液中で4°Cで2日間インキュベートします。
- 0.1 M PB、洗浄ごとに4 x 15分で洗浄し、抗体溶液中の5%の正常なウサギ血清でブロックします。
- 0.1 M PB、4 x 15分で洗います。ロバの抗ウサギ遮断抗体(20 μg/mL)を抗体溶液中で4°Cで2日間インキュベートします。
- 1回の洗浄で0.1M PB、4×15分洗い、4°Cで5日間、抗体溶液中の蛍光標識(メーカーの指示に従って)に結合した一次抗体dsRed(ウサギ)でインキュベートします。
- 1回の洗浄で0.1M PB、4×15分洗い、抗体溶液中の一次抗体(ヤギ抗カー4(1:500))を4°Cで5日間インキュベートします。
- 0.1 M PB、4 x 15分ごとに洗浄してください。2次ロバ抗ヤギ647抗体(1:500)を抗体溶液中で4°Cで2日間インキュベートする。
- 0.1 M PBで洗浄し、各洗浄を4 x 15分、水性取り付け媒体に取り付け(上皮側を上に上に)、組織部の上にカバースリップを置きます。
注:ケラチン-8およびdsRedのみと同様に異なる種の抗体を使用する場合は、ステップ3.9に進む前に、ステップ3.2の抗体溶液にすべての一次抗体とステップ3.3のすべての二次抗体を追加します。
4. 共焦点画像化とデコンボリューション
- 60倍の目的(数値絞り= 1.40)、4 ms/pixel、ズーム3、カルマン2、サイズ1024 x 1024の共焦点顕微鏡を使用して、共焦点画像をキャプチャします。z 軸に沿って 0.47 mm のステップ サイズを選択します。乳頭へのインナーブをキャプチャするには、3のズームを持つ視野が狭すぎて乳頭へのすべてのインナビテーションをキャプチャするには2.5のズームを使用してください。
- イメージをデコンボリューションするには、一部の設定が自動的にイメージと共に読み込まれることに注意してください。したがって、モダリティ、対物レンズ、開口数、浸漬媒体、サンプル培地、および画像に取り込まれた蛍光穿光器の残りの詳細を記入してください。次に 、[3D デコンボリューション] を選択します。
5. 画像解析
- 味覚芽とインナーブボリューム
- 装飾された画像スタックをピクセルベースの画像解析ソフトウェアにインポートし ( 材料表を参照)、味覚芽のボリュームと味覚芽内の全インレーションの体積を決定します。
- メインのオブジェクトメニューで音量をオフにします。
- [オブジェクト] メニュー の [新しいサーフェスの追加 ] を選択 します。[自動作成をスキップ し、手動で編集する] を選択し、[ コンター] を選択します。
- [選択]をクリックし、矢印が+として表示され、味覚芽の境界線をトレースするのを観察します。スライサーを移動し、各光学セクションで味覚芽の輪郭を描きます。輪郭が完成したら、[サーフェスを作成]をクリックします。
- メインのオブジェクトメニューに味覚ボリュームオブジェクトが表示されている のを確認 します。 ツールの下で味覚芽のボリュームを見つけます。
- 味覚芽内のインナーブのボリューム
- 味覚芽オブジェクトの下にある 鉛筆 アイコンを選択し、 マスクをすべて選択します。
- ドロップダウンメニューで、神経線維ラベルに対応する 蛍光チャネル を選択します。 [重複したチャネルの作成] をオンにします。
- [ ボクセルをサーフェス外に設定:] をオンにし、 ボックスに 「0」 と入力します。
- 「 表示調整 」ウィンドウに表示される新しいチャンネルを観察します。
- [オブジェクト] メニュー の [ 新しいサーフェスを作成] を選択します。[ 自動作成をスキップする、手動で編集する]チェック ボックスをオフにします。
- 青い矢印を 2 回クリックして、次の手順に進みます。
- [削除] をクリックし、緑色の二重矢印をクリックして、味覚芽内に存在する神経線維の体積を表すサーフェスを完成させます。ボリュームの値を検索するには、神経繊維オブジェクトメニューの下にある「ツール」を選択し、ドロップダウンメニューから「ボリューム」を選択します。
- 乳頭へのインナーブの体積
- セクション 5.1 で説明したように、味覚芽のボリュームを作成します。
- テイストバッドオブジェクトの下にある 鉛筆 アイコンを選択し、 マスクをすべて選択します。
- ドロップダウンメニューで、神経線維ラベルに対応する 蛍光チャネル を選択します。 [重複したチャネルの作成] をオンにします。
- [サーフェス内のボクセルを: に設定] をオンにし、ボックスに「0」と入力します。[OK] をクリックします。
- [新しいサーフェスを追加]をクリックして サーフェスを生成します。[ 対象地域のみをセグメント化] を選択します。
- 青い矢印をクリックし、関心のある領域が味覚芽の基部から始まるようにZ値を増やします。
- 青い矢印を 2 回クリックして、次の手順に進みます。
- [削除] をクリックし、緑色の二重矢印をクリックして、乳頭へのインナビネーションの体積を表すサーフェスを完成させます。ボリュームの値を検索するには、神経繊維オブジェクトメニューの下にある「ツール」を選択し、ドロップダウンメニューから「ボリューム」を選択します。
- 端子アーバー接触解析
- 画像準備
- [編集]メニューに移動し、[3D トリミング] を選択します。すべての側面に画像をトリミングし、味覚芽の外側のスペースを削除します。
注:任意の関連する構造を削除せずに味覚芽に近いようにトリミング - 任意の余分な画像は、処理時間を長くします。 - メイン メニューの [編集] を クリックし、[ データ型の変更] をクリックします。ドロップダウンメニューから [To: 32ビットフロート ]を選択します。
- [オブジェクト] メニュー の [新しいサーフェスの追加 ] を選択 します。[ 自動作成をスキップして手動で編集する] をクリックし、[ コンター] を選択して、スライス位置を右にドラッグして、光学スライスの総数を確認します。
- 等角ボクセルを生成し、ボクセルがそれぞれ長方形(0.0691 x 0.0691 x 0.474)であるのではなく、ボクセルが元のボクサー強度の同じ値を持つ立方体に分割することによって、ボクセルが0.0691 x 0.0691 x 0.0691であることを確認します。[ イメージのプロパティ] を選択します。次に、ボクセルサイズのZ値をXまたはY値で除算し(= 0.474/0.0691)、その値に前のステップで見つかったスライス(光学断面)の数を掛けます。
- メインメニューの [編集] に戻り 、[3D リサンプル]を選択します。
- Z 値 (スライスの数) を新しく計算された値に置き換えます。
- [編集]メニューに移動し、[3D トリミング] を選択します。すべての側面に画像をトリミングし、味覚芽の外側のスペースを削除します。
- 蛍光に基づく自動サーフェスの作成
- [新しいサーフェスを追加] をもう一度クリックして新しいサーフェスを追加し、[対象の領域のみをセグメント化] をオフにして、[次へ] をクリックします。
- ソースチャネルドロップダウンメニューから、味を伝える細胞タイプの1つに対してチャンネルを選択します。スムーズを選択解除し、次のステップに進みます。
- 画像に存在する蛍光強度の範囲を示す次の画面で何かを変更しないでください。次のステップに移動するには、下部にある 青い矢印 をもう一度クリックします。
- [ 削除] をクリックし、 緑色の二重矢印 をクリックしてサーフェスを完成させます。
- 完成したセルサーフェスが表示される画面の左側にある [オブジェクト ] メニューに移動し 、Surface 2などの汎用的なものと呼ばれます。 サーフェス名 をダブルクリックして、ラベルが表す名前に従って名前を付けます。
注: この場合、生成されるサーフェスは PLCß2 ラベルのセルに基づいています。 - サーフェスの代わりに点がある場合は、左下隅のメニューの下にある[中心点]ではなく[サーフェス]をクリックします。次に、メッセージが表示されたら[OK] をクリックします。
- 他の味を伝達する細胞マーカーと神経線維マーカーについて、ステップ 5.3.2.1~5.3.2.5 を繰り返します。
- 進行状況を保存 (エクスポート) します。
- メイン メニューでセルタイプ の Surface をクリックします。そのオブジェクトのメニューから[ ツール ]をクリックし、 [ 距離変換] をクリックします。
- [XTDistance 変換] というポップアップ ボックスが表示されるのを待ちます。[外部サーフェス オブジェクト]を選択します。[表示調整] メニューの [サーフェス名までの距離] に表示される新しいチャネルをメモしておきます。
- [オブジェクト]メニューから[神経ファイバ]サーフェスを選択します。鉛筆アイコンをクリックし、[すべてマスク] をクリックします。
- 表示されるドロップダウンメニューから、新しいチャンネル[サーフェス名までの距離]を選択します。[表示調整] ウィンドウに表示される [サーフェス名までの距離]という新しいチャネルをメモしておきます。
- メインの [オブジェクト] メニューを使用して、新しいオブジェクトを作成します。[対象地域のみをセグメント化する] をオフにし、青い矢印をクリックします。[PLCß2 までのマスク距離]チャネルを選択し、[スムーズ]をオフにします。
- 次の画面で、味を伝達する細胞がこのソフトウェアで識別可能な神経線維から最小の距離内にある領域があるかどうかを確認します。これを行うには、0.01-0.11 μmの制限を設定して、神経線維に近い任意の受容体細胞蛍光をチェックします。
- 左側の緑色のボックスに 「0.01」 と入力して下限しきい値を設定し 、Tabキーを押します。次に 赤いボタン をクリックし 、0.11 と入力して上限を設定します。 Tab キーを押してから、 下部の青い矢印を クリックして次のステップに進みます。
- [削除]をクリックし、次に緑色の二重矢印をクリックして終了します。
- [オブジェクト]メニューの PLCß2 の 0.01~0.11 以内にこのサーフェスの名前を変更します。[オブジェクト]メニューの[PLCß2サーフェスの0.01~0.11以内]を選択します。
- 鉛筆を選択し、[すべてマスク] をクリックします。ドロップダウンメニューから赤(神経線維)チャンネルを選択し、[OK]をクリックします。
- チャンネルの名前をクリックします。チャネルの名前を0.01 ~ 0.11 の PLCß2 の内部で変更します。
注:これは、作成された表面内に存在する赤色蛍光チャネルの複製を表す蛍光チャネルです。 - カラーセレクタの中央にある白をクリックします。構造の色と対比する色を選択します。
- この段階でファイルをエクスポート (つまり、保存) します。
- 他の味を伝達する細胞マーカーについて、手順 5.4.2.9 ~5.4.2.21 を繰り返します。
- この段階でファイルをエクスポート (つまり、保存) します。
注: ラベル付きのセル タイプと別のタイプのセルの近接性を解析するには、ステップ 5.4.2.11 の神経ファイバーサーフェス (および次の手順) を対象とするオブジェクトと、後続の各ステップに関連する同等のコンポーネントに置き換えます。
- 画像準備
- 装飾された画像スタックをピクセルベースの画像解析ソフトウェアにインポートし ( 材料表を参照)、味覚芽のボリュームと味覚芽内の全インレーションの体積を決定します。
6. ニューロンアーバー再構成と絶対細胞数定量化
- ターミナルアーバーのトレースと分析
- 3D ベクターベースのイメージ解析ソフトウェアでデコンボルトされたイメージ ファイルを開き ( 材料表を参照)、[ トレース] を選択し、[ ニューロン] をクリックして[ デンドライト] をクリックします。
- イメージ スタック内の味覚芽のベースまでスクロールします。イメージ スタックをスクロールしながら、各ファイバーを最後までトレースします。
- 分岐の終わりに、最後を右クリックし、 終了を選択します。分岐点で右クリックし、[ ノードの分岐] を選択します。
注: これにより、1 つの分岐を最後までトレースし、分岐点に戻り、このトレースがまだ同じニューロンであることを認識するプログラムで他の分岐をトレースできます。 - データ ファイルを .DATファイルは、3Dベクトルベースの画像解析ソフトウェアで解析のために開くことができます。
7. 細胞数の定量化
- Z位置に固定された細胞タイプを転写するための別個のマーカーが核レベルに置くことができる限り、任意の画像解析ソフトウェアパッケージ内の標識された味覚芽細胞を定量化する。
結果
SSRedおよびケラチン-8に対する抗体によるリングアル上皮の染色(一般的な味覚芽マーカー)は、Phox2b-Cre:tdTomatoマウス50,51において味覚芽全体と全味覚芽の内インベーションの両方を標識した(図3A)。毛穴からそのベースにこれらの味覚芽をイメージングすると、最高解像度のx-y平面画像(図3A、B)を与えた。ピクセルベースのイメージングプログラムの輪郭関数を用いて、各セクション(図3B)における味覚芽の周辺を概説し、次いで味覚芽体積を表す表面(図3C)を生成した。表面内のみの味覚芽ラベルに関連する蛍光をマスキング(または複製)は、この蛍光のみを含む新しいチャネルを作成し、味覚芽を隠す乳頭染色を排除した(図3D)。味覚芽内の神経線維蛍光をマスク(図3E)し、その中の内インナビエーションの体積を表す表面を自動的に作成するために使用される(図3F)。同様のアプローチは、味覚芽の体積と、周囲味覚芽におけるそれに関連するインナーブの量を測定するためにも使用されました(図3G)。代表的な測定データは、真菌形態(p=0.115)または周回(p=0.090)測定領域における味覚芽量とインネクレーション量との間に相関関係がないことを明らかにした(図3H)。
TrkBCreERにおけるタモキシフェンの低用量の投与:tdTomatoマウスは、遺伝子組み換えおよび少数のニューロンの標識を引き起こし、味覚芽が数個の標識された末端アーバー(味覚芽内のニューロン部分)にゼロで内在するようにする。このリンガル上皮は、末端のアーバーおよび抗カー4(酸味)および抗PLCβ2(甘味、苦味、および旨味)の抗体に対して、味覚伝達細胞用の抗dsRed抗体を用いて染色した(図4A)。標識された端末アーバーをトレースするためにベクトルベースの画像解析プログラムを使用した(図4B)。青と緑のトレースに関連するアーバーの直交高さは、それぞれ33.4 μm (図 4C)と 32.4 μm (図 4D)でした。青い端子アーバーの3D Convex Hullの測定値(すなわち、味覚芽内の端子アーバーの範囲)は、緑のアーバーの644.0 μm3および3647.0 μm3であった。緑色のトレースの樹形図を図 4Eに示し、ブランチの長さをミクロン単位で測定します。緑のアーバーは7つの枝の端および183.4 μmの全長を有していた。PLCβ2+およびCar4+細胞の絶対数の定量化は、この味覚芽が17 PLCβ2+細胞と2つのCar4+細胞を持っていることを明らかにした。細胞ピクセルベースのイメージングソフトウェアを使用して、神経線維と味転起細胞の間の最も近い近接を決定すると、味覚芽中の合計19個の味覚変容細胞のうち、青色末端アーバー(図4F、Gに赤色で示されている)が、ライトブルーのCar4+細胞(光顕微鏡の解像度)の200nm以内(光顕微鏡の解像度)であったことが明らかになった。緑色のトレースに関連する端子アーバーはマゼンタ(図4Fおよび図4H)に示されており、光と濃い青色のCar4+セル(図4Hの白色領域)の両方の200 nm以内にあります。これらのアーバーに次に最も近い細胞が200nm以上離れていたので、2つの構造を分離するラベルなしボクセルがあった。
分裂前駆細胞は、0日目、1日目、3日目にEdUの注射を用いて標識し、4日目に組織を採取した。全マウントケラチン-8および真菌形態の味覚芽のEdU染色は、EdU標識細胞が味覚芽の内外に存在していたことを明らかにした(図5A-C)。個々のEdU+/ケラチン-8+細胞(ティールおよび黄色)およびEdU+/ケラチン-8-核(紫およびマゼンタ)をセグメント化した(図5B、C)。示された濃い青色細胞はケラチン-8+であり、成熟した味移起細胞と一致する細長い形状を有していた。これらの表面は、細孔から基部(図5B)に向けられた味覚芽と味覚芽の長軸に沿って示されている(図5C)。各構造は、各構造内の蛍光をマスキングすることにより、個々の光学スライスで見ることができる(図5D-F)。マゼンタと紫の核は、白点の輪郭で示される味覚芽のケラチン-8+境界の外側にある(図5D、E)。黄色、ティール、青の細胞は味覚芽の中にあった(図5D-F)。個々の味移調細胞は、Car4標識(図6A-C)またはPLCβ化(図6D-F)のいずれかのピクセルベースのイメージングソフトウェアを使用して再構築することができる。ピクセルベースのイメージングソフトウェアを使用して、細胞間の最も近い近接を測定し、Car4+セル(図6Bに示されている同じセル)が単一のPLCβ2+セルの200nm以内にあったことが明らかになった(図6G、緑)。細胞が互いに200nm以内にあった領域は白色(図6G)で示され、白い矢印で示される。次の最も近いセルは200nm以上離れていて、2つの異なる向きで図6H、Iの黄色で示されています。図7は、乳頭(しかし味覚芽の外)内で終端する内インネレーションの分離と分析を示し、味覚芽の周りの分布と上皮からの距離を含む。

図1:真菌形態味覚芽染色のための舌上皮の調製( A)上皮と筋を解剖前に標識した切断舌の図。(B)一度十分な筋肉を取り除くと、上皮の下側に残っている筋肉はごく少量に過ぎない。上皮の切断側を見て解剖の進行を評価することに加えて、(C)解剖スコープの下でガラススライドに平らに上皮を敷設すると、組織の一部が均一に半透明(紫色の長方形)であることを明らかにする。十分な筋肉がこの領域から取り除かれました。対照的に、紫色の矢印は、除去する必要があるより多くの筋肉がある左側の領域を示しています。上皮の下側全体が紫色の長方形の領域と類似したら、次のステップに進みます。(D) 上皮の一部を筋肉側を下にして凍結した後、追加の筋肉と層状子は、クライオスタットを使用して薄いセクションとして除去される。切断が完了すると、残りの上皮は薄く半透明です。(E-F)ガラススライド上にシリアル切片(20μm)を採取し、次のセクションを切断する前に各セクションを蛍光顕微鏡で見た。上皮の下には、筋線維が複数の方向に向き、筋線維が断面と筋線維に沿って(E、赤い長方形)に沿って存在するようにしています。E-Fのシリアルセクションは、筋層筋の境界を示す、多方向(E、赤い長方形)に向いている筋線維から、主に一方向に向いている筋線維(F、赤い長方形)への移行を示しています。同じ組織の別の領域(黄色の長方形)は、筋線維が一方向に向いているときに、次のセクションは、すべての筋肉がその領域から取り除かれたので結合組織をもたらす可能性が高いことを示しています。青い長方形は両方とも上皮の下側を表します。味覚芽がセクション(G、赤い矢印)に存在する場合、あまりにも多くの組織が除去されています。理想的には、上皮の下側(しかし味覚芽がない)が除去されたセクション(F、黄色の長方形)に見えるとき、断面化は完了する。同じ方向に向いている筋線維を有する領域(E、黄色の長方形とF、赤い長方形)も断面化に適しているが、筋線維が複数方向に向いている領域(E、赤い長方形)は避けるべきである。(G)一度セクションは上皮/層状層の下側を含むが、上皮の多くが除去され、セクションは味覚芽を含む前に、いくつかの追加のセクションを切断することが可能である。(H)最も一般的な間違いは、上皮が組織の端に見られ、筋肉が上皮の内側に見られ、OTC/まばらな筋肉が真ん中に存在するクライオスタットセクションによって明らかにされる。これは、ほとんどの場合、凍結または鈍い終了鉗子で平坦化不十分になる前に、組織の底に平らに組織を敷設しないことが原因です。A-C = 1 mm のスケール バー。スケールバーはE、F、H = 100 μmです。G = 50 μmのスケールバー。

図2:口蓋の解剖をして口蓋を切断した(A)最初に薄い刃のはさみを使って硬い口蓋を切り取り、次に同じハサミを使って下層の結合組織から軟口蓋を分離した。口腔から組織を取り出した後、残った組織は、ハサミで除去した。この時点で、残りが残っているのは、軟口蓋の背面にある腺です。これらの腺を優しく削り取るためにカミソリの刃が使われました。口蓋の完成した解剖の(C)背中および(D)上皮表面を示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
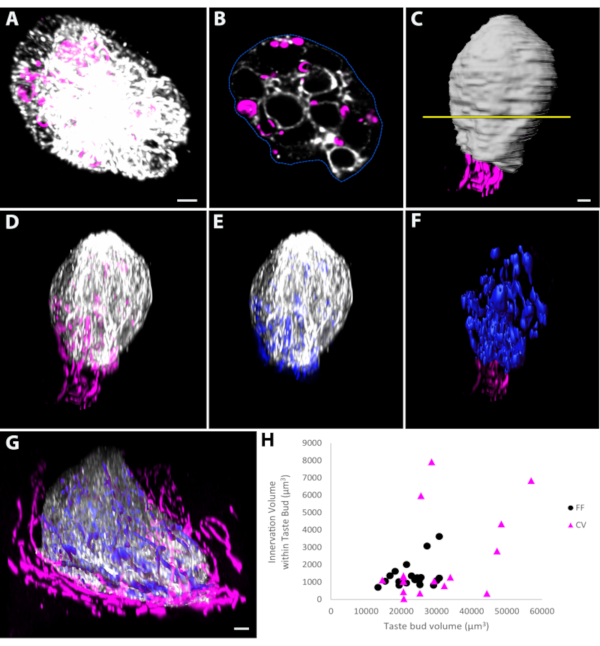
図3:全マウント味覚芽の体積を測定する(A)全体マウント味覚芽を味覚芽の基部に、最高分解能の平面がx-y平面になるようにイメージした。各光学スライスを画素系画像解析ソフトウェアで見て、角輪関数を用いてケラチン-8で染色した味覚芽の周囲を手動で概説した。(B)1つの光学スライスの例が提供される。(C)味覚芽の長軸に沿ったこの代表セクションの位置は黄色い線で示される。各光学断面を概説した後、味覚芽の体積を表す表面(白)を作成した。味覚芽を表すボリューム内の味覚芽(ケラチン-8 in D)またはtdTomato標識型インナレーション(Eの擬似色青色)に対応する蛍光チャネルをマスキングまたは複製する。味覚芽内の蛍光(E)は、味覚芽内の内インキレーションの体積を表す表面を生成するために使用した(F、青)。(G) 同様のアプローチが、Aの真菌形態味覚芽と同じ向きでイメージされた全マウントの円周味覚芽に適用された。(H)真菌形態の体積と味覚芽の周回とそれぞれのインナレーション量を測定すると、いずれかの領域でサンプリングされた味覚芽の味覚芽とインナレーション量との間に相関関係がないことを明らかにした。スケールバーはA-D、F = 4 μm;G = 5 μm のスケールバー。この図は、オーマン・ゴーら50から変更されました。略語: FF = 真菌形態;CV = 周回。この図の大きなバージョンを表示するには、ここをクリックしてください。
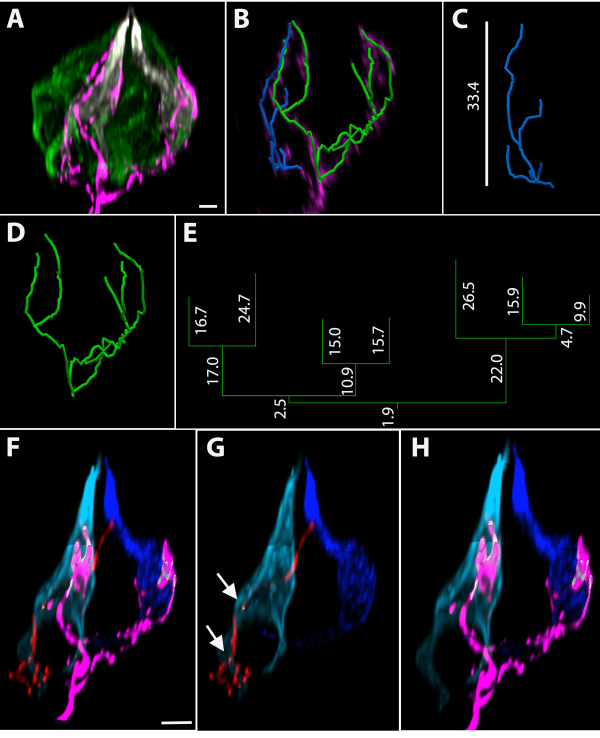
図4:まばらな細胞遺伝標識を用いた真菌形態味覚芽中の代表的な末端アーバー (A)味覚伝達細胞マーカーCar4(白)とPLCβ2(緑色)で染色された全マウント味覚芽。(B)この味覚芽は、繊維を再構築した後に取り除かれた味覚芽で示されている2つのラベル付き端子アーバーを有する。(C)青いアーバーは、33.4 μmの味覚芽に6枝端と直交高さがあり、(D)緑のアーバーは7枝端を有する。(E)緑色のアーバーに対応する樹状図は、マイクロメートル単位で各セグメント長を備えています。(F-H)構造物間の距離を測定した。(F-G)Cの青いトレースはセグメント化され、赤で表示されます。(G)この端子アーバーが水色Car4+セルの200nm以内にある領域は白い矢印で示されます。(F, H)緑色の再構成で表される末端のアーバーはマゼンタで示される。(H) マゼンタアーバー(4B、Dの緑のトレースに関連付けられている)は、ダークとライトブルーCar4+セルの両方の200 nm以内にあります。スケールバーA、B = 4 μm;F-H = 5 μm のスケールバー。

図5:新しい味覚芽細胞の組み込みを追跡するために、全体マウントを使用することができます。マウスは、0日目、1日目、3日目に前駆子を分割する標識を行うためにEdUを注射し、4日目に屠殺した。(A, B)EdU(緑色)で標識された細胞は、ケラチン-8(A、白、B、灰色)で標識された味覚芽の周りと内の両方で識別することができる。(B, C)個々のEdU標識、味覚芽およびケラチン-8-、EdU標識核の内側のケラチン-8+細胞は、味覚芽の外側にセグメント化される。(D-F)A-Bでセグメント化された各構造内の蛍光をマスクし、断面で見ることができる。味覚芽の周囲は白い点線で輪郭を描いています (D-F)。(D)黄色の細胞は味覚芽の中にあり、EdUラベルとケラチン-8+の両方です。マゼンタ核は味覚芽の外側にあり、ケラチン-8-です。(E)ティール細胞は味覚芽の内側にあり、EdUラベルとケラチン-8+の両方を持っています。紫色のEdU標識核は、ケラチン-8-と味覚芽の外側(白い矢印)です。(F)青色細胞はケラチン-8+と伸長しており、成熟した味転生細胞と一致する。スケールバー(A-C =3 μm)D = 2 μm のスケールバー。スケールバーのE,F = 4 μm. 略称: EdU = 5-エチニル-2'-デオキシウリジン.この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:全味芽細胞の形状は、他の味覚芽細胞との関係と一緒に分析することができる。個々の味覚芽細胞をセグメント化して表面を作成すると、個々の味覚芽細胞を分離し、明確な視覚化を容易にする。個体(A-C)Car4+および(D-F)PLCβ2+細胞は、個々の細胞形状の変動を示す。(G) BのCar4+セルに最も近いPLCβ2+セルは、200nm以内であると判断した(矢印で示される小さな0.5μm2の位置)。次の最も近いセルは300nm以上離れていて、セグメント化されたCar4+セルとは別の構造として区別可能でした。(H, I)次に近いセルはセグメント化されました。マスクされた蛍光は黄色で示されます。次の最も近いセル(黄色)の3つの最も近い点は、H,Iの矢印で示されます。スケールバー(A-C = 3 μm)D、E = 4 μm のスケールバー。F = 2 μm のスケールバー。G-I = 3 μm のスケールバー。
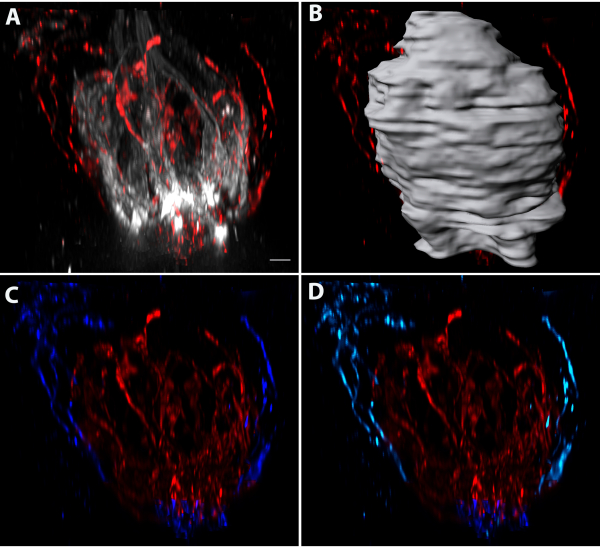
図7:乳頭に対するインナレーションを定量化する( A) 味覚ニューロンの一部の標識は、乳頭へのインナーブ化にもラベルを付ける。(B)味覚芽内の内インナーブは、味覚芽の外側のインナーブから分離され(図3に記載されているように)、(C)味覚芽の内側のインナーブ(赤)をマスキングし、味覚芽の外側のインナーブ(濃い青色)のみをマスキングする。味覚芽(赤)へのインナーブの体積は1649.6 μm3であった。味覚芽の外側のインナレーションは、乳頭へのインナースの定量化に含まれてはならない乳頭の下に味の繊維が含まれます。(D) 乳頭に対するインナーセンスの蛍光をマスクした(水色)。乳頭へのインナーブの体積は121.8 μm3であった。スケールバー(A-D= 4 μm)この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
3つの口腔味覚領域(真菌形態、円周、口蓋)から味覚芽全体を一貫して収集し、染色するアプローチの開発は、味移し細胞を分析し、新たに組み込まれた細胞、インナーブ、およびこれらの構造間の関係を追跡するための重要な改善を提供する。さらに、標識母集団50の内部または外側の両方で潜在的な二次ニューロンマーカーの局在化を促進する。これは、特に、味乳頭が堅牢な体性感覚のインナーヴィス52、53を受け取ることを考えると、いくつかの味覚ニューロンを標識する可能性があることを考えると、特に関連する。乳頭ハウジング味覚芽は、より低い倍率を使用して画像化することもできます。これは、乳頭全体、ならびに味覚芽へのインナーブの視覚化を可能にし、味覚芽および周囲の神経線維に浸透する内インレーションの独立した分析を可能にする。
皮膚の体性感覚神経終末は、毛包の周りの彼らの組織と上皮の他の成分との関係に基づいて区別することができます。乳頭の平行分析は、類似した特徴54,55をもたらすかもしれない。内の関係のための正常な基盤を確立し、そして、味覚芽および乳頭の組成は、末梢味覚機能56、57における欠損の根底にあるメカニズムを決定するためのベースラインとなる。味覚芽は、細胞のターンオーバーと末端アーバーの改造が様々な因子58によって調整される動的感覚的エンドオルガンである。味覚芽59内の電位回路に関する調査は、疾患プロセス57、及び正常な味覚機能58を破壊する化学療法を、味覚芽および神経線維全体をそのまま維持するこの方法によって増強することができる。ここで説明する全体実装方式は、いずれも分析の可能性を広げ、可能な測定を絞り込みます。
舌は密で異種の組織であり、味覚芽自体が透過性を制限する多くの細胞間接合部を含み、味覚芽の全マウント染色を達成するアプローチを開発することは、重大な課題を提示した。以前の方法では、代表的なセクション60を取るか、より厚い切片を切断し、抗体の浸透を制限した32、33、34。さらに、これらの厚いセクションから全体の味覚芽の選択は、より小さな味覚芽に向かってデータを偏った。あるいは、上皮を剥がすと、味覚芽神経線維が破壊される可能性があります。このアプローチが39、40を使用する場合、特にラベルは付けされません。神経の樹状は、味覚芽26、50、61の中に大きな神経叢を形成するので、アーバー除去が味覚芽の他の細胞間の正常な関係を破壊するかどうかは不明である。対照的に、現在の全味覚芽法は、絶対数と測定値を定量化することを可能にする。この染色により、多くのトランスデューシングセルの特徴(タイプ、形状、位置)と端子アーバー(およびそれらの間の関係)を保存して解析することができます。
この方法には、いくつかの制限があります。特に、薄いセクション62で使用されている一部の抗体は、全体マウントでは機能せず、検査できる構造の種類を制限する。また、共焦点顕微鏡分解能が制限される中、個々の細胞から解析される構造データ、および細胞間の関係からも24が制限される。例えば、細胞は互いの200nm以内であると判断することができるが、細胞間の特殊な構造(例えば、シナプス)63は検査できない。最後に、この方法を使用してすべてのセル型にラベルを付けることができるわけではありません。例えば、この調製物において塩を透過させる細胞に特異的にラベルを付けるのは困難であることが証明されている。これらのセルは、タイプ 1、タイプ II、およびタイプ III のセル14、15、16、17、18、19、64の組み合わせのサブセットである可能性があります。主に支持する細胞であるタイプI細胞は、他の細胞を包み込んでいるように見えるので、全体のマウントでは調べることができず、別々のエンティティ65として区別することは困難です。塩透過細胞の信頼性の高いマーカーを持つことは、より包括的な分析を可能にする14,66.同様に、PLCβ2染色は、複数のタイプの刺激を伝達することができる味細胞を表すので、この細胞型のさらなる分離を可能にした標識も改善となるであろう。
以下は、注意が必要な重要な準備手順です。まず、解剖後に残る筋肉層が均一かつ可能な限り薄くなっていることを確認します。この層が偶数でない場合、抗体の浸透は最終的に均一ではないだろう。第二に、上皮の破片が凍結する前に組織鋳型の底に平らに横たわっていて、それが凍結されるまで組織を軽く押すために鈍い終わりの鉗子を使用することが重要である。筋肉の最小量(偶数層)が上皮の下側に残っているとき、わずか3つのクライオスタットセクションが上皮の下側に達する。クライオスタット内の組織の位置を、組織全体の面を横切って切片が取られることによって、組織の一部が不均一に除去される場合がある。これらの理由から、さらなる解凍、さらなる解剖、および組織の再凍結を避けることを強くお勧めします。代わりに、組織を凍結する前に組織解剖を評価するために注意する必要があります。
全体として、ここで提示された全体のマウント組織の調製方法は、全体の味覚芽だけでなく、3つの味覚芽領域から周囲の乳頭を収集するために使用することができます:真菌形態、周回、および口蓋。様々な疾患条件56、57および化学療法56は味覚機能を破壊することが知られているが、これらの変化の根底にあるメカニズムは不明のままである。ここで示す味覚芽の全体マウント染色アプローチを使用すると、味覚伝達細胞とその神経線維の両方にラベルを付けて、欠損が特定の細胞型の喪失、切断された末端の樹形形態、味覚変容細胞間の混乱した関係、または細胞のトランスデューシング細胞と神経線維との間の混乱した関係によるものかどうかを判断できる堅牢な実験設計を表しています。さらに、味覚芽中の新しい細胞の絶対数を定量化するだけでなく、定義されたタイプ(すなわち、PLCβ2+またはCar4+)の新しい味形転写細胞(EdU-ラベル)の数を定量化することも可能です。これらの新しい細胞が正常な形状を発達させ、味覚芽に正常に組み込むかどうか(すなわち、治療後の味覚芽に移動する)も調べることができる。これらの措置の多くは、味覚芽数と共に、すべて同じ組織から作ることができ、実験に必要な異なる動物の数を制限する。これらの可能性は、味の欠損のための臨床介入を提供する実験的な方法の合理化を容易にするだけでなく、味覚機能の基礎となる正常なメカニズムに関する洞察を提供する可能性があります。
開示事項
著者らは開示するものは何もない。
謝辞
カヴィスカ・クルパラナンタは、組織染色と周回味覚芽のイメージングへの貢献、乳頭へのインナーゼーションの染色とイメージングのためのジェニファー・シュー、動物のケアとジェノタイピングのためのカイティー・ホーン、柔らかい口蓋味の芽の組織染色に対するリクン・マに感謝します。このプロジェクトは、R21 DC014857とR01 DC007176からR.F.K、F31 DC017660からL.Oにサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 2,2,2-Tribromoethanol | ACROS Organics | AC421430100 | |
| 2-Methylbutane | ACROS | 126470025 | |
| AffiniPure Fab Fragment Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-007-003 | 15.5μL/mL |
| Alexa Fluor® 647 AffiniPure Donkey Anti-Rat IgG | Jackson Immuno Research | 712-605-150 | (1:500) |
| AutoQuant X3 software | Media Cybernetics | ||
| Blunt End Forceps | Fine Science Tools | FST 91100-12 | |
| Click-iT™ Plus EdU Cell Proliferation Kit | Molecular Probes | C10637 | Follow kit instructions |
| Coverglass | Marienfeld | 107242 | |
| Cytokeratin-8 | Developmental Studies Hybridoma Bank (DSHB), (RRID: AB_531826) | Troma1 supernatant | (1:50, store at 4°C) |
| Dissection Scissors (coarse) | Roboz | RS-5619 | |
| Dissection Scissors (fine) | Moria | MC19B | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A21206 | (1:500) |
| Donkey anti-Rabbit, Alexa Fluor® 555 | ThermoFisher Scientific | A31572 | (1:500) |
| DyLight™ 405 AffiniPure Fab Fragment Bovine Anti-Goat IgG | Jackson Immuno Research | 805-477-008 | (1:500) |
| Fluoromount G | Southern Biotech | 0100-01 | |
| Glass slides | Fisher Scientific (Superfrost Plus Miscroscope Slides) | 12-550-15 | |
| Goat anti-Car4 | R&D Systems | AF2414 | (1:500) |
| Imaris | Bitplane | pixel-based image analysis software | |
| Neurolucida 360 + Explorer | MBF Biosciences | 3D vector based image analysis software | |
| Normal Donkey Serum | Jackson Immuno Research | 017-000-121 | |
| Normal Rabbit Serum | Equitech-Bio, Inc | SR30 | |
| Olympus FV1000 | (multi-Argon laser with wavelengths 458, 488, 515 and additional HeNe lasers emitting 543 and 633) | ||
| Paraformaldehyde | EMD | PX0055-3 | 4% in 0.1M PB |
| Rabbit anti-dsRed | Living Colors DsRed Polyclonal Antibody; Clontech Clontech Laboratories, Inc. (632496) | 632496 | (1:500) |
| Rabbit anti-PLCβ2 | Santa Cruz Biotechnology | Cat# sc-206 | (1:500) |
| Sodium Phosphate Dibasic Anhydrous | Fisher Scientific | BP332-500 | |
| Sodium Phosphate Monobasic | Fisher Scientific | BP330-500 | |
| tert-Amyl alcohol | Aldrich Chemical Company | 8.06193 | |
| Tissue Molds | Electron Microscopy Sciences | 70180 | |
| Tissue-Tek® O.C.T. Compound | Sakura | 4583 | |
| Triton X-100 | BIO-RAD | #161-0407 | |
| Zenon™ Alexa Fluor™ 555 Rabbit IgG Labeling Kit | ThermoFisher Scientific | Z25305 | Follow kit instructions |
参考文献
- Clapp, T. R., Medler, K. F., Damak, S., Margolskee, R. F., Kinnamon, S. C. Mouse taste cells with G protein-coupled taste receptors lack voltage-gated calcium channels and SNAP-25. BMC Biology. 4 (1), 7 (2006).
- Clapp, T. R., Yang, R., Stoick, C. L., Kinnamon, S. C., Kinnamon, J. C. Morphologic characterization of rat taste receptor cells that express components of the phospholipase C signaling pathway. The Journal of Comparative Neurology. 468 (3), 311-321 (2004).
- Delay, R. J., Roper, S. D., Kinnamon, J. C. Ultrastructure of mouse vallate taste buds: II. Cell types and cell lineage. The Journal of Comparative Neurology. 253 (2), 242-252 (1986).
- Finger, T. E. Cell types and lineages in taste buds. Chemical Senses. 30, 54-55 (2005).
- Kataoka, S., et al. The candidate sour taste receptor, PKD2L1, is expressed by type III taste cells in the mouse. Chemical Senses. 33 (3), 243-254 (2008).
- Murray, R. Fine structure of gustatory cells in rabbit taste buds. Journal of Ultrastructure Research. 27 (5-6), 444 (1969).
- Murray, R. G., Murray, A. Fine structure of taste buds of rabbit foliate papillae. Journal of Ultrastructure Research. 19 (3), 327-353 (1967).
- Yang, R., Crowley, H. H., Rock, M. E., Kinnamon, J. C. Taste cells with synapses in rat circumvallate papillae display SNAP-25-like immunoreactivity. The Journal of Comparative Neurology. 424 (2), 205-215 (2000).
- Yee, C. L., Yang, R., Böttger, B., Finger, T. E., Kinnamon, J. C. "Type III" cells of rat taste buds: Immunohistochemical and ultrastructural studies of neuron-specific enolase, protein gene product 9.5, and serotonin. Journal of Comparative Neurology. 440 (1), 97-108 (2001).
- Zhang, Y., et al. Coding of sweet, bitter, and umami tastes. Cell. 112 (3), 293-301 (2003).
- Chandrashekar, J., et al. The taste of carbonation. Science. 326 (5951), 443-445 (2009).
- Oka, Y., Butnaru, M., Von Buchholtz, L., Ryba, N. J. P., Zuker, C. S. High salt recruits aversive taste pathways. Nature. 494 (7438), 472-475 (2013).
- Stratford, J. M., Larson, E. D., Yang, R., Salcedo, E., Finger, T. E. 5-HT3A-driven green fluorescent protein delineates gustatory fibers innervating sour-responsive taste cells: A labeled line for sour taste. Journal of Comparative Neurology. 525 (10), 2358-2375 (2017).
- Baumer-Harrison, C., et al. Optogenetic stimulation of type I GAD65(+) cells in taste buds activates gustatory neurons and drives appetitive licking behavior in sodium-depleted mice. The Journal of Neuroscience. 40 (41), 7795-7810 (2020).
- Nomura, K., Nakanishi, M., Ishidate, F., Iwata, K., Taruno, A. All-electrical Ca(2+)-independent signal transduction mediates attractive sodium taste in taste buds. Neuron. 106 (5), 816-829 (2020).
- Ohmoto, M., Jyotaki, M., Foskett, J. K., Matsumoto, I. Sodium-taste cells require Skn-1a for generation and share molecular features with sweet, umami, and bitter taste cells. eneuro. 7 (6), (2020).
- Roebber, J. K., Roper, S. D., Chaudhari, N. The role of the anion in salt (NaCl) detection by mouse taste buds. The Journal of Neuroscience. 39 (32), 6224-6232 (2019).
- Oka, Y., Butnaru, M., von Buchholtz, L., Ryba, N. J., Zuker, C. S. High salt recruits aversive taste pathways. Nature. 494 (7438), 472-475 (2013).
- Lewandowski, B. C., Sukumaran, S. K., Margolskee, R. F., Bachmanov, A. A. Amiloride-insensitive salt taste is mediated by two populations of type III taste cells with distinct transduction mechanisms. The Journal of Neuroscience. 36 (6), 1942-1953 (2016).
- Beidler, L. M., Smallman, R. L. Renewal of cells within taste buds. The Journal of Cell Biology. 27 (2), 263-272 (1965).
- Hamamichi, R., Asano-Miyoshi, M., Emori, Y. Taste bud contains both short-lived and long-lived cell populations. Neuroscience. 141 (4), 2129-2138 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. P. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Spector, A. C., Travers, S. P. The representation of taste quality in the mammalian nervous system. Behavoiral and Cognitive Neuroscience Reviews. 4 (3), 143-191 (2005).
- Huang, T., Ohman, L. C., Clements, A. V., Whiddon, Z. D., Krimm, R. F. Variable branching characteristics of peripheral taste neurons indicates differential convergence. bioRxiv. , (2020).
- Taruno, A., et al. CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes. Nature. 495 (7440), 223-226 (2013).
- Kinnamon, J. C., Taylor, B. J., Delay, R. J., Roper, S. D. Ultrastructure of mouse vallate taste buds. I. Taste cells and their associated synapses. The Journal of comparative neurology. 235 (1), 48-60 (1985).
- Dando, R., et al. A permeability barrier surrounds taste buds in lingual epithelia. American Journal of Physiology. Cell Physiology. 308 (1), 21-32 (2015).
- Mistretta, C. M. Permeability of tongue epithelium and its relation to taste. American Journal of Physiology. 220 (5), 1162-1167 (1971).
- Michlig, S., Damak, S., Le Coutre, J. Claudin-based permeability barriers in taste buds. The Journal of Comparative Neurology. 502 (6), 1003-1011 (2007).
- Kinnamon, S. C., Finger, T. E. Recent advances in taste transduction and signaling. F1000Research. 8, 2117 (2019).
- Meng, L., Huang, T., Sun, C., Hill, D. L., Krimm, R. BDNF is required for taste axon regeneration following unilateral chorda tympani nerve section. Experimental Neurology. 293, 27-42 (2017).
- Meng, L., Ohman-Gault, L., Ma, L., Krimm, R. F. Taste bud-derived BDNF is required to maintain normal amounts of innervation to adult taste buds. eneuro. 2 (6), (2015).
- Tang, T., Rios-Pilier, J., Krimm, R. Taste bud-derived BDNF maintains innervation of a subset of TrkB-expressing gustatory nerve fibers. Molecular and Cellular Neuroscience. 82, 195-203 (2017).
- Zhang, G. H., Zhang, H. Y., Deng, S. P., Qin, Y. M. Regional differences in taste bud distribution and -gustducin expression patterns in the mouse fungiform papilla. Chemical Senses. 33 (4), 357-362 (2008).
- Huang, T., Ma, L., Krimm, R. F. Postnatal reduction of BDNF regulates the developmental remodeling of taste bud innervation. Developmental Biology. 405 (2), 225-236 (2015).
- Nosrat, I. V., Margolskee, R. F., Nosrat, C. A. Targeted taste cell-specific overexpression of brain-derived neurotrophic factor in adult taste buds elevates phosphorylated TrkB protein levels in taste cells, increases taste bud size, and promotes gustatory innervation. Journal of Biological Chemistry. 287 (20), 16791-16800 (2012).
- Liebl, D. J., Mbiene, J. -. P., Parada, L. F. NT4/5 mutant mice have deficiency in gustatory papillae and taste bud formation. Developmental Biology. 213 (2), 378-389 (1999).
- Kumari, A., Yokota, Y., Li, L., Bradley, R. M., Mistretta, C. M. Species generalization and differences in Hedgehog pathway regulation of fungiform and circumvallate papilla taste function and somatosensation demonstrated with sonidegib. Scientific Reports. 8 (1), (2018).
- Venkatesan, N., Boggs, K., Liu, H. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering. Part C, Methods. 22 (4), 332-337 (2016).
- Meisel, C. T., Pagella, P., Porcheri, C., Mitsiadis, T. A. Three-dimensional imaging and gene expression analysis upon enzymatic isolation of the tongue epithelium. Frontiers in Physiology. 11, 825 (2020).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Guagliardo, N. A., Hill, D. L. Fungiform taste bud degeneration in C57BL/6J mice following chorda-lingual nerve transection. The Journal of Comparative Neurology. 504 (2), 206-216 (2007).
- Ohtubo, Y., Yoshii, K. Quantitative analysis of taste bud cell numbers in fungiform and soft palate taste buds of mice. Brain Research. 1367, 13-21 (2011).
- Ogata, T., Ohtubo, Y. Quantitative analysis of taste bud cell numbers in the circumvallate and foliate taste buds of mice. Chemical Senses. 45 (4), 261-273 (2020).
- Tomchik, S. M., Berg, S., Kim, J. W., Chaudhari, N., Roper, S. D. Breadth of tuning and taste coding in mammalian taste buds. Journal of Neuroscience. 27 (40), 10840-10848 (2007).
- Finger, T. E. ATP signaling is crucial for communication from taste buds to gustatory nerves. Science. 310 (5753), 1495-1499 (2005).
- Lau, J., et al. Temporal control of gene deletion in sensory ganglia using a tamoxifen-inducible Advillin-CreERT2 recombinase mouse. Molecular Pain. 7 (1), 100 (2011).
- Hirsch, M. -. R., D'Autréaux, F., Dymecki, S. M., Brunet, J. -. F., Goridis, C. APhox2b::FLPotransgenic mouse line suitable for intersectional genetics. genesis. 51 (7), 506-514 (2013).
- Perea-Martinez, I., Nagai, T., Chaudhari, N. Functional cell types in taste buds have distinct longevities. PLoS ONE. 8 (1), 53399 (2013).
- Ohman-Gault, L., Huang, T., Krimm, R. The transcription factor Phox2b distinguishes between oral and non-oral sensory neurons in the geniculate ganglion. Journal of Comparative Neurology. 525 (18), 3935-3950 (2017).
- Dvoryanchikov, G., et al. Transcriptomes and neurotransmitter profiles of classes of gustatory and somatosensory neurons in the geniculate ganglion. Nature Communications. 8 (1), (2017).
- Whitehead, M. C., Ganchrow, J. R., Ganchrow, D., Yao, B. Organization of geniculate and trigeminal ganglion cells innervating single fungiform taste papillae: a study with tetramethylrhodamine dextran amine labeling. Neuroscience. 93 (3), 931-941 (1999).
- Suemune, S., et al. Trigeminal nerve endings of lingual mucosa and musculature of the rat. Brain Research. 586 (1), 162-165 (1992).
- Rutlin, M., et al. The cellular and molecular basis of direction selectivity of Aδ-LTMRs. Cell. 159 (7), 1640-1651 (2014).
- Abraira, V. E., Ginty, D. D. The sensory neurons of touch. Neuron. 79 (4), 618-639 (2013).
- Feng, P., Huang, L., Wang, H. Taste bud homeostasis in health, disease, and aging. Chemical Senses. 39 (1), 3-16 (2014).
- Cooper, K. W., et al. COVID-19 and the chemical senses: supporting players take center stage. Neuron. 107 (2), 219-233 (2020).
- Barlow, L. A. Progress and renewal in gustation: new insights into taste bud development. Development. 142 (21), 3620-3629 (2015).
- Roper, S. D. Taste buds as peripheral chemosensory processors. Seminars in Cell & Developmental Biology. 24 (1), 71-79 (2013).
- Ma, H., Yang, R., Thomas, S. M., Kinnamon, J. C. BMC. Neuroscience. 8 (1), 5 (2007).
- Kinnamon, J. C., Sherman, T. A., Roper, S. D. Ultrastructure of mouse vallate taste buds: III. Patterns of synaptic connectivity. The Journal of Comparative Neurology. 270 (1), 1-10 (1988).
- Romanov, R. A., et al. Chemical synapses without synaptic vesicles: Purinergic neurotransmission through a CALHM1 channel-mitochondrial signaling complex. Science Signaling. 11 (529), 1815 (2018).
- Dani, A., Huang, B., Bergan, J., Dulac, C., Zhuang, X. Superresolution imaging of chemical synapses in the brain. Neuron. 68 (5), 843-856 (2010).
- Vandenbeuch, A., Clapp, T. R., Kinnamon, S. C. Amiloride-sensitive channels in type I fungiform taste cells in mouse. BMC Neuroscience. 9 (1), 1 (2008).
- Bartel, D. L., Sullivan, S. L., Lavoie, &. #. 2. 0. 1. ;. G., Sévigny, J., Finger, T. E. Nucleoside triphosphate diphosphohydrolase-2 is the ecto-ATPase of type I cells in taste buds. The Journal of Comparative Neurology. 497 (1), 1-12 (2006).
- Wilson, C. E., Vandenbeuch, A., Kinnamon, S. C. Physiological and behavioral responses to optogenetic stimulation of PKD2L1+ type III taste cells. eneuro. 6 (2), (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved