Method Article
Tinción, visualización y análisis de papilas gustativas fungiformes, circunvaladas y del paladar
En este artículo
Resumen
Este documento describe métodos para la preparación de tejidos, tinción y análisis de papilas gustativas completas fungiformes, circunvaladas y del paladar que producen consistentemente papilas gustativas enteras e intactas (incluidas las fibras nerviosas que las inervan) y mantienen las relaciones entre las estructuras dentro de las papilas gustativas y la papila circundante.
Resumen
Las papilas gustativas son colecciones de células transductoras del gusto especializadas para detectar subconjuntos de estímulos químicos en la cavidad oral. Estas células transductoras se comunican con las fibras nerviosas que llevan esta información al cerebro. Debido a que las células transductoras del gusto mueren continuamente y son reemplazadas a lo largo de la edad adulta, el entorno de las papilas gustativas es complejo y dinámico, lo que requiere análisis detallados de sus tipos de células, sus ubicaciones y cualquier relación física entre ellas. Los análisis detallados se han visto limitados por la heterogeneidad y la densidad del tejido lengüístico que han reducido significativamente la permeabilidad de los anticuerpos. Estos obstáculos requieren protocolos de seccionamiento que resultan en la división de las papilas gustativas en todas las secciones para que las mediciones solo se aproximen y se pierdan las relaciones celulares. Para superar estos desafíos, los métodos descritos en este documento implican la recolección, obtención de imágenes y análisis de papilas gustativas completas y cenadores terminales individuales de tres regiones gustativas: papilas fungiformes, papilas circunvaladas y el paladar. La recolección de papilas gustativas completas reduce el sesgo y la variabilidad técnica y se puede usar para informar números absolutos de características que incluyen el volumen de las papilas gustativas, la inervación total de las papilas gustativas, los recuentos de células transductoras y la morfología de los cenadores terminales individuales. Para demostrar las ventajas de este método, este documento proporciona comparaciones de los volúmenes de papilas gustativas e inervación entre las papilas gustativas fungiformes y circunvaladas utilizando un marcador general de papilas gustativas y una etiqueta para todas las fibras gustativas. También se proporciona un flujo de trabajo para el uso del etiquetado genético de células dispersas de las neuronas del gusto (con subconjuntos etiquetados de células transductoras del gusto). Este flujo de trabajo analiza las estructuras de los cenadores individuales del nervio del gusto, los números de tipo de célula y las relaciones físicas entre las células utilizando un software de análisis de imágenes. Juntos, estos flujos de trabajo proporcionan un enfoque novedoso para la preparación y el análisis de tejidos tanto de papilas gustativas completas como de la morfología completa de sus cenadores inervantes.
Introducción
Las papilas gustativas son colecciones de 50-100 células epiteliales especializadas que se unen a subconjuntos de estímulos químico-gustativos presentes en la cavidad oral. En general, se cree que las células transductoras del gusto existen como tipos1,2,3,4,5, 6,7,8,9,inicialmente basadas en criterios de microscopía electrónica que luego se correlacionaron con marcadores moleculares. Las células tipo II expresan fosfolipasa C-beta 2 (PLCβ2)2 y receptor transitorio potencial del canal catiónico, subfamilia M miembro 51 e incluyen células que transducen dulce, amargo y umami1,10. Las células tipo III expresan anhidrasa carbónica 4 (Car4)11 y proteína asociada a sinaptosomal 258 y denotan células que responden principalmente al sabor agrio11. Las células que transducen salinidad no han sido tan claramente delineadas12,13,14,pero potencialmente podrían incluir las células Tipo I, Tipo II y Tipo III15,16,17,18,19. El entorno de las papilas gustativas es complejo y dinámico, dado que las células transductoras del gusto giran continuamente a lo largo de la edad adulta y son reemplazadas por progenitores basales3,20,21. Estas células transductoras de sabor se conectan a las fibras nerviosas pseudounipolares de los ganglios geniculados y petrosales, que pasan la información del gusto al tronco encefálico. Estas neuronas se han categorizado principalmente en función del tipo de información gustativa que llevan22,23 porque la información sobre su morfología ha sido esquiva hasta hace poco24. Las células de tipo II se comunican con las fibras nerviosas a través de la proteína moduladora de la homeostasis del calcio 1 canales iónicos25,mientras que las células de tipo III se comunican a través de las sinapsis clásicas8,26. La caracterización adicional de las células de las papilas gustativas, incluidos los linajes de tipo celular transductores, los factores que influyen en su diferenciación y las estructuras de conexión de los cenadores son todas áreas de investigación activa.
Los estudios de papilas gustativas se han visto obstaculizados por varios desafíos técnicos. Los tejidos heterogéneos y densos que componen la lengua reducen significativamente la permeabilidad de anticuerpos para la inmunohistoquímica27,28,29. Estos obstáculos han requerido protocolos de seccionamiento que resultan en la división de las papilas gustativas entre secciones para que las mediciones se aproximen en función de secciones representativas o se sumen entre secciones. Anteriormente, se han utilizado secciones delgadas representativas para aproximar tanto los valores de volumen como los recuentos de células transductoras30. La sección en serie más gruesa permite obtener imágenes de todas las secciones de papilas gustativas y la suma de las mediciones de cada sección31. Cortar secciones tan gruesas y seleccionar solo papilas gustativas enteras sesga el muestreo hacia papilas gustativas más pequeñas32,33,34. Las estimaciones de la inervación nerviosa de las papilas gustativas seccionadas se han basado en análisis de los números de píxeles13, 35,si se cuantifican en absoluto36,37,38. Estas mediciones ignoran por completo la estructura y el número de cenadores nerviosos individuales, porque los cenadores están divididos (y generalmente mal etiquetados). Por último, aunque pelar el epitelio permite teñir papilas gustativas enteras39,40, también elimina las fibras nerviosas de las papilas gustativas y podría interrumpir las relaciones normales entre las células. Por lo tanto, las investigaciones de las relaciones estructurales dentro de las papilas gustativas han sido limitadas debido a esta interrupción causada por los enfoques de tinción.
La recolección de estructura completa elimina la necesidad de secciones representativas y permite la determinación de mediciones de valor absoluto de volúmenes, recuentos celulares y morfologías de estructura41. Este enfoque también aumenta la precisión, limita el sesgo y reduce la variabilidad técnica. Este último elemento es importante porque las papilas gustativas muestran una variabilidad biológica considerable tanto dentro de34,42 como entre las regiones43,44, y los análisis completos de papilas gustativas permiten comparar el número absoluto de células entre las condiciones de control y experimentales. Además, la capacidad de recoger papilas gustativas intactas permite el análisis de las relaciones físicas entre las diferentes células transductoras y sus fibras nerviosas asociadas. Debido a que las células transductoras del gusto pueden comunicarse entre sí45 y comunicarse con las fibras nerviosas46,estas relaciones son importantes para la función normal. Por lo tanto, las condiciones de pérdida de función pueden no deberse a una pérdida de células, sino a cambios en las relaciones celulares. Aquí se proporciona un método para recolectar papilas gustativas completas para lograr los beneficios de las mediciones absolutas para refinar los análisis de volumen tanto para las papilas gustativas como para sus inervaciones, recuentos y formas de células gustativas, y para facilitar los análisis de las relaciones de las células transductoras y las morfologías nervio-cenador. También se presentan dos flujos de trabajo aguas abajo de este nuevo método de montaje completo para la preparación de tejidos: 1) para analizar el volumen de las papilas gustativas y la inervación total y 2) para el etiquetado genético de células dispersas de las neuronas del gusto (con subconjuntos de células transductoras del gusto marcadas) y los análisis posteriores de la morfología del cenador del nervio gustativo, el número de tipos de células gustativas y sus formas, y el uso de software de análisis de imágenes para analizar las relaciones físicas entre las células transductoras y las que se producen entre la transducción. células y sus cenadores nerviosos. Juntos, estos flujos de trabajo proporcionan un enfoque novedoso para la preparación de tejidos y para el análisis de papilas gustativas completas y la morfología completa de sus cenadores de inervación.
Protocolo
NOTA: Todos los animales fueron atendidos de acuerdo con las pautas establecidas por la Política del Servicio de Salud Pública de los Estados Unidos sobre el Cuidado y Uso Humanitario de animales de laboratorio y la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio. Los ratones Phox2b-Cre (cepa MMRRC 034613-UCD, NP91Gsat/Mmcd) o ratones TrkBCreER (Ntrk2tm3.1(cre/ERT2)Ddg)fueron criados con ratones reporteros tdTomato (Ai14). AdvillinCreER47 fueron criados con Phox2b-flpo48 y Ai65. Para las inyecciones de 5-etinil-2′-desoxiuridina (EdU), se preparó la EdU y se calcularon las dosis según Perea-Martinez et al.49.
1. Preparación de materiales
- Preparación de soluciones
- Disolver 5.244 g de fosfato de sodio monobásico y 23.004 g de fosfato de sodio dibásico en agua de doble destilación (ddH2O) en una placa de agitación. Ajuste el pH a 7.4 y lleve el volumen total para obtener 1 L de tampón de fosfato de sodio (PB) de 0.2 M.
- Disuelva el paraformaldehído en ddH2O en una campana extractora de humos calentando mientras se agita en una placa de agitación hasta que la solución alcance los 90 °C. Añadir 4 M de solución de NaOH gota a gota para limpiar el paraformaldehído, y filtrar la solución utilizando un matraz Erlenmeyer al vacío y un filtro cerámico con papel de filtro. Agregue un volumen igual de 0.2 M PB y ajuste el pH a 7.4 para obtener 4% de PFA en 0.1 M PB.
2. Preparación de tejidos
- Recolección de tejidos
- Sacrifique ratones utilizando una sobredosis anestésica con una solución de trabajo que contiene 10 ml de solución salina estéril y 0,25 ml de una solución madre que contiene 5 g de 2,2,2-tribromoetanol y 5 ml de alcohol terc-amílico. Perfusa transcárdica con 4% de PFA en 0,1 M PB; quitar la lengua y el paladar.
- Aislar las papilas gustativas circunvaladas utilizando un corte coronal que separa la lengua posterior, detrás de la eminencia intermolar; cortar las papilas gustativas con una cuchilla de afeitar; y luego dividir la lengua anterior en la línea media. Post-fijación durante la noche a 4 °C con 4% de PFA en 0,1 M PB.
- Crioproteger el tejido en sacarosa al 30% durante la noche a 4 °C.
NOTA: El tejido se puede congelar en un compuesto de temperatura de corte óptima (OCT) utilizando 2-metilbutano enfriado en un vaso de precipitados sobre hielo seco y almacenado a -80 ° C si el procedimiento debe detenerse aquí.
- Papilas gustativas fungiformes
- Enfríe el 2-metilbutano en un vaso de precipitados sobre hielo seco en preparación para el paso 2.2.8.
- Descongelar y enjuagar la lengua en 0,1 M PB. Coloque la mitad de la lengua anterior que contiene las papilas fungiformes en un portaobjetos de vidrio bajo un microscopio de disección.
- Use fórceps contundentes y tijeras de disección para extirpar el músculo. Use fórceps de extremo romo para mantener el tejido abierto a medida que el epitelio lingual está curvado, y asegure una orientación plana manteniendo las cuchillas de las tijeras de disección gruesas paralelas al epitelio.
- Deseche el epitelio ventral no queratinizado de la lengua, ya que no contiene papilas gustativas.
- Use tijeras de disección finas para una disección más cercana a la parte inferior del epitelio queratinizado.
NOTA: Es importante diseccionar cerca del epitelio para que el músculo restante sea de grosor uniforme y la superficie sea lisa para garantizar una penetración uniforme de anticuerpos. La consecuencia del grosor no uniforme del músculo restante será una sección desigual en el criostato, con exposición del epitelio en áreas con menos músculo y una capa más gruesa de músculo para otras áreas, lo que impide la penetración de anticuerpos. - Use las pinzas de extremo romo para colocar un pedazo de epitelio en un molde de tejido (lado muscular hacia abajo) y asegúrese de que quede plano. Una vez que el tejido esté plano, agregue una gota de OCT al tejido.
NOTA: Dado que la punta de la lengua es curva, puede ser necesario hacer un corte en el epitelio donde está curvada para que el tejido se pueda hacer que quede plano. - Coloque el molde de tejido sobre una base de metal (previamente enfriada en hielo seco) debajo del endoscopio de disección. Continúe golpeando el tejido ligeramente con las pinzas hasta que la OCT se haya congelado para asegurarse de que el tejido se congele lo más plano posible.
- Una vez que el OCT se haya congelado, agregue rápidamente OCT adicional y coloque el molde en un vaso de precipitados de 2-metilbutano (enfriado en hielo seco) hasta que se congele.
- Seccionamiento de criostatos
NOTA: El criostato se utiliza para la extracción fina del tejido subcutáneo restante, lo que puede inhibir la penetración de anticuerpos(Figura 1).- Monte los moldes OCT en el criostato y corte secciones de 20 μm. Recoja cada sección y visualícela bajo el microscopio de luz para evaluar su proximidad a la base del epitelio(Figura 1E - H).
- Después de afeitar el tejido de la parte inferior del epitelio, descongele el epitelio y enjuáguelo dos veces en 0,1 M PB en una coctelera.
- Papilas gustativas circunvaladas
- Usando un corte coronal con una hoja de afeitar, separe la papila circunvalada de la lengua anterior. Use dos cortes parasagitales con la misma cuchilla de afeitar para extirpar el tejido lateral a la papila bajo un endoscopio de disección. Coloque la papila en un molde de tejido usando fórceps de modo que un borde lateral de la papila circunvalada se enfrente a la parte inferior del molde de tejido.
NOTA: El tejido se puede congelar en OCT utilizando 2-metilbutano enfriado en un vaso de precipitados sobre hielo seco y almacenado a -80 ° C si el procedimiento debe detenerse aquí. - Cortar el tejido en secciones flotantes de 90 μm en el criostato.
- Usando un corte coronal con una hoja de afeitar, separe la papila circunvalada de la lengua anterior. Use dos cortes parasagitales con la misma cuchilla de afeitar para extirpar el tejido lateral a la papila bajo un endoscopio de disección. Coloque la papila en un molde de tejido usando fórceps de modo que un borde lateral de la papila circunvalada se enfrente a la parte inferior del molde de tejido.
- Papilas gustativas en el paladar
- Cortar el paladar duro anterior a la unión del paladar blando y duro (Figura 2). Use tijeras para separar el paladar blando del tejido subyacente, asegurándose de que se corten los fragmentos de hueso restantes. Extirpar músculo adicional y tejido conectivo.
NOTA: Una vez eliminado, todo el tejido que queda consistirá en glándulas y tejido conectivo suelto, que se adhieren ligeramente a la parte inferior del paladar. - Sostenga el paladar con fórceps de extremo romo y retire las glándulas restantes y el tejido conectivo suelto raspándolos suavemente con una cuchilla de afeitar.
NOTA: El tejido se puede congelar en OCT utilizando 2-metilbutano enfriado en un vaso de precipitados sobre hielo seco y almacenado a -80 ° C si el procedimiento debe detenerse aquí.
- Cortar el paladar duro anterior a la unión del paladar blando y duro (Figura 2). Use tijeras para separar el paladar blando del tejido subyacente, asegurándose de que se corten los fragmentos de hueso restantes. Extirpar músculo adicional y tejido conectivo.
3. Tinción inmunohistoquímica
- Lavar los pañuelos con 0,1 M pb, 3 x 15 min. Coloque los tejidos en tubos de 1 ml con solución bloqueadora (suero de burro al 3%, surfactante no iónico al 0,5% (consulte la Tabla de materiales),0,1 M PB) a 4 °C durante la noche.
- Retire la solución bloqueadora e incube el tejido en anticuerpo primario (conejo anti-PCLβ2) en solución de anticuerpos (0,1 M PB, surfactante no iónico al 0,5%) durante 5 días a 4 °C.
- Lavar con 0,1 M pb, 4 x 15 min cada lavado, e incubar en el anticuerpo secundario anti-conejo 488 de burro (1:500) en solución de anticuerpos durante 2 días a 4 °C.
- Lavar con 0,1 M pb, 4 x 15 min cada lavado, y bloquear con suero de conejo normal al 5% en solución de anticuerpos.
- Lavar con 0,1 M PB, 4 x 15 min. Incubar con el anticuerpo bloqueador anti-conejo de burro (20 μg/ml) en solución de anticuerpos durante 2 días a 4 °C.
- Lavar con 0,1 M pb, 4 x 15 min cada lavado, y luego incubar con anticuerpo primario dsRed (conejo) conjugado a una etiqueta fluorescente (según las instrucciones del fabricante) en una solución de anticuerpos durante 5 días a 4 °C.
- Lavar con 0,1 M pb, 4 x 15 min cada lavado, y luego incubar con anticuerpo primario (cabra anti-Car4 (1:500)) en solución de anticuerpos durante 5 días a 4 °C.
- Lavar con 0,1 M PB, 4 x 15 min cada lavado. Incubar con anticuerpo secundario burro anti-cabra 647 (1:500) en solución de anticuerpos durante 2 días a 4 °C.
- Lavar con 0,1 M PB, 4 x 15 min cada lavado, y montar (lado epitelial hacia arriba) en medios de montaje acuosos, y colocar una cubierta sobre la sección de tejido.
NOTA: Si usa anticuerpos de diferentes especies, como en el caso de queratina-8 y dsRed solamente, agregue todos los anticuerpos primarios a la solución de anticuerpos en el paso 3.2 y todos los anticuerpos secundarios en el paso 3.3 antes de continuar con el paso 3.9.
4. Imagen confocal y deconvolución
- Capture imágenes confocales utilizando un microscopio confocal con un objetivo de 60x (apertura numérica = 1.40), 4 ms / píxel, zoom de 3, Kalman de 2 y tamaño de 1024 x 1024. Seleccione un tamaño de paso de 0,47 mm a lo largo del eje z. Para capturar la inervación de la papila, use un zoom de 2.5 si el campo de visión con un zoom de 3 es demasiado estrecho para capturar toda la inervación a la papila.
- Para desenredar las imágenes, tenga en cuenta que algunas configuraciones se importarán automáticamente con la imagen; por lo tanto, complete los detalles restantes para la modalidad, la lente del objetivo, la apertura numérica, el medio de inmersión, el medio de muestra y los fluoróforos capturados en la imagen. A continuación, seleccione Deconvolución 3D.
5. Análisis de imágenes
- Volumen de papilas gustativas e inervación
- Importe pilas de imágenes desenredadas a un software de análisis de imágenes basado en píxeles (consulte la Tabla de materiales)para determinar el volumen de las papilas gustativas y el volumen de inervación total dentro de la papila gustativa.
- Desmarque Volumen en el menú principal Objeto.
- Seleccione Agregar nuevas superficies en el menú Objeto. Seleccione Omitir creación automática, editar manualmentey, a continuación, seleccione Contorno.
- Haga clic en Seleccionar y observe la flecha que aparece como un + para ayudar a trazar el borde de la papila gustativa. Mueva la cortadora y delinee la papila gustativa en cada sección óptica. Una vez que se completen los contornos, haga clic en Crear superficie.
- Observe el objeto de volumen de papilas gustativas que aparece ahora en el menú principal de objetos. Localice el volumen de la papila gustativa en Herramientas.
- Volumen de inervación dentro de la papila gustativa
- Seleccione el icono del lápiz debajo del objeto de la papila gustativa y, a continuación, seleccione Enmascarar todo.
- En el menú desplegable, seleccione el canal fluorescente que corresponde con la etiqueta de la fibra nerviosa. Marque Crear canal duplicado.
- Marque Establecer vóxeles fuera de la superficie en:, y escriba 0 en el cuadro.
- Observe el nuevo canal que aparece en la ventana Ajuste de pantalla, que es un duplicado inalterado del canal fluorescente seleccionado dentro de la papila gustativa.
- En el menú principal Objeto, seleccione Crear nueva superficie. Desmarque Omitir creación automática, edite manualmente.
- Haga clic dos veces en la flecha azul para continuar con el siguiente paso.
- Haga clic en Eliminar, luego haga clic en la flecha doble verde para completar la superficie, que representa el volumen de las fibras nerviosas presentes dentro de la papila gustativa. Para encontrar el valor del volumen, seleccione Herramientas en el menú Objeto de fibra nerviosa y seleccione Volumen en el menú desplegable.
- Volumen de inervación a la papila
- Cree un volumen de la papila gustativa como se describe en la sección 5.1.
- Seleccione el icono del lápiz debajo del objeto de la papila gustativa y, a continuación, seleccione Enmascarar todo.
- En el menú desplegable, seleccione el canal fluorescente que corresponde con la etiqueta de la fibra nerviosa. Marque Crear canal duplicado.
- Marque Establecer vóxeles dentro de la superficie en: y escriba 0 en el cuadro. Haga clic en Aceptar.
- Genere una superficie haciendo clic en Agregar nueva superficie. Seleccione Segmentar sólo una región de interés.
- Haga clic en la flecha azuly aumente el valor Z para que la región de interés comience en la base de la papila gustativa.
- Haga clic dos veces en la flecha azul para continuar con el siguiente paso.
- Haga clic en Eliminar, luego haga clic en la flecha doble verde para completar la superficie, que representa el volumen de la inervación a la papila. Para encontrar el valor del volumen, seleccione Herramientas en el menú Objeto de fibra nerviosa y seleccione Volumen en el menú desplegable.
- Análisis de contacto del cenador terminal
- Preparación de imágenes
- Vaya al menú Editar y seleccione Recortar 3D. Recorte la imagen por todos lados, eliminando el espacio fuera de la papila gustativa.
NOTA: Recorte lo más cerca de la papila gustativa sin eliminar ninguna estructura relevante: cualquier exceso de imagen alargará el tiempo de procesamiento. - Seleccione Editar en el menú principal, haga clic en Cambiar tipo de datos. Seleccione Para: flotador de 32 bits en el menú desplegable.
- Seleccione Agregar nuevas superficies en el menú Objeto. Haga clic en Omitir creación automática, editar manualmente,seleccione Contornoy, a continuación, arrastre la posición del sector hacia la derecha para encontrar el número total de sectores ópticos.
- Genere vóxeles isométricos y asegúrese de que en lugar de que los vóxeles sean rectángulos (0.0691 x 0.0691 x 0.474) como XxYxZ, respectivamente, los vóxeles sean 0.0691 x 0.0691 x 0.0691 dividiendo los rectángulos en cubos con valores idénticos para la intensidad de fluorescencia que el vóxel rectangular original. Seleccione Propiedades de imagen. Luego, divida el valor Z para voxel Size por el valor X o Y (= 0.474/0.0691) y multiplique ese valor por el número de cortes (secciones ópticas) encontrados en el paso anterior.
- Vuelva a Editar en el menú principal y seleccione Volver a muestrear 3D.
- Reemplace el valor Z (número de sectores) por el valor recién calculado.
- Vaya al menú Editar y seleccione Recortar 3D. Recorte la imagen por todos lados, eliminando el espacio fuera de la papila gustativa.
- Creación de superficies automáticas basadas en fluorescencia
- Haga clic en Agregar nueva superficie de nuevo para agregar una nueva superficie, anule la selección de Segmentar solo una región de interésy haga clic en Siguiente.
- En el menú desplegable Canal de origen, seleccione el canal para uno de los tipos de celdas de transducción de sabor. Anule la selección de Suavizar y continúe con el siguiente paso.
- No altere nada en la siguiente pantalla que muestre el rango de intensidades fluorescentes presentes en la imagen. Haga clic en la flecha azul en la parte inferior de nuevo para pasar al siguiente paso.
- Haga clic en Eliminary, a continuación, haga clic en la flecha doble verde para completar la superficie.
- Vaya al menú Objeto en la mano izquierda de la pantalla donde aparecerá la superficie de celda completada y se llamará algo genérico como Surface 2. Haga doble clic en el nombre de la superficie para nombrarlo de acuerdo con lo que representa la etiqueta.
NOTA: En este caso, la superficie generada se basa en la celda marcada con PLCß2. - Si hay puntos en lugar de una superficie, en el menú de la esquina inferior izquierda, haga clic en Superficie en lugar de Punto central. A continuación, haga clic en Aceptar cuando se le solicite.
- Repita los pasos 5.3.2.1-5.3.2.5 para los otros marcadores celulares transductores del gusto y el marcador de fibra nerviosa.
- Guarde (exporte) el progreso.
- Haga clic en un tipo de celda Surface en el menú principal. En el menú de ese objeto, haga clic en Herramientasy, a continuación, haga clic en Transformación de distancia.
- Espere a que aparezca un cuadro emergente titulado XTDistanceTransformation. Seleccione Objeto de superficie exterior. Anote el nuevo canal que aparece en el menú Ajuste de pantalla denominado Distancia al nombre de la superficie.
- Seleccione la superficie Fibra nerviosa en el menú Objeto. Haga clic en el icono del lápiz y luego en Enmascarar todo.
- En el menú desplegable que aparece, seleccione el nuevo canal Distancia hasta el nombre de la superficie. Anote el nuevo canal que aparece en la ventana Ajuste de pantalla denominada Distancia enmascarada al nombre de la superficie.
- Cree un nuevo objeto mediante el menú principal Objeto. Anule la selección de Segmentar solo una región de interés y haga clic en la flecha azul. Seleccione la distancia enmascarada al canal PLCß2 y desmarque Suavizar.
- En la siguiente pantalla, verifique si hay alguna región donde las células transductoras de sabor estén a la distancia más pequeña de las fibras nerviosas discernibles por este software. Para hacer esto, establezca un límite de 0.01-0.11 μm para verificar si hay fluorescencia de células receptoras tan cerca de las fibras nerviosas.
- Escriba 0.01 en el cuadro verde del lado izquierdo para establecer el umbral inferior, presione Tab. Luego haga clic en el botón rojo y escriba 0.11 para establecer el umbral superior. Presione Tab y luego haga clic en la flecha azul en la parte inferior para pasar al siguiente paso.
- Haga clic en Eliminar y luego en la flecha doble verde para finalizar.
- Cambie el nombre de esta superficie dentro de 0.01-0.11 de PLCß2 en el menú Objeto. Seleccione Dentro de 0.01 - 0.11 de la superficie PLCß2 en el menú Objeto.
- Seleccione el lápiz y luego haga clic en Enmascarar todo. Seleccione el canal rojo (fibra nerviosa) en el menú desplegable y haga clic en Aceptar. Tome nota del nuevo canal que aparece en la ventana Ajuste de pantalla denominada CHS2 enmascarado.
- Haga clic en el nombre del canal; cambie el nombre del canal dentro de 0.01 - 0.11 de PLCß2.
NOTA: Este es un canal fluorescente que representa un duplicado del canal fluorescente rojo presente dentro de la superficie creada. - Haga clic en blanco en el centro del selector de color. Seleccione un color que contraste con los colores de las estructuras.
- Exporte (es decir, guarde) el archivo en esta etapa.
- Repita los pasos 5.4.2.9-5.4.2.21 para otros marcadores celulares transductores del sabor.
- Exporte (es decir, guarde) el archivo en esta etapa.
NOTA: Para analizar la proximidad de un tipo de célula etiquetada a otro, simplemente reemplace la superficie de la fibra nerviosa en el paso 5.4.2.11 (y los siguientes pasos) con el objeto de interés y los componentes equivalentes que pertenecen a cada paso posterior.
- Preparación de imágenes
- Importe pilas de imágenes desenredadas a un software de análisis de imágenes basado en píxeles (consulte la Tabla de materiales)para determinar el volumen de las papilas gustativas y el volumen de inervación total dentro de la papila gustativa.
6. Reconstrucción del cenador neuronal y cuantificación del número celular absoluto
- Rastreo y análisis del cenador terminal
- Abra el archivo de imagen desenrevesado en un software de análisis de imágenes basado en vectores 3D (consulte la Tabla de materiales),seleccione Rastrear,haga clic en Neuronay luego haga clic en Dendrita.
- Desplácese hasta la base de la papila gustativa en la pila de imágenes. Traza cada fibra hasta el final mientras te desplazas por la pila de imágenes.
- Cuando esté en el extremo de la rama, haga clic con el botón derecho en el extremo y seleccione Finalizar. En los puntos de bifurcación, haga clic con el botón derecho y seleccione Nodo bifurcado.
NOTA: Esto permite rastrear una rama hasta el final y luego regresar al punto de bifurcación y rastrear la otra rama con el programa reconociendo que este rastreo sigue siendo de la misma neurona. - Guarde el archivo de datos como un archivo . DAT, que luego se puede abrir para su análisis en el software de análisis de imágenes basado en vectores 3D.
7. Cuantificación del número de células
- Cuantificar las células de papilas gustativas etiquetadas en cualquier paquete de software de análisis de imágenes, siempre que se puedan colocar marcadores distintos para transducir tipos de células ancladas a la posición z a nivel nuclear.
Resultados
Tinción del epitelio lingual con anticuerpos contra dsRed y queratina-8 (un marcador general de papilas gustativas) etiquetadas tanto como todas las papilas gustativas enteras y toda la inervación de las papilas gustativas en ratones Phox2b-Cre:tdTomato50,51 (Figura 3A). Las imágenes de estas papilas gustativas desde sus poros hasta sus bases dieron las imágenes planas x-y de mayor resolución(Figura 3A,B). La función de contorno del programa de imágenes basado en píxeles se utilizó para delinear la periferia de la papila gustativa en cada sección(Figura 3B),y luego generar una superficie(Figura 3C)que representaba el volumen de las papilas gustativas. Enmascarar (o duplicar) la fluorescencia asociada con la etiqueta de la papila gustativa solo dentro de la superficie creó un nuevo canal que contenía solo esta fluorescencia y eliminó cualquier tinción de papila que oscureciera la papila gustativa(Figura 3D). La fluorescencia de la fibra nerviosa dentro de la papila gustativa se enmascaró(Figura 3E)y se utilizó para crear automáticamente una superficie que representa el volumen de inervación dentro de ella(Figura 3F). Un enfoque similar también se utilizó para medir el volumen de las papilas gustativas y el de su inervación asociada en las papilas gustativas circunvaladas(Figura 3G). Los datos representativos de medición no revelaron correlaciones entre los volúmenes de las papilas gustativas y los volúmenes de inervación en las regiones de medición fungiformes(p = 0,115) o circunvaladas(p = 0,090)(Figura 3H).
La administración de una dosis baja de tamoxifeno en ratones TrkBCreER:tdTomato causa la recombinación de genes y el etiquetado de un pequeño número de neuronas para que las papilas gustativas estén inervadas por cero a unos pocos cenadores terminales marcados (la porción neuronal dentro de la papila gustativa). El epitelio lingual se tiñó utilizando un anticuerpo anti-dsRed para los cenadores terminales y anticuerpos anti-Car4 (agrio) y anti-PLCβ2 (dulce, amargo y umami) para las células transductoras del gusto(Figura 4A). Se utilizó un programa de análisis de imágenes basado en vectores para rastrear los cenadores terminales etiquetados(Figura 4B). Las alturas ortogonales de los cenadores asociados con los trazados azul y verde fueron de 33,4 μm(Figura 4C)y 32,4 μm(Figura 4D),respectivamente. Las mediciones del casco convexo 3D (es decir, la extensión del cenador terminal dentro de la papila gustativa) para el cenador terminal azul fue de 644.0 μm3 y 3647.0 μm3 para el cenador verde. El dendrograma para el trazado verde se muestra en la Figura 4E con longitudes de rama medidas en micras. El cenador verde tenía siete extremos de rama y una longitud total de 183,4 μm. La cuantificación de los números absolutos de células PLCβ2+ y Car4+ reveló que esta papila gustativa tenía 17 células PLCβ2+ y dos células Car4+. El uso de un software de imágenes basado en píxeles celulares para determinar la proximidad más cercana entre las fibras nerviosas y las células transductoras del gusto reveló que de un total de 19 células transductoras del gusto en la papila gustativa, el cenador terminal azul (que se muestra en rojo en la Figura 4F,G)estaba dentro de los 200 nm (la resolución del microscopio de luz) de la célula car4 + azul claro (áreas blancas indicadas por flechas en la Figura 4G). El cenador terminal asociado con el trazado verde se muestra en magenta(Figura 4F y Figura 4H)y está dentro de los 200 nm de las celdas Car4+ azul claro y oscuro (áreas blancas en la Figura 4H). Como la siguiente celda más cercana a estos cenadores estaba a más de 200 nm de distancia, había un vóxel sin etiquetar que separaba las dos estructuras.
Las células progenitoras en división se etiquetaron mediante inyecciones de EdU en los días 0, 1 y 3, y los tejidos se recolectaron el día 4. La tinción de queratina-8 y EdU de montaje entero de papilas gustativas fungiformes reveló que las células marcadas con EdU estaban presentes tanto dentro como fuera de las papilas gustativas(Figura 5A-C). Se segmentaron células individuales de EdU+/queratina-8+ (verde azulado y amarillo) y núcleos de EdU+/queratina-8- (púrpura y magenta)(Figura 5B,C). La célula azul oscuro mostrada era queratina-8+ y tenía una forma alargada consistente con células maduras transductoras de sabor. Estas superficies se muestran con la papila gustativa orientada de poro a base(Figura 5B)y a lo largo del eje largo de la papila gustativa(Figura 5C). Cada estructura se podía ver en cortes ópticos individuales enmascarando la fluorescencia dentro de cada estructura(Figura 5D-F). Los núcleos magenta y púrpura están fuera del borde de queratina-8+ de la papila gustativa indicado por el contorno de puntos blancos(Figura 5D,E). Las células amarillas, verde azulado y azul estaban dentro de la papila gustativa(Figura 5D-F). Las células transductoras de sabor individuales podrían reconstruirse utilizando un software de imágenes basado en píxeles de etiquetado Car4(Figura 6A-C)o etiquetado PLCβ2(Figura 6D-F). Se utilizó un software de imágenes basado en píxeles para medir la proximidad más cercana entre las células reveló que una célula Car4 + (la misma celda como se muestra en la Figura 6B)estaba dentro de los 200 nm de una sola celda PLCβ2 +(Figura 6G,verde). El área donde las celdas estaban dentro de los 200 nm entre sí se muestra en blanco(Figura 6G)y se indica con flechas blancas. La siguiente celda más cercana estaba a más de 200 nm de distancia y se muestra en amarillo en la Figura 6H,I en dos orientaciones diferentes. La Figura 7 demuestra el aislamiento y análisis de la inervación que termina dentro de la papila (pero fuera de la papila gustativa) e incluye su distribución alrededor de la papila gustativa y su distancia del epitelio.

Figura 1: Preparación del epitelio lingual para la tinción fungiforme de las papilas gustativas. (A) Vista de la lengua cortada con epitelio y músculo marcados antes de cualquier disección. (B) Una vez que se ha eliminado suficiente músculo, solo queda una pequeña cantidad de músculo en la parte inferior del epitelio. Además de evaluar el progreso de la disección al ver el lado cortado del epitelio, (C) colocar el epitelio plano en un portaobjetos de vidrio debajo del endoscopio de disección revela que algunas porciones del tejido son uniformemente translúcidas (rectángulo púrpura); se ha eliminado suficiente músculo de esta área. En contraste, las flechas púrpuras indican regiones a la izquierda donde hay más músculo que necesita ser removido. Una vez que toda la parte inferior del epitelio sea similar al área en el rectángulo púrpura, continúe con el siguiente paso. (D) Después de que las porciones del epitelio se han congelado con el lado muscular hacia abajo, el músculo adicional y la lámina propia se eliminan como secciones delgadas utilizando el criostato. Cuando se completa la sección, el epitelio restante es delgado y translúcido. (E-F) Las secciones seriadas (20 μm) se recogieron en un portaobjetos de vidrio, y cada sección se observó bajo un microscopio fluorescente antes de cortar la siguiente sección. Muy por debajo del epitelio, las fibras musculares están orientadas en múltiples direcciones para que las fibras musculares estén presentes tanto en la sección transversal como a lo largo de la fibra muscular(E,rectángulo rojo). Las secciones seriadas en E-F demuestran la transición de fibras musculares orientadas en múltiples direcciones(E,rectángulo rojo) a fibras musculares orientadas principalmente en una dirección(F,rectángulo rojo), lo que es indicativo del borde músculo-lámina propia. Otra región de la misma pieza de tejido (rectángulos amarillos) demuestra que cuando las fibras musculares están orientadas en una dirección, la siguiente sección probablemente producirá tejido conectivo porque todo el músculo se ha eliminado de esa región. Los rectángulos azules representan la parte inferior del epitelio. Si las papilas gustativas están presentes en la sección(G,flechas rojas), se ha eliminado demasiado tejido. Idealmente, la sección se completa cuando la parte inferior del epitelio (pero sin papilas gustativas) es visible en las secciones eliminadas(F,rectángulo amarillo). Aunque las áreas con fibras musculares orientadas en la misma dirección(E,rectángulo amarillo y F,rectángulo rojo) también son adecuadas para la seccionamiento, se deben evitar las áreas donde las fibras musculares están orientadas en múltiples direcciones(E,rectángulo rojo). (G) Una vez que las secciones incluyen la parte inferior del epitelio / lámina propia, solo es posible cortar algunas secciones adicionales antes de que se haya eliminado demasiado epitelio y las secciones incluyan papilas gustativas. (H) El error más común se revela por las secciones de criostato donde el epitelio se ve en el borde del tejido, el músculo se ve dentro del epitelio y el músculo OTC / escaso está presente en el medio. Esto se debe con mayor frecuencia a no colocar el tejido plano en la parte inferior del molde de tejido antes de la congelación o al aplanamiento insuficiente con fórceps de extremo romo. Barras de escala en A-C = 1 mm; barras de escala en E, F, H = 100 μm; barra de escala en G = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Disección del paladar para la tinción. (A) El paladar se diseccionó primero usando tijeras de hoja delgada para cortar el paladar duro, (B) luego usando las mismas tijeras para separar el paladar blando del tejido conectivo subyacente. Después de extraer el tejido de la cavidad oral, cualquier tejido restante se eliminó con las tijeras. En este punto, todo lo que puede quedar son glándulas en la parte posterior del paladar blando. Se usó una cuchilla de afeitar para raspar suavemente estas glándulas. Se muestra la superficie(C)posterior y (D) epitelial de la disección completa del paladar. Haga clic aquí para ver una versión más grande de esta figura.
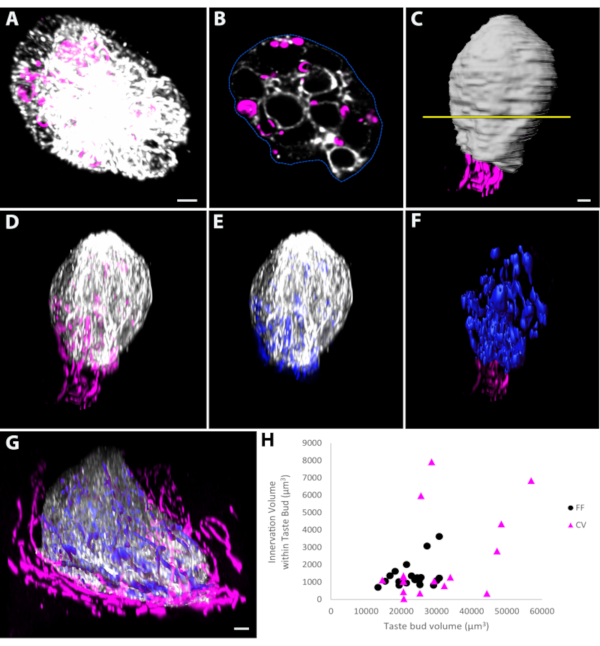
Figura 3: Medición del volumen en papilas gustativas de montaje entero. (A) Las papilas gustativas de montaje entero se tomaron imágenes desde el poro gustativo hasta la base de la papila gustativa, de modo que el plano de mayor resolución sea el plano x-y. Cada rebanada óptica se vio en un software de análisis de imágenes basado en píxeles, y la función de contorno se utilizó para delinear manualmente la periferia de la papila gustativa teñida con queratina-8. (B) Se proporciona un ejemplo de una rebanada óptica. (C) La posición de esta sección representativa a lo largo del eje largo de la papila gustativa se muestra mediante la línea amarilla. Después de delinear cada sección óptica, se creó una superficie que representa el volumen de la papila gustativa (blanco). Enmascarar o duplicar el canal fluorescente correspondiente a la papila gustativa (queratina-8 en D)o la inervación marcada con tdTomato (azul pseudocoloreado en E)dentro del volumen que representa la papila gustativa. La fluorescencia dentro de la papila gustativa en (E) se utilizó para generar una superficie que representa el volumen de inervación dentro de la papila gustativa (F, azul). (G)Se aplicó un enfoque similar a las papilas gustativas circunvaladas de montura entera fotografiadas en la misma orientación que la papila gustativa fungiforme en A. (H) La medición del volumen de papilas gustativas fungiformes y circunvaladas y su respectivo volumen de inervación reveló que no existe correlación entre la papila gustativa y el volumen de inervación para las papilas gustativas muestreadas para ninguna de las regiones. Barras de escala en A-D, F = 4 μm; barra de escala en G = 5 μm. Esta cifra ha sido modificada a partir de Ohman-Gault et al.50. Abreviaturas: FF = fungiforme; CV = circunvalado. Haga clic aquí para ver una versión más grande de esta figura.
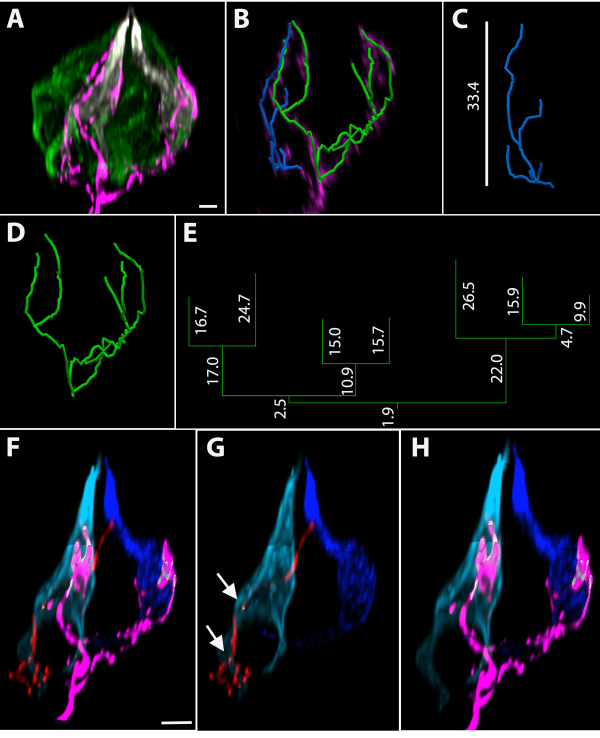
Figura 4: Cenadores terminales representativos en papilas gustativas fungiformes utilizando etiquetado genético de células dispersas. (A) Papilas gustativas de montaje entero teñidas con marcadores de células transductoras gustativas Car4 (blanco) y PLCβ2 (verde). (B) Esta papila gustativa tiene dos cenadores terminales etiquetados, que se muestran con la papila gustativa eliminada después de reconstruir las fibras. (C) El cenador azul tiene 6 extremos de rama y una altura ortogonal en la papila gustativa de 33.4 μm y (D) el cenador verde tiene 7 extremos de rama. (E) El dendrograma correspondiente al cenador verde se proporciona con cada longitud de segmento en micrómetros. (F-H) Se midió la distancia entre estructuras. (F-G) El trazado azul en C fue segmentado y se muestra en rojo. (G) Las áreas donde este cenador terminal está dentro de los 200 nm de la celda car4+ azul claro se indican con flechas blancas. (F, H) El cenador terminal representado por la reconstrucción verde se muestra en magenta. (H) El cenador magenta (asociado con el trazado verde en 4B, D) está dentro de los 200 nm de las células Car4+ de color azul oscuro y claro. Barra de escala en A, B = 4 μm; barras de escala en F-H = 5 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5:Los soportes integrales se pueden utilizar para rastrear la incorporación de nuevas células de papilas gustativas. Los ratones fueron inyectados con EdU para etiquetar progenitores divisorios en los días 0, 1 y 3 y sacrificados el día 4. (A, B) Las células marcadas con EdU (verde) se pueden identificar tanto alrededor como dentro de la papila gustativa, que está etiquetada con queratina-8 (A, blanco, B, gris). (B, C) Las células individuales marcadas con EdU, queratina-8+ dentro de la papila gustativa y los núcleos marcados con queratina-8-, EdU se segmentan fuera de la papila gustativa. (D-F) La fluorescencia dentro de cada estructura segmentada en A-B fue enmascarada y se puede ver en sección transversal. El perímetro de la papila gustativa se delinea con una línea punteada blanca (D-F). (D) La célula amarilla está dentro de la papila gustativa y está etiquetada con EdU y queratina-8+. El núcleo magenta está fuera de la papila gustativa y es queratina-8-. (E) La célula verde azulado está dentro de la papila gustativa y está etiquetada con EdU y queratina-8+. El núcleo púrpura marcado con EdU es queratina-8- y fuera de la papila gustativa (flecha blanca). (F) La célula azul es queratina-8+ y alargada, consistente con células maduras transductoras de sabor. Barras de escala en A-C = 3 μm; barras de escala en D = 2 μm; barras de escamas en E, F = 4 μm. Abreviatura: EdU = 5-etinil-2′-desoxiuridina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Las formas de las células enteras de las papilas gustativas se pueden analizar junto con sus relaciones con otras células de las papilas gustativas. (A-F). La segmentación de células de papilas gustativas individuales para crear superficies aísla las células de papilas gustativas individuales, lo que facilita una visualización clara. Las células plCβ2+ individuales (A-C) Car4+ y (D-F) muestran la variación en las formas celulares individuales. (G) Se determinó que la célula PLCβ2+ más cercana a la célula Car4+ en B estaba dentro de los 200 nm (en una sola ubicación pequeña de 0,5 μm2 indicada por flecha). La siguiente celda más cercana estaba a más de 300 nm de distancia y se podía distinguir como una estructura separada de la celda Car4+ segmentada. (H, I) La siguiente celda más cercana fue segmentada; y la fluorescencia enmascarada se muestra en amarillo. Los tres puntos más cercanos para la siguiente celda más cercana (amarillo) se indican con puntas de flecha en H, I. Barras de escala en A-C = 3 μm; barras de escala en D, E = 4 μm; barra de escala en F = 2 μm; barras de escala en G-I = 3 μm. Haga clic aquí para ver una versión más grande de esta figura.
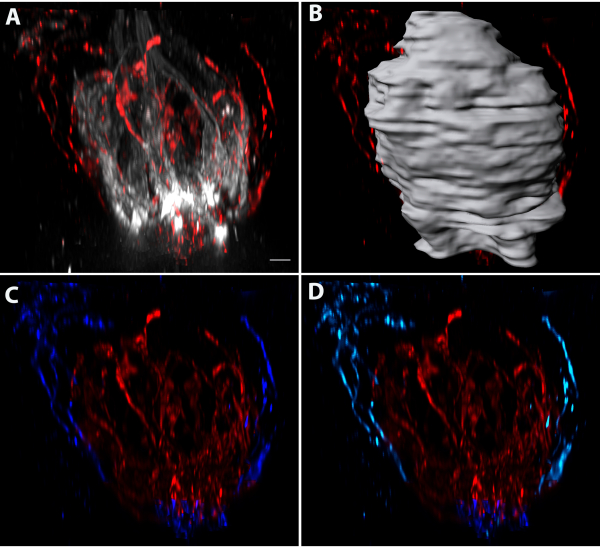
Figura 7: Cuantificación de la inervación en la papila. (A) Algunas etiquetas para las neuronas del gusto también etiquetan la inervación en la papila. (B) La inervación dentro de la papila gustativa se separa de la inervación fuera de la papila gustativa segmentando la papila gustativa (como se describe para la Figura 3),(C) enmascarando la inervación dentro de la papila gustativa (rojo), y luego enmascarando la inervación fuera de la papila gustativa solamente (azul oscuro). El volumen de inervación a la papila gustativa (rojo) fue de 1649,6 μm3. La inervación fuera de la papila gustativa incluirá fibras gustativas debajo de la papila que no deben incluirse en la cuantificación de la inervación a la papila. (D) La fluorescencia de la inervación a la papila fue enmascarada (azul claro). El volumen de inervación a la papila fue de 121,8 μm3. Barras de escala en A-D = 4 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El desarrollo de un enfoque para recolectar y teñir consistentemente papilas gustativas enteras de tres regiones gustativas de la cavidad oral (fungiformes, circunvaladas y el paladar) proporciona mejoras significativas para analizar las células transductoras del gusto, rastrear las células recién incorporadas, la inervación y las relaciones entre estas estructuras. Además, facilita la localización de un potencial marcador neuronal secundario tanto dentro como fuera de una población marcada50. Esto es particularmente relevante dado que las papilas gustativas también reciben una inervación somatosensorial robusta52,53, que también puede etiquetar algunas neuronas gustativas. Las papilas que albergan las papilas gustativas también se pueden visualizar utilizando un aumento más bajo. Esto permite la visualización de la inervación a toda la papila, así como a las papilas gustativas, y permite análisis independientes de la inervación que penetra en la papila gustativa y las fibras nerviosas circundantes.
Las terminaciones nerviosas somatosensoriales en la piel se pueden distinguir en función de su organización alrededor de los folículos pilosos y sus relaciones con otros componentes del epitelio; los análisis paralelos en papilas gustativas pueden arrojar caracterizaciones similares54,55. Establecer una base normal para las relaciones dentro de las papilas gustativas y las papilas gustativas y la composición de las mismas servirá como línea de base para determinar los mecanismos subyacentes a los déficits en las funciones gustativas periféricas56,57. La papila gustativa es un órgano final sensorial dinámico donde la renovación celular y la remodelación terminal del cenador están coordinadas por una variedad de factores58. Las investigaciones sobre los circuitos potenciales dentro de la papila gustativa59,los procesos de enfermedad57y las quimioterapias que interrumpen la función normal del gusto58 podrían mejorarse con este método, que mantiene intactas las papilas gustativas completas y las fibras nerviosas. El método de montaje completo descrito aquí amplía las posibilidades de análisis y refina las mediciones que son posibles.
Dado que la lengua es un tejido denso y heterogéneo, y que la papila gustativa en sí contiene muchas uniones de célula a célula que limitan la permeabilidad27,el desarrollo de un enfoque para lograr la tinción de las papilas gustativas de montaje completo presentó un desafío significativo. Los métodos anteriores implicaban tomar secciones representativas60 o cortar secciones más gruesas, que luego limitaban la penetración de anticuerpos32,33,34. Además, la selección de papilas gustativas enteras de estas secciones más gruesas sesgó los datos hacia papilas gustativas más pequeñas. Alternativamente, es probable que pelar el epitelio interrumpa las fibras nerviosas de las papilas gustativas; estos no están específicamente etiquetados cuando se utiliza este enfoque39,40. Los cenadores nerviosos forman un gran plexo dentro de una papila gustativa26,50,61, por lo que no está claro si la eliminación del cenador interrumpe las relaciones normales entre otras células en la papila gustativa. Por el contrario, el actual método de papilas gustativas completas permite cuantificar los números absolutos y las mediciones. Esta tinción permite preservar y analizar muchas características de las células transductoras (tipo, forma y ubicación) y los cenadores terminales (así como las relaciones entre ellos).
Hay varias limitaciones en este enfoque. En particular, algunos anticuerpos que se han utilizado en secciones delgadas62 no funcionan en montajes completos, lo que limitará los tipos de estructuras que se pueden examinar. Además, como la resolución de la microscopía confocal es limitada, los datos estructurales analizados de células individuales y de las relaciones entre células también estarán limitados24. Por ejemplo, se puede determinar que las células están a menos de 200 nm entre sí, pero no se pueden examinar las estructuras especializadas entre las células (por ejemplo, sinapsis)63. Por último, no todos los tipos de células se pueden etiquetar utilizando este enfoque. Por ejemplo, ha demostrado ser difícil etiquetar específicamente las células que transducen sal en esta preparación. Estas células podrían ser un subconjunto de una combinación de células Tipo 1, Tipo II y Tipo III14,15,16,17,18,19,64. Las células de tipo I, que son principalmente células de soporte, no se pueden examinar en monturas enteras porque parecen envolverse alrededor de otras células, lo que las hace difíciles de distinguir como entidades separadas65. Tener un marcador confiable para las células transductoras de sal permitiría realizar análisis más completos14,66. Del mismo modo, como la tinción PLCβ2 representa células gustativas capaces de transducir múltiples tipos de estímulos, una etiqueta que permitiera una mayor separación de este tipo de célula también sería una mejora.
Los siguientes son pasos preparatorios importantes que requieren atención. Primero, asegúrese de que la capa muscular que queda después de la disección sea uniforme y lo más delgada posible. Si esta capa no es uniforme, la penetración de anticuerpos finalmente no será uniforme. En segundo lugar, es crucial que las piezas de epitelio permanezcan planas en el fondo del molde de tejido antes de congelarse, y que se usen fórceps de extremo romo para presionar ligeramente el tejido hasta que se congele. Cuando la cantidad mínima de músculo (en una capa par) permanece en la parte inferior del epitelio, tan solo tres secciones de criostato llegarán a la parte inferior del epitelio. El posicionamiento del tejido en un criostato, de modo que las secciones se toman a través de toda la cara del tejido, a veces da como resultado que partes del tejido se eliminen de manera desigual. Por estas razones, se recomienda encarecidamente evitar la descongelación adicional, la disección adicional y la recongelación del tejido. En su lugar, se debe tener cuidado para evaluar la disección del tejido antes de congelar el tejido.
En general, el método para la preparación de tejido de montaje completo que se presenta aquí se puede utilizar para recolectar papilas gustativas completas, así como la papila circundante de tres regiones de papilas gustativas: fungiformes, circunvaladas y del paladar. Aunque se sabe que una variedad de afecciones de la enfermedad56,57 y quimioterapias56 interrumpen la función del gusto, los mecanismos subyacentes a estos cambios siguen siendo desconocidos. El uso del enfoque de tinción de montaje completo para las papilas gustativas presentado aquí representa un diseño experimental robusto donde tanto las células transductoras del gusto como sus fibras nerviosas podrían etiquetarse para determinar si un déficit se debe a la pérdida de un tipo de célula específica, morfologías de cenador terminal comprometidas, relaciones interrumpidas entre las células transductoras del gusto o relaciones interrumpidas entre las células transductoras y sus fibras nerviosas. Además, sería posible no solo cuantificar el número absoluto de nuevas células marcadas en las papilas gustativas, sino también cuantificar el número de nuevas células transductoras del gusto (marcadas con EdU) de un tipo definido (es decir, PLCβ2+ o Car4+). También se podría examinar si estas nuevas células desarrollan formas normales y se incorporan normalmente a la papila gustativa (es decir, se mueven a la papila gustativa después del tratamiento). Muchas de estas medidas, junto con el número de papilas gustativas, se pueden hacer a partir del mismo tejido, lo que limita el número de animales diferentes necesarios para un experimento. Estas posibilidades podrían facilitar la racionalización de los métodos experimentales para proporcionar intervenciones clínicas para los déficits de sabor, así como proporcionar información sobre los mecanismos normales subyacentes a la función del gusto.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Kavisca Kuruparanantha por sus contribuciones a la tinción de tejidos y la obtención de imágenes de papilas gustativas circunvaladas, Jennifer Xu por la tinción y la imagen de la inervación en la papila, Kaytee Horn por el cuidado de los animales y el genotipado, y Liqun Ma por su tinción de tejidos de las papilas gustativas del paladar blando. Este proyecto fue apoyado por R21 DC014857 y R01 DC007176 a R.F.K y F31 DC017660 a L.O.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,2,2-Tribromoethanol | ACROS Organics | AC421430100 | |
| 2-Methylbutane | ACROS | 126470025 | |
| AffiniPure Fab Fragment Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-007-003 | 15.5μL/mL |
| Alexa Fluor® 647 AffiniPure Donkey Anti-Rat IgG | Jackson Immuno Research | 712-605-150 | (1:500) |
| AutoQuant X3 software | Media Cybernetics | ||
| Blunt End Forceps | Fine Science Tools | FST 91100-12 | |
| Click-iT™ Plus EdU Cell Proliferation Kit | Molecular Probes | C10637 | Follow kit instructions |
| Coverglass | Marienfeld | 107242 | |
| Cytokeratin-8 | Developmental Studies Hybridoma Bank (DSHB), (RRID: AB_531826) | Troma1 supernatant | (1:50, store at 4°C) |
| Dissection Scissors (coarse) | Roboz | RS-5619 | |
| Dissection Scissors (fine) | Moria | MC19B | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A21206 | (1:500) |
| Donkey anti-Rabbit, Alexa Fluor® 555 | ThermoFisher Scientific | A31572 | (1:500) |
| DyLight™ 405 AffiniPure Fab Fragment Bovine Anti-Goat IgG | Jackson Immuno Research | 805-477-008 | (1:500) |
| Fluoromount G | Southern Biotech | 0100-01 | |
| Glass slides | Fisher Scientific (Superfrost Plus Miscroscope Slides) | 12-550-15 | |
| Goat anti-Car4 | R&D Systems | AF2414 | (1:500) |
| Imaris | Bitplane | pixel-based image analysis software | |
| Neurolucida 360 + Explorer | MBF Biosciences | 3D vector based image analysis software | |
| Normal Donkey Serum | Jackson Immuno Research | 017-000-121 | |
| Normal Rabbit Serum | Equitech-Bio, Inc | SR30 | |
| Olympus FV1000 | (multi-Argon laser with wavelengths 458, 488, 515 and additional HeNe lasers emitting 543 and 633) | ||
| Paraformaldehyde | EMD | PX0055-3 | 4% in 0.1M PB |
| Rabbit anti-dsRed | Living Colors DsRed Polyclonal Antibody; Clontech Clontech Laboratories, Inc. (632496) | 632496 | (1:500) |
| Rabbit anti-PLCβ2 | Santa Cruz Biotechnology | Cat# sc-206 | (1:500) |
| Sodium Phosphate Dibasic Anhydrous | Fisher Scientific | BP332-500 | |
| Sodium Phosphate Monobasic | Fisher Scientific | BP330-500 | |
| tert-Amyl alcohol | Aldrich Chemical Company | 8.06193 | |
| Tissue Molds | Electron Microscopy Sciences | 70180 | |
| Tissue-Tek® O.C.T. Compound | Sakura | 4583 | |
| Triton X-100 | BIO-RAD | #161-0407 | |
| Zenon™ Alexa Fluor™ 555 Rabbit IgG Labeling Kit | ThermoFisher Scientific | Z25305 | Follow kit instructions |
Referencias
- Clapp, T. R., Medler, K. F., Damak, S., Margolskee, R. F., Kinnamon, S. C. Mouse taste cells with G protein-coupled taste receptors lack voltage-gated calcium channels and SNAP-25. BMC Biology. 4 (1), 7 (2006).
- Clapp, T. R., Yang, R., Stoick, C. L., Kinnamon, S. C., Kinnamon, J. C. Morphologic characterization of rat taste receptor cells that express components of the phospholipase C signaling pathway. The Journal of Comparative Neurology. 468 (3), 311-321 (2004).
- Delay, R. J., Roper, S. D., Kinnamon, J. C. Ultrastructure of mouse vallate taste buds: II. Cell types and cell lineage. The Journal of Comparative Neurology. 253 (2), 242-252 (1986).
- Finger, T. E. Cell types and lineages in taste buds. Chemical Senses. 30, 54-55 (2005).
- Kataoka, S., et al. The candidate sour taste receptor, PKD2L1, is expressed by type III taste cells in the mouse. Chemical Senses. 33 (3), 243-254 (2008).
- Murray, R. Fine structure of gustatory cells in rabbit taste buds. Journal of Ultrastructure Research. 27 (5-6), 444 (1969).
- Murray, R. G., Murray, A. Fine structure of taste buds of rabbit foliate papillae. Journal of Ultrastructure Research. 19 (3), 327-353 (1967).
- Yang, R., Crowley, H. H., Rock, M. E., Kinnamon, J. C. Taste cells with synapses in rat circumvallate papillae display SNAP-25-like immunoreactivity. The Journal of Comparative Neurology. 424 (2), 205-215 (2000).
- Yee, C. L., Yang, R., Böttger, B., Finger, T. E., Kinnamon, J. C. "Type III" cells of rat taste buds: Immunohistochemical and ultrastructural studies of neuron-specific enolase, protein gene product 9.5, and serotonin. Journal of Comparative Neurology. 440 (1), 97-108 (2001).
- Zhang, Y., et al. Coding of sweet, bitter, and umami tastes. Cell. 112 (3), 293-301 (2003).
- Chandrashekar, J., et al. The taste of carbonation. Science. 326 (5951), 443-445 (2009).
- Oka, Y., Butnaru, M., Von Buchholtz, L., Ryba, N. J. P., Zuker, C. S. High salt recruits aversive taste pathways. Nature. 494 (7438), 472-475 (2013).
- Stratford, J. M., Larson, E. D., Yang, R., Salcedo, E., Finger, T. E. 5-HT3A-driven green fluorescent protein delineates gustatory fibers innervating sour-responsive taste cells: A labeled line for sour taste. Journal of Comparative Neurology. 525 (10), 2358-2375 (2017).
- Baumer-Harrison, C., et al. Optogenetic stimulation of type I GAD65(+) cells in taste buds activates gustatory neurons and drives appetitive licking behavior in sodium-depleted mice. The Journal of Neuroscience. 40 (41), 7795-7810 (2020).
- Nomura, K., Nakanishi, M., Ishidate, F., Iwata, K., Taruno, A. All-electrical Ca(2+)-independent signal transduction mediates attractive sodium taste in taste buds. Neuron. 106 (5), 816-829 (2020).
- Ohmoto, M., Jyotaki, M., Foskett, J. K., Matsumoto, I. Sodium-taste cells require Skn-1a for generation and share molecular features with sweet, umami, and bitter taste cells. eneuro. 7 (6), (2020).
- Roebber, J. K., Roper, S. D., Chaudhari, N. The role of the anion in salt (NaCl) detection by mouse taste buds. The Journal of Neuroscience. 39 (32), 6224-6232 (2019).
- Oka, Y., Butnaru, M., von Buchholtz, L., Ryba, N. J., Zuker, C. S. High salt recruits aversive taste pathways. Nature. 494 (7438), 472-475 (2013).
- Lewandowski, B. C., Sukumaran, S. K., Margolskee, R. F., Bachmanov, A. A. Amiloride-insensitive salt taste is mediated by two populations of type III taste cells with distinct transduction mechanisms. The Journal of Neuroscience. 36 (6), 1942-1953 (2016).
- Beidler, L. M., Smallman, R. L. Renewal of cells within taste buds. The Journal of Cell Biology. 27 (2), 263-272 (1965).
- Hamamichi, R., Asano-Miyoshi, M., Emori, Y. Taste bud contains both short-lived and long-lived cell populations. Neuroscience. 141 (4), 2129-2138 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. P. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Spector, A. C., Travers, S. P. The representation of taste quality in the mammalian nervous system. Behavoiral and Cognitive Neuroscience Reviews. 4 (3), 143-191 (2005).
- Huang, T., Ohman, L. C., Clements, A. V., Whiddon, Z. D., Krimm, R. F. Variable branching characteristics of peripheral taste neurons indicates differential convergence. bioRxiv. , (2020).
- Taruno, A., et al. CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes. Nature. 495 (7440), 223-226 (2013).
- Kinnamon, J. C., Taylor, B. J., Delay, R. J., Roper, S. D. Ultrastructure of mouse vallate taste buds. I. Taste cells and their associated synapses. The Journal of comparative neurology. 235 (1), 48-60 (1985).
- Dando, R., et al. A permeability barrier surrounds taste buds in lingual epithelia. American Journal of Physiology. Cell Physiology. 308 (1), 21-32 (2015).
- Mistretta, C. M. Permeability of tongue epithelium and its relation to taste. American Journal of Physiology. 220 (5), 1162-1167 (1971).
- Michlig, S., Damak, S., Le Coutre, J. Claudin-based permeability barriers in taste buds. The Journal of Comparative Neurology. 502 (6), 1003-1011 (2007).
- Kinnamon, S. C., Finger, T. E. Recent advances in taste transduction and signaling. F1000Research. 8, 2117 (2019).
- Meng, L., Huang, T., Sun, C., Hill, D. L., Krimm, R. BDNF is required for taste axon regeneration following unilateral chorda tympani nerve section. Experimental Neurology. 293, 27-42 (2017).
- Meng, L., Ohman-Gault, L., Ma, L., Krimm, R. F. Taste bud-derived BDNF is required to maintain normal amounts of innervation to adult taste buds. eneuro. 2 (6), (2015).
- Tang, T., Rios-Pilier, J., Krimm, R. Taste bud-derived BDNF maintains innervation of a subset of TrkB-expressing gustatory nerve fibers. Molecular and Cellular Neuroscience. 82, 195-203 (2017).
- Zhang, G. H., Zhang, H. Y., Deng, S. P., Qin, Y. M. Regional differences in taste bud distribution and -gustducin expression patterns in the mouse fungiform papilla. Chemical Senses. 33 (4), 357-362 (2008).
- Huang, T., Ma, L., Krimm, R. F. Postnatal reduction of BDNF regulates the developmental remodeling of taste bud innervation. Developmental Biology. 405 (2), 225-236 (2015).
- Nosrat, I. V., Margolskee, R. F., Nosrat, C. A. Targeted taste cell-specific overexpression of brain-derived neurotrophic factor in adult taste buds elevates phosphorylated TrkB protein levels in taste cells, increases taste bud size, and promotes gustatory innervation. Journal of Biological Chemistry. 287 (20), 16791-16800 (2012).
- Liebl, D. J., Mbiene, J. -. P., Parada, L. F. NT4/5 mutant mice have deficiency in gustatory papillae and taste bud formation. Developmental Biology. 213 (2), 378-389 (1999).
- Kumari, A., Yokota, Y., Li, L., Bradley, R. M., Mistretta, C. M. Species generalization and differences in Hedgehog pathway regulation of fungiform and circumvallate papilla taste function and somatosensation demonstrated with sonidegib. Scientific Reports. 8 (1), (2018).
- Venkatesan, N., Boggs, K., Liu, H. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering. Part C, Methods. 22 (4), 332-337 (2016).
- Meisel, C. T., Pagella, P., Porcheri, C., Mitsiadis, T. A. Three-dimensional imaging and gene expression analysis upon enzymatic isolation of the tongue epithelium. Frontiers in Physiology. 11, 825 (2020).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Guagliardo, N. A., Hill, D. L. Fungiform taste bud degeneration in C57BL/6J mice following chorda-lingual nerve transection. The Journal of Comparative Neurology. 504 (2), 206-216 (2007).
- Ohtubo, Y., Yoshii, K. Quantitative analysis of taste bud cell numbers in fungiform and soft palate taste buds of mice. Brain Research. 1367, 13-21 (2011).
- Ogata, T., Ohtubo, Y. Quantitative analysis of taste bud cell numbers in the circumvallate and foliate taste buds of mice. Chemical Senses. 45 (4), 261-273 (2020).
- Tomchik, S. M., Berg, S., Kim, J. W., Chaudhari, N., Roper, S. D. Breadth of tuning and taste coding in mammalian taste buds. Journal of Neuroscience. 27 (40), 10840-10848 (2007).
- Finger, T. E. ATP signaling is crucial for communication from taste buds to gustatory nerves. Science. 310 (5753), 1495-1499 (2005).
- Lau, J., et al. Temporal control of gene deletion in sensory ganglia using a tamoxifen-inducible Advillin-CreERT2 recombinase mouse. Molecular Pain. 7 (1), 100 (2011).
- Hirsch, M. -. R., D'Autréaux, F., Dymecki, S. M., Brunet, J. -. F., Goridis, C. APhox2b::FLPotransgenic mouse line suitable for intersectional genetics. genesis. 51 (7), 506-514 (2013).
- Perea-Martinez, I., Nagai, T., Chaudhari, N. Functional cell types in taste buds have distinct longevities. PLoS ONE. 8 (1), 53399 (2013).
- Ohman-Gault, L., Huang, T., Krimm, R. The transcription factor Phox2b distinguishes between oral and non-oral sensory neurons in the geniculate ganglion. Journal of Comparative Neurology. 525 (18), 3935-3950 (2017).
- Dvoryanchikov, G., et al. Transcriptomes and neurotransmitter profiles of classes of gustatory and somatosensory neurons in the geniculate ganglion. Nature Communications. 8 (1), (2017).
- Whitehead, M. C., Ganchrow, J. R., Ganchrow, D., Yao, B. Organization of geniculate and trigeminal ganglion cells innervating single fungiform taste papillae: a study with tetramethylrhodamine dextran amine labeling. Neuroscience. 93 (3), 931-941 (1999).
- Suemune, S., et al. Trigeminal nerve endings of lingual mucosa and musculature of the rat. Brain Research. 586 (1), 162-165 (1992).
- Rutlin, M., et al. The cellular and molecular basis of direction selectivity of Aδ-LTMRs. Cell. 159 (7), 1640-1651 (2014).
- Abraira, V. E., Ginty, D. D. The sensory neurons of touch. Neuron. 79 (4), 618-639 (2013).
- Feng, P., Huang, L., Wang, H. Taste bud homeostasis in health, disease, and aging. Chemical Senses. 39 (1), 3-16 (2014).
- Cooper, K. W., et al. COVID-19 and the chemical senses: supporting players take center stage. Neuron. 107 (2), 219-233 (2020).
- Barlow, L. A. Progress and renewal in gustation: new insights into taste bud development. Development. 142 (21), 3620-3629 (2015).
- Roper, S. D. Taste buds as peripheral chemosensory processors. Seminars in Cell & Developmental Biology. 24 (1), 71-79 (2013).
- Ma, H., Yang, R., Thomas, S. M., Kinnamon, J. C. BMC. Neuroscience. 8 (1), 5 (2007).
- Kinnamon, J. C., Sherman, T. A., Roper, S. D. Ultrastructure of mouse vallate taste buds: III. Patterns of synaptic connectivity. The Journal of Comparative Neurology. 270 (1), 1-10 (1988).
- Romanov, R. A., et al. Chemical synapses without synaptic vesicles: Purinergic neurotransmission through a CALHM1 channel-mitochondrial signaling complex. Science Signaling. 11 (529), 1815 (2018).
- Dani, A., Huang, B., Bergan, J., Dulac, C., Zhuang, X. Superresolution imaging of chemical synapses in the brain. Neuron. 68 (5), 843-856 (2010).
- Vandenbeuch, A., Clapp, T. R., Kinnamon, S. C. Amiloride-sensitive channels in type I fungiform taste cells in mouse. BMC Neuroscience. 9 (1), 1 (2008).
- Bartel, D. L., Sullivan, S. L., Lavoie, &. #. 2. 0. 1. ;. G., Sévigny, J., Finger, T. E. Nucleoside triphosphate diphosphohydrolase-2 is the ecto-ATPase of type I cells in taste buds. The Journal of Comparative Neurology. 497 (1), 1-12 (2006).
- Wilson, C. E., Vandenbeuch, A., Kinnamon, S. C. Physiological and behavioral responses to optogenetic stimulation of PKD2L1+ type III taste cells. eneuro. 6 (2), (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados