Method Article
ミトコンドリア膜動態を再構成するためのモデル膜プラットフォーム
要約
ミトコンドリア融合は、ミトコンドリアダイナミクスの基礎となる重要なホメオスタティック反応である。ここで説明する インビトロ 再構成システムは、膜テザリング、ドッキング、ヘミフュージョン、および細孔開孔を解決できるミトコンドリア内膜融合を研究するものである。細胞膜システムを探索する際のこのアプローチの多様性について考察する。
要約
ミトコンドリアダイナミクスは、オルガネラの多様な機能と細胞応答に不可欠です。混雑した空間的に複雑なミトコンドリア膜は、調節要因を区別する困難な環境です。タンパク質および脂質成分の実験的制御は、調節の特定の質問に答える助けになります。しかし、これらの因子の定量的操作は、細胞アッセイでは困難です。ミトコンドリア内膜融合の分子機構を調べるには、ミトコンドリア内膜の脂質環境を模した インビトロ 再構成プラットフォームを導入しました。ここでは、脂質二重層を調製し、ミトコンドリア膜タンパク質を再構成するための詳細なステップについて説明する。このプラットフォームは、ミトコンドリア内膜融合中の中間体と、個々の遷移のための運動学を定量的に分析することを可能にした。このプロトコルは、非対称脂質組成を用いた二重層の製造について説明し、膜貫通タンパク質をクッション二層に再構成するための一般的な考慮事項を説明する。この方法は、他の膜系を研究するために適用され得る。
概要
膜区画化は真核細胞1の特徴である(図1A)。生体膜は、二次元溶媒以上のものとして認識され、タンパク質機能および高分子複合体集合体22,33の調節において重要な役割を果たしている環境と考えられている。天然脂質は、膜タンパク質活性33,44を調節するリガンドである。膜空間組織と多様な形状に彫刻される膜の能力は、新しい機能33,5を選択するための重要な物理的特性である。
モデル膜プラットフォームは、細胞膜構造、ダイナミクス、および機能66、7、87,8を理解するのに役立つバイオミメティックシステムです。モデル膜は、典型的には、定義された生物物理学的性質(剛性、厚さ、および弾力性)を有する、明確に定義された組成の脂質混合物を含む。蛍光イメージングに結合されて、モデル膜のプラットホームは膜の構造および機能99、10、1110の量的分析を11可能にする。脂質二重層再構成戦略は、SNARE媒介膜融合99、10、DNA10媒介膜融合12、およびウイルス融合11、13,13を研究するために用いられている。このような方法の利点は、観察可能な反応イベント14に先行する中間ステップの運動情報を得る可能性がある。
原形質膜はモデル膜を用いて広く研究されている。脂質相分離を有する二重層は、細胞シグナル伝達11、15、16,15,16において重要な脂質いかだ構造を研究するために開発された。細胞受容体の組織を調べるのにマイクロパターン化された脂質平板二重層17、18が用いられている。17,ポリマーまたはゲル支持膜は、膜細胞骨格組織、細胞シグナル伝達中の膜タンパク質分配、および細胞-細胞接触19での移動を研究するためのバイオ模倣系として使用されてきた。
人工膜システムは、細胞内小器官20の研究にも応用されている。オルガネラは、独特のサブ環境を作り出す特徴的な形態を特徴とする。小胞子(ER)ネットワークは一例である。リポソームへのレチコンの再構成の際、細胞ERと同様の特性を有する管状膜構造が形成される21.また、アプラスチンの添加により、ER融合タンパク質が、リポソームから脂質細管を誘導してネットワーク20を形成することができる。これは、プロテオリポソームがオルガネラ形態とダイナミクスに機能的洞察を提供する方法の一例です。
ミトコンドリアの膜融合と核分裂は、ミトコンドリア集団22、23、24、25,24,25の健康に不可欠である。22,ダイナミンファミリーGTPasesのセットはミトコンドリア膜融合を触媒する。Mfn 1/2は外膜融合を触媒する。Opa1は、内膜融合26を媒介する(図1B)。Opa1には、ミトコンドリア内膜に膜貫通固定された長い形態(l-Opa1)と、膜間空間に存在する「可溶性」短い形態(s-Opa1)の2つの形態がある。2つのOpa1形態の比率は、Oma1とYme1L,27、28、29、30の2つのプロテアーゼの活性によって調節される。27,2829,30Opa1規制における重要な質問は、Opa1の2つの形態、(短くおよび長い)媒介膜融合およびそれらの規制相互作用2828、29、31、32、33の方法が含まれる。,29,31,32,33
ここでは、内膜融合におけるl-およびs-Opa1の役割を明らかにするミトコンドリア内膜融合の調査に成功した再構成戦略について述べる。ポリマーテザリング脂質二重層と200nmのユニラメラ小胞を用いてミトコンドリア内膜を模倣したプラットフォームを開発した。脂質二重層の下のポリマーテザーの利点としては、以下のものが挙げられる。まず、再構成された膜貫通タンパク質を保存し、それ以外の場合はガラススライド34に近いことによって破壊され得る。第二に、脂質二重層とガラス基板との間に厚い水層を果たし、毛穴開孔9の研究を容易にし、PEGポリマーの粘弾性特性により膜湾曲変化を可能にする35。膜融合の工程を特徴付けるために3色蛍光イメージングを使用しました(図1C-F)。
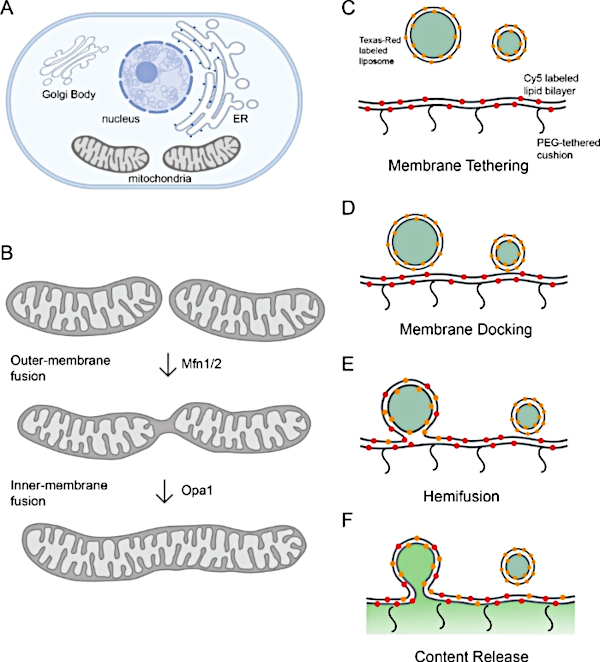
図1:ミトコンドリア膜融合のモニタリング
(A)オルガネラは細胞膜コンパートメントである。(B) ミトコンドリア膜融合の逐次的なステップ。ミトコンドリアの外膜の融合はMfn1および/またはMfn2によって触媒され、内膜融合はOpa1によって媒介される。(C-F)ミトコンドリア膜融合を研究するインビトロ再構成プラットフォームの模式図。プラットフォームには、プロテオリポソームとポリマーテザリング脂質二重層の2つの部分があり、どちらも再構成されたl-Opa1を備えています。2種類の蛍光膜色素と含量マーカーを含む蛍光標識は、膜融合中のステップを区別するのに役立ちます。2つの膜マーカー(Cy5-PE(赤)とテキサスレッドPE(オレンジ)は、閉じた膜ドッキングについて報告することができるFRETペアを作ります。プロテオリポソームを標識するテキサスレッド-PEの拡散は、脂質脱混合(ヘミフュージョン)の指標である。コンテンツの放出は、カルセイン信号のデケンチ(緑色で示す)を通して監視されます。バイオレンダーを使用して作成されたパネル A と B。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
脂質混合物の調製
- 1,2-ジオレオイル-sn-グリセロ-3ホスホコリン(DOPC)、1-パルミトイル-2-オレノイル-snグリセロ-3-ホスホエタノールアミン(POPE)、L-α-ホスファチジルイノシトール(肝臓PI)、カーディオリピン、カーディオリピン、カーディオリピン、カーディアリピン、1,2-ジオレオイル-sn-3ホスホコリンを溶解させることにより、脂質ストック溶液を調製 1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン-N-[メトキシ(ポリエチレングリコール)-2000](18:1 PEG2000 PE)を25mg/mLの濃度でクロロホルムに。蛍光色素共役脂質(テキサスレッドDHPEおよびCy5 DOPE)クロロホルムを1mg/mLの濃度で溶解します。脂質溶液をクロロホルム耐性ライナーでアンバーバイアルに保管し、ポリテトラフルオロエチレンテープでさらに密封します。溶液は-20°Cで6ヶ月まで保つことができます。
- ソリューション A と B を作成します。
- 混合脂質は、DOPC(52.8モル%)、法王(20モル%)、肝臓PI(7モル%)を含む溶液A(最終濃度1mg/mL)を調製するためにそしてカーディオリピン(20モル%)、および0.2モル%のフルオロフォア。
- DOPC(47.8モル%)、法王(20モル%)、肝臓PI(7モル%)、カージオリピン(20モル%)を含む溶液B(最終濃度1mg/mL)を作るDOPE-PEG2000(5モル%)、および0.2モル%のフルオロフォア。
- ガラスシリンジを使用して、計算された貯蔵溶液をアンバーバイアルに添加して脂質混合物を生成します。バイアルに余分なクロロホルムを追加することにより、最終的なボリュームを一致させます。
注:FCS(蛍光相関分光法)の場合、色素共役脂質の比率を0.002mol%に下げ、残りをDOPCで置き換えてください。
脂質二重層の作製
- 顕微鏡カバーガラスは520°Cで30分間滑ります。焼いた後、カバースライドを室温まで冷やします。
- 約10gの水酸化ナトリウムの重量を量り、攪拌しながら500mLのメタノールを加えます。2時間撹拌し、沈殿が現れるまで溶液中に水酸化ナトリウムを添加し続ける。全体のプロセスの間に適切なPPEを着用することを確認してください。
- 10%ドデシル硫酸ナトリウム溶液でガラススライドをきれいにします。メタノールは、水酸化ナトリウムで飽和;50 mM塩酸、順次(30分間の各条件下での浴超音波処理)。各条件の間に10分間超純水でガラススライドを清掃します。
注:ガラススライドの準備に新鮮なソリューションを使用することを強くお勧めしますが、各ソリューションは5倍以内または1ヶ月以内に再利用できます。使用前に溶液を攪拌してください。 - 洗浄カバーガラスをHCl溶液に密封して2週間まで保管し、良好な二重層品質を確保します。超純水に保存されている場合は、1週間以内にスライドを使用してください。
- トラフに湿気が見られないまで、クロロホルムと超純水を使用して、ラングミュア・ブロジェット浸漬システムのポリテトラフルオロエチレントラフを洗浄します。トラフ表面にクロロホルムをスプレーし、セルロースワイプ3xで十分に拭きます。超純水ですすい、吸引によって水を取り除きます。3x を繰り返します。
- トラフの表面をきれいな超純水で覆います。
- 洗浄液または超純水から表面処理カバーガラスを2個取り、約30sの超純水でガラススライドを洗い流します。
- カバーグラスをバックツーバックに配置します。基板クランプを使用して、ガラススライドを保持します。Langmuir コントロール ソフトウェアの「ディッパーダウン」を手動でクリックして、水面の下にガラススライドを浸します。
- フィルムバランスをゼロにし、空気水界面でのドロップによって溶液Bを慎重に広げる(図2A)。脂質が空気と水の界面でのみ広がっていることを確認し、クロロホルムと脂質滴がポリテトラフルオロエチレン表面の底に沈まないようにしてください。 これを確実にしないと、脂質の「チャネル」が作成され、単層形成を防ぐことができます。
- 〜15〜20 mN/m前後でフィルムバランスが読み出されるまで脂質を加えるのをやめて、~10~15分待ちます。37 mN/mまでのフィルムバランスの読み出しまで、「実験開始」をクリックして、表面積を変更するためにバリアコントローラを開始します。~20~30分間の圧力を保つ(図2B)。
- 表面張力を37 mN/mに保ちながら、カバーガラスを22mm/分の速度で上げます。ポリマーテザリングを有する脂質単層は、ブロジェット浸漬プロセスを通じて、空気-水界面からカバーガラスの表面に移される(図2C)。これは脂質二重層の底のリーフレットを形成する。
- 吸引によって空気水界面をきれいにし、超純水でトラフを洗い流す。
- クロロホルム、エタノール、超純水を使用して、片めのガラススライド(例えば、シェーファースライド)を洗浄してください。水層の下に超純水でトラフの上にきれいなガラススライドを設定します。井戸が空気と水の界面に向かっていることを確認し、ガラススライドが完全に覆われるまで新鮮な超純水を注ぎます。ステップ 2.8 を繰り返します。
- シリコン吸引カップを使用してステップ2.4から脂質単層をカバーガラスに保持し(単層側が吸引カップから離れることを確認し、脂質単層を空気-水界面に静かに押し込み、インタフェースで〜2〜3sのカバーガラスを保持し、スライドにカバーガラスを押し付けます)スライドをカバースライドで取り出します。
注:脂質二重層は、カバーガラスの表面に、2つのスライドの間の挟まれた領域に面して保持されます(図2E)。 - 二重層のカバーガラスを蛍光顕微鏡に持って行きます。脂質二重層を画像化する。脂質染料の均質な分布が観察された場合、2層の小さな領域を30sのフォトブリーチし、~30s-1分間光源をオフにし、再度画像を回復観察する。脂質二重層は、蛍光回復を示す。
注:欠陥や蛍光回復不良を有する膜は、それ以上の実験には使用しないでください。
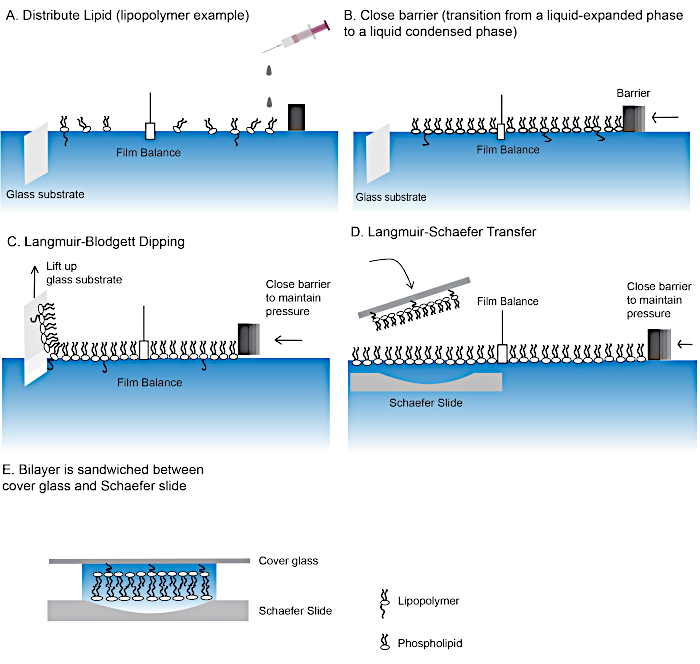
図2:ポリマーテザリング脂質二重層を作るステップ。
ラングミュア・ブロジェット浸漬(A-C)およびラングミュア・シェーファー転移(D)技術を用いて脂質二重層を作るステップ。(E) 脂質二重層を含む最終的な「サンドイッチ」。 この図の大きなバージョンを表示するには、ここをクリックしてください。
3. タンパク質のポリマー・テザリング脂質二重層への再構成
- 超純水を含む結晶化皿を準備します。きれいな顕微鏡のイメージリングを準備し、皿の下に置きます。
- 水の下に脂質二重層を含むシェーファースライドとカバーガラスの「サンドイッチ」を浸し、シェーファースライドとカバーガラスを優しく分離し、カバーガラススライドを底面から保持し、二層側から離れ、カバーガラスを画像リングに移し、画像リングを閉じる。
注:脂質二重層を含むカバーガラスが常に水中にあり、リングが十分に密閉されていることを確認してください。 - 画像リング内の超純水をBis-Tris NaClバッファーに置き換え、脂質二重層が気泡にさらされないようにします。脂質二重層に1.1 x10-9 M n-オクチル-β-D-グルコピラノシドを加える。DDMの1.2 x10-9 Mと1.3 x10-12モルの精製l-Opa136の混合物を画像リングにすぐに加えます。ベンチトップシェーカー上のサンプルを低速で2時間インキュベートする(図3)。
注:洗剤は、再構成されるタンパク質によって異なる場合があります。 - 30 mg SM-2 樹脂ビーズを 3 mL のビストリス バッファーに分配し、塗布前に振ります。プラスチックピペットを使用して、SM-2樹脂ビーズの5〜10 μLを画像リングに加え、10分間インキュベートし、リンスして樹脂ビーズを除去します。イメージリングのバッファーの最終ボリュームは 1.5 mL です。

図3:l-Opa1をポリマーテザリング脂質二重層に再構成する手順。この図の大きなバージョンを表示するには、ここをクリックしてください。
4. プロテオリポソームの調製
- クロロホルム溶液中に1mgの脂質混合物Aを調製する。窒素流下で20分間クロロホルムを蒸発させ、一晩真空下に置き、脂質膜を形成します。
- カルセイン15.56gを1.5モルNaOH溶液の50mLに溶解させて50mMカルセイン含有液を調製し、カルセインが完全に溶解するまで室温で攪拌し、12.5mビストリスと超純水を最終体積500mLに加える。pH を 7.5 に調整します。
- カルセイン含有緩衝液中の脂質膜を懸濁し、200nmのリポソームをポリカーボネート膜を用いて200nmリポソームで65°Cで懸濁液を加熱して脂質を完全に水和する。
- 0.5 μM DDM に 2 μg の l-Opa1 を 0.2 mg リポソームに加え、4 °C で 1.5 時間インキュベートします。250 mlのビストリス、150 mM NaCl、50 mM calcein バッファーを一晩で 250 ml に対して 3.5 kDa 透析カセットを使用して、透析によって界面活性剤を取り出し、バッファーを 2 回変更します。
- PD-10脱塩カラムを使用して余分なカルセインを除去します。
5. イメージングとデータ解析
- 100x油浸性目標(N.A 1.4)を使用してTIRF画像を取得します。カルセインでカプセル化されたTexasRed-PE標識リポソームおよびプロテオリポソームの分析には、543 nmレーザーと488nmレーザーを使用してください。平坦な脂質二重層に埋め込まれたCy5-PEの分析には633 nmレーザーを使用してください。
- 脂質二重層を使用してTIRF角度を合わせて最大の放出を得る。再構成後の脂質二重層の品質は、25°Cで100x油目的を用いて観察される。 リン脂質と再構成二重層の拡散係数は、他の37のプロトコルを用いてFCSを用いて決定される。
- 2 mg/mLプロテオリポソーム10μLを画像リングに加え、画像の10分前にセットします。GTP、GMPPCP、またはGDPは、1 mM MgCl2 および1 mMのヌクレオチドで反応リングに添加される。
- 膜融合におけるs-Opa1の影響を決定するために、s-Opa1をl-Opa1を含むプロテオリポソーム/支持された二重層サンプルに滴定し、融合事象を記録する。
- テキサスレッド-DHPEとカルセインの同時イメージングはビーム分割システムを通して達成される。488 nmおよび543 nmのレーザーは両方とも、蛍光励起源としてサンプルに同時に適用される。次いで、発光光を560 nmのビームスプリッターを使用して分割します。スプリットエミッションライトは、42 nmの帯域幅と40 nmの帯域幅を持つ609 nmフィルタを備えた510 nmフィルタでフィルタリングされます。フィルターされたビームはカメラ チップの 2 つの隣接する領域に投影されます。
- 蛍光発光は、帯域幅が 40 nm の 609 放出フィルタと、帯域幅 70 nm の 698 放出フィルタを通じて同時に記録されます。顕微鏡システムは-10 °Cに維持されるCMOSのカメラが装備されている。
- リポソームの粒子同定は、ガウスベースの粒子認識アルゴリズムを用いて行うことができる。粒子分布と強度はチャンネルごとに解析されます。脂質二重層シグナルは、粒子を分離するためのマスクとして使用されます。
結果
再構成された膜貫通タンパク質は自由に拡散し、膜内で均質に分布する。
脂質二重層およびその脂質流動性の例画像は、蛍光顕微鏡で検証され、図4に示されている。フォトブリーチング前後の二重層における脂質分布を図4A,Bに示す。脂質二重層の均質性は、再構成前後の蛍光顕微鏡を用いて可視化した(図4D,E)。l-Opa1は、脂質二重層で再構成し、蛍光相関分光法(FCS)によって検証した。二重層の脂質拡散率を評価するために、染色コンジュゲート脂質を用います。再構成されたOpa1は、蛍光タグ付き抗Opa1 C末端抗体を用いて標識した。二層脂質拡散は1.46±0.12μm2 /s2と測定し、二層再構成l-Opa1の拡散係数は0.88±0.10μm2/sであった。2l-Opa1の75%が脂質二重層に再構成されていることを示すFCS曲線からの強度読み出し(図4G,H)。これらの結果は、l-Opa1が高分子につながれた脂質二重層に自由に拡散し、機能的複合体に自己集合する可能性があることを示唆している。
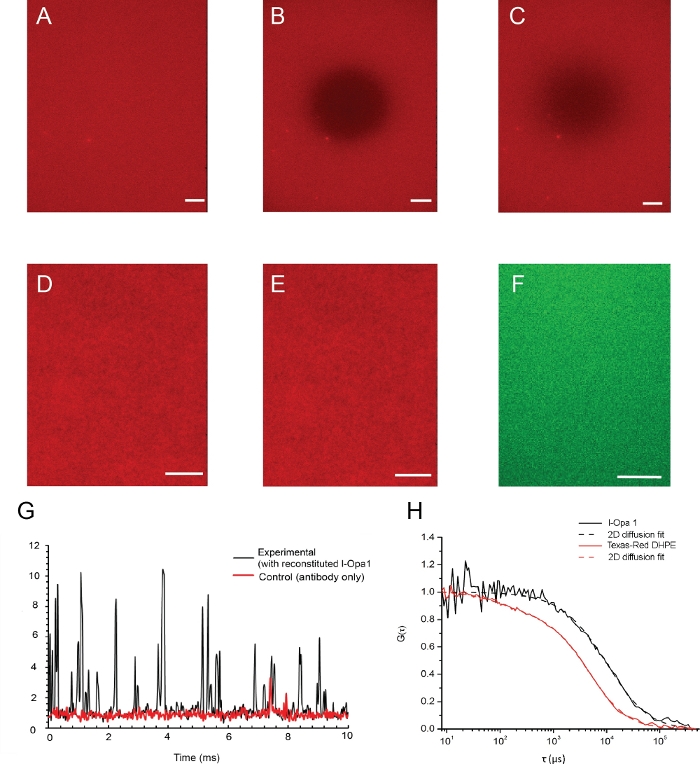
図4:モデル膜中の脂質および再構成タンパク質の分布
(A-C)脂質二重層およびその脂質流動性の画像例は、蛍光顕微鏡で検証される。(A)フォトブリーチ前の二重層における均質な脂質分布。(B)写真の切り落とし直後のスナップショット。(C)蛍光回復後に画像化された二重層は、再構成後の膜の脂質流動性が良好であることを示す。(D,E)脂質分布の前の代表的な画像 (D), および後 (E) l-Opa1再構成は、再構成プロセスが二重層に欠陥を作成しなかったことを示します。Alexa 488共役抗体で標識されたl-Opa1の代表TIRF画像(F)は再構成時にOpa1の均質な分布を示した。G. 代表的な生光子は、蛍光相関分光法によるl-Opa1シグナルのカウントを示す。対照では、二重層でl-Opa1は再構成されず、抗体を添加してすすいでいた。l-Opa1の拡散は膜内の脂質より著しく遅く、膜貫通l-Opa1(H)の再構成に成功した。Hスケールバー:10 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
蛍光ステップの漂白は、l-Opa1の平均2〜3コピーが所定のリポソームで再構成されたことを示した(図5A,B)。OPA1再構成プロテオリポソームのサイズ分布を、DLSを用いた再構成後に試験した(図5C)。プロテオリポソームにおけるOpa1の再構成もFCSを用いて検証された。遊離抗体の拡散係数は164±22μm2/sであった。脂質色素で標識したリポソームの拡散係数は2.22±0.33μm2/s2であり、テキサスレッド標識抗ヒス抗体に結合したl-Opa1プロテオリポソームの拡散係数は2.12±0.36μm2/sであった。2
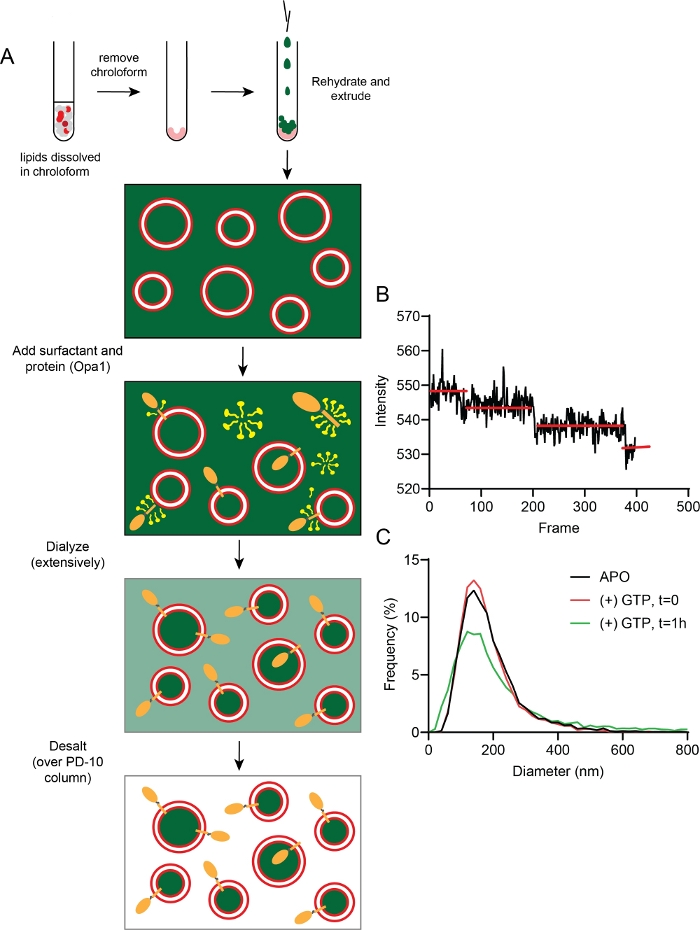
図5:プロテオリポソームの作製と特性評価
(A)カプセル化された焼入しカルセインを用いてプロテオリポソームを製造するステップ。(B)蛍光ステップ漂白の代表的なデータは、リポソームに埋め込まれたl-Opa1の平均2〜3コピーを示す。(C)代表サイズ分布のプロテオリポソーム(赤色)を含まない1時間のヌクレオチドを含まないGTPインキュベーション(緑色)。この図の大きなバージョンを表示するには、ここをクリックしてください。
蛍光顕微鏡による膜テザリング、脂質脱混合/ヘミフュージョン、および孔開きの検出
膜テザリングは、TIRF顕微鏡を用いて脂質二重層の表面上のTexasRedのシグナルを観察することによって監視される(図6A)。膜脂質脱混合(ヘミフュージョン)挙動は、色素がリポソームから脂質二重層に拡散する中、TexasRedを介してモニタリングされた。カルセインデクチンは、脂質のみのデミックスから完全な融合細孔形成を区別するのに役立ちます。これにより、粒子がヘミフュージョンで失速する条件(図6B)と、完全な融合に進む粒子との比較が可能になる(図6C)。
膜テザリングは、リポソームからの安定した脂質シグナルによって示される。距離は、2つの膜36のラベル間のFRET信号に基づいて評価することができた。半球信号はカルセイン信号(図6B、下列)に脱滲みを特徴としないが、TexasRed信号の急速な減衰は、脂質二重層への色素の拡散を示す(図6B 上列)。完全な融合(孔開開)は脂質崩壊と内容放出の両方を特徴とする(図6C)。テキサスレッドの強度とカルセイン強度は、膜融合36の運動に定量的な詳細を提供するために時間依存的な方法で追跡することができる。
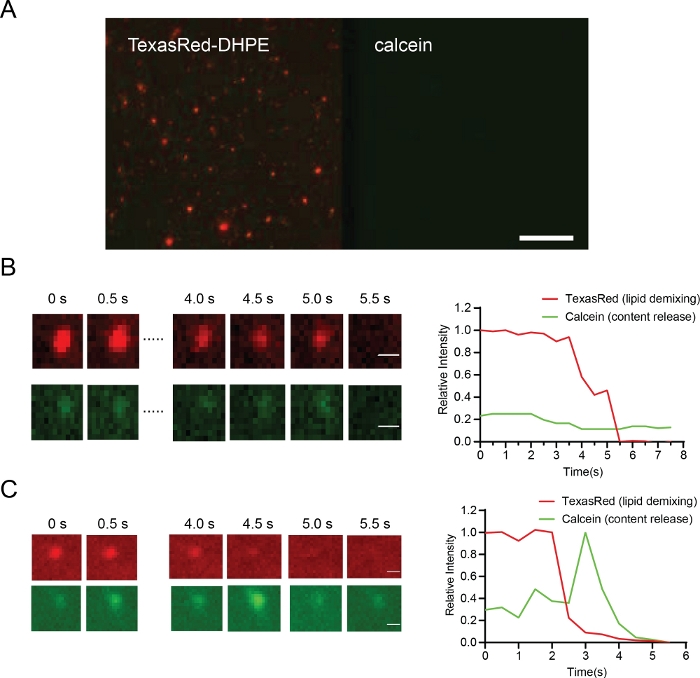
図6:粒子テザリング(A、スケールバー10μm)、ヘミフュージョン(B、スケールバー0.5μm)、および融合(C、スケールバー0.5μm)を示す代表的な結果。
(A)プロテオリポソームは、GTP添加前にOpa1再構成脂質二重層につながれた。(B) ヘミフュージョンの例Bの上段は脂質脱混合(TexasRedシグナル、赤)を示し、Bの下段は、これらの条件下での含有量放出(カルセインシグナル、グリーン)を示さない。(C)脂質二重層と融合したプロテオリポソームの代表的な痕跡。コンテンツの放出は、カルセイン(下段、緑)の脱焼を示す下段の画像から観察することができる。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
インビトロモデル膜システムは、明確に定義された条件下で複雑な膜プロセスを記述することができます。これらのシステムは、分子機構6、15、20、3815,20を6明らかにするために、複雑な分子プロセスに必要な最小限の成分を38区別することができる。膜タンパク質の場合、リポソームおよび平面支持二重層は一般的な再構成システムである。固形脂質二重層とは対照的に、ポリマー・テザリング二重層における基質と支持膜の間のポリマークッションは、大きな膜タンパク質の自由な移動性を可能にし、そして膜貫通タンパク質は自由に拡散し、組み立てる34。これらの特徴は、ミトコンドリア内膜融合36の運動学を調査するのに役立ちました。
ラングミュア・ブロジェット/ラングミュア・シェーファー(LB/LS)技術を用いて、ポリマーテザー化脂質二重層を用意しました。これにより、不斉脂質成分を持つ二重層を調製することができます。細胞膜は非対称リーフレット組成を有し、LB/LSアプローチは、そのような二重層の研究を可能にする。シェーファー移動により、ガラス基板全体を脂質二重層で覆うことができます。二重層調製のためにきれいな表面を準備することが重要です。さらに、シェーファー転送を正しく実行するには練習が必要です。正常なシェーファー転移は、脂質二重層に望ましくない欠陥を生じさせる可能性がある。このプロトコルにおいて、フィルムバランスに加えた圧力は、20%カーディオリピンを含む二重層に適用可能である。他のコンポーネントとの二重層については、主要コンポーネントの表面圧力面積の一元性を参照してください。別の方法は、ラングミュア・ブロジェット/ベシクル融合(LB/VF)法であり、下の脂質単層がラングミュアトラフの空気水界面からきれいな基板に移され、次いでリポソームが支持された脂質層の上部に融合し、最終二重層39を形成する。LB/VF法を用いた膜タンパク質の再構成は、プロテオリポソームの融合によって再構成が行われるため、LB/LSより簡単です。しかし、ベシクル融合には過剰なリポソームの添加が必要であり、濃度依存性タンパク質相互作用に依存する膜事象の研究が複雑になる可能性がある。
好ましい機能的指向におけるポリマーテザリング脂質二重層およびリポソームの両方への膜貫通タンパク質の再構成が成功することは重要であり、実施することは困難である。これを説明するには実験的な制御が必要です。ポリマーテザリング脂質二重層の場合、再構成中に脂質二重層の完全性を維持することも重要である。界面活性剤濃度は、脂質二重層の溶解を防ぐために比較的低く保たれなければならないが、目的のタンパク質37,40,40の変性を防ぐほど高い。ここで説明する方法は、単一分子研究のための膜タンパク質の再構成に理想的であるが、大規模な研究のために必ずしもスケーラブルではない。界面活性剤の選択も重要な考慮事項です。しばしば、精製および貯蔵に使用される界面活性剤は良い出発点である。界面活性剤の最大濃度は、通常、CMC36の約200倍少なく、界面活性剤がタンパク質の安定性を維持し、タンパク質凝集を防止する範囲で、膜36の完全性を維持する。2または3の界面活性剤を含むカクテルが考えられてもよい。リポソームへの再構成のためには、界面活性剤の低濃度は必要ありません。しかし、CMC未満の界面活性剤濃度は、リポソームに対して均一なサイズおよび形態分布を維持することが好ましい。染料の漏出を防ぐためには、染料含有緩衝液に対して透析する必要がある。
リポソーム系融合アッセイとは対照的に、我々が確立したプラットフォームは、膜融合の各ステップの運動学を調査するためのアプローチを提供する。この方法は、ほぼネイティブ条件下で膜貫通融合タンパク質を研究する能力を提供します。モデル膜プラットフォームは、ミトコンドリア内膜のような細胞内環境における膜タンパク質集合体とオリゴマー化、膜「スカルプティング」、タンパク質と脂質の相互作用を研究するために適用できます。この方法はまた、二重層組成非対称性のような膜蛋白質相互作用における重要な生理学的条件の探索を可能にする。主要なミトコンドリア脂質の役割は、カーディオリピン、リポソームおよびポリマー支持二重層の両方の二重層特性において定義され続ける。イオン強度、膜厚さ、膜の剛性、膜の曲率、膜弾性粘性特性などの特性は、タンパク質が特定の機能状態に組み立てる能力に影響を与える可能性があります。モデル膜系を創造的に応用する今後の研究は、膜タンパク質組織と機能の新たな側面を明らかにする可能性を秘めています。
開示事項
なし。
謝辞
著者らは、チャールズ・H・フッド財団児童保健研究賞の支援と、マサチューセッツ総合病院分子生物学部門からの寛大な支援を認めている。
資料
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(Cyanine 5) | Avanti polar lipid | Cat #: 810335C1mg | membrane fluorescent markers |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar lipids | Cat #: 880130P | lipid molecules |
| 1',3'-bis[1,2-dioleoyl-sn-glycero-3-phospho]-glycerol (sodium salt) | Avanti Polar lipids | Cat #: 710335P | lipid molecules |
| 18:1 (Δ9-Cis) PC (DOPC) | Avanti Polar lipids | Cat #: 850375P | lipid molecules |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar lipids | Cat #: 850757P | lipid molecules |
| Alexa Fluor 488 Antibody Labeling Kit | ThermoFisher Scientific | A20181 | |
| Amber vial with PTFE liner | Fisher scientific | 14-955-332 | sample vials to keep lipid solutions |
| Calcein | Sigma-Aldrich | Cat #: C0875; PubChem Substance ID: 24892279 | fluorescent dye |
| Chloroform | Fisher scientific | 298-500/ C295-4 | Fisher brand Chloroform is usually quite reliable for lipid works. |
| Concavity slide (1 well) | Electron Microscopy Science | 71878-05 | applied as Schaefer Slide |
| FCS analysis tool | Smith Lab, University of Akron | software tool | |
| Fiji /ImageJ | Fiji | SCR_002285 | software tool |
| Fisherbrand Cover Glasses: Circles | Fisher scientific | 12-545-102 | Cover glass for solid supported lipid bilayers, the item is now discontinued as authors prepared the manuscript. An alternative is Fisher brand premium cover glass with catalog number: 12-548-5M |
| GTP Disodium salt | SIGMA-ALDRICH INC | Cat #: 10106399001 | |
| Langmuir & Langmuir-Blodgett Trough | Biolin Scientifc | KN2002 | |
| L-α-lysophosphatidylinositol (Liver, Bovine) (sodium salt) | Avanti Polar lipids | Cat #: 850091P | lipid molecules |
| Mini Extruder | Avanti Polar lipids | 610020 | |
| n-Dodecyl-β-D-Maltopyranoside | Anatrace | Cat #: D310 25 GM | surfactant for reconstitution |
| n-Octyl-α-D-Glucopyranoside | Anatrace | Cat #: O311HA 25 GM | surfactant for reconstitution |
| PC Membranes 0.2μm | Avanti Polar Lipids | 610006 | |
| Rabbit Anti-Opa1 antibody | NOVUS BIOLOGICALS | Cat #: NBP2-59770 | antibody for Opa1 C-terminal detection |
| Slidebook | Intelligent imaging | RRID: SCR_014300 | software tool |
| Teflon threaded seal tape | Fisher Scientific | NC0636085 | taflon tape for sample storage |
| Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt (Texas Red DHPE) | ThermoFisher Scientific | Cat #: T1395MP | membrane fluorescent markers |
参考文献
- Sackmann, E., Lipowsky, R., Sackmann, E. Biological membranes architecture and function. Structure and Dynamics of Membranes. 1, 1-63 (1995).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118, 1099-1102 (2005).
- Schink, K. O., Tan, K. W., Stenmark, H. Phosphoinositides in Control of Membrane Dynamics. Annual Review of Cell and Developmental Biology. 32, 143-171 (2016).
- Gu, R. X., Ingolfsson, H. I., de Vries, A. H., Marrink, S. J., Tieleman, D. P. Ganglioside-Lipid and Ganglioside-Protein Interactions Revealed by Coarse-Grained and Atomistic Molecular Dynamics Simulations. Journal of Physical Chemistry B. 121 (15), 3262-3275 (2017).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Chan, Y. H., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Biswas, K. H., Groves, J. T. Hybrid Live Cell-Supported Membrane Interfaces for Signaling Studies. Annual Reviews in Biophysics. 48, 537-562 (2019).
- Pick, H., Alves, A. C., Vogel, H. Single-Vesicle Assays Using Liposomes and Cell-Derived Vesicles: From Modeling Complex Membrane Processes to Synthetic Biology and Biomedical Applications. Chemical Reviews. 118 (18), 8598-8654 (2018).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophysical Journal. 99 (12), 4047-4055 (2010).
- Kiessling, V., et al. Rapid fusion of synaptic vesicles with reconstituted target SNARE membranes. Biophysical Journal. 104 (9), 1950-1958 (2013).
- Yang, S. T., Kiessling, V., Tamm, L. K. Line tension at lipid phase boundaries as driving force for HIV fusion peptide-mediated fusion. Nature Communication. 7, 11401 (2016).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophysical Journal. 101 (8), 37 (2011).
- Chao, L. H., Klein, D. E., Schmidt, A. G., Pena, J. M., Harrison, S. C. Sequential conformational rearrangements in flavivirus membrane fusion. Elife. 3, 04389 (2014).
- Floyd, D. L., Harrison, S. C., van Oijen, A. M. Analysis of kinetic intermediates in single-particle dwell-time distributions. Biophysical Journal. 99 (2), 360-366 (2010).
- Sezgin, E., Schwille, P. Model membrane platforms to study protein-membrane interactions. Molecular Membrane Biology. 29 (5), 144-154 (2012).
- Ge, Y., Gao, J., Jordan, R., Naumann, C. A. Changes in Cholesterol Level Alter Integrin Sequestration in Raft-Mimicking Lipid Mixtures. Biophysical Journal. 114 (1), 158-167 (2018).
- Dutta, D., Kam, L. C. Micropatterned, multicomponent supported lipid bilayers for cellular systems. Methods in Cell Biology. 120, 53-67 (2014).
- Groves, J., Ferrari, M., Desai, T., Bhatia, S. Supported Lipid Bilayers as Mimics for Cell Surfaces and as Tools in Biotechnology. BioMEMS and Biomedical Nanotechnology. , (2006).
- Shoaib, T., Nalam, P. C., He, Y., Chen, Y., Espinosa-Marzal, R. M. Assembly, Morphology, Diffusivity, and Indentation of Hydrogel-Supported Lipid Bilayers. Langmuir. 33 (28), 7105-7117 (2017).
- Wang, N., Rapoport, T. A. Reconstituting the reticular ER network - mechanistic implications and open questions. Journal of Cell Science. 132 (4), 227611 (2019).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Chan, D. C. Fusion and fission: interlinked processes critical for mitochondrial health. Annual Reviews of Genetics. 46, 265-287 (2012).
- Nunnari, J., Suomalainen, A. Mitochondria: in sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wai, T., Langer, T. Mitochondrial Dynamics and Metabolic Regulation. Trends in Endocrinology Metabolism. 27 (2), 105-117 (2016).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nature Reviews Molecular Cell Biology. 11 (12), 872-884 (2010).
- Chen, H., et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development. Journal of Cell Biology. 160 (2), 189-200 (2003).
- Ishihara, N., Fujita, Y., Oka, T., Mihara, K. Regulation of mitochondrial morphology through proteolytic cleavage of OPA1. EMBO Journal. 25 (13), 2966-2977 (2006).
- Anand, R., et al. The i-AAA protease YME1L and OMA1 cleave OPA1 to balance mitochondrial fusion and fission. Journal of Cell Biology. 204 (6), 919-929 (2014).
- Mishra, P., Carelli, V., Manfredi, G., Chan, D. C. Proteolytic cleavage of Opa1 stimulates mitochondrial inner membrane fusion and couples fusion to oxidative phosphorylation. Cell Metabolism. 19 (4), 630-641 (2014).
- Baker, M. J., et al. Stress-induced OMA1 activation and autocatalytic turnover regulate OPA1-dependent mitochondrial dynamics. EMBO Journal. 33 (6), 578-593 (2014).
- DeVay, R. M., et al. Coassembly of Mgm1 isoforms requires cardiolipin and mediates mitochondrial inner membrane fusion. Journal of Cell Biology. 186 (6), 793-803 (2009).
- Rainbolt, T. K., Lebeau, J., Puchades, C., Wiseman, R. L. Reciprocal Degradation of YME1L and OMA1 Adapts Mitochondrial Proteolytic Activity during Stress. Cell Reports. 14 (9), 2041-2049 (2016).
- Ban, T., et al. Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin. Nature Cell Biology. 19 (7), 856-863 (2017).
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Shilts, K., Naumann, C. A. Tunable cell-surface mimetics as engineered cell substrates. Biochimica Biophysica Acta Biomembrane. 1860 (10), 2076-2093 (2018).
- Ge, Y., et al. Two forms of Opa1 cooperate to complete fusion of the mitochondrial inner-membrane. Elife. 9, 50973 (2020).
- Ge, Y., Siegel, A. P., Jordan, R., Naumann, C. A. Ligand binding alters dimerization and sequestering of urokinase receptors in raft-mimicking lipid mixtures. Biophysical Journal. 107 (9), 2101-2111 (2014).
- Simons, K., Vaz, W. L. Model systems, lipid rafts, and cell membranes. Annual Review of Biophysics and Biomolecular Structure. 33, 269-295 (2004).
- Kiessling, V., Liang, B., Tamm, L. K. Reconstituting SNARE-mediated membrane fusion at the single liposome level. Methods in Cell Biology. 128, 339-363 (2015).
- Siegel, A. P., Kimble-Hill, A., Garg, S., Jordan, R., Naumann, C. A. Native ligands change integrin sequestering but not oligomerization in raft-mimicking lipid mixtures. Biophysics Journal. 101 (7), 1642-1650 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved