Method Article
Une plate-forme membranaire modèle pour reconstituer la dynamique memitochondriale de membrane
Dans cet article
Résumé
La fusion mitochondriale est une réaction homéostatique importante sous-jacente à la dynamique mitochondriale. Décrit ici est un système de reconstitution in vitro pour étudier la fusion mitochondriale de membrane interne qui peut résoudre l’attachement de membrane, l’amarrage, l’hémifusion, et l’ouverture de pore. La polyvalence de cette approche dans l’exploration des systèmes de membrane cellulaire est discutée.
Résumé
La dynamique mitochondriale est essentielle pour les diverses fonctions et réponses cellulaires de l’organelle. La membrane mitochondriale surpeuplée, complexe spatialement, est un environnement difficile pour distinguer les facteurs régulateurs. Le contrôle expérimental des composants protéiques et lipidiques peut aider à répondre à des questions spécifiques de régulation. Pourtant, la manipulation quantitative de ces facteurs est difficile dans les tests cellulaires. Pour étudier le mécanisme moléculaire de la fusion des mitochondries à membrane interne, nous avons introduit une plate-forme de reconstitution in vitro qui imite l’environnement lipidique de la membrane interne mitochondriale. Ici, nous décrivons des étapes détaillées pour préparer les bicouches lipidiques et reconstituer les protéines membranaires mitochondriales. La plate-forme a permis l’analyse des intermédiaires dans la fusion mitochondriale de membrane interne, et la cinétique pour les transitions individuelles, d’une manière quantitative. Ce protocole décrit la fabrication de bicouches à composition lipidique asymétrique et décrit des considérations générales pour reconstituer les protéines transmembranaires en bilayer amorti. La méthode peut être appliquée pour étudier d’autres systèmes membranaires.
Introduction
La compartimentation membranaire est une caractéristique des cellules eucaryotes1 (Figure 1A). Les membranes biologiques sont de plus en plus reconnues comme plus qu’un solvant bidimensionnel, et sont considérées comme un environnement jouant un rôle essentiel dans la régulation de la fonction protéique et de l’assemblage complexe macromoléculaire2,3. Les lipides indigènes sont des ligands qui régulent l’activité protéique membranaire3,4. L’organisation spatiale de membrane et la capacité des membranes à être sculptées dans diverses formes sont des propriétés physiques importantes pour sélectionner de nouvelles fonctions3,5.
Les plates-formes de membrane de modèle sont des systèmes biomimétiques qui peuvent nous aider à comprendre la structure, la dynamique et la fonction de membrane cellulaire6,7,8. Les membranes modèles comprennent généralement un mélange lipidique de composition bien définie, avec des propriétés biophysiques définies (rigidité, épaisseur et élasticité). Couplées à l’imagerie par fluorescence, les plates-formes membranaires modèles permettent l’analyse quantitative de la structure et de la fonction de la membrane9,,10,11. Les stratégies de reconstitution de bilayer lipidique ont été utilisées pour étudier la fusion membranaire snare-médiée9,10, fusion membranaire à médiation d’ADN12, et fusion virale11,13. Un avantage de ces méthodes est la possibilité d’obtenir des informations cinétiques pour les étapes intermédiaires précédant un événement de réaction observable14.
La membrane plasmatique a fait l’objet d’études approfondies à l’aide de membranes modèles. Des bicouches avec séparation de phase lipidique ont été développées pour étudier les structures de radeau lipidique importantes dans la signalisation cellulaire11,15,16. Les bilayers planaires de lipides micropatternés17,18 ont été utilisés pour étudier l’organisation des récepteurs cellulaires. Des membranes de polymère ou de gel ont été utilisées comme systèmes biomimétiques pour étudier l’organisation membranaire-cytosquelette, le partitionnement des protéines membranaires pendant la signalisation cellulaire, et la migration aux contacts cellule-cellule19.
Des systèmes de membrane artificielle sont également appliqués pour étudier les organites subcellulaires20. Les organites présentent des morphologies caractéristiques qui créent des sous-environnements distincts. Le réseau réticulum endoplasmique (ER) en est un exemple. Lors de la reconstitution des réticulons en liposomes, les structures tubulaires de membrane avec des propriétés semblables à l’ER cellulaire sont formées21. L’ajout d’atlastine, une protéine de fusion ER, peut induire des tubules lipidiques à partir de liposomes pour former un réseau20. C’est un exemple pour la façon dont les protéoliposomes peuvent fournir un aperçu fonctionnel de la morphologie et de la dynamique organielles.
La fusion et la fission des membranes mitochondriales sont essentielles pour la santé de la population mitochondriale22,23,24,25. Un ensemble de dynamimine famille GTPases catalyse la fusion memitochondrial membranaire. Mfn 1/2 catalyse la fusion de membrane externe. Opa1 médiateur la fusion à membrane interne26 (Figure 1B). Opa1 a deux formes : une forme longue (l-Opa1), la transmembrane ancrée à la membrane interne mitochondriale, et une forme courte « soluble » (s-Opa1), présente dans l’espace intermembrane. Le rapport des deux formulaires Opa1 est réglementé par l’activité de deux protéases, Oma1 et Yme1L27,28,29,30. Les questions importantes dans la réglementation Opa1 comprennent: comment les deux formes de fusion de membrane de médiation Opa1, (courte et longue) et leur interaction réglementaire28,29,31,32,33.
Ici nous décrivons une stratégie de reconstitution appliquée avec succès pour étudier la fusion mitochondriale de membrane interne qui a clarifié les rôles de l- et s-Opa1 dans la fusion interne-membrane. Nous avons développé une plate-forme imitant la membrane interne mitochondriale à l’aide d’une bicouche lipidique liée au polymère et de vésicules unilamellar de 200 nm. Les avantages d’une attache de polymère sous la bicouche lipidique incluent les éléments suivants. Tout d’abord, il préserve la protéine transmembrane reconstituée, qui autrement pourrait être perturbée par la proximité de la lame de verre34. Deuxièmement, il sert une épaisse couche d’eau entre la bicouche lipidique et le substrat en verre, ce qui facilite les études de l’ouverture des pores9, et troisièmement la nature viscoélastique du polymère PEG permet des changements de courbure membranaire35. Nous avons utilisé l’imagerie par fluorescence tricolore pour caractériser les étapes de la fusion membranaire (Figure 1C-F).
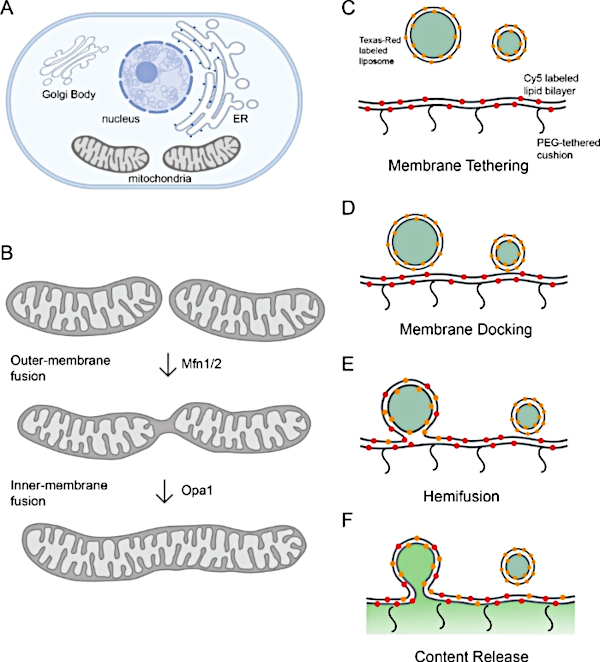
Figure 1 : Surveillance de la fusion des membranes mitochondriales.
(A) Les Organites sont des compartiments à membrane cellulaire. (B) Étapes séquentielles de la fusion de membrane mitochondriale. La fusion de la membrane externe des mitochondries est catalysée par Mfn1 et/ou Mfn2, tandis que la fusion des membranes intérieures est médiée par Opa1. (C-F) Schéma de la plate-forme de reconstitution in vitro pour étudier la fusion memitolière membranaire. La plate-forme comprend deux parties : un protéoliposome et une bicouche lipidique à attache polymère, toutes deux avec l-Opa1 reconstituée. Les étiquettes fluorescentes, y compris deux colorants fluorescents à membrane différents et un marqueur de contenu, aident à distinguer les étapes lors de la fusion des membranes. Les deux marqueurs membranaires (Cy5-PE (rouge) et TexasRed PE (orange) font une paire FRET, qui peut se rapporter sur l’amarrage à membrane étroite. Diffusion de TexasRed-PE qui étiquette protéoliposome est un indicateur de démélangage lipidique (hémifusion). La libération de contenu est surveillée par le déquenchage du signal de calcéine (montré en vert). Panneaux A et B créés à l’aide de Biorender. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Protocole
1. Préparation de mélanges lipidiques
- Préparer une solution de stock lipidique en dissolvant 1,2-dioleoyl-sn-glycero-3phosphocholine (DOPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoéthanolamine (POPE), L-α-phosphatidylinositol (IP hépatique), cardiolipine, et 1,2-dioleoyl-sn-glycero-3-phosphoéthanolamine-N-[methoxy(polyéthylène glycol)-2000] (18:1 PEG2000 PE) en chloroforme à la concentration de 25 mg/mL. Dissoudre le chloroforme fluorescent de colorant conjugué (TexasRed DHPE et Cy5 DOPE) à une concentration de 1 mg/mL. Conservez la solution lipidique dans des flacons d’ambre avec un revêtement résistant au chloroforme, encore scellé avec du ruban de polytétrafluoroéthylène. La solution peut être conservée à -20 °C jusqu’à 6 mois.
- Faire des solutions A et B.
- Mélanger les lipides pour préparer la solution A (concentration finale 1 mg/mL) qui contient le DOPC (52,8 mol),POPE (20 mol%), l’IP hépatique (7 mol%) et la cardiolipine (20 mol%), et 0,2 mol% fluorophore.
- Faire la solution B (concentration finale 1 mg/mL) contenant dopc (47,8 mol%), POPE (20 mol%), IP hépatique (7 mol%), cardiolipine (20 mol%) dope-PEG2000 (5 mol %), et 0,2 mol% fluorophore.
- Générer le mélange de lipides en ajoutant le volume calculé de la solution de stockage dans des flacons d’ambre à l’aide d’une seringue en verre. Assortissez le volume final en ajoutant du chloroforme supplémentaire dans les flacons.
REMARQUE : Pour le SCF (spectroscopie de corrélation de fluorescence), diminuer le rapport des lipides conjugués colorants à 0,002 mol% et remplacer le reste par DOPC.
2. Fabrication de bicouches lipidiques
- Cuire au microscope des lames de verre de couverture à 520 °C pendant 30 min. Après la cuisson, refroidir le couvercle glisse à température ambiante.
- Pesez environ 10 g d’hydroxyde de sodium et ajoutez à 500 mL de méthanol en remuant. Remuer pendant 2 h, continuer à ajouter de l’hydroxyde de sodium dans la solution jusqu’à ce que les précipités commencent à se manifester. Assurez-vous de porter le EPI approprié pendant tout le processus.
- Nettoyer les lames de verre dans une solution de sulfate de dodécy au sodium à 10 %; méthanol saturé d’hydroxyde de sodium; et 50 mM d’acide chlorhydrique, séquentiellement (sonication de bain sous chaque condition pendant 30 min). Nettoyez la lame de verre dans l’eau ultrapure pendant 10 min entre chaque condition.
REMARQUE : Bien qu’il soit fortement recommandé d’utiliser des solutions fraîches pour la préparation des diapositives en verre, chaque solution peut être réutilisée jusqu’à 5 x ou dans un délai d’un mois, selon la première. Assurez-vous de mélanger la solution avant chaque utilisation. - Conservez le verre de couverture nettoyé scellé dans la solution HCl jusqu’à 2 semaines pour assurer une bonne qualité de bicouche. Si elles sont stockées dans de l’eau ultrapure, utilisez les glissières en une semaine.
- Nettoyez l’auge de polytétrafluoroéthylène du système de trempage Langmuir-Blodgett à l’aide d’eau chloroforme et ultrapure jusqu’à ce qu’aucun mouillage ne soit observé sur le creux. Vaporiser du chloroforme sur la surface du creux, essuyer soigneusement avec des lingettes de cellulose 3x. Rincer à l’eau ultrapure et retirer l’eau par aspiration. Répéter 3x.
- Couvrir la surface de l’abreuvoir d’eau ultrapure propre.
- Prenez 2 morceaux de verre de couverture traité en surface à partir d’une solution de nettoyage ou d’eau ultrapure, et rincez la lame de verre avec de l’eau ultrapure pour environ 30 s.
- Placez le verre de couverture d’une manière dos à dos. Utilisez la pince de substrat pour tenir les lames de verre. Plongez la lame de verre sous la surface de l’eau en cliquant manuellement sur « dipper down » sur le logiciel de contrôle Langmuir.
- Zéro l’équilibre du film, épandant soigneusement la solution B goutte par goutte à l’interface air-eau (Figure 2A). Assurez-vous que les lipides ne se propagent qu’à l’interface air-eau, sans chloroforme et les gouttelettes lipidiques qui s’enfoncent au fond de la surface du polytétrafluoroéthylène. Ne pas s’assurer que cela créera un « canal » lipidique et empêchera la formation de monocouches.
- Arrêtez d’ajouter des lipides jusqu’à ce que l’équilibre du film se lisent autour de ~15-20 mN/m, attendez ~10-15 min. Initier le contrôleur de barrière pour modifier la surface en cliquant sur « commencer les expériences », jusqu’à ce que la lecture de l’équilibre du film soit de 37 mN/m. Maintenez la pression pendant ~20-30 min (Figure 2B).
- Soulevez le verre de couverture à la vitesse de 22 mm/min tout en maintenant la tension de surface à 37 mN/m. Une monocouche lipidique avec attache de polymère sera transférée de l’interface air-eau à la surface du verre de couverture par le processus de trempage Blodgett (Figure 2C). Ceci forme la feuille inférieure de la bicouche lipidique.
- Nettoyez l’interface air-eau par aspiration, rincez l’auge avec de l’eau ultrapure.
- Nettoyez une lame de verre à un puits (p. ex., lame Shaefer) à l’aide de chloroforme, d’éthanol et d’eau ultrapure avant utilisation. Placez la lame de verre propre sur le creux avec de l’eau ultrapure sous la couche d’eau. Assurez-vous que le puits est orienté vers l’interface air-eau et versez de l’eau douce ultrapure jusqu’à ce que la glissière de verre soit entièrement recouverte. Répétez l’étape 2.8.
- Tenir le verre de couverture avec la monocouche de lipides de l’étape 2.4 à l’aide d’une ventouse de silicium (assurez-vous que le côté monocouche est loin de la ventouse), poussez doucement la monocouche lipidique à l’interface air-eau, tenez le verre de couverture pendant ~2-3 s à l’interface, puis poussez le verre de couverture contre la glissière (Figure 2D). Sortez la diapositive à l’aide d’une lame de couverture.
REMARQUE : La bicouche lipidique se tiendra à la surface du verre de couverture faisant face à la zone en sandwich entre les deux lames (figure 2E). - Prenez le verre de couverture avec la bilayer à un microscope d’épifluorescence. Image de la bicouche lipidique. Si une distribution homogène de colorant lipidique est observée, photobleach une petite zone de la bicouche pendant 30 s, éteindre la source de lumière pendant ~ 30 s-1 min., puis l’image à nouveau pour observer la récupération. La bicouche lipidique montrera la récupération de fluorescence.
REMARQUE : Les membranes présentant des défauts ou une mauvaise récupération de fluorescence ne doivent pas être utilisées pour d’autres expériences.
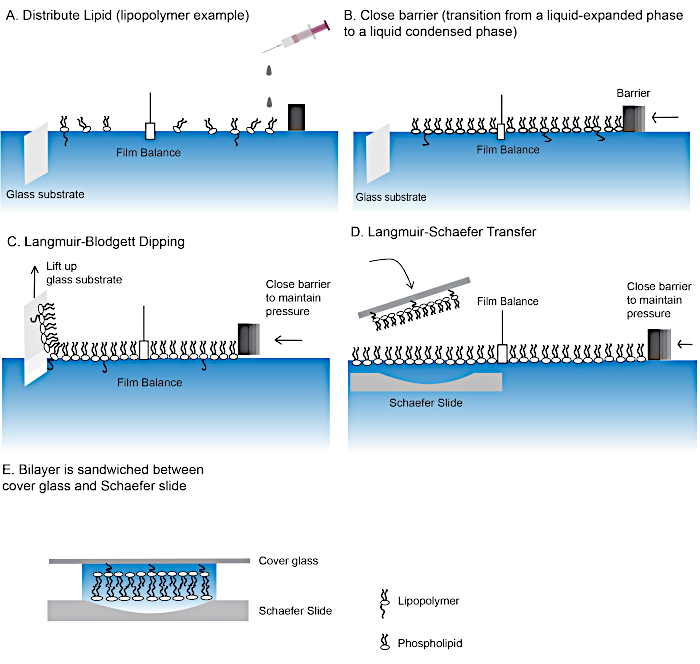
Figure 2 : Étapes dans la fabrication d’une bicouche lipidique liée au polymère.
Étapes de fabrication de bicouches lipidiques à l’aide des techniques de trempage Langmuir-Blodgett (A-C) et langmuir-Schaefer (D). (E) Le « ie » final contenant la bicouche lipidique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
3. Reconstitution de protéines dans la bicouche lipidique attachée au polymère
- Préparer un plat de cristallisation contenant de l’eau ultrapure. Préparer un anneau d’image de microscope propre et placer sous le plat.
- Plongez le « sandwich » de la diapositive Schaefer et couvrez le verre contenant la bicouche lipidique sous l’eau, séparez doucement la glissière de Schaefer et couvrez le verre, tenez la glissière de verre de couverture du fond, loin du côté de la bicouche, transférez le verre de couverture dans l’anneau d’image, fermez l’anneau d’image.
REMARQUE : Assurez-vous que le verre de couverture avec la bicouche lipidique est toujours dans l’eau, et l’anneau est bien scellé. - Remplacez l’eau ultrapure de l’anneau d’image par un tampon Bis-Tris NaCl, assurez-vous que la bicouche lipidique n’est pas exposée à des bulles d’air. Ajouter 1,1 x 10-9 M n-Octyl-β-D-Glucopyranoside à la bicouche lipidique. Ajouter immédiatement le mélange de 1,2 x 10-9 M de DDM et de 1,3 x 10-12 mol purifié l-Opa136 dans l’anneau d’image. Incuber l’échantillon sur un shaker à basse vitesse pendant 2 h (figure 3).
REMARQUE : Les détergents peuvent varier en fonction des protéines à reconstituer. - Distribuer 30 mg de perles de résine SM-2 dans 3 mL de tampon Bis-Tris et secouer avant d’appliquer. Utilisez une pipette en plastique pour ajouter 5~10 μL de perles de résine SM-2 à l’anneau d’image, incuber pendant 10 min, enlever les perles de résine par rinçage. Le volume final de la mémoire tampon dans l’anneau d’image est de 1,5 mL.

Figure 3 : Procédure de reconstitution de l-Opa1 en bicouche lipidique attaché au polymère. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
4. Préparation des protéoliposomes
- Préparer 1 mg de mélange lipidique A dans une solution chloroforme. Évaporer le chloroforme sous le débit d’azote pendant 20 min et garder sous vide pendant la nuit et former un film lipidique.
- Préparer 50 mM de calcéine contenant tampon en dissolvant 15,56 g de calcéine à 50 mL de 1,5 mol de solution NaOH, remuer à température ambiante jusqu’à ce que la calcéine soit complètement dissoute, a ajouté 12,5 mM Bis-Tris et l’eau ultrapure au volume final de 500 mL. Ajuster le pH à 7,5.
- Suspendre le film lipidique dans la calcéine contenant tampon, hydrater complètement le lipide en chauffant la suspension à 65 °C pendant 20 min. 200 nm liposomes sont formés par extrusion à l’aide d’une membrane en polycarbonate.
- Ajouter 2 μg de l-Opa1 dans 0,5 μM DDM à 0,2 mg de liposome et incuber à 4 °C pendant 1,5 h. Retirer le surfactant par dialyse à l’aide d’une cassette de dialyse de 3,5 kDa contre 250 ml de Bis-Tris de 25 mM, 150 mM de NaCl et un tampon de calcéine de 50 mM à 4 °C pendant la nuit, en changeant le tampon deux fois.
- Retirez la calcéine supplémentaire à l’aide d’une colonne de dessaltage PD-10.
5. Imagerie et analyse de données
- Acquérir des images TIRF à l’aide d’un objectif d’immersion 100x d’huile (N.A 1.4). Utilisez un laser de 543 nm et un laser de 488 nm pour l’analyse des liposomes et protéoliposomes étiquetés TexasRed-PE encapsulés de calcéine. Utilisez un laser de 633 nm pour l’analyse de Cy5-PE intégré dans la bicouche lipidique planaire.
- Aligner l’angle TIRF à l’aide d’une bicouche lipidique pour obtenir une émission maximale. La qualité de la bicouche lipidique après reconstitution est observée à l’aide d’un objectif d’huile 100x à 25 °C. Le coefficient de diffusion du bicalier phospholipidique et reconstitué est déterminé à l’aide de FCS avec un protocole décrit ailleurs37.
- Ajouter 10 μL de protéoliposomes de 2 mg/mL à l’anneau d’image et régler pendant 10 minutes avant l’image. GTP, GMPPCP, ou PIB sont ajoutés dans l’anneau de réaction avec 1 mM MgCl2 et 1 mM de nucléotide.
- Pour déterminer l’influence de s-Opa1 dans la fusion membranaire, titrez s-Opa1 dans un échantillon de bilayer protéoliposome/soutenu contenant l-Opa1, et enregistrez des événements de fusion.
- L’imagerie simultanée de TexasRed-DHPE et de calcein est réalisée grâce à un système de fractionnement des faisceaux. Les lasers 488 nm et 543 nm sont simultanément appliqués à l’échantillon comme sources d’excitation flourescentes. La lumière d’émission est ensuite divisée à l’aide d’un séparateur de faisceau de 560 nm. La lumière d’émission fractionnée est alors filtrée par un filtre de 510 nm avec une bande passante de 42 nm et un filtre de 609 nm avec une bande passante de 40 nm. Le faisceau filtré est projeté sur deux zones adjacentes sur la puce de la caméra.
- L’émission fluorescente est enregistrée simultanément à travers un filtre à 609 émissions avec une bande passante de 40 nm, et un filtre à 698 émissions avec une bande passante de 70 nm. Le système de microscope est équipé d’une caméra CMOS maintenue à -10 °C.
- L’identification des particules des liposomes peut être effectuée à l’aide d’un algorithme de reconnaissance des particules gaussien. La distribution et l’intensité des particules sont analysées canal par canal. Un signal de bicouche lipidique est utilisé comme masque pour isoler les particules.
Résultats
La protéine transmembrane reconstituée diffuse librement et est répartie de façon homogène dans la membrane.
Exemple d’images d’une bicouche lipidique et de sa fluidité lipidique validée par microscopie épifluorescence est présentée à la figure 4. La distribution des lipides dans le bicouche avant et après le photobleaching est indiquée à la figure 4A,B. L’homogénéité de la bicouche lipidique a été visualisée à l’aide d’un microscope à épifluorescence avant et après la reconstitution (figure 4D,E). l-Opa1 reconstitué dans la bicouche lipidique a été validé par spectroscopie de corrélation de fluorescence (FCS). Nous utilisons des lipides conjugués colorants pour évaluer la diffusion lipidique de la bicouche. L’Opa1 reconstitué a été étiqueté à l’aide d’un anticorps anti-Opa1 C-terminal marqué par fluorescent. La diffusion des lipides bicalayers a été mesurée en 1,46 ± 0,12 μm2/s,tandis que le coefficient de diffusion du l-Opa1 reconstitué par la bicouche était de 0,88 ± 0,10 μm2/s. La lecture d’intensité des courbes de FCS indique que 75 % de l-Opa1 est reconstitué dans la bicouche lipidique (figure 4G,H). Ces résultats suggèrent que l-Opa1 diffuse librement dans la bicouche lipidique liée au polymère avec le potentiel de s’auto-assembler dans les complexes fonctionnels.
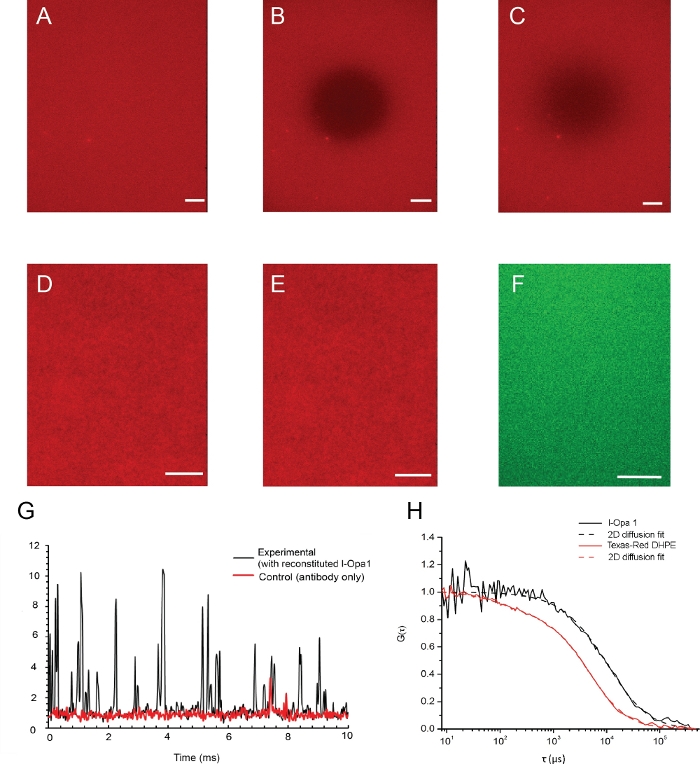
Figure 4 : Distribution des lipides et des protéines reconstituées dans la membrane du modèle.
(A-C) Exemple d’images d’une bicouche lipidique et de sa fluidité lipidique validée par microscopie par épifluorescence. (A) Distribution homogène de lipides dans le bicouche avant le photobleaching. (B) Instantané immédiatement après le photobleaching. (C) Bilayer photographié après la récupération de fluorescence indique une bonne fluidité lipidique de la membrane après la reconstitution. (D,E) Les images représentatives de la distribution des lipides avant (D) et après (E) l-Opa1 reconstitution indiquent que le processus de reconstitution n’a pas créé de défauts dans la bicouche. Image représentative tirf de l-Opa1 étiquetée avec l’anticorps conjugué Alexa 488 (F) montrant une distribution homogène d’Opa1 lors de la reconstitution. G. Compte de photons bruts représentatifs du signal l-Opa1 par spectroscopie fluorescente de corrélation. Dans le contrôle, aucun l-Opa1 n’a été reconstitué dans la bicouche, tandis que l’anticorps a été ajouté et rincé. La diffusion de l-Opa1 est significativement plus lente que les lipides dans la membrane, compatible avec la reconstitution réussie de la transmembrane l-Opa1 (H). Barre d’échelle : 10 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Le blanchiment d’étape de fluorescence a indiqué qu’une moyenne de 2 à 3 copies de l-Opa1 ont été reconstituées dans un liposome donné (figure 5A,B). La distribution de taille des protéoliposomes reconstitués Opa1 a été testée après reconstitution à l’aide de DLS (Figure 5C). La reconstitution d’Opa1 dans les protéoliposomes a également été vérifiée à l’aide de FCS. Le coefficient de diffusion des anticorps libres était de 164 ± 22 μm2/s; le coefficient de diffusion des liposomes étiquetés avec un colorant lipidique était de 2,22 ± 0,33 μm2/s,et le coefficient de diffusion des protéoliposomes l-Opa1 liés à un anticorps anti-his étiqueté TexasRed était de 2,12 ± 0,36 μm2/s.
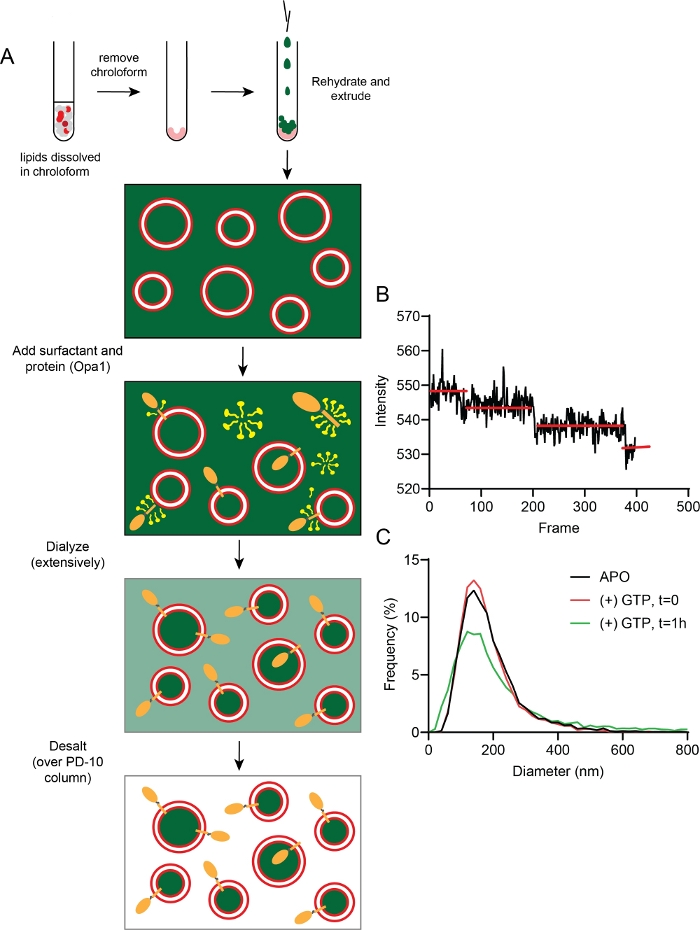
Figure 5 : Fabrication et caractérisation des protéoliposomes.
(A) Étapes dans la fabrication de protéoliposomes avec la calcéine encapsulée et éteinte. (B) Les données représentatives du blanchiment d’étape fluorescente montrent une moyenne de 2-3 copies de l-Opa1 incorporées dans le liposome. (C) Distributions de taille représentatives des protéoliposomes (rouge) sans aucun nucléotide 1 h après incubation de GTP (vert). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Détection de l’attachement de membrane, de mélange/hémifusion de lipides, et ouverture de pore par microscopie fluorescente.
L’attachement à la membrane est surveillé en observant le signal de TexasRed à la surface de la bicouche lipidique à l’aide de la microscopie TIRF (Figure 6A). Le comportement de mélange des lipides membranaires (hémifusion) a été surveillé par TexasRed pendant que le colorant diffuse des liposomes dans la bicouche lipidique. Le déquenchage de calcéine aide à distinguer la formation complète de pores de fusion du démélangage des lipides seulement. Cela permet de comparer les conditions où les particules calent à l’hémifusion (fig 6B), et les particules qui procèdent à la fusion complète (Figure 6C).
L’attachement de membrane est indiqué par un signal lipidique stable des liposomes. La distance pourrait être évaluée en fonction du signal FRET entre les étiquettes des deux membranes36. Le signal hémifusion ne comporte aucun déquenchage dans le signal de calcéine(figure 6B, rangée inférieure), mais une décomposition rapide du signal TexasRed indique la diffusion du colorant dans la bicouche lipidique(figure 6B rangée supérieure). La fusion complète (avec ouverture des pores) comporte à la fois la décomposition des lipides et la libération de contenu (figure 6C). TexasRed intensité et l’intensité de la calcéine peut être suivi d’une manière dépendante du temps pour fournir des détails quantitatifs pour la cinétique de la fusion membranaire36.
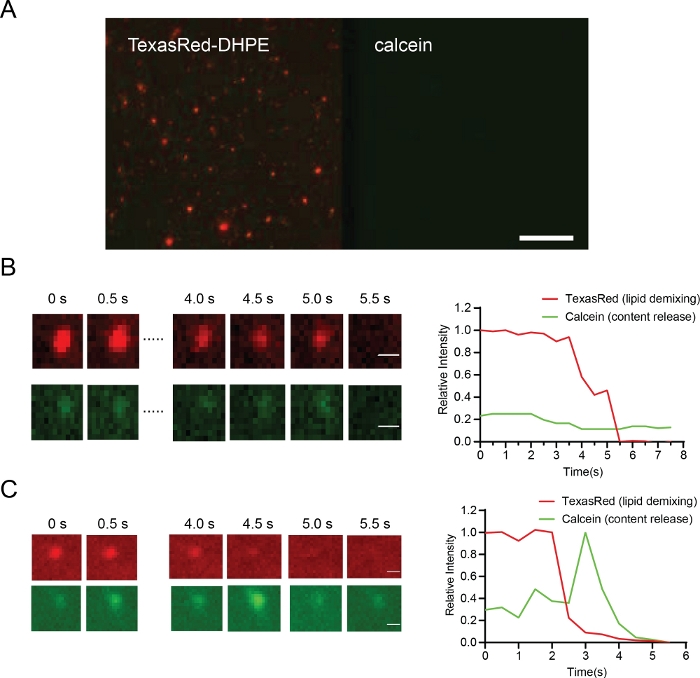
Figure 6 : Résultats représentatifs montrant l’attache des particules (A, barre d’échelle 10 μm), l’hémifusion (B, barre d’échelle 0,5 μm) et la fusion (C, barre d’échelle 0,5 μm).
(A) Protéoliposomes attachés à la bicouche lipidique reconstituée par Opa1 avant l’addition de GTP. (B) Un exemple d’hémifusion. La ligne supérieure en B montre le mélange lipidique (signal TexasRed, rouge), la ligne inférieure en B ne montre aucune libération de contenu (signal de calcéine, vert) dans ces conditions. (C) Une trace représentative de la fusion protéoliposome avec la bicouche lipidique. La libération de contenu peut être observée à partir d’images dans la rangée inférieure montrant le déquenchage de calcéine (rangée inférieure, vert). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Les systèmes in vitro de membrane modèle peuvent décrire des processus de membrane complexes dans des conditions bien définies. Ces systèmes peuvent distinguer les composants minimaux nécessaires à des processus moléculaires complexes pour révéler les mécanismes moléculaires6,15,20,38. Pour les protéines membranaires, les liposomes et les bilayers supportés par planar sont des systèmes de reconstitution courants. Contrairement aux bicouches lipidiques soutenues solidement, le coussin polymère entre le substrat et la membrane soutenue dans les bicouches à attaches polymères permet une libre mobilité des grandes protéines membranaires, et les protéines transmembranantes de diffuser et d’assembler librement34. Ces caractéristiques nous ont aidés à étudier la cinétique des mitochondries fusion de membrane interne36.
Nous avons préparé un bicouche lipidique attaché au polymère à l’aide des techniques Langmuir-Blodgett/Langmuir-Schaefer (LB/LS). Cela nous permet de préparer une bicouche avec des composants lipidiques asymétriques. Les membranes cellulaires ont une composition de feuillet asymétrique, et l’approche LB/LS permet l’étude de ces bicouches. Avec le transfert schaefer, un substrat en verre entier peut être recouvert d’une bicouche lipidique. Il est essentiel de préparer une surface propre pour la préparation des bicouches. En outre, il faut de la pratique pour effectuer un transfert Schaefer correctement. Le transfert infructueux de Schaefer peut créer des défauts indésirables dans une bicouche lipidique. Dans ce protocole, la pression ajoutée à l’équilibre du film s’applique à une bicouche contenant 20% de cardiolipine. Pour les bicouches avec d’autres composants, reportez-vous à l’isotherme de la surface de la zone de pression des composants clés. Une méthode alternative est la méthode Langmuir-Blodgett/vesicle fusion (LB/VF), où la monocouche lipidique inférieure est transférée de l’interface air-eau d’un creux Langmuir sur un substrat propre, puis les liposomes fusionnent vers le haut de la monocouche lipidique soutenue et forment le bilayer final39. La reconstitution des protéines membranaires à l’aide de la méthode LB/VF est plus simple que la LB/LS, car la reconstitution peut être effectuée par la fusion des protéoliposomes. Cependant, la fusion des vésicules nécessite l’ajout de liposomes excédentaires, ce qui peut compliquer l’étude des événements membranaires dépendants des interactions protéine-protéine dépendantes de la concentration.
La reconstitution réussie des protéines transmembrane dans les bicouches lipidiques et les liposomes liés au polymère dans une orientation fonctionnelle préférée est importante, mais difficile à appliquer. Des contrôles expérimentaux sont nécessaires pour en tenir compte. Pour les bicouches lipidiques attachées au polymère, il est également important de maintenir l’intégrité de la bicouche lipidique lors de la reconstitution. Les concentrations de surfactants doivent être maintenues relativement faibles pour empêcher la dissolution de la bicouche lipidique, mais suffisamment élevées pour empêcher la dénaturation de la protéine d’intérêt37,40. La méthode décrite ici est idéale pour reconstituer les protéines membranaires pour les études à molécule unique, mais n’est pas nécessairement évolutive pour des études à plus grande échelle. Le choix de Surfactant est une autre considération importante. Fréquemment, le surfactant utilisé pour la purification et le stockage est un bon point de départ. La concentration maximale de surfactant est généralement ~200 fois moins du CMC36, dans une gamme où le surfactant maintient la stabilité des protéines et empêche l’agrégation des protéines, tout en maintenant l’intégrité de la membrane36. Des cocktails contenant 2 ou 3 agents de surf peuvent être considérés. Pour la reconstitution en liposomes, une faible concentration de surfactant n’est pas nécessaire. Cependant, les concentrations de surfactants en dessous de CMC sont préférables pour maintenir la taille uniforme et la distribution de morphologie pour les liposomes. Pour éviter les fuites de colorant de contenu, il est nécessaire de dialer contre un tampon contenant des colorants.
Contrairement aux tests de fusion à base de liposome, la plate-forme que nous avons établie fournit une approche pour étudier la cinétique de chaque étape de la fusion membranaire. Cette méthode permet d’étudier les protéines de fusion transmembranaires dans des conditions quasi indigènes. Les plates-formes membranaires modèles peuvent être appliquées pour étudier l’assemblage et l’oligomérisation des protéines membranaires, la « sculpture » membranaire et les interactions protéines-lipides des protéines dans les environnements subcellulaires, comme la membrane interne mitochondriale. Cette méthode permet également d’explorer d’importantes conditions physiologiques dans l’interaction membrane-protéine, telles que l’asymétrie de composition bilayer. Le rôle d’un lipide mitochondrial clé, la cardiolipine, dans les propriétés de bilayer des liposomes et des bicouches soutenues par polymère reste à définir. Des propriétés telles que la résistance ionique, l’épaisseur de la membrane, la rigidité de la membrane, la courbure de la membrane et les propriétés de viscosité de l’élasticité de la membrane peuvent toutes influencer la capacité des protéines à se réunir en états fonctionnels spécifiques. Les études futures appliquant de façon créative les systèmes de membrane de modèle ont le potentiel de découvrir de nouveaux aspects de l’organisation et de la fonction de protéine de membrane.
Déclarations de divulgation
Aucun.
Remerciements
Les auteurs reconnaissent le soutien du Prix de recherche en santé infantile de la Fondation Charles H. Hood et le généreux soutien du Département de biologie moléculaire du Massachusetts General Hospital.
matériels
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(Cyanine 5) | Avanti polar lipid | Cat #: 810335C1mg | membrane fluorescent markers |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar lipids | Cat #: 880130P | lipid molecules |
| 1',3'-bis[1,2-dioleoyl-sn-glycero-3-phospho]-glycerol (sodium salt) | Avanti Polar lipids | Cat #: 710335P | lipid molecules |
| 18:1 (Δ9-Cis) PC (DOPC) | Avanti Polar lipids | Cat #: 850375P | lipid molecules |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar lipids | Cat #: 850757P | lipid molecules |
| Alexa Fluor 488 Antibody Labeling Kit | ThermoFisher Scientific | A20181 | |
| Amber vial with PTFE liner | Fisher scientific | 14-955-332 | sample vials to keep lipid solutions |
| Calcein | Sigma-Aldrich | Cat #: C0875; PubChem Substance ID: 24892279 | fluorescent dye |
| Chloroform | Fisher scientific | 298-500/ C295-4 | Fisher brand Chloroform is usually quite reliable for lipid works. |
| Concavity slide (1 well) | Electron Microscopy Science | 71878-05 | applied as Schaefer Slide |
| FCS analysis tool | Smith Lab, University of Akron | software tool | |
| Fiji /ImageJ | Fiji | SCR_002285 | software tool |
| Fisherbrand Cover Glasses: Circles | Fisher scientific | 12-545-102 | Cover glass for solid supported lipid bilayers, the item is now discontinued as authors prepared the manuscript. An alternative is Fisher brand premium cover glass with catalog number: 12-548-5M |
| GTP Disodium salt | SIGMA-ALDRICH INC | Cat #: 10106399001 | |
| Langmuir & Langmuir-Blodgett Trough | Biolin Scientifc | KN2002 | |
| L-α-lysophosphatidylinositol (Liver, Bovine) (sodium salt) | Avanti Polar lipids | Cat #: 850091P | lipid molecules |
| Mini Extruder | Avanti Polar lipids | 610020 | |
| n-Dodecyl-β-D-Maltopyranoside | Anatrace | Cat #: D310 25 GM | surfactant for reconstitution |
| n-Octyl-α-D-Glucopyranoside | Anatrace | Cat #: O311HA 25 GM | surfactant for reconstitution |
| PC Membranes 0.2μm | Avanti Polar Lipids | 610006 | |
| Rabbit Anti-Opa1 antibody | NOVUS BIOLOGICALS | Cat #: NBP2-59770 | antibody for Opa1 C-terminal detection |
| Slidebook | Intelligent imaging | RRID: SCR_014300 | software tool |
| Teflon threaded seal tape | Fisher Scientific | NC0636085 | taflon tape for sample storage |
| Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt (Texas Red DHPE) | ThermoFisher Scientific | Cat #: T1395MP | membrane fluorescent markers |
Références
- Sackmann, E., Lipowsky, R., Sackmann, E. Biological membranes architecture and function. Structure and Dynamics of Membranes. 1, 1-63 (1995).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118, 1099-1102 (2005).
- Schink, K. O., Tan, K. W., Stenmark, H. Phosphoinositides in Control of Membrane Dynamics. Annual Review of Cell and Developmental Biology. 32, 143-171 (2016).
- Gu, R. X., Ingolfsson, H. I., de Vries, A. H., Marrink, S. J., Tieleman, D. P. Ganglioside-Lipid and Ganglioside-Protein Interactions Revealed by Coarse-Grained and Atomistic Molecular Dynamics Simulations. Journal of Physical Chemistry B. 121 (15), 3262-3275 (2017).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Chan, Y. H., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Biswas, K. H., Groves, J. T. Hybrid Live Cell-Supported Membrane Interfaces for Signaling Studies. Annual Reviews in Biophysics. 48, 537-562 (2019).
- Pick, H., Alves, A. C., Vogel, H. Single-Vesicle Assays Using Liposomes and Cell-Derived Vesicles: From Modeling Complex Membrane Processes to Synthetic Biology and Biomedical Applications. Chemical Reviews. 118 (18), 8598-8654 (2018).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophysical Journal. 99 (12), 4047-4055 (2010).
- Kiessling, V., et al. Rapid fusion of synaptic vesicles with reconstituted target SNARE membranes. Biophysical Journal. 104 (9), 1950-1958 (2013).
- Yang, S. T., Kiessling, V., Tamm, L. K. Line tension at lipid phase boundaries as driving force for HIV fusion peptide-mediated fusion. Nature Communication. 7, 11401 (2016).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophysical Journal. 101 (8), 37 (2011).
- Chao, L. H., Klein, D. E., Schmidt, A. G., Pena, J. M., Harrison, S. C. Sequential conformational rearrangements in flavivirus membrane fusion. Elife. 3, 04389 (2014).
- Floyd, D. L., Harrison, S. C., van Oijen, A. M. Analysis of kinetic intermediates in single-particle dwell-time distributions. Biophysical Journal. 99 (2), 360-366 (2010).
- Sezgin, E., Schwille, P. Model membrane platforms to study protein-membrane interactions. Molecular Membrane Biology. 29 (5), 144-154 (2012).
- Ge, Y., Gao, J., Jordan, R., Naumann, C. A. Changes in Cholesterol Level Alter Integrin Sequestration in Raft-Mimicking Lipid Mixtures. Biophysical Journal. 114 (1), 158-167 (2018).
- Dutta, D., Kam, L. C. Micropatterned, multicomponent supported lipid bilayers for cellular systems. Methods in Cell Biology. 120, 53-67 (2014).
- Groves, J., Ferrari, M., Desai, T., Bhatia, S. Supported Lipid Bilayers as Mimics for Cell Surfaces and as Tools in Biotechnology. BioMEMS and Biomedical Nanotechnology. , (2006).
- Shoaib, T., Nalam, P. C., He, Y., Chen, Y., Espinosa-Marzal, R. M. Assembly, Morphology, Diffusivity, and Indentation of Hydrogel-Supported Lipid Bilayers. Langmuir. 33 (28), 7105-7117 (2017).
- Wang, N., Rapoport, T. A. Reconstituting the reticular ER network - mechanistic implications and open questions. Journal of Cell Science. 132 (4), 227611 (2019).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Chan, D. C. Fusion and fission: interlinked processes critical for mitochondrial health. Annual Reviews of Genetics. 46, 265-287 (2012).
- Nunnari, J., Suomalainen, A. Mitochondria: in sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wai, T., Langer, T. Mitochondrial Dynamics and Metabolic Regulation. Trends in Endocrinology Metabolism. 27 (2), 105-117 (2016).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nature Reviews Molecular Cell Biology. 11 (12), 872-884 (2010).
- Chen, H., et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development. Journal of Cell Biology. 160 (2), 189-200 (2003).
- Ishihara, N., Fujita, Y., Oka, T., Mihara, K. Regulation of mitochondrial morphology through proteolytic cleavage of OPA1. EMBO Journal. 25 (13), 2966-2977 (2006).
- Anand, R., et al. The i-AAA protease YME1L and OMA1 cleave OPA1 to balance mitochondrial fusion and fission. Journal of Cell Biology. 204 (6), 919-929 (2014).
- Mishra, P., Carelli, V., Manfredi, G., Chan, D. C. Proteolytic cleavage of Opa1 stimulates mitochondrial inner membrane fusion and couples fusion to oxidative phosphorylation. Cell Metabolism. 19 (4), 630-641 (2014).
- Baker, M. J., et al. Stress-induced OMA1 activation and autocatalytic turnover regulate OPA1-dependent mitochondrial dynamics. EMBO Journal. 33 (6), 578-593 (2014).
- DeVay, R. M., et al. Coassembly of Mgm1 isoforms requires cardiolipin and mediates mitochondrial inner membrane fusion. Journal of Cell Biology. 186 (6), 793-803 (2009).
- Rainbolt, T. K., Lebeau, J., Puchades, C., Wiseman, R. L. Reciprocal Degradation of YME1L and OMA1 Adapts Mitochondrial Proteolytic Activity during Stress. Cell Reports. 14 (9), 2041-2049 (2016).
- Ban, T., et al. Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin. Nature Cell Biology. 19 (7), 856-863 (2017).
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Shilts, K., Naumann, C. A. Tunable cell-surface mimetics as engineered cell substrates. Biochimica Biophysica Acta Biomembrane. 1860 (10), 2076-2093 (2018).
- Ge, Y., et al. Two forms of Opa1 cooperate to complete fusion of the mitochondrial inner-membrane. Elife. 9, 50973 (2020).
- Ge, Y., Siegel, A. P., Jordan, R., Naumann, C. A. Ligand binding alters dimerization and sequestering of urokinase receptors in raft-mimicking lipid mixtures. Biophysical Journal. 107 (9), 2101-2111 (2014).
- Simons, K., Vaz, W. L. Model systems, lipid rafts, and cell membranes. Annual Review of Biophysics and Biomolecular Structure. 33, 269-295 (2004).
- Kiessling, V., Liang, B., Tamm, L. K. Reconstituting SNARE-mediated membrane fusion at the single liposome level. Methods in Cell Biology. 128, 339-363 (2015).
- Siegel, A. P., Kimble-Hill, A., Garg, S., Jordan, R., Naumann, C. A. Native ligands change integrin sequestering but not oligomerization in raft-mimicking lipid mixtures. Biophysics Journal. 101 (7), 1642-1650 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon