Method Article
磁性ナノ材料の生体機能化
要約
この研究では、特定の細胞を標的とする抗体を用いて磁性ナノ材料を生体機能化するためのプロトコルを提供します。その一例として、鉄ナノワイヤを用いてがん細胞を標的としています。
要約
磁性ナノ材料は、さまざまな生物医学的用途で大きな注目を集めています。これらのナノマテリアルを特定の標的薬で生体官能基化することは、副作用を最小限に抑えながら診断や治療における有効性を高めるための重要な側面です。非磁性材料と比較した磁性ナノ材料の利点は、非接触で長距離にわたって磁場に応答する能力です。これにより、それらをガイドまたは蓄積することができますが、監視することもできます。近年、バイオメディカル応用のためのユニークな特徴を持つ磁性ナノワイヤ(NW)が開発されています。これらのNWの大きな磁気モーメントは、磁場による動きのより効率的な遠隔制御を可能にします。これは、がん治療、薬物送達、細胞追跡、幹細胞分化、磁気共鳴画像法などで大きな成功を収めています。さらに、テンプレート支援電気化学堆積によるNW製造は、NW特性を厳密に制御する汎用性の高い方法を提供します。特に鉄NWと酸化鉄-鉄(コアシェル)NWは、磁化率が高く毒性が低いため、生物医学的用途に適しています。
本研究では、多数のがん細胞で過剰発現している特定の細胞表面マーカーに対する特異的抗体を用いて、鉄/酸化鉄NWを生体機能化する方法を提供します。酸化鉄表面の性質を利用するため、超常磁性酸化鉄ナノ粒子にも応用できます。NWはまず、リンカーとして作用する3-アミノプロピル-トリ-エトキシ-シラン(APTES)でコーティングされ、抗体はこれに共有結合します。APTESコーティングと抗体の生体機能化は、電子エネルギー損失分光法(EELS)とゼータ電位測定によって証明されています。さらに、NW上の抗体の抗原性は、免疫沈降とウェスタンブロットを使用してテストされます。生体官能基化NWの特異的標的化とその生体適合性は、共焦点顕微鏡と細胞生存率アッセイによって研究されています。
概要
磁性ナノ材料のユニークな特性は、磁場1に応答する能力であり、これは多くの方法でそれらを作動させるために有益に利用することができるが、例えば、磁気共鳴画像法(MRI)によって監視することも可能である。交流磁界を高周波で印加すると、熱を発生し、高体温症を誘発し、治療の選択肢となります1。別のアプローチは、近赤外線(NIR)レーザーで実現できる光熱処理です2,3。
多数の磁性ナノ材料の中で、酸化鉄は、磁気分離、温熱療法2,4、細胞誘導5、薬物送達6,7,8、MRIの造影剤9,10などの生物学的応用において最も注目されています。これは、それらの高い生体適合性11,12、大きな磁化11,12、コーティングされる能力9,13,14,15、薬物を運ぶ能力2,16、薬物で官能基化される能力2,16および標的化剤12,13,17によるものである、18、および光エネルギーを熱に変換する能力2。最近、MagForceは、ハイパーサーミア治療に酸化鉄ナノ粒子を使用する癌患者の臨床試験を開始しました19。
最近、磁性ナノワイヤ(NW)は、生物医学的用途にますます利用されています3,11,16,20,21,22。それらは磁性ナノビーズと同様の特性を有するが、異方性形状と非常に大きな磁気モーメントを提供し、磁気力学的効果を誘発する低周波作動を含む磁場23,24による非常に効率的な遠隔制御を可能にする25,26,27,28,29.その結果、NWは、エクソソーム単離30、細胞追跡21、癌治療3、11、16、薬物送達16、31、32、およびMRI造影剤33などの異なる生物学的用途のために実施されている。
特定の細胞標的化能力を持つ生体機能化磁性ナノ材料は、生物医学的応用や精密医療に大きな可能性を秘めています34,35。これらの標的剤を付着させるには、ナノ材料の表面改質が必要です。典型的には、それらは、処理剤の付着を容易にする官能基を提供するコーティングを必要とする。文献には、磁性ナノ材料用の有機および無機コーティングが多数あります。ナノ材料に固定化できる官能基に基づいて、これらのコーティングは、カルボン酸基に基づく分子、ポリマー、ヒスチジン、およびシラン基に基づく分子の4つの主要なグループに分類できます。
カルボン酸基に基づく分子は、表面改質法の1つです。それは高い類縁を利用します
コーティング上の負のカルボン酸基と磁性ナノ材料上の正電荷との間36,37,38。カルボン酸の金属表面への結合プロセスは、金属カルボン酸塩の生成またはカルボキシル基の金属への付着を伴い得る。しかし、鉄/金やニッケル/金のNWなど、バイオ用途に優れた特性を持つマルチセグメントNWの場合39,40、このタイプのコーティングは簡単には適用できません。金セグメントを修飾するためのチオール基と、磁気セグメント(鉄またはニッケル)用のカルボキシル基の2つの異なるコーティングを同時に必要とします38。カルボキシル基に基づく分子の例としては、ヘマトポルフィリン、ピメリン酸、パルミチン酸、および3-[(2-アミノエチル)ジチオ]プロピオン酸(AEDP)がある38。ポリマーを用いた磁性ナノ材料の表面改質には、いくつかの明確な利点があります。ポリマーの分子量が大きいため、溶液38中の磁性ナノ材料の安定性を高める。但し、ナノ材料38のサイズを著しく大きくすることになる。ポリビニルピロリドン(PVP)、ポリエチレンイミン(PEI)、アルギニン-グリシン-Dアスパラギン酸(RGD)、およびポリエチレングリコール(PEG)は、表面改質に最も一般的に使用されるポリマーの例です。それぞれに独自の機能があり、38を使用します。第3の表面改質方法は、ヒスチジンコーティングを用いることである。ヒスチジンは、ヒスチジンアミノ酸側鎖を持つタンパク質であり、ニッケル38などの限られた数の磁性ナノ材料に対して高い親和性を持っています。それは蛋白質の浄化プロセス38,41,42に使用することができる。ヒスチジンコーティングは、ニッケル/金NW38などのマルチセグメントNWにも適用できます。ナノ材料表面のシラン化は、十分に確立されたプロセスである38,43,44。これは、3つの単結合を介して任意の金属酸化物表面に結合したケイ素原子に基づいており、同時にこのケイ素原子はアルキル鎖を介して末端の官能基に結合しています38,43,44。このコーティングの利点は遊離アミン基を提供することであり、ニッケルや金などの磁性材料と非磁性材料の両方をそれぞれコーティングする能力があります38,45。したがって、生理食塩水基に基づく分子を使用することは、多節化されたNWを生体機能化するための実用的なルートです。シラン基に基づく分子の例としては、(3-アミノプロピル)トリエトキシシラン(APTES)および(3-アミノプロピル)トリメトキシシラン(APTMS)がある38,45。
コーティングへのターゲティング剤の添加は、罹患細胞の診断および治療の両方において重要な役割を果たすことができ、同時に、健康な組織に対する副作用を最小限にすることができる46,47。ナノ材料の表面に標的化剤を添加すると、エンドサイトーシス受容体を介した細胞の選択的結合と内在化の両方が促進されます7。これらの標的化リガンドがなければ、ナノ材料は細胞膜と非特異的に相互作用し、細胞膜はリガンドを有するナノ材料と比較してより低い速度で結合する48。がん組織を標的とする際の課題の1つは、健康な組織との類似性です。したがって、ターゲティングの成功は、主に生物学的標的として使用する適切なリガンドを決定することに依存する49,50。ナノ材料を癌細胞に誘導するために様々な標的化剤が用いられている48,51(例えば、CD44は、健康な細胞と比較して癌細胞で高い発現を示すためである52,53,54,55)。
ターゲティング剤は、その構成要素とその複雑さに基づいて、アプタマーベースのターゲティング、リガンドベースのターゲティング、抗体ベースのターゲティングの3つの主要なグループに分類できます。アプタマーは、化学的に合成されたDNAまたはRNAオリゴヌクレオチドの短い鎖で、2次元および3次元構造に折りたたまれており、特定の抗原、ほとんどの場合タンパク質を標的とすることができます56。リガンドベースのターゲティングには、ペプチドおよび短いアミノ酸鎖が含まれる57。抗体ベースのターゲティングは、抗体全体、または抗体フラグメント、例えば一本鎖可変フラグメントまたは抗原結合フラグメント51の使用を含む。この方法を用いることは、その特異的標的抗原に対して高い結合親和性を有する2つの結合部位を有するという利点を有し、これにより極めて高い選択性が得られる58。結合部位はロックに類似し、抗原はキー58に類似している。
この作業において、使用されたNWは、以前の出版物59に詳細に記載された方法である酸化アルミニウム膜上に電着することによって製造された。ここでの焦点は、これらの酸化鉄(コアシェル)NWを膜から放出し、特異的抗体で生体機能化して標的化能力を提供することです。抗体は酸化鉄-鉄NWに直接結合できず、リンカーを必要とします。NWをAPTESでコーティングすると遊離アミン基が得られ、抗体のカルボキシル基を介した共有結合が可能になります(図1)。APTESコーティングの利点は、鉄/金またはニッケル/金NWs 45などの磁性21と非磁性60の両方の材料で機能する能力です。このプロトコルで説明されているすべてのコーティングおよび生体機能化ステップは、一般に、あらゆる酸化鉄/酸化鉄ナノ材料で利用できます。ここでは、例として鉄/酸化鉄NWを使用しました。その結果、抗体官能基化NWは特定の細胞表面受容体に対して高い抗原性を有しており、さまざまな用途に使用できることが示されました。例としては、細胞分離、薬物送達、光熱および/または磁気機械処理を使用した特異的がん細胞治療が含まれます。
プロトコル
注意: 使用する前に、関連するすべての製品安全データシート(MSDS)を必ず参照してください。すべての適切な安全対策と個人用保護具(安全メガネ、手袋、白衣、フルレングスのズボン、つま先の閉じた靴)を使用してください。生物学的ヒュームフードですべての生物学的反応を実行します。
注:このプロトコルは、3 x 104抗体/NWの密度で抗CD44抗体でコーティングされた0.36 mgの鉄/ mLに相当する2 x 1010生体機能化NW / mLを生成することを目的としています。酸化鉄-鉄(コアシェル)NWは長さ2.5μm、直径41.5nmである。
1. 鉄ナノワイヤの放出
注:鉄/酸化鉄NWの製造プロセスは、以前の出版物59で詳細に説明されている。
- カッティングマットの上で、アルミニウム(Al)ディスク(図2A)を片刃と小さなハンマーを使用して細かく切断し(図2B)、2 mLチューブに収めます。ピンセットを使用して、小さなAl片をチューブに移します。
- Alの小片が入った2 mLチューブに、1 mLの1 M水酸化ナトリウム(NaOH)を充填します。すべてのAl片がNaOHで覆われていることを確認してください。
- 溶液を化学ヒュームフード内で室温で30分間作動させたままにします。
- ピンセットを使用してAl片のみを取り除き、放出されたNW(黒いクラスター、 図3A)をNaOH溶液にさらに30分間保持します。NaOH溶液は変更しないでください。
- 2 mL チューブを磁気ラックに入れて NW を回収し、2 分間待ってから古い 1 M NaOH 溶液を取り出します。新鮮なNaOH溶液と交換してください。
- NW を含む 2 mL チューブを 30 秒間超音波処理し、化学ヒュームフード内に 1 時間放置します。
- 手順1.5〜1.6を少なくとも4回繰り返します。
- 2 mLチューブを磁気ラックに入れてNWを洗浄し、2分間待ちます。
- NaOH溶液を廃棄し、1 mLの無水エタノールと交換します。
- チューブを30秒間超音波処理します。
- 2 mL チューブを磁気ラックに入れ、2 分間待ちます。
- 古い無水エタノール溶液を廃棄し、1 mLの新鮮な無水エタノールと交換し、30秒間超音波処理します。
- 手順 1.11 と 1.12 を少なくとも 4 回繰り返します。
- NWは、必要になるまで室温で1 mLの無水エタノールに浸けておきます。
- 誘導結合プラズマ質量分析(ICP-MS)を使用して、鉄の濃度、ひいてはNWの濃度を測定します。
注: プロトコルはここで一時停止できます。ただし、長期間保存する場合は、必要になるまで Al テンプレートから NW を解放しないでください。放出されたNWを頻繁な超音波処理なしでエタノール中に長時間沈殿させ続けると、分離するためにより長い時間の超音波処理を必要とする凝集体が作成されます。
2. ナノワイヤをAPTESでコーティング
注:このプロトコルでは、100 μLのAPTES溶液(密度0.946 g / mL61)は、1.6 x 107 m2 / gのNWをコーティングするのに十分です。ナノマテリアルの比率や質量に変化がある場合は、それに応じてAPTESの体積を調整する必要があります。
- ステップ 1.14 の NW を 1 mL のピペットを使用して 5 mL のガラス管に移します。
- 2 mL チューブに残った NW を回収するには、1 mL の無水エタノールを加えて空の 2 mL チューブを 2 回洗浄し、1 mL ピペットを使用して 5 mL のガラスチューブに移します。
- ピペットを使用して、100 μLのAPTESを採取し、NW溶液に直接添加します。
- 5 mL ガラス管を 10 秒間ボルテックスします。
- 5 mLのガラス管を実験室用レトルトスタンドのクランプで調整します。
- 5 mLのガラス管の半分を超音波浴の水の中に入れ、1時間超音波処理します。
- 超音波浴から5 mLのガラス管を取り出し、400 μLの脱イオン(DI)水と20 μLの1 M NaOH(塩基性触媒)を加えます。
注意: 最初に脱イオン水を追加することが重要です。 - ステップ2.5〜2.6で説明したように5 mLのガラス管を調整し、さらに1時間超音波処理します。
- 超音波浴から5mLのガラス管を取り出します。
- ガラス管の横に磁石を5分間置き、NWを収集します。
- 上清を1 mLの新鮮な無水エタノールと交換し、10秒間超音波処理します。
- 手順2.10〜2.11を4回繰り返します。
- 1 mLピペットを使用して、すべてのNW懸濁エタノールを新しい5 mLガラスチューブに移します。
注:APTESコーティングされたNWは、必要になるまでエタノールでガラス管に保管できます。プロトコルはここで一時停止できます。
3. ナノワイヤの生体機能化
- 抗体の活性化
注:約 3 x 104 部の抗体/NW を達成するには、鉄 0.1 mg あたり 30 μL の抗体(1 mg/mL)を使用します。- 2 mL チューブに、0.4 mg の 3-3-ジメチル-アミノプロピルカルボジイミド(EDC)と 1.1 mg のスルホ-N-ヒドロキシスルホスクシンイミド(スルホ-NHS)を 1 mL の 2-N-モルホリノエタンスルホン酸水和物(MES)(pH 4.7)に溶解します。
注意: EDC / sulfo-NHS混合物は、使用前に新鮮で準備する必要があります。 - 新しい 2 mL チューブに、抗 CD44 抗体 (1 mg/mL) 30 μL、リン酸緩衝生理食塩水 (PBS、pH 7) 960 μL、EDC/スルホ-NHS 混合物 10 μL (ステップ 3.1.1 で調製) をそれぞれ加えます。
- 2 mLのチューブを10 x g のチューブシェーカーに入れ、室温で15分間加熱します。
- 2 mL チューブに、0.4 mg の 3-3-ジメチル-アミノプロピルカルボジイミド(EDC)と 1.1 mg のスルホ-N-ヒドロキシスルホスクシンイミド(スルホ-NHS)を 1 mL の 2-N-モルホリノエタンスルホン酸水和物(MES)(pH 4.7)に溶解します。
- APTES被覆ナノワイヤの作製
- ステップ3.1.3の15分間のインキュベーション中に、APTESでコーティングされたNWチューブ(ステップ2.13から)の隣に磁石を置き、NWを2分間洗浄し、NWを回収します。
- エタノールを廃棄し、1 mL の 0.1 M PBS(pH 7)と交換し、10 秒間超音波処理します。
- 手順3.2.1〜3.2.2を4回繰り返します。
- ステップ 3.2.1 の説明に従って NW を収集し、0.1 M PBS を廃棄します。溶液なしでNWをチューブに保管してください。
- 抗体の結合
- すべての活性化抗体溶液(ステップ3.1.3で調製)をNWsチューブ(3.2.4で調製)に移し、10秒間超音波処理します。
- ガラス管をローテーターに4°Cで一晩置きます。
- 手順3.2.1と同様に磁石でNWを回収し、上澄みを捨てます。
- 2%ウシ血清アルブミン(BSA)溶液1 mLを4°Cで1時間添加し、反応をブロックします。
- 抗体官能基化NWの抗原性を、免疫沈降(IP)アッセイやウェスタンブロット(WB)アッセイなどを用いて確認します。
注:より良い結果を得るには、ブロッキングステップの直後に、IP、WB、または生体適合性アッセイで生体官能基化NWを使用してください。
4. 生体適合性アッセイ
注:NWの生体適合性を研究するために、さまざまな細胞生存率アッセイおよびさまざまな細胞株を使用できます。ここで用いたNWの濃度は、以前の出版物16に基づく。細胞播種は、NWの生体機能化の1日前に行う必要があります。
注意: 以下のすべての手順は、バイオセーフティキャビネットの下で実行する必要があります。
- 96ウェルプレートに、マッコイの細胞培養培地(100 μL/ウェル)に懸濁した結腸がん細胞(HCT116細胞株)4 x 104 を9ウェルに播種し、インキュベーター内で37°C、5%二酸化炭素(CO2)で一晩置きます。
- ステップ3.2.1と同様に、NW(ステップ3.3.4から)を磁石で回収してPBSで洗浄し、古い溶液を1 mLの0.01 M PBS(pH 7)と交換します。この手順を 3 回繰り返します。
- ステップ3.2.1と同様に磁石を使用して回収し、温めたマッコイ培地でNW(ステップ4.2から)を洗浄し、古いPBSを1 mLの温めたマッコイ培地と交換します。この手順を 3 回繰り返します。
- ステップ3.2.1と同様に磁石を用いて(ステップ4.3から)NWを回収し、1mLの温めたマッコイ培地を900μLの温めたマッコイ培地と交換する。NWs 濃度は 0.02 mg/mL の NW にする必要があります。
- 96ウェルプレート(ステップ4.1)をインキュベーターからバイオセーフティキャビネットに運びます。
- バイオセーフティキャビネットの下で、細胞から古い培地を廃棄し、100 μLの懸濁NW(ステップ4.4で調製)と交換します。
- プレート(ステップ4.6で調製)を手で振とうし、インキュベーター内で37°C、5%CO2で24時間インキュベートします。
- 翌日、インキュベーターから96ウェルプレート(ステップ4.7で調製)を取り出します。バイオセーフティキャビネットの下で、多層ピペットを使用して、11 μLの細胞生存率試薬(材料表)を各ウェルに加えます。
- プレートシェーカーでプレートを10 x g の速度で10秒間振とうします。
- プレートをインキュベーターで1時間インキュベートします。
- インキュベーターから96ウェルプレート(ステップ4.10で調製)を取り出します。細胞生存率試薬(励起540 nm、発光590 nm)の吸光度を測定して、マイクロプレートリーダー(材料表)でプレートを読み取ります。
結果
アルミニウム(Al)ディスク(図2A)を細かく切断し(図2B)、使用するチューブに収まるようにすることが重要です。Al片に1 M NaOHを添加した後、すぐに反応が開始され、気泡の発生によって観察されます。1分以内に反応が起こらない場合、または反応が非常に速く、溶液が白い雲で完全に濁った場合は、すぐに古いNaOH溶液を取り除き、新しい溶液と交換してください。NaOH溶液のpH値を確認してください。pH>12である必要があります。NaOHで最初の30分間にNWがAl片から放出されると、NW(黒いクラスター、 図3A)はNaOH溶液内に浮遊します。NWを解放する最後のステップでは、解は均質でなければなりません。NWのクラスタは存在しません(図3B)。NWを磁石で3分間回収した場合、溶液は透明になり、NWペレットは黒色になります(図3C)。ペレットが灰色だった場合は、チューブを廃棄し、新しいAlサンプルからやり直してください。
放出プロセス中に、NWは、以前のレポート11,16,20と同様の厚さ約5 nmの天然酸化鉄層を取得します。この酸化物層は、NWの生体適合性16、官能基化16,18および磁気特性20に重要な寄与を有する。ただし、必要になるまでNWをテンプレートに保持する(つまり、リリースしない)と、環境への影響を防ぐことができます。放出プロセス後のNWの平均直径と長さは、それぞれ2.5μmと41.5nmでした。単一のNWの質量は、表1に示すように計算することができ、誘導結合プラズマ質量分析法(ICP-MS)によって確認された。ここでは、各アルミナディスクには約0.3mgの鉄が含まれていました。
放出後のNWの凝集を低減し、さらなる機能化を可能にするために、NWをAPTESでコーティングしました。このコーティングは遊離アミン基を提供し、磁性材料と非磁性材料の両方をコーティングする能力を備えているため39,45、鉄/金NWなどのマルチセグメントNWのコーティングに適しています。ナノワイヤのコーティングでは、2つの点に着目することが重要です。まず、NWの表面積と質量に基づいて、APTES分子62から必要な体積を計算します。これらの計算を表2に示します。次に、ナノワイヤの凝集や、APTESコーティングによるNW表面の一部のブロッキングを防ぐために、ナノワイヤを連続的に動かします。例えば、このプロトコルでは、ナノワイヤは、APTESコーティングと抗体の機能化中に、それぞれ超音波浴とローテーターの下でインキュベートされました。各APTES分子は、ケイ素原子と末端官能性アミン基21とを含む。したがって、電子エネルギー損失分光法(EELS)マップを使用して、北西表面にシリコン原子(ピンク色)を示すことにより、APTESコーティングの存在を確認できます(図4A)。対照的に、コーティングされていないNWは、鉄原子を樹皮青色(図4B)で、鉄/酸素混合原子を水色(図4B)で示しています。コーティングされていないNWの対応するEELSマッピング(図4C、4D)は、表面(図4D)よりも中心部(図4C)の方が鉄と酸素の強度が高いことを示しており、鉄-酸化鉄(コアシェル)構造を示しています。EELSマッピング(図4C、4D)は、NW上の酸化鉄層がFe2O3よりもFe3O4多いことが確認され、これは以前の出版物20と同様である。
結合した抗体の抗原性は、IPおよびWBアッセイを用いて確認することができ、陽性サンプルではバンドが観察されますが、陰性対照では観察されません(図5)。クリアバンドを観察するには、0.1 mg/10 x 106 セル未満のNWを使用しないでください。BCAアッセイ(材料表)を、 表3 に示したいくつかの計算と組み合わせて、NW上の抗体数を定量するために使用しました。
さらに、ゼータ電位測定を用いて、表面官能基化を解明しました。APTESの末端アミン基は、 図6に示すように、コーティングされていないNWの負電荷を減少させました。抗体で修飾されたNWは、APTESでコーティングされたNWと比較して電荷も変化しました(図6)。ゼータ電位の測定はすべて pH 7 で行いました。
抗体官能基化NWの特異的な細胞標的化は、共焦点顕微鏡を用いて確認することができます(図7)。新しいナノ材料の生体適合性は、アプリケーションを開始する前にテストする必要があります。そこで、細胞生存率測定法を用い、非コーティング、APTESコーティング、抗体コーティングNWは高濃度でも生体適合性を有することを確認しました(図8)。
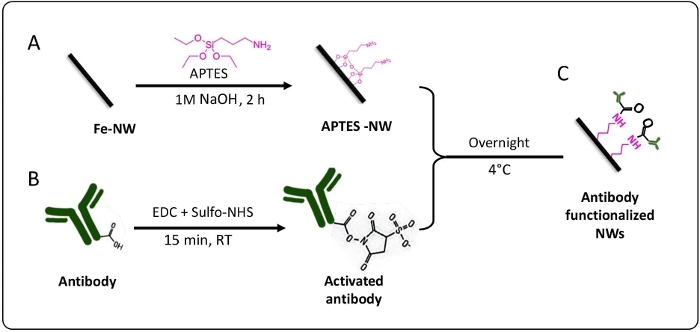
図1:概略図は、ナノワイヤのコーティングおよび生体機能化方法を表しています。 (A)鉄NWをAPTESでコーティングします。(B)EDC+スルホ-NHSを用いて抗体を活性化し、末端に(C)抗体官能基化ナノワイヤを有する。この図の拡大版をご覧になるには、ここをクリックしてください。

図2:鉄蒸着アルミニウムディスク。 (A)切断前のアルミディスク。(B)赤い線は、ディスクをカットする場所を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:ナノワイヤの放出ステップ。 (A)ナノワイヤのクラスターがNaOH溶液中に浮遊している。画像は、NaOHを添加し、Al膜を除去してから10分後に撮影しました。(B)エタノールに懸濁したナノワイヤ。写真は、超音波処理ステップの直後の最後のリリースステップで撮影されました。(C)磁石で捕集した黒色ナノワイヤペレット。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:電子エネルギー損失分光法(EELS)マップ。 (A)APTES被覆ナノワイヤ(APTES-NW)。青とピンクの色は、それぞれ鉄原子とケイ素原子を表しています。(B)非被覆ナノワイヤ(NW)。樹皮の青と水色は、それぞれ鉄と鉄/酸素の混合マッピングを表しています。(C)コアと(D)コーティングされていないNWのシェルの対応するEELSマッピング。 この図の拡大版を表示するには、ここをクリックしてください。
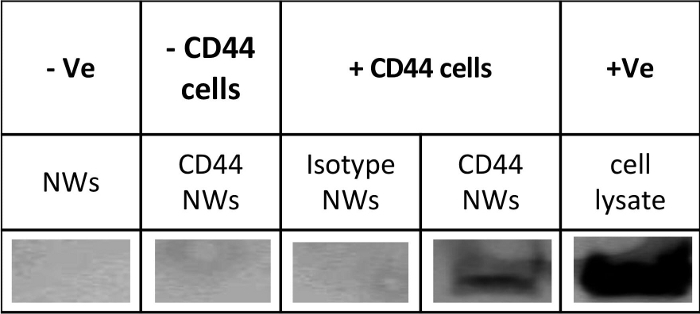
図5:抗体結合ナノワイヤの機能発現と活性の確認。 CD44-NWの抗原性は、免疫沈降(IP)およびウェスタンブロット(WB)を用いて確認された。+Ve:ポジティブコントロール(全細胞ライセート)を表します。-Ve:ネガティブコントロール(コーティングされていないNWのみ)を表します。– CD44細胞:CD44抗原を発現しない細胞を表します。+ CD44細胞:CD44抗原を発現する結腸がん細胞を表します。これは、n = 3つの独立した実験の代表的なブロットです。 この図の拡大版をご覧になるには、ここをクリックしてください。
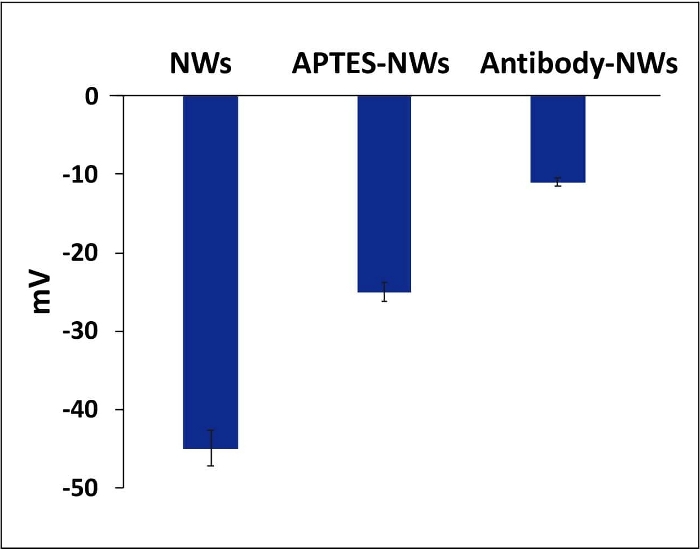
図6:NW、APTES-NW、および抗体のゼータ電位値。 バーは標準誤差±平均を表します。 この図の拡大版をご覧になるには、ここをクリックしてください。

図7:共焦点顕微鏡画像は、特定のターゲティングを示しています。 CD44-NWは付着している(A および C)が示されているが、Isotype-NW(ネガティブコントロール)は付着していない(B および D)。赤、青、緑の色は、それぞれCD44-NWの細胞膜、核、クラスターを表しています。A と B は、それぞれ C と D の明視野像です。 この図の拡大版をご覧になるには、ここをクリックしてください。

図8:大腸がん細胞(HCT116)を異なる製剤のナノワイヤーでインキュベートした細胞生存率の研究。 細胞を24時間のインキュベーション後にNWで処理し、次いでNWで24時間インキュベートしました。すべての実験は、37°Cのインキュベーター内で行いました。 バーは標準誤差±平均を表します。 この図の拡大版をご覧になるには、ここをクリックしてください。
| パラメーター | 価値 | 単位 | ||
| Fe NWの長さ(h) | 2.6 | μmの | ||
| 半径 (直径/2) (r) | 0.01679231 | μmの | ||
| Fe密度(D) | 7.87 | g/cm3 | ||
| 1 Fe NW体積(V)= π r ^ 2h | 2.30E-15 | CM3 | ||
| 1 Fe NW質量 = V x D | 1.80E-08 | μgの | ||
| 1 Fe NW 表面積 = 2π r^2 + 2πrh | 2.76E-01 | μm2 | 2.8E+05 | nmの2 |
表1:鉄NW質量の計算。
| パラメーター | 価値 | 単位 |
| APTES/100 μLの密度* | 9.50E-01 | g |
| APTESの分子ワイト(MW) | 2.21E+02 | g/mol |
| APTESモル数=質量/MW | 4.29E-03 | 商船三井 |
| APTES分子数/100 μL** | 2.57E+21 | 分子 |
| APTESサイズ*** | 5.00E-01 | 海里 |
| APTES表面積 | 2.00E-01 | nmの2 |
| NW表面積**** | 2.76E+05 | nmの2 |
| 0.3mgのNW中のNWの数**** | 1.70E+10 | NWの |
| 北西の周囲に1つの層を作るのに必要なAPTES分子の数 | 1.38E+06 | APTES分子 |
| 0.3 mg の NW に必要な APTES 分子数 | 2.35E+16 | APTES分子 |
| *参照番号61 | ||
| ** 分子数 = mol*アボガドロ数 (6E+23) | ||
| 参照番号 62 | ||
| 表1より | ||
表2:NWsコーティングに必要なAPTES分子数の計算。
| Y字型IgG抗体 | 北西 | |
| 抗体1個あたりの質量 | 2.3E-13 μg | 1.8E-08 μg※ |
| 1つの抗体の表面積 | 23 nm2 | 2.6E+05 nm2 |
| BCAアッセイに基づく | 1 mgあたり0.3 mg。 | |
| NW1mg当たりの抗体0.3mg中の抗体分子数とNWの数 | ~1E+15抗体** ~5.6E+10 NWあたり | |
| NWあたりの抗体分子数 | ~2E+04抗体/1 NW*** | |
| ※表1より算出 | ||
| **0.3 mg中の抗体数は、BSAアッセイから受け取った抗体数(0.3 mg)をY字型IgG抗体の平均分子量(180 kDa = 3E-16 mg)で割って計算しました。 | ||
| Y字型IgG抗体1分子の表面積(~23 nm2)と1つのNWの表面積(~2.6E+05 nm2)に基づくと、約1E+04抗体でNW上に単層を形成するのに十分です。私たちの場合、抗体の密度は予想量の2倍でした。これは、抗体の高度な接着を可能にするより多くのアームを提供するAPTESコーティングに関連している可能性があります。この場合、NWが抗体で完全に覆われ、NWの配向に関係なく、抗体が細胞表面抗原に結合する機会が高くなります。ただし、抗体密度が予想される数(1E+04分子の抗体)よりも低い場合、細胞とNW間の結合可能性は低くなります。 | ||
表3:ナノワイヤ上の抗体数の計算。
ディスカッション
他のナノ材料製造およびコーティング方法と同様に、使用される溶液には高品質の溶液が必要です。遊離型(1 M NaOH)および官能基化(MES)溶液は、数回再利用できます。ただし、新しいプロセスを開始する前にpH値を確認することは非常に重要です。放出工程では、NWをNaOHで洗浄することを少なくとも4回行う必要があります。洗浄が良いほど、NWの安定性が向上し、NWの凝集が少なくなります。酸化物層は、エタノールまたは水63への浸漬時のNWの安定性を高める。
NWの直径と長さは、APTESと抗体でコーティングした後に影響を受けました。ここで、NWを切断する超音波処理ステップにより、直径は41.5nmから70nmに増加し、長さは2.5μmから1.6μmに減少しました。したがって、生体機能化工程後のNWの形態を特徴付けることが不可欠である。
抗体のNWへの結合は、アミン基(APTES)とカルボキシル基(抗体)の間の共有結合相互作用に依存しています。したがって、APTESコーティングの存在を確認することは重要なステップであり、EELSマッピングを使用しました。コーティング方法は安全で簡単です。高温や長いインキュベーション時間を必要としません。また、APTESコーティングは、カルボキシル基を持つ他の抗体やタンパク質の共有結合を可能にするリンカーとしても機能します。
抗体でNWを生体官能基化する場合、生体機能化プロセス後の抗体の結合部位の抗原性が影響を受ける可能性があります。この問題を調査するには、IP および WB メソッドを使用できます。このプロトコルで述べられるbiofunctionalization方法を使用して抗体が特定のセル受容器に高い抗原性のNWsに結合することを可能にする。さらに、抗体でNWを生体機能化することで、目的の受容体であるCD44を持つ細胞を標的にする能力が加わりました。これは共焦点顕微鏡によって確認されました。コーティングされていないNWの生体適合性は高かったが(>95%)、NWにAPTESコーティングまたは抗体を添加すると、生体適合性が100%向上した。
さらに、コーティングおよび生体機能化プロトコルは、効率的、経済的、および再現性があります。これは、他の酸化鉄-鉄ナノ材料にも適用できるはずであり、コーティングと結合抗体の両方の濃度は、ナノ材料の表面積と質量に基づいて最適化する必要があります。このプロトコルは、一般的な実験室の周囲条件で安全に行うことができます。生体機能化により、ナノマテリアルの生体適合性とターゲティング能力が大幅に向上しました。一般に、NWはナノメディカルアプリケーション(マルチモーダルまたはコンビナトリアル処理、細胞検出またはガイダンス、生物学的センシングを含む)にとって非常に有望な材料です。ここで説明するように、生体機能化と組み合わせることで、特定の細胞ターゲティングを達成し、精度と有効性を高めることができます。
開示事項
著者は何も開示していません。
謝辞
この出版物で報告された研究は、キングアブドゥッラー科学技術大学(KAUST)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 2 mL tube (snap-cap Microcentrifuge) | Eppendorf, Fisherscientific | 05-402-7 | |
| 2-N-Morpholino EthaneSulfonic acid hydrate 99% (MES) | Thermscientific | AC172590250 | Concentration 0.1 M and pH 4.7 |
| 3-3-Dimethyl-aminopropyl Carbodiimide (EDC) | Thermofisher | PG82079 | |
| 3-AminoPropyl-Tri-Ethoxy-Silane (APTES) | Sigma Aldrich | 919302 | |
| 5 mL glass tube | Fisherscientific | 03-339-22C | |
| 96-well plate ( flat bottom) | Sigma Aldrich | CLS3595 | |
| Anti-CD44 antibody | BD Biosciences | 550990 | Clone 515, concentration 1 mg/mL |
| APTES ((3-Aminopropyl)triethoxysilane), 99% | Sigma Aldrich | 919-30-2 | Concentration 99% |
| BCA assay (Pierce BCA Protein Assay Kit) | Thermofisher | 23225 | |
| Bovine Serum Albumin solution (BSA) | Sigma Aldrich | 9048-46-8 | Concentration 35% |
| Cell incubator | Thermofisher | 50116047 | |
| Cell viability reagent | AlamarBlue,Thermofisher | DAL1025 | |
| Colon cancer cells - HCT116 cell line | ATCC | 430641 | |
| Hardwood Hammer | Any hammer tool can be used, there is no specific brand. | ||
| Inductively coupled plasma Mass Spectrometer (ICP-MS) | Perkin Elmer | ELAN 9000 ICP-MS | The used software is "Elan instrument control session" |
| Laboratory Retort Stand with Clamp | RVFM | 13-0140 | This is used to handle the 5 mL glass tube in the sonicator bath. |
| Magnetic rack (DynaMag-2 Magnet) | Thermofisher | 12321D | |
| McCoy’s 5A Medium 1x | Gibco | 16600082 | |
| Microplate reader (Bio-Rad xMark Absorbance Spectrophotometer) | Bio-Rad | 1681150 | Microplate Manager 6 software (#168-9520) |
| Phosphate buffered saline (PBS) 10x | Gibco | 14200067 | Concentration 0.1 M (No calcuim, no magnesium) |
| Phosphate buffered saline (PBS) 1x | Gibco | 14190136 | Concentration 0.01 M (No calcuim, no magnesium) |
| Plate shaker (Microplate Genie) | Scientific Industries (Genie) | SI-0400 | |
| Single Edge Razor blades | Polysciences | 08410-1 | |
| Sodum hydrixide (NaOH) | Sigma Aldrich | 1310-73-2 | Concentration 1 M, pH 13 |
| Sulfo-N-HydroxySulfosuccinimide (sulfo-NHS) | Thermofisher | 106627-54-7 | |
| Trypsin | ATCC | 30-2101 | |
| Tube rotator | VWR | 10136-084 | |
| Tube shaker (Eppendorf Thermomixer R Mixer, 2.0 mL) | Eppendorf, Fisherscientific | 05-400-204 | |
| Ultrasonic bath (2510) | Branson | 2489502 |
参考文献
- Dürr, S. Magnetic nanoparticles for cancer therapy. Nanotechnology Reviews. 2 (4), 395-409 (2013).
- Espinosa, A. Duality of iron oxide nanoparticles in cancer therapy: amplification of heating efficiency by magnetic hyperthermia and photothermal bimodal treatment. ACS Nano. 10 (2), 2436-2446 (2016).
- Martínez Banderas, A. I., et al. Iron-Based Core-Shell Nanowires for Combinatorial Drug Delivery, Photothermal and Magnetic Therapy. ACS Applied Materials Interfaces. , (2019).
- Das, R. Tunable high aspect ratio iron oxide nanorods for enhanced hyperthermia. The Journal of Physical Chemistry. 120 (18), 10086-10093 (2016).
- Chen, J., et al. Guidance of stem cells to a target destination in vivo by magnetic nanoparticles in a magnetic field. ACS Applied Materials Interfaces. 5 (13), 5976-5985 (2013).
- Juneja, R., Roy, I. Iron oxide-doped niosomes as drug carriers for magnetically targeted drug delivery. International Journal of Nanomedicine. 13, 7 (2018).
- Aires, A., et al. Multifunctionalized iron oxide nanoparticles for selective drug delivery to CD44-positive cancer cells. Nanotechnology. 27 (6), 065103 (2016).
- Trabulo, S., Aires, A., Aicher, A., Heeschen, C., Cortajarena, A. L. Multifunctionalized iron oxide nanoparticles for selective targeting of pancreatic cancer cells. Biochimica et Biophysica Acta -General Subjects. 1861 (6), 1597-1605 (2017).
- Blanco-Andujar, C., et al. Design of iron oxide-based nanoparticles for MRI and magnetic hyperthermia. Nanomedicine. 11 (14), 1889-1910 (2016).
- Hachani, R., et al. Polyol synthesis, functionalisation, and biocompatibility studies of superparamagnetic iron oxide nanoparticles as potential MRI contrast agents. Nanoscale. 8 (6), 3278-3287 (2016).
- Contreras, M. F., Sougrat, R., Zaher, A., Ravasi, T., Kosel, J. Non-chemotoxic induction of cancer cell death using magnetic nanowires. International Journal of Nanomedicine. 10, 2141 (2015).
- Perez, J. E., et al. . Cytotoxicity. , (2018).
- Kievit, F. M., Zhang, M. Surface engineering of iron oxide nanoparticles for targeted cancer therapy. Accounts of Chemical Research. 44 (10), 853-862 (2011).
- Xu, H. Antibody conjugated magnetic iron oxide nanoparticles for cancer cell separation in fresh whole blood. Journal of Biomaterials. 32 (36), 9758-9765 (2011).
- Zhang, L., Dong, W. F., Sun, H. B. Multifunctional superparamagnetic iron oxide nanoparticles: design, synthesis and biomedical photonic applications. Nanoscale. 5 (17), 7664-7684 (2013).
- Martínez-Banderas, A. I., et al. Functionalized magnetic nanowires for chemical and magneto-mechanical induction of cancer cell death. Scientific Reports. 6, 35786 (2016).
- Tian, Q., et al. Multifunctional Polypyrrole@ Fe3O4 Nanoparticles for Dual-Modal Imaging and In Vivo Photothermal Cancer Therapy. Small. 10 (6), 1063-1068 (2014).
- Alsharif, N. A., Martiìnez-Banderas, A. I., Merzaban, J., Ravasi, T., Kosel, J. Biofunctionalizing Magnetic Nanowires Toward Targeting and Killing Leukemia Cancer Cells. IEEE Transactions on Magnetics. 2 (99), 1-5 (2018).
- Ventola, C. L. Progress in nanomedicine: approved and investigational nanodrugs. Journal of Pharmacy Therapeutics. 42 (12), 742 (2017).
- Ivanov, Y. P., et al. Tunable magnetic nanowires for biomedical and harsh environment applications. Scientific Reports. 6, 24189 (2016).
- Margineanu, M. B., et al. Semi-automated quantification of living cells with internalized nanostructures. Journal of Nanobiotechnology. 14 (1), 4 (2016).
- Jeon, Y. S., et al. Metallic Fe-Au Barcode Nanowires as a Simultaneous T Cell Capturing and Cytokine Sensing Platform for Immunoassay at the Single-Cell Level. ACS Applied Materials Interfaces. 11 (27), 23901-23908 (2019).
- Lee, E., et al. Highly selective CD44-specific gold nanorods for photothermal ablation of tumorigenic subpopulations generated in MCF7 mammospheres. Nanotechnology. 23 (46), 465101 (2012).
- Patel, N. S., Lago-Cachón, D., Mohammed, H., Moreno, J. A., Kosel, J. J. J. Iron Nanowire Fabrication by Nano-Porous Anodized Aluminum and its Characterization. Journal of Visualized Experiments. (152), e60111 (2019).
- Rozhkova, E. A., et al. Ferromagnetic microdisks as carriers for biomedical applications. Journal of Applied Physics. 105 (7), 306 (2009).
- Kim, D. H., et al. Biofunctionalized magnetic-vortex microdiscs for targeted cancer-cell destruction. Nature Materials. 9 (2), 165-171 (2010).
- Kim, D. H., et al. Mechanoresponsive system based on sub-micron chitosan-functionalized ferromagnetic disks. Journal of Materials Chemistry. 21 (23), 8422-8426 (2011).
- Vitol, E. A., Novosad, V., Rozhkova, E. A. Multifunctional ferromagnetic disks for modulating cell function. IEEE Transactions on Magnetics. 48 (11), 3269-3274 (2012).
- Vitol, E. A., Novosad, V., Rozhkova, E. A. Microfabricated magnetic structures for future medicine: from sensors to cell actuators. Nanomedicine. 7 (10), 1611-1624 (2012).
- Lim, J., et al. Direct isolation and characterization of circulating exosomes from biological samples using magnetic nanowires. Journal of Nanobiotechnology. 17 (1), 1-12 (2019).
- Shore, D., et al. Electrodeposited Fe and Fe–Au nanowires as MRI contrast agents. Chemical Communications. 52 (85), 12634-12637 (2016).
- Martínez-Banderas, A. I., et al. Iron-Based Core-Shell Nanowires for Combinatorial Drug Delivery and Photothermal and Magnetic Therapy. ACS Applied Materials Interfaces. 11 (47), 43976-43988 (2019).
- Martínez-Banderas, A. I., et al. Magnetic core-shell nanowires as MRI contrast agents for cell tracking. Journal of Nanobiotechnology. 18 (1), 1-12 (2020).
- Zhu, L., Zhou, Z., Mao, H., Yang, L. Magnetic nanoparticles for precision oncology: theranostic magnetic iron oxide nanoparticles for image-guided and targeted cancer therapy. Nanomedicine. 12 (1), 73-87 (2017).
- Guleria, A., Priyatharchini, K., Kumar, D. . Applications of Nanomaterials. , 345-389 (2018).
- Allara, D. L., Nuzzo, R. G. Spontaneously organized molecular assemblies. 2. Quantitative infrared spectroscopic determination of equilibrium structures of solution-adsorbed n-alkanoic acids on an oxidized aluminum surface. Langmuir. 1 (1), 52-66 (1985).
- Allara, D. L., Nuzzo, R. G. Spontaneously organized molecular assemblies. 1. Formation, dynamics, and physical properties of n-alkanoic acids adsorbed from solution on an oxidized aluminum surface. Langmuir. 1 (1), 45-52 (1985).
- Schrittwieser, S., Reichinger, D., Schotter, J. Applications, surface modification and functionalization of nickel nanorods. Materials and Structures. 11 (1), 45 (2018).
- Lim, J., Choi, M., Lee, H., Kim, Y. H., Han, J. Y., Lee, E. S., Cho, Y. Direct isolation and characterization of circulating exosomes from biological samples using magnetic nanowires. Journal of Nanobiotechnology. 17 (1), 1 (2019).
- Nemati, Z., et al. Magnetic Isolation of Cancer-derived Exosomes Using Fe/Au Magnetic Nanowires. ACS Applied Nano Materials. 3 (2), 2058-2069 (2020).
- Hainfeld, J. F., Liu, W., Halsey, C. M., Freimuth, P., Powell, R. D. Ni-NTA-gold clusters target His-tagged proteins. Journal of Structural Biology. 127 (2), 185-198 (1999).
- Agarwal, G., Naik, R. R., Stone, M. O. Immobilization of histidine-tagged proteins on nickel by electrochemical dip pen nanolithography. Journal of the American Chemical Society. 125 (24), 7408-7412 (2003).
- Aswal, D., Lenfant, S., Guerin, D., Yakhmi, J., Vuillaume, D. Self assembled monolayers on silicon for molecular electronics. Analytica Chimica Acta. 568 (1-2), 84-108 (2006).
- Haensch, C., Hoeppener, S., Schubert, U. S. Chemical modification of self-assembled silane based monolayers by surface reactions. Chemical Society Reviews. 39 (6), 2323-2334 (2010).
- Wildt, B., Mali, P., Searson, P. C. Electrochemical template synthesis of multisegment nanowires: Fabrication and protein functionalization. Langmuir. 22 (25), 10528-10534 (2006).
- Schladt, T. D., Schneider, K., Schild, H., Tremel, W. Synthesis and bio-functionalization of magnetic nanoparticles for medical diagnosis and treatment. Dalton Transactions. 40 (24), 6315-6343 (2011).
- Kumar, C. S. . Magnetic nanomaterials. , (2009).
- Peiris, P., et al. Precise targeting of cancer metastasis using multi-ligand nanoparticles incorporating four different ligands. Nanoscale. 10 (15), 6861-6871 (2018).
- Veiseh, O., Gunn, J. W., Zhang, M. Design and fabrication of magnetic nanoparticles for targeted drug delivery and imaging. Journal of Advanced Drug Delivery Reviews. 62 (3), 284-304 (2010).
- Rosenblum, D., Joshi, N., Tao, W., Karp, J. M., Peer, D. Progress and challenges towards targeted delivery of cancer therapeutics. Nature Communications. 9 (1), 1410 (2018).
- Bazak, R., Houri, M., El Achy, S., Kamel, S., Refaat, T. Cancer active targeting by nanoparticles: a comprehensive review of literature. Journal of Cancer Research Clinical Oncology. 141 (5), 769-784 (2015).
- Zeilstra, J., et al. CD44 expression in intestinal epithelium and colorectal cancer is independent of p53 status. PLoS One. 8 (8), 72849 (2013).
- Pesarrodona, M., et al. Intracellular targeting of CD44+ cells with self-assembling, protein only nanoparticles. International Journal of Pharmaceutics. 473 (1-2), 286-295 (2014).
- Chandra, V., et al. Quantitative assessment of CD44 genetic variants and cancer susceptibility in Asians: a meta-analysis. Oncotarget. 7 (45), 74286 (2016).
- Thapa, R., Wilson, G. D. The importance of CD44 as a stem cell biomarker and therapeutic target in cancer. Stem Cells International. 2016, (2016).
- Gao, S., Zheng, X., Jiao, B., Wang, L. Post-SELEX optimization of aptamers. Analytical Bioanalytical Chemistry. 408 (17), 4567-4573 (2016).
- Das, M., Mohanty, C., Sahoo, S. K. Ligand-based targeted therapy for cancer tissue. Expert Opinion on Drug Delivery. 6 (3), 285-304 (2009).
- Janeway, C. A., Travers, P., Walport, M., Shlomchik, M. . Immunobiology: the Immune System in Health and Disease. 2, (2001).
- Patel, N. S., Lago-Cachón, D., Mohammed, H., Moreno, J. A., Kosel, J. Iron Nanowire Fabrication by Nano-Porous Anodized Aluminum and its Characterization. Journal of Visualized Experiments. (152), e60111 (2019).
- Rao, X., et al. High density gold nanoparticles immobilized on surface via plasma deposited APTES film for decomposing organic compounds in microchannels. Applied Surface Science. 439, 272-281 (2018).
- . Merck. (3-Aminopropyl)triethoxysilane Available from: https://www.sigmaaldrich.com/catalog/product/aldrich/440140?lang=en®ion=SA (2020)
- Munguía-Cortés, L., et al. APTES-functionalization of SBA-15 using ethanol or toluene: Textural characterization and sorption performance of carbon dioxide. Journal of the Mexican Chemical Soceity. 61 (4), 273-281 (2017).
- Sperling, R. A., Parak, W. J. Surface modification, functionalization and bioconjugation of colloidal inorganic nanoparticles. Philosophical Transactions of the Royal Society A: Mathematical & Physical Engineering Sciences. 368 (1915), 1333-1383 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved