Method Article
ハイブリッド原子間力顕微鏡走査型電気化学顕微鏡(AFM-SECM)を用いたナノ材料の表面電気化学的活性の調査
要約
原子間力顕微鏡(AFM)とスキャン電気化学顕微鏡(SECM)、すなわちAFM-SECMを組み合わせることで、ナノスケールで材料表面の高解像度の地形情報や電気化学的情報を同時に取得することができます。このような情報は、ナノ材料、電極、生体材料の局所的な表面上の異種特性(反応性、欠陥、反応部位など)を理解するために重要です。
要約
走査電気化学顕微鏡(SECM)は液体/固体、液体/気体および液体/液体/液体の界面の局所的な電気化学的挙動を測定するために使用される。原子間力顕微鏡(AFM)は、地形と機械的特性の点で微細構造とナノ構造を特徴付けるための汎用性の高いツールです。しかし、従来のSECMまたはAFMは、ナノスケールで電気的または電気化学的特性に関する限定的に解決された情報を提供します。例えば、結晶面レベルでのナノ材料表面の活性は、従来の電気化学法では解決が困難である。この論文では、AFMとSECMの組み合わせ、すなわちAFM-SECMを組み合わせてナノスケールの表面電気化学活性を探査し、高解像度の地形データを取得する方法を報告する。このような測定は、ナノ構造と反応活性の関係を理解するために重要であり、材料科学、生命科学、化学プロセスにおける幅広い用途に関連しています。組み合わされたAFM-SECMの多様性は、ファセットナノ粒子(NPs)とナノバブル(NB)の地形および電気化学的特性をそれぞれマッピングすることによって実証される。ナノ構造の以前に報告されたSECMイメージングと比較して、このAFM-SECMは、表面マッピングの高解像度で局所的な表面活性または反応性の定量的評価を可能にする。
概要
電気化学(EC)行動の特性評価は、生物学1、2、エネルギー3、4、材料合成5、6、7、および化学プロセス8、9など、多様な分野における界面反応の動態およびメカニズムに関する重要な洞察を提供することができる。電気化学的インピーダンス分光法10、電気化学的ノイズ法11、ガルバノスタティック間断滴定12、および環式ボルタンメトリー13を含む従来のEC測定は、通常、巨視的規模で行われ、表面平均応答を提供する。したがって、電気化学的活性が表面に分布する方法に関する情報を抽出することは困難ですが、ナノ材料が広く使用されている場合、ナノスケールの局所的なスケール表面特性は特に重要です。したがって、ナノスケールの多次元情報と電気化学の両方を同時に捕捉できる新しい技術が非常に望ましい。
走査電気化学顕微鏡(SECM)は、物質の局所的な電気化学的活性をマイクロスケールおよびナノスケール14で測定するために広く用いられている技術である。典型的には、SECMは、サンプル表面をスキャンして局所的な電気化学的性質15を空間的に解決する際に、電気活性化学種を検出するためのプローブとして超マイクロ電極を使用する。プローブで測定された電流は、メディエータ種の還元(または酸化)によって生成され、この電流はサンプルの表面における電気化学的反応性の指標です。SECMは1989年16年の最初の創設後に大きく進化しましたが、まだ2つの主な制限によって挑戦されています。EC信号は通常、チップ基板相互作用特性に敏感であるため、SECMの1つの制限は、プローブを一定の高さで保つことで、電気化学的活性と表面景観の直接的な相関を防ぐことであり、収集されたEC情報18との地形の畳み込みに起因する。第2に、商用SECMシステムが、マイクロメータスケール19にあるプローブ寸法によって空間分解能が部分的に決定されるので、サブマイクロメータ(μm)画像解像度を得ることは困難である。したがって、ナノ電極は、ナノメートル範囲の直径を有する電極を、サブマイクロメートルスケール20、21、22、23以下の解像度を達成するためにSECMでますます使用されている。
一定の先端基板距離制御を提供し、より高い空間電気化学的分解能を得るために、SECMのいくつかのハイブリッド技術、例えばイオン伝導位置24、せん断力位置決め25、交流電流SECM26、原子間力顕微鏡(AFM)位置決めなどが用いられている。これらの計測器の中で、SECM統合AFM測位(AFM-SECM)は非常に有望なアプローチとなっています。AFMは固定された先端基板距離を提供することができるので、統合されたAFM-SECM技術は、鋭いAFM先端を用いたマッピングまたはサンプルスイープを通じてナノスケール表面構造および電気化学的情報を同時に取得することができます。1996年27年にマクファーソンとアンウィンによるAFM-SECMの初の運用に成功して以来、プローブの設計と製造、および化学および生物学的プロセスにおける電気化学などの様々な研究分野での応用に大きな改善が達成されました。例えば、AFM-SECMは、貴金属ナノ粒子28のような複合材料表面をイメージングするために実施されている、機能的または寸法的に安定した電極29、30、及び電子機器31。AFM-SECMは先端の現在のイメージから電気化学的に活動的なサイトを地図化できる。
同時の地形および電気化学的測定は、導電性AFM 32、33、34、35、電気化学AFM(EC-AFM)36、37、38、39、走査イオンなどの他の技術によっても達成することができた。 伝導顕微鏡走査電気化学顕微鏡(SICM-SECM)24、40、及び走査電気化学細胞顕微鏡(SECCM)41、42これらの技術間の比較は、レビューペーパー1で議論されている。本研究の目的は、SECM-AFMを用いて、水中のファセット結晶性酸化カップルースナノ材料およびナノバブルに関する電気化学的マッピングと測定を実証することであった。ファセットナノ材料は、独特の結晶構造特徴を持つファセットが独特の表面原子構造を有し、さらにそれらの触媒特性を支配するため、クリーンエネルギー用途における金属酸化物触媒のために広く合成される。また、金質基板上の表面ナノバブル(NB)の液体/気体界における電気化学的挙動を測定し、比較しました。NBは、直径<1μm(超微細気泡とも呼ばれる)43の気泡であり、溶液46、47、ガス質量移動46、48の高い滞留時間を含む多くの興味深い特性44、45を引き出す。さらに、NBsの崩壊は衝撃波を作り出し、ヒドロキシルラジカル(•OH)49、50、51、52の形成を行う。溶液中の酸素NBの電気化学的反応性を測定し、NBの基本的な化学的性質をよりよく理解しました。
プロトコル
1. サンプル準備
-
シリコン基板上のファセットCu2Oナノ粒子と堆積物の調製
- 溶解 0.175 g の CuCl2の 2 H2O (99.9%)100 mL の脱イオン(DI)水に入れ、10 mMCuCl2の水溶液を生成します。
- CuCl2 溶液に10.0 mLの2.0 M NaOHと0.6 Mアスコルビン酸滴下の10 mLを加えます。
- 55°Cの水浴で一定の攪拌の下で250 mLラウンドボトムフラスコに溶液を3時間加熱します。
- 得られた沈殿物を遠心分離(5,000xg15分間)で回収し、続いてDI水を3回洗浄し、エタノールを2回洗浄して残留無機イオンおよびポリマーを除去する。
- 60°Cで5時間53時間真空中での乾燥沈殿。
- エポキシを用いた図1Aに示すようにCu2Oナノ粒子を堆積させる基板として調製したシリコンウエハを使用して試験を確実に行う。
注意:シリコンウエハー(Ø3"シリコンウエハ、タイプP )を38mm x 38mmの単一片に切断し、エタノール、メタノール、DI水を使用して有機および無機汚染物質を除去しました。 - きれいなガラスのスライドが付いたピペットの先端およびタイルを使用して、洗浄されたシリコンウエハに10 μLのエポキシを直接堆積させます。約5分後、異なるエポキシコーティングされたシリコンウエハー基板上にナノ粒子/水懸濁液(10mgL-1)の10μLを別々に滴下する。 図1B に示す4つの異なる赤色の斑点は、堆積したナノ粒子のポテンシャル位置を示す。
- 基板を40°Cで6時間真空乾燥する。
- サンプル基板をECサンプルセル(図4)に入れ、10mM Ru(NH3)6Cl3(98%)を含む0.1MKClの1.8 mLで満たします。
-
NBの準備
- 圧縮酸素の直接注入による酸素ナノバブルの発生(純度99.999%)管状セラミック膜(100 nmの孔径、WFA0.1)を介してDI水に入れます。
注:ガスは、414 kPaの圧力下で連続的に注入され、0.45 L·m-1 の流れは、他の54に報告されるように安定した気泡サイズ分布に達するまで。 - ECサンプルセルの金基板上に1.8mLのNBの水懸濁液を加え、10分間安定させます。
注:新鮮な40ミリメートルx 40 mmの金板(Si上のAu)は、NBsを固定するための基板として使用されました。 - NBサスペンションの0.9 mLをデスキャンし、0.1 M KClで10 mM Ru(NH3)6Cl3溶液の0.9 mLに交換してください。
- 圧縮酸素の直接注入による酸素ナノバブルの発生(純度99.999%)管状セラミック膜(100 nmの孔径、WFA0.1)を介してDI水に入れます。
2. AFM-SECMのセットアップ
注:AFMは提示されたAFM-SECM測定で使用されました。EC分析を行うために、AFMは2ポテンスタットとSECMアクセサリーを装備していました。図S1に示すように、2ポテンシマスタットはAFMコントローラに接続され、ポテンシマスタットとAFMの両方が同じコンピュータに接続された。付属品は、SECMチャック、保護ブーツ付きのSECMプローブホルダー、および最大電流流量55を制限する抵抗セレクタ(10 MΩ抵抗を使用)を備えた歪み解放モジュールを含む。図 2に示すように、AFM-SECM プローブの先端半径は 25 nm、先端高さは 215 nm です。試料は、Ag線電極(直径25mm)とPt線の対極(直径25mm)を用いて同じ擬似参照を共有する作動電極として機能した。プローブとサンプルは、異なる電位(Agワイヤー疑似参照電極と対して)でバイアスされ、異なる酸化還元反応を可能にする可能性があります。この資料では、先端は[Ru(NH3)6]3+を-400 mVで2+2+Ag線擬似参照電極に減らします。
- 既存のサンプルチャックをSECMチャックに交換し、2本のM3 x 6 mmソケットヘッドキャップネジと2.5mm六極レンチを使用してチャックを所定の位置にねじ込みます(図3A)。
- 温度制御ケーブルをSECMチャックに接続し、低ノイズのSECMケーブルをスプリングコネクタブロック(カラーからカラー)とスイッチブロック(図3B)に接続します。
メモ: SECMテスト中は、スイッチを右側に保持する必要があります。 - ひずみ解放モジュールをAFMスキャナに取り付け、延長ケーブル付きスプリングコネクタブロックの作動電極コネクタに接続します(図3C)。
- ECサンプルセルを組み立てます。
- 挿入物を上部のリングに置きます (図 4A)。
- 2つのOリングを、それぞれ、挿入部の底溝と上溝に組み立てます(図4Bおよび図4C)。
- 上部のリング上部にガラスカバーを置き、軽く斜めに4本のネジで締めます(図4D)。
- 直径24mmの硬い鋭いワイヤー(図4E)を使用して、上部リングのプラスチック部品の2つのチャネルを通してOリングに2つの穴を突き刺します(図4F)。
- O リングの穴に Ag ワイヤと Pt ワイヤを挿入し、 図 4Gに示すように、Pt ワイヤを EC サンプル セルの円にカーブします。
- ECサンプルセル上部を密封するには、組み立てたECサンプルセルをECサンプルセル底面に押し下げて、Oリングがガラスカバーに完全に接触するようにします(図4H)。
- ECサンプルセルの上部を上下逆さまに配置し、バネ付きピン(ポゴピン)がサンプル表面に触れるように、テストサンプル(または基板)を下方に向けます( 図4I および 図4Jを参照)。テストサンプルは、ECサンプルセルボトムパーツシールを作るためにOリングをカバーする必要があります。
- ECサンプルセルの底部を上に置き、右の長さのネジで斜めに締めます(図4K)。
3. AFM-SECMの運用
- AFMおよび双ポテンスタット機器の初期化
- 2 つのソフトウェア アイコンをダブルクリックして、AFM システムと 2 ポテンピオスタット コントロール インターフェイスを初期化します。
- SECM プローブのロード
- 静電気防止パッド、静電放電(ESD)保護プローブスタンド、着用可能な静電気防止手袋、リストストラップを含むESDフィールドサービスパッケージを準備します(図5A)。図5Bは、ESDモニタとリストストラップの接続を示しています。
メモ:赤いパッドが地面に接続されると、ESDモニタがビープ音を鳴らします。ユーザーがリストストラップを着用するとビープ音が鳴ります。 - AFM スキャナが液体に曝されないようにするには、AFM-SECM テスト中に保護ブート (図 6A)を使用します。プローブホルダーをESD保護プローブスタンド(図6B)に置きます。プラスチック製のピンセットを使用して、保護ブーツを先端ホルダーに取り付けます(図6C)。次に、 図 6Dに示すように、保護ブートの小さなカットをプローブホルダーのノッチに合わせます。
- 先端のツイーザー(緑色)を使用してAFM-SECMプローブの箱(図7A)を開き、プローブを溝の両側からつかみます(図7B)。ディスク・グリッパー(銀色)を使用してプローブ・ホルダーをスタンドに保持しながら、プローブ・ワイヤーをスタンドの穴に入れ、プローブをプローブホルダーのスロットにスライドさせます(図7C)。プローブがスロットの内側に入ったら、トゥイーザーの平らな端を使用して押し込みます。プローブが完全に先端ホルダーに入っていることを確認します(図7D)。
- 図 8Aに示すように、プローブホルダ全体(ホルダー・ブートを含む)をスキャナーに取り付けます。
- Teflon チップのトゥイザーを使用して、銅リングのすぐ下のワイヤをつかんでモジュールに接続します(図8B)。
- スキャナーを鳩尾に戻します。
- 静電気防止パッド、静電放電(ESD)保護プローブスタンド、着用可能な静電気防止手袋、リストストラップを含むESDフィールドサービスパッケージを準備します(図5A)。図5Bは、ESDモニタとリストストラップの接続を示しています。
- サンプルセルのロード
- ECサンプルセル内に試験サンプル(または基板)を組み立てた後、SECMチャックと疑似参照電極(Ag線)の中心点にECサンプルセルを配置し、反極(Pt線)をバネコネクタブロックに接続します(図3)。ECサンプルセルは、チャックに磁気的に取り付けられています。
- イメージング前の SECM ソフトウェアの準備
- AFM-SECM ソフトウェアで、SECM- ピークフォース QNM を選択してワークスペースをロードします (図 S2)。
- [設定]で、SECM プローブをロードし、アライメント ステーションを使用して先端にレーザーを位置合わせします。
- ナビゲーション(図 S3)に移動します。サンプル表面に焦点を合わせるには、スキャナーをゆっくりと下に移動します。ECサンプルセルの位置を少し調整して、スキャナーが移動中にECサンプルセルのガラスカバーに触れないようにします。サンプルに焦点を当てた後、[ブラインド エンゲージポジションの更新] をクリックします。
注意: サンプルの高さは異なるので、サンプルを変更した後にブラインドエンゲージ位置を更新する必要があります。 - [ 移動]をクリックして流体位置を追加します。
- 溶液のレベルがガラスカバーよりも低いことを確認するために、バッファー溶液の〜1.8 mLをECサンプルセルに加えます。水位がガラスカバーの上にある場合、水がスキャナーに忍び寄り、電気ショートを引き起こし、スキャナを壊す可能性があります。さらに5分間待ち、ピペットを使用して溶液を攪拌して気泡を取り除きます。
注:バッファ溶液(10 mM [Ru(NH3)6]0.1 M KClの支持電解質を備えた3+)は、準備後に常に冷蔵庫に保管する必要があります。フィルター付きのシリンジ(1 μm以下の孔径)を使用して、使用する前に溶液をフィルターします。 - [ ブラインド エンゲージポジションに移動] をクリックします。ヒントはバッファソリューションに戻ります。レーザーを少し調整して、レーザーが先端に揃っていることを確認します。
- CHIソフトウェアを開きます。 図 S4に示すように、ツール バーの [テクニック ] コマンドをクリックして技術セレクタを開き、[ 回路ポテンシャル – 時間を開く] を選択します。OCP測定にはデフォルト設定(実行時間を400s)にしてOCP測定を実行します。
メモ: OCP テストで示された可能性は、安定してゼロに近いはずです。 - 図 S5 および図 S6に示すように、もう一度テクニックコマンドをクリックし、循環ボルタンメトリー (CV)を実行します。
注: 次のようにパラメータを設定します。必要に応じて、「スイープ セグメント」を大きな数値に設定します。「init E/Final E」は、OCP測定の電位値と同じにする必要があり、「高E」と「低E」はそれぞれ「init E/Final E」の+0.3 Vまたは−0.3Vである可能性があります。ここでは、初期および高いEと-0.4 Vとして0 Vを使用し、低および最終Eとして使用します。スキャン速度は0.05 V/sで、感度は1 e-009でした。CVテストを実行し、ここで測定した最高電流(i)は10 mMの0.3-1.2 nAである必要があります[Ru(NH3)6]3+。
- セクラムイメージング
- AFM-SECM ソフトウェアに戻ります。チップは既に液体の中にあるので 、[Engage]をクリックします。
- スキャン後、リフト高さが100nmのリフトモード(リフト・バイ・センサー)をオンにし、サンプルの粗さに基づいてリフト高さを調整します。
- CHIソフトウェアでは、 図S7に示すパラメータを使用してクロノランペロメトリーを実行します。初期Eを-0.4 V、パルス幅を1000秒(システムで受け入れる最大数)に設定し、CVスキャンで感度を同じにします。
注:クロノアンペロメトリー法は、提示されたバイポテンショスタットにアンペロメトリックi-t技術がないために選択されました。 - CHIプログラムを実行している状態で、AFM-SECMソフトウェアに戻り、ストリップチャートのリアルタイム読み取りを確認し、 スタート (図S8)をクリックします。読み取りはリアルタイムで更新されます。その後、地形イメージングと現在のイメージングプロセスの両方が開始されます。AFM-SECM ソフトウェアに画像を保存します。
- アプローチ曲線の確認
- サンプルまたは基板領域にチップを1μmのスキャンサイズでかき合います。
- 3.5.3 で述べたように クロノランペロメトリー を実行します。
- AFM-SECM ソフトウェアに戻り、コマンド「 ランプへ移動」を選択します。
- [ ランプ] をクリックします。アプローチ曲線はAFM-SECMソフトウェアに記録されます。
- チップクリーニング
- ECサンプルセルをきれいな水容器として使用する。ナビゲーションパネルのブラインドエンゲージ機能を使用して、チップを液体の中および外に移動します。きれいな水を3回交換します。この3回の洗浄の後、クリーンワイプを使用してプローブホルダーから残った水を慎重に取り除き、プローブをプローブボックスに戻します。
注意: イメージング後、AFM-SECM プローブは慎重に洗浄する必要があります。静電気がプローブを損傷する可能性があるため、洗浄ボトルから出てくる水を使用してプローブを清掃しないでください。
- ECサンプルセルをきれいな水容器として使用する。ナビゲーションパネルのブラインドエンゲージ機能を使用して、チップを液体の中および外に移動します。きれいな水を3回交換します。この3回の洗浄の後、クリーンワイプを使用してプローブホルダーから残った水を慎重に取り除き、プローブをプローブボックスに戻します。
結果
AFM-SECMによるONBの地形と現在のイメージング
AFMを有するNBsを特徴付けた以前の研究では、固体基板56,57に固定化されたNBのサイズと分布を明らかにするために、地形画像のみを報告した。ここでの実験は、形態学的および電気化学的情報の両方を明らかにした。図9では、個々の酸素ナノバブル(ONB)を明確に識別でき、これは、先端の現在のマッピングまたは情報と同様に、地形を提供します。チップ電流は図9Cに示すように、-0.4Vのバイアス電位下で先端の[Ru(NH3)6]3+に減少した[Ru(NH 3)6]3+の酸化還元反応によって生成された。 地形と現在の画像の比較は、NBの位置と現在のスポットとの良好な相関関係を示しています。この結果は、OnBがバルク溶液から先端領域58への[Ru(NH 3)6]3+の拡散および質量移動を促進し、AFM-SECMチップがNBs59を介してスキャンしたときに(6 pAの基板背景電流に対して)より高い電流をもたらすことを確認した。
AFM-SECMによるCu2O NPの地形と現在のイメージング
Cu2Oナノ粒子の地形と現在の画像を図10に示します。チップ電流は図10Cに示すように、-0.4Vの可能性を有する先端でも減少する[Ru(NH3)6]3+の酸化還元反応により発生した。ナノ粒子の大きさは約500〜1000nmである。提示された地形画像を、1次平坦化処理で処理した。AFMによって決定される粒子サイズは、SEM画像から得られたものと同等である。長さ又は幅は、先端畳み込み効果によりナノ粒子の高さ(約500nm)よりわずかに大きく、有限サイズのAFM先端60によって物体寸法の過大評価を引き起こすAFMイメージングプロセスにおける周知のアーティファクトである。本研究では、Cu2Oナノ粒子が鋭い八面体形状を有するので、AFM先端が急な側壁と底部に触れることができない可能性があり、この畳み込み効果は、表面61の多くの横広がりに対応できる。図10Bは、地形画像に見えるナノ粒子が、現在の画像における明らかな電流「スポット」と関連していることを示し、一方、バックグラウンド電流(〜10pA)は平坦シリコン基板に対応する。
Cu2O NP の CV とアプローチ曲線
図11Aは、10mMの1mm離れた基板の先端を有するAFM-SECM先端の5つの代表的CV曲線を示す[Ru(NH3)6)3+3+および0.1M KCl。拡散限界先端電流(〜1.2nA)は時間とともに減少しなかった。図11Aは、50mVs−1としてスキャンレートでのCV曲線を示し、これは−0.4V対Ag/AgClのバイアス電位が[Ru(NH3)6)6]3+の還元反応による最大高原先端電流に至ったのを確認する。
図11Bは、先端がサンプル表面に向かって移動する時の先端電流の変化を示す。AFM-SECM先端は、接点62,63の結果として物理的な先端基板接点または曲げを示す設定点(本作業では5nN)に達するまで、基板表面をZ方向に接近した。プロット上の電流はi0(i 0=3.385 nA)に正規化され、チップがサンプル表面の1μm上にあるときに測定される先端電流として定義されます。先端は10 mM [Ru(NH3)6]3+および0.1 M KClを含む電解質中の−0.4 V対Ag/AgClで偏っていた。正規化された先端電流は、チップサンプル距離の減少に伴って増加しました。<8nmでは、先端がナノ粒子表面に接触し、正規化された先端電流が急激に増加し、負に帯電したSi表面が[Ru(NH 3)6]の局所濃度を上昇させるためか、表面付近に3+が増加した。
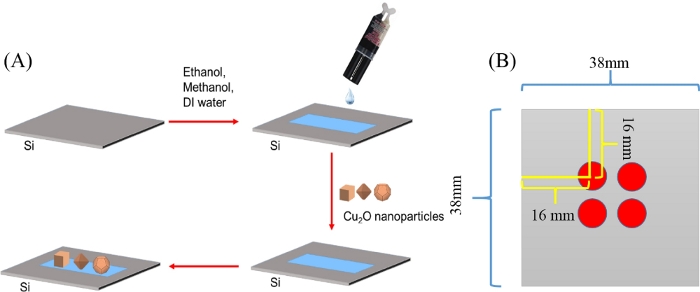
図1:シリコンウエハ上のCu2Oナノ粒子の析出。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:AFM-SECMシステムの概略図この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:SECMチャックおよびその他の付属品の取り付け手順この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:ECサンプルセルの集合体手順この図の大きなバージョンを表示するには、ここをクリックしてください。
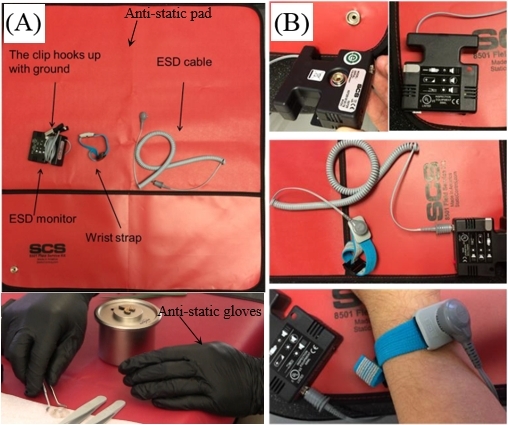
図 5: ESD フィールド サービス パッケージ
(A)ESD保護部品の部品;(B)ESDモニター、リストストラップ、アース線の接続。この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:プローブホルダーへの保護ブートの取り付け手順この図の大きなバージョンを表示するには、ここをクリックしてください。

図 7: SECM プローブをプローブホルダーにロードする。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 8: SECM プローブ
(A) プローブホルダーブートアセンブリをスキャナーに接続します。(B) プローブの歪み解放モジュールへの接続。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図9:10mM[Ru(NH 3)6]3+および0.1M KClを含む電解質中の酸素NBの同時に取得したトポグラフィー(A)と先端電流(B)画像。
先端(端部先端半径は25nm)は-0.4Vでバイアスした。(C) NBsのAFM-SECM測定の模式図 この図の大きなバージョンを表示するには、ここをクリックしてください。
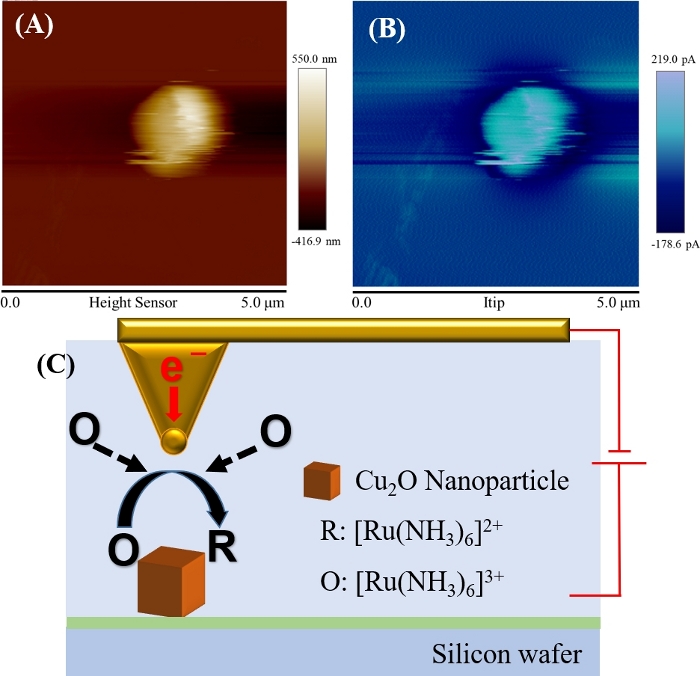
図10:10mM[Ru(NH 3)6]3+および0.1M KClを含む電解質中のCu2Oナノ粒子のトポグラフィー(A)と先端電流(B)画像を同時に取得した。
先端(先端半径は25nm)は、NPsのAFM-SECM測定の-0.4V(C)模式図でバイアスされました 。

図 11: Cu2O NP の CV およびアプローチ曲線
(A) Cu2Oナノ粒子表面におけるナノ電極プローブのアプローチ曲線を10mM[Ru(NH3)6)6]3+および0.1 M KCl.この図の大きなバージョンを表示するには、ここをクリックしてください。
| 反応 | E0 / V | 濃度 | 適用可能ポテンシャル | 参照 |
| 2H+ + 2e- | 0 | |||
| [Ru(NH3)6]3 + e- | 0.10 (NHE) | 10mM | -0.4 V (Ag/AgCl) | 1 |
| 2NO2- + 3H2O + 4e- | 0.15(NHE) | 0.1 M | +0.95V (Ag/AgCl) | 2 |
| [Fe(CN)6]3- + e- | 0.358(NHE) | 2~5mM | +0.0 ~ 0.5V(Ag/AgCl) | 3 |
| ClO4- + H2O + 2e- | 0.36(NHE) | 0.1~1 M | +0.30 V(SCE) | 4 |
| [イルクル6]3- + 3e- | 0.77(NHE) | 10mM | +1.0 V(Ag/AgCl) | 5 |
| SO42-+ H2O + 2e- | -0.93 (NHE) | 10mM | -0.45 V(Ag/AgCl) | 6 |
| AgCl + e- | 0.22233(NHE) | |||
|
参照: 1. 江、J.らPt/p-SiおよびPt/p+-Si電極のナノ電気およびナノ電気化学的イメージング。ケムサスケム。10 (22), 4657-4663, (2017). 2. イスキエルド, J., アイファート, A., クランツ, C. & ソート, R.M.原子間力と走査電気化学顕微鏡を用いた受動酸化鉄層におけるピット核形成と成長の現場でのモニタリング。ケムエレクトロケム。2 (11), 1847-1856, (2015). 3. ジョーンズ, C. E. アンウィン, P. R. & マクファーソン, J. V.結合走査電気化学原子間力顕微鏡法(SECM-AFM)を用いた水溶液中の方解の切断面からの溶解に関与する表面プロセスの所見で。ケムフィスケム。4 (2), 139-146, (2003). 4. アン、 A., カンブリル, E., チョビン, A., Demaille, C. & Goyer, C. ナノシステムの地形および機能的イメージングのための先端付きレドックスメディエーターを用いた電気化学原子間力顕微鏡.ACSナノ。3 (10), 2927-2940, (2009). 5. マクファーソン, J. V., ジョーンズ, C. E., バーカー, A. L. & アンウィン, P. R. 単一ナノスケールの毛穴を介した拡散の電気化学的イメージング.分析化学。74 (8), 1841-1848, (2002). 6. イスキエルド, J., アイファート, A., クランツ, C. & ソート, R.M.原子力を用いた酸性塩化物溶液中の銅腐食の研究をその場で、電気化学顕微鏡をスキャンする。エレクトロキミカ・アクタ247 588-599, (2017). | ||||
表1:文献に用いられる酸化還元メディエーターの例
図S1:二ポテンシウスタットとAFMコントローラとの接続を示す写真。こちらをダウンロードしてください。
図 S2: ソフトウェアにピークフォース SECM ワークスペースをロードします。こちらをダウンロードしてください。
図 S3: SECM ワークスペース用のナビゲーション パネルこちらをダウンロードしてください。
図 S4: オープンサーキットのポテンシャル – 時間を実行します。こちらをダウンロードしてください。
図 S5: 循環ボルタンメトリーを実行します。こちらをダウンロードしてください。
図S6:循環ボルタンメトリー測定のパラメータ設定こちらをダウンロードしてください。
図S7:クロノアンペロメトリー測定のパラメータ。こちらをダウンロードしてください。
図 S8: AFM-SECM ソフトウェアでの読み取りを開始します。こちらをダウンロードしてください。
図 S9: アンペロメトリック i-t 技術のパラメータこちらをダウンロードしてください。
ディスカッション
このプロトコルでは、高解像度のマルチモーダルイメージングを可能にするAFM-SECM技術を組み合わせて説明した。この技術により、単一ナノ粒子またはナノバブル上で収集またはマッピングされたSECM電流と同時に地形をマッピングすることができます。実験は市販のプローブを用いて行った。これらのプローブは、電気化学的環境、電気化学的性能、機械的安定性、および多サイクル処理18との化学的適合性を提供するように設計された。しかし、AFM-SECMプローブの安定性と耐久性は、信頼性と高分解能で電気化学情報を測定する上で重要です。その結果、ステップ3.2および3.7で説明されているステップは、静電放電による破壊からAFM-SECM先端を保護するために重要です。特定のプロトコルステップに関する詳細な説明も記載されています。
ステップ3.4.5では、10mM[Ru(NH3)6]3+0.1MKClの支持電解質を有し、提示された試験に使用した。5-10 mMは、良好な電流信号30を得るために文献中の[Ru(NH3)6]3+の一般的に使用される濃度である。AFM-SECM測定で一般的に使用される酸化還元メディエーターの例は、議論に要約されている(表1)。
ステップ3.4.6では、電極の品質と安定性がOCP測定で確認されます。OCPで測定された電位がゼロ近くまたは不安定でない場合は、カウンタおよび疑似参照電極をチェックする必要があります。不安定なOCPの原因として考えられるのは、電極に気泡が付着しているか、液体に浸かっていない電極である可能性があります。
ステップ3.4.8では、ここで言及されている潜在的な範囲は「高E」および「低E」は、CVテストを開始するための安全な選択である「init E/Final E」の+0.3 Vまたは−0.3Vである可能性があります。そして、CV曲線における高原電流に至る電位値に基づいて電位範囲を調整することができる。スキャン速度は0.01 V/sから0.1 V/sの間で変化する可能性があります。より高いスキャンレート属性は高い感性に起因するが、充電電流も増加する。また、高いスキャンレートでボルタンモグラムは歪んだ形状64を提示した。CV テストで「オーバーフロー」が表示されない限り、より高い感度値を選択する必要があります。「オーバーフロー」メッセージが表示された場合は、感度を下げます。
ステップ3.5.2では、イメージングのために、AFM-SECMイメージングプロセスは、通常40〜150nmのリフト高さのリフトスキャンモードを使用して行った。低いリフト高さを選択した場合、サンプル表面にチップがクラッシュする可能性があります。リフトの高さが高すぎると、チップがサンプル表面から遠く離れているため、現在のイメージング解像度が低下する可能性があります。
提示された測定プロトコルのステップ3.5.3では、Ag/Ag/AgClに対して-0.4 V対Ag/AgCl(-0.18V対NHE)が選択され、[Ru(NH3)6]3+の削減を行う。このプローブは[Ru(NH3)6]3+に対して-0.35 ~ -0.5 V 対 Ag ワイヤ擬似参照電極で2+を減らしますが、サンプルは 0 ~ -0.1 V でバイアスされる可能性があります [ Ru(NH3)6]3+再生)。この値はCVスキャンで測定される高原電流に依存する。また、表1に要約した異なるレドックスメディエーターによっても異なります。
また、クロノアンペロメトリー法は、提示されたバイポテンショスタットにアンペロメトリックi-t技術がないために選択された。読者がアンペロメトリック i-t 技術をサポートするバイポテンショスタットを持っている場合、 図 S9に示すように i-t のテクニックを設定できます。実行時間は、AFM-SECMの少なくとも1つの現在のイメージングプロセスに十分であることを確認するために2000秒として選択されました。
また、固体粒子は撮像過程で粒子が剥離しないように基板上に完全に固定化されなければならないので、サンプル調製も非常に重要です。さらに、試料表面の電気化学的または電気的特性(例えば、電極)をスキャンまたはプローブするには、サンプルと基板との結合が電気伝導性を確保する必要がある。サンプル調製方法は、特にナノオブジェクトの特性評価に対して、幅広いアプリケーションに有用で参照可能である必要があります。ただし、サンプルの固定化方法は、特定のサンプル65,66によって異なる場合があります。全体として、AFM-SECMが酸素NBsとCu2Oナノ粒子の高解像度イメージングを可能にすることを実証しました。明らかに、このAFM-SECMプロトコルは界面電気化学分析において重要な役割を果たすと予想され、材料科学、化学、生命科学1、19などの異なる研究分野で幅広い応用が期待される。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、米国科学財団(賞番号:1756444)が、ナノ材料の生物学的および環境インターフェース、USDA国立食品農業研究所、AFRIプロジェクト[2018-07549]、米国環境保護庁がニュージャージー工科大学に授与する支援協定第83945101-0によって資金提供されています。EPAによって正式に審査されていない。この文書に記載されている見解は、著者のものであり、必ずしも機関の見解を反映しているわけではありません。EPAは、本書に記載されている製品や商用サービスを保証するものではありません。著者らはまた、ニュージャージー工科大学の学部研究イノベーションプログラム(URI)フェーズ1とフェーズ2に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Atomic force microsopy | Bruker, CA | Dimenison Icon | |
| Bipotentiostat | CH Instruments, Inc. | CHI 700E | |
| Materials | |||
| Silicon wafer | TED PELLA, Inc. | 16013 | |
| Fresh gold plates | Bruker, CA | model 119-017-307 | |
| PF-SECM-AFM probes | Bruker, CA | 990-050138 | |
| PF-SECM strain-release module | Bruker, CA | 840-012-724 | |
| PF-SECM Probe Holder | Bruker, CA | 900-050121 | |
| PF-SECM Chuck | Bruker, CA | PF-SECM Chuck | |
| PF-SECM O-ring | Bruker, CA | 598-000-106 | |
| PF-SECM cover glass, SECM Cell | Bruker, CA | 900-050137 | |
| EC Cell Assy | Bruker, CA | 932-017-300 | |
| ESD Field Service | Bruker, CA | 490-000-066 | |
| PF-SECM Boot | Bruker, CA | 900-050136 | |
| Spring connector block | Bruker, CA | 900-050524 | |
| PFSECM Tweezers | Bruker, CA | ||
| Cable, SECM Tip module | Bruker, CA | 468-050171 | |
| Ag wire | Bruker, CA | 249-000-056 | |
| Pt wire | Bruker, CA | 248-000-004 | |
| Hard sharp wire | Bruker, CA | TT-ECM10 | |
| Tubular ceramic membrane | Refracton | WFA0.1 | |
| Chemicals | |||
| Copper(II) chloride dihydrate | ACROS Organics | AC315281000 | |
| Sodium Hydroxide | Fisher Chemical | S318-100 | |
| Ascorbic Acid | Fisher Chemical | A61-25 | |
| Epoxy | Loctite | Instant Mix | |
| Potassium Chloride | Fisher Chemical | P217-500 | |
| Hexaammineruthenium(III) chloride | ACROS Organics | AC363342500 |
参考文献
- Shi, X., Qing, W., Marhaba, T., Zhang, W. Atomic Force Microscopy-Scanning Electrochemical Microscopy (AFM-SECM) for Nanoscale Topographical and Electrochemical Characterization: Principles, Applications and Perspectives. Electrochimica Acta. , 135472 (2019).
- Aazam, E. S., Ghoneim, M. M., El-Attar, M. A. Synthesis, characterization, electrochemical behavior, and biological activity of bisazomethine dye derived from 2, 3-diaminomaleonitrile and 2-hydroxy-1-naphthaldehyde and its zinc complex. Journal of Coordination Chemistry. 64 (14), 2506-2520 (2011).
- Shukla, A., Sampath, S., Vijayamohanan, K. Electrochemical supercapacitors: Energy storage beyond batteries. Current science. 79 (12), 1656-1661 (2000).
- Kötz, R., Carlen, M. Principles and applications of electrochemical capacitors. Electrochimica Acta. 45 (15-16), 2483-2498 (2000).
- Botte, G. G. Electrochemical manufacturing in the chemical industry. The Electrochemical Society Interface. 23 (3), 49-55 (2014).
- Kongsricharoern, N., Polprasert, C. Electrochemical precipitation of chromium (Cr6+) from an electroplating wastewater. Water Science and Technology. 31 (9), 109-117 (1995).
- Datta, M., Landolt, D. Fundamental aspects and applications of electrochemical microfabrication. Electrochimica Acta. 45 (15-16), 2535-2558 (2000).
- Wang, S., George, K., Nesic, S. High pressure CO2 corrosion electrochemistry and the effect of acetic acid. Corrosion/2004. 4375, (2004).
- Song, G. L. . Corrosion of Magnesium alloys. , 3-65 (2011).
- Bellezze, T., Giuliani, G., Viceré, A., Roventi, G. Study of stainless steels corrosion in a strong acid mixture. Part 2: anodic selective dissolution, weight loss and electrochemical impedance spectroscopy tests. Corrosion Science. 130, 12-21 (2018).
- Ehsani, A., et al. Evaluation of Thymus vulgaris plant extract as an eco-friendly corrosion inhibitor for stainless steel 304 in acidic solution by means of electrochemical impedance spectroscopy, electrochemical noise analysis and density functional theory. Journal of Colloid and Interface Science. 490, 444-451 (2017).
- Cui, Z. H., Guo, X. X., Li, H. Equilibrium voltage and overpotential variation of nonaqueous Li-O2 batteries using the galvanostatic intermittent titration technique. Energy & Environmental Science. 8 (1), 182-187 (2015).
- Elgrishi, N., et al. A Practical Beginner's Guide to Cyclic Voltammetry. Journal of Chemical Education. 95 (2), 197-206 (2018).
- Amemiya, S., Bard, A. J., Fan, F. R. F., Mirkin, M. V., Unwin, P. R. Scanning Electrochemical Microscopy. Annual Review of Analytical Chemistry. 1 (1), 95-131 (2008).
- Mirkin, M. V., Nogala, W., Velmurugan, J., Wang, Y. Scanning electrochemical microscopy in the 21st century. Update 1: five years after. Physical Chemistry Chemical Physics. 13 (48), 21196-21212 (2011).
- Bard, A. J., Fan, F. R. F., Kwak, J., Lev, O. Scanning electrochemical microscopy. Introduction and principles. Analytical Chemistry. 61 (2), 132-138 (1989).
- Engstrom, R. C., Pharr, C. M. Scanning electrochemical microscopy. Analytical Chemistry. 61 (19), 1099-1104 (1989).
- Nellist, M. R., et al. Atomic force microscopy with nanoelectrode tips for high resolution electrochemical, nanoadhesion and nanoelectrical imaging. Nanotechnology. 28 (9), 095711 (2017).
- Patel, A. N., Kranz, C. (Multi) functional atomic force microscopy imaging. Annual Review of Analytical Chemistry. 11, 329-350 (2018).
- Ufheil, J., Heß, C., Borgwarth, K., Heinze, J. Nanostructuring and nanoanalysis by scanning electrochemical microscopy (SECM). Physical Chemistry Chemical Physics. 7 (17), 3185-3190 (2005).
- Bergner, S., Wegener, J., Matysik, F. M. Simultaneous imaging and chemical attack of a single living cell within a confluent cell monolayer by means of scanning electrochemical microscopy. Analytical Chemistry. 83 (1), 169-174 (2011).
- Hu, K., et al. Platinized carbon nanoelectrodes as potentiometric and amperometric SECM probes. Journal of Solid State Electrochemistry. 17 (12), 2971-2977 (2013).
- Kranz, C. Recent advancements in nanoelectrodes and nanopipettes used in combined scanning electrochemical microscopy techniques. Analyst. 139 (2), 336-352 (2014).
- Morris, C. A., Chen, C. C., Baker, L. A. Transport of redox probes through single pores measured by scanning electrochemical-scanning ion conductance microscopy (SECM-SICM). Analyst. 137 (13), 2933-2938 (2012).
- Ludwig, M., Kranz, C., Schuhmann, W., Gaub, H. E. Topography feedback mechanism for the scanning electrochemical microscope based on hydrodynamic forces between tip and sample. Review of Scientific Instruments. 66 (4), 2857-2860 (1995).
- Eckhard, K., Schuhmann, W. Alternating current techniques in scanning electrochemical microscopy (AC-SECM). Analyst. 133 (11), 1486-1497 (2008).
- Macpherson, J. V., Unwin, P. R., Hillier, A. C., Bard, A. J. In-situ imaging of ionic crystal dissolution using an integrated electrochemical/AFM probe. Journal of the American Chemical Society. 118 (27), 6445-6452 (1996).
- Huang, K., Anne, A., Bahri, M. A., Demaille, C. Probing Individual Redox PEGylated Gold Nanoparticles by Electrochemical-Atomic Force Microscopy. ACS Nano. 7 (5), 4151-4163 (2013).
- Chennit, K., et al. Electrochemical Imaging of Dense Molecular Nanoarrays. Analytical Chemistry. 89 (20), 11061-11069 (2017).
- Jiang, J., et al. Nanoelectrical and Nanoelectrochemical Imaging of Pt/p-Si and Pt/p+-Si Electrodes. ChemSusChem. 10 (22), 4657-4663 (2017).
- Knittel, P., Mizaikoff, B., Kranz, C. Simultaneous nanomechanical and electrochemical mapping: combining peak force tapping atomic force microscopy with scanning electrochemical microscopy. Analytical Chemistry. 88 (12), 6174-6178 (2016).
- Quist, A. P., et al. Atomic force microscopy imaging and electrical recording of lipid bilayers supported over microfabricated silicon chip nanopores: Lab-on-a-chip system for lipid membranes and ion channels. Langmuir. 23 (3), 1375-1380 (2007).
- Cohen, H., et al. Electrical characterization of self-assembled single- and double-stranded DNA monolayers using conductive AFM. Faraday Discussions. 131, 367-376 (2006).
- Chung, J. W., et al. Single-crystalline organic nanowires with large mobility and strong fluorescence emission: a conductive-AFM and space-charge-limited-current study. Journal of Materials Chemistry. 19 (33), 5920-5925 (2009).
- Guo, D. Z., Hou, S. M., Zhang, G. M., Xue, Z. Q. Conductance fluctuation and degeneracy in nanocontact between a conductive AFM tip and a granular surface under small-load conditions. Applied Surface Science. 252 (14), 5149-5157 (2006).
- Rocca, E., Bertrand, G., Rapin, C., Labrune, J. C. Inhibition of copper aqueous corrosion by non-toxic linear sodium heptanoate: mechanism and ECAFM study. Journal of Electroanalytical Chemistry. 503 (1), 133-140 (2001).
- Toma, F. M., et al. Mechanistic insights into chemical and photochemical transformations of bismuth vanadate photoanodes. Nature Communications. 7, 12012 (2016).
- Kouzeki, T., Tatezono, S., Yanagi, H. Electrochromism of Orientation-Controlled Naphthalocyanine Thin Films. The Journal of Physical Chemistry. 100 (51), 20097-20102 (1996).
- Yamaguchi, Y., Shiota, M., Nakayama, Y., Hirai, N., Hara, S. Combined in situ EC-AFM and CV measurement study on lead electrode for lead-acid batteries. Journal of Power Sources. 93 (1), 104-111 (2001).
- Comstock, D. J., Elam, J. W., Pellin, M. J., Hersam, M. C. Integrated Ultramicroelectrode-Nanopipet Probe for Concurrent Scanning Electrochemical Microscopy and Scanning Ion Conductance Microscopy. Analytical Chemistry. 82 (4), 1270-1276 (2010).
- Ebejer, N., Schnippering, M., Colburn, A. W., Edwards, M. A., Unwin, P. R. Localized High Resolution Electrochemistry and Multifunctional Imaging: Scanning Electrochemical Cell Microscopy. Analytical Chemistry. 82 (22), 9141-9145 (2010).
- Ebejer, N., et al. Scanning Electrochemical Cell Microscopy: A Versatile Technique for Nanoscale Electrochemistry and Functional Imaging. Annual Review of Analytical Chemistry. 6 (1), 329-351 (2013).
- Alheshibri, M., Qian, J., Jehannin, M., Craig, V. S. A history of nanobubbles. Langmuir. 32 (43), 11086-11100 (2016).
- Liu, G., Wu, Z., Craig, V. S. Cleaning of protein-coated surfaces using nanobubbles: an investigation using a quartz crystal microbalance. The Journal of Physical Chemistry C. 112 (43), 16748-16753 (2008).
- Ghadimkhani, A., Zhang, W., Marhaba, T. Ceramic membrane defouling (cleaning) by air Nano Bubbles. Chemosphere. 146, 379-384 (2016).
- Uchida, T., et al. Transmission electron microscopic observations of nanobubbles and their capture of impurities in wastewater. Nanoscale Research Letters. 6 (1), 1 (2011).
- Ushikubo, F. Y., et al. Evidence of the existence and the stability of nano-bubbles in water. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 361 (1-3), 31-37 (2010).
- Bowley, W. W., Hammond, G. L. Controlling factors for oxygen transfer through bubbles. Industrial, Engineering Chemistry Process Design and Development. 17 (1), 2-8 (1978).
- Li, P., Takahashi, M., Chiba, K. Enhanced free-radical generation by shrinking microbubbles using a copper catalyst. Chemosphere. 77 (8), 1157-1160 (2009).
- Takahashi, M., et al. Effect of shrinking microbubble on gas hydrate formation. The Journal of Physical Chemistry B. 107 (10), 2171-2173 (2003).
- Takahashi, M., Chiba, K., Li, P. Free-radical generation from collapsing microbubbles in the absence of a dynamic stimulus. The Journal of Physical Chemistry B. 111 (6), 1343-1347 (2007).
- Ahmed, A. K. A., et al. Influences of air, oxygen, nitrogen, and carbon dioxide nanobubbles on seed germination and plant growth. Journal of Agricultural and Food Chemistry. 66 (20), 5117-5124 (2018).
- Zhang, D. F., et al. Delicate control of crystallographic facet-oriented Cu 2 O nanocrystals and the correlated adsorption ability. Journal of Materials Chemistry. 19 (29), 5220-5225 (2009).
- Khaled Abdella Ahmed, A., et al. Colloidal Properties of Air, Oxygen, and Nitrogen Nanobubbles in Water: Effects of Ionic Strength, Natural Organic Matters, and Surfactants. Environmental Engineering Science. , (2017).
- Huang, Z., et al. PeakForce scanning electrochemical microscopy with nanoelectrode probes. Microscopy Today. 24 (6), 18-25 (2016).
- Lou, S. T., et al. Nanobubbles on solid surface imaged by atomic force microscopy. Journal of Vacuum Science, Technology B: Microelectronics and Nanometer Structures Processing, Measurement, and Phenomena. 18 (5), 2573-2575 (2000).
- Borkent, B. M., Dammer, S. M., Schönherr, H., Vancso, G. J., Lohse, D. Superstability of surface nanobubbles. Physical Review Letters. 98 (20), 204502 (2007).
- Agarwal, A., Ng, W. J., Liu, Y. Principle and applications of microbubble and nanobubble technology for water treatment. Chemosphere. 84 (9), 1175-1180 (2011).
- Tasaki, T., Wada, T., Baba, Y., Kukizaki, M. Degradation of surfactants by an integrated nanobubbles/VUV irradiation technique. Industrial & Engineering Chemistry Research. 48 (9), 4237-4244 (2009).
- Fujita, D., Itoh, H., Ichimura, S., Kurosawa, T. Global standardization of scanning probe microscopy. Nanotechnology. 18 (8), 084002 (2007).
- Häßler-Grohne, W., Hüser, D., Johnsen, K. P., Frase, C. G., Bosse, H. Current limitations of SEM and AFM metrology for the characterization of 3D nanostructures. Measurement Science and Technology. 22 (9), 094003 (2011).
- Sakai, K. . Measurement Techniques and Practices of Colloid and Interface Phenomena. , 51-57 (2019).
- Gan, T., Wu, B., Zhou, X., Zhang, G. Ultrahigh resolution, serial fabrication of three dimensionally-patterned protein nanostructures by liquid-mediated non-contact scanning probe lithography. RSC Advances. 6 (55), 50331-50335 (2016).
- Arteaga, J. F., et al. Comparison of the simple cyclic voltammetry (CV) and DPPH assays for the determination of antioxidant capacity of active principles. Molecules. 17 (5), 5126-5138 (2012).
- Moreno-Herrero, F., Colchero, J., Gomez-Herrero, J., Baro, A. Atomic force microscopy contact, tapping, and jumping modes for imaging biological samples in liquids. Physical Review E. 69 (3), 031915 (2004).
- Doktycz, M., et al. AFM imaging of bacteria in liquid media immobilized on gelatin coated mica surfaces. Ultramicroscopy. 97 (1-4), 209-216 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved