Method Article
細針吸引による血管外トリパノノーマ寄生虫の検出
要約
ファインニードル吸引は、細胞が薄い針を使用して病変または器官から得られる技術である。吸引材料は、診断のために顕微鏡下で塗りつぶされ、染色され、検査されるか、分子生物学、サイトメトリーまたはインビトロ分析に使用されます。それは安く、簡単で、速く、最低の外傷を引き起こす。
要約
ファインニードル吸引(FNA)は、医療および獣医の両方のプラクティスに不可欠な日常的な診断手順です。これは、静脈穿刺に使用される通常の針に似た細い針を使用して、触知可能な塊、器官または滲出物(体腔内の流体蓄積)からの細胞および/または微生物の経皮的な吸引で構成される。FNAによって収集された材料は、一般的に非常に細胞細胞であり、取り出された吸引は、その後、塗りつぶされ、空気乾燥、湿った固定、染色され、顕微鏡下で観察されます。臨床文脈では、FNAは適切な治療管理へのガイドとして機能する重要な診断ツールである。それは簡単で、速く、最小限に侵略的であり、実験室および人的資源への限られた投資を要求するので、それは主に国内で、また家畜で獣医の専門家によって広く使用される。動物モデルを用く研究では、FNAは同じ動物で繰り返し行うことができるという利点があり、疾患の過程で腫瘍や臓器/組織からの細胞の収集を通じて縦方向の研究を可能にする。日常的な顕微鏡検査に加えて、取得した材料は、免疫細胞化学、電子顕微鏡、生化学分析、フローサイトメトリー、分子生物学またはインビトロアッセイにも使用できます。FNAは、感染したマウスの生殖腺中の原虫寄生虫トリパノソマブルーサイを同定するために使用され、牛の将来の診断の可能性を開いた。
概要
ファインニードル吸引(FNA)は、ヒトおよび家畜の両方で、癌および非腫瘍性疾患の診断に広く使用されている。この技術は長年にわたって標準化され、多数の教科書1、2に記載されています。
それは主に、空の注射器に取り付けられた薄い針を持つ触知可能な塊、器官または滲出物の触皮的吸引で構成され、質量1、3から細胞または流体を引き出すために負圧を使用する。針は、典型的には22~25G(針内径に対応するゲージ)であり、より大きなボア針(大口径、例えば、21G)の使用は、細胞性を高めるために有用であるが、これは過度の血液汚染を引き起こす可能性がある。針の長さは質量の深さに依存しますが、1または11/2インチは表面質量に一般的に使用されます。注射器は通常5~10mLで、より大きな注射器でより高い真空を達成し、吸引収率を増加させます。触知不能な深い塊は、より長い針と画像ガイダンス(超音波検査)で、吸引することもできます。取り出した吸引は、その後、塗りつぶし、空気乾燥、湿式固定、染色し、顕微鏡下で観察され、診断3を達成することができる(図1)。
これは、触知可能な塊の診断を達成するために、また、リンパ節、甲状腺、前立腺、あるいは外部の男性の生殖構造のような器官のために、主に術前の設定で使用される、シンプルで安価で、痛みのない、最小限の侵襲的な技術です。1.診断ツールであることに加えて、この技術は、他の目的のために細胞の収集に使用することができ、すなわち、細胞遺伝学、電子顕微鏡(図1D)、フローサイトメトリック特性測定4、5 ,6,7, 細胞培養の確立8.臨床実践における一般的な例は、体外受精9のための精子検索である。
吸引は、複数の塗りつぶしを得るために同じ質量で数回繰り返すことができます。不均一な病変の場合には、例えば、固体領域および嚢胞空間は、細胞が各領域から吸引されることが重要である。FNAによって収集された材料は、一般的に非常に細胞細胞であり、ほとんどの場合、組織生検を必要とせずに疾患の診断を可能にします。特殊な汚れ、免疫蛍光。免疫細胞化学(図1D)、および分子技術は、FNAを介して得られたスミアにおいても、例えば、形態単独で認識できない場合に感染性薬剤の同定のために10を行うことができる。FNAに必要な一般的なアプリケーションと機器と備品の概要を表1および2にまとめます。
診断目的での針穿刺の使用に関する最初の報告書は、アラブ医学の初期の文章に記載されていますが、現代の針吸引技術が実装されたのは20世紀初頭です 11.特に、おそらく感染症の診断のためのFNAの使用を示唆する最初の報告は、グリーグとグレーが睡眠病患者からのリンパ節の針吸引を報告した1904年の研究であり、モチルトリパノソーム12を明らかにしました。.著者らは、初期および高度な症例の両方でトリパノソームの存在を報告し、血液汚れで見られるものよりも高密度で、これらはしばしばまれな事象12である。
牛におけるトリパノソーマ症の現在の診断は、血液、リンパまたは免疫診断技術13、14、15における寄生虫の直接観察に依存する。我々は以前に、マウスにおける実験的なトリパノーソーマ感染症において、トリパノソーマ・ブルーセイ(T.brucei)が脂肪組織16および外部男性の生殖構造の一部に顕著な栄養を有することを示した。すなわちエピディミズム17.寄生虫は、これらの組織の間質に多数16で蓄積する。
以下に示すプロトコルは、生きているマウスにおけるFNAの詳細なステップバイステップの技術的手順を説明し、外部の男性生殖構造(精巣、精巣、上体脂肪)に存在するトリパノソームの吸引を目的とし、続いて特定の寄生虫タンパク質(VSG)16,17に対する従来の細胞学および免疫染色。吸引は、適用される感染および安全手順の6日後に行われ、実験動物の日常的な取り扱いのために一般的に確立されたものである。免疫不全(蒸気殺菌ガウン、マスク、ヘアボンネット、滅菌手袋を着用し、常に無菌技術を確保する)を有する動物には、日和見病原体への偶発的な暴露を軽減するための追加の措置が必要です。
プロトコル
このプロトコルのすべての動物実験は、EUの規制に従って行われ、インスティトゥート・デ・メディチナ分子(iMM)の動物倫理委員会(AEC_2011_006_LF_TBrucei_IMM)によって承認されました。iMMの動物施設は、実験動物の使用に関するポルトガルの法律(法令113/2013)に準拠し、欧州指令2010/63/EUおよびFELASA(欧州実験動物科学連盟)のガイドラインに従い、実験動物福祉に関する勧告
1. マウスの外的男性生殖器官からの寄生虫の吸引
注:ファインニードル吸引(FNA)は、野生型の雄C57BL/6Jマウスで行われ、生後6〜10週、前述の16のように2,000μLの生理生理生理生理の下皮注射を通じてT.ブルーシーに感染した。
-
外部男性生殖器官のFNAの場合は、マウスを層流フードに入れ、生理生の75mg/kgケタミン+1mg/kgメデトミジンの混合物の200μLの精外注射で動物を麻酔する。
- つま先ピンチ法で麻酔を確認します。脚の引き込みの反射が存在しない場合は、後部の回復における位置マウス(図2A)。
- 慎重に精巣を触診し、上の皮膚からのサイズと距離を評価します。人差し指と中指の間、または人差し指と親指の間の器官を拘束します。重なった皮膚を質量をしっかりと伸ばし、ターゲットをさらに固定します。アルコール拭きで表面をきれいにします(図2A)。
- 組み立てられた22G針と5 mLの注射器を保持し、針の先端をターゲットに挿入し、常に残りの状態でプランジャーを使用します(図2B-C)。
- 注射器プランジャーを4mLから5mLマーク2~3回引き込むことで吸引を行います。代表的なサンプルの確率を高め、精巣のような小さな構造を標的にするために、臓器内の針を直線またはいくつかの異なる接線に沿ってリダイレクトします。組織の損傷を最小限に抑えるために、この手順が穏やかであることを確認してください (図 2C-D)。
- 吸引を離し、針を引き出します。これは、シリンジのバレルに吸引の吸引につながり、その回復を妨げるので、引き込まれたプランジャーで針を再描画しないでください(図2E)。針の撤退後、穿刺部位で殺菌されたガーゼスポンジで圧力をかけることによって出血を制御する。
- 注射器を針から取り外し、空気で満たし、針を再接続し、針の内容物をスライドにそっと取り出します。飛散を避けるために、針の先端を非常に近くに、あるいはスライド上に置きます(図2F-I)。
- 反復サンプリングを確実にするために、臓器/動物ごとに少なくとも1つの追加の吸引を実行します。
- 生理生理生理中の1mg/kgアティパメゾールの200 μLの皮下注射で麻酔を戻し、回復のために動物を自宅のケージに戻し、完全な回復まで観察する。
2. 吸引材からのスミア製剤
注:手順全体を通して手袋を使用し、針と注射器の安全な処分を確保します。
-
2ステッププル方式
- 非支配的な手を使用して吸引のドロップを持つスライドをピックアップし、親指と人差し指の間に曇った端をつまむ(図3A)。
- 第二のきれいなスライド、スプレッダースライドを、支配的な手でピックアップし、吸引のドロップで最初のスライドを横切ってそれを持って来ます。約30°の角度で落下のちょうど上の標本スライドの上にスライドの滑らかなきれいな端を置きます(図3B)。
- 1つの光、連続的かつ安定した動きでスライドを前方に滑空し、薄膜を得る(図3C)。
- スライドを残し、材料の完全かつ高速な空気乾燥を可能にします(図3D)。ヒートフィックスしないでください。スライドの曇った端に鉛筆でラベルを付けます。
注:プロトコルは、このステップで一時停止することができ、汚れは汚れの準備ができるまで無期限に保存することができます。
3. スミアの染色
注:手順全体を通して手袋を使用し、ステップ 3.1.4 および 3.2.9 がヒュームフード内で実行されていることを確認します。
-
ギムサ染色プロトコル
- 100%メタノールを100%含むコプリン瓶にスライドを5分間浸漬することにより、空気乾燥スミアを修正します(図3E)。
- 20%ギムサ溶液(蒸留水中で1/5に希釈)を含むコプリン瓶にスライドを30分間、または10分間10%ギムサ(図3F)に移します。
- 水道水で洗い流し、ティッシュペーパーを使って十分に乾燥させます。
- スライドを水平に保持し、非水性取り付け媒体を1滴塗布します。カバーガラスの端をスライドの上に置き、下に置き、そっと押して気泡を取り除きます。
-
FNAスミアにおける免疫細胞化学
- 空気乾燥スミアを室温で100%メタノール100%で10分間固定します。
- 1xリン酸バッファー(PBS)でコプリン瓶で5分間スライドを洗い、毎回新鮮な1x PBSを使用してこのステップを3回繰り返します。
- コプリン瓶からスライドを取り外し、スミアに触れずに余分なバッファーを拭き取り、撥水ペンでスミアの周りに円を描きます(材料の表)。
- スライドを水平に保持し、各スミアに希釈された一次抗体溶液の150 μLを適用し、室温で1時間インキュベートします。
注:ここで使用される一次抗体は、非精製ウサギ血清抗T.ブルーゼイVSG13抗原(多くのT.ブルーゼイVSGとのクロス反応性、社内で産生される)であり、1x PBSで1:50,000で希釈した。適切な一次抗体を免疫前血清(材料表)に置き換えることにより、二次抗体の非特異的結合の評価を可能にすることによって陰性対照を行う。 - 1x PBSでコプリン瓶で5分間スライドを洗い、毎回新鮮な1x PBSを使用してこのステップを3回繰り返します。
- スライドを水平に保持し、市販のホースラディッシュペルオキシダーゼ/DAB可視化システムの150 μLを各スミアに適用します。室温で30分間インキュベート(材料の表)。
- 1x PBSで5分間3倍洗います。
- ハリスヘマトキシリンを含むコプリン瓶にスライドを浸すことによってカウンターステイン。水道水で洗い流し、紙を使って十分に乾燥させます。
- スライドを水平に保持し、非水性取り付け媒体を1滴塗布します。カバーガラスの端をスライドの上に置き、下に置き、そっと押して気泡を取り除きます。
結果
FNAは、5mL注射器に結合した22G針を用いてT.bruceiに感染したマウスの外的な男性生殖器官、およびスミア製剤用のガラススライドで行った(図1A-C)。この方法は単純だが最適な結果は、全身麻酔を通じて達成されるマウスの完全な固定化、および手順全体を通して器官の安定化(図2A-B)に依存する。吸引を2〜3回適用し、針は小さい器官および組織の代表的なサンプリングを可能にするために1〜2回リダイレクトされた:精巣不和および精巣脂肪。負圧は、針を外部化する前に放出された。針の内膜およびハブに含まれる吸気(約20μL)を用いて、2つの塗りつぶしを製造するために用いられた(図3A-C)。吸引の放出なしで針が引き抜かれた場合、材料は注射器に吸い込まれ、回収できなかった。このプロセスは、ペアのオルガンごとに1回、2回繰り返すことに成功した。乾燥後、スミアを湿式固定し、トリパノソーム表面タンパク質に対する免疫細胞化学を行った。
良質のスミア(図4A-C)は、宿主細胞が保存された形態学的特徴を示す良好な細胞密度を有する細胞の単層によって特徴付けられ、起源および相対的な組織の同定を可能にした。お互いの比率。寄生虫は効率的に免疫染色され、識別可能で数えきれない(図4B)。感染したマウスにおける胸膜滲出のFNAの1例は、直接観察および診断のためにGiemsaで染色され、また示されている(図3D-Fおよび図4C)。
不良または否定的な FNA 結果は、さまざまな理由が原因である可能性があります: (1) FNA 材料が少なすぎるとスライドに表現され、サンプルの代表的でないです。(2)FNA材料が1枚のスライド上に表現されすぎて、過度に厚い汚れが生じ、細胞学的評価が損なわれ、(3)スミアを作るときにあまりにも多くの力が加えられ、細胞が破壊され、裸の核やDNAストリーク(クラッシュアーティファクト)が多くなります。または(4)スミアを作るときに十分な力が加えられており、細胞が分解しない場合には、細胞の形態学的特徴の評価を妨げる層化層をもたらす(図5)。
FNA細胞病理学と組織病理学を比較すると、すなわち細胞対組織の分析は、細胞形態がより良好に保存され、細胞の相対的な割合と数え方がより良く評価できるという利点があります(図6)。さらに、免疫細胞化学は、通常、ホルマリン固定およびパラフィン埋め込み組織で行われる免疫組織化学よりも簡単で、迅速かつ容易に最適化できます。
| ターゲット | アプリケーション | 利点 | 制限 |
| 触知質量 | 日常的な顕微鏡検査、診断 | シンプルで迅速 | ティッシュアーキテクチャなし |
| 器官 | 免疫組織化学 | 低コスト | 盲目の吸引(針は接線的にターゲットを見逃す可能性があり、吸引は壊死性、嚢胞性または出血領域を標的にすることがある) |
| 胸水 | フローサイトメトリー | 複数のサイトからのサンプリング | |
| 細胞 遺伝 学 | よく保存された細胞形態 | ||
| 電子顕微鏡 | 合併症のない | ||
| PCR、その他の分子技術 | 高い診断精度 | ||
| 生化学分析 | 麻酔(固定化用) | ||
| インビトロアッセイ、細胞培養 | 非端末手順 |
表1:ターゲット、一般的な用途、細かい針吸引の利点および制限。
| FNAキット | 吸引針と注射器の原型 |
| 吸引: | 針の部品: |
| 1. 使い捨てプラスチック注射器(5または10 mL) (図1B) | ベベル針シャフトの先端は、点を形成するために傾斜され、傾斜は斜めである。唯一のベベラ針は、皮下吸引に適しています。 |
| 3.22から25ゲージ(直径)の針。0.75、1.0、1.5インチ、標準のベバベ先端エッジ(図1A) | シャフトその長さが質量の深さに応じて調整されうる針の中空管状部分。針のゲージは、シャフトの内側の直径である穴の直径に対応します(小さな針は、より高いゲージを持っています)。より大きなボア針(22G未満)の使用は、細胞性を高めるために有用であるが、これは過剰なiatrogenic血液汚染を引き起こす可能性がある。 |
| 1. 麻酔(必要に応じて)。FNAに関連する痛みは静脈穿刺の痛みに似ていますが、良好な吸引は、小さな動物や小さな変動病変および器官において特に重要な、被験者の良好な固定化を必要とする。FNAの対象となるラットおよびマウスは、適切に受動的に拘束されるべきであり、または必要に応じて、鎮静または軽い全身麻酔下にあるべきである。 | ハブ注射器に取り付けられている針のプラスチック部分;吸引された材料の視覚化を可能にするために透明にする必要があります。FNAの間に得られた吸引材料は針シャフトで集められ、材料がハブに入るのを見ると吸引が止まる。 |
| FNAスミアの作り方と解釈: | シリンジ部品: |
| 1. 曇った端ガラス顕微鏡スライド (図 1C) | バレル/シリンダー。注射器の中空部分。嚢胞性病変または滲出物を扱わなければ、バレルに吸引された物質は一般に回収できない。FNA細胞学のための吸引の理想的な容積は約5 μLであり、針のシャフトおよびハブを占める吸引の平均容積に相当する。 |
| 2. ロマノフスキー型染色(例:ディフ・キク、ギムサ) | ヒント針ハブが取り付けられているバレルの端。 |
| 3. 顕微鏡(明視野) | プランジャー一方の端に平らなディスクまたは唇を有し、もう一方の端にゴム製シールを有するシリンジの可動部分。バレルにフィットし、細胞、液体を針に引き込む圧力を提供します。良好な負圧を作成する完全に密封されたプランジャーは、良好な吸引収率を得るために義務付けされています。 |
表2:細かい針吸引に必要な機器と備品。
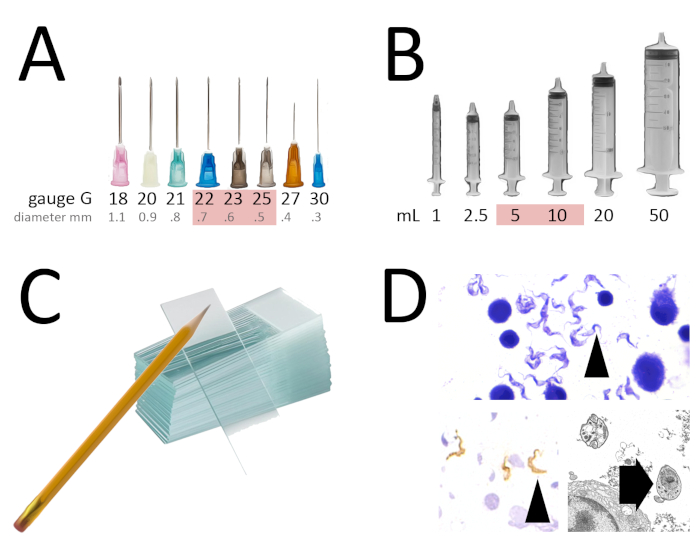
図 1:細かい針の吸引のための用具および結果。(A)FNAのための針の理想的な直径は22から25 G.(B)良好な吸引収率を得るために理想的な注射器容積は5から10 mLである。(C) 鉛筆で書き込み用の曇りマーキング領域を備えたグリースガラススライドを含むクリーン、ドライ、フリー(免疫組織化学の場合)。(D) Giemsa染色(黒い矢印)で観察されたトリパノソームの例、VSG表面タンパク質(白色矢印)および透過電子顕微鏡下(ブロック矢印)に対する免疫染色。この図のより大きなバージョンを表示するには、ここをクリックしてください。
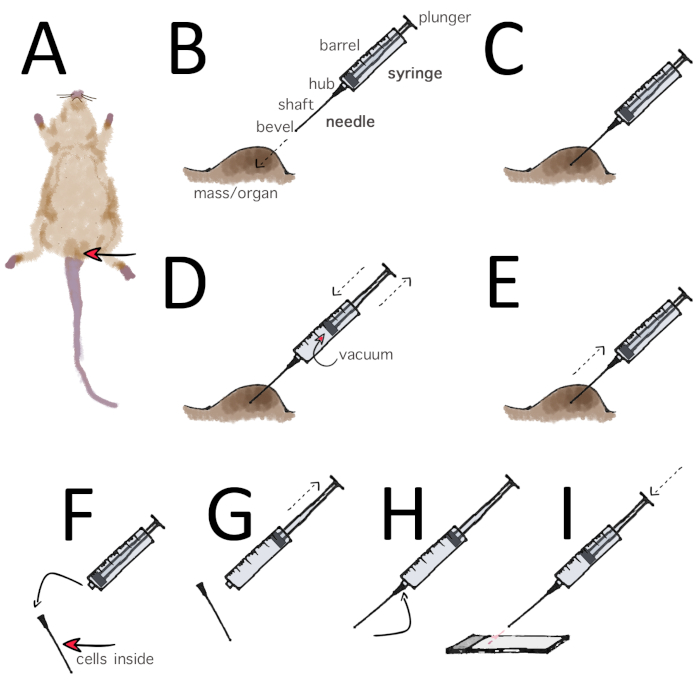
図 2: マウスにおける外的な男性生殖器官(精巣、精巣、上皮脂肪)の微細な針吸引(FNA)を示す回路図。(A) 動物が固定されると、以前に組み立てられた吸引器具が拾い上げられる。(B-C)針の先端をターゲットオルガンに挿入します。(D)シリンジプランジャーを1mLから2mLマークに引き込んで吸引を行い、3~4回繰り返す。針の先端はまた十分な材料を集めるために吸引を加えながらターゲット内で前後に動かすことができる。(E) 吸引を解除し、針を引き出すだけです。(F) 注射器から針を取り出し、(G)プランジャーを引き戻します。(H) 針を取り付け直します。(I) 注射器を素早く突き出して、材料をガラススライドに取り出します。飛散を避けるために、針の先端が非常に近いか、スライド上で休むようにしてください。吸引の滴は、曇ったマーキング領域の端から約1cm置かれています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
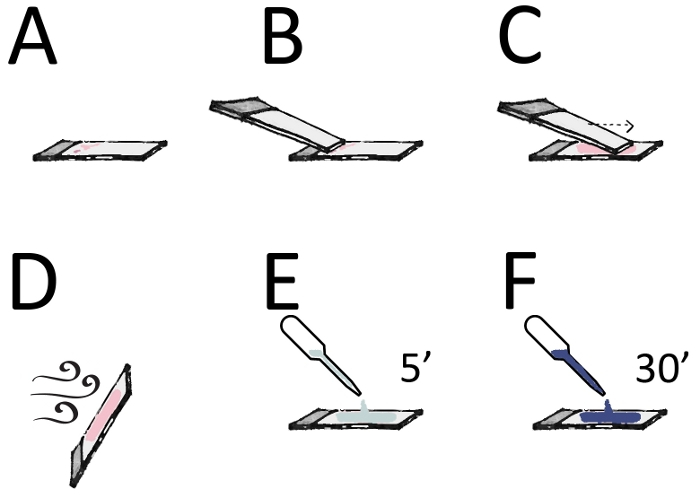
図 3: 汚れの調製と染色.(A) 親指と人差し指の間のスライドの一方の端 (曇った領域) を保持します。(B) 材料の落下物のすぐ前にある標本スライドに、2番目のスライド(拡散機)の滑らかなきれいなエッジを置きます。(C) スプレッドを適度な速度で一度前方にスライドさせて薄膜を得る。(D) スライドを空気乾燥させ、スライドの曇った端に鉛筆でラベルを付けます。(E) メタノールで5分間乾燥した後(F)20%ギムサ溶液で30分間(または10分間10%ギムサ)汚れ。水で軽くすすいで、完全に乾燥させ、キシレンに浸し、不溶性の取り付け剤を取り付けます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
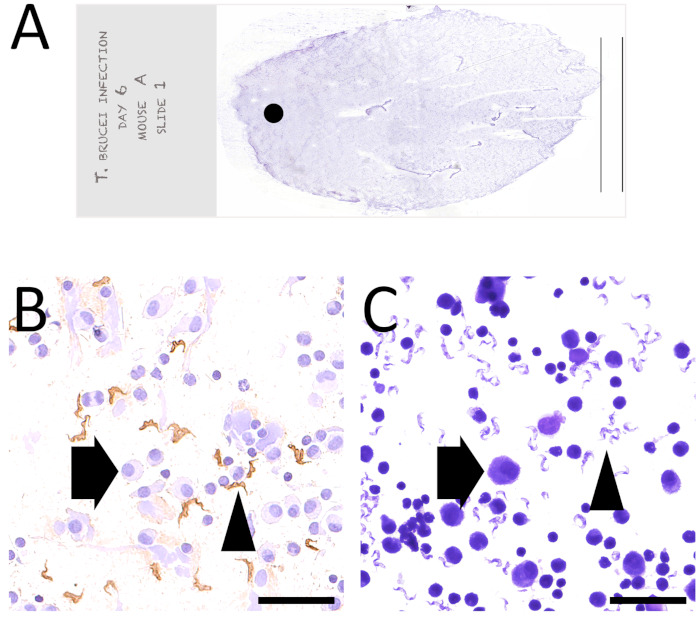
図 4: 感染したマウスにおける外部男性生殖構造のFNAから得られたスミアのマイクロ写真T. ブルーシー(A) 良質の直接スミアの総外観:材料は、曇ったエッジ(黒い点)から約1cm離れたスライド上に表現され、スライドの端(平行線)の前に0.5cmを塗りつぶして停止しました。(B)寄生虫の表面タンパク質(VSG)に対する免疫細胞化学は、感染の6日目に外部男性生殖器官のFNAから得られたスミアについて行った。多数の寄生虫(矢印)がマウス生殖細胞(矢印)と混合して検出された。DABはハリス・ヘマトキシリンと反論した。元の倍率:40x(スケールバー= 50 μm)。(C)感染の21日目に根膜滲出のFNAの後に得られたスミアのギムサ染色は、宿主(マウス)細胞と混合された多数の寄生虫(矢頭)を示し、この場合、炎症細胞、マクロファージ(矢印)およびリンパ球を示した。元の倍率:40x(スケールバー= 50 μm)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 5:質の悪いFNAスミア。(A)細胞汚れが不十分で、質量または器官の代表的でない。(B) 非常に厚い汚れ。(C) 破砕されたアーティファクトは、細胞、裸の核およびDNAストリークを含む。(D) 細胞の集合体および層化された層。DABはハリス・ヘマトキシリンと反論した。元の倍率:20x(スケールバー= 100 μm)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
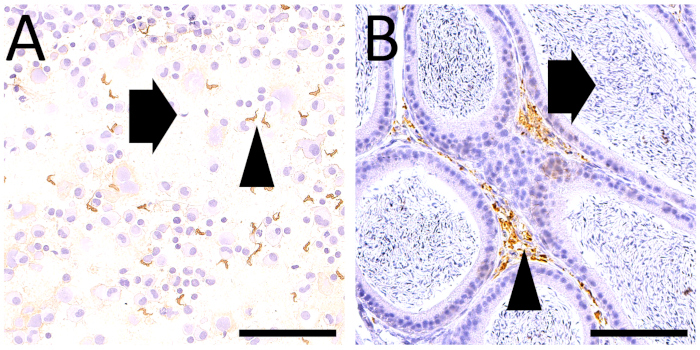
図 6: 感染したマウスにおける精巣細胞学と細胞学の比較T. ブルーシー(A)FNAスミアおよび(B)4μmパラフィン部に対応するマイクロ写真は、同じ倍率(20倍の元倍率、スケールバー=100μm)で、いずれも寄生虫の表面タンパク質(VSG)に対して免疫染色した。スミアは、十分に保存された細胞形態を有する多数の寄生虫(矢頭)を示し、中程度の数の生殖細胞と少数の精子(矢印)と混合した。組織学的セクションは、明体内精子(矢印)を有する精巣管からなる、よく保存された組織構造を示し、精巣性間質間質(矢頭)を拡大する多数の寄生虫の存在を示した。DABはハリス・ヘマトキシリンと反論した。元の倍率:20x(スケールバー= 100 μm)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ファインニードル吸引(FNA)は、ヒトおよび家畜の疾患を診断するために広く使用される方法である。この技術は長年にわたって標準化されてきた1、2、小さな穴の針を利用して、触知可能な質量または器官1、3から細胞または流体を吸引する。吸引体は、通常、ガラススライドに塗りつぶされ、診断を達成するために顕微鏡観察のために染色されますが、この技術は、他の目的のために細胞を取り出すためにも使用することができます 4,5,6 ,7,8,9.
この手順は、マウスあたり迅速(<5分、経験豊富な研究者向け)であり、合併症のリスクは最小限であり、単純な静脈穿刺を受けた場合に発生するリスクと同様です。このため、触知可能な質量のFNAの場合、麻酔は敏感な解剖学的位置のためにのみ必要とされるか、または動物の良好な固定化および吸引される器官または質量の安定化が最適な結果のために非常に重要である場合。これは、小さな実験動物のために頻繁に、片手で小さなげっ歯類の安全かつ効果的な拘束として、他方の手で吸引のための領域への最良のアクセスを確保しながら、麻酔なしで達成することは困難です。短期麻酔は、ほとんどの場合、マウスの良好なFNAのために必要であり、それにもかかわらず必要である。良好な固定化は、病変の細胞成分を代表する吸引を得る可能性を最大化し、負圧が加えられながら針の先端を外部化する可能性を最小限に抑えます。
手順自体は非常に簡単ですが、真空の調整されたアプリケーションとリリースが最も重要なステップです。針の挿入後、シリンジのプランジャーは制御された真空(吸引)を達成するために引き込まれ、プランジャーを手放すことによって負圧を放出した後にのみ針を質量から取り出すことができます(図2)。それ以外の場合、吸引は注射器のバレルに吸い込まれ、その後回復することは非常に困難です。もう一つの非常に重要なステップは、高品質の汚れの調製です。スミアを作る方法はさまじいが、方法にかかわらず、材料をガラスの上に置いた直後にスミアを準備する必要があります。生体材料は、細胞クラッシュアーティファクトを避けるために穏やかに広げる必要があります。カバースリップを拡散機として使用すると、これらのアーティファクトを防ぐことができます。しかし、スミアを作っている間にあまりにも多くの力の適用は、カバースリップを壊します。良質のスミアは、通常、光を容易に透過できるように、単層として分布する細胞集団のほとんどを持っています。細胞材料は、血栓に過度に閉じ込められてはなりません.
FNAの目標は、質量、組織または臓器から細胞を収集することです。より大きなボア針の使用は、細胞性を高めるために有用であるが、より小さな針でサンプリングすると、より少ない豊富な材料が、より高い品質をもたらす一方で、過度の血液汚染に関連付けることができます。我々の場合、T.bruceiに実験的に感染したマウスにおける外皮性男性生殖構造の皮下吸引は、5mL注射器に結合された22ゲージ針で行った。マウスを麻酔し、精巣を片手で安定させ、穿刺と吸引を導き、もう一方の手で行った。生殖細胞、精子、上皮細胞および間質細胞を混合した多数のトリパノソームを回収し、寄生虫の表面タンパク質(VSG)に塗りつぶして免疫染色した(図4)。
特定の病変の複数の領域を複数回サンプリングすることはできますが、これは針先と標的臓器または質量を視覚化しない盲目の吸引であるため、アスピシンには常に潜在的なサンプリング誤差があります。これは、疑わしい病変の負のFNAがさらなる調査を観察しない臨床現場では非常に関連していますが、疾患の動物モデルにはそれほど関連していません。したがって、一般的な制限は、主に偽陰性の結果を含み、より少ない頻度の偽陽性結果(例えば、血液汚染から)が、動物実験の設定における最も重要な制限は、組織に関する情報の欠如であるアーキテクチャ17は、我々がヒスト病理学と同様に、例えば寄生虫の分布パターン、免疫細胞、および細胞間相互作用特徴である。それにもかかわらず、FNAは、同じ動物の時間を超えて繰り返しサンプリングを可能にする非終端手順であり、常により良い保存された細胞形態を可能にするという利点があります(図5)。宿主細胞、免疫細胞またはマウスからの微生物を収穫するためのFNAの代替は、常に目的の質量または器官を収集するためにマウスを安楽死させることに依存しています。
私たちの知る限りでは、小さな実験動物におけるFNAの使用に関する報告はほんのわずかであり、1949年からは、22G針で骨髄の吸引に対応し、18を研究するための骨髄の吸引に対応し、その他すべてのフローサイトメトリーと組み合わせて腫瘍関連炎症細胞または内皮細胞のいずれも定量化7,19,20.我々の研究は、この技術が感染症モデルの診断と研究に拡張することができ、細胞学と免疫細胞化学や電子顕微鏡のような技術を組み合わせることができることを示しています。実験動物における方法の主な利点の2つは、(1)この手順が末端ではない、すなわち、生きたマウスで行うことができる。そして(2)軽度の重症度のために、それは同じ動物の連続的な吸引を可能にする。したがって、各研究に必要なマウスの数が少なく、臨床疾患の進行と疾患および/または微生物の細胞および分子特徴の進化との相関関係が容易に行うことができ、縦方向の研究が可能になります。
おそらく、感染症を診断するためのFNAの使用に関する最初の報告は、1904年のグリーグとグレイによる研究で、睡眠病患者からのリンパ節の針吸引を報告し、モチルトリパノソーム12を明らかにした。実験室のマウスの知見が牛への翻訳、すなわち、トリパノソマが外部の男性の生殖構造からFNAによって容易にサンプリングできれば、この技術が動物の診断に役立つことを期待できる。家畜の農場でトリパノソーマ症。
開示事項
著者は何も開示していない。
謝辞
このプロジェクトは、フンダサン・パラ・ア・シエンシア・エ・テノロジア(FCT)/ミニステリオ・ダ・シエンシア、テクノロジア・エ・エンシノ・スーペリア(MCTES)から、ファンドス・ド・オルサメント・デ・エスタド(ref.:ID/BIM/50005/2019)によって資金提供されました。LMFは、ファンダサン・パラ・ア・シエンシア・エ・テクノロジア(IF/01050/2014)の研究者であり、研究室はERC(FatTryp,ref.771714)によって資金提供されています。この作品の出版はまた、フンダサン・パラ・ア・シエンシア・エ・テノロジア(FCT)/ミニステリオ・ダ・シエンシア、テクノロジア・エ・エンシノ・スーペリア(MCTES)がファンドス・ド・オルサメント・デ・エスタドを通じて資金提供したUID/BIM/50005/2019プロジェクトにも資金を提供しました。私たちは、iMMの組織学と比較病理学研究所のアンドレア・ピントに対し、感染したマウスの組織を共有するためのサンドラ・トリンダーデ、ティアゴ・レベロ、ヘンリク・マチャド(iMM)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Atipamezole (ANTISEDAN 10 mL) | Bio 2 | 7418046 | Anesthesia reversal |
| Cover slips (24 x 60 No.1) | VWR | 631-0664 | Smear making |
| DAB | Dako | K3468 | Immunocytochemistry |
| Entellan (500 mL) | VWR | 1.07961.0500 | Mounting media |
| Envision Flex antibody diluent | Dako | 8006 | Immunocytochemistry |
| EnVision Flex conjugated w/ HRP (anti-rabbit) | Dako | K4010 | Immunocytochemistry |
| Envision Flex Wash Buffer | Dako | K8007 | Immunocytochemistry |
| Giemsa stain | Atom Scientific Ltd | RRSPSS-A | Smear staining |
| Glass slides (Superfrost Plus) | VWR | 631-9483 | Smear making |
| Harris Haematoxylin | Bio-optica | 05-06004E | Immunocytochemistry |
| Hydrogen Peroxidase solution | Sigma | H1009-500ML | Immunocytochemistry |
| Hypodermic needles Microlance 3 (23 G) | Henry Schein | 902-8001 | Aspiration technique |
| Ketamin (IMALGENE 1,000-10 mL) | Bio 2 | 7410928 | Anesthesia |
| Medetomidine (DOMITOR 10 mL) | Bio 2 | 7418335 | Anesthesia |
| Methanol | Merck | 1.06009.2511 | Smear fixative |
| Pap pen | Merck | Z377821-1EA | Immunocytochemistry |
| Protein Block Serum free | Dako | X0909 | Immunocytochemistry |
| Syringes (5 mL, 10 mL) | Henry Schein | 900-3311, 900-3304 | Aspiration technique |
参考文献
- Leopold, G., Koss, M. R. M. . Koss’ Diagnostic cytology and it’s histologic bases. , (2006).
- Raskin, R. E., Meyer, D. J. . Canine and Feline Cytology: a Color Atlas and Interpretation Guide. Canine and Feline Cytology. , (2016).
- Hopper, K. D., Abendroth, C. S., Sturtz, K. W., Matthews, Y. L., Shirk, S. J. Fine-needle aspiration biopsy for cytopathologic analysis: Utility of syringe handles, automated guns, and the nonsuction method. Radiology. 185 (3), 819-824 (1992).
- Saliba, A. E., et al. Microfluidic sorting and multimodal typing of cancer cells in self-assembled magnetic arrays. Proceedings of the National Academy of Sciences, U.S.A. 107 (33), 14524-14529 (2010).
- Guzera, M., Cian, F., Leo, C., Winnicka, A., Archer, J. The use of flow cytometry for immunophenotyping lymphoproliferative disorders in cats: a retrospective study of 19 cases. Veterinary and Comparative Oncology. 14, 40-51 (2016).
- Young, N. A., Al-Saleem, T. I., Ehya, H., Smith, M. R. Utilization of fine-needle aspiration cytology and flow cytometry in the diagnosis and subclassification of primary and recurrent lymphoma. Cancer. 40 (4), 307-319 (1998).
- Carroll, C. S. E., Altin, J. G., Neeman, T., Fahrer, A. M. Repeated fine-needle aspiration of solid tumours in mice allows the identification of multiple infiltrating immune cell types. Journal of Immunological Methods. 425, 102-107 (2015).
- Araujo, R. W., Paiva, V., Gartner, F., Amendoeira, I., Martinez Oliveira, J., Schmitt, F. C. Fine needle aspiration as a tool to establish primary human breast cancer cultures in vitro. Acta Cytologica. 43 (6), 985-990 (1999).
- Craft, I., et al. Percutaneous epididymal sperm aspiration and intracytoplasmic sperm injection in the management of infertility due to obstructive azoospermia. Fertility and Sterility. 63 (5), 1038-1042 (1995).
- Powers, C. N. Diagnosis of infectious diseases: A cytopathologist’s perspective. Clinical Microbiology Reviews. 120 (3), 351-367 (1998).
- Diamantis, A., Magiorkinis, E., Koutselini, H. Fine-needle aspiration (FNA) biopsy: Historical aspects. Folia Histochemica et Cytobiologica. 47 (2), 191-197 (2009).
- Greig, E. D. W., Gray, A. C. H. Note on the lymphatic glands in sleeping sickness. British Medical Journal. 1 (2265), 1252 (1904).
- Robson, J., Ashkar, T. S. Trypanosomiasis in domestic livestock in the Lambwe Valley area and a field evaluation of various diagnostic techniques. Bulletin of the World Health Organization. 47 (6), 727-734 (1972).
- Disease, T. African Animal Trypanosomiasis. In Vitro. , 1-15 (2009).
- Kennedy, P. G. E. Clinical features, diagnosis, and treatment of human African trypanosomiasis (sleeping sickness). Lancet Neurology. 12 (2), 186-194 (2012).
- Trindade, S., et al. Trypanosoma brucei parasites occupy and functionally adapt to the adipose tissue in mice. Cell Host and Microbe. 19 (6), 837-848 (2016).
- Carvalho, T., Trindade, S., Pimenta, S., Santos, A. B., Rijo-Ferreira, F., Figueiredo, L. M. Trypanosoma bruceitriggers a marked immune response in male reproductive organs. PLoS Neglected Tropical Diseases. 12 (8), 1-15 (2018).
- Sundberg, R. D., Hodgson, R. E. Aspiration of bone marrow in laboratory animals. Blood. 4 (5), 557-561 (2013).
- Sottnik, J. L., Guth, A. M., Mitchell, L. A., Dow, S. W. Minimally invasive assessment of tumor angiogenesis by fine needle aspiration and flow cytometry. Angiogenesis. 13 (3), 251-258 (2010).
- Betka, J., Hovorka, O., Boucek, J., Ulbrich, K., Etrych, T., Rihova, B. Fine needle aspiration biopsy proves increased T-lymphocyte proliferation in tumor and decreased metastatic infiltration after treatment with doxorubicin bound to PHPMA copolymer carrier. Journal of Drug Targeting. 21 (7), 648-661 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved