Method Article
体外タウ蛋白と創薬スクリーニングの集計を勉強するための試金
要約
本稿で説明したタウ凝集アッセイは、生体内でタウの折りたたみと集計の予想される機能を模倣します。
要約
Tau 蛋白の凝集とペアになっているヘリカル フィラメントの形成は、アルツハイマー病と他のタウオパチーの特徴です。神経変性疾患に関連付けられている他のタンパク質と比較して、タウ蛋白の報告された体外凝集速度がより少なく一貫した比較的高い可変性を示します。ここでタウの折りたたみと集計の生体に関連する予想される手順を模した体外凝集アッセイの開発について述べる.アッセイは、N 末端酸性挿入として 4 つの微小管結合ドメイン (MBD) の両方が含まれている最長のタウ アイソ (huTau441) を使用しています。生体外で集計をヘパリン添加によるトリガーおよび 96 よくマイクロ プレート フォーマットで thioflavin T 蛍光が継続的に続きます。タウ凝集アッセイは、さまざまな坑井、実験の実行および蛋白質のバッチ間再現性が高いです。集計は、タウ・ デ ・ ノボ維構造の形成の播種で非常に効率的な PHF のような形態をもたらします。タウの折りたたみと凝集のメカニズムを勉強に応用に加え現在の試金はタウの病因を妨げる薬剤をスクリーニングするための強力なツールです。
概要
アルツハイマー病は、集約されたアミロイド β1の細胞外の老人斑の蓄積によって病理組織学的に定義されている壊滅的な神経変性疾患と細胞内蛋白のもつれを含む集計過リン酸化タウ蛋白質2。生理タウは単量体と 0-2 を含む六つのユニークなアイソ フォームとして提示 N ターミナル挿入、3 または 4 の微小管結合ドメイン3,4を選択的スプライシングと 2-3 リン酸化の平均に起因します。タウ、折りたたみ、線維構造に自己凝集が認知症個人5,6の病理学的評価として、タウの病因の重要な要素を構成することといわれています。
集約された蛋白タウもつれ広告だけでなく、前頭側頭葉変性症 (FTLD)、ピック病、進行性核上性麻痺 (PSP)、前頭 − 側頭葉認知症 (FTD)、プライマリを含む他のタウオパチーのも特長であります。加齢に伴うタウオパチー (パート)2。生化学的視点から広告に関連付けられている病理過程に光を当てることがタウの折りたたみと凝集のメカニズムを理解することと他のタウオパチー。集計堅牢な生体外の試金にも科学的側面薬剤候補7,8,9,10のスクリーニングのための貴重なツールです。核依存重合プロセス (NDP)11,12,13,14をタウの凝集に続くといわれています。NDP 動態はシグモイド、精力的に高速ダウンヒル集計プロセス続く精力的に好ましくない核形成ステップから始まります。
プリオン蛋白質、アミロイド β と α-シヌクレインを含むその他のアミロイド蛋白質とは異なりタウが生理学的な条件の下で自発的に集計されないし、も極端な pHs や高温が集計15を助長。これは最もおそらくタウ凝集のインターフェイスに存在 hydrophylic 相互作用によるです。ただし、タウは、生理的濃度で効率的に集計ヘパリン16などその他ポリ17,18誘導剤が使用されているとき。
タウの折りたたみと、集計の詳細にいくつかの光を流すタウ凝集アッセイ体外を設定するまでの努力が、彼らは体内のタウの凝集速度に信じられるものを模倣の短い来た。ほとんどの場合、タウの凝集速度はタウの核生成に関連付けられた lag phase を欠けていた。これは開始のタウ蛋白製剤の骨材の存在および/またはより生理的全長タウより多くの高い集約傾向とタウ フラグメントの使用非常に高いタウ蛋白濃度を使用しての結果をされている可能性があります。タンパク質19,20,21,22,23。さらに、先行研究は、再現性とタウ凝集速度のロバスト性の側面を解決しなかった。
ここでは、堅牢な体外タウ凝集試金タウ核生成の後、急激な成長フェーズに対応する lag phase で核依存重合の主な特徴を模倣をについて説明します。さらに、生成された組換えタウ集計は自然の繊維であり、非常に高いシード効力があります。アッセイは、またタウ バッチ間再現性の高い凝集阻害剤のスクリーニング、貴重なツールを表します。
プロトコル
1. 試薬の準備
-
反応バッファー
- 反応バッファーを準備: 0.5 mM TCEP 粉末を溶解して pH 6.7 PBS で TCEP (MW = 286.65 g/mol) PBSstock 溶液、pH 7.4。
注: TCEP の存在は、システインを含む野生型タウ蛋白を用いた集計研究を埋めるためです。現在のプロトコルの TCEP は、7.4 から 6.7 に PBS の pH 調整にのみ使用され、任意の酸化還元反応の調節に役割を果たしています。 - 徹底的にミックスし、滅菌 0.22 μ m 孔サイズ PES 膜フィルターを通じてソリューションをフィルターします。
- 因数と-80 ° C でストア。
- ベンチで解凍し、ご使用前に RT で安定します。
- 反応バッファーを準備: 0.5 mM TCEP 粉末を溶解して pH 6.7 PBS で TCEP (MW = 286.65 g/mol) PBSstock 溶液、pH 7.4。
-
huTau441
- (タンパク質の発現と精製のための参照 Apetriらの huTau441 を削除します。24)-80 ° C のフリーザーから。
- ベンチに解凍し、室温 (RT) に釣り合います。
- 気泡を除去するために 20-25 ° C、12,000 × g で 5 分間タンパク質ストック チューブをスピンします。
- 280 huTau441by 吸収の濃度測定 0.31 mL mg-1cm-1の消散係数を用いた nm
-
Thioflavin T
- ThT 乾燥粉末の 10 mg を溶解して 500 μ M thioflavin T (ThT) 原液を準備 (MW = 318.86 g/mol) 35 mL 反応バッファー内。
- 徹底的に、最高速度で 20 秒間 3 回渦をミックスし、滅菌 0.22 μ m 孔サイズ PES 膜フィルターを通じてソリューションをフィルターします。
- 411 で吸収測定による濃度を決定する 22,000 M-1 cm-1の消散係数を使用して nm と 500 μ M に ThT 濃度を調整。光から保護された常温保存します。新鮮な 2 ヶ月ごとを準備します。
-
ヘパリン
- HMW ヘパリン乾燥粉末の 1 mg を溶解することにより新鮮な 55 μ M、ヘパリン溶液を準備 (MW = 17-19 kDa) 室温 1 mL 反応バッファーに
- 積極的に振るし、渦 2 倍を 5 秒間。
- 滅菌 0.20 μ m 孔サイズ PES 膜フィルター (注射器) をソリューションをフィルターします。
2 マルチモード マイクロ プレート リーダーで連続モード ThT 凝集アッセイ
注: ThT 色素反応連続モード (自動測定) で huTau441 凝集速度を監視するために追加されます。通常蛍光光度計で反応を続けることができますがで、マニュアル操作性従来のキュベットを使用して測定の頻度が制限し、記録された運動曲線の精度を妥協します。この理由から、自動のマルチモード マイクロ プレート リーダーを使用します。
-
楽器設定
- コンピューターとマルチモード マイクロ プレート リーダーを入れます。10 分間安定装置を可能にします。
- ソフトウェアを起動し、プロトコルを準備します。
- プロトコルの種類を選択: (データ削減は実行しない独立して各板) の標準プロトコル。
- 37 ° C に温度を設定し、プロトコルを続行する前に preheatment を選択します。
- 運動の実行設定: 実行時間 50 h/測定間隔: 15 分。
- 連続モードで 425 インプレッション (3 mm) で揺れが軌道を設定します。
- 読み取り方法を選択: 蛍光強度エンドポイント、カイネティック - 分光波長: 励起 440 nm (20 nm 帯域幅)/発光 485 nm (20 nm 帯域幅) - 光学位置: トップ - 通常速度 - を読んで、高さ: 4.50 mm
- 作成されたプロトコルを使用して実行を開始します。所望の温度を平衡事前に楽器の名前を実験、新しく作成されたファイルの出力先を選択でき
-
自発的な huTau441 変換
- 1.5 mL チューブに反作用のサンプルを準備します。反応と少なくとも 4 複製あたり使用 200 μ L ミックス (4 の反作用ボリュームをレプリケート = 800 μ L)。
- 800 μ L 反応試料 (4 レプリケートします) の場合は 15 μ M huTau441、8 μ M ヘパリンおよび 50 μ M を準備 ThT 反応バッファーにタンパク質を混ぜることによって開始ヘパリンと ThT を追加し、上下に 5 回ピペッティングでよく混ぜます。試薬の追加の示された順序を尊重します。
- 12,000 × g で気泡を除去するために 5 分の 25 ° C のサンプルをスピンします。
- 200 μ L/ウェルの 96 ウェル マイクロ プレートで反作用のサンプルの分注 (96 ウェル黒ソリッド マイクロ プレート、よくボリューム 360 μ L、底が平らな)。空気の泡の形成を避けるため。
- 蒸発を避けるためにプレートをシールします。
- マルチモード マイクロ プレート リーダーでマイクロ プレートを置き、測定を開始します。
- 実験の終了後、機器からプレートを削除してデータ処理ソフトウェアにデータをエクスポートします。
-
変換、種子コレクションと貯蔵の品質チェック。
- プレートからシーラーを削除し、プールを 1.5 mL チューブに異なる複製。それを収集する前に、上下 2 回をピペッティングにより井戸に集約されたサンプルをよく混ぜます。集計は井戸の底に沈殿する傾向があります。
- ミックス徹底的 1.5 mL 管の上下に 5 回ピペッティングとマイカ表面 (さらに詳細を見る Apetriらの AFM による集計を分析するために 10-20 μ L を分注24)。
- 1 時間 20,000 × g と 4 ° C で 1.5 mL チューブを回すことによって、集計を収穫します。集計は、ペレットを形成します。
- 分離および単量体の tau (さらに詳細を参照 Apetriらの集計に成功した変換を示すサンプルの有無を確認する S MALS で上清を分析24)。
- 初期 huTau441 の蛋白質の集中そしてサンプル ボリュームを示す残りの集計 (ペレット) を含む 1.5 mL チューブにラベルを付けます。スナップは、凝集体を凍結し、-80 ° C で保存します。
-
シードの反応
- -80 ° C の冷凍庫から huTau441 集計を削除します。反応バッファーのボリューム ラベル (初期サンプル ボリューム) に記載された、8 回に 5 上下ピペッティングにより集計ルートを再懸濁しますに安定管を追加します。
- 集計サンプルを超音波照射します。200 μ L のサンプル (15 μ M huTau441)、超音波 1/8「陰極を使って氷の上 (100 μ l から 10 mL まで) 15 の全期間のため 1 秒のパルスと 2 の一時停止を使用して s 30% 振幅 (超音波発生装置 250 ワット) で s。右のサンプルを再平衡します。
注: 採用超音波処理条件は、20-50 nm24の長さとタウ線維の同質な人口に します。 - 1.5 mL チューブに反作用のサンプルを準備します。反応と少なくとも 4 複製あたり使用 200 μ L ミックス (4 の反作用ボリュームをレプリケート = 800 μ L)。
- 15 μ M huTau441、8 μ M ヘパリンおよび 50 μ M を含む 800 μ L 反応サンプルを準備 ThT 反応バッファーにタンパク質を混ぜることによって開始ヘパリンと ThT を追加し、上下に 5 回ピペッティングでよく混ぜます。試薬の追加の示された順序を尊重します。
- 12,000 × g で気泡を除去するために 5 分の 25 ° C のサンプルをスピンします。
- 反作用のサンプル (96 ウェル黒ソリッド マイクロ プレート、よくボリューム 360 μ L、底が平らな) の 96 ウェルのウェルあたりの 200 μ L を分注します。空気の泡の形成を避けるため。
- (5 回) をピペッティング上下反復をして徹底的に前もって形成された線維サンプルを均質化し、種子の割合に相当する額もそれぞれ追加します。前もって形成されたシード添加の 2 μ L は、200 μ L よく総容積 1% (v/v) です。ミックス ピペッティングを上下 3 回井戸に追加するとき、空気の泡の形成を避けるため。
- 蒸発を避けるためにプレートをシールします。
- マルチモード マイクロ プレート リーダーでマイクロ プレートを置き、測定を開始します。
- 機器からプレートを削除し、データをスプレッドシートにエクスポートします。
結果
組換え huTau44124C291A および C322A の突然変異および N 末端彼および C ターミナル C タグ表現され、前述の精製を含む記述されています。HuTau441 バッチは、SDS-PAGE、事実上 100% S MALS (図 1) により評価した単量体の可視化として高純度。8 μ M HMW ヘパリン添加による 15 μ M の huTau441 の集計とマルチモード マイクロ プレート リーダーを使用して ThT 蛍光反応が継続的に続いた。励起波長は 440 nm (帯域幅 20 nm) 485 で測定した排出量に対し nm (帯域幅 20 nm)。試金はほとんど見分けがつかない (図 2 a) をされている 10 の個々 の井戸からの結果と、再現性が高いです。ThT の肯定的な huTau441 の凝集体の形態は、原子間力顕微鏡による 50 h 後に評価されました。集約された hutau441 は、長さが異なる (図 2 b) 報告された前のヴィヴォ形態と同様の繊維構造の均一混合物です。さらに、最終的な反応混合物では、モノマー、S MALS 測定 (図 2) に示すように、集計に完全に変換を示唆は含まれません。独立した実験的実行で huTau441 集計の動態、s 字カーブが似ており、区別がつかない遅れと成長段階 (図 3) が強調するように似ています。蛋白質の別のバッチを使用する場合、高レベルの再現性は維持されます (図 4)。さらに、前もって形成された huTau441 集計、タウ モノマーを募集し、 de novoタウ凝集体の形成を誘導するのに非常に効率的です。前もって形成されたタウ凝集の 0.0025% (v/v) として低量である核形成およびde novo線維 (図 5) のトリガー生成を省略することができます。
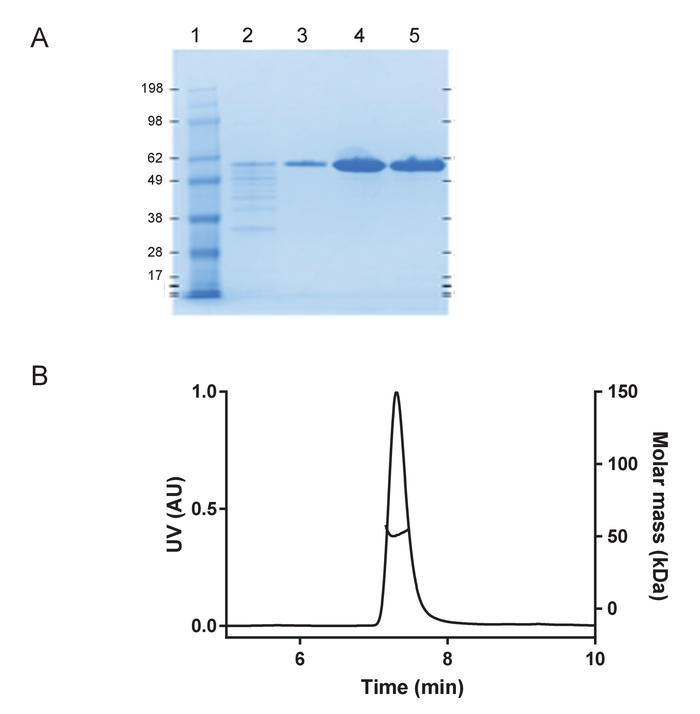
図 1: 遺伝子組換え huTau441 は単量体と高純度。(KDA) の分子量標準蛋白質の梯子を含む 4-12 %sds ページのゲルの条件の変化の下で A) 純度評価 (レーン 1);最後の C タグ アフィニティ精製ステップ (レーン 2); から流れるカラム洗浄分数 (レーン 3)、(4 車線) の前に、huTau441 タンパク質のピークの溶出バッファーの後交換し、(レーン 5)、それぞれ)。B) S MALS 解析、huTau441。タンパク質 > 99.9 %51 kDa のモル質量と単量体とを示しています、集計またはフラグメントが含まれていません。この図の拡大版を表示するのにはここをクリックしてください。
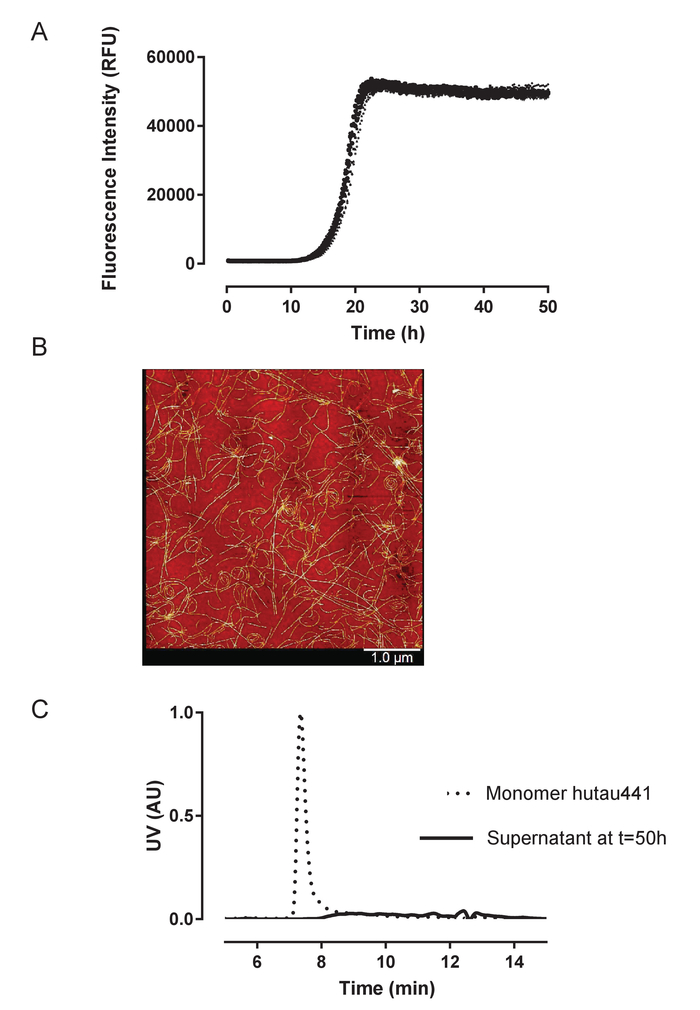
図 2: 組換え huTau441 の集計は再現性の高い、繊維構造につながる定量的。A) ヘパリンの動態は、huTau441 集計 ThT 蛍光 96 よくマイクロ プレート フォーマットで継続的に監視を誘導されます。HuTau441 とヘパリン濃度は、それぞれ 15 μ M と 8 μ M です。10 の個々 のカーブ同じマイクロ プレートの 10 の井戸で同じ蛋白質のバッチ変換に対応し、14.2 (SD) の平均遅れ位相によって特徴付けられる ± 0.38 h と t50 18.8 ± 0.40 h. 運動データの 5 パラメーター物流が装備されました。c 字曲線上の漸近線は線形の減少と。遅れ位相と t50線形回帰による予測値間の補間により算出しています。遅れ位相は、ThT 蛍光信号の 3% の増加に基づいて計算されます。曲線 IBM SPSS 統計バージョン 20.0.0.2 を使用して継手および概要の統計情報を取得します。B). タウ凝集体は、50 h; AFM イメージングによって示されるように PHF のような形態を表示C). S MALS 単量体 huTau441 の解析 (t = 0 h) 及び反応の完了で反応混合物の上澄み (t = 50 h)。50 h の時点で g と 4 ° C と S MALS で注入結果清 X 20,000 で 1 時間反応混合物は遠心分離。モノマー ピークの消失は、タウの完全な集計を確認します。この図の拡大版を表示するのにはここをクリックしてください。
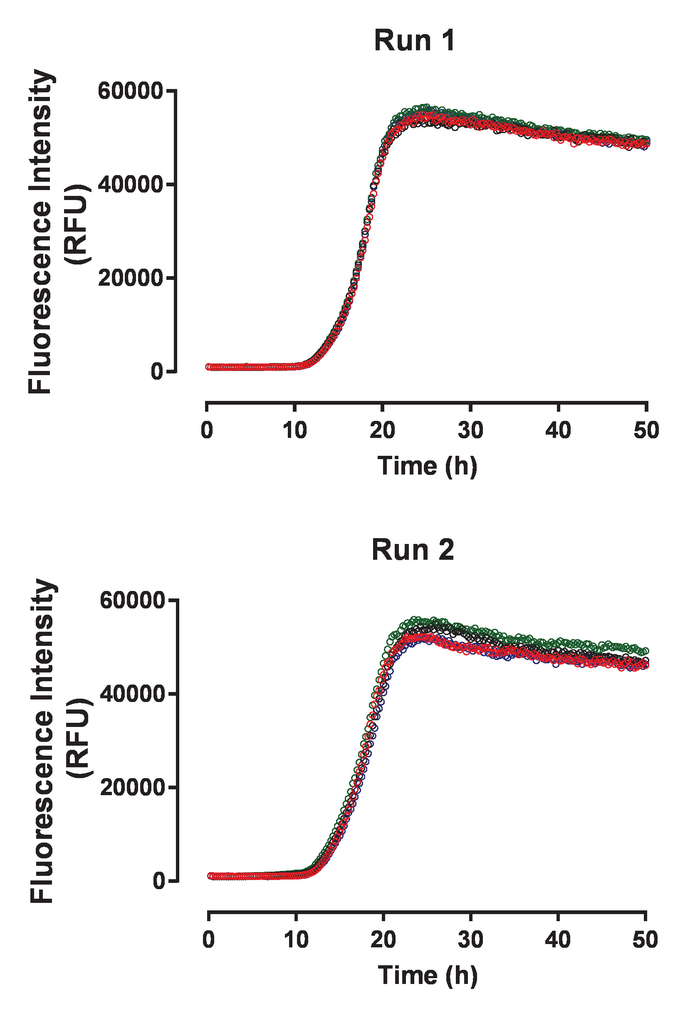
図 3: タウ凝集アッセイは独立した実験的実行の間再現性の高いを示します。2 つのパネルは、huTau441 蛋白質の同じバッチを使用して 2 つの独立した実験で収集された自発的な huTau441 集計の 4 つの個々 の動態トレースを表示します。HuTau441 とヘパリン濃度は、それぞれ 15 μ M と 8 μ M です。速度はそれぞれ 12.2 ± 0.18 h ・ t50 17.8 ± 0.8 h (実行 1) と 11.6 ± 0,52 h (SD) の平均遅れ位相と t50 17.8 ± 0.23 h (実行 2) によって特徴付けられます。速度論的データは、上部の漸近線は線形の減少と 5 パラメーター ロジスティック曲線を装着しました。T50線形回帰による予測値間の補間により算出しています。遅れ位相は、ThT 蛍光信号の 3% の増加に基づいて計算されます。この図の拡大版を表示するのにはここをクリックしてください。

図 4: タウ凝集アッセイ huTau441 タンパク質の異なるバッチ間再現性の高いを示します。各パネルは、4 つは特定の huTau441 バッチに対応するレプリケートされますを示しています。各バッチの集計は、独立した実験に続いた。HuTau441 とヘパリン濃度は、それぞれ 15 μ M と 8 μ M です。凝集速度 15.3 ± 0.38 h (SD) の平均遅れ位相と 21.1 ± 0.46 h (バッチ 1); t50によって特徴付けられるバッチ 4 つ個々 のタウに対応します。12.5 ± 0.07 h の相と t50 19.8 ± 0.34 h (バッチ 2);15.1 ± 0.34 h の相と t50 21.9 ± 0.86 h (バッチ 3) のラグし、ラグ 11.5 ± 0.29 h の段階および t50 17.8 ± 0.29 h (バッチ 4)、それぞれ。速度論的データは、上部の漸近線は線形の減少と 5 パラメーター ロジスティック曲線を装着しました。遅れ位相と t50線形回帰による予測値間の補間により算出しています。遅れ位相は、ThT 蛍光信号の 3% の増加に基づいて計算されます。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 前もって形成された hutau441 集計が高い活動をシードある。シードを開始するには、熱量タウ凝集体は、モノマー hutau441 に追加しました。赤、青、異なる運動曲線の各色が追加された種子の量が異なるを表します: 1.25%、0.63%、0.31%、0.16%、0.08%、0.04%、0.02%、0.01%、0.005%、0.0025% (v/v)、それぞれ。Hutau441 の自然変換は黒で表されます。すべての条件は、4 連でテストされました。種濃度に関連付けられている 4 つの運動複製、再現性の高いとほとんど区別がつかない。Hutau441 とヘパリン濃度は、それぞれ 15 μ M と 8 μ M です。前もって形成された熱量維構造の少量添加は自然変換で観測された lag phase を排除し、効果は種子の量と比例しています。赤から青に、t50が観測された (t50 spont.conv t50シード) の違いはそれぞれ 18.9、18.40、17.8、17.3、16.6、16.1、15.4 インチ、14.7、14.2、13.7 時間。Hutau441 の自発的な転換は、平均 t50 (SD) 19.85 のによって特徴付けられる ± 0.54 h. 速度論的データが上部の漸近線は線形の減少と 5 パラメーター ロジスティック曲線が取り付けられていた。t50線形回帰による予測値間の補間により算出しています。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
多くの努力にもかかわらずタウ凝集速度報告は本邦日付欠如再現性のレベルおよび/または核依存重合19,20,21の機能の一部に,22,23,25です。 これはしばしば遅れ相、非能率的なシードと非維タウ凝集性の欠如によって強調されて。これらの欠点の理由は変わることができるし、最適タウ蛋白質品質 (断片化、集計、低純度等の存在。)、蛋白質および誘導の実験条件ではや試薬の選択が含まれています。もう一つの複雑になる要因は、2 つのシステイン残基タウ凝集インターフェイスの周りにある内を形成したり、インター - 分子二硫化物橋によって酸化還元環境とタウ凝集の効率に影響を与える。減らされた形態のシステイン残基を維持するために使用されている還元剤 DTT や TCEP などほとんどの方法でおよびこうして再現性25のレベルを上げます。また、タウの消散係数が非常に低いため、タンパク質濃度の正確な測定の難しさに です。
特に、いくつかのパラメーターと我々 はタウ蛋白の堅牢な再現性のある、代表的な集計プロファイルに対して重要と考えられる品質属性に着目した: 内の可能性を排除し、インター-分子ジスルフィド形成濃度測定の精度の向上や高純度タウ モノマーを上げています。すべてのこれらの試薬関連の質問我々 は最適な分析法の開発のために重大考慮する潜在的な留意点です。これらの問題に対処するため完全な長さの huTau441 は、2 つの突然変異で、C291A、C322A とは、N 末端と C 末端タグを表現しました。システイン残基の変異は、最小限の影響タウ蛋白質ジスルフィド ブリッジを制御するそれ以外の場合困難を排除しながら。比較的短い N 末端と C 末端のタグ付きタンパク質を表現すると、非常に高い純度、整合性およびモノマー コンテンツにつながった 2 段階の親和性の浄化のプロトコルを追求できました。さらに、タンパク質の吸光係数を増加しより正確な濃度測定24を許可 F8W 変異を導入しました。
高品質の蛋白質の試薬の使用、に加えて他のアッセイのパラメーターを最適化したも。最適なタウ: ヘパリンの比が 0.5 (M/M) 以前に発行された研究26に沿っては周りに識別されました。さらに、機械的及び光学機器設定が再現性と最適なパラメーターはメーカーによって多少異なる場合があることを確認することが重要です。
この試金で説明したタウの凝集は、広告でタウ病因に関連付けられ、関連のタウオパチーの特性を示しています。プロセスは、高エネルギー核の形成に対応する lag phase で始まり、線維の成長に対応する急速な成長段階が続きます。ラグ タイムが十分シード処理種子濃度 (図 5) も長すぎないので、タンパク質分解および/または非特異的凝集を避ける間の広い範囲をカバー (図の詳細に検討する広範なウィンドウを開く2). これらのセカンダリ イベントで生理的条件に時間の長い期間のため huTau441 など天然変性タンパク質を公開するとき起こり特に。得られたタウ集計表示 PHFs の形態は AD 患者の脳から分離された、単量体のタウを募集し、 de novoに変換することで非常に効率的には、集計、シードと呼ばれるプロセスが生成されます。試金は井戸、実験の実行およびタンパク質バッチ間事実上区別されて運動曲線、再現性が高いです。アプリケーションを合わせることができる現在の試金は最長タウ アイソ フォーム、huTau441 にのみ焦点を当て tau (Ameijdeら、Acta Neuropathologica 通信、プレス) の他の形態の変換を検討するさらに、それは可能解明タウ アイソ フォームの相互作用に焦点を当て、3 r と 4 r のアイソ フォームが存在する病や前頭側頭型認知症の PHFs やピック病のタウ病理が主に含まれている広告のタウの病態の違いに光を当てる可能性があります。3 r と 4 r 型のアイソ フォーム、それぞれ27。
アッセイの再現性の非常に高い読者にその特定のラボ設定で比較的容易に実装できるようにします。アッセイ体内の折りたたみとタウの凝集に信じられるものを模倣、新薬候補をスクリーニングするための貴重なツールを構成するタウ病態とそれに光を当てる、機構の研究を有効にして、干渉を評価病態プロセスの異なるステップ。
開示事項
著者が明らかに何もありません。
謝辞
著者は、データ解析のためのマーティン Koldijk と優れたテクニカル サポートのマーゴット ・ ヴァン ・ Winsen ハンナ Inganäs、表現と huTau441 の浄化のためヘクター Quirante を感謝したいです。
資料
| Name | Company | Catalog Number | Comments |
| Thioflavin T | Sigma-Aldrich | T3516-5G | dry powder (Mw = 318.86 g/mol) |
| Heparin | Sigma-Aldrich | H3393-50KU | dry powder (Mw = 17-19 kDa) |
| TCEP | Sigma-Aldrich | 75259-1G | dry powder (MW= 286.65 g/mol) |
| PBS | Gibco-Life Technologies | 10010-015 | Sterile, pH 7.4 (1X) |
| 0.22 μm sterile filter | Corning | 431160 | PES membrane |
| 0.20 μm sterile serynge filter | Corning | 431229 | PES membrane |
| 96-well microplates | Thermo Scientific | 9502867 | Black, flat botton |
| Microplate sealers | R&D Systems | DY992 | Adhesive strips |
| Synergy Neo2 Multi-Mode Microplate Reader | Biotek | Synergy Neo2 | Hybrid Technology, Gen5 Software |
| Eppendorf Tubes | Eppendorf | 0030 120.086 | 1,5 ml tubes |
| Ultrasonics-Branson SFX250 | Branson | 101-063-966R | 1/2" Solid Horn and 1/8" microtip |
参考文献
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. The New England Journal of Medicine. 362 (4), 329-344 (2010).
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annual Review of Neuroscience. 24, 1121-1159 (2001).
- Goedert, M., Wischik, C. M., Crowther, R. A., Walker, J. E., Klug, A. Cloning and sequencing of the cDNA encoding a core protein of the paired helical filament of Alzheimer disease: identification as the microtubule-associated protein tau. Proceedings of the National Academy of Sciences of the United States of America. 85 (11), 4051-4055 (1988).
- Himmler, A., Drechsel, D., Kirschner, M. W., Martin, D. W. Tau consists of a set of proteins with repeated C-terminal microtubule-binding domains and variable N-terminal domains. Molecular and Cellular Biology. 9 (4), 1381-1388 (1989).
- Mandelkow, E., von Bergen, M., Biernat, J., Mandelkow, E. M. Structural principles of tau and the paired helical filaments of Alzheimer's disease. Brain Pathology. 17 (1), 83-90 (2007).
- Lee, V. M., Balin, B. J., Otvos, L., Trojanowski, J. Q. A68: a major subunit of paired helical filaments and derivatized forms of normal Tau. Science. 251 (4994), 675-678 (1991).
- Wischik, C. M., Harrington, C. R., Storey, J. M. Tau-aggregation inhibitor therapy for Alzheimer's disease. Biochemical Pharmacology. 88 (4), 529-539 (2014).
- Pickhardt, M., et al. Identification of Small Molecule Inhibitors of Tau Aggregation by Targeting Monomeric Tau As a Potential Therapeutic Approach for Tauopathies. Current Alzheimer Research. 12 (9), 814-828 (2015).
- Paranjape, S. R., et al. Azaphilones inhibit tau aggregation and dissolve tau aggregates in vitro. ACS Chemical Neuroscience. 6 (5), 751-760 (2015).
- Seidler, P. M., et al. Structure-based inhibitors of tau aggregation. Nature Chemistry. 10 (2), 170-176 (2018).
- Apetri, A. C., Vanik, D. L., Surewicz, W. K. Polymorphism at residue 129 modulates the conformational conversion of the D178N variant of human prion protein 90-231. Biochemistry. 44 (48), 15880-15888 (2005).
- Crespo, R., Rocha, F. A., Damas, A. M., Martins, P. M. A generic crystallization-like model that describes the kinetics of amyloid fibril formation. Journal of Biological Chemistry. 287 (36), 30585-30594 (2012).
- Holmes, B. B., et al. Proteopathic tau seeding predicts tauopathy in vivo. Proceedings of the National Academy of Sciences. 111 (41), E4376-E4385 (2014).
- Surewicz, W. K., Jones, E. M., Apetri, A. C. The emerging principles of mammalian prion propagation and transmissibility barriers: Insight from studies in vitro. Accounts of Chemical Research. 39 (9), 654-662 (2006).
- Jeganathan, S., von Bergen, M., Mandelkow, E. M., Mandelkow, E. The natively unfolded character of tau and its aggregation to Alzheimer-like paired helical filaments. Biochemistry. 47 (40), 10526-10539 (2008).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- Kampers, T., Friedhoff, P., Biernat, J., Mandelkow, E. M., Mandelkow, E. RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments. FEBS Letters. 399 (3), 344-349 (1996).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. American Journal of Pathology. 150 (6), 2181-2195 (1997).
- Barghorn, S., Mandelkow, E. Toward a unified scheme for the aggregation of tau into Alzheimer paired helical filaments. Biochemistry. 41 (50), 14885-14896 (2002).
- Friedhoff, P., Schneider, A., Mandelkow, E. M., Mandelkow, E. Rapid assembly of Alzheimer-like paired helical filaments from microtubule-associated protein tau monitored by fluorescence in solution. Biochemistry. 37 (28), 10223-10230 (1998).
- Morozova, O. A., March, Z. M., Robinson, A. S., Colby, D. W. Conformational features of tau fibrils from Alzheimer's disease brain are faithfully propagated by unmodified recombinant protein. Biochemistry. 52 (40), 6960-6967 (2013).
- Ramachandran, G., Udgaonkar, J. B. Mechanistic studies unravel the complexity inherent in tau aggregation leading to Alzheimer's disease and the tauopathies. Biochemistry. 52 (24), 4107-4126 (2013).
- Sui, D., Liu, M., Kuo, M. H. In vitro aggregation assays using hyperphosphorylated tau protein. Journal of Visualized Experiments. (95), e51537 (2015).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta Neuropathologica Communications. 6 (1), 43 (2018).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Zhu, H. L., et al. Quantitative characterization of heparin binding to Tau protein: implication for inducer-mediated Tau filament formation. Journal of Biological Chemistry. 285 (6), 3592-3599 (2010).
- Buee, L., Delacourte, A. Comparative biochemistry of tau in progressive supranuclear palsy, corticobasal degeneration, FTDP-17 and Pick's disease. Brain Pathology. 9 (4), 681-693 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved