Method Article
In Vitro Análisis para el estudio de la agregación de la proteína Tau y detección de drogas
En este artículo
Resumen
El análisis de la agregación de tau se describe en este manuscrito imita las características anticipadas en vivo tau mal plegamiento y agregación.
Resumen
Agregación de la proteína tau y la formación de filamentos helicoidales apareados es un sello de la enfermedad de Alzheimer y otras tauopatías. En comparación con otras proteínas relacionadas con enfermedades neurodegenerativas, la cinética de agregación divulgado en vitro de la proteína tau son menos consistentes que presenta una variabilidad relativamente alta. Aquí describimos el desarrollo de un ensayo en vitro la agregación que imita los pasos esperados asociados con mal plegamiento y agregación de tau en vivo. El ensayo utiliza la isoforma tau más largo (huTau441) que contiene insertos acídicos N-terminal, así como cuatro dominios de unión a microtúbulos (MBD). La agregación en vitro es desencadenada por la adición de heparina y seguida continuamente por fluorescencia de tioflavina T en un formato de 96 microplaca de bien. El ensayo de agregación de tau es altamente reproducible entre diferentes pozos, funcionamientos experimentales y lotes de la proteína. La agregación conduce a tau PHF-como morfología, que es muy eficiente en el sembrador de la formación de estructuras fibrilares de novo . Además de su aplicación en el estudio del mecanismo de tau mal plegamiento y agregación, el ensayo actual es una robusta herramienta para la detección de drogas que puedan interferir en la patogenia de la tau.
Introducción
La enfermedad de Alzheimer es un desorden neurodegenerative devastador que histopatológicamente se define por la acumulación de placas seniles extracelulares de agregados amiloides beta1 y Neurofibrilar intracelular que contiene agregado la proteína del tau de Hyperphosphorylated2. Tau fisiológica es monomérica y presentados como seis isoformas únicas que contiene 0-2 inserciones terminales N y 3 o 4 enlace de microtúbulos dominios3,4 derivadas de splicing alternativo y un promedio de 2-3 fosforilaciones. Se cree que la hiperfosforilación, mal plegamiento y uno mismo-agregación de en las estructuras fibrilares constituyen los elementos clave en la patogenia de tau, como patológico evaluado en individuos con demencia5,6.
Los enredos de agregados de tau neurofibrilares son un rasgo distintivo no sólo para el anuncio, sino también para otras tauopatías, incluyendo la degeneración lobular frontotemporal (DLFT), enfermedad de Pick, parálisis supranuclear progresiva (PSP), la demencia fronto-temporal (FTD) y primaria relacionadas con la edad tauopathy (parte)2. Desde un punto de vista bioquímico, comprender el mecanismo de tau mal plegamiento y agregación podría arrojar luz sobre los procesos patológicos asociados con enfermedad de Alzheimer y otras tauopatías. Además del aspecto científico, robusto en vitro ensayos de agregación son herramientas valiosas para la detección de drogas los candidatos7,8,9,10. Se cree que la agregación de tau sigue una nucleación dependiente polimerización proceso (NDP)11,12,13,14. La cinética de la NDP es sigmoidal y comienza con un paso de nucleación enérgio desfavorable seguido por un proceso de agregación enérgio rápido cuesta abajo.
A diferencia de otras proteínas amyloidogenic, incluyendo la proteína del prión, beta amiloideo y α-sinucleína, tau no agregan espontáneamente bajo condiciones fisiológicas y pHs incluso extremo o las altas temperaturas son no-conducentes para agregación15. Esto es probablemente debido a las interacciones de hidrofílico presentes en la interfaz de la agregación de tau. Sin embargo, tau agregados eficientemente en concentraciones fisiológicas cuando se utilizan inductores tales como heparina16 u otros polianiones17,18 .
Los esfuerzos anteriores para configurar en vitro ensayos de agregación de tau han arrojado algo de luz sobre los detalles de tau mal plegamiento y agregación, pero vinieron de imitar lo que se cree que la cinética de agregación en vivo tau. En la mayoría de los casos, la cinética de la agregación de tau faltaba la fase de retraso inicial asociada con la nucleación de tau. Esto pudo haber sido la consecuencia del uso de las concentraciones de proteína tau muy alta, presencia de agregados en la preparación de la proteína tau a partir o uso de fragmentos de tau con mucho mayor propensión de la agregación de tau largo más fisiológica la proteína19,20,21,22,23. Además, estudios previos no abordó el aspecto de robustez de la cinética de la agregación de tau y reproducibilidad.
Aquí, describimos un robusto en vitro tau agregación ensayo que imita las características principales de una polimerización de nucleación dependiente con una fase de retraso inicial correspondiente a la nucleación de tau seguida por una fase de crecimiento exponencial. Además, los agregados de tau recombinantes generados son fibrilares en la naturaleza y tienen una potencia extremadamente alta de siembra. El ensayo es altamente reproducible también entre lotes de tau y representa una herramienta valiosa para detectar inhibidores de la agregación.
Protocolo
1. preparación del reactivo
-
Tampón de reacción
- Preparación de buffer de reacción: 0,5 mM TCEP en PBS, pH 6.7 disolviendo polvo seco TCEP (MW = 286.65 g/mol) en PBSstock solución, pH 7,4.
Nota: Es la presencia de TCEP debido a tender un puente sobre estudios de agregación usando proteína del tau del tipo salvaje que contiene cisteínas. En el protocolo actual, TCEP sólo se utiliza para ajustar el pH de PBS de 7.4 a 6.7 y no desempeña ningún papel en la regulación de reacciones redox. - Mezclar bien y filtrar la solución a través de un filtro de membrana estéril 0,22 μm poro tamaño PES.
- Alícuota y conservar a-80 ° c.
- Descongelar en el Banco y estabilizar a temperatura ambiente antes de usar.
- Preparación de buffer de reacción: 0,5 mM TCEP en PBS, pH 6.7 disolviendo polvo seco TCEP (MW = 286.65 g/mol) en PBSstock solución, pH 7,4.
-
huTau441
- Quitar huTau441 (para ver de expresión y purificación de proteínas Apetri et al. 24) congelador de-80 ° c.
- Descongelar en el Banco y alcancen la temperatura ambiente (RT).
- Girar el tubo con la acción de la proteína por 5 min a 12.000 x g a 20-25 ° c para eliminar las burbujas de aire.
- Medir la concentración de huTau441by de absorción a 280 nm con un coeficiente de extinción de 0,31 mL mg-1cm-1
-
Tioflavina T
- Preparar 500 μM tioflavina T (ThT) solución disolviendo 10 mg de polvo seco de ThT (MW = 318.86 g/mol) en 35 mL de tampón de reacción.
- Homogeneizar, vortex 3 veces durante 20 segundos a velocidad máxima y filtrar la solución con un estéril 0,22 μm poro tamaño PES filtro de membrana.
- Determinar la concentración de las mediciones de absorción en 411 nm con un coeficiente de extinción de 22.000 M-1 cm-1 y ajuste ThT concentración a 500 μM. Almacenar a temperatura ambiente protegido de la luz. Preparar fresca cada 2 meses.
-
Heparina
- Preparar solución fresca de heparina 55 μM al disolver 1 mg de polvo seco de la heparina de APM (MW = 17-19 kDa) en 1 mL de tampón de reacción a TA.
- Agite vigorosamente y vórtice 2 veces durante 5 segundos.
- Filtrar la solución a través de un estéril 0,20 μm poro tamaño PES filtro de membrana (jeringa).
2. continuo modo ThT ensayo de agregación en un lector de microplaca multimodo
Nota: ThT colorante se agrega a la reacción para monitorizar la cinética de agregación huTau441 en modo continuo (mediciones automáticas). Aunque la reacción puede ser seguida por un fluorómetro regular usando una cubeta convencional, la naturaleza manual de la operación limita la frecuencia de las mediciones y compromete la precisión de las curvas cinéticas grabadas. Por esta razón, se utiliza un lector de microplacas de varios modos de funcionamiento automático.
-
Instrumento establecido
- Encienda la computadora y el lector de microplaca multimodo. Dejó el equipo durante 10 minutos.
- Inicie el software y elaborar un protocolo.
- Seleccione el tipo de protocolo: protocolo estándar (reducción de datos se realiza independientemente para cada placa).
- Ajustar la temperatura a 37 ° c y seleccione preheatment antes de continuar con el protocolo.
- Establecer el funcionamiento cinético: duración 50 h / intervalo de medición: 15 min.
- Sistema orbital agitación a cpm 425 (3 mm) en modo continuo.
- Seleccione el método de lectura: las longitudes de onda de fluorescencia intensidad punto final/cinética - monocromadores: excitación 440 nm (ancho de banda de nm 20) óptica de emisión 485 nm (20 ancho de banda de nm) - posición: Top - Normal Lee velocidad - leer altura: 4,50 mm
- Inicie el funcionamiento mediante el protocolo creado. Nombre del experimento, seleccione el destino del archivo recién creado y que el instrumento antes alcancen la temperatura deseada.
-
Conversión espontánea huTau441
- Preparar la muestra de reacción en un tubo de 1,5 mL. Mezcla de uso 200 μL por reacción y por lo menos 4 repeticiones (volumen de reacción de 4 repeticiones = 800 μL).
- Preparar 800 μL reacción muestra (en caso de 4 repeticiones) que contiene 15 μM huTau441, 8 la heparina μM y 50 μM ThT. Comience mezclando la proteína con el tampón de reacción, añadir heparina y ThT y mezclar bien mediante pipeteo arriba y abajo 5 veces. Respetar el orden indicado para la adición de reactivo.
- Hacer girar muestras a 12.000 x g y 25 ° c por 5 min eliminar las burbujas de aire.
- Dispensar 200 μL de reacción muestra por pozo en microplacas de 96 pocillos (microplacas sólido negro de 96 pozos, pozo-volumen 360 μL, parte inferior plana). Evitar formación de burbujas de aire.
- Sello de microplacas para evitar la evaporación.
- Colocar microplacas en lector de microplaca multimodo y empezar las mediciones.
- Después de la terminación del experimento, extraiga la placa de equipo y exportar datos a un software de procesamiento de datos.
-
Control de calidad de la conversión, colección de semillas y almacenamiento.
- Quite el cierre hermético de la placa y las diferentes repeticiones en tubos de 1,5 mL de la piscina. Mezclar bien la muestra agregada de los pozos mediante pipeteo arriba y abajo 2 veces antes de recoger. Agregados tienden a depositar en el fondo del pozo.
- Mezcla bien en 1,5 mL de tubo mediante pipeteo arriba y abajo 5 veces y dispensar 10-20 μL en una superficie de mica para el análisis de los agregados por AFM (para otros detalles vea Apetri et al. 24).
- Cosechar los agregados haciendo girar el tubo de 1,5 mL a 20.000 x g y 4 ° c durante 1 hora. Agregados forman un gránulo.
- Separar y analizar el sobrenadante por S-MALS para confirmar la ausencia de tau monomérica en la muestra que indica una conversión exitosa en áridos (para más detalles vea Apetri et al. 24).
- Etiquetar el tubo de 1,5 mL que contiene los agregados restantes (pellet) que indica la concentración de la proteína de huTau441 inicial y volumen de la muestra. Complemento los agregados de congelar y almacenar a-80 ° c.
-
Reacción
- Quitar huTau441 agregados de congelador de-80 ° c. Añadir el volumen de tampón de reacción indicada en la etiqueta (volumen de la muestra inicial) y dejar que el tubo estabilizar a RT. resuspender los agregados mediante pipeteo arriba y abajo de 5 a 8 veces.
- Someter a ultrasonidos la muestra agregada. Para una muestra de 200 μL (15 μM huTau441), someter a ultrasonidos en el hielo con una micropunta de 1/8"(de 100 μL a 10 mL) durante un periodo total de 15 s con pulsos de 1 s y pausas de 2 s en 30% amplitud (sonicador 250 Watts). Volver a equilibrar la muestra a RT.
Nota: Las condiciones de sonicación empleados conducen a una población homogénea de fibrillas de tau con longitudes de 20-50 nm24. - Preparar la muestra de reacción en tubos de 1,5 mL. Mezcla de uso 200 μL por reacción y por lo menos 4 repeticiones (volumen de reacción de 4 repeticiones = 800 μL).
- Preparar 800 μL muestra de reacción que contiene 15 μM huTau441, 8 la heparina μM y 50 μM ThT. Comience mezclando la proteína con el tampón de reacción, añadir heparina y ThT y mezclar bien mediante pipeteo arriba y abajo 5 veces. Respetar el orden indicado para la adición de reactivo.
- Hacer girar muestras a 12.000 x g y 25 ° c por 5 min eliminar las burbujas de aire.
- Dispensar 200 μL de reacción muestra por pozo de 96 pocillos (microplacas sólido negro de 96 pozos, pozo-volumen 360 μL, parte inferior plana). Evitar formación de burbujas de aire.
- Homogeneizar completamente la muestra de fibrilla preformado repetitivo hacia arriba y abajo pipeteo (5 veces) y añadir a cada pozo el importe correspondiente al porcentaje deseado de semillas. Para un volumen total bien de 200 μL, 2 μL de la adición de semillas preformadas es un 1% (v/v). Mezclar mediante pipeteo arriba y abajo 3 veces cuando se agrega al pozo y evitar la formación de burbujas de aire.
- Sello de microplacas para evitar la evaporación.
- Colocar microplacas en lector de microplaca multimodo y empezar las mediciones.
- Extraiga la placa de equipo y exportar datos a una hoja de cálculo.
Resultados
HuTau441 recombinantes que contienen las mutaciones C291A y C322A y N-terminal su terminal C C-tags expresado y purificado previamente descrito24. Los lotes de huTau441 son muy puros como visualizado en SDS-PAGE y prácticamente 100% monomérica evaluada por S presentes (figura 1). La agregación de 15 μm huTau441 fue inducida por la adición de heparina de APM de 8 μm y la reacción fue seguida continuamente por ThT fluorescencia usando un lector de microplaca multimodo. La longitud de onda de excitación fue de 440 nm (nm de ancho de banda 20) Considerando que la emisión se midió a 485 nm (ancho de banda 20 nm). El ensayo es altamente reproducible, con resultados de 10 pocillos individuales ser prácticamente indistinguibles (figura 2A). La morfología de los agregados de ThT huTau441 positivo fueron evaluada después de 50 h por AFM. Agregados hutau441 es una mezcla homogénea de estructuras fibrilares de longitudes similares a divulgado ex vivo morfologías (figura 2B). Además, la mezcla de reacción final no contiene monómero, sugiriendo una conversión plena a áridos como se muestra en las mediciones de S presentes (figura 2). La cinética de la agregación huTau441 en carreras experimentales independientes son muy similares como subrayado por similares curvas sigmoidales y fases de crecimiento y retraso indistinguibles (figura 3). El alto nivel de reproducibilidad se mantiene cuando se utilizan los diferentes lotes de la proteína (figura 4). Además, agregados preformados huTau441 son muy eficientes en reclutamiento monómero de tau y de inducir la formación de agregados de tau de novo . Cantidades tan bajas como 0.0025% (v/v) de agregados de tau preformadas son capaces de eludir la nucleación y la generación de gatillo de las fibrillas de novo (figura 5).
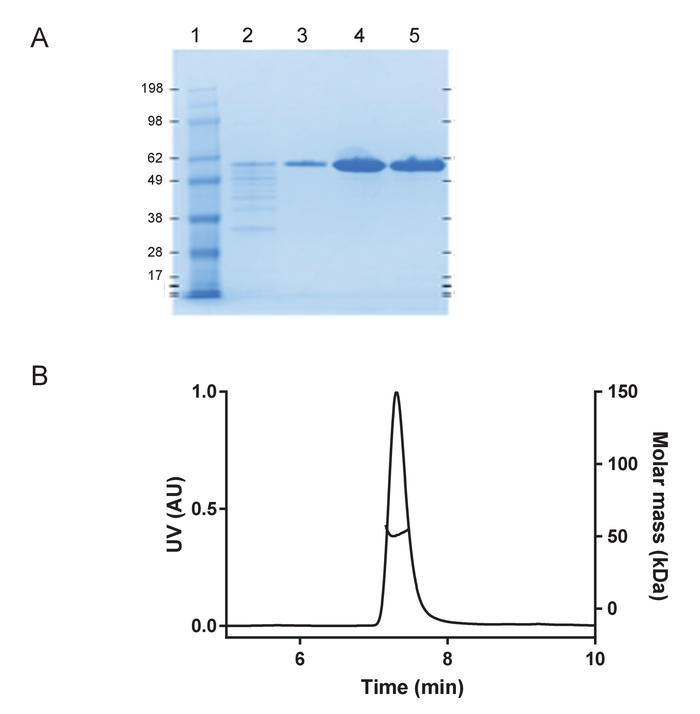
Figura 1: huTau441 recombinante es monomérica y altamente puro. A) evaluación pureza bajo desnaturalizar condiciones en gel de SDS-PAGE 4-12% incluyendo escala de proteínas estándar de peso molecular (en kDA) (carril 1); flujo a través de la etapa final de purificación afinidad de C-tag (carril 2); fracción de lavado de columna (carril 3), eluida pico de proteínas de huTau441, antes (carril 4) y después de búfer de intercambio (carril 5), respectivamente). B) análisis de la huTau441 en S-MALS. La proteína muestra > 99.9% monomérica con una masa molar de 51 kDa y no contiene agregados o fragmentos. Haga clic aquí para ver una versión más grande de esta figura.
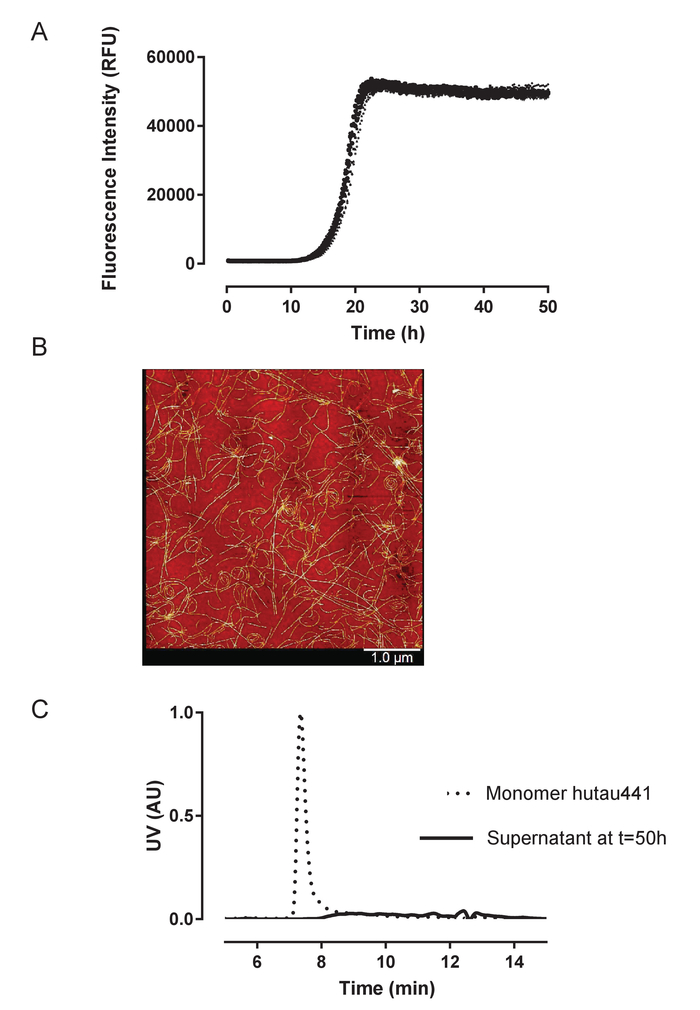
Figura 2: agregación de huTau441 recombinante es altamente reproducible y cuantitativo conduce a estructuras fibrilares. A) cinética de la heparina induce agregación huTau441 monitoreada continuamente en 96 formato de microplaca bien por fluorescencia de ThT. Concentraciones de huTau441 y heparina son 15 μm y 8, respectivamente. Las 10 curvas individuales corresponden a la conversión de un mismo lote de proteína en diez pozos de la microplaca de la misma y se caracterizan por una fase de retraso promedio (con SD) de 14,2 ± 0,38 h y t50 de datos cinéticos de 18,8 ± 0,40 h. fue cabido con un parámetro de 5 logisti curva c con una disminución lineal en la asíntota superior. Retraso de fase y t50 se calcularon por interpolación entre los valores predichos por la regresión lineal. Fase lag se calcula basándose en el aumento de 3% de la señal de fluorescencia de ThT. Curva de la guarnición y del Resumen de estadísticas se obtienen mediante IBM SPSS estadísticas versión 20.0.0.2. B). agregados de Tau muestran morfologías de PHF-como indicado por proyección de imagen de AFM en 50 h; C). Análisis de S-MALS de huTau441 monomérica (t = 0 h) y el sobrenadante de la mezcla de reacción a la terminación de la reacción (t = 50 h). En el momento de 50 h se centrifugó la mezcla de reacción durante 1h a 20.000 X g y 4 ° c y el sobrenadante resultante inyectado en S presentes. La desaparición del pico de monómero confirma la total agregación de tau. Haga clic aquí para ver una versión más grande de esta figura.
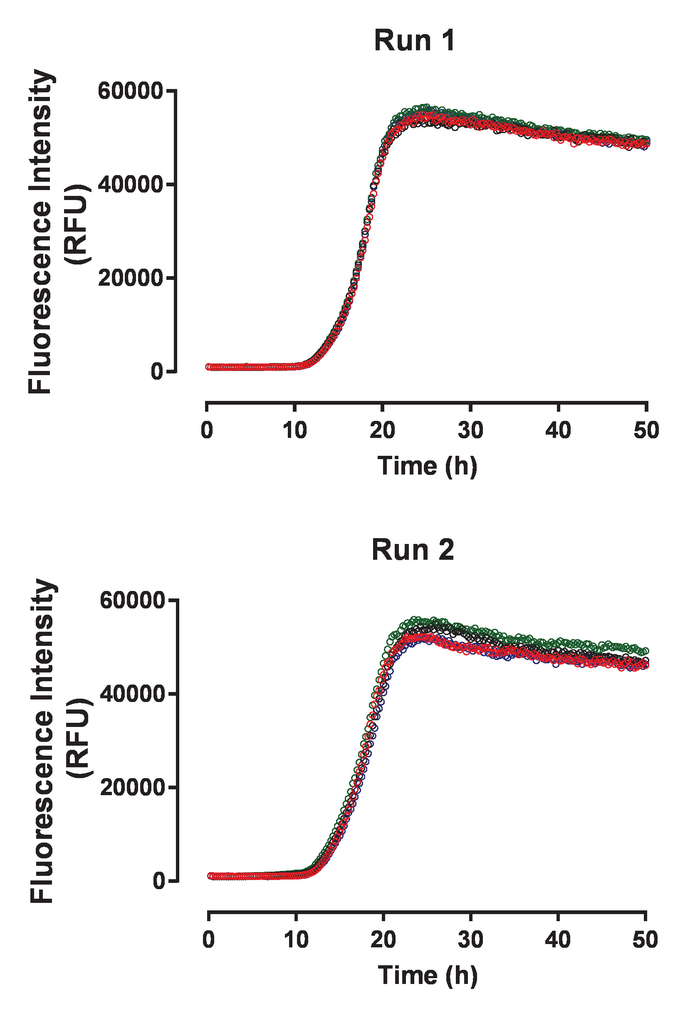
Figura 3: el análisis de la agregación de tau muestra alta reproducibilidad entre corridas experimentales independientes. Los dos paneles muestran cuatro rastros individuales cinética de agregación espontánea huTau441 recogidos en dos experimentos independientes con el mismo lote de proteína huTau441. Concentraciones de huTau441 y heparina son 15 μm y 8, respectivamente. Cinética se caracterizan por una fase de retraso promedio (con SD) de 12,2 ± 0,18 h y t50 de 17,8 ± 0,8 h (Run 1) y de 11,6 ± 0,52 h y t50 de 17,8 ± 0,23 h (Run 2), respectivamente. Datos cinéticos fue cabidos con una curva logística 5 parámetros con una disminución lineal en la asíntota superior. T50 se calcularon por interpolación entre los valores predichos por la regresión lineal. Fase lag se calcula basándose en el aumento de 3% de la señal de fluorescencia de ThT. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: el análisis de la agregación de tau muestra alta reproducibilidad entre lotes diferentes de la proteína de huTau441. Cada panel muestra que cuatro repeticiones correspondientes a un lote específico huTau441. La agregación de cada lote fue seguida en experimentos independientes. Concentraciones de huTau441 y heparina son 15 μm y 8, respectivamente. Cinética de agregación corresponde la tau individual cuatro lotes se caracterizan por una fase de retraso promedio (con SD) de 15,3 ± 0,38 h y t50 de 21,1 ± 0,46 h (lote 1); fase lag de 12,5 ± 0,07 h y t50 de 19,8 ± 0,34 h (lote 2); retraso de fase de 15,1 ± 0,34 h y t50 de 21,9 ± 0,86 h (lote 3) y retraso de fase de 11.5 ± 0,29 h y t50 de 17,8 ± 0,29 h (lote 4), respectivamente. Datos cinéticos fue cabidos con una curva logística 5 parámetros con una disminución lineal en la asíntota superior. Retraso de fase y t50 se calcularon por interpolación entre los valores predichos por la regresión lineal. Fase lag se calcula basándose en el aumento de 3% de la señal de fluorescencia de ThT. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: agregados preformados hutau441 tienen alta siembra actividad. Para iniciar la siembra, agregados de tau sonicado se añadieron al monómero hutau441. De rojo a azul, cada color de las diferentes curvas de cinéticas representa la diferente cantidad de semillas mayor: 1.25%, 0,63%, 0.31%, 0,16%, 0.08%, 0,04%, 0,02%, 0,01%, 0.005% y 0.0025% (v/v), respectivamente. Conversión espontánea de hutau441 se representa en negro. Todas las condiciones se analizaron por cuadruplicado. Las cuatro repeticiones cinéticas asociadas a una cierta concentración de semillas son altamente reproducibles y en muchos casos indistinguibles. Concentraciones de hutau441 y heparina son 15 μm y 8, respectivamente. La adición de pequeñas cantidades de formadas estructuras fibrilares sonicación elimina la fase de retraso inicial en la conversión espontánea y el efecto es proporcional a la cantidad de semillas. De rojo a azul, la diferencia de t50 observado (t50 spont.conv-t50 siembra) es horas 18.9, 18,40, 17.8, 17.3, 16,6, 16.1, 15.4, 14.7, 14.2 y 13.7, respectivamente. Conversión espontánea de hutau441 se caracteriza por un promedio t50 (con SD) de 19.85 ± 0,54 h. datos cinéticos fue cabido con una curva logística 5 parámetros con una disminución lineal en la asíntota superior. t50 se calcularon por interpolación entre los valores predichos por la regresión lineal. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
A pesar de numerosos esfuerzos, la cinética de la agregación de tau divulgado en la literatura a la falta de la fecha el nivel deseado de reproducibilidad o algunas de las características de una nucleación dependiente polimerización19,20,21 , 22 , 23 , 25. esto a menudo se acentúa por la falta de una fase lag, sembrando ineficiente y naturaleza no fibrilar de agregados de tau. La razón de estas deficiencias puede variar e incluye calidad de proteína tau óptimo (fragmentación, presencia de agregados de baja pureza, etcetera.), elección de la proteína y la inducción de reactivos y condiciones experimentales. Otro factor que complica son los dos residuos de cisteína situados alrededor de la interfaz de la agregación de tau pueden intra - o inter - puentes disulfuro molecular dependiendo del ambiente redox y afectan la eficiencia de la agregación de tau. En los enfoques más reducción de reactivos tales como TDT o TCEP se han utilizado para mantener los residuos de cisteína en formas reducidas y así aumentar los niveles de reproducibilidad25. Además, el coeficiente de extinción de tau es muy baja que conduce a dificultades para mediciones precisas de la concentración de proteína.
Nos centramos especialmente en unos parámetros y atributos de calidad que consideramos cruciales para un perfil de agregación sólido, reproducible y representativa para la proteína tau: elimina la posibilidad de intra - y inter-formación del disulfuro molecular, generación de un monómero tau altamente puro y mejorar la exactitud de la determinación de la concentración. Todos estos reactivos relacionados con preguntas son posibles puntos de atención que consideramos esenciales para el desarrollo óptimo del ensayo. Para abordar estas cuestiones, longitud total huTau441 se expresó con dos mutaciones, C291A y C322A y con las etiquetas N y C terminal. Mutación de los residuos de cisteína tiene un impacto mínimo en la proteína tau, eliminando el muy difíciles controlar el puente disulfuro. Expresando la proteína con las etiquetas relativamente corto N - y c-terminal nos permitió seguir un protocolo de purificación de afinidad de dos etapas que condujeron a la muy alta pureza, la integridad y el contenido de monómero. Además, hemos introducido una mutación F8W que aumentó el coeficiente de extinción de la proteína y permite mucho más precisa de las mediciones de concentración24.
Además de utilizar reactivos de proteína de alta calidad, también fueron optimizados otros parámetros de análisis. El tau óptima: cociente de la heparina fue identificada para ser alrededor de 0,5 (M/M) que está en consonancia con los estudios previamente publicados26. Además, configuración instrumental mecánico y óptico es cruciales para garantizar la reproducibilidad y los parámetros óptimos pueden diferir en cierta medida dependiendo del fabricante.
La agregación de tau que se describe en este ensayo muestra características que se asociado con la patogénesis de la tau en AD y relacionadas con tauopatías. El proceso comienza con una fase de retraso inicial correspondiente a la formación de núcleos de alta energía y es seguido por una fase de rápido crecimiento que corresponde al crecimiento de la fibrilla. El tiempo es suficientemente largo para abrir una ventana amplia para estudiar en detalle el proceso de transferencia que abarcan una amplia gama de concentraciones de semillas (figura 5) mientras que todavía no demasiado largo por lo que se evita la degradación de las proteínas o agregación inespecífica (figura 2). estos eventos secundarios podrían suceder especialmente cuando una proteína intrínsecamente desordenada como huTau441 se expone durante largos períodos de tiempo en condiciones fisiológicas. La pantalla de agregados de tau obtenidos la morfología de los PHFs aislado de cerebros de pacientes con EA y son muy eficaces en el reclutamiento tau monomérica y conversión a de novo genera agregados, un proceso que se denomina siembra. El ensayo es altamente reproducible, las curvas cinéticas siendo prácticamente indistinguible entre pozos, funcionamientos experimentales y lotes de proteínas. Aunque el ensayo actual se centra sólo en la más larga isoforma tau, huTau441, la aplicación puede ser adaptada para el estudio de la conversión de otras formas de tau (Ameijde et al., Acta Neuropathologica comunicaciones, en prensa) además, permite estudios mecanísticos se centró en la interacción de los isoforms del tau y posiblemente arrojan luz sobre las diferencias entre la patogénesis de la tau en AD donde 3R y 4R isoformas están presentes en PHFs y de PICK enfermedad o Demencia Frontotemporal donde la patología tau contiene principalmente 3R y 4R isoforms del tau, respectivamente27.
La muy alta reproducibilidad de la prueba debe permitir que los lectores a aplicar con relativa facilidad en sus entornos de laboratorio específicas. El ensayo imita lo que se cree para ser en vivo mal plegamiento y agregación de tau, permitiendo estudios mecanísticos que arrojan luz sobre la patogénesis de tau y constituye una herramienta valiosa para la detección de fármacos candidatos y evaluar su interferencia con los diferentes pasos del proceso de patogénesis.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Hector Quirante para la expresión y purificación de huTau441, Hanna Inganäs y Margot van Winsen excelente soporte técnico y Martin Koldijk para análisis de datos.
Materiales
| Name | Company | Catalog Number | Comments |
| Thioflavin T | Sigma-Aldrich | T3516-5G | dry powder (Mw = 318.86 g/mol) |
| Heparin | Sigma-Aldrich | H3393-50KU | dry powder (Mw = 17-19 kDa) |
| TCEP | Sigma-Aldrich | 75259-1G | dry powder (MW= 286.65 g/mol) |
| PBS | Gibco-Life Technologies | 10010-015 | Sterile, pH 7.4 (1X) |
| 0.22 μm sterile filter | Corning | 431160 | PES membrane |
| 0.20 μm sterile serynge filter | Corning | 431229 | PES membrane |
| 96-well microplates | Thermo Scientific | 9502867 | Black, flat botton |
| Microplate sealers | R&D Systems | DY992 | Adhesive strips |
| Synergy Neo2 Multi-Mode Microplate Reader | Biotek | Synergy Neo2 | Hybrid Technology, Gen5 Software |
| Eppendorf Tubes | Eppendorf | 0030 120.086 | 1,5 ml tubes |
| Ultrasonics-Branson SFX250 | Branson | 101-063-966R | 1/2" Solid Horn and 1/8" microtip |
Referencias
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. The New England Journal of Medicine. 362 (4), 329-344 (2010).
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annual Review of Neuroscience. 24, 1121-1159 (2001).
- Goedert, M., Wischik, C. M., Crowther, R. A., Walker, J. E., Klug, A. Cloning and sequencing of the cDNA encoding a core protein of the paired helical filament of Alzheimer disease: identification as the microtubule-associated protein tau. Proceedings of the National Academy of Sciences of the United States of America. 85 (11), 4051-4055 (1988).
- Himmler, A., Drechsel, D., Kirschner, M. W., Martin, D. W. Tau consists of a set of proteins with repeated C-terminal microtubule-binding domains and variable N-terminal domains. Molecular and Cellular Biology. 9 (4), 1381-1388 (1989).
- Mandelkow, E., von Bergen, M., Biernat, J., Mandelkow, E. M. Structural principles of tau and the paired helical filaments of Alzheimer's disease. Brain Pathology. 17 (1), 83-90 (2007).
- Lee, V. M., Balin, B. J., Otvos, L., Trojanowski, J. Q. A68: a major subunit of paired helical filaments and derivatized forms of normal Tau. Science. 251 (4994), 675-678 (1991).
- Wischik, C. M., Harrington, C. R., Storey, J. M. Tau-aggregation inhibitor therapy for Alzheimer's disease. Biochemical Pharmacology. 88 (4), 529-539 (2014).
- Pickhardt, M., et al. Identification of Small Molecule Inhibitors of Tau Aggregation by Targeting Monomeric Tau As a Potential Therapeutic Approach for Tauopathies. Current Alzheimer Research. 12 (9), 814-828 (2015).
- Paranjape, S. R., et al. Azaphilones inhibit tau aggregation and dissolve tau aggregates in vitro. ACS Chemical Neuroscience. 6 (5), 751-760 (2015).
- Seidler, P. M., et al. Structure-based inhibitors of tau aggregation. Nature Chemistry. 10 (2), 170-176 (2018).
- Apetri, A. C., Vanik, D. L., Surewicz, W. K. Polymorphism at residue 129 modulates the conformational conversion of the D178N variant of human prion protein 90-231. Biochemistry. 44 (48), 15880-15888 (2005).
- Crespo, R., Rocha, F. A., Damas, A. M., Martins, P. M. A generic crystallization-like model that describes the kinetics of amyloid fibril formation. Journal of Biological Chemistry. 287 (36), 30585-30594 (2012).
- Holmes, B. B., et al. Proteopathic tau seeding predicts tauopathy in vivo. Proceedings of the National Academy of Sciences. 111 (41), E4376-E4385 (2014).
- Surewicz, W. K., Jones, E. M., Apetri, A. C. The emerging principles of mammalian prion propagation and transmissibility barriers: Insight from studies in vitro. Accounts of Chemical Research. 39 (9), 654-662 (2006).
- Jeganathan, S., von Bergen, M., Mandelkow, E. M., Mandelkow, E. The natively unfolded character of tau and its aggregation to Alzheimer-like paired helical filaments. Biochemistry. 47 (40), 10526-10539 (2008).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- Kampers, T., Friedhoff, P., Biernat, J., Mandelkow, E. M., Mandelkow, E. RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments. FEBS Letters. 399 (3), 344-349 (1996).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. American Journal of Pathology. 150 (6), 2181-2195 (1997).
- Barghorn, S., Mandelkow, E. Toward a unified scheme for the aggregation of tau into Alzheimer paired helical filaments. Biochemistry. 41 (50), 14885-14896 (2002).
- Friedhoff, P., Schneider, A., Mandelkow, E. M., Mandelkow, E. Rapid assembly of Alzheimer-like paired helical filaments from microtubule-associated protein tau monitored by fluorescence in solution. Biochemistry. 37 (28), 10223-10230 (1998).
- Morozova, O. A., March, Z. M., Robinson, A. S., Colby, D. W. Conformational features of tau fibrils from Alzheimer's disease brain are faithfully propagated by unmodified recombinant protein. Biochemistry. 52 (40), 6960-6967 (2013).
- Ramachandran, G., Udgaonkar, J. B. Mechanistic studies unravel the complexity inherent in tau aggregation leading to Alzheimer's disease and the tauopathies. Biochemistry. 52 (24), 4107-4126 (2013).
- Sui, D., Liu, M., Kuo, M. H. In vitro aggregation assays using hyperphosphorylated tau protein. Journal of Visualized Experiments. (95), e51537 (2015).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta Neuropathologica Communications. 6 (1), 43 (2018).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Zhu, H. L., et al. Quantitative characterization of heparin binding to Tau protein: implication for inducer-mediated Tau filament formation. Journal of Biological Chemistry. 285 (6), 3592-3599 (2010).
- Buee, L., Delacourte, A. Comparative biochemistry of tau in progressive supranuclear palsy, corticobasal degeneration, FTDP-17 and Pick's disease. Brain Pathology. 9 (4), 681-693 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados