Method Article
イメージング 2 光子生体顕微鏡を用いたインフルエンザ ウイルス感染症の中に気管粘膜の細胞相互作用
* これらの著者は同等に貢献しました
要約
本研究ではマウスの気管粘膜のインフルエンザ ウイルスに感染後 2 光子生体イメージングと細胞の相互作用の解析を実行するためのプロトコルを提案する.このプロトコルは、呼吸器感染症の中に免疫細胞動態を調査している研究に関連するされます。
要約
細胞または細胞病原体相互作用体内の分析は、感染に対する免疫応答のダイナミクスを理解する重要なツールです。2 光子生体顕微鏡 (2 P IVM) は、画像集録中に生成された退色を最小限に抑えながら生きている動物、深部組織の細胞の相互作用の観察することができます。日には、リンパ系および非リンパ系臓器の 2 P IVM のさまざまなモデルが記載されています。ただし、呼吸器官のイメージングは、動物の呼吸サイクルに伴う動きのための挑戦を残ります。
ここでは、体内の免疫細胞の相互作用気管内 2 P IVM を使用してインフルエンザ ウイルス感染マウスを視覚化するプロトコルについて述べる.この目的に、手術手技と好中球と粘膜上皮における樹状細胞 (DC) の動的な画像の取得に続いて、気管挿管が含まれてカスタム画像処理プラットフォームを開発しました。また、気管内のインフルエンザ経鼻感染と流れフローサイトメトリー解析免疫細胞の実行に必要な手順を詳しく説明します。最後に、映画のコースの中に好中球 DC 運動との相互作用を分析しました。このプロトコルは、気管の細胞間相互作用の評価に必要な安定性と明るい 4 D 画像の生成のためできます。
概要
光子生体顕微鏡 (2 P IVM) は、彼らがその自然環境1で発生すると、リアルタイム イメージング細胞間相互作用のための効果的な手法です。この方法の主な利点の 1 つは他は従来のイメージング技術2と比較して試料の深さ (1 mm 500 μ m) で細胞プロセスの研究をできるということです。同時に 2 光子レーザーによって生成された 2 つの低エネルギー光子の使用は、画像集録プロセス2に通常関連付けられている組織の写真-損傷を最小限に抑えます。最後の十年の間にいくつかの分野3,4、5の細胞間相互作用の種類を勉強する 2 P IVM を適用されています。これらの研究は、特に彼らの高いダイナミズムと著名な連絡先の他の細胞と環境によって生成された信号を次の形成によって特徴付けられる免疫細胞を調査に関連するされています。2 P IVM は病原体とホストの6間の相互作用の研究にも適用されています。確かに、種類と、その結果、免疫応答7を妨げて免疫細胞間接触の期間、いくつかの病原体を変更できますは以前示されています。
気道粘膜は空輸の病原体に対する免疫応答が、最初のサイトは、8を生成されます。したがって、生体内でこの組織でホスト病原体の相互作用の解析は伝染の間にホストの防衛メカニズムの開始を理解する重要です。しかし、気道の 2 P IVM は主に画像の取得のプロセスを妥協する動物の呼吸サイクルによって生成される成果物のために挑戦。最近では、手術の異なるモデルは、イメージング マウスの気管9,10、11,12と肺13,14,15、について記載されています。 16。気管の 2 P IVM モデル肺肺胞 2 P IVM モデルが感染の後期の勉強するより適切な上気道における免疫反応の初期段階を視覚化するための優秀な設定を表します。肺を開発モデルを提示するレーザーの光の透過を制限し、肺の気道の粘膜を生体内でイメージ投射17 にアクセスできなくなる空気で満たされた肺胞の存在に関連付けられている制限.逆に、連続上皮によって形成された気管の構造は、画像の取得を促進します。
ここでは、インフルエンザの感染、動物の手術の準備、気管の 2 P IVM を実行に必要な手順の詳細な説明が含まれているプロトコルを提案します。さらに、好中球、樹状細胞 (DC) インフルエンザ ウイルス18,19 に対する防御機構の仲介人として重要な役割を果たす 2 つの免疫細胞の種類の可視化の特定の実験の設定を述べる.最後に、好中球 DC の相互作用を分析する手順をについて説明します。これらの連絡先は、DC の活性化を調節するために示されていると、その後20病原体に対する免疫応答に影響を与える。
プロトコル
含むマウスはスイス連邦獣医局のガイドラインと動物のプロトコルに従って行われた動物のすべての手続きは、ローカル獣医当局によって承認されました。
1. CD11c YFP マウスのインフルエンザ
- バイオ セーフティ
注:、(PR8) A/Puerto リコ/8/34 新型インフルエンザ a/h1n1 のマウス適応ひずみが受精卵の成長は、精製し、前述21として滴定します。すべての感染した動物や生物学的サンプルに関連する手順は 2 つの条件バイオ バイオ セーフティー レベル (BSL) によると内閣の下で実施。- 感染症プロシージャの前後には、70% エタノール溶液による安全キャビネットをきれいに。
- 次適切な人にバイオ セーフティ指針 (http://www.who.int/csr/resources/publications/biosafety/Biosafety7.pdf) この手順中に生成される全ての廃棄物を破棄します。オートクレーブ容器の固形廃棄物および 70% エタノール溶液または医療消毒液で満たされたビニール袋に汚液を破棄します。
- インフルエンザの鼻腔内感染
注: B6。Cg Tg(Itgax-Venus) 1Mnz/J (CD11c YFP)22 c57bl/6 j の背景には、この研究で使用されました。マウスは、生物医学の研究所特定病原体無料施設で維持されました。- 1 檻あたり最大 5 歳- と性別をマッチさせた (8 週齢に 6) CD11c YFP マウスを配置します。感染手順の前に住宅事情にマウス順化、少なくとも 2 日間待ちます。
- PR8 株式を解凍し、続けるウイルス希釈 30 μ L。 ダルベッコ リン酸バッファー生理食塩水は、200 のプラーク形成単位 (PFU) の最終的な集中を取得する塩化カルシウムと塩化マグネシウム (PBS) なし変更冷たいの 1 x を使用して対応する希釈を準備全体の手順中に氷の上
注:使用前にインフルエンザ ウイルスのあらゆるバッチの滴定は正確な感染用量を確保するためお勧めします。 - ケタミン (100 mg/kg) とキシラジン (10 mg/kg) の投与量を腹腔内に注入 (i. p.) 26 G 針 1 mL 注射器を使用しています。
- マウスが完全に麻酔 (立ち直りとペダルの逃避反射の完全な損失) まで待ちます。深い麻酔は、ない完全に麻酔下マウスが飲み込むか、または伝染の線量の変動につながるウイルスの接種材料を追放から最適な伝染に必要です。
- 仰臥位で, 麻酔下のマウスを置きます。ウイルスの接種材料の 15 μ L を収集します。マウスの左の鼻孔に近いピペット チップを置き、滴ずつ接種ウイルスを分配します。水滴を吸入する必要があります、鼻の空洞の中に直接それらのピペットはないです。
- 2-5 分を待ってから、ピペット チップを右の鼻にウイルスの接種材料の残りの 15 μ L を含みます。
注: 窒息を避けるためには、小型滴を約 20 秒間隔で済ます。 - マウスが正しく呼吸は確認し、横褥瘡でケージに。マウスの呼吸と麻酔の回復 (誘導後約 60 分) を監視します。
注: それは同時に 1 以上のマウスに感染する可能です。この場合、シーケンス内のすべてのマウスの左の鼻孔で接種ウイルスを管理、2-5 分待つし、右の鼻にウイルスを管理します。個体間のばらつきを避けるためには、同時に 3 つ以上のマウスに感染します。 - 動物の健康状態や体重減少を毎日監視します。
- 機関のガイドラインの定める人道的エンドポイントに従ってマウスを安楽死させます。安楽死法は動物実験当局によって承認されなければならないし、ローカル倫理規程を尊重する必要があります。2 光子の実験の後に、頚部転位続いてケタミン ・ キシラジンの過量投与によるマウスを安楽死させます。他の実験では、安楽死の方法として CO2吸入を使用します。
注: 感染した気管、50% 組織培養感染量 (TCID50) アッセイまたは実質の時間のポリメラーゼの連鎖反応のウイルス抗体価を測定するには、(RT-PCR) 法は前述23として実行できます。
- フローサイトメトリーによる気管で好中球動員の評価
注: プロトコルのこの部分はオプションです。それは評価気管粘膜インフルエンザ感染における好中球の動員を目指しています。- CO2吸入することによって感染後 3 日目 (探偵) に感染し、感染していないコントロール マウスを安楽死させます。
注: 気管の損傷を防止するためには、動物の安楽死頚部転位を使用しないでください。また、安楽死させたマウスの灌流血好中球からの汚染を避けるためにお勧めします。 - マウスの首を 70% エタノール溶液にスプレーし、胸から外科はさみを使用してあごに皮膚切開を行います。
- 鉗子を使用して唾液腺を分離し、, 気管を公開します。
- 鉗子、はさみを使用して気管の周りの筋肉を解剖します。
注: この手順は、気管はプロシージャの間に簡単に破損している可能性がありますので慎重に実行する必要があります。 - 鉗子で気管を押しながら慎重に解剖して食道をデタッチします。
- 鉗子で気管の胸腔内の一部を保持して、気管支の初めに切開を行います。喉頭から気管をデタッチし、左の筋肉を注意深く取り外します。
- RPMI 1640 + HEPES 媒体 (RPMI) 氷の上を含む 1.5 mL チューブに器官を配置します。
- コラゲナーゼ (I および II) の 0.26 ユニット/mL と DNase の 0.2 mg/mL を含む気管消化酵素混合物を準備 RPMI で。
- 1 mL の酵素の混合を含む 6 ウェル プレートに切り裂かれた気管を配置します。
- 鉗子、はさみの助けを借りて、小さな断片に器官をカットします。このステップの間に氷の上プレートを保ちます。
- 45 分の 37 ° C で孵化させなさい。この時、プレート 15 分毎を振る。
- PBS で 1 mL の FACS 洗浄バッファー (2 mM EDTA および 2% 熱不活化フィルター滅菌ウシ胎児血清 (FBS)) を追加することによって酵素の消化力を停止します。
- 組織の部分的に未消化の部分の関連付けを解除するために 1 mL ピペットでソリューションを再懸濁します。
- 40 μ m ストレーナーを介してコンテンツを渡すことによって、また一つにソリューションを転送します。その後、優しくスマッシュ 2 mL シリンジのプランジャーを使用するストレーナーの上に閉じ込められた器官の残りの部分。
注: こし器を気管の部分的に未消化の部分を破りフローサイトメトリー解析中に最適な細胞数を取得する重要なステップであります。 - 洗浄バッファーと転送氷で保たれる懸濁液 5 mL チューブ FACS で井戸とストレーナーを洗浄します。
- 4 ° C で 5 分間 166 x gでチューブを遠心分離します。上澄みを廃棄し、FACS 洗浄液を 100 μ l 添加の細胞を再懸濁します。
- フローサイトメトリー用抗体の表面汚損を続行します。簡単に言えば、CD16/32 表面の汚損に続いて抗体を用いた単離細胞の Fc 受容体をブロックします。好中球を正しく識別するには、流れの cytometry パネルは次の抗体を含める必要があります。 生存率と同様に、αLy6G、αCD11b、αCD45、死んだ細胞を除外する染料します。
- 流れの cytometer でサンプルの全体の内容を実行し、データを分析します。
- 免疫細胞の最適な数を取得するには、ない 3,000 イベント/秒以上の速度で単一細胞懸濁液を実行します。これは買収時に除外されたイベントの数を減らすでしょう。このプロトコルを使用して、それは 1 に 200 万気管あたりのセルを取得することが可能する必要があります。
- CO2吸入することによって感染後 3 日目 (探偵) に感染し、感染していないコントロール マウスを安楽死させます。
2. 分離と好中球の注入
注: この手順では、B6.129 (ICR) の-Tg (CAG 生さ) CK6Nagy/J マウス (CK6 生さ) が使用されている24。これらの動物は、ヒト β-アクチン プロモーターの下のすべてのセル型で CFP を表現します。また、それも c57bl/6 j マウスを使用してセルを隔離して 2.6 の手順で説明されているプロトコルによると、それらを染色可能です。浄化および好中球の操作、活性化状態、潜在的、渡り鳥や機能のプロパティの変更が増加します。
- CO2吸入によって、動物を安楽死させます。
- 大腿骨と脛骨の両方を削除し、それらをきれいにやさしく鉗子を使用します。
- 骨骨を切り、氷で保たれる 50 mL のチューブで、滅菌冷 PBS でいっぱい 1 mL 注射器を使用して骨髄をフラッシュします。
- 18 G 針を用いて細胞を再懸濁し、40 μ m ストレーナー付け細胞懸濁液をフィルターします。4 ° C で 5 分間 110 x gで PBS で 1 回洗浄し、2 mL の冷 PBS で細胞を再懸濁します。
-
希釈 100% Percoll 9:1 10 x PBS で percoll 72%, 64%, 52 %1x PBS を使用してのグラデーションのソリューションを準備。慎重に 2 mL の各 15 mL チューブで 3 つのグラデーションをレイヤー、1 つを集中してから開始。
- 1,100 × g室温 (RT) 加速とブレーキなしで 30 分で 2 mL を慎重にグラデーションと遠心分離機の上に骨髄細胞懸濁液を追加します。
- 慎重に 64%、72% 間のインターフェイスでバンドを削除、200 x g冷 PBS の 4 ° C で 5 分間で一度洗います。Pbs 100 μ L のボリュームで細胞を再懸濁します、氷の上にそれらを保ちます。好中球の純度は 90% よりも高くなる予定です。
- 必要に応じて、ラベル好中球と製造元のプロトコルを使用して細胞増殖キット。最終濃度 1 mL の量で 10 μ M の細胞懸濁液に染料を追加、37 ° C、30 分インキュベート (166 x g、5 分) を洗います。
- 診断を用いた細胞濃度を推定し、26 G 針 1 mL 注射器、イメージングの前に 12 h を使用して以前の感染 CD11c YFP+マウスの 100 μ L の最大音量で静脈内 5 x 10 の6セルを挿入します。
3. イメージング用マウスを準備
-
麻酔
- 1.2.3 のステップによると接種後 3 日で感染した CD11c YFP+マウスを麻酔します。
- マウスは麻酔が深く、一度カテーテルが、麻酔は再投与することを備えることができます。
- 30 G 針を注射器鉗子を使用してから削除します。
- PE 10 医療シリコン チューブの 20 cm の部分に針を挿入します。
- チューブの反対側にケタミン ・ キシラジンの混合物でいっぱい 30 G 針の注射器を挿入します。
- チューブ内の空気を除去します。
- (図 1 a私) 自動換気を維持するために酸素 insufflating マシンからチューブに接続して 20 G カテーテルを準備します。100% 酸素ガス供給を使用して 0.2 mL の一回換気量を 130 ビート/分 (b.p.m。) の息比率を設定します。
-
手術のためマウスを準備します。
- 加熱平板または温水手術ベンチ 37 ° C で手術のすべての時間の設定上特定のカスタマイズされた手術ボード (図 1 aii-iii) 上でマウスを維持します。
- 電気かみそりや脱毛クリームを使ってマウスの首から髪の毛を剃る (図 1 b私).
- プラスチック マウス上のマウス位置を配置 (図 1 aii で)、位置情報の外部動物の頭部を維持する (図 1 bii) 気管挿管を容易にする角度を作成します。
- 前肢、足と尾、サージカル テープ固定、濃縮ビタミン A ゲルでマウスの目を湿らし、マウス首 (図 1 bii) を消毒します。
-
手術
- 正しくオートクレーブ項目、すなわち、はさみ、顕微鏡のハサミ、鉗子を準備します。
- 首、胸の上部と下顎骨 (図 1 biii) の低い点を通る線の間の中流域で約 1 cm 長い、長い内側の軸に小切開を実行します。
- 皮膚パッチや唾液腺横移動し、筋肉で覆われて、気管を視覚化します。その後、鉗子 (図 1 biii) を慎重に使用する気管の筋肉を解剖します。
- カテーテルでマウスを挿管し、人工換気 (図 1 biv) を開始します。
注: カテーテルは、気管の粘膜と内側の鉄針保護外部プラスチック部分で構成されます。針のプレゼンスを拡張して気管を安定させると、博覧会を規制するための理想的なソリューションを表します。カテーテルによる人工換気は、マウスの適切な呼吸が保証されます。 - すぐに呼吸モニター マウスに人工換気を開始します。
- カテーテルの高さと手術の基板 (図 1 aii b) 特定のロッドに接続されている手術フック (図 1 bv) を使用して方向を修正します。あごの同じ高さで気管を公開します。
- ワセリンと気管を囲み、臓器 (図 1 bvi) に適切な水分補給を保証する事前に加熱された PBS を数滴でそれをカバーします。
- Coverslip の準備の上にマウントします。この手順では、XYZ の翻訳者 (図 1 aii c) にねじ込み、金属ホルダー (図 1Bvii) の coverslip を接着します。手術の準備の上に coverslip を配置する XYZ 翻訳を調整します。
- 腹腔内麻酔の管理のためのカテーテルを置く (図 1Bviii)。
- ケタミン ・ キシラジン混合物 30 分毎の初期投与量の 50% を挿入します。
注: 最初のケタミン ・ キシラジンの混合物の 25% から 50% 再投与は安全で有効な代替25です。ただし、このプロトコルは、端末全体の手順中に動物の厳格な固定が必要なので、麻酔の深い外科平面を維持するために高用量を使用します。
4.体内タイムラプス イメージング
注: 画像の取得は 25 X、恒温培養室、2 つの Ti:Sa レーザーを装備、直立二光子励起顕微鏡で行った/NA 1.1 水浸対物レンズです。フォトマル (PMT) 画像の取得に使用されたハイブリッド検出器または高感度 GaAsP。
- (37-38 ° C に予熱) 顕微鏡培養チャンバー内麻酔下のマウスを使って手術のボードを配置し、上、水の滴を追加します。
- 気管の組織にフォーカスをセンターと検索。
-
520 × 520 ピクセル、440 × 440 μ m2のビューのフィールドでスキャン周波数を 800 Hz に設定し、線の平均 1。
- 曲 Ti:Sa レーザー 830 nm からコラーゲン、150 のソースで電力の指示と第二高調波発生 (SHG) を励起する mW。920 で 2 番目の Ti:Sa レーザーをチューニング 94 nm mW CFP と YFP の両方を刺激するソース。
- 設定 3 D と同時励振タイムラプス アクイジション ・ モード
注: は、退色と光毒性を最小限に抑えるため可能な限り低レーザー力を保持します。
- 560 でマスター ダイクロイック ミラーとの非 descanned モードで 2 つのチャネルを使用してレコードの蛍光 nm。このプロトコルで使用され、セットアップの 2 番目のダイクロイック ミラー分割 495 で信号分離する nm チャンネル チャンネル 2 (排出フィルター 525/50) から 1 (排出フィルター 475/50) (図 2 a)。この構成収集 SHG 光の最初のチャネルのコラーゲンから CFP 排出が両方のチャンネル 1 と 2 で収集され、YFP チャンネル 2 でのみ収集されます。
- Z 軸は、3 μ m (ボクセル サイズ 0.86 μ x 3 μ m) のステップ サイズの範囲 50 μ m を定義します。記録画像すべて 30 秒 30 分の合計時間。
- 必要な場合は、複数の領域を取得します。さらなる買収を実行する前にバイタル サインをチェックし、(手順 3.3.10 参照) 必要な場合はカテーテルを麻酔を膨らませてください。
- イメージング プロセスの最後に、頚部転位続いてケタミン ・ キシラジンの過剰摂取によるマウスを安楽死させます。
5. 画像好中球 DC 運動との相互作用の処理と定量解析
注: このプロトコル専門イメージング ソフトウェアが顕微鏡データの分析に使用されました。
- 4 D 画像集録が完了すると、十分な計算リソースを持つワークステーションにファイル (データおよびメタデータ) を転送 (推奨最小システム要件: 32 GB の RAM、高速固体-国家-ドライブ、最近の CPU 専用の GPU に基づいて、大規模な並列アーキテクチャ)。
- イメージング ソフトウェアでファイルを開きます。
- ビデオを再生し、興味のセルが明確に表示されている画像のアーティファクトが存在しないことを確認します。
注: このため、サンプルの動きに輝度変化が十分に限られていることを確認します。確かに、これらは自動解析26のための課題を表しています。隣接するフレーム間のサンプルの動きが過剰な場合は、固定基準として例えば SHG チャネルを使用してドリフト補正法を適用します。これにより、セルの動きではなく、サンプルの動きより測定。さらに、明るい背景や破片、選択パラメーターとしてボリュームを使用して再建されたサーフェスを切り取る。 - CFP とコラーゲン (SHG) の間の信号を分離するために CFP+のセルに特定の共局在チャネルを生成します。このため、緑のチャネルと青のチャンネルの両方に肯定的な強度を有するボクセルのみを選択する (図 2 b私) ゲート ポリゴンを示します。
注: この手順は、顕微鏡のフィルター セットと細胞の染色によると異なる場合があります。グリーンとブルーのチャンネルの両方に十分な強度を持つボクセルのみを選択することによって実現できます。使用可能なツールの中で強度閾値に基づく共存チャネルを自動的に計算する「coloc」機能を使用できます。 されますさらに、機械学習に基づく手法は、専門家の27の監督でこの手順を使用できます。 - 検出し、CFP+セル、自動表面再構成と共局在を適切なチャネルでトラッキング (表面ツール) を追跡します。
メモ: 最終的なトラッキング エラーの手動のキュレーションと定義されたしきい値 (すなわち150 s) よりも短い期間でのトラックの除外必要があります。 - CFP と YFP の信号を分離するために CD11c YFP+のセルに特定の共局在チャネルを生成します。このため、ゲート多角形 (図 2 bii) 緑のチャンネルで肯定的な強度が、青チャンネルの低強度を有するボクセルのみを選択するを示します。
注: チャンネル 1、チャンネル 2、CFP の共局在チャネル、YFP のための共局在のチャネルすべてのチャンネルの組み合わせからの信号を示す代表的な顕微鏡写真を図 2 biiiで見つけることができます。 - CD11c YFP+細胞の表面を再構築し、時間 (サーフェス ツール) をかけて自分の位置を追跡します。
メモ: 最終的なトラッキング エラーの手動補正はこのステップの必要はありません。確かに、DC の複雑の時空間的ダイナミクスによる 2 P IVM データから正確な表面を再構築は利用できる分割ソフトウェアでは実現できないやりがいのある作業です。挑戦的なこの作業を行う理由の間で細長い突起明るさ変化できないと平滑化フィルターまたは静的しきい値など、特定の画像処理技術の利用のため。さらに、DC のネットワークでは、2 P IVM データの外見だけに基づいて単一の細胞を分離することは困難です。これらの理由はソフトウェアのパラメーターをチューニングすることによって正確な分割をしようとするのではなく、DC の非正確なサーフェスを再構築する提案します。5.8 で説明されているよう、堅牢な指標による可能性のあるエラーを処理します。 -
細胞の移動を測定します。
- CFP+と CD11c YFP+細胞の古典的な移行措置をエクスポートします。、これらの中で「トラック速度平均」は、セルの方向性を示す「真直度」を追跡しながらセル平均移動速度を示します。これらの措置は、イメージング ソフトウェアからスプレッドシート ファイルとしてエクスポートできます。
- エクスポートされたスプレッドシート ファイルの計算 (修正された閉じ込め比とも呼ばれる)」修正トラック直」「トラック直」の平方根で乗算として定義されている CFP+と CD11c YFP+細胞では、「実行期間を追跡"ビデオ デュレーションの平方根で割った値。この対策は、28、トラッキング エラー由来のインスタンスを追跡短いの存在下で「真直度を追跡する」よりも堅牢です。
注: 同じ長さの動画だけは、このメジャーと比較できます。
-
細胞間相互作用を測定します。
- (最も近いボクセル) の距離がしきい値 (すなわち2 μ m) よりもより小さいか等しい場合は、CFP+ 、CD11c YFP+セル間の接触を定義します。
注: このしきい値は十分に厳密な近接セルが場合にのみ、連絡先を検出するはずです。しかし、我々 はこのしきい値を N ボクセル半径よりも大きい回理想的には 0 より大きい値に保つためにお勧め (N > 2)、境界線が平滑化ことができる細胞の再構築を実際のセル サイズよりも小さいので。 - CFP+と CD11c YFP+細胞間の接触の期間との数をカウントします。イメージング ソフトウェアにこの行うことができます例えば「キスと実行」プラグインを実行することによって。これらの措置は、[統計] タブからスプレッドシート ファイルとしてエクスポートできます。
- (最も近いボクセル) の距離がしきい値 (すなわち2 μ m) よりもより小さいか等しい場合は、CFP+ 、CD11c YFP+セル間の接触を定義します。
- 統計ソフトウェアで以前に計算されたメジャーをインポート、プロットを生成し、統計的検定を実行します。
結果
この作品で述べるvivoにおける詳細なプロトコル運動と好中球と DC の間の相互作用マウスの気管 (図 3 a) でインフルエンザ感染中。この目的を分離 CFP+好中球 (純度 92%;図 3 b)CK6 生さからマウスと我々 に対してそれらに転送 CD11c YFP マウスではインフルエンザに感染します。その後、我々 は接種後 3 日で気管の 2 P IVM を実行フローサイトメトリーによる解析 (図 3) で示すように、この時点では、感染部位に好中球の明確な募集を観察しました。2 P IVM プロトコル齧歯動物 (図 1 a) の特定の手術ボードと酸素供給器の使用が必要です。呼吸、気管の博覧会を促進し、制御する器官の動き (図 1 b) を呼吸に関連付けられている動物を助けた気管内挿入カニューレを通して酸素を供給します。この実験のセットアップでは、次の安定した 4 D 画像取得体内感染した気管内 (図 3 D映画 1) 30 分の期間中に。
細胞の移動を測定し、好中球と DC の時空間的ダイナミクスを定量化できる特殊なイメージング ソフトウェアを通じて取得した 4 D 画像の解析。細胞運動に関する DC の動きと後者 (図 4 a) よりもはるかに高速の速度を示した募集好中球有意差を観察しました。この結果は、好中球、高運動性細胞走化性因子ソース29への移行対応として前述の動的な性質を確認します。、その方向性について生産順番に減少期間と測定方向動作 (図 4 b) の高められた分散のトラックを追跡、携帯で頻繁にエラーが得られた DC の複雑な形態を締結このため、追跡期間を考慮した方向性を測定することができる堅牢なメトリックを計算しました。このメトリックを使用すると、好中球は、対DC (図 4) の方向性に大きな違いを見ました。
また、好中球と DC 間の距離の計算は、検出し、時間をかけて相手を分析するを許可しました。この実験のモデル (図 4) のイメージの期間中にすべての連絡先はありません、DC との複数簡単な連絡先を形成されたいくつかの好中球が見られました。また、時間の経過とともに好中球と DC 間の距離の平均の傾向の研究を特徴付けることの特定のセルの動向の調査、研究細胞 (図 4E) の全体的なポジショニングを研究することを許可します(図 4 階、映画 2) 各単一セルの動作。

図 1: マウスの気管の 2 P IVM の手順と装置。(Ai)自動換気担当ポータブル動物麻酔システムは、マウスに酸素を供給するポンプに接続されます。正面図 (Aii)と側面図 (Aiii)気管モデルに使用されるカスタムメイドの手術ボードの。プラスチック マウス位置で金属段階の構成は、(Aii は) 可動クランプ (Aii b) を保持するためのロッド、罰金、可変 XYZ 翻訳 (Aii c)。(B) 気管手術モデルの一連のステップ: (Bi) 脱毛 (Bii)、外科領域の手術のボード (Biii) 外科的気管 (Biv 博覧会で麻酔下のマウスの位置) 挿管人工呼吸、(Bv) カテーテルの固定、露出した気管を PBS (Bvi) 追加カテーテルの観察とカテーテルの (Bviii) 配置 (Bvii) 取付麻酔。この図の拡大版を表示するのにはここをクリックしてください。
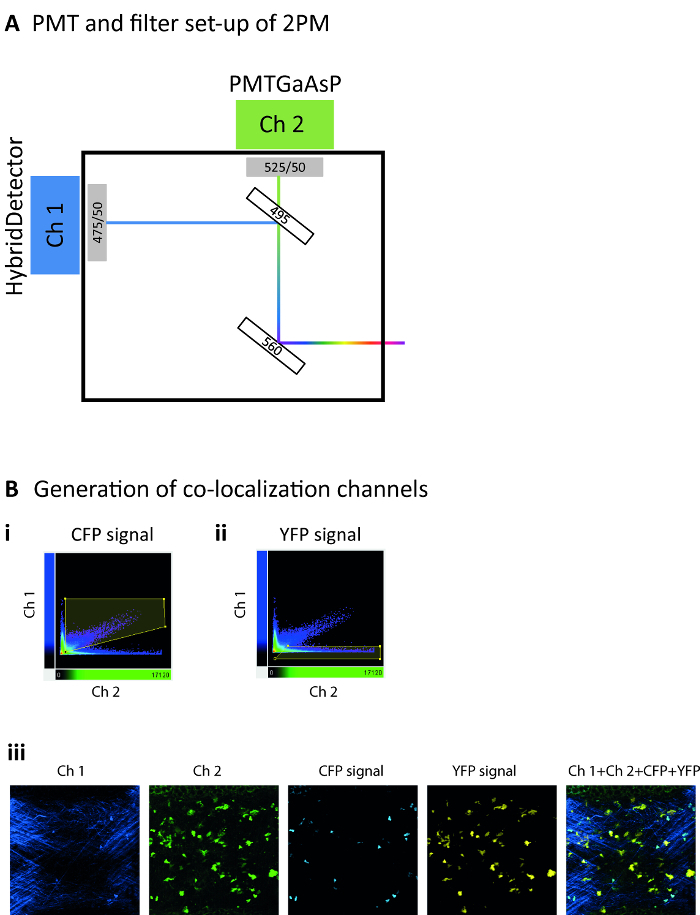
図 2: 2 P IVM の中に蛍光信号検出します。顕微鏡検出の模式図 (A) フィルター設定、対応するチャンネル。560 nm 分離青/緑赤/遠赤の排出量からのダイクロイック ミラー。495 で追加のダイクロイック ミラー nm は発光スペクトルの異なる領域をさらに認識するために使用します。チャネル 1 チャネル 2 を使用して高感度 GaAsP PMT (排出フィルター 525/50) 中のハイブリッド検出器 (排出フィルター 475/50) を採用しています。(B) 代表的な散布ドット プロット (Bi) CFP と YFP (Bii) fluorophores から来る信号を識別するための共存チャンネルの世代のゲーティングの戦略を示す 2 P 信号の。(Biii)すべてのチャンネルの組み合わせ、(黄)、YFP の共局在チャネル CFP (ライトブルー) の共局在チャネル チャネル 2 (緑 2 Ch) チャネル 1 (Ch 1、濃い青) から特定の信号を示す代表的な顕微鏡写真 (Ch 1 + Ch 2 + CFP +YFP)。この図の拡大版を表示するのにはここをクリックしてください。
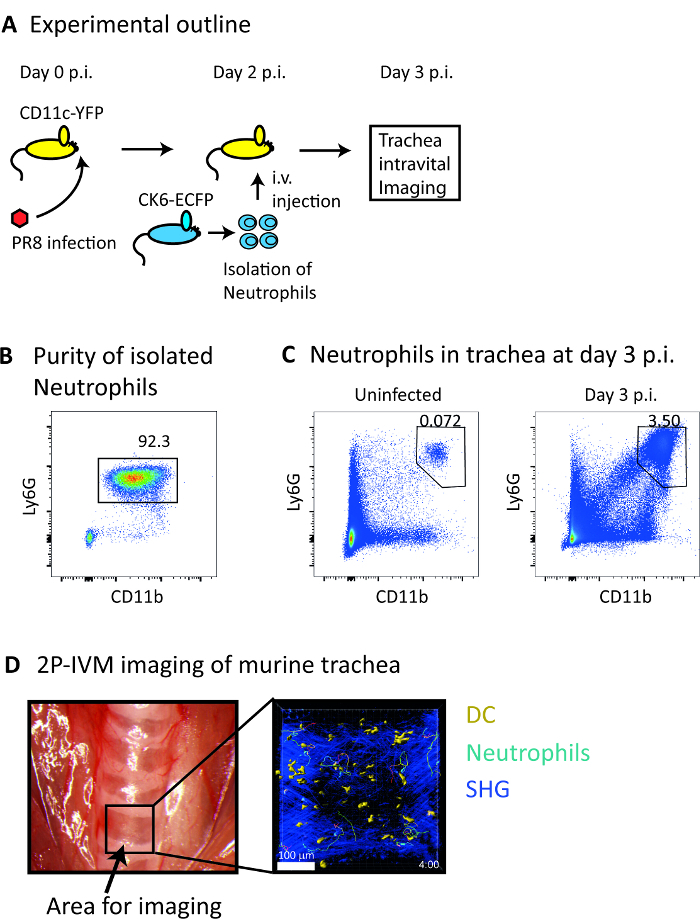
図 3: インフルエンザ感染して気管に好中球および DC の生体 4 D イメージングします。(A) プロトコルの概略。(B) 代表的なフロー フローサイトメトリーによる散布図 Percoll 勾配法を用いたマウスの骨髄から分離した細胞懸濁液の合計 CD45 + セルに対する好中球の割合を示します。(C) 代表的なフロー フローサイトメトリーによる散布図 3 日目探偵 (D) (左のパネル)、マウスの解剖学的画像でインフルエンザ ウイルス感染マウスと比較して感染マウスから気管における好中球の頻度の増加を示す気管を示す画像の取得の選択領域。(右側のパネル)探偵 SHG 信号が青暗い表示されます 3 日目で自分の曲とともに好中球 (ライトブルー) および DC (黄色) の表面の再構成を示す 2 P IVM の顕微鏡写真の代表的な 3 D 投影。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
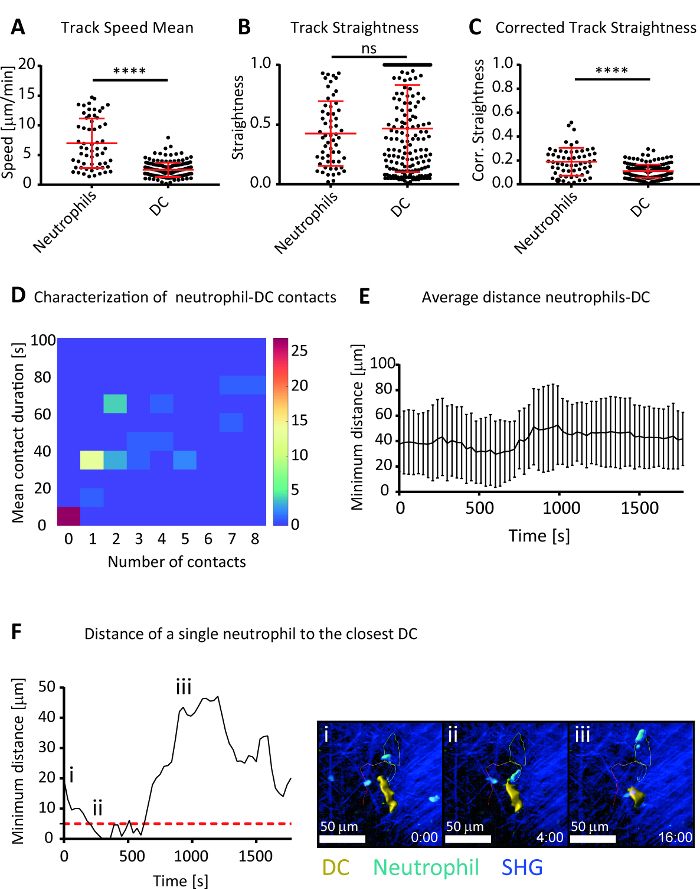
図 4: 好中球とインフルエンザ感染して気管に DC 移行と相互作用ダイナミクスの解析。トラックの速度を示す代表的なプロット (A) の意味、真直度 (B) を追跡し、(2009 年)28、好中球と、接種後 3 日で気管の DC の Beltman および同僚によって定義されているトラック真直度 (C) を修正インフルエンザ ウイルス。修正されたトラック真直度測定は、エラーを追跡する堅牢性を展示します。(D) 2次元ヒストグラムの DC と平均接触時間との接触の彼らの数によると好中球の頻度を示します。(E) 映画の期間中に最も近い DC の好中球の平均距離です。(F) (左) 代表者時間の最も近い DC に好中球の距離の分析。赤の点線は、好中球が DC との接触を確立することを考慮する距離のしきい値を示します。(右i ~ iii)顕微鏡写真 (イエロー) DC に向けて好中球 (ライトブルー) の移行を表す別の時点で取得します。セルのトラックは、青から赤の時間を表すために色を変更する色とりどりの線として表示されます。線維性コラーゲンから SHG 信号が濃い青色で表示されます。スケールバー = 50 μ m。すべての数字で表示されているデータは、少なくとも 3 つの独立実験の代表です。結果は、Welch の検定によって ± SD. 統計の意味を与えられます。ns p > 0.05;p < 0.0001。この図の拡大版を表示するのにはここをクリックしてください。

映画 1: 好中球および DC インフルエンザ感染中に気管にダイナミクス。好中球 (ライトブルー) DC (黄色) と気管のコラーゲン ネットワーク (紺) に関して、それぞれのトラックとの間の相互作用ダイナミクスを示す 30 分コマ撮りの 3 D 画像。代表的な好中球 DC の相互作用は、白い矢印で示されます。セルのトラックは、青から赤の時間を表すために色を変更する色とりどりの線として表示されます。スケールバー = 50 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)

映画 2: 代表的な短期的な好中球 DC 相互作用気管内インフルエンザ感染中です。30 分経過の 3 D 画像 (黄色) 好中球 (ライトブルー) と DC の代表的な相互作用を示すと、それぞれのトラック。セルのトラックは、青から赤の時間を表すために色を変更する色とりどりの線として表示されます。コラーゲンから SHG 信号が濃い青色で表示されます。スケール バー = 10 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
この作業は、マウスの気管にインフルエンザ感染に対して転送された好中球と DC との相互作用の移行を示す 4 D 画像の生成のための詳しいプロトコルを示します。説明 2 P IVM モデルは気道感染症における免疫細胞動態に関連します。
最近では、気道の細胞動態の可視化に基づくいくつかのモデルは先進9,10、11,12,13,14,15 をされています。 ,16。ただし、肺の生体内イメージングはまだやりがいのある、このオルガンと呼吸サイクル30の中に動きを最小限に抑えるための技術的な問題の解剖学的位置を考慮しました。これらの問題を克服するため、何人かの著者は外科的胸部13,14に挿入する必要がありますの特注円形吸引室の使用を提案している.ただし、この手順では、炎症反応の調査に焦点を当てているこれらの研究において、結果を危険にさらすことができる侵襲的介入が必要です。さらに、肺手術モデル提示17肺胞の空気によって光の屈折による深部組織イメージングの制限です。逆に、気管の異なるモデルは、気道上皮での細胞動態を研究する最近採用されています。この器官のイメージングは、公開および気管の上皮への高いアクセシビリティと同様、器官の固定に必要な比較的簡単な手術などの肺と比較して明確な利点を示します。提案された気管モデル、また気管はインフルエンザ感染8のコース期間中にウイルスの複製の最初のサイトの一つですので、インフルエンザなどの気道の病原体に対する反応の開始を調査に関連。
興味深いことに、気管のイメージング手法は最近、挿管無料の代替を示す研究は、12を公開しました。このメソッドは、減少の炎症によって特徴付けられる、上皮細胞の mucociliarity 関数が保存する必要がある研究で明確な利点を示しています。ただし、このメソッドは十分な安定性を保証しませんし、明るい信号数 μ m の範囲で細胞間の接触を逆に、勉強に必要な現在のプロトコルにおける提案手法の習得機関のより良い固定を提供しますおかげで、挿管とオルガンと coverslip12の短い距離の結果としてより強い蛍光信号の検出が可能します。
2 P IVM 画像取り込み体内中に組織の固定化を達成する、最適なデータを生成する最も重要なステップです。本手法の安定性に寄与するいくつかの重要な措置を含める: 適切なマウス麻酔;正しいマウス挿管;coverslip で器官へ簡単にアクセスができる気管の手術博覧会。また、イメージング細胞 (視野あたり理想的な 30 細胞) の数が正しい結果を強化します。セルの最適な数の募集が大部分はウイルスの接種材料の適切な管理で非常に大きなウイルスの伝染の線量に依存します。
プロトコルの別の重要なステップは、気管の手術の博覧会です。異なった手段は、手術中に臓器へのダメージを最小限に抑えるために適用できます。たとえば、気管が直接に触れてはならない手術器具。代わりに、周囲の組織の (皮膚、唾液腺、筋肉) を操作することで公開する必要があります。厳密に必要な場合、unsharpened アイテムを使用して気管を処理する必要があります。さらに、血管損傷を避けるために努力すべき。最後に、器官の脱水を防ぐためには、手術後すぐに PBS でそれをカバーすることが重要ですも。
気管粘膜の免疫細胞の相互作用の可視化のため上記の方法でこのメソッドのユニークな利点にもかかわらずこのモデルの使用は、いくつかの制限を示します。前述のように、気管の手術に関連付けられている炎症の存在は、免疫応答を勉強して欠点を表します。この制限を克服するためには、プロシージャの開始前に抗炎症薬を管理することが可能です。このモデルのもう一つの制限は、居住者の細胞と粘液層によって生成される主に気道に強い蛍光信号の存在に関連付けられます。この非特異蛍光分析に支障をきたす工芸品を作成します。さらに、比較細胞追跡期間が異なるのとトラッキング エラーは、短い期間26のトラックを導入するときトラック真直度パラメーターの誤った計算を生成可能性があります。この問題を克服するためにトラックの真直度を修正するペナルティ係数を適用されます。このような補正は、ミスの追跡結果28の影響を最小限に抑えるものです。
2 P IVM 実験の重要な側面には、手術とイメージングを受けた再使用のマウスに可能性があります。生体内でイメージ投射プロトコルがここで説明その他手術後回復する可能性を残す動物の安楽死やオルガン コレクションと再使用マウスを必要はありません。単一マウスを使用して、異なる時点でポイントが合計動物実験動物の削減の原則をサポートに必要な数を劇的に減少させる気管イメージングを実行します。さらに、それはまた個体間変動を減らすことができます。ただし、動物の回復および再利用は、復旧時に適切な鎮痛薬と動物に抗生物質の投与を含む動物福祉基準に従う必要があります。これらのすべての手順を動物実験プロトコルに含まれている、ローカル獣医当局の承認をする必要があります。
説明のプロトコルは、他の免疫細胞の種類の研究に容易に適応させることができます。たとえば、分離と蛍光 (ステンド グラス) 病原体特定の T 細胞の注入は T 細胞活性化ダイナミクス31として気管 DC など他の細胞との相互作用を研究する使用できます。同様に、血液やリンパ管の可視化は感染症の経過中に気管の組織に炎症性細胞の募集を検討する興味深いアプローチを表すことができます。また、気管の 2 P IVM は他の空輸の病原体に対する免疫応答の動態の研究にも適用でした。したがって、肺炎球菌32など遺伝子組換え蛍光、空輸の病原体の使用は、免疫システムとの相互作用を研究する新たな機会を作成します。この手順は、感染時に免疫細胞の動態を測定に焦点を当ては、がん、喘息、創傷治癒などの別のフィールドにも適用でした。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、スイス国民基金 (SNF) 補助金 (176124、145038, 148183)、欧州委員会マリー キュリー復帰グラント (612742) や D.U.P. への交付金の SystemsX.ch によって支えられた (2013/124)。
資料
| Name | Company | Catalog Number | Comments |
| Gigasept instru AF | Schülke & Mayr GmbH | 4% solution | |
| CD11c-YFP mice | Jackson Laboratories | 008829 | mice were bred in-house |
| CK6-ECFP mice | Jackson Laboratories | 004218 | mice were bred in-house |
| 1x Dulbecco's Phosphate Buffered Saline modified without Calcium Choride and Magnesium Chloride | Sigma | D8537-500ML | |
| 10x Dulbecco's Phosphate Buffered Saline modified without Calcium Choride and Magnesium Chloride | Sigma | D1408-500ML | |
| Percoll PLUS | Sigma | E0414-1L | Store at 4°C |
| Ketamin Labatec | Labatec Pharma | 7680632310024 | Store at RT, store at 4 °C when in solution of ket/xyl mixture |
| Rompun 2% (Xylazin) | Bayer | 6293841.00.00 | Store at RT, store at 4 °C when in solution of ket/xyl mixture |
| 26 G 1 mL Sub-Q BD Plastipak | BD Plastipak | 305501 | |
| 30 G, 0.3 mL BD Micro-Fine Insulin Syringes | BD | 324826 | |
| Falcon 40 µm Cell Strainer | Corning | 352340 | |
| 2 mL Syringes | BD Plastipak | 300185 | |
| Microlance 3x 18 G needles | BD | 304622 | |
| Introcan Safety 20 G (catheter) | Braun | 4251652.01 | |
| 6 Well Cell Culture Cluster | Costar | 3516 | |
| RPMI medium 1640 + HEPES (1x) | ThermoFisher Scientific | 42401-018 | Store at 4°C |
| Liberase TL Research Grade | Roche | 5401020001 | Store at -20 °C / collagenase (I and II) mixture |
| DNAse I | Amresco (VWR) | 0649-50KU | Store at -20 °C |
| CellTrace Violet stain | ThermoFisher Scientific | C34557 | Store at -20 °C |
| EDTA | Sigma | EDS-500G | |
| Fetal Bovine Serum | Gibco | 10270-106 | Store at -20 °C |
| PE-10 Micro Medical Tubing | 2Biological Instruments SNC | #BB31695-PE/1 | |
| Surgical Plastic Tape | M Plast | ||
| Viscotears | Bausch & Lomb | Store at RT | |
| Plasticine | Ohropax | ||
| High Tolerance Glass Coverslip 15 mm Round | Warner Instruments | 64-0733 | |
| SomnoSuite Portable Animal Anesthesia System | Kent Scientific | SS-01 | |
| Nuvo Lite mark 5 | GCE medline | 14111211 | |
| MiniTag (gaseous anesthesia and heating bench) | Tem Sega | ||
| SURGICAL BOARD | University of Bern | ||
| TrimScope II Two-photon microscope | LaVision Biotec | ||
| Chameleon Vision Ti:Sa lasers | Coherent Inc. | ||
| 25X NA 1.05 water immersion objective | Olympus | XLPLN25XWMP2 | |
| The Cube&The Box incubation chamber and temperature controller | Life imaging Services | ||
| Imaris 9.1.0 | Bitplane | Imaging software | |
| GraphPad Prism 7 | GraphPad | Statistical software |
参考文献
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature biotechnology. 21 (11), 1369-1377 (2003).
- Fein, M. R., Egeblad, M. Caught in the act: revealing the metastatic process by live imaging. Disease Models & Mechanisms. 6 (3), 580-593 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Cahalan, M. D., Parker, I. Choreography of cell motility and interaction dynamics imaged by two-photon microscopy in lymphoid organs. Annual review of immunology. 26, 585-626 (2008).
- Germain, R. N., Robey, E. A., Cahalan, M. D. A Decade of Imaging Cellular Motility and Interaction Dynamics in the Immune System. Science. 336 (6089), 1676-1681 (2012).
- Coombes, J. L., Robey, E. A. Dynamic imaging of host-pathogen interactions in vivo. Nature Reviews Immunology. 10 (5), 353-364 (2010).
- Pulendran, B., Maddur, M. S. Innate Immune Sensing and Response to Influenza. Life Science Journal. 6 (4), 23-71 (2014).
- Lim, K., et al. Neutrophil trails guide influenza- specific CD8 + T cells in the airways. Science. 349 (6252), (2015).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American journal of respiratory cell and molecular biology. 47 (6), 864-868 (2012).
- Kretschmer, S., et al. Autofluorescence multiphoton microscopy for visualization of tissue morphology and cellular dynamics in murine and human airways. Laboratory investigation; a journal of technical methods and pathology. 96 (8), 918-931 (2016).
- Veres, T. Z., et al. Intubation-free in vivo imaging of the tracheal mucosa using two-photon microscopy. Scientific Reports. 7 (1), 694 (2017).
- Looney, M. R., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature. 8 (1), 91-96 (2011).
- Thornton, E. E., Krummel, M. F., Looney, M. R. Live Imaging of the Lung. Current Protocols in Cytometry. 60 (1), (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and immunity. 82 (2), 864-872 (2014).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Lambrecht, B. N., Hammad, H. Lung Dendritic Cells in Respiratory Viral Infection and Asthma: From Protection to Immunopathology. Annual Review of Immunology. 30 (1), 243-270 (2012).
- Camp, J. V., Jonsson, C. B. A role for neutrophils in viral respiratory disease. Frontiers in Immunology. 8, (2017).
- van Gisbergen, K. P. J. M., Sanchez-Hernandez, M., Geijtenbeek, T. B. H., van Kooyk, Y. Neutrophils mediate immune modulation of dendritic cells through glycosylation-dependent interactions between Mac-1 and DC-SIGN. The Journal of experimental medicine. 201 (8), 1281-1292 (2005).
- Gonzalez, S. F., et al. Capture of influenza by medullary dendritic cells via SIGN-R1 is essential for humoral immunity in draining lymph nodes. Nature Immunology. 11 (5), 427-434 (2010).
- Lindquist, R. L., et al. Visualizing dendritic cell networks in vivo. Nature immunology. 5 (12), 1243-1250 (2004).
- Li, H., et al. Human Vγ9Vδ2-T cells efficiently kill influenza virus-infected lung alveolar epithelial cells. Cellular and Molecular Immunology. 10 (2), 159-164 (2013).
- Tran Cao, H. S., et al. Development of the transgenic cyan fluorescent protein (CFP)-expressing nude mouse for "technicolor" cancer imaging. Journal of Cellular Biochemistry. 107 (2), 328-334 (2009).
- Jaber, S. M., et al. Dose regimens, variability, and complications associated with using repeat-bolus dosing to extend a surgical plane of anesthesia in laboratory mice. Journal of the American Association for Laboratory Animal Science JAALAS. 53 (6), 684-691 (2014).
- Pizzagalli, D. U., et al. Leukocyte Tracking Database, a collection of immune cell tracks from intravital 2-photon microscopy videos. Scientific Data. , (2018).
- Sommer, C., Straehle, C., Kothe, U., Hamprecht, F. A. Ilastik: Interactive learning and segmentation toolkit. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 230-233 (2011).
- Beltman, J. B., Marée, A. F. M., De Boer, R. J. Analysing immune cell migration. Nature Reviews Immunology. 9 (11), 789-798 (2009).
- Keller, H. U. Motility, cell shape, and locomotion of neutrophil granulocytes. Cell motility. 3 (1), 47-60 (1983).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital Microscopy. Immunity. 21 (3), 315-329 (2004).
- Lambert Emo, K., et al. Live Imaging of Influenza Infection of the Trachea Reveals Dynamic Regulation of CD8+ T Cell Motility by Antigen. PLOS Pathogens. 12 (9), e1005881 (2016).
- Kjos, M., et al. Bright fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of bacteriology. 197 (5), 807-818 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved