Method Article
双光子活体显微镜感病毒感染时气管黏膜的影像细胞相互作用
* 这些作者具有相同的贡献
摘要
在本研究中, 我们提出了一个协议, 执行双光子活体成像和细胞相互作用分析的小鼠气管粘膜感染后流感病毒。这个协议将是相关的研究人员研究免疫细胞动力学在呼吸道感染。
摘要
细胞和细胞-病原体相互作用的分析是了解感染免疫反应动力学的重要工具。双光子活体显微镜 (2 p-病媒) 允许观察活体动物深层组织中的细胞相互作用, 同时尽量减少在图像采集过程中产生的漂白。迄今为止, 对2种对淋巴和非淋巴器官的 p 病媒进行了不同的模型描述。然而, 由于与动物呼吸循环有关的运动, 呼吸器官的成像仍然是一个挑战。
在这里, 我们描述了一个协议, 以可视化在体内免疫细胞相互作用的小鼠的气管感染流感病毒使用 2 p-病媒。为此, 我们开发了一种自定义成像平台, 包括气管的手术暴露和插管, 其次是获取粘膜上皮中中性粒细胞和树突状细胞 (DC) 的动态图像。此外, 我们详细的步骤, 以执行流感鼻腔感染和流动细胞分析的免疫细胞在气管。最后, 分析了中性粒细胞和直流运动及其在电影过程中的相互作用。该协议允许生成稳定和明亮的4D 图像, 用于评估气管内细胞间的相互作用。
引言
双光子活体显微术 (2 p-病媒) 是一种有效的技术, 实时成像细胞间的相互作用, 因为它们发生在他们的自然环境1。这种方法的一个主要优点是, 它允许在更大的试样深度 (500 µm 到1毫米) 的细胞过程研究与其他传统成像技术2相比。同时, 两光子激光器产生的两个低能光子的使用最大限度地减少了通常与图像采集过程2相关的组织光损伤。在过去的十年中, 2 p-病媒应用于研究不同类型的细胞相互作用的几个学科3,4,5。这些研究特别相关的免疫细胞, 其特点是其高活力和形成明显的接触后, 其他细胞和环境产生的信号。2对病原体与宿主6之间的相互作用也进行了研究。事实上, 以前已经表明, 一些病原体可以改变免疫细胞之间接触的类型和持续时间, 从而妨碍免疫应答7。
气道粘膜是第一个场所, 其中免疫反应的空气病原体产生8。因此,在体内分析这种组织中的病原宿主相互作用, 对于了解宿主防御机制在感染过程中的启动至关重要。然而, 2 的气道病媒是挑战, 主要是由于动物的呼吸周期产生的文物, 这破坏了图像采集过程。最近, 不同的手术模式被描述为成像小鼠气管9,10,11,12和肺部13,14,15, 16。气管 2 p-病原学模型代表了一个良好的设置, 以可视化的初期阶段的免疫反应在上呼吸道, 而肺肺泡 2 p-病原细胞模型更适合研究晚期感染。肺模型的存在与充气肺泡的存在有关, 限制了激光的光穿透, 使肺内呼吸道的黏膜层无法在体内成像17.反之, 由连续上皮形成的气管结构有利于图像的采集。
在这里, 我们提出了一个协议, 其中包括详细说明了执行流感感染所需的步骤, 动物的外科准备, 和2对气管的 p 病媒。此外, 我们描述了一个具体的实验设置, 以可视化中性粒细胞和树突状干细胞 (DC), 两种免疫细胞类型, 发挥重要作用的调解机制, 以抵御流感病毒18,19.最后, 我们描述了一种分析中性粒细胞-DC 相互作用的过程。这些接触已经显示, 以调节 DC 激活, 并随后, 影响免疫反应的病原体20。
研究方案
所有涉及老鼠的动物程序都是按照瑞士联邦兽医局的指导方针和动物协议进行的, 当地兽医当局已经批准。
1. CD11c-YFP 小鼠的流感感染
- 安全性
注: Rico/8/34 甲型h1n1 流感 (PR8) 的老鼠适应菌株生长在受精卵, 纯化和滴定如前所述21。根据生物安全水平 (BSL) 2 条件, 在生物安全柜下进行了涉及受感染动物或生物样品的所有步骤。- 在感染程序前后用70% 乙醇溶液清洁生物安全柜。
- 根据世卫组织生物安全准则 (http://www.who.int/csr/resources/publications/biosafety/Biosafety7.pdf), 丢弃在此过程中产生的所有废料。在装满70% 乙醇溶液或医用消毒剂的塑料袋中, 丢弃耐高压箱和污染液体中的固体废弃物。
- 流感鼻腔感染
注: B6。本研究采用 C57BL/6J 背景的 Cg Tg (Itgax-金星) 1 mnz/J (CD11c-YFP)22 。在生物医学研究研究所, 小鼠被保存在特定的无病原体设施中。- 每笼最多可放置5岁及性别配对 (六至八周) CD11c-YFP 鼠。在感染程序之前, 至少要等待两天的时间, 让老鼠适应住房条件。
- 解冻 PR8 的库存, 并准备相应的稀释使用冷 1x Dulbecco 的磷酸盐缓冲盐水改性不含氯化钙和氯化镁 (PBS), 以获得最终浓度的200斑块成型单位 (PFU) 在30µL. 保持病毒稀释在整个过程中的冰。
注: 建议在使用前对每批流感病毒进行滴定, 以确保准确的感染剂量。 - 使用26克针1毫升注射器注射剂量氯胺酮 (100 毫克/千克) 和甲苯噻嗪 (10 毫克/千克) 腹腔 (ip)。
- 等待, 直到鼠标完全麻醉 (完全丧失矫正和踏板撤退反射)。深层麻醉对最佳感染是必要的, 因为没有完全麻醉的小鼠会吞下或排出病毒接种, 导致感染剂量的变化。
- 将麻醉鼠置于仰卧位。收集15µL 病毒接种。把吸管尖端靠近鼠标左鼻孔, 并免除病毒接种下降。因为必须吸入水滴, 不要直接在鼻腔内吸管。
- 等待2–5分钟, 并放置在右鼻孔中含有其余15µL 病毒接种的吸管尖端。
注意: 为了避免窒息, 在大约二十年代的时间间隔内分配小尺寸滴。 - 检查鼠标是否正确呼吸并将其放置在侧压卧笼中。监测小鼠呼吸和麻醉恢复 (诱导后约60分钟)。
注意: 同时感染1只老鼠是可能的。在这种情况下, 管理病毒接种在所有老鼠的左鼻孔序列, 等待2–5分钟, 然后管理病毒在右鼻孔。为了避免个体间的变异, 在同一时间感染不超过3只老鼠。 - 每天监测动物健康状况和体重损失。
- 弄死小鼠根据权威指南确定的人道端点。安乐死方法必须得到动物实验当局的批准, 并要尊重当地的道德规范。经过双光子实验, 弄死小鼠用药过量的氯胺酮/甲苯噻嗪后颈椎脱位。在所有其他实验中, 使用 CO2吸入作为安乐死的方法。
注: 为了测量受感染气管的病毒滴度, 50% 种组织培养感染剂量 (TCID50) 检测或实时聚合酶链反应 (rt-pcr) 检测可进行如前所述23。
- 流式细胞术评价中性粒细胞在气管内的应用
注意: 协议的这一部分是可选的。目的评价在流感感染后气管黏膜中中性粒细胞的招募情况。- 弄死感染和未感染的控制小鼠在3天后感染 (私家侦探) 通过 CO2吸入。
注意: 为了防止气管损伤, 避免使用颈椎脱位弄死动物。此外, 预防安乐死小鼠的灌注是可取的, 以避免血液中性粒细胞的污染。 - 用70% 乙醇溶液喷洒鼠标颈部, 用手术剪刀从胸部到下巴进行皮肤切口。
- 用镊子将涎腺分开, 并暴露气管。
- 用镊子和剪刀解剖气管周围的肌肉。
注意: 这一步必须小心执行, 因为气管在过程中很容易损坏。 - 用钳夹住气管, 并通过解剖仔细分离食道。
- 用镊子将气管的胸腔部分托住, 在支气管树的开始处进行切口。然后把气管从喉部分离出来, 然后小心地取出剩下的肌肉。
- 将该器官放置在1.5 毫升管中, 其中含有 RPMI 1640 + HEPES 介质 (RPMI) 在冰上。
- 制备用于气管消化的酶合剂, 在 RPMI 中含有0.26 单位/毫升胶原酶 (i 和 II) 和0.2 毫克/毫升的 DNase。
- 将解剖气管放置在含有1毫升酶合剂的6井板中。
- 在镊子和剪刀的帮助下, 把风琴切成小块。在这一步, 把盘子放在冰上。
- 孵育37°c 45 分钟。在这段时间里, 每隔15分钟摇动盘子。
- 在 PBS 中加入1毫升的 (2 毫米 EDTA 和2% 种热灭活过滤-灭菌胎牛血清), 停止酶消化。
- 用1毫升的吸管并用重悬溶液, 帮助解除部分未消化的组织。
- 通过40µm 过滤器传递内容, 将解决方案转移到另一个井中。然后, 用2毫升注射器活塞轻轻粉碎被困在滤网顶部的器官的其余部分。
注: 在过滤器上粉碎部分未消化的气管是在流动细胞分析中获得最佳细胞数的关键步骤。 - 清洗井和过滤器与外地资产管制系统洗涤缓冲和转移悬浮在5毫升管保持在冰上。
- 离心管在 166 x g 5 分钟在4摄氏度。丢弃上清液, 并用重悬100µL 的细胞。
- 对流式细胞术进行抗体表面染色。简单地, 使用抗体对 CD16/32 的隔离细胞阻断 Fc 受体, 其次是表面染色。为了正确识别中性粒细胞, 流式细胞术小组应包含以下抗体: αLy6G, αCD11b, αCD45, 以及一种能排除死细胞的活性染料。
- 在流式细胞仪上运行样本的全部内容并分析数据。
- 为了获得最佳的免疫细胞数, 以不超过3000个事件的速度运行单细胞悬浮。这将减少在购置过程中排除的事件数。使用这个协议, 应该可以获得每气管1到200万的细胞。
- 弄死感染和未感染的控制小鼠在3天后感染 (私家侦探) 通过 CO2吸入。
2. 中性粒细胞的分离和注射
注意: 在这个过程中, B6.129 (ECFP) 的 CK6Nagy 和 J 小鼠 (CK6-ECFP) 使用了24。这些动物表达 CFP 在所有细胞类型下的人β肌动蛋白启动子。另外, 也可以使用 C57BL/6J 小鼠隔离细胞并根据步骤2.6 中描述的协议对其进行染色。中性粒细胞的纯化和操作可能会增加其活化状态, 有可能改变它们的迁移和功能特性。
- 弄死动物由 CO2吸入。
- 取出股骨和胫骨, 用镊子轻轻擦拭。
- 切骨骨骺和冲洗骨髓使用1毫升注射器填充无菌冷 PBS, 在50毫升的管保持在冰上。
- 用18克针并用重悬细胞, 用40微米滤网过滤细胞悬浮液。以 110 x g为5分钟, 在2毫升的冷 PBS 中, 用 PBS 在4摄氏度和并用重悬细胞上洗涤一次。
-
稀释 100% Percoll 9:1 在 10x pbs 和准备梯度解决方案的 Percoll 72%, 64% 和52% 使用 1x PBS。小心层2毫升的每一个三梯度在15毫升管, 从最集中的一个开始。
- 仔细添加2毫升的骨髓细胞悬浮在梯度和离心机在 1100 x g 30 分钟室温 (RT) 没有加速度和刹车。
- 小心地删除64% 和72% 之间的接口, 并在 200 x g清洗一次在4°c 与冷 PBS。并用重悬细胞在 100 ul 的 PBS, 并保持在冰上。中性粒细胞的纯度预计将高于90%。
- 或者, 使用制造商的协议, 用细胞增殖套件标记中性粒细胞。将染料添加到细胞悬浮液中, 最终浓度为10微米, 体积为1毫升, 孵育37°c 30 分钟, 洗涤 (166 x g, 5 分钟)。
- 用 hemocytometer 和静脉注射 5 x 106细胞, 在先前受感染的 CD11c-YFP+小鼠中使用26克针1毫升注射器, 在成像前, 用一根最大体积的 100 ul 来估计细胞浓度。
3. 准备鼠标成像
-
麻醉
- 麻醉感染 CD11c-YFP+鼠3天的私家侦探根据步骤1.2.3。
- 一旦老鼠被深深麻醉, 准备一导管麻醉再灌注。
- 用镊子从注射器中取出30克针。
- 将针插入20厘米 PE-10 医用硅管。
- 在管的另一侧插入30克氯胺酮/甲苯噻嗪混合物填充的针头注射器。
- 卸下管子内的空气。
- 准备一个20克导管连接到一个管道从氧 insufflating 机, 以保持自动通风 (图 1Ai)。将其设置为130节拍每分钟 (b.p.m.) 的呼吸比率, 其潮汐体积为0.2 毫升, 使用100% 氧气供气。
-
准备手术用鼠标
- 将鼠标放在特定的定制手术板上 (图 1Aii iii) 在加热板上, 或在手术期间设置在37摄氏度的加热手术台上。
- 使用电动剃刀和脱毛霜 (图 1Bi) 剃去老鼠颈部的毛发。
- 将鼠标放在塑料鼠标位置的上方 (图 1Aii a), 使动物头部处于定位外 (图 1Bii), 以创建一个有利于气管插管的角度。
- 用手术胶带固定前肢、爪子和尾巴, 用维生素 a 浓缩凝胶滋润老鼠眼睛, 并对鼠标颈部进行消毒 (图 1Bii)。
-
手术
- 准备适当的蒸压物品, 即剪刀、显微外科剪刀和镊子。
- 在颈部的长内侧轴上做一个小切口, 大约1厘米长, 在上胸部和穿过下颌下角的线之间的中间区域 (图 1Biii)。
- 侧移皮肤斑块和涎腺, 并可视化气管, 由肌肉覆盖。然后, 用镊子仔细解剖气管肌肉 (图 1Biii)。
- 用导管插管鼠标, 开始人工通气 (图 1Biv)。
注: 导管由外部塑料部分组成, 用于保护气管粘膜和内铁针。针的存在是延长和稳定气管和调节其博览会的理想解决方案。人工通气通过导管将保证正确的呼吸鼠标。 - 立即启动人工通风监测鼠标呼吸。
- 用手术钩 (图 1Bv) 连接到手术板上的特定杆上, 固定导管高度和方向 (图1Aii b)。将气管暴露在下巴的同一高度。
- 用石油果冻将气管围起来, 用几滴预加热的 PBS 盖住, 保证适当的水合器官 (图 1Bvi)。
- 在准备工作的顶端安装盖玻片。在这个步骤中, 将盖玻片粘附在金属支架上 (图 1Bvii), 这将被拧到 XYZ 翻译 (图 1A二 c)。调整 XYZ 翻译器, 将盖玻片放在手术准备的顶端。
- 放置导管用于麻醉腹腔的管理 (图 1Bviii)。
- 注射氯胺酮/甲苯噻嗪混合物的初始剂量的50% 每30分钟。
注: 从50% 至25% 的初始氯胺酮/甲苯噻嗪混合物中再加药是一种安全有效的替代品25。然而, 由于该协议是终端和严格的固定化的动物是需要在整个过程中, 使用更高的剂量, 以维持一个深的手术平面的麻醉。
4.体内时间推移成像
注: 图像采集采用直立双光子显微镜, 配备两个 Ti: Sa 激光器, 温度控制孵化室, 25 x/NA 1.1 水浸泡目标。用于图像采集的光电倍增管 (PMT) 要么是混合探测器, 要么是高灵敏度 GaAsP。
- 将手术板与麻醉鼠标放在显微镜孵化室内 (在37–38°c 预热), 并在盖玻片上加一滴水。
- 中心, 并发现重点在气管组织。
-
将扫描频率设置为800赫兹, 具有 520 x 520 像素, 视场为 440 x 440 微米2 , 直线平均值1。
- 调谐 Ti: Sa 激光到 830 nm 激发第二次谐波产生 (SHG) 从胶原蛋白, 与指示力在源150兆瓦。调整第二 Ti: Sa 激光在920毫微米与94兆瓦在来源, 刺激 CFP 和 YFP。
- 同时励磁3D 和 timelapse 采集模式的建立
注意: 保持激光功率尽可能低, 以最小化漂白和毒性。
- 记录荧光使用两个通道在非 descanned 模式, 与主分色镜在 560 nm。在本协议中使用的设置中, 第二个分色镜将信号分割为 495 nm, 将通道 1 (发射过滤器 475/50) 与通道 2 (发射过滤器 525/50) 分开 (图 2A)。该配置从第一通道中的胶原蛋白收集 SHG 光, 而在通道1和2中收集 CFP 发射, 而 YFP 仅在2通道中收集。
- 沿 Z 轴定义一个范围50微米, 其步长为3微米 (体素尺寸0.86 微米 x 3 微米)。每年三十年代记录图像的总持续时间为30分钟。
- 如果需要, 则获取多个区域。在运行更多的收购, 检查生命体征和注入麻醉通过导管, 如果需要 (见步骤 3.3.10)。
- 在成像过程结束时, 弄死小鼠通过氯胺酮/甲苯噻嗪过量后颈椎脱位。
5. 中性粒细胞-DC 运动和相互作用的图像处理和定量分析
注: 在本协议中, 使用专门的成像软件对显微数据进行分析。
- 完成4D 图像采集后, 将文件 (数据和元数据) 传输到具有足够计算资源的工作站 (建议的最低系统要求:32 GB RAM、快速固态驱动器、最近的 CPU、专用 GPU 基于大规模并行体系结构)。
- 打开图像软件中的文件。
- 播放视频并确保感兴趣的单元格清晰可见, 并且不存在图像工件。
注: 为此, 验证样品的运动和亮度变化是否有足够的限制。事实上, 这些都代表了自动分析26的挑战。如果相邻帧之间的样本移动过大, 则应用漂移校正方法, 例如, 将 SHG 通道用作固定参照。这样可以更好地测量细胞的运动, 而不是样本的运动。此外, 在明亮的背景或碎片的存在, 修剪重建的表面使用体积作为选择参数。 - 为 CFP+细胞生成一个联合定位通道, 以便在 CFP 和胶原蛋白 (SHG) 之间分离信号。为此, 表示一个浇口多边形 (图 2Bi), 它只选择在绿色通道和蓝色通道中具有正强度的素。
注意: 这个过程可能会因显微镜的过滤器集和细胞的染色而异。它可以通过选择只有在绿色和蓝色通道中具有足够强度的素来实现。在可用的工具中, "coloc" 功能可用于自动计算基于强度阈值的定位信道。此外, 基于机器学习的方法可用于这一步骤与专家27的监督。 - 检测和跟踪 CFP+单元格, 使用自动曲面重建和跟踪 (表面工具) 在适当的共定位通道。
注意: 可能需要手动精选最终跟踪错误和排除跟踪时间短于定义的阈值 (即150s)。 - 为 CD11c-YFP+单元格生成一个联合定位通道, 以便分离 CFP 和 YFP 信号。为此, 表示一个浇口多边形 (图 2Bii), 它只选择在绿色通道中具有正强度的素, 而蓝色通道中的强度较低。
注: 代表性显微照片显示1通道、通道2、CFP 的共用定位通道、YFP 的共用定位通道以及所有通道的组合, 可在图 2Biii中找到。 - 重建 CD11c-YFP+单元格的表面, 并跟踪它们的位置 (曲面工具)。
注意: 此步骤不需要手动更正最终跟踪错误。事实上, 由于 DC 的复杂时空动力学, 从 2 p-病媒数据中重建其精确表面是一项具有挑战性的任务, 可用的分割软件无法实现。在使这项任务具有挑战性的原因中, 薄突起和亮度变化不允许使用某些图像处理技术, 如平滑滤镜或静态阈值。此外, 在 DC 的网络中, 很难将单个细胞仅基于其在 2 p 病媒数据中的出现而分离。由于这些原因, 我们建议重建直流非精确曲面, 而不是通过调整软件参数来进行精确的分割。然后, 通过稳健的指标处理可能的错误, 如5.8 所述。 -
测量单元格迁移。
- 导出 CFP+和 CD11c-YFP+单元格的经典迁移措施。其中, "轨道速度" 表示细胞的平均迁徙速度, 而 "轨道直线度" 则表示细胞的方向性。这些度量值可以从映像软件导出为电子表格文件。
- 在导出的电子表格文件中, 计算 CFP+和 CD11c-YFP+单元格的 "校正轨道直线度" (也称为修正约束比率), 定义为 "轨道直线度" 乘以平方根"跟踪持续时间" 除以视频持续时间的平方根。这一措施比 "轨道直线性" 在短轨道28的存在更健壮, 起源于例如从跟踪错误。
注意: 只有相同长度的视频可以与此度量值进行比较。
-
测量细胞的相互作用。
- 如果 CFP+单元格和 CD11c-YFP+单元格之间的距离 (最近的素) 小于或等于阈值 (即2 微米), 则定义一个联系人。
注意: 此阈值应足够严格, 以便仅在单元格接近时检测到联系人。然而, 我们鼓励保持这个阈值大于 0, 理想的 n 乘以体素半径 (n > 2), 因为边界平滑可以使细胞重建小于实际的细胞大小。 - 计算 CFP+和 CD11c-YFP+单元格之间的联系人的数量和持续时间。在成像软件中, 这可以通过执行 "接吻和运行" 插件来完成。这些度量值可以从 "统计" 选项卡导出为电子表格文件。
- 如果 CFP+单元格和 CD11c-YFP+单元格之间的距离 (最近的素) 小于或等于阈值 (即2 微米), 则定义一个联系人。
- 在统计软件中导入以前计算过的度量值, 生成绘图并执行统计测试。
结果
在这项工作中, 我们描述了一个详细的协议来研究体内的运动和中性粒细胞和 DC 之间的相互作用, 在流感感染的小鼠气管 (图 3A)。为此, 我们分离 CFP+中性粒细胞 (92% 纯度;图 3B)从 CK6-ECFP 鼠, 我们过继转输转移到 CD11c-YFP 鼠感染流感。在那之后, 我们在3天的私家侦探身上执行了2的气管内病媒。此时, 我们观察到感染区内的中性粒细胞的明显招募, 如流细胞分析所示 (图 3C)。2 p 病媒协议要求使用特定的手术板和啮齿类动物的氧气供应商 (图 1A)。通过插入气管插管提供氧气帮助动物呼吸, 促进气管的阐明, 并控制与呼吸相关的器官运动 (图 1B)。经过实验建立后, 我们在30分钟的时间内在体内获得了稳定的4D 图像 (图 3D, 电影 1)。
通过专门的影像学软件对获得的4D 图像进行分析, 可以测量细胞的迁移, 并量化中性粒和 DC 的时空动态。关于细胞运动, 我们观察到 DC 的运动与被吸收的中性粒细胞之间存在显著的差异 (图 4A)。这一结果证实了中性粒细胞的动态性质, 以前被描述为能够向趋化因子源29迁移的高度运动细胞。在方向性方面, 我们得出结论, DC 的复杂形态学在细胞跟踪中产生了频繁的误差, 反过来又导致了持续时间缩短和测量方向行为方差增加的轨道 (图 4B)。因此, 我们计算了一个健壮的度量值, 它能够通过考虑跟踪持续时间来测量方向性。利用这一指标, 我们观察到中性粒细胞与DC 的方向性有显著的差异 (图 4C)。
此外, 计算中性粒细胞和 DC 之间的距离, 可以检测和分析他们的接触时间。在这个实验模型中, 我们观察到一些中性粒细胞形成了与 DC 和其他没有形成任何接触在成像期间 (图 4D) 的多短暂接触。此外, 对中性粒细胞与 DC 间距离的平均趋势的研究, 使我们能够研究研究过的干细胞的整体定位 (图 4E), 而对特定细胞的趋势的调查则允许对每个单细胞的行为 (图 4F, 影片 2)。

图 1: 对小鼠气管 2 p-病媒进行的设备和步骤.(Ai)便携式动物麻醉系统负责自动通风, 连接到一个泵, 为鼠标提供氧气。前视图 (所有)和侧面视图 (Aiii)的定制手术板用于气管模型。该电路板由金属舞台组成, 具有塑料鼠标位置 (全a), 一杆为持有可移动钳 (全 b) 和一个微调 XYZ 翻译 (全 c)。(B) 气管外科模型的顺序步骤: (Bi) 切除手术区的毛发 (Bii) 麻醉鼠标在手术板中的定位, (比尔) 气管的手术说明 (Biv) 插管用人工通气导管, (Bv) 固定导管, (英属维尔京群岛) 增加 PBS 到暴露气管, (Bvii) 安装盖玻片, (Bviii) 放置导管麻醉。请单击此处查看此图的较大版本.
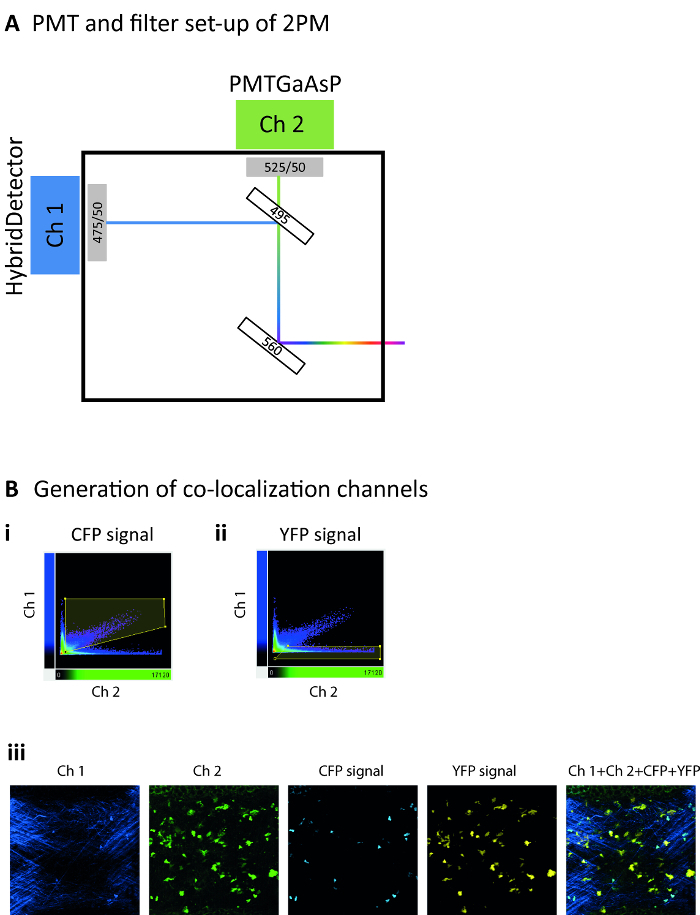
图 2: 2 p-病媒中的荧光信号检测.(A) 显微镜检测过滤器设置和相应通道的示意图表示。分色镜在560毫微米分离蓝色或绿色从红色或远的红色放射。另外的分色镜在495毫微米被用于进一步承认发射光谱的不同的分区域。通道1采用混合探测器 (发射过滤器 475/50), 而通道2使用高灵敏度 GaAsP PMT (发射过滤器 525/50)。(B) 有代表性的散布点图2P 信号显示定位通道的生成的门策略, 用于识别来自 CFP (Bi) 和 YFP (Bii) 显影的信号。(比尔)代表性显微照片, 显示1频道的具体信号 (Ch 1, 深蓝色), 通道 2 (Ch 2, 绿色), CFP (淡蓝色) 的共同本地化通道, YFP (黄色) 的联合本地化通道, 以及所有通道的组合 (ch 1 + ch 2 + CFP +YFP)。请单击此处查看此图的较大版本.
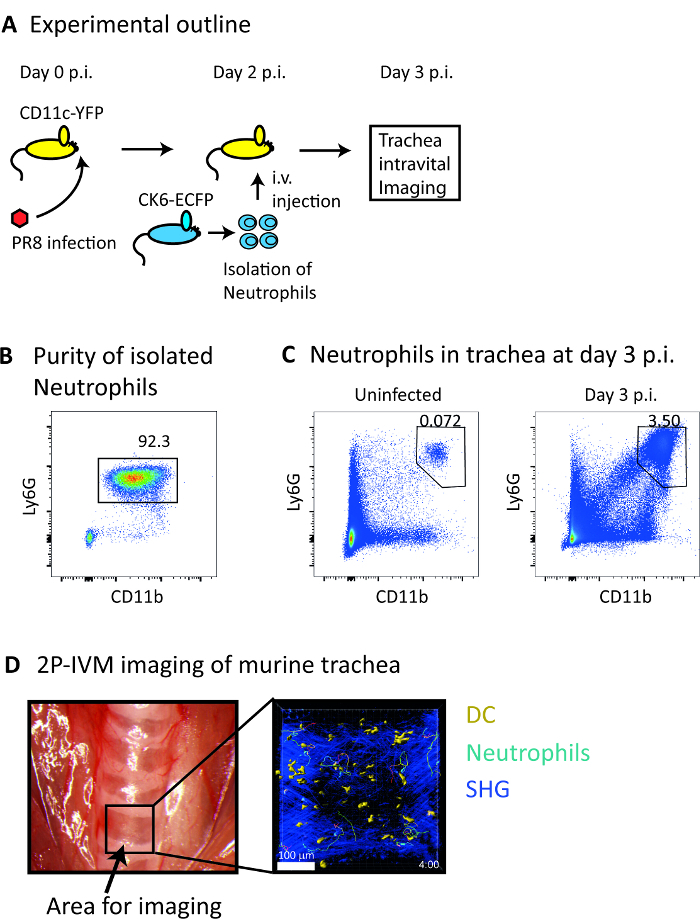
图 3: 活体4D 成像的中性粒细胞和 DC 在流感感染气管.(A) 《议定书》的示意图大纲。(B) 具有代表性的流动细胞散点图显示, 使用 Percoll 梯度法, 从小鼠骨髓中分离出的细胞悬浮液中中性粒细胞的百分比。(C) 有代表性的流动细胞 scatterplots 显示, 与感染流感病毒的小鼠相比, 在3天的老鼠 (左面板) 的解剖图像中, 对未感染小鼠气管中性粒细胞的频率增加气管显示为图像采集选择的区域。(右面板)有代表性的3D 预测 2 p 病媒显微图像显示中性粒细胞 (淡蓝色) 和 DC (黄色) 的表面重建连同他们的足迹在天3私家侦探 SHG 信号显示在深蓝色。刻度条 = 100 µm.请点击这里查看这个数字的大版本.
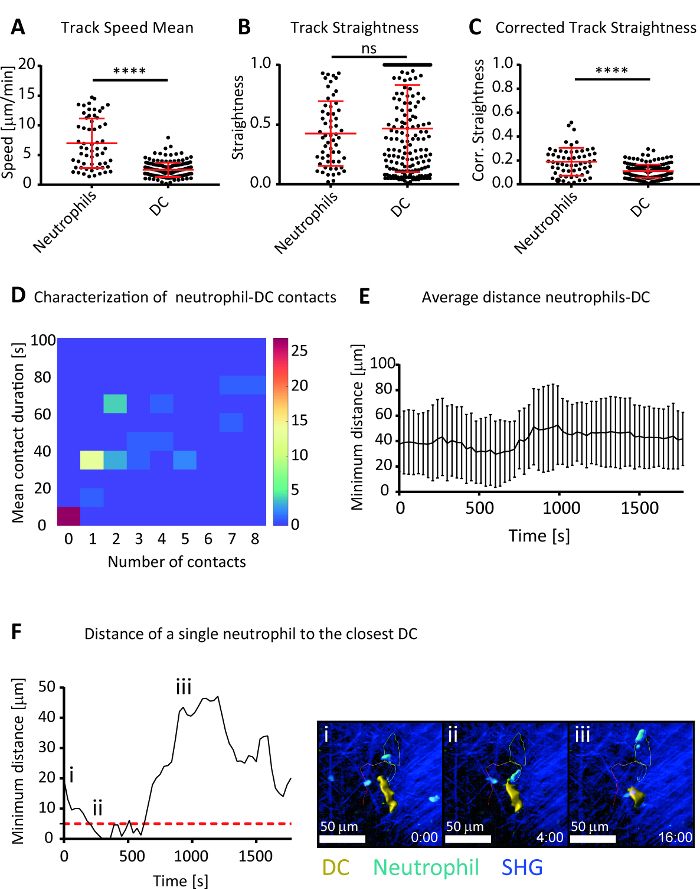
图 4: 流感感染气管中中性粒细胞和 DC 迁移及相互作用动力学的特征.代表图显示轨道速度平均值 (A), 轨道平直度 (B) 和校正的轨道平直性 (C), 由 Beltman 和同事 (2009)28, 在3天的私人侦探的气管内的中性粒细胞和 DC 的定义与流感病毒。修正后的轨道直线度测量对跟踪误差具有鲁棒性。(D) 2D 直方图, 显示中性粒细胞的频率, 根据其与 DC 的接触次数和平均接触时间。(E) 电影期间, 中性粒细胞与最近的 DC 的平均距离。(左) 分析代表性中性粒细胞与最近的 DC 的距离。点红色线表示距离阈值, 认为中性粒细胞与 DC 建立了联系。(右i-iii)在不同时间点获得的显微照片, 代表中性粒细胞 (淡蓝色) 向 DC (黄色) 的迁移。单元格轨道显示为一个五彩线条, 它将颜色从蓝色变为红色, 以表示时间。SHG 来自纤维胶原的信号呈深蓝色。刻度条 = 50 µm。在所有数字中, 所提出的数据代表至少三个独立实验。结果以韦尔奇的测试数据为平均值。ns p > 0.05;p < 0.0001。请单击此处查看此图的较大版本.

电影 1: 流感感染时气管内的中性粒细胞和 DC 动力学.30分钟时移3D 图像显示中性粒细胞 (浅蓝色) 和 DC (黄色) 之间的相互作用动力学, 以及它们各自的轨道上的胶原网络 (深蓝色) 的气管。代表性中性粒细胞-DC 相互作用由白色箭头指示。单元格轨道显示为一个五彩线条, 它将颜色从蓝色变为红色, 以表示时间。刻度条 = 50 µm.请点击这里查看此视频。(右键单击可下载.

电影 2: 典型的短期中性粒细胞-DC 在气管内与流感感染的相互作用.30 分钟时移 3D 图像显示中性粒细胞 ( 淡蓝色 ) 与 DC ( 黄色 ) 及其各自轨道之间的代表互作用。单元格轨道显示为一个五彩线条, 它将颜色从蓝色变为红色, 以表示时间。胶原蛋白的 SHG 信号呈深蓝色。刻度条 = 10 µm.请点击这里查看此视频。(右键单击可下载.
讨论
这项工作提供了一个详细的协议, 以生成4D 图像显示过继转输转移中性粒细胞的迁移及其与 DC 的相互作用, 在流感感染的小鼠气管。描述的 2 p-病媒模型将是相关的研究免疫细胞动力学在呼吸道感染。
最近, 在气道细胞动力学的可视化的几个模型被开发了9,10,11,12,13,14,15 ,16。然而,在体内的肺成像仍然是挑战, 考虑到这个器官的解剖位置和技术困难, 以减少运动在呼吸周期30。为了克服这些问题, 一些作者提出使用一个定制的圆形吸尘室, 需要手术插入胸腔13,14。然而, 这一程序需要一个侵入性干预, 可能损害的结果, 特别是在那些研究的重点是对炎症反应的调查。此外, 由于肺泡17中空气产生的光折射, 肺外科模型对深部组织成像存在局限性。相反, 最近使用了不同的气管模型来研究气道上皮细胞动力学。与肺相比, 这种器官的成像具有明显的优势, 如暴露和固定器官所需的相对简单的手术, 以及对气管上皮的更高的可得性。建议的气管模型也适用于调查对呼吸道病原体 (如流感病毒) 的反应启动, 因为气管是流感感染过程中第一个病毒复制地点之一,8。
有趣的是, 一项研究显示了一种替代无插管方法的气管成像, 最近发表了12。这种方法的特点是炎症减少, 并显示了明显的优势, 在研究中, 上皮细胞的 mucociliarity 功能需要保留。然而, 这种方法并不保证足够的稳定性和获得更明亮的信号, 以研究细胞接触在一些µm 的范围内. 反之, 本协议中提出的方法可以更好地固定器官由于插管, 并允许检测更强的荧光信号, 由于更短的距离之间的器官和盖玻片12。
在体内实现组织固定化 2 p-病媒图像采集是生成最优数据最关键的步骤。对该方法的稳定性作出了一些重要的措施, 包括: 适当的小鼠麻醉;正确的鼠标插管;和一个外科的解释气管, 允许方便地进入器官的盖玻片。此外, 成像正确数量的细胞 (理想的30细胞每视野) 将加强获得的结果。最佳细胞数量的招募在很大程度上取决于病毒感染剂量, 这是非常受病毒接种的适当管理的影响。
该议定书的另一个关键步骤是对气管的外科阐述。可采取不同的措施, 最大限度地减少在手术过程中对器官造成的损害。例如, 气管不应直接接触手术工具。相反, 它应该通过只操作周围的组织 (皮肤, 涎腺和肌肉) 来暴露。如有必要, 应使用铁器钝刃项目处理气管。此外, 还应努力避免血管损伤。最后, 为了防止器官脱水, 在手术后立即用 PBS 覆盖它也是很重要的。
尽管这种方法的独特优势, 在过去所描述的方法, 以可视化的免疫细胞相互作用的气管粘膜, 使用这个模型提出了一些限制。如上文所述, 在研究免疫应答时, 与气管手术相关的炎症可能是一个缺点。为了克服这一限制, 在启动程序之前, 有可能管理抗炎药物。该模型的另一个局限性与存在于呼吸道中的强荧光信号有关, 这主要是由驻留细胞和粘液层产生的。这种非特异荧光产生的文物可能会阻碍分析。此外, 在比较不同工期的单元径时, 当跟踪误差引入短历时26的轨道时, 可能产生轨道直线度参数的误导计算。为了克服这一问题, 我们采用了罚系数来修正轨道直线度。这种更正旨在尽量减少在结果28中遗漏跟踪的影响。
2 p-病媒实验的一个关键方面是可能再次使用的小鼠已经进行了手术和成像。这里描述的体内成像协议不需要动物安乐死或器官收集, 从而使在手术后恢复和重新使用小鼠的可能性为其他程序。例如, 使用单个鼠标在不同时间点执行气管成像, 可以显著减少实验所需的总动物数量, 支持动物还原原理。此外, 它还可以减少个体间的变异性。然而, 动物的恢复和再利用必须遵循动物福利标准, 包括在恢复时间内对动物进行适当的镇痛药物和抗生素的管理。所有这些程序都必须纳入动物实验协议, 并经当地兽医当局批准。
所描述的协议可以很容易地适应其他免疫细胞类型的研究。例如, 分离和注射 (荧光或染色) 病原体特异 t 细胞可用于研究 t 细胞活化动力学31以及它们与其他细胞 (如气管 DC) 的相互作用。类似地, 血液或淋巴管的可视化可以代表一种有趣的方法来研究感染过程中的炎症细胞进入气管组织。此外, 还可以应用2对气管的 p-病原体, 研究其他空气中致病菌的免疫反应动力学。因此, 使用转基因荧光空气病原体, 如肺炎链球菌32, 将为研究它们与免疫系统的相互作用创造新的机会。虽然这一过程的重点是测量免疫细胞在感染期间的动态, 它也可以应用到不同的领域, 包括癌症, 哮喘, 或伤口愈合。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了瑞士国家基金会 (SNF) 赠款 (176124、145038和 148183)、欧洲委员会居里夫人重返社会补助金 (612742) 和 SystemsX.ch D.U.P. (2013/124) 赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Gigasept instru AF | Schülke & Mayr GmbH | 4% solution | |
| CD11c-YFP mice | Jackson Laboratories | 008829 | mice were bred in-house |
| CK6-ECFP mice | Jackson Laboratories | 004218 | mice were bred in-house |
| 1x Dulbecco's Phosphate Buffered Saline modified without Calcium Choride and Magnesium Chloride | Sigma | D8537-500ML | |
| 10x Dulbecco's Phosphate Buffered Saline modified without Calcium Choride and Magnesium Chloride | Sigma | D1408-500ML | |
| Percoll PLUS | Sigma | E0414-1L | Store at 4°C |
| Ketamin Labatec | Labatec Pharma | 7680632310024 | Store at RT, store at 4 °C when in solution of ket/xyl mixture |
| Rompun 2% (Xylazin) | Bayer | 6293841.00.00 | Store at RT, store at 4 °C when in solution of ket/xyl mixture |
| 26 G 1 mL Sub-Q BD Plastipak | BD Plastipak | 305501 | |
| 30 G, 0.3 mL BD Micro-Fine Insulin Syringes | BD | 324826 | |
| Falcon 40 µm Cell Strainer | Corning | 352340 | |
| 2 mL Syringes | BD Plastipak | 300185 | |
| Microlance 3x 18 G needles | BD | 304622 | |
| Introcan Safety 20 G (catheter) | Braun | 4251652.01 | |
| 6 Well Cell Culture Cluster | Costar | 3516 | |
| RPMI medium 1640 + HEPES (1x) | ThermoFisher Scientific | 42401-018 | Store at 4°C |
| Liberase TL Research Grade | Roche | 5401020001 | Store at -20 °C / collagenase (I and II) mixture |
| DNAse I | Amresco (VWR) | 0649-50KU | Store at -20 °C |
| CellTrace Violet stain | ThermoFisher Scientific | C34557 | Store at -20 °C |
| EDTA | Sigma | EDS-500G | |
| Fetal Bovine Serum | Gibco | 10270-106 | Store at -20 °C |
| PE-10 Micro Medical Tubing | 2Biological Instruments SNC | #BB31695-PE/1 | |
| Surgical Plastic Tape | M Plast | ||
| Viscotears | Bausch & Lomb | Store at RT | |
| Plasticine | Ohropax | ||
| High Tolerance Glass Coverslip 15 mm Round | Warner Instruments | 64-0733 | |
| SomnoSuite Portable Animal Anesthesia System | Kent Scientific | SS-01 | |
| Nuvo Lite mark 5 | GCE medline | 14111211 | |
| MiniTag (gaseous anesthesia and heating bench) | Tem Sega | ||
| SURGICAL BOARD | University of Bern | ||
| TrimScope II Two-photon microscope | LaVision Biotec | ||
| Chameleon Vision Ti:Sa lasers | Coherent Inc. | ||
| 25X NA 1.05 water immersion objective | Olympus | XLPLN25XWMP2 | |
| The Cube&The Box incubation chamber and temperature controller | Life imaging Services | ||
| Imaris 9.1.0 | Bitplane | Imaging software | |
| GraphPad Prism 7 | GraphPad | Statistical software |
参考文献
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature biotechnology. 21 (11), 1369-1377 (2003).
- Fein, M. R., Egeblad, M. Caught in the act: revealing the metastatic process by live imaging. Disease Models & Mechanisms. 6 (3), 580-593 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Cahalan, M. D., Parker, I. Choreography of cell motility and interaction dynamics imaged by two-photon microscopy in lymphoid organs. Annual review of immunology. 26, 585-626 (2008).
- Germain, R. N., Robey, E. A., Cahalan, M. D. A Decade of Imaging Cellular Motility and Interaction Dynamics in the Immune System. Science. 336 (6089), 1676-1681 (2012).
- Coombes, J. L., Robey, E. A. Dynamic imaging of host-pathogen interactions in vivo. Nature Reviews Immunology. 10 (5), 353-364 (2010).
- Pulendran, B., Maddur, M. S. Innate Immune Sensing and Response to Influenza. Life Science Journal. 6 (4), 23-71 (2014).
- Lim, K., et al. Neutrophil trails guide influenza- specific CD8 + T cells in the airways. Science. 349 (6252), (2015).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American journal of respiratory cell and molecular biology. 47 (6), 864-868 (2012).
- Kretschmer, S., et al. Autofluorescence multiphoton microscopy for visualization of tissue morphology and cellular dynamics in murine and human airways. Laboratory investigation; a journal of technical methods and pathology. 96 (8), 918-931 (2016).
- Veres, T. Z., et al. Intubation-free in vivo imaging of the tracheal mucosa using two-photon microscopy. Scientific Reports. 7 (1), 694 (2017).
- Looney, M. R., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature. 8 (1), 91-96 (2011).
- Thornton, E. E., Krummel, M. F., Looney, M. R. Live Imaging of the Lung. Current Protocols in Cytometry. 60 (1), (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and immunity. 82 (2), 864-872 (2014).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Lambrecht, B. N., Hammad, H. Lung Dendritic Cells in Respiratory Viral Infection and Asthma: From Protection to Immunopathology. Annual Review of Immunology. 30 (1), 243-270 (2012).
- Camp, J. V., Jonsson, C. B. A role for neutrophils in viral respiratory disease. Frontiers in Immunology. 8, (2017).
- van Gisbergen, K. P. J. M., Sanchez-Hernandez, M., Geijtenbeek, T. B. H., van Kooyk, Y. Neutrophils mediate immune modulation of dendritic cells through glycosylation-dependent interactions between Mac-1 and DC-SIGN. The Journal of experimental medicine. 201 (8), 1281-1292 (2005).
- Gonzalez, S. F., et al. Capture of influenza by medullary dendritic cells via SIGN-R1 is essential for humoral immunity in draining lymph nodes. Nature Immunology. 11 (5), 427-434 (2010).
- Lindquist, R. L., et al. Visualizing dendritic cell networks in vivo. Nature immunology. 5 (12), 1243-1250 (2004).
- Li, H., et al. Human Vγ9Vδ2-T cells efficiently kill influenza virus-infected lung alveolar epithelial cells. Cellular and Molecular Immunology. 10 (2), 159-164 (2013).
- Tran Cao, H. S., et al. Development of the transgenic cyan fluorescent protein (CFP)-expressing nude mouse for "technicolor" cancer imaging. Journal of Cellular Biochemistry. 107 (2), 328-334 (2009).
- Jaber, S. M., et al. Dose regimens, variability, and complications associated with using repeat-bolus dosing to extend a surgical plane of anesthesia in laboratory mice. Journal of the American Association for Laboratory Animal Science JAALAS. 53 (6), 684-691 (2014).
- Pizzagalli, D. U., et al. Leukocyte Tracking Database, a collection of immune cell tracks from intravital 2-photon microscopy videos. Scientific Data. , (2018).
- Sommer, C., Straehle, C., Kothe, U., Hamprecht, F. A. Ilastik: Interactive learning and segmentation toolkit. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 230-233 (2011).
- Beltman, J. B., Marée, A. F. M., De Boer, R. J. Analysing immune cell migration. Nature Reviews Immunology. 9 (11), 789-798 (2009).
- Keller, H. U. Motility, cell shape, and locomotion of neutrophil granulocytes. Cell motility. 3 (1), 47-60 (1983).
- Sumen, C., Mempel, T. R., Mazo, I. B., von Andrian, U. H. Intravital Microscopy. Immunity. 21 (3), 315-329 (2004).
- Lambert Emo, K., et al. Live Imaging of Influenza Infection of the Trachea Reveals Dynamic Regulation of CD8+ T Cell Motility by Antigen. PLOS Pathogens. 12 (9), e1005881 (2016).
- Kjos, M., et al. Bright fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of bacteriology. 197 (5), 807-818 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。