Method Article
蛍光顕微鏡の人間の脳をホルマリン固定組織で背景の蛍光性の単純な除去
要約
生体試料のバック グラウンド蛍光はしばしば高齢の人間後組織を中心に、蛍光イメージング技術を複雑にします。このプロトコルは、これらのサンプルから蛍光ことができる効果的に削除する方法について説明します photobleach 免疫染色の前にサンプル ソース市販発光ダイオード光を使用します。
要約
蛍光は細胞内コンパートメントを可視化する組織サンプル中の特定の蛋白質の局在を決定するために使用する一般的な方法です。高品質の蛍光画像の取得に大きな障害は老化色素リポフスチンなどによって生じたアルデヒド固定などの一般的なサンプル準備プロセスによって組織の内因性蛍光。このプロトコルでは、どのように背景の蛍光性が大幅蛍光プローブと白色蛍光体発光ダイオード (LED) 治療前に配列を使用して退色を軽減できますをについて説明します。白色蛍光体の広域スペクトル発光 Led の放出ピークの範囲にわたって fluorophores の漂白を可能にします。非常に低コストで既製のコンポーネントから構築することができますのフォトブリーチング装置および市販化学消す物にアクセス可能な代替手段を提供しています。従来の蛍光染色に続いて組織の退色の前処理は、バック グラウンド蛍光の無料画像を生成します。に比べてプローブとしてバック グラウンドを低減する化学の消す物を確立する信号をそれは効果的に背景とリポフスチンの蛍光を軽減しながら退色処理いたプローブの蛍光強度に及ぼす影響。退色には、前処理のためのより多くの時間が必要ですが、退色時間を短縮する高輝度 LED アレイが使えます。この簡単な方法は、さまざまな組織、脳などのリポフスチンの蓄積後特に組織や心臓や骨格筋に潜在的適用できます。
概要
ターゲット特定の蛋白質の抗体を使用して蛍光顕微鏡は細胞培養や組織に興味の蛋白質を視覚化する使用します。蛍光抗体法で明確かつ決定的な画像の取得に主要な合併症が引き起こされること内生的哺乳類体内年齢色素リポフスチン、エラスチンとコラーゲン1のような蛋白質、蛍光 2。蛍光の他の源をアルデヒド固定3などのサンプル準備の手順を導入できます。主に酸化修飾タンパク質と脂質分解残基から成るリポフスチン顆粒は加齢2長い生きている細胞に蓄積されます。これにより脳や心臓や骨格筋などの後組織イメージングの難しさ、リポフスチンの蛍光発光スペクトルが広い、変数、頻繁に使用される一般的な fluorophores の発光波長に合わせ、4をラベリングします。これらの要因は、特に挑戦的な前頭側頭葉変性症 (FTLD) など晩発性神経変性疾患の例から人間の脳組織のイメージングを作る。
蛍光を減らすためには、我々 は、白色発光ダイオード (LED) 配列家庭用デスク ランプ5を使用するとスライド マウントの切片を照射法を考案しました。この単純なテクニックは、酢酸アンモニウムまたはスーダン黒い B やエリオクロム ブラック T6などの染料を焼入れ市販 CuSO4など化学の消す物を使用する方法に代わるものを提供します。大幅なコスト削減にマルチ スペクトルがあります LED ランプ フォトブリーチング法と合併症や工芸品デジタル蛍光除去方法スペクトル非混合7,8などから生成を回避できます。白色蛍光体 Led ある、広い発光スペクトル、高輝度と低製造コスト、退色様々 な発色団5,9の既製のコンポーネントとして最適です。
このプロトコルでは、アクセス可能なコンポーネントを使用して退色装置の建設を示すし、退色をタウ陽性介在物 (FTLD T) リン酸化タウの特異抗体を使用してを含む FTLD 組織の場合に適用します。2 つの一般的に使用される発色団を用いる蛍光標識抗体をイメージングに退色の影響を示す: アレクサ 488 とテキサス赤。未処理のセクション対退色の影響または商業化学クェンチャーの治療を受けた人は定量化し、比較します。この退色前処理は、生体試料の蛍光を削除する任意の標準的な蛍光汚損のプロトコルに組み込むことができます。
プロトコル
注: 国際会議の調和 (ICH) の国際組織の医療科学 (協議) 協議会を含む国際規格に準拠しての作品発表を行った、およびヘルシンキ宣言の原則。ヒト組織大学健康ネットワーク研究倫理委員会の承認を得ていた。人間の脳は海上の脳組織銀行の一部として採取。コレクションの時に、全ての患者からインフォームド コンセントを得た
。1 です。 のフォトブリーチング装置ソリューション
- 準備在庫ソリューション。
- X 8.77 g 塩化ナトリウムとトリスの 6.06 g を溶解することにより在庫トリス緩衝生理食塩水 (1 x TBS) ソリューション (150 mM NaCl、50 mM トリス-Cl、pH 7.4) 1 の準備 1 L ddH 2 O の 800 mL でベースし、7.4 塩酸ボリューム 1 L とオートクレーブを育てることを使用するために pH を調整します
- ddH 2 O (10%、200 x の在庫) 10 mL におけるアジ化ナトリウムの 1 g を溶解することによりアジ化ナトリウム 10% (200 x の在庫) を準備します 。
- 1-3 標準サイズのスライド、スライド室としてシングル 100 × 100 mm の透明な正方形のシャーレを使用します。単一のスライド室 0.05% アジ化 TBS ソリューションにするため 1 x TBS 50 mL に 200 x ナトリウムのアジ化物の在庫の 0.25 mL を追加します。垂直方向に追加のスライドを処理する 2-3 スライド室をスタックします。各商工会議所のアジ化 TBS ソリューションの追加の 50 mL を準備します 。
- は、ランプの頭の下に合うことができるようにスライド chamber(s) を昇格する足場を作成します。
- のための 100 mm x 100 mm スライド室は底と 100 mm x 100 mm x 30 mm プラスチック製食品容器の側面の開口部をカットし、コンテナーを反転します。側の開口部が大きいので、LED 光源を合わせて、下部開口部は、光源からの光は支障なく試料室に達するよう十分な大きさを確保することを確認します 。
- は、足場足場とサンプル室/卓上型のグリップを高めるために電気テープを適用します。それは安全にサンプルに達することからのライトを妨げることがなくスライド室を高めますので足場を構築する任意の代替材料を使用します 。
- デスク ランプからサンプルを (可能な場合) に直接 LED ライトを妨げることがありますし、上方の LED 配列の向きからディフューザーや不透明なプラスチックを削除します。LED アレイ上の足場とスライド chamber(s) を配置します。簡単な操作で柔軟な首とランプを使用します 。
- 構造反射ドームをスライド室とアルミ箔で足場をカバーするのに十分な大きさのボックスの内側をライニングによって装置のカバーします。単室の 150 mm × 150 mm x 複数の 150 mm 段ボール箱 1 mL ピペット チップ ボックスを使用して、垂直方向にチャンバーを積み上げ 。
2。ティッシュ セクションのフォトブリーチング前処理
注: ティッシュ セクションの準備組織、固定および使用する方法を埋め込むのソースによって異なる場合があります。ここでは、FTLD T のケースから脳組織 (眼窩脳) は ~ 2 日間ホルマリン、ショ糖密度勾配を 10 月に埋め込まれ、クライオスタットを使用して 10 の μ m 厚いセクション カットで修正しました
。- では 4 ° C の冷たい部屋、冷たいキャビネットや冷蔵庫、足場の下でランプの向きし、足場に試料室を配置します。試料室にアジ化 TBS 溶液 50 mL を注ぐ 。
- 埋没ティッシュ セクションはきれいな鉗子を使用してアジ化 TBS を含むスライド室に標準的なガラス顕微鏡スライドにマウントされています。複数のスライドのスライドが単一のレイヤー上商工会議所で置かれることを確認します 。
- 反射型のドームを持つ装置をカバー、LED ランプを点灯、4 ° C で 48 時間インキュベートします 。
3。蛍光
- 染色 DAPI 対比染色とアレクサ 488 - とテキサス赤共役二次抗体を使用してリン酸化タウの組織、最初の抗原検索、透過、妨害、およびプライマリのソリューションを準備するには抗体の結合。
- 準備 500 mL の抗原検索のバッファー (10 mM クエン酸、2 mM エチレンジアミン四酢酸、0.05% Tween 20; pH 6.2) 0.92 g クエン酸と ddH 2 O. 調整 pH の 500 mL のエチレンジアミン四酢酸 (EDTA) 0.37 g 溶解NaOH で 6.2 に Tween 20 0.25 mL を追加します 。
- 500 ml 0.025% のトリトン X-100 の 0.125 mL を 500 mL の 1 に追加することによって TBS ソリューション (TBS-トリトン) でトリトン X-100 TBS. x
- 0.1 g 10 mL TBS. に BSA を溶解することにより TBS (BSA TBS バッファー) の 1% ウシ血清アルブミン (BSA) ソリューションの準備
- 1.8 mL の 1% にヤギ血清 0.2 mL を追加してブロッキング溶液を調製 BSA/TBS.
- 抗リン-PHF タウ pSer202 + Thr205 の 1.5 μ L 分注による一次抗体溶液 (1: 100 希釈) 150 μ L を準備、スライドごとに 1% BSA TBS バッファーし、氷をつけっぱなしの 148.5 μ L に (AT8) 抗体
- 25 mL の抗原検索バッファーを含むスライド コレクターの垂直 photobleached のスライドが水没抗原検索を実行します。コレクターが風呂の水に落ちないようにテープや文字列が付いているコレクターを保護します。30 分 90 ° C の水浴のコレクターを熱し、スライドを削除する前に 30 分間室温に冷却するコレクターを許可します。それとしてすぐにスライドになります乾燥するセクションは削除されません 。
- 30 ml TBS トリトンの染色瓶に抗原検索コレクターからスライドをコピーして穏やかな揺れで軌道シェーカー上で 5 分間セクションを洗います。新鮮な TBS トリトンで一度洗浄を繰り返します。芯糸くず組織概要疎水性ペンで組織と離れて余分なバッファー。スライドを乾燥しないように注意してください。
- スライドごとに、組織にソリューションをブロックの 200 μ L 分注により、組織をブロックし、加湿チャンバー内でスライドを配置。湿らせたペーパー タオルを含むピペット チップ ボックスの内側スライド ラックを置くことによって部屋を構築します。レベルの表面上で 2 時間室温で孵化させなさい。ブロッキング液が組織を完全にカバーすることを確認します 。
- 吸引によりブロックのソリューションを削除し、組織に一次抗体溶液の 100-150 μ L をピペットします。十分な量の抗体が存在し、セクションは 1 つの側面に抗体溶液のプールを避けるために平らな面を確認します。加湿チャンバーで一晩 4 ° C でインキュベートします 。
- は、二次抗体の混合物と、DAPI ーシスを準備します。
- 、スライドごとにヤギ抗マウス アレクサ 488 の 1.5 μ L とヤギ抗マウス BSA TBS の 147 μ L にテキサス赤の 1.5 μ L を追加することによって二次抗体の混合物 (1: 100 希釈) の 150 μ L を準備し氷のまま
- 準備 0.1 μ g/mL DAPI シリアル希釈による対比染色。徹底的に原液を混合し、ストック 5 mg/mL 5 μ g/mL の溶液の 1 mL をする TBS の 999 の DAPI の 1 μ L を希釈します。スライドごとに希釈 3 μ5 μ g/mL の溶液を最終濃度 0.1 μ G/ml の TBS の 147 μ L で L.
注意: DAPI 既知変異原物質は、注意して処理する必要があります 。
- 吸引により一次抗体を削除します。TBS トリトンの軌道シェーカーで穏やかな混合で 5 分間洗浄 30 mL を含む jar を染色、ガラスのスライドが水没します。新鮮な TBS トリトン洗浄手順を繰り返します。離れて余分な TBS トリトンを芯し、各スライドに二次抗体の混合物の 100 に 150 μ L をピペットします。
- 組織は抗体の混合物で完全に覆われていることを確認します。暗闇の中で加湿チャンバーに室温で 2 時間インキュベートします 。
- 吸引により二次抗体の混合物を削除し、TBS (トリトン) 30 mL を含む jar を染色グラスにスライドを転送します。軌道シェーカーで穏やかな混合 5 分間洗ってください。繰り返し新鮮な TBS と洗浄ステップは 0.1 μ g/mL DAPI 対比染色の 100 に 150 μ L を各スライドに適用し、暗闇の中で室温で 10 分間インキュベートします 。
- は TBS を含む jar を染色ガラス スライドを転送し、各洗浄のため新鮮な TBS を使用して 5 分ごとに、穏やかな混合で 3 回を洗います。芯の距離余分なバッファーします 。
- 水土台媒体組織への適用の 3 が値下がりしました。鉗子を使用すると、組織は、1 つの端から始まると気泡の捕捉を避けるためにもう一方の端をゆっくりと下げる上にきれいなガラス基板をゆっくりと下ろします。場合はすぐにイメージング、coverslip が外れないように注意してください。それ以外の場合、暗闇の中で 4 ° C で保存する前に乾燥するメディアをマウントを許可します 。
4。蛍光顕微鏡
- 蛍光ランプ、顕微鏡とコンピューターで
- ターン ランプ 15 分染色組織スライド蛍光顕微鏡ステージの場所間のウォーム アップをし。10 倍の倍率の組織を検索する明視野画像を使用します 。
- DdH 2 O のドロップを coverslip 表面に適用し、20 x 水浸対物レンズ (NA = 1.0)。設定 4 直線の平均平面スキャンを選択します。ピンホール サイズを与える 〜 3 μ m の光学的スライス 1 の風通しの良いユニットに設定します。最高の信号を別々 のトラックで各 fluorophore レーザー励起発光波長を選択します
。 注: Alexa 488: ex λ = 488 nm (アルゴン レーザー) λ em = 493 570 nm;テキサスの赤: λ ex = 561 nm (DPSS 561 nm レーザー)、λ em = 601 635 nm;DAPI: λ ex = 405 nm (405 ダイオード レーザー)、λ em = 410 507 nm。- は、レーザー パワーを調整し、各トラックの信号強度を最適化する設定を得る。合成画像を収集し、保存します。同じレーザー設定を使用して、別のスライドで蛍光強度を比較します 。
- 各チャネルにおける蛍光強度の可視化は、ImageJ 10 RGB プロファイル ツール マクロをインストールします。Web ページからテキスト ファイル (https://imagej.nih.gov/ij/macros/tools/RGBProfilesTool.txt) としてマクロを保存します。ImageJ メニューから選択プラグイン - > マクロ - > インストール;RGB プロファイル ツールをインストールするテキスト ファイルを選択します。
- ImageJ のコンフォーカル画像ファイルを開き、次を実行することによって RGB 3 スタックから合成画像に変換: 画像 - > の色 - > チャンネル ツール。選択 " 複合 " 3 つのチャネルすべてのドロップ ダウン メニューとチェックから。次に、イメージを選択 > タイプ - > RGB 色 。
- は、RGB プロファイル ツール アイコンを選択し、プロファイルするイメージのセクションの間で線を引きます。強度データをプロットするためのスプレッドシートとして保存します 。
結果
フォトブリーチング用前処理ステップは、直前の抗原検索や免疫染色 (図 1 a) 標準的な蛍光プロトコルに追加できます。フォトブリーチング用装置の組立は、様々 なを使って行うこともできる安価な既製のコンポーネント (図 1 b)。白色蛍光体の発光スペクトル Led は以前レポート (図 1)5,11に同意させる幅広い退色に適した波長の広い範囲をカバーしています。48 h 退色後リポフスチンとして一般的な背景の蛍光性のようにされるスペックルの強度は無染色で FTLD T (図 1) の両方の発光波長でかなり減少しました。フォトブリーチング効果を発揮で 2 つの異なる二次抗体を使って、FTLD-T の場合病的タウ介在物を視覚化する過リン酸化タウ染色。タウ介在物の異なる形状ともラベリング用 2 つ発色団の自信を持って技術を検証する目的のターゲットとされる機能を区別することが出来ます。
低倍率で複合画像、アレクサ 488 とテキサスの赤のチャンネルの組み合わせから黄色に染まって、タウ陽性の介在物の形態から成る短い細胞プロセスと呼ばれるリング状のコレクション「アストロ サイトプラクの (図 2 a-c)。この形態は、大脳皮質基底核変性症 (CBD)12,13, この場合の病理レポートとの特徴です。未処理のサンプルで多数の構造体がタウの介在物とは似ていないし、自発であることを示唆している、赤のチャンネルに主に蛍光を示した複合イメージ内に存在目的抗体の汚損ではなく。背景の蛍光性の顕著なレベルはビューのフィールド (図 2 a) を通してこのチャネルに表示されますも。これらの蛍光機能が削除され、全体的なイメージは、退色 (PB) と化学クェンチャー (図 2 b・ c) 処理がはるかにきれい。
我々 は、各サンプルの小さい地域をプロファイリングによってこれらのサンプルの蛍光の違いを定量化しました。単一のアストロ プラークは、比較 (図 2 d-r) の各処理条件で提示されます。未処理のサンプルで背景の蛍光性はすべての 3 つのチャンネルで存在が、アレクサ 488 とテキサス赤抗体二次抗体の蛍光は比較的高かった (図 2 h)。ただし、未処理のサンプルに存在される構造はタウ (図 2 h) 染色テキサス赤二次抗体に匹敵するテキサス赤チャネルの蛍光強度を持っていた。標的タンパク質は、私たちのケースでタウなど個別の予測可能な形態を持っていなかった場合、組織の蛍光は、レンダリング イメージ uninterpretable。
対照的に、ときアレクサ 488 のバック グラウンド蛍光免疫染色の前に退色前処理を適用し、テキサス州レッド チャンネルを有意に減少した未処理のサンプルと immunostained タウの蛍光と比較してください。影響が残った (図 2 im)。商業化学クェンチャー急冷アレクサ 488 チャネルで蛍光退色のだけ効果的に。また、DAPI 蛍光バック グラウンド 48 h 退色処理 (図 2 m) による影響を受けなかったも抑制されます。しかし、化学クェンチャーも逆効果焼入 (図 2 nr) 性を示唆しているテキサス赤セカンダリ DAPI 信号の強度を低減しました。

図 1: ワークフローでは標準的な蛍光退色前処理のアプリケーション。A)イメージングへ組織の買収から、標準的な蛍光プロトコルの簡易模式図。プライマリおよびセカンダリの蛍光抗体の応用は、漫画で表されます。代表的な顕微鏡画像が生成されます。スケールバー = 100 μ m. B) 代表的な退色装置 (反射の蓋は表示されていません) 市販のコンポーネントを使用して構築します。C) 白色 LED アレイの発光スペクトル。狭い発光ピーク 450 nm と広いピーク 550 nm が観察されます。D) 内因性背景 FTLD T 組織アレクサ 488 (493 570 nm) とテキサス赤 (601-635 nm) 発光波長の蛍光退色の影響.リポフスチンに似たされる斑点が目に見えて 48 h 退色後減少します。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
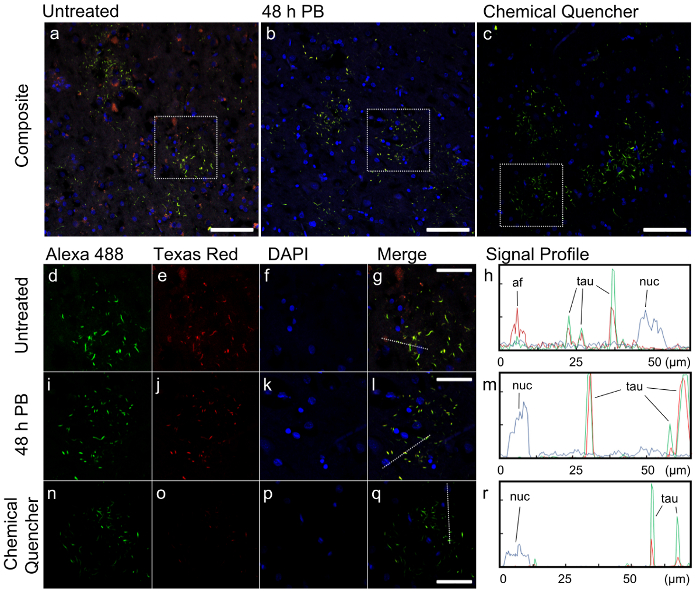
図 2:反リン酸化タウ免疫染色と FTLD T 組織の場合の画質に蛍光除去の効果a から c) 低倍率、代表的な視野での複合蛍光画像未処理 (a)、(b) と化学クエンチャ 48 h の photobleached は、(c) サンプルを扱われます。色を表す彼らのそれぞれの光源による励起を介して以下のチャンネルで蛍光: アレクサ 488 (緑):ex λ = 488 nm (アルゴン レーザー) λem = 493 570 nm;テキサス州レッド (赤):ex λ = 561 nm (DPSS 561 nm レーザー)、λem = 601 635 nm;DAPI (青):ex λ = 405 nm (405 ダイオード レーザー)、λem = 410 507 nm。スケールバー = 100 μ m. d r) 未処理 (d g)、photobleached (i l) 別蛍光チャンネルの化学を癒す治療 (n-q) サンプルで点線の領域の高倍率画像イメージを合併し、蛍光信号プロファイルを定量化します。マージされたチャンネル (g, l, q) の点線は、生成されたプロファイル (h、m、r) 信号の線を表しています。スケールバー = 50 の μ m 蛍光粒子 (af)カルビンディン抗体に蛍光タウ (tau) と核の信号 (nuc) が示されます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本稿に記載されている組織のフォトブリーチング前処理は、既製のコンポーネントを使用して蛍光の効果的な除去が可能です。プロトコルでは、アレクサ 488 とテキサス赤、核の対比染色として DAPI の二次抗体を使用して人間の脳をホルマリン固定組織におけるリン酸化タウ凝集体の蛍光イメージングについて説明します。メソッドを適用すると、他の組織に、開始点としてサンプルに 48 h フォトブリーチング前処理を実行することをお勧めします。退色、製造元の推奨事項に従う抗体の希薄を使用して興味の機能のためのプロトコルを汚す標準蛍光を実行します。背景の蛍光性がまだ存在する場合退色時間や手順を汚す抗体を変更する必要があります。退色の期間、装置やサンプルの蛍光のレベルを構築する選択ランプによって異なります。それぞれのユニークなランプ装置に最適の漂白時間を決定する必要があります。これは無染色、coverslipped 組織切片 TBS アジにマウントされ、蛍光顕微鏡を用いた 12 時間間隔でスライドの内因性蛍光測定退色によって行うことができます。以前のレポートで粒子解析によるリポフスチン退色を監視、指数関数的減衰をカーブフィッティング関数5、簡略化のため定期的にセクションの目視効果があることも同様に判断する、蛍光性のほとんどの期間が急冷になります。リポフスチン色素を多量に含む高齢者の脳組織の場合、800 ルクス ランプで 48 時間培養で十分でした。特定の信号は、退色後バック グラウンドと比較して弱いまま、染色中に第一次および二次抗体の濃度を増やすことを検討します。また、二次抗体の非特異的結合によるバック グラウンド信号が生じないように二次抗体だけ制御を行うことが重要です。交差反応しない抗体を選択する注意してください、特に複数のターゲットのために汚れます。さらに、特定の信号が染色のプロセス中に誤って急冷いないことを確認します。例えば、BSA (ニューロンを染色) のニッスル染色はクエンチしました。このインスタンスで、魚皮ゼラチン5などの選択肢をブロッキング剤の BSA のコンポーネントを置き換える必要があります。
退色のため白色蛍光体の Led の使用は 420 からの発光スペクトルによる一定の制限 650 nm nm。したがって、紫外線の波長で重要な退色を行うことはありません。また、特定の波長の光の発色団広い発光スペクトルによる望ましくない発光波長を除外する LED アレイ上のカラー フィルター シートをオーバーレイするなどの変更が必要です。さらに、組織の変質は、他のメソッドよりも処理時間が長く必要があります。この場合、(89 歳の個人) から脳の時代と 2 日以上の長いアルデヒド固定期間のため 48 時間退色時間が必要でした。アクティブな処理時間が必要ないが考慮退色時間と染色のセッションをそれに応じて計画する必要があります。高輝度の LED ランプまたは複数のランプの使用が大幅に低下退色時間光量子束の簡単な増加によって。
既存の方法に比べると、私たちの技術はいくつかの重要な利点を提供しています。異なり、蛍光顕微鏡でスキャン レーザーを使用して退色、LED 光を使用して、サンプルの光誘起損傷の兆候は認められなかった。私達の装置の別の主な利点は、コストの大幅な削減を他の技術上です。当社装置の組立のコストは約 $10 us ドル、および装置のアセンブリは、あらゆる研究室は、photobleacher の独自のバージョンを採用することが引き起こすような柔軟です。比較では、カスタム スライド ホルダーと LED アレイの mutispectral を使用して他のメソッドと冷却室最大 $1000 USD8を構築する必要があります。さらに、商業化学の消す物、100 スライド 120 ドルを費用し、サンプルに不要な可能性のある化合物を導入する消耗品です。化学クェンチャー可能性があります本研究では比較のためには、脂質結合スーダン ブラック染料には、リポ蛋白の免疫染色を妨げる可能性が含まれています。
全体的にみて、退色前処理および標本の免疫染色で最も重要な手順には染色中のセクションの処理が含まれます。退色中セクションを復元すると、かつてない以降の手順のいずれかの乾燥に許可されていることが重要です。スライドの乾燥と、抗体の不均等な分布を引き起こす、uninterpretable の成果物を作成します。時間と潜在的に貴重なサンプルの損失を避けるためには、プロトコルのいくつかの手順で注意する必要があります。抗原検索後 TBS トリトン透過ソリューションに転送する前に冷却する組織ができます。瞬時乾燥で組織のサンプルが高温に加熱すると空気にも一時的な露出になります。また抗体、ブロック、または対比染色ソリューション使用してアプリケーション中の組織完全にカバーを確認します。これはソリューションの流出を避けるために疎水性のペンによる組織の輪郭が表示されたら完全に平らな面に加湿チャンバー内ですべてのソリューションが適用されていることを確認することによって達成することができます。これは一晩の孵化 (一次抗体結合) の間に特に重要です。
退色前の染色に Led 白色蛍光体を使用しての成功のアプリケーションは、アーカイブされた組織への螢光抗体法の応用を促進するかもしれない。我々 は、将来的に幅広い試料に対応できる期待汎用性と安価な治療です。このメソッドを用いながら人間の脳組織にいるだけ、このテクニックを簡単に任意の汚損のプロトコルに組み込むことができますを蛍光では骨格や心臓など後の組織において、望ましい結果を防止筋肉 lipofucin が蓄積する可能性が高い。
開示事項
著者が明らかに何もありません。
謝辞
この研究では、カナダのコンソーシアムの神経変性、加齢 (CCNA)、カナダの研究所の健康研究 (機構)、カナダ (ALS)、ALS 協会・ アルツハイマー協会カナダ (ASC) の全体または一部を支えられました。著者はスルタン Darvesh と海上脳組織銀行から FTLD の脳組織を提供するため時空をターゲットと増幅の放射線応答 (STTARR) プログラムおよび関連会社からミラノ グリー Andrew Reid を感謝したいです。埋め込み、区分のサービス、および、高度な光学顕微鏡施設 (AOMF) 顕微鏡の楽器を提供するための組織のための機関の資金調達。ケビン ハドリーは原稿の批判的検討の感謝の意を。
資料
| Name | Company | Catalog Number | Comments |
| Trizma Base | Sigma-Aldrich | T6066 | |
| Sodium Choloride | Sigma-Aldrich | S7653 | |
| Hydrochloric Acid | Caledon Laboratory Chemicals | 1506656 | |
| Sodium Azide | BioShop Canada | SAZ001 | |
| 100 mm x 100 mm x 20 mm Pitri dish | Sarstedt | 82.9923.422 | All components of photobleacher can be substituted based on availability |
| 6 W LED Dimmable Desk Lamp | DBPower | DS501 | All components of photobleacher can be substituted based on availability |
| Citric Acid | Sigma-Aldrich | C-2404 | |
| Ethylenediaminetetraacetic acid (EDTA) | BioShop Canada | EDT001 | |
| Tween 20 | Sigma-Aldrich | P-7949 | |
| Sodium Hydroxide | BioShop Canada | SHY700.1 | |
| Water bath | Haake Fisons | K15 | |
| Slide collector | FisherScientific | 12-587-17B | |
| Staining Jar | FisherScientific | E94 | |
| Orbital Shaker | Bellco Glass | 7744-08115 | |
| Triton X-100 | Sigma-Aldrich | T7878 | |
| Bovine Serum Albumin | FisherScientific | BP1600-1 | |
| Normal Goat Serum | Aurion | 905.002 | |
| Hydrophobic pen | Sigma-Aldrich | Z672548-1EA | |
| Phospho-Tau (Ser202, Thr205) Monoclonal Antibody (AT8) | ThermoFisher | MN1020 | |
| Goat anti-Mouse Secondary Antibody, Texas Red-X | ThermoFisher | T862 | |
| Goat anti-Mouse Secondary Antibody, Alexa Fluor 488 | ThermoFisher | A-11029 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Mounting medium | ThermoScientific | 28-600-42 | |
| Glass soverslip | |||
| Confocal Microscope | Zeiss | LSM710 | |
| Imaging software ZEN 2012 Black Edition 11.0 | Zeiss | LSM710 | Software accompanies the Confocal Microscope |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| RGB Profile Tools macro | NIH | https://imagej.nih.gov/ij/macros/tools/RGBProfilesTool.txt | |
| Commercial chemical quencher | Biotum | 23007 |
参考文献
- Banerjee, B., Miedema, B. E., Chandrasekhar, H. R. Role of basement membrane collagen and elastin in the autofluorescence spectra of the colon. J Investig Med. 47 (6), 326-332 (1999).
- Terman, A., Brunk, U. T. Lipofuscin . Int J Biochem Cell Biol. 36 (8), 1400-1404 (2004).
- Del Castillo, P., Llorente, A. R., Stockert, J. C. Influence of fixation, exciting light and section thickness on the primary fluorescence of samples for microfluorometric analysis. Basic Appl Histochem. 33 (3), 251-257 (1989).
- Ottis, P., Koppe, K., et al. Human and rat brain lipofuscin proteome. Proteomics. 12 (15-16), 2445-2454 (2012).
- Sun, Y., Chakrabartty, A. Cost-effective elimination of lipofuscin fluorescence from formalin-fixed brain tissue by white phosphor light emitting diode array. Biochem Cell Biol. 94 (6), 545-550 (2016).
- Davis, A. S., Richter, A., et al. Characterizing and Diminishing Autofluorescence in Formalin-fixed Paraffin-embedded Human Respiratory Tissue. J Histochem Cytochem. 62 (6), 405-423 (2014).
- Zimmermann, T., Rietdorf, J., Pepperkok, R. Spectral imaging and its applications in live cell microscopy. FEBS Lett. 546 (1), 87-92 (2003).
- Duong, H., Han, M. A multispectral LED array for the reduction of background autofluorescence in brain tissue. J Neurosci Methods. 220 (1), 46-54 (2013).
- Albeanu, D. F., Soucy, E., Sato, T. F., Meister, M., Murthy, V. N. LED arrays as cost effective and efficient light sources for widefield microscopy. PLoS One. 3 (5), 1-7 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Robertson, J. B., Zhang, Y., Johnson, C. H. Light-emitting diode flashlights as effective and inexpensive light sources for fluorescence microscopy. J Microsc. 236 (1), 1-4 (2009).
- Mackenzie, I. R. A., Neumann, M. Molecular neuropathology of frontotemporal dementia: insights into disease mechanisms from postmortem studies. J Neurochem. 138 (S1), 54-70 (2016).
- Kouri, N., Whitwell, J. L., Josephs, K. A., Rademakers, R., Dickson, D. W. Corticobasal degeneration: a pathologically distinct 4R tauopathy. Nat Rev Neurol. 7 (5), 263-272 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved