Method Article
Einfache Beseitigung von Hintergrundfluoreszenz in Formalin fixiert menschliche Gehirngewebe für die Immunfluoreszenz-Mikroskopie
In diesem Artikel
Zusammenfassung
Hintergrund Autofluoreszenz biologischer Proben erschwert oft Fluoreszenz basierende bildgebende Verfahren, vor allem im Alter menschlicher postmitotischen Gewebe. Dieses Protokoll beschreibt, wie die Autofluoreszenz aus diesen Proben effektiv entfernt werden kann mit einer handelsüblichen Licht emittierende Diode Licht Quelle zu Photobleach die Probe vor Immunostaining.
Zusammenfassung
Immunfluoreszenz ist eine gängige Methode, verwendet um subzelluläre Kompartimente zu visualisieren und die Lokalisierung von bestimmten Proteinen innerhalb einer Gewebeprobe bestimmen. Ein großes Hindernis für die Übernahme von Bildern hoher Qualität Immunfluoreszenz ist endogene Autofluoreszenz des Gewebes durch Alterung Pigmente wie Lipofuszin oder gemeinsame Probe Verarbeitungsverfahren wie Aldehyd Fixierung. Dieses Protokoll beschreibt, wie Hintergrundfluoreszenz durch Immunofluoreszenz mit weißem Phosphor lichtemittierende Diode (LED) Arrays vor der Behandlung mit fluoreszierenden Sonden erheblich reduziert werden kann. Die Breitspektrum Emission von weißem Phosphor ermöglichen LEDs in einem Spektrum von Emission Gipfeln des Fluorophore bleichen. Immunofluoreszenz-Apparat aus Standardkomponenten zu sehr geringen Kosten aufgebaut werden kann und bietet eine zugängliche Alternative zu handelsüblichen chemischen stillt. Eine Immunofluoreszenz Vorbehandlung des Gewebes gefolgt von konventionellen Immunfluoreszenz Färbung erzeugt Bilder gratis Hintergrund Autofluoreszenz. Im Vergleich zu chemischen stillt die Sonde sowie Hintergrund reduziert Signale, Immunofluoreszenz Behandlung hatte keinen Einfluss auf Sonde Fluoreszenz-Intensität, während es effektiv Hintergrund und Lipofuszin Fluoreszenz reduziert. Obwohl Immunofluoreszenz mehr Zeit für die Vorbehandlung erfordert, können höhere Intensität LED-Arrays zur Immunofluoreszenz verkürzen. Diese einfache Methode kann potenziell zu einer Vielzahl von Geweben, insbesondere postmitotischen Gewebe, die ansammeln von Lipofuszin wie dem Gehirn und Herz- oder skelettartige Muskeln angewendet werden.
Einleitung
Fluoreszenz-Mikroskopie mit Antikörpern, die Ausrichtung auf bestimmte Proteine wird routinemäßig verwendet, um Proteine des Interesses in Zellkultur und Geweben zu visualisieren. Eine schwere Komplikation für den Erwerb der eindeutige und endgültige Bilder in Immunfluoreszenz ist Autofluoreszenz, die endogen im Säugetier-Gewebe durch die Alter Pigment Lipofuszin und Proteine wie Elastin und Kollagen1entstehen können, 2. Andere Quellen der Autofluoreszenz können durch Vorbereitung Beispielschritte z. B. Aldehyd Fixierung3eingeführt werden. Lipofuszin-Granulat, hauptsächlich bestehend aus oxidativ modifizierten Protein- und Lipid-Abbau-Rückstände, reichern sich in langlebigen Zellen mit zunehmendem Alter2. Dies bewirkt, dass Schwierigkeiten im Bereich der bildgebenden postmitotischen Gewebe wie Gehirn und Herz- oder skelettartige Muskeln, wie die Fluoreszenz Emissionsspektrum von Lipofuszin ist breit und variabel, oft zeitgleich mit der Emissionswellenlänge von gemeinsamen Fluorophore verwendet für 4Kennzeichnung. Diese Faktoren machen Bildgebung des menschlichen Hirngewebe von late-Onset neurodegenerativen Erkrankungen wie Frontotemporal lobar Degeneration (FTLD) besonders anspruchsvoll.
Um Autofluoreszenz zu reduzieren, haben wir eine Technik entwickelt, in der wir die Rutsche montiert Gewebeschnitte mit weißem Licht emittierende (LED)-Diodenarray mit einem Haushalt Schreibtisch Lampe5bestrahlen. Diese einfache Technik bietet eine Alternative zu Techniken, mit denen chemische stillt z. B. CuSO4 in Ammoniumacetat, oder im Handel erhältlichen Farbstoffe wie Sudan schwarz-B und Eriochrome Schwarz T6abschrecken. Es hat auch erhebliche Kostenersparnis über multispektralen LED Lampe Immunofluoreszenz Techniken und vermeidet Komplikationen und Artefakte aus digitalen Autofluoreszenz Methoden der Haarentfernung wie spektrale un-Mischen7,8erzeugt. Weißer Phosphor haben LEDs eine breite Emissionsspektrum, hohe Leuchtkraft und niedrige Herstellungskosten, eignen sich ideal als handelsübliche Komponente für Immunofluoreszenz verschiedener Chromophore5,9.
In diesem Protokoll wir zeigen den Bau von einem Immunofluoreszenz-Apparat mit zugänglichen Komponenten und ein Fall von FTLD Gewebe mit Tau-positiver Einschlüsse (FTLD-T) mit einem Antikörper spezifisch für phosphorylierten Tau Immunofluoreszenz zuweisen. Wir zeigen die Wirkung der Immunofluoreszenz Fluoreszent-markierten Antikörpern beschäftigt zwei häufig verwendete Chromophore Imaging: Alexa 488 und Texas Red. Die Wirkung der Immunofluoreszenz im Vergleich zu unbehandelten Abschnitte oder die Behandlung mit einem kommerziellen chemische Quencher werden quantifiziert und verglichen. Diese Vorbehandlung Immunofluoreszenz kann in jedes standard Immunfluoreszenz-Färbung-Protokoll zu Autofluoreszenz in einer biologischen Probe entfernen aufzunehmen.
Protokoll
Hinweis: die vorliegende Arbeit wurde durchgeführt in Übereinstimmung mit den anerkannten internationalen Standards, einschließlich der internationalen Konferenz auf Harmonisierung (ICH), der Rat für internationale Organisationen der medizinischen Wissenschaften (zusammensetzte) , und den Grundsätzen der Erklärung von Helsinki. Verwendung von menschlichem Gewebe wurde mit Zustimmung der Universität Health Network Research Ethics Board. Die menschliche Gehirn Proben wurden als Bestandteil der maritimen Brain Tissue Bank gesammelt. Zum Zeitpunkt der Erhebung war die Einwilligung aller Patienten.
1. bauen Immunofluoreszenz Apparate-und Lösungen
- Stammlösungen vorbereiten.
- Bereiten Sie 1 L 1 x Lager Tris gepufferte Kochsalzlösung (1 X TBS) Lösung (150 mM NaCl, 50 mM Tris-Cl, pH 7,4) durch auflösen 8,77 g NaCl und 6,06 g Tris in 800 mL DdH 2 O und anpassen den pH-Wert 7,4 mit HCl. bringen die Lautstärke auf 1 L und Autoklaven. < / Li >
- 10 % (200 X bestand) Natriumazid durch Auflösen von 1 g Natriumazid in 10 mL DdH 2 O (10 %, 200 X Lager) vorzubereiten.
- Für 1-3 standard-Größe Folien, verwenden eine einzigen 100 x 100 mm transparent, quadratische Petrischale als Folie Kammer. Fügen Sie für eine einzelne Folie Kammer 0,25 mL 200 X Natrium-Azid Lager 50 mL 1 X TBS eine 0,05 % Natriumazid-TBS-Lösung zu machen hinzu. Stapeln Sie 2-3 Folie Kammern vertikal um weitere Folien zu verarbeiten. Bereiten Sie eine zusätzliche 50 mL-Azid-TBS-Lösung für jede Kammer.
- Schaffen ein Gerüst um die Folie Kammer(n) zu erhöhen, so dass ein Leuchtenkopf darunter Platz haben.
- Für ein 100 mm x 100 mm Folie Kammer, Öffnungen in den Boden und die Seiten von einem 100 mm x 100 mm x 30 mm Kunststoff Essen-Container und Container zu invertieren. Sicherzustellen, dass die seitlichen Öffnungen sind groß genug, um fit eine LED-Lichtquelle und sichergestellt, die untere Öffnung ist groß genug, so dass Licht von der Lichtquelle die Probenkammer ohne Hindernis erreicht.
- Gelten Isolierband für das Gerüst, um den Griff zwischen Gerüst und die Probe Kammer/Benchtop zu erhöhen. Alternative Materialien, um das Gerüst zu bauen, so lange es sicher die Folie Kammer erhebt, ohne zu behindern das Licht vom Erreichen der Probenmaterials verwenden.
- Entfernen Sie alle Diffusoren oder opaken Kunststoff von der Schreibtischlampe, die möglicherweise behindern das LED-Licht von der Probe direkt (wenn möglich) zu erreichen und das LED-Array nach oben zu orientieren. Legen Sie das Gerüst und Folie Kammer(n) über das LED-Array. Verwenden Sie eine Lampe mit einem flexiblen Hals für einfache Manipulation.
- Konstrukt einer reflektierenden Kuppel decken für den Apparat durch Auskleidung der Innenseite der Schachtel groß genug, um die Folie Kammer und Gerüst mit Alufolie abdecken. Verwenden Sie eine 1 mL-Pipette-Info-Feld für eine einzelne Kammer oder eine 150 x 150 mm x 150 mm Karton für mehrere, vertikal gestapelt Kammern.
2. Immunofluoreszenz Vorbehandlung von Gewebeschnitten
Hinweis: Gewebe Abschnitt Vorbereitung kann variieren, abhängig von der Quelle der Gewebe und Fixierung und Einbettungsmethoden verwendet. Hier wurde Hirngewebe (orbitofrontalen Windungen) Fall von FTLD-T ~ 2 Tage in Formalin, durchlaufen einen Farbverlauf von Saccharose, eingebettet im OAT und schneiden bis 10 µm dicke Abschnitte mit einem Kryostat behoben.
- In ein 4 ° c kalten Raum, kalten Schrank oder Kühlschrank, die Lampe unter dem Schafott zu orientieren und legen die Probenkammer auf dem Schafott. Gießen Sie 50 mL-Azid-TBS-Lösung in die Probenkammer.
- Submerge Gewebeschnitte auf standard-Glas-Objektträger in die Folie Kammer mit Azid-TBS mit sauberen Pinzette montiert. Für mehrere Folien, sicherzustellen, dass die Folien in der Kammer auf eine single Layer platziert werden.
- Decken den Apparat mit der reflektierenden Kuppel, schalten Sie die LED-Lampe und 48 h bei 4 ° c inkubieren.
3. Immunfluoreszenz
- Färben der Gewebe für phosphorylierten Tau mit DAPI Gegenfärbung und Alexa 488- und Texas Red-konjugierten Sekundärantikörper, zuerst erarbeiten Lösungen für Antigen-Retrieval, Permeabilisierung, blockieren und PV Antikörperbindung.
- Bereiten 500 mL Antigen-Retrieval-Puffer (10 mM Zitronensäure, 2 mM Ethylenediaminetetraacetic Säure, 0,05 % Tween 20; pH 6.2) durch Auflösen von 0,92 g Zitronensäure und 0,37 g der Ethylenediaminetetraacetic Säure (EDTA) in 500 mL DdH 2 O. Stellen Sie den pH-Wert 6.2 mit NaOH und 0,25 mL Tween 20.
- Bereiten Sie 500 mL von 0,025 % Triton x-100 in TBS-Lösung (TBS-Triton) durch Zugabe von 0,125 mL Triton x-100 bis 500 mL 1 x El
- Bereiten Sie eine 1 % Rinderserumalbumin (BSA) Lösung in TBS (BSA-TBS Puffer) durch Auflösen von 0,1 g BSA in 10 mL TBS.
- Bereiten die blockierende Lösung durch Zugabe von 0,2 mL normalem Ziegenserum bis 1,8 mL von 1 % BSA/El
- Vorbereitung auf jede Folie, 150 µL Primärantikörper Lösung (1: 100 Verdünnung) pipettieren 1,5 µL Anti-Phospho-PHF-Tau pSer202 + Thr205 (AT8) Antikörper in 148,5 µL 1 % BSA-TBS Puffern und lassen auf Ice
- Um Antigen-Retrieval durchzuführen, tauchen die Photobleached Folien vertikal in einem Dia-Kollektor mit 25 mL Antigen-Retrieval-Puffer. Fixieren Sie Kollektor mit Band und/oder Saiten, so dass der Sammler nicht in das Wasserbad fällt. Den Sammler in einem Wasserbad bei 90 º c für 30 min erhitzen und Kollektor auf 30 min bei Raumtemperatur abkühlen bevor Sie die Folien entfernen lassen. Nehmen Sie nicht die Folien sofort als es, dass die Abschnitte bewirkt austrocknen.
- Übertragen die Folien aus dem Antigen-Retrieval-Kollektor in ein Färbung Glas, gefüllt mit 30 mL TBS-Triton und waschen Sie die Abschnitte für 5 min auf einem Orbitalschüttler mit sanft schütteln. Wiederholen Sie das Waschen einmal mit frischen TBS-Triton. Docht entfernt überschüssigen Puffer mit einem fusselfreien Tuch und das Gewebe mit einem hydrophoben Stift zu skizzieren. Achten Sie darauf, nicht die Folien austrocknen lassen.
- Für jede Folie, das Gewebe zu blockieren, indem Pipettieren 200 µL Lösung auf das Gewebe zu blockieren und legen Sie die Folie in eine feuchte Kammer. Konstruieren Sie die Kammer durch platzieren Regales Folie in eine Pipette Tipp-Box mit einem feuchten Papiertuch. Inkubation bei Raumtemperatur für 2 h auf einer ebenen Fläche. Sicherzustellen, dass die blockierende Lösung Gewebe deckt.
- Die blockierende Lösung durch Absaugen entfernen und pipette 100-150 µL Primärantikörper Lösung auf das Gewebe. Ausreichendes Volumen an Antikörper vorhanden ist und, dass der Abschnitt auf einer ebenen Fläche zu vermeiden, Bündelung der Antikörperlösung auf der einen Seite ist zu gewährleisten. Bei 4 ° c über Nacht in eine feuchte Kammer inkubieren.
- Bereiten die Sekundärantikörper Mischung und das DAPI nuklearen Gegenfärbung.
- Für jede Folie 150 µL Sekundärantikörper Mischung (1: 100 Verdünnung) durch Zugabe von 1,5 µL Ziege Anti-Maus Alexa 488 und 1,5 µL Ziege Anti-Maus Texas rot bis 147 µL des BSA-TBS zubereiten und lassen auf Eis.
- Vorbereiten 0,1 µg/mL DAPI Gegenfärbung durch serielle Verdünnung. Mischen Sie die Stammlösung gründlich und verdünnen Sie 1 µL Lager 5 mg/mL DAPI 999 von TBS 1 mL 5 µg/mL Lösung zu machen. Verdünnen Sie für jede Folie 3 µL 5 µg/mL Lösung mit 147 µL TBS, eine Endkonzentration von 0,1 µg/mL.
Achtung: DAPI ist ein bekannter Mutagen und sollten mit Vorsicht behandelt werden.
- Den primären Antikörper durch Absaugen entfernen. Tauchen Sie die Folien in einem Glas JAR-Datei mit 30 mL TBS-Triton und Wäsche für 5 min mit schonendes Mischen auf einem Orbitalschüttler Färbung. Wiederholen Sie die Waschschritt mit frischen TBS-Triton. Docht entfernt überschüssige TBS-Triton und pipette 100 bis 150 µL der Sekundärantikörper Mischung zu jeder Folie.
- Stellen Sie sicher das Gewebe vollständig durch die Antikörper-Mischung bedeckt ist. 2 h bei Raumtemperatur in die feuchte Kammer im Dunkeln inkubieren.
- Sekundärantikörper Mischung durch Aspiration entfernen und in ein Glas JAR-Datei mit 30 mL TBS (keine Triton) Färbung die Folie zu übertragen. Für 5 min mit schonendes Mischen auf einem Orbitalschüttler waschen. Wiederholung der Waschschritt mit frischen TBS gelten 100 bis 150 µL von 0,1 µg/mL DAPI Gegenfärbung für jede Folie und 10 min bei Raumtemperatur im Dunkeln inkubieren.
- Übertragen die Folien zu einem Glas JAR-Datei mit TBS Färbung und 3 Mal mit schonendes Mischen für jeweils 5 min mit frischen TBS für jede Wäsche waschen. Docht entfernt überschüssigen Puffer.
- Gelten 3 Tropfen der wässrigen Montage Medium des Gewebes. Mit Pinzette, vorsichtig senken Sie ein sauberes Glas Deckglas auf das Gewebe, beginnend mit einer Kante und langsam senken die andere Kante, Trapping von Luftblasen zu vermeiden ab. Achten Sie darauf, nicht um das Deckglas zu verdrängen, wenn sofort imaging. Ansonsten erlauben das Eindeckmittel vor der Lagerung bei 4 ° c im Dunkeln trocknen.
4. Fluoreszenz-Mikroskopie
- Wendung auf die Fluoreszenz Lampe, das Mikroskop und die Computer und lassen Sie die Lampe aufgewärmt gefärbte Gewebe in der Fluoreszenz-Mikroskop-Stufe gleitet 15 min. Platz. Verwenden Sie das Hellfeld-Bild, um das Gewebe bei 10facher Vergrößerung zu finden.
- Geben Sie einen Tropfen des DdH 2 O an die Oberfläche des Deckglases und verwenden Sie ein Objektiv 20 X Wasser eintauchen (NA = 1,0). Wählen Sie die 4 durchschnittliche Linienebene Scan einstellen. Legen Sie die Lochkamera Größe auf 1 luftig Einheit, die eine optische Scheibe ~ 3 Mikrometer gibt. Wählen Sie die Laserwellenlängen Anregung und Emission für jedes Fluorophor in separate Spuren für beste Signal.
Hinweis: Alexa 488: λ ex = 488 nm (Argonlaser) λ Em = 493-570 nm; Texas Red: λ ex = 561 nm (DPSS 561 nm Laser), λ Em = 601-635 nm; DAPI: λ ex = 405 nm (405 Diode Laser), λ Em = 410-507 nm.- Passen Sie die Laserleistung und gain-Einstellungen um die Signalstärke für jeden Track zu optimieren. Das zusammengesetzte Bild erfassen und speichern. Die gleichen Lasereinstellungen verwenden, um Fluoreszenz-Intensitäten in eine andere Folie vergleichen.
- Zur Visualisierung der Fluoreszenzintensität in jedem Kanal, das RGB-Profil Werkzeuge Makro für ImageJ 10 zu installieren. Speichern Sie das Makro aus der Webseite als Text-Datei (https://imagej.nih.gov/ij/macros/tools/RGBProfilesTool.txt). Wählen Sie im Menü ImageJ Plugins - > Makros - > installieren; Wählen Sie die Textdatei, die RGB-Profile-Tool zu installieren.
- In ImageJ die konfokale Image-Datei öffnen und konvertieren die zusammengesetzten Bilder von den 3 Stapeln zu RGB durch Ausführen der folgenden: Bild - > Farbe - > Channel-Tool. Wählen Sie " Composite " aus dem Dropdown-Menü und prüfen Sie alle drei Kanäle. Wählen Sie Bild - > Typ - > RGB-Farben.
- Wählen Sie die RGB-Profil-Werkzeug-Symbol und ziehen Sie eine Linie über den Abschnitt in das Bild, um ein Profil erstellt werden. Sichern Sie die Intensitätsdaten als Tabelle zum Plotten.
Ergebnisse
Immunofluoreszenz Vorbehandlung Schritt kann ein standard Immunfluoreszenz-Protokoll unmittelbar vor der Antigen-Retrieval und Immunostaining (Abbildung 1A) hinzugefügt werden. Montage des Gerätes Immunofluoreszenz kann auch durchgeführt werden, mit Hilfe verschiedener, preiswerte, handelsübliche Komponenten (Abbildung 1 b). Das Emissionsspektrum von weißem Phosphor LEDs deckt ein breites Spektrum von Wellenlängen macht sie geeignet für breite Palette Immunofluoreszenz zustimmen vorherige Berichte (Abbildung 1)5,11. Nach 48 h Immunofluoreszenz wurde die Intensität der Autofluorescent Flecken, die Lipofuszin sowie allgemeine Hintergrundfluoreszenz ähneln in beiden Emission Wellenlängen in einem ungefärbten Abschnitt von FTLD-T (Abbildung 1) erheblich reduziert. Die Wirksamkeit von Immunofluoreszenz demonstriert, gebeizt wir für hyperphosphoryliertem Tau, pathologische Tau Einschlüsse im Falle von FTLD-T mit zwei verschiedenen Sekundärantikörper zu visualisieren. Die klare Form des Tau Einbeziehungen und die Verwendung von zwei Chromophore zur Kennzeichnung auch können wir getrost Autofluorescent Merkmale unterscheiden die beabsichtigten Ziele um die Technik zu überprüfen.
In den zusammengesetzten Bildern bei niedriger Vergrößerung, die Morphologie der Tau-positiver Einschlüsse, gebeizt gelb aus der Kombination von Alexa 488 und Texas Red-Kanälen besteht aus ringförmigen Sammlungen von kurzen Zellprozesse, die genannt werden "astrocytic Plaketten (Abbildung 2a-C). Diese Morphologie ist charakteristisch für Kortiko Degeneration (CBD)12,13, der mit der Pathologie-Bericht von diesem Fall einverstanden ist. In der unbehandelten Probe, sind zahlreiche Strukturen in das zusammengesetzte Bild, keine Ähnlichkeit mit Tau Einbeziehungen und zeigte Fluoreszenz in erster Linie in den roten Kanal, was darauf hindeutet, dass es Autofluoreszenz ist beabsichtigten Antikörper Färbung. Eine spürbare Hintergrundfluoreszenz ist auch sichtbar in diesem Kanal in das Sichtfeld (Abbildung 2a). Diese Autofluorescent Funktionen werden entfernt und das Gesamtbild erscheint viel sauberer, wenn Proben mit Immunofluoreszenz (PB) und der chemischen Quencher (Abb. 2 b-c) behandelt wurden.
Wir dann quantifiziert die Fluoreszenz Unterschiede in diesen Proben durch Profilierung eine kleinere Region in jeder Probe. Eine einzelne astrocytic Tafel präsentiert in jeder Behandlung Zustand zum Vergleich (Abb. 2d-R). In der unbehandelten Probe Hintergrundfluoreszenz ist in allen drei Kanälen, aber sekundäre Antikörper Fluoreszenz Alexa 488 und Texas Red-Antikörper war relativ hoch (Abb. 2h). Allerdings hatte die Autofluorescent Strukturen in der unbehandelten Probe Fluoreszenz-Intensitäten im Texas Red Channel vergleichbar mit der Texas Red Sekundärantikörper, die für Tau (Abb. 2 h) gebeizt. Wenn das Zielprotein in unserem Fall keine ausgeprägte, vorhersehbare Morphologie wie Tau, würde die Autofluoreszenz im Gewebe das Bild nicht interpretierbar gemacht haben.
Im Gegensatz dazu gegenüber die unbehandelte Probe und die Fluoreszenz des Immunostained Tau als Immunofluoreszenz-Vorbehandlung vor Immunostaining, Hintergrundfluoreszenz in der Alexa 488 angewandt wurde und Texas Red-Kanäle wurde deutlich reduziert unberührt blieb (Abb. 2i-m). Die kommerzielle chemische Quencher abgeschreckt die Autofluoreszenz im Alexa 488 Kanal nur so effektiv wie Immunofluoreszenz. Es unterdrückt auch DAPI Hintergrundfluoreszenz, die 48 h Immunofluoreszenz Behandlung (Abbildung 2 m) nicht betroffen war. Jedoch verringert die chemische Quencher auch die Intensität der Texas Red sekundäre und DAPI Signale, was auf ein gewisses Maß an kontraproduktiv abschrecken (Abbildung 2n-R).

Abbildung 1 : Anwendung der Immunofluoreszenz Vorbehandlung in einem standard Immunfluoreszenz Workflow. (A) vereinfachte schematische Darstellung der standard Immunfluoreszenz-Protokoll aus Gewebe Erwerb Imaging. Anwendung der primären und sekundären fluoreszierende Antikörper wird durch Karikaturen dargestellt. Eine repräsentative Mikroskopbild wird produziert. Maßstabsleiste = 100 µm. B) eine repräsentative Immunofluoreszenz Apparat konstruiert, mit Standardkomponenten (reflektierende Deckel wird nicht angezeigt). (C) Emissionsspektrum von weißen LED-Array. Ein schmaler Emission Peak bei 450 nm und einer breiten Spitze bei 550 nm beobachtet. (D) Wirkung der Immunofluoreszenz auf endogene Hintergrundfluoreszenz von FTLD-T Gewebe bei Alexa 488 (493-570 nm) und Texas Red (601-635 nm) Emission Wellenlängen. Autofluorescent Flecken ähnlich Lipofuszin sind nach 48 h Immunofluoreszenz gemildert. Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
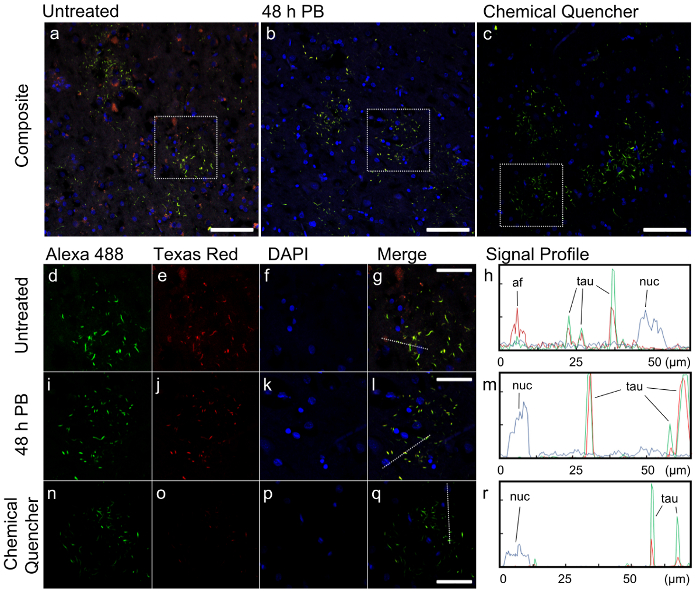
Abbildung 2:Auswirkungen der Autofluoreszenz Entfernung auf die Bildqualität des Schrankes FTLD-t Gewebe mit Anti-phosphoryliert Tau Immunostaining. a-c) geringer Vergrößerung, zusammengesetzte Immunfluoreszenz Bilder von repräsentativen Gesichtsfelder in unbehandelt (a), behandelt Photobleached für 48 h (b) und chemische Quencher (c) Muster. Farben zeigen Fluoreszenz in den folgenden Kanälen über Anregung durch ihre jeweiligen Lichtquellen: Alexa 488 (grün): λex = 488 nm (Argonlaser) λEm = 493-570 nm; Texas Red (rot): λex = 561 nm (DPSS 561 nm Laser), λEm = 601-635 nm; DAPI (blau):ex λ = 405 nm (405 Diode Laser), λEm = 410-507 nm. Maßstabsleiste = 100 µm. d-R) Bilder mit höherer Vergrößerung der punktierten Regionen in unbehandelten (d-g), Photobleached (i-l) und chemische Quencher behandelt (n-Q) Proben mit separaten Fluoreszenz Kanäle, Bild zusammengeführt und Fluoreszenz-Signal Profile quantifiziert. Gepunktete Linien in den zusammengeführten Kanälen (g, l, Q) repräsentieren die Zeile, auf welches, die Signal Profile (h, m, R) generiert wurden. Maßstabsleiste = 50 µm. Autofluorescent Partikel (af)Immunolabeled Tau Fluoreszenz (Tau) und Kern-Signal (Nuc) werden angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die Immunofluoreszenz Vorbehandlung des Gewebes in diesem Manuskript beschrieben ermöglicht eine effektive Beseitigung der Autofluoreszenz mit Standardkomponenten. Das Protokoll beschreibt Immunfluoreszenz Bildgebung der phosphorylierten Tau Aggregate in Formalin fixiert menschliche Gehirngewebe mit sekundären Antikörper konjugiert, Alexa 488 und Texas Red mit DAPI als eine nukleare Gegenfärbung. Um die Methode zu anderen Geweben anwenden, empfehlen wir eine 48 h Immunofluoreszenz Vorbehandlung der Probe als Ausgangspunkt. Führen Sie nach Immunofluoreszenz die standard Immunfluoreszenz Färbeprotokoll für die Features mit Antikörper-Verdünnungen, die nach den Empfehlungen des Herstellers. Wenn Hintergrundfluoreszenz noch vorhanden ist, muss die Immunofluoreszenz Dauer und/oder der Antikörper Färbung Schritte geändert werden. Die Dauer der Immunofluoreszenz variieren je nach der Lampe ausgewählt, um das Gerät und die Höhe der Autofluoreszenz in der Probe zu konstruieren. Die optimale bleichende Zeit für jedes einzigartige Lampe Apparat muss ermittelt werden. Dies kann durch Immunofluoreszenz eine ungefärbte, vorhanden Gewebekapitel in TBS-Azid montiert und misst die endogene Fluoreszenz der Folie im 12 h-Abstand mit einem Fluoreszenzmikroskop erfolgen. In früheren berichten wir von Partikelanalyse Lipofuszin Immunofluoreszenz überwacht und Kurvenanpassung an exponentiellen Zerfall Funktionen5, aber der Einfachheit halber visueller Beobachtung der Abschnitte in regelmäßigen Abständen kann gleichermaßen effektiv zu beurteilen, die Dauer auf die meisten der Fluoreszenz wird gestillt. In unserem Fall im Alter von Hirngewebe mit hohen Mengen an Lipofuszin Pigmente war 48 h Inkubation mit einer 800 Lux Lampe ausreichend. Wenn bestimmte das Signal schwach im Vergleich zu den Hintergrund nach Immunofluoreszenz bleibt, erwägen Sie, Erhöhung der Konzentration von primären und sekundären Antikörper während der Färbung. Es ist auch wichtig, dass ein Antikörper nur Sekundärregelung um sicherzustellen, dass das Hintergrundsignal nicht durch unspezifische Sekundärantikörper Bindung verursacht wird. Achten Sie darauf, die um Antikörper zu wählen, die keine Kreuzreaktion zu tun, vor allem, wenn für mehrere Ziele zu beflecken. Darüber hinaus sicherstellen Sie, dass die spezifische Signale nicht versehentlich bei der Färbung abgeschreckt werden. Nissl Fleck (für das Beflecken Neuronen) wird beispielsweise von BSA abgeschreckt. In diesem Fall sollte die BSA-Komponente der blockierenden Lösung mit Alternativen wie Fisch Haut Gelatine5ersetzt werden.
Der Einsatz von weißem Phosphor LEDs für Immunofluoreszenz hat gewisse Einschränkungen aufgrund seiner Emissionsspektrum von 420 nm bis 650 nm. Somit ist keine signifikante Immunofluoreszenz in der UV-Wellenlängen möglich. Auch aufgrund der breiten Emissionsspektrum Immunofluoreszenz Chromophore von bestimmten Wellenlängen erfordert Modifikationen wie überlagern Farbfilter Bogen über die LED-Arrays, um unerwünschte Emissionen Wellenlängen herauszufiltern. Darüber hinaus erfordern Immunofluoreszenz Gewebe längere Bearbeitungszeiten als andere Methoden. In diesem Fall durch das Alter des Hirngewebes (vom Individuum 89-jährige) und die lange Aldehyd Fixierung Zeitraum von mehr als 2 Tage war eine 48 h Immunofluoreszenz Dauer erforderlich. Obwohl keine aktive Verarbeitungszeit erforderlich ist, muss man berücksichtigen Immunofluoreszenz-Zeit und die Färbung Sitzung entsprechend zu planen. LED-Lampen von höheren Leuchtkraft oder der Einsatz von mehreren Lampen kann deutlich Immunofluoreszenz durch die einfache Erhöhung der Photon Flux verkürzen.
Im Vergleich zu bisherigen Methoden, bietet unsere Technik mehrere wesentliche Vorteile. Im Gegensatz zu Immunofluoreszenz mit Scan Lasern in der Fluoreszenzmikroskopie beobachteten wir keine Anzeichen für eine Foto-induzierten Schäden unserer Proben mit LED Immunofluoreszenz. Ein weiterer großer Vorteil von unserem Apparat ist die deutliche Reduzierung der Kosten gegenüber anderen Techniken. Montage von unserem Apparat kostet ca. $10 USD, und die Montage des Gerätes ist flexibel genug, so dass jedes Labor seine eigene Version der Photobleacher annehmen kann. Zum Vergleich: andere Methoden mit Mutispectral LED-Arrays mit benutzerdefinierten Objekthalter und Kühlkammern bis zu $1000 USD8bauen erfordert. Darüber hinaus sind kommerzielle chemische Quenchen Verbrauchsmaterialien, die Kosten von 120 US-Dollar für 100 Dias und potenziell unerwünschte Verbindungen in der Probe einführen. Die chemische Löscher verwendet für den Vergleich in der vorliegenden Studie wahrscheinlich enthält der Lipid-Bindung Sudan schwarzen Farbstoff, der Immunostaining Lipoproteine stören kann.
Insgesamt umfasst die wichtigsten Schritte in der Vorbehandlung Immunofluoreszenz und Immunostaining der Probe die Handhabung des Abschnitts beim Immunostaining. Es ist wichtig, dass nach Abschnitt während Immunofluoreszenz rehydriert, es nicht erlaubt ist, in den nachfolgenden Schritten austrocknen. Trocknung der Folie verursachen ungleichmäßige Verteilung von Antikörpern und nicht interpretierbar Artefakte zu schaffen. Zur Vermeidung von Zeitverlust und potenziell wertvollen Proben müssen in mehreren Schritten in das Protokoll zu achten. Lassen Sie nach Antigen-Retrieval das Gewebe vor der Übertragung an die TBS-Triton Permeabilisierung Lösung abkühlen. Auch kurzzeitige Exposition gegenüber Luft, wenn die Probe auf hohe Temperaturen erhitzt wird dazu führen, dass sofortige Trocknung des Gewebes. Auch sicherstellen Sie, dass Antikörper, die Sperrung oder die Gegenfärbung Lösungen vollständig das Gewebe während der Anwendung abdecken. Dies kann erreicht werden, indem sichergestellt wird, dass das Gewebe vollständig durch die hydrophobe Feder Lösung Stichwahl vermeiden umrissen wird und dass alle Lösungen in eine feuchte Kammer auf einer ebenen Fläche angewendet werden. Dies ist besonders wichtig während der Nacht Inkubationen (primären Antikörper-Bindung).
Die erfolgreiche Anwendung von Immunofluoreszenz mit weißem Phosphor LEDs vor Fleckenbildung kann die Anwendung von Immunfluoreszenz Methoden zur archivierten Gewebe erleichtern. Es ist eine vielseitige und kostengünstige Behandlung, die wir erwarten, offen für eine Vielzahl von Proben in der Zukunft sein. Obwohl wir diese Methode nur zum menschlichen Hirngewebe angewendet haben, kann diese Technik in jeder Färbung Protokoll leicht integriert werden in die Autofluoreszenz wünschenswerte Ergebnisse, vor allem in postmitotischen Gewebe wie Herz- oder Skelett verhindert wird Muskeln, wo Lipofuzin eher ist zu akkumulieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Studie wurde im ganzen oder in Teilen durch die kanadische Konsortium der Neurodegeneration und Alterung (CCNA), Canadian Institute der Gesundheit Forschung (CIHR), der ALS Society of Canada (ALS Kanada) und der Alzheimer-Gesellschaft von Kanada (ASC) unterstützt. Die Autoren möchten danke Sultan Darvesh und Andrew Reid von der Maritime Brain Tissue Bank für die Bereitstellung der FTLD Hirngewebe Mailand Ganguly aus der räumlich-zeitliche Ausrichtung und Verstärkung der Strahlung Reaktion (STTARR) Programm und seine angeschlossenen Förderorganisationen für Tissue, Einbettung und Dienstleistungen und die erweiterte optische Mikroskopie Facility (AOMF) für die Bereitstellung von Mikroskopie-Instrumente-Schnitt. Kevin Hadley wird für die kritische Durchsicht des Manuskripts gedankt.
Materialien
| Name | Company | Catalog Number | Comments |
| Trizma Base | Sigma-Aldrich | T6066 | |
| Sodium Choloride | Sigma-Aldrich | S7653 | |
| Hydrochloric Acid | Caledon Laboratory Chemicals | 1506656 | |
| Sodium Azide | BioShop Canada | SAZ001 | |
| 100 mm x 100 mm x 20 mm Pitri dish | Sarstedt | 82.9923.422 | All components of photobleacher can be substituted based on availability |
| 6 W LED Dimmable Desk Lamp | DBPower | DS501 | All components of photobleacher can be substituted based on availability |
| Citric Acid | Sigma-Aldrich | C-2404 | |
| Ethylenediaminetetraacetic acid (EDTA) | BioShop Canada | EDT001 | |
| Tween 20 | Sigma-Aldrich | P-7949 | |
| Sodium Hydroxide | BioShop Canada | SHY700.1 | |
| Water bath | Haake Fisons | K15 | |
| Slide collector | FisherScientific | 12-587-17B | |
| Staining Jar | FisherScientific | E94 | |
| Orbital Shaker | Bellco Glass | 7744-08115 | |
| Triton X-100 | Sigma-Aldrich | T7878 | |
| Bovine Serum Albumin | FisherScientific | BP1600-1 | |
| Normal Goat Serum | Aurion | 905.002 | |
| Hydrophobic pen | Sigma-Aldrich | Z672548-1EA | |
| Phospho-Tau (Ser202, Thr205) Monoclonal Antibody (AT8) | ThermoFisher | MN1020 | |
| Goat anti-Mouse Secondary Antibody, Texas Red-X | ThermoFisher | T862 | |
| Goat anti-Mouse Secondary Antibody, Alexa Fluor 488 | ThermoFisher | A-11029 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Mounting medium | ThermoScientific | 28-600-42 | |
| Glass soverslip | |||
| Confocal Microscope | Zeiss | LSM710 | |
| Imaging software ZEN 2012 Black Edition 11.0 | Zeiss | LSM710 | Software accompanies the Confocal Microscope |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| RGB Profile Tools macro | NIH | https://imagej.nih.gov/ij/macros/tools/RGBProfilesTool.txt | |
| Commercial chemical quencher | Biotum | 23007 |
Referenzen
- Banerjee, B., Miedema, B. E., Chandrasekhar, H. R. Role of basement membrane collagen and elastin in the autofluorescence spectra of the colon. J Investig Med. 47 (6), 326-332 (1999).
- Terman, A., Brunk, U. T. Lipofuscin . Int J Biochem Cell Biol. 36 (8), 1400-1404 (2004).
- Del Castillo, P., Llorente, A. R., Stockert, J. C. Influence of fixation, exciting light and section thickness on the primary fluorescence of samples for microfluorometric analysis. Basic Appl Histochem. 33 (3), 251-257 (1989).
- Ottis, P., Koppe, K., et al. Human and rat brain lipofuscin proteome. Proteomics. 12 (15-16), 2445-2454 (2012).
- Sun, Y., Chakrabartty, A. Cost-effective elimination of lipofuscin fluorescence from formalin-fixed brain tissue by white phosphor light emitting diode array. Biochem Cell Biol. 94 (6), 545-550 (2016).
- Davis, A. S., Richter, A., et al. Characterizing and Diminishing Autofluorescence in Formalin-fixed Paraffin-embedded Human Respiratory Tissue. J Histochem Cytochem. 62 (6), 405-423 (2014).
- Zimmermann, T., Rietdorf, J., Pepperkok, R. Spectral imaging and its applications in live cell microscopy. FEBS Lett. 546 (1), 87-92 (2003).
- Duong, H., Han, M. A multispectral LED array for the reduction of background autofluorescence in brain tissue. J Neurosci Methods. 220 (1), 46-54 (2013).
- Albeanu, D. F., Soucy, E., Sato, T. F., Meister, M., Murthy, V. N. LED arrays as cost effective and efficient light sources for widefield microscopy. PLoS One. 3 (5), 1-7 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Robertson, J. B., Zhang, Y., Johnson, C. H. Light-emitting diode flashlights as effective and inexpensive light sources for fluorescence microscopy. J Microsc. 236 (1), 1-4 (2009).
- Mackenzie, I. R. A., Neumann, M. Molecular neuropathology of frontotemporal dementia: insights into disease mechanisms from postmortem studies. J Neurochem. 138 (S1), 54-70 (2016).
- Kouri, N., Whitwell, J. L., Josephs, K. A., Rademakers, R., Dickson, D. W. Corticobasal degeneration: a pathologically distinct 4R tauopathy. Nat Rev Neurol. 7 (5), 263-272 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten