Method Article
ハチミツの抑止化学物質をスクリーニングするためのビデオトラッキングプロトコル
要約
ミツバチコロニーの喪失は、作物受粉サービスに挑戦している。現在の受粉者保護の実践は、忌避化学物質を用いてハチミツと有害な農薬との接触を最小限に抑えるための別のアプローチを保証する。ここでは、ミツバチに対する抑止力をスクリーニングするための視覚追跡プロトコルの詳細な方法を提供します。
要約
ヨーロッパミツバチApis mellifera L.は、毎年何十億ドルもの費用を生み出す、経済的にも農業的にも重要な花粉媒介者です。ハチミツのコロニー数は、1947年以来、米国および多くのヨーロッパ諸国で減少しています。この減少には、ミツバチの殺虫剤への意図しない曝露を含む多くの要因が影響します。新しい方法と規制の開発は、これらの花粉媒介者への農薬の曝露を減らすために保証されている。 1つのアプローチは、最近の農薬処理された作物からミツバチを抑える忌避化学物質の使用である。ここでは、選択された忌避化学物質にさらされたミツバチの抑止を識別するためのプロトコルについて説明します。ハチミツの飼料を採取し、試験の15時間前にインキュベーターで一晩飢えさせる。個々のミツバチを、砂糖 - アガロースキューブ(対照処理)または砂糖 - アガロース - 複合キューブ(撥水処理)を入れたペトリ皿に入れる料理の真ん中に。ペトリ皿は、ビデオトラッキングソフトウェアを使用してミツバチの歩行活動を記録するライトボックス内のカメラの下に配置されたアリーナとして機能する。合計8つの対照および8つの忌避剤処理を10分間分析し、各処理を新しいミツバチと重複させた。ここでは、ハチミツは化合物処理をした糖 - アガロースのキューブに抑えられているが、ミツバチは添加化合物なしで糖 - アガロースのキューブに引き寄せられることを示している。
概要
ヨーロッパのミツバチ、 Apis melliferaL。世界的に2,000億ドル以上の受粉サービスを提供する、経済的かつ農業上重要な昆虫である1 。米国とヨーロッパでは、ミツバチのコロニー数は減少しています。米国はカリフォルニア州を失っている。 1947年から2008年にかけて管理されたミツバチのコロニーの60%を占めていました。 1961〜2007年の27% 2、3 。寄生虫の侵入、病原体の感染、養蜂の実践、殺虫剤の使用などがありますが、これらに限定されません。
ハチミツは、2つの主要経路を介して農薬に暴露される可能性があります。ハイブ以外の農薬の暴露は、餌を食べる人が農作物と接触するときに起こります害虫からの保護のための化学薬品を噴霧されている。蜂蜜中の農薬の暴露は、養蜂者がダニ、バクテリア、微胞子虫などの病害虫や病原菌を防除するために化学物質を利用する場合に発生する可能性があります4 。米国とカナダの24の養蜂場のワックス、花粉、ミツバチのサンプルで農薬残留物が確認されている5,6。蜜蜂への農薬の接触の影響には、急性毒性ならびに麻痺、失見当識、および行動および健康の変化などの亜致死的影響が含まれる1,7。現代の農業では農作物収量を維持するために農薬を使用する必要があるため、これらの化学物質は将来も引き続き信頼されます2 。殺虫剤暴露からミツバチをより良く保護するためには、新しい議定書と規制の開発が必要である5 。保護のための1つの可能なアプローチは、餌を餌取りする間、ミツバチが農薬にさらされるのを減らすための忌避剤の使用である。
節足動物防除剤(IR)は、典型的には、節足動物の病原菌に対する個人的な咬傷保護手段として用いられてきた8 。 60年以上前に開発された最も広く使用され成功したIRはDEET 8,9です。これは昆虫忌避試験のゴールドスタンダードとみなされ、世界保健機関と環境保護庁が忌避スクリーニングのためのポジティブコントロールとして使用されています10 。さらに、DEETはミツバチを脅威から彼らのコロニーに分散させることが判明している11 。個人用IRに関連する現在の属性には、(1)広範な節足動物に対する持続的な効果、 (2)皮膚または衣類に適用したときに使用者に対して非刺激性であること; (3)無臭または楽しいにおい; (4)衣服への影響なし。 (5)皮膚に塗布し、使用者の発汗、洗浄、および拭きに耐えるときに油状の外観を示さない。 (6)一般的に使用されるプラスチックには影響を与えない。 (7)化学的に安定であり、広範な使用のために手頃な価格12 。ミツバチに使用される忌避剤は、永続的な効果、アプリケータに対する非刺激性、無臭または快適な臭気、化学的に安定で広範な使用のために手頃な価格、およびミツバチに対する無毒性のようないくつかの属性を必要とするだけである。しかしながら、これらの属性を深く探究する前に、高いスループットで忌避/抑止のための化合物をスクリーニングする方法が必要とされている。ここでは、ハチミツの抑止のための化合物をスクリーニングする実験室アッセイのプロトコールについて説明します。これは、忌避性を決定する重要なステップです。以下のプロトコールは、ミツバチに対する殺虫剤の致死効果を評価するための視覚的追跡方法を記述した以前の研究から変更されている13 。ハウこのプロトコルは、農薬処理された作物からミツバチを抑える可能性がある候補忌避物質の効果を測定するように設計されているという点で異なる。ミツバチに対する化学的抑止剤の実験室試験に推奨されるプロトコールはないので、このプロトコールはそのような化合物をスクリーニングする簡単なアプローチを提供する。
プロトコル
1.シュガー・アガロース・キューブの調製
- 8gの砂糖を秤量し、50mLの三角フラスコに入れる。
- 三角フラスコに20mLの脱イオン水を満たします。フラスコを旋回させて砂糖を溶解する。
- 170 mgのアガロースを秤量し、砂糖溶液に加える。
- 砂糖 - アガロース溶液をマイクロ波で25秒間高温に加熱する。アガロースを糖溶液に溶解する。
- フラスコと糖 - アガロース溶液を冷ます。
注:フラスコは冷たくて触ってはいけませんが、溶液が凝固しないようにしてください。- 対照処理のために糖 - アガロースキューブを調製するために、半冷却糖 - アガロース溶液を計量ボート型に注ぐ。
注:計量ボートの型は、1.5 x 1.5 x 0.3 cm 3の寸法です。 - 忌避剤処理のための糖 - アガロース - 化合物立方体を調製するために、所望量の化合物を半冷却溶液に添加する( 例えば 、1%DEET in sウガ - アガロース溶液(v / v))。フラスコを旋回させて化合物を混合し、次に溶液を計量ボート型に注ぐ。
注:この時点で、8個の制御型と8個の試験型が準備されます。制御型には忌避剤が含まれていません。
- 対照処理のために糖 - アガロースキューブを調製するために、半冷却糖 - アガロース溶液を計量ボート型に注ぐ。
- 冷蔵庫でカビの糖 - アガロースの立方体を5〜10分間冷ます。秤量ボート型から凝固した糖 - アガロースの立方体を取り出し、湿らせたペーパータオルを入れたプラスチック容器に入れる。
- コンテナを冷蔵庫に入れて保管します。砂糖 - アガロースの立方体は、調製から7日以内に使用する必要があります。
2.ビデオトラッキングソフトウェアのプログラミングと実験的セットアップ
- 画面の左側にある実験エクスプローラバー(トラッキングソフトウェアの「材料表」を参照)の下で、正しいカメラが選択され、ビデオレコーディングがペトリ皿の中央にあることを確認します。
- ビデオの録画を中央に配置する必要がある場合は、カメラの設定とAOIコントロールの下にある中央のXとYの中央のオプションを選択します。
- [実験設定]で、アリーナの数を16に変更します。[追跡される機能]で、[中心点検出]を選択します。
- アレーナ設定を選択して、アッセイに必要なアリーナを設定します。
- 16個のペトリ皿をカメラの下に置かれたライトボックスの上に4 x 4パターンで置きます( 図1 )。
注:これらの料理は録音場を作成するために使用され、空です。
- 16個のペトリ皿をカメラの下に置かれたライトボックスの上に4 x 4パターンで置きます( 図1 )。

図1:ライトボックス上のペトリ皿配置。ペトリ皿はライトボックスの上に4 x 4ブロックで配置されています。この配置は、vのための制御および忌避剤処理の容易な識別を提供する事実追跡プロトコル。 この図の拡大版を見るには、ここをクリックしてください。
- アリーナの設定では、右側のツールパネルにあるグラブの背景ボタンを使用して、16枚のペトリ皿を撮影します。これは、アリーナをセットアップするためのテンプレートとして使用されます。
- アリーナの設定画面の上部にあるツールバーの "楕円の作成"を選択し、イメージ内のペトリ皿の1つの直径に一致する円を作成します。アリーナ1マーカーを円に配置します( 図2 )。

図2:ビジュアルトラッキングソフトウェアアリーナ設定のスクリーンショット円内の斜めの縞の観察は、円内の検出領域の確認を提供する。 Aゾーン1のマーカーは、各四角に対して提供され、各ペトリ皿のターゲットゾーンを定義します。 この図の拡大版を見るには、ここをクリックしてください。
- 右側のツールパネルのArena 1にある「Zone Group 1」を選択します。画面上部のツールバーから「長方形を作成」を選択します。これを使用して30 x 30ピクセルの正方形を作成し、前の手順で作成した円の中心に配置します。上部のツールバーから「ゾーンを追加」を選択し、四角形の中央をクリックします。ゾーン1マーカーが正方形になるように移動します。
注:作成された四角は給餌ゾーンであり、給餌ゾーンは糖アガロースキューブよりわずかに大きい限り、記載されているサイズと正確に同じである必要はありません。
les / ftp_upload / 55603 / 55603fig3.jpg "/>
図3:Completed Arena Settingsのスクリーンショット完成したアリーナの設定はこの例のようになります。 この図の拡大版を見るには、ここをクリックしてください。
- 右側のツールパネルで[Arena 1]を選択し、[完全なアリーナを複製]をクリックします。ドロップダウンメニューから「All Other Arenas」を選択し、「OK」をクリックします。複製されたアリーナの設定をグラブ画像の残りのペトリ皿に移動します(図3)。
- "Arena 1"を選択し、上部のツールバーで "目盛りの校正"を選択します。アリーナ1ペトリ皿の直径全体に較正線を描きます。直径測定値を9cmに変更する(使用しているペトリ皿の直径)。右側のツールパネルで[アリーナ設定の検証]を選択します。
- 選択 "左のコントロールバーの「検出設定」を選択します。
- 「検出設定1」を選択し、右側のツールボックスにあるドロップダウンメニューで「グレースケール」を選択します。検出下では、範囲を0〜83に設定します( 図4A )。
- 「検出設定」を右クリックして、「検出設定2」という名前の新しい設定を作成します。 「グレースケール」が選択されていることを確認しますが、他のパラメータは変更しないでください。
注:ビデオウィンドウには、アリーナの上に大きな黄色の円が表示されます。これは、記録前にペトリ皿を正しい位置に配置するのを助けます( 図4B )。
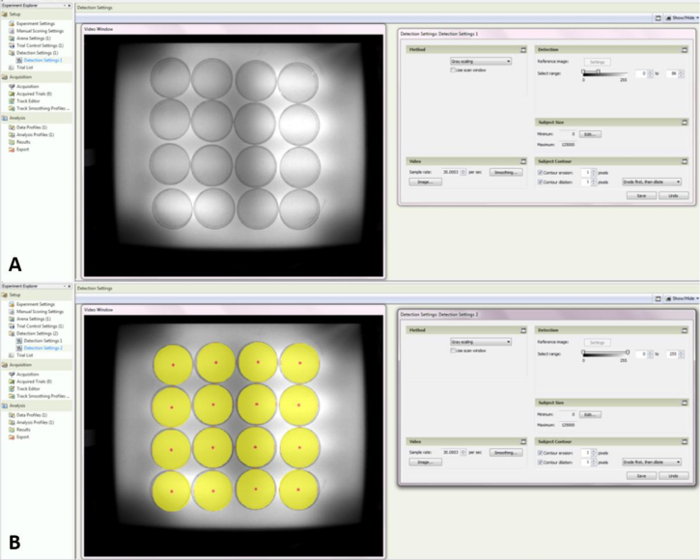
図4:検出設定1と2のスクリーンショット ( A )アレーナがどのように表示され、グレースケールがシャーベットのハチミツ。 ( B )試行の間にペトリ皿の配置を行うことができるように、アリーナ検出領域を示す。 この図の拡大版を見るには、ここをクリックしてください。
- Experimental Explorerで "Trial List"を選択し、上部ツールバーの "Add Variable"をクリックします。ユーザー定義変数に「治療」と名前を付けます。ユーザが定義したTreatmentカラムの "Predefined Values"ドロップダウンバーを選択し、C(コントロール)とT(治療)をPredefined Valuesとして追加します。上部のツールバーにある「トライアルの追加」ボタンを選択します。 2つの試行を追加し、各競技場がコントロールアリーナ(C)か治療アリーナ(T)かを選択する( 図5 )。

Fi図5:試用リストのスクリーンショット。プログラムがここで情報を使用してデータを分離し、それを統計的に分析するので、アリーナに正しくラベルを付けることが重要です。 この図の拡大版を見るには、ここをクリックしてください。
- Experiment Explorerパネルの下の "Data Profile"を選択します。左側の列で、 "User-defined Independent Variables"見出しの下にある "Treatment"を選択します。これは、フローチャートにある領域に「フィルタ」ボックスを追加します。ポップアップボックスで "C"を選択し、新しく作成したフィルターを "開始"ボックスと "結果1"ボックスの間に置きます。フローチャートの矢印は、開始ボックスからフィルタ、最後に結果1を指すように調整する必要があります。
- 手順2.12を繰り返しますが、今回はフィルタの "T"を選択してから、「共通要素」セクションの下の「結果」をクリックします。新しく作成したボックスをフローチャート領域に移動し、矢印でボックスを接続します( 図6 )。
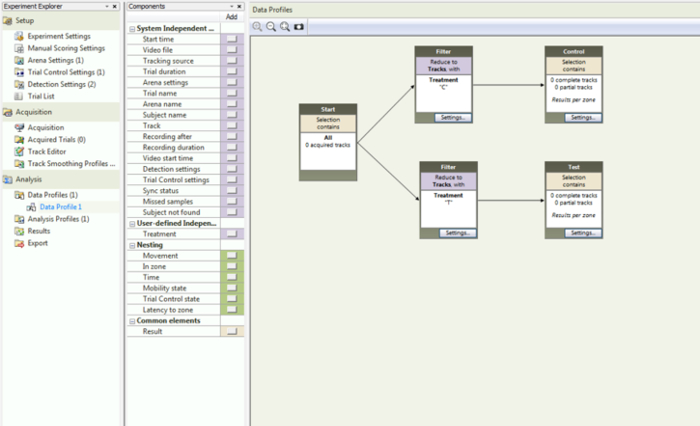
図6:データプロファイルのスクリーンショットこれは、統計分析で適切な分離を得るためにフローチャートがどのように設定されるべきかを示しています。 この図の拡大版を見るには、ここをクリックしてください。
- ファイルを保存します。
3.ハチミツ個体を集める
- 保護服を着て、ミツバチ(主に飼い犬)を集めるハイブを選択してください。
- ハイブの外側カバーと内側カバーを取り外します。ハイブツールを使用して、巣箱を含まないトップハイブボディのフレームを選択します。ハイブボックスからフレームを静かに持ち上げます。
- ミツバチ女王のためのフレームを点検しなさい。彼女がそこにいない場合は、輸送のためにフレームからコンテナにミツバチ労働者を掃除します。十分な個体を集めて、試験する各化合物について2回の完全試験を行うことができるようにする(対照で試験ごとに16人が利用される)。
注:収集された個体は、主に飼料作物であるべきである。しかし、コレクションに含まれる看護師のような他の高齢者がいるかもしれません。 - ミツバチが取り除かれた時期を書き留めます。それらを空気孔を含む9cm×7cm×9cmのプラスチックボックスに移し、32℃および70%相対湿度のインキュベーターに入れる。
- ミツバチを15時間飢えさせる。
注:これは通常、テストの前に蜂蜜が収集される場合に最適です。
4.ビジュアルトラッキングアッセイの実施
- ビジュアルトラッキングプログラムを起動し、保存を開きますこのアッセイのために作成された実験ファイル。
- 「検出設定2」を選択します。
- コントロールの砂糖 - アガロースの立方体を16のペトリ皿のうちの8つの中心に置きます。残りの8種類の砂糖 - アガロース - 化合物(抑止力)キューブでこのプロセスを繰り返します。
- 鉗子を使用して、プラスチック箱から単一のミツバチを取り出し、コントロールのペトリ皿の1つに入れます。
- 残りの15ペトリ皿について、ステップ4.4を繰り返す。
- すべての皿をライトボックスに置き、ペトリ皿の各アリーナにアリーナ検出領域(検出設定2が選択されているときはコンピュータ画面に表示されている)が収まるように配置します。赤いスペクトルに設定された一連のLEDライトでライトボックスを下から照らします。箱とカメラ全体を黒いプラスチックシートで包み、外光をなくし、アリーナ内の影を減らします。
- ペトリ皿をセットした後、「検出設定1」が選択された設定。
注:この時点で、ビジュアルトラッキングソフトウェアは、ペトリ皿のアリーナ内のミツバチのみをピックアップする必要があります。 - Experiment Explorerから「Acquisition」を選択します。録音を開始するには、右側のAcquisition Controlポップアップボックスにある緑色の「試用開始」ボタンを押します。
- アッセイを10分間実行し、その後、Acquisition Controlポップアップボックスの赤い "Stop Trial"ボタンをクリックして、記録を停止します。
- ペトリ皿から個体を取り出し、別々の容器に入れて2回検査しないでください。
- 同じ化合物の2回目の試行について、4.4-4.10のステップを繰り返します。
注:このメソッドは、ユーザーが必要に応じて治療ごとのミツバチの数を増やすように変更することができます。 - 実験エクスプローラで[統計]を選択し、[計算]をクリックします。
- データをデータ・マネージャ・ソフトウェアにエクスポートし、重要度のデータを分析するには、aを使用します。Tukeyの事後検定による分散分析、および好ましい統計ソフトウェアプログラムを用いた不対t検定が含まれる。
結果
砂糖 - アガロース(コントロール処理)または糖 - アガロース - 複合キューブ(抑止処置)のいずれかを用いて、ミツバチが標的ゾーンに費やした時間を記録する視覚追跡プロトコルを開発した。記録された時間は、統計的ソフトウェアプログラムを用いて分析され、目標ゾーンにおける平均±標準誤差が棒グラフとして報告された。昆虫忌避剤/抑止試験のためのゴールドスタンダードであるDEETを、このプロトコールで陽性対照として用いた。砂糖アガロースキューブ(ネガティブコントロール)を与えたミツバチは標的ゾーンで343±26秒を費やしたが、砂糖アガロースDEET(忌避剤)を与えたミツバチは標的ゾーンで16±4秒を費やした( 図7 )。 DEETは、標的ゾーンのミツバチが消費した時間をcaで大幅に削減しました。 95%であった。
次いで、このプロトコルにより、ミツバチに対する抑止を決定するために興味のあった化合物をスクリーニングした。図8Aは、標的ゾーンの食物源からミツバチを抑止しない化合物を表す。対照皿の標的ゾーンでミツバチが費やした平均時間は約2時間であった。 352±60秒、 ca.化合物Aを注入した糖 - アガロースキューブを有するペトリ皿内のミツバチについては282±43秒であった。 図8Bは個々のミツバチに対する同様の抑止効果を有するDEET以外の化合物を表す。対照のペトリ皿の中にあるハチミツは、平均時間の間、標的ゾーンにとどまった。 493±31秒、 ca.化合物Bを注入した糖 - アガロースキューブを含有するペトリ皿中のミツバチについては23±3秒。これらの結果は、ミツバチの化学的抑止剤のスクリーニングにこのプロトコルを使用することを立証した。目的の化合物でこのプロトコルを実行する前に、ミツバチの飢餓時間の量を決定するためにタイムコースの試験を行う必要があります。
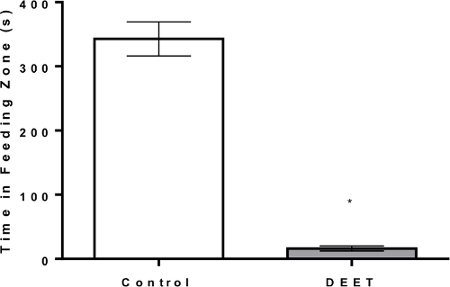
図7: ビジュアルトラッキングソフトウェア抑止プロトコル陽性対照DEETの結果例ハチミツは夕方にハイブから集められ、除去時間が記録されます。次いでそれらは、空気孔を含むプラスチック容器に移される。箱を32℃に設定したインキュベーターに置き、15時間一晩保持する。翌朝、個体を対照糖 - アガロースキューブまたはDEET-注入糖 - アガロースキューブのいずれかを含むペトリ皿に入れる。記述された抑止プロトコルが次に実行される。この図に示された結果は、撥水性ゴールドスタンダードDEETの典型的なものです。この図から、飢えたミツバチが給餌に費やす平均時間は、コントロールキューブ( 約 343秒)を有するものは、個人がDEET( 約 16秒)を含浸させた立方体を有する給餌ゾーンで過ごす平均時間よりも有意に大きい(P <0.0001)。 この図の拡大版を見るには、ここをクリックしてください。

図8: ビジュアルトラッキングソフトウェアテスト済み化合物の結果例 ( A )コントロールディッシュ( 約 352秒)中の標的ゾーン中の個体が過ごした平均時間が、化合物Aを用いたテストディッシュ( 約 282秒)中の標的ゾーンで過ごした平均時間と有意差がないことを示すデータを表す)。 ( B )対照区と対照区との間の標的区域で費やされた平均時間の有意差を示すデータを表すes( 約 493s)および化合物B注入キューブ( 約23s )。無作為t検定を行って有意性を決定した(P <0.0001; DF 15)。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
このビジュアルトラッキングプロトコールは、比較的容易かつ容易にハチミツの化学抑制剤をスクリーニングする簡単なアプローチを提供する。ミツバチに対する化学的抑止力の実験室試験の推奨プロトコールはありません。以前の半および全圃場研究では、ミツバチの忌避剤14,15 ;記載されたプロトコルは時間がかかり、労働集約的であり、一般的な研究室の外に追加の設備資源を必要とする。このプロトコールは、ミツバチを用いたこのような化合物の半減試験の前に化学抑制剤の前提条件評価として設計された。
ハイブ以外のミツバチの化学的抑止力を評価するために個人をスクリーニングする際には問題があります。例えば、ミツバチは社会的な昆虫であり、行動に影響を与えるハイブ内のフェロモンに依存している14 。このプロトコル要求飢えに加えてフェロモンの手がかりをもはや受け取らない個体の使用を再開する。個々のミツバチの摂食反応を標準化するには、飢餓が必要です。飢餓時間は、24時間の時間経過研究によって決定された。飢餓は、個々のミツバチに有害な影響を与える可能性があることに留意すべきである。例えば、ミツバチは、ハイブから収集してから18時間後に嗜眠性になる。これらの観察に基づいて、ミツバチは、ハイブから収集してから15時間飢えていた。
失敗したスクリーニングを避けるためにこのプロトコールに関連する重要なステップは以下を含む:(1)少なくとも12時間の飢餓後に試験を行う; (2)飢餓が18-19時間を超えた後に試験を実施することを避ける。これはミツバチの活力を低下させるためである。 (3)各試験の対照個体を交換する; (4)アリーナ内の外光および制御シャドウの管理。さらに、新しい化合物scをスクリーニングする前にペトリ皿を交換する必要がありますレイン。場合によっては、ミツバチは録音中にペトリ皿の中で排泄されます。これは、通常、録音やデータ収集を妨げません。すべてのペトリ皿は、砂糖 - アガロースおよび化合物残渣ならびにミツバチの糞便を除去するために、各スクリーンの後に完全に洗浄されるべきである。
このプロトコルは主にミツバチの抑止のために化合物をスクリーニングするように設計されていますが、他の昆虫種の抑止を識別するために容易に適合させることができます。ビジュアルトラッキングソフトウェアを使用する大きな利点 それは各化合物のスクリーニングのための完全なビデオ録画を行うということです。調査者は、各録音を確認して分析する必要がある場合、関心のあるファイルを選択して、同じパラメータまたは新しいパラメータを使用して迅速に画面を再現することができます。ビジュアルトラッキングソフトウェアには、ミツバチよりも小さい個々の昆虫を検出する機能もあります。しかしながら、これは、カメラフィールドの視界が減少し、アリーナが少なくなる1つの画面に記録することができます。このプロトコルの強みは、実験室環境での抑止効果のために数分以内に化合物をスクリーニングする能力である。このように、関心のある化合物ライブラリを選択された数の野外試験の候補に減らすことによって、時間と資金を節約することができます。
開示事項
著者は何も開示することはない。
謝辞
ビジュアルトラッキングソフトウェアと機器の使用についてDr. Thomas Kuharに感謝します。私たちはJames WilsonとScott O'Nealに技術的支援をしてくれてありがとう。
資料
| Name | Company | Catalog Number | Comments |
| 50 mL Erlenmeyer flask | Kimax | 26500-50 | used for making the sugar/agarose cubes |
| Sugar | Kroger | any similar product will sufffice | |
| Deionized water | acquired in house | ||
| Agarose | Apex | 20-102 | used for making the sugar/agarose cubes |
| Mold for agarose cubes (Weigh Boat) | any mold that will provide the researcher with a 1.5 cm x 1.5 cm x 0.3 cm sugar/agarose cube will suffice | ||
| EthoVision XT | Noldus | visual tracking software | |
| 633 nm LEDs | Cyron | HTP904E | These lights were placed into a constructed light box to illuminate the arenas from below. The box was a simple wooden structure with a frosted plastic/plexi glass cover that allowed the light to disperse upwards without any glare. |
| Laptop or PC | Dell | Inspiron One 2305 | necessary for video tracking software. Any pc device capable of runnin tbe visual tracking software will suffice |
| Bee Keeping protective clothing | Dadant & Sons Inc | V0126 | any protective hood and jacket will suffice |
| Hive tool | Dadant & Sons Inc | M00757 | used to open honey bee hive |
| Container for honey bees | any container suitable for housing and storing honey bees will suffice | ||
| Featherweight forceps narrow tip | Bioquip | 4748 | used to select individual honey bees |
| 9 cm (diameter) Petri dish | Fisher Scientific | S01778 | arena used to contain individual honey bees during video tracking |
| Recording Device (Camera) | Basler | acA-1300-60gm | any device that can record the subject clearly and transfer the file to a computer will suffice |
| GraphPad Prism | Graphpad | any statistical software package will suffice |
参考文献
- Gallai, N., Salles, J. M., Settele, J., Vaissière, B. E. Economic valuation of the vulnerability of world agriculture confronted with pollinator decline. Ecol Econ. 68 (3), 810-821 (2009).
- van Engelsdorp, D., Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J Invertebr Pathol. 103, Suppl 1. S80-S95 (2010).
- Aizen, M. A., Harder, L. D. The Global Stock of Domesticated Honey Bees Is Growing Slower Than Agricultural Demand for Pollination. Current Biol. 19 (11), 915-918 (2009).
- Smith, K. M., Loh, E. H., Rostal, M. K., Zambrana-torrelio, C. M., Mendiola, L., Daszak, P. Pathogens, Pests, and Economics Drivers of Honey Bee Colony Declines and Losses. Ecohealth. 10, 434-445 (2014).
- Mullin, C. A., Frazier, M., et al. High Levels of Miticides and Agrochemicals in North American Apiaries: Implications for Honey Bee Health. PLoS ONE. 5 (3), (2010).
- Li, Y., Kelley, R. A., Anderson, T. D., Lydy, M. J. Development and comparison of two multi-residue methods for the analysis of select pesticides in honey bees, pollen, and wax by gas chromatography - quadrupole mass spectrometry. Talanta. 140, 81-87 (2015).
- Kakumanu, M. L., Reeves, A. M., Anderson, T. D., Rodrigues, R. R., Williams, M. A., Williams, M. A. Honey Bee Gut Microbiome Is Altered by In-Hive Pesticide Exposures. Front Microbiol. 7, 1-11 (2016).
- Katz, T. M., Miller, J. H., Hebert, A. A. Insect repellents: Historical perspectives and new developments. J Am Acad Dermatol. 58 (5), 865-871 (2008).
- Dickens, J. C., Bohbot, J. D. Mini review: Mode of action of mosquito repellents. Pestic Biochem Phys. 106 (3), 149-155 (2013).
- Lawrence, K. L., Achee, N. L., Bernier, U. R., Mundal, K. D., Benante, J. P. Field Evaluations of Topical Arthropod Repellents in North, Central, and South America. J Med Entomol. 51 (5), 980-988 (2014).
- Collins, A. M., Rubink, W. L., Cuadriello Aguilar,, I, J., Hellmich Ii,, L, R. Use of insect repellents for dispersing defending honey bees (Hymenoptera Apidae). J Econ Entomol. 89 (3), 608-613 (1996).
- Brown, M., Hebert, A. A. Insect repellents: An overview. J Am Acad Dermatol. 36 (2), 243-249 (1997).
- Teeters, B. S., Johnson, R. M., Ellis, M. D., Siegfried, B. D. Using video-tracking to assess sublethal effects of pesticides on honey bees (Apis mellifera L.). Environ Toxicol Chem. 31 (6), 1349-1354 (2012).
- Vallet, A., Cassier, P., Lensky, Y. Ontogeny of the fine structure of the honeybee (Apis mellifera L.) workers and the pheromonal activity of 2-heptanone. J Insect Physiol. 37 (11), 789-804 (1991).
- Free, J. B., Ja Pickett,, Ferguson, aW., Simpkins, J. R., Smith, M. C. Repelling foraging honeybees with alarm pheromones. J Agr Sci. 105 (2), 255(1985).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved