Method Article
Protocollo di monitoraggio video a chimici detergenti dello schermo per le api di miele
In questo articolo
Riepilogo
La perdita di colonie di api è una sfida per la raccolta dei servizi di impollinazione. Le attuali pratiche di protezione dell'impollinatore garantiscono un approccio alternativo per ridurre al minimo il contatto delle api con pesticidi nocivi utilizzando chimiche repellenti. Qui forniamo metodi dettagliati per un protocollo di monitoraggio visivo per la visualizzazione dei deterrenti per le api.
Abstract
L'api di miele europea, Apis mellifera L. , è un impollinatore economico e agricolo che genera miliardi di dollari ogni anno. I numeri di colonie di api sono in diminuzione negli Stati Uniti e in molti paesi europei dal 1947. In questo declino svolgono un certo numero di fattori, tra cui l'esposizione involontaria delle api di api ai pesticidi. Lo sviluppo di nuovi metodi e regolamenti è garantito per ridurre l'esposizione di pesticidi a questi impollinatori. Un approccio è l'uso di sostanze chimiche repellenti che dissuadono le api da miele da una coltura trattata recentemente con pesticidi. Qui descriviamo un protocollo per discernere la deterrenza delle api da miele esposte a chimici selezionati. Gli allevamenti di api di miele vengono raccolti e affamati durante la notte in un incubatore 15 ore prima del test. Le singole api di miele vengono collocate in piatti di Petri che presentano un cubo di agarosio (trattamento di controllo) o un cubo di agarosio (trattamento repellente)Al centro del piatto. Il piatto di Petri serve come arena posta sotto una telecamera in una scatola chiara per registrare le attività del locomotore delle api con il software di monitoraggio video. Un totale di 8 controlli e 8 trattamenti repellenti sono stati analizzati per un periodo di 10 minuti con ogni trattamento è stato duplicato con nuove api di miele. Qui dimostriamo che le api di miele vengono deterrite dai cubetti di zucchero-agarosio con un trattamento composto mentre le api di miele vengono attratte dai cubetti di zucchero-agarosio senza un composto aggiunto.
Introduzione
L'ape di miele europea, Apis melliferaL. , È un insetto economico e agricolo importante che fornisce servizi di impollinazione valutati a più di 200 miliardi di dollari a livello globale1. Negli Stati Uniti e in Europa, i numeri delle colonie di api sono diminuiti. Gli Stati Uniti hanno perso ca. Il 60% delle colonie api del miele gestite dal 1947-2008, mentre l'Europa ha perso ca. 27% dal 1961-2007 2 , 3 . Ci sono diversi fattori che potrebbero essere responsabili dell'aumento del numero delle perdite di colonia, tra cui ma non solo, infestazioni di parassiti, infezioni da agenti patogeni, pratiche di apicoltura e uso di antiparassitari 2 - 4 .
Le api del miele possono essere esposte ai pesticidi attraverso due principali vie. L'esposizione agli antiparassitari al di fuori dell'alveare può verificarsi quando foraggiamento individui entrano in contatto con colture cheSono stati spruzzati con sostanze chimiche per la protezione contro i parassiti. L'esposizione ai pesticidi all'interno dell'alveare può verificarsi quando gli apicoltori utilizzano sostanze chimiche per controllare i parassiti e gli agenti patogeni in-hive, quali acari, batteri e microsporidi 4 . I residui di antiparassitari sono stati identificati nei campioni di api, pollini e api da 24 apiari negli Stati Uniti e in Canada 5 , 6 . Gli effetti del contatto con pesticidi nelle api contengono la tossicità acuta e gli effetti sub-letali come paralisi, disorientamento e cambiamenti comportamentali e sanitari 1 , 7 . Poiché l'agricoltura moderna richiede l'uso di pesticidi per mantenere elevati rendimenti delle colture, queste sostanze chimiche continueranno ad essere affidate in futuro 2 . Per proteggere meglio le api da esportazione dei pesticidi, è necessario sviluppare nuovi protocolli e regolamenti 5 .Un possibile approccio per la protezione è l'uso di repellenti per ridurre l'esposizione delle api da miele ai pesticidi, mentre foraggiare per il cibo.
Gli insetti di insetti (IRs) sono stati tipicamente utilizzati come misure di protezione personale dei pidocchi nei confronti dei vettori di malattie degli artropodi 8 . L'IR più utilizzato e di successo, sviluppato più di 60 anni fa, è DEET 8 , 9 . È considerato il gold standard per i test di repellenti insetti e viene utilizzato dall'organizzazione mondiale della sanità e dall'Agenzia per la protezione dell'ambiente come un controllo positivo per il nuovo screening repellente 10 . Inoltre, è stato trovato che DEET ha disperso le api da una minaccia alla loro colonia 11 . Gli attributi attuali associati a IR personali includono: (1) effetto duraturo contro un ampio numero di artropodi; (2) non irritante per l'utilizzatore quando applicata alla pelle o abbigliamento; (3) inodore oOdore gradevole; (4) nessun effetto sugli abiti; (5) nessun aspetto oleoso quando applicato alla pelle e resistere alla sudorazione, lavaggio e pulitura dell'utente; (6) nessun effetto sulle materie plastiche comunemente usate; E (7) chimicamente stabili e convenienti per uso diffuso 12 . Un repellente usato per le api deve avere solo alcuni di questi attributi, come effetti durevoli, non irritanti agli applicatori, odori inodori o gradevoli, chimicamente stabili e accessibili per uso diffuso e non tossici per le api. Tuttavia, prima di esaminare in profondità questi attributi, è necessario un metodo per la selezione di composti per la repellenza / deterrenza in modo ad alto rendimento. Qui descriviamo un protocollo per un dosaggio di laboratorio per schermare composti per la deterrenza delle api, un passo importante per determinare la repellenza. Il seguente protocollo è modificato da uno studio precedente che descrive un metodo di monitoraggio visivo per valutare gli effetti subletali dei pesticidi sulle api 13 . HoweVeramente, questo protocollo differisce in quanto è progettato per misurare gli effetti dei repellenti candidati che potrebbero dissuadere le api da colture trattate con antiparassitari. Non ci sono protocolli raccomandati per i test di laboratorio dei detersivi chimici per le api di miele e, di conseguenza, questo protocollo fornisce un approccio semplice per la visualizzazione di tali composti.
Protocollo
1. Preparare i cubetti di zucchero-agarosio
- Pesare 8 g di zucchero e mettere in un pallone Erlenmeyer da 50 ml.
- Riempire il pallone Erlenmeyer con 20 ml di acqua deionizzata. Sciogliere lo zucchero girando il pallone.
- Pesare 170 mg di agarosio e aggiungerlo alla soluzione di zucchero.
- Scaldare la soluzione di zucchero-agarosio in un forno a microonde in alto per 25 s. Sciogliere l'agarosio nella soluzione di zucchero.
- Lasciare raffreddare il pallone e la soluzione di zucchero-agarosio.
NOTA: Il pallone deve essere fresco al tocco, ma non permettere che la soluzione si solidifichi.- Per preparare un cubo di zucchero-agarosio per il trattamento di controllo, versare la soluzione semi-raffreddata di zucchero-agarosio in uno stampo per barche pesanti.
NOTA: Lo stampo della barra pesatrice ha le dimensioni di 1,5 x 1,5 x 0,3 cm 3 . - Per preparare un cubo di agarosio-zucchero per il trattamento repellente aggiungere la quantità desiderata di composto alla soluzione semi-raffreddata ( es . 1% DEET in sSoluzione ugar-agarosio (v / v)). Girare il pallone per mescolare nel composto e versare la soluzione in uno stampo per barche pesanti.
NOTA: a questo punto saranno preparati otto stampi di controllo e otto stampi di prova. Gli stampi di controllo non contengono repellenti.
- Per preparare un cubo di zucchero-agarosio per il trattamento di controllo, versare la soluzione semi-raffreddata di zucchero-agarosio in uno stampo per barche pesanti.
- Raffreddare i cubetti di zucchero-agarosio negli stampi in frigorifero per 5-10 min. Rimuovere i cubetti di zucchero-agarosio solidificati dalle forme della barca pesatrice e metterli in un contenitore di plastica con un tovagliolo di carta inumidito.
- Inserire i contenitori in un frigorifero per la conservazione. I cubi di agarosio devono essere utilizzati entro 7 giorni dalla preparazione.
2. Programmazione del software di monitoraggio video e configurazione sperimentale
- In Impostazioni esperimento nella barra Esplora esperimenti (nel software di monitoraggio, vedere Tabella materiali), che si trova nella parte sinistra dello schermo, assicurarsi che la fotocamera corretta sia selezionata e che la registrazione video sia centrata sulle arene dei piatti di Petri.
- Se la registrazione video deve essere centrata, passare alle impostazioni della fotocamera e sotto i comandi AOI e selezionare le opzioni X centrali e centrali Y.
- In Impostazioni esperimentali, modificare il numero di arene a 16. Nella sezione Caratteristiche monitorate selezionare il rilevamento di punti centrali.
- Selezionare Impostazioni arena per impostare l'arena desiderata per il saggio.
- Posizionare i 16 piatti Petri in un modello 4 x 4 sulla parte superiore di una scatola chiara posizionata sotto la fotocamera ( Figura 1 ).
NOTA: Questi piatti vengono utilizzati per creare l'arena di registrazione e sono vuoti.
- Posizionare i 16 piatti Petri in un modello 4 x 4 sulla parte superiore di una scatola chiara posizionata sotto la fotocamera ( Figura 1 ).

Figura 1: Piatto di Petri sulla scatola chiara. I piatti di Petri sono disposti in un blocco 4 x 4 sulla parte superiore della scatola chiara. Questa disposizione fornisce una facile identificazione dei trattamenti di controllo e repellenti per la vIsual tracking protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
- Nelle impostazioni di Arena, utilizzare il pulsante di sfondo afferrare, situato sul pannello degli strumenti di destra, per scattare una foto dei 16 piatti Petri. Questo verrà utilizzato come modello per impostare l'arena.
- Seleziona "Crea ellisse" dalla barra degli strumenti nella parte superiore della schermata Impostazioni dell'arena e crea un cerchio che corrisponda al diametro di uno dei piatti di Petri nell'immagine acquisita. Posizionare l'indicatore Arena 1 nel cerchio ( Figura 2 ).

Figura 2: Schermata delle impostazioni dell'array software di monitoraggio visivo. L'osservazione di strisce diagonali all'interno del cerchio fornisce la conferma dell'area di rilevamento nel cerchio. UN Per ogni piazza è previsto l'indicatore di zona 1 e definisce la zona di destinazione per ogni piatto di Petri. Clicca qui per visualizzare una versione più grande di questa figura.
- Selezionare "Zone Group 1" situato sotto Arena 1 nel pannello degli strumenti a destra. Seleziona "Crea rettangolo" dalla barra degli strumenti nella parte superiore dello schermo. Crea un quadrato di 30 x 30 pixel con questo e posizionalo al centro del cerchio creato nel passaggio precedente. Seleziona "Aggiungi zona" dalla barra degli strumenti superiore e fai clic nel centro della casella. Spostare l'indicatore di zona 1 in modo che sia nella piazza.
NOTA: Il quadrato creato è la zona di alimentazione e non è necessario che la zona di alimentazione sia esattamente la stessa dimensione elencata finché è leggermente più grande del cubo di agarosio.
Les / ftp_upload / 55603 / 55603fig3.jpg "/>
Figura 3: Schermata delle impostazioni dell'arena completata. Le impostazioni arene completate dovrebbero essere simili a questo esempio. Clicca qui per visualizzare una versione più grande di questa figura.
- Selezionare "Arena 1" nel pannello degli strumenti a destra e fare clic su Duplica arena completa. Dal menu a discesa selezionare "All Other Arenas" e quindi fare clic su OK. Spostare le impostazioni arene duplicate sui piatti rimasti petri nell'immagine afferrata (Figura 3).
- Seleziona "Arena 1" e poi seleziona "Calibra scala" nella barra degli strumenti superiore. Disegnare la linea di calibrazione attraverso il diametro del piatto di Arena 1 Petri. Cambiare la misura del diametro a 9 cm (diametro dei piatti Petri in uso). Selezionare "Validate Arena Settings" nel pannello degli strumenti di destra.
- Selezionare "Impostazioni di rilevamento "sulla barra di controllo a sinistra.
- Selezionare "Impostazioni di rilevamento 1" e quindi selezionare "Scala grigia" nel menu a discesa situato nella casella degli strumenti a destra. In fase di rilevazione, impostare l'intervallo in modo che sia da 0 a 83 ( Figura 4A ).
- Fare clic con il pulsante destro del mouse su "Impostazioni di rilevamento" e fare una nuova impostazione denominata "Impostazioni di rilevamento 2". Assicurarsi che "Scala grigia" sia ancora selezionata, ma non modificare gli altri parametri.
NOTA: ci saranno grandi cerchi gialli nella finestra video sulle arene. Ciò aiuterà nell'organizzare i piatti di Petri nelle posizioni corrette prima della registrazione ( Figura 4B ).
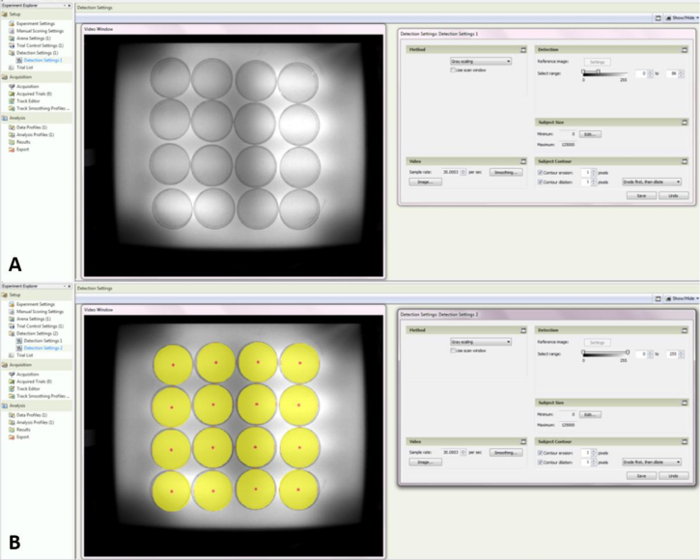
Figura 4: Schermata delle impostazioni di rilevamento 1 e 2. ( A ) Mostra quale sarà l'arena con la correzione grigia corretta per unMiele ape in un piatto di Petri. ( B ) Indica l'area di rilevamento dell'arena in modo che il posizionamento dei piatti di Petri possa essere effettuato tra prove. Clicca qui per visualizzare una versione più grande di questa figura.
- Seleziona "Elenco prove" nell'Expert sperimentale e fai clic su "Aggiungi variabile" nella barra degli strumenti superiore. Nome della variabile definita dall'utente come "Trattamento". Seleziona la barra a tendina "Valori predefiniti" nella colonna Trattamento definita dall'utente e aggiungi C (controllo) e T (trattamento) come Valori predefiniti. Selezionare il pulsante "Aggiungi prove" situato sulla barra degli strumenti superiore. Aggiungere due prove, quindi per ogni arena selezionare se si tratta di una arena di controllo (C) o di un arena di trattamento (T) ( Figura 5 ).

Fi5: Schermata dell'elenco di prova. L'etichettatura delle arene è importante qui, in quanto il programma utilizza le informazioni qui per separare i dati per analizzarlo statisticamente. Clicca qui per visualizzare una versione più grande di questa figura.
- Seleziona "Profilo dati" nel pannello Esplora esperimenti. Nella colonna a sinistra, selezionare "Trattamento" situato nella voce "Variabili indipendenti definite dall'utente". Questo aggiungerà una casella "Filtro" nell'area con il diagramma di flusso. Seleziona "C" nella casella di riepilogo e inserisci il filtro appena creato tra la casella "Inizio" e la casella "Risultato 1". Le frecce del diagramma di flusso devono essere regolate in modo che puntino dalla casella di partenza al filtro e infine al risultato 1.
- Ripetere il passaggio 2.12, ma questa volta selezionare "T" per il filtro e quindi selezionare"Risultato" nella sezione "Elementi comuni". Spostare le caselle di nuova creazione nell'area di diagramma di flusso e collegare le caselle con le frecce ( Figura 6 ).
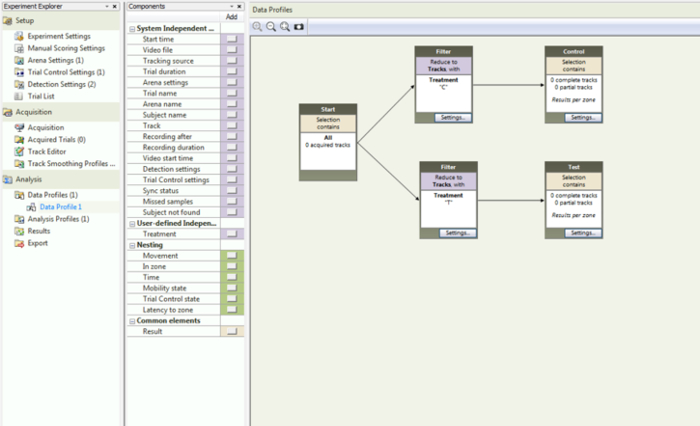
Figura 6: Schermata del profilo dati. Ciò mostra come deve essere impostato il diagramma di flusso per ottenere la separazione appropriata nell'analisi statistica. Clicca qui per visualizzare una versione più grande di questa figura.
- Salvare il file.
3. Raccogliere gli individui delle api di miele
- Metti vestiti protettivi e seleziona un alveare per raccogliere api (soprattutto foraggeri).
- Rimuovere la copertura esterna e interna dell'alveare. Utilizza uno strumento per l'alveare per selezionare un telaio dal corpo alveare superiore che non contiene covata.Estrarre delicatamente la cornice dalla cassetta dell'allupa.
- Ispeziona la cornice per la regina di api. Se non è lì, spazzare i lavoratori di api di miele dal telaio in un contenitore per il trasporto. Raccogliere persone sufficienti per essere in grado di eseguire due prove complete per ciascun composto da testare (16 individui sono utilizzati per ogni prova con controlli).
NOTA: Gli individui raccolti dovrebbero essere principalmente foragatori; Tuttavia, potrebbero essere altre persone di età compresa tra le api infermiere incluse nella raccolta. - Prendi nota del tempo in cui le api di miele sono state rimosse. Trasferitelo in una scatola di plastica di 9 cm x 7 cm x 9 cm contenente fori d'aria e inserirli in un incubatore a 32 ° C e 70% di umidità relativa.
- Starve le api per 15 h.
NOTA: Questo funziona di solito meglio se le api di miele vengono raccolte la sera prima di essere sottoposte a test.
4. Eseguire il test di monitoraggio visivo
- Avviare il programma di monitoraggio visivo e aprire il salvataggioD file sperimentale creato per questo saggio.
- Selezionare "Impostazioni rilevamento 2".
- Posizionare i cubetti di zucchero-agarosio nei centri di 8 dei 16 piatti di Petri. Ripetere questo processo con i cubetti di zucchero-agarosio (detersivo) nei restanti 8 piatti.
- Usare la pinza per rimuovere una singola ape di miele dalla scatola di plastica e metterla in uno dei piatti di controllo di Petri.
- Ripetere la fase 4.4 per i restanti 15 piatti di Petri.
- Posizionare tutti i piatti sulla scatola luminosa e posizionarli in modo che le aree di rilevamento delle arene (mostrate sullo schermo del computer quando è selezionata l'impostazione 2 di rilevamento) si adattano a ciascuna delle arene dei piatti di Petri. Illuminare la scatola luminosa dal basso da una serie di luci LED impostate allo spettro rosso. Circondato l'intera scatola e la fotocamera con un foglio di plastica nero per eliminare la luce esterna e ridurre le ombre all'interno delle arene.
- Dopo che i piatti di Petri sono stati impostati, assicurarsi che "Impostazioni di rilevazione 1" sia laImpostazione selezionata.
NOTA: A questo punto il software di monitoraggio visivo dovrebbe raccogliere solo le api di miele all'interno delle arene dei piatti di Petri. - Seleziona "Acquisizione" dall'Experiment Explorer. Premere il pulsante "Start Trial" verde situato nella finestra popup Acquisition Control sulla destra per iniziare la registrazione.
- Esegui il test per 10 minuti e fai clic sul pulsante rosso "Stop Trial" nella casella di popup Acquisition Control per interrompere la registrazione.
- Togliere gli individui dai piatti di Petri e collocarli in un contenitore separato in modo che non venissero testati due volte.
- Ripetere i passaggi 4.4-4.10 per la seconda prova sullo stesso composto.
NOTA: Questo metodo può essere modificato per aumentare il numero di api per trattamento, se necessario dall'utente. - Selezionare Statistiche nell'Experiment Explorer e quindi fare clic su calcolo.
- Esportare i dati in un software di gestione dei dati e quindi analizzare i dati per significato utilizzando un a-wUn'analisi di varianza con un post-test di Tukey e un t-test non accoppiato che utilizza un programma software statistico preferito.
Risultati
Un protocollo di monitoraggio visivo è stato sviluppato per registrare la quantità di tempo delle api da miele spesi in una zona di destinazione con agarosio a base di zucchero (trattamento di controllo) o cubo composto da zucchero-agarosio (trattamento deterrente). Il tempo registrato è stato analizzato utilizzando un programma software statistico e il tempo medio trascorso ± errore standard nella zona di destinazione viene riportato come un grafico a barre. Il DEET, il gold standard per i test di repellente / deterrente insetti, è stato utilizzato in questo protocollo come un controllo positivo. Le api di miele dotate di un cubo di zucchero-agarosio (controllo negativo) hanno speso 343 ± 26 s nella zona di destinazione mentre le api di miele dotate di un agarosio-DEET (repellente) hanno speso 16 ± 4 s nella zona di destinazione ( Figura 7 ). DEET ha ridotto notevolmente la quantità di tempo trascorsa dalle api nel campo target da ca. 95% rispetto a quello del trattamento di controllo.
I composti che erano di interesse per determinare la deterrenza alle api miele sono stati quindi sottoposti a screening attraverso questo protocollo. La figura 8A rappresenta un composto che non elude le api da provenire dalla fonte alimentare nella zona di destinazione. Il tempo medio trascorso dalle api di miele nella zona di destinazione nei piatti di controllo era ca. 352 ± 60 s, rispetto a ca. 282 ± 43 s per le api da miele nei piatti petri che avevano cubi di agarosio infuso con il composto A. La figura 8B rappresenta un composto diverso da DEET con effetti di deterrenza simili sulle singole api di miele. Le api di miele all'interno dei piatti di controllo di Petri sono rimasti nella zona di destinazione per un tempo medio di ca. 493 ± 31 s, rispetto a ca. 23 ± 3 s per le api di miele nei piatti petri contenenti un cubo di agarosio zuccherato infuso con il composto B. Questi risultati convalidano l'uso di questo protocollo per la screening di detersivi chimici per le api. Prima di eseguire questo protocollo con composti di interesse, puòEssere necessari per condurre una prova di tempo per determinare la quantità di tempo di fame per le api da miele.
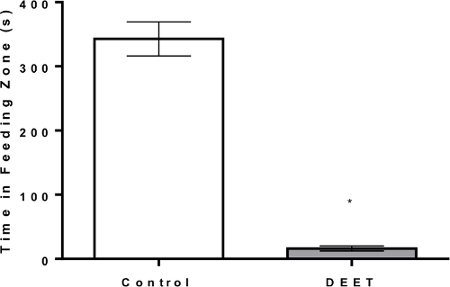
Figura 7: Risultati di esempio dal software di monitoraggio visivo del protocollo DEER. Le api del miele vengono raccolte da un alveare in serata e vengono registrati i tempi di rimozione. Quindi vengono trasferiti in un contenitore di plastica contenente fori d'aria. La scatola è posta in un incubatore a 32 ° C e si tiene per una notte per 15 ore. La mattina successiva, gli individui vengono posti in piatti di Petri contenenti un cubo di zucchero-agarosio o un cubo di agarosio a base di DEET. Viene quindi eseguito il protocollo di deterrenza descritto. I risultati mostrati in questa figura sono tipici per il gold standard di repellenza-DEET. Da questa figura vediamo che la quantità media di un ape di miele affamato spenderà nell'alimentazione zUno con un cubo di controllo ( circa 343 s) è significativamente maggiore (P <0.0001) rispetto al tempo medio che un individuo spende nella zona di alimentazione con un cubo impregnato con DEET ( circa 16 s). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Risultati di esempi da software di monitoraggio visivo Composti testati. ( A ) Rappresenta dati che mostrano il tempo medio trascorso dagli individui nella zona di destinazione nei piatti di controllo ( circa 352 s) non è significativamente differente dal tempo medio trascorso nella zona di destinazione in piatti collaudati con il composto A ( circa 282 s ). ( B ) Rappresenta i dati che mostrano differenze significative nel tempo medio trascorso nella zona di destinazione tra il cucciolo di controllo( Ca. 493 s) e cubi composti B-infuso ( ca. 23 s). Un test t unpaired è stato eseguito per determinare il significato (P <0.0001; DF 15). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo di monitoraggio visivo fornisce un semplice approccio alla schermatura di deterrenti chimici per le api da miele in modo relativamente rapido e semplice. Non ci sono protocolli raccomandati per il test di laboratorio di detersivi chimici per le api. Precedenti studi a semi e in pieno campo hanno esaminato i repellenti di api da miele 14 , 15 ; Tuttavia i protocolli descritti richiedono tempo, lavoro intensivo e necessitano di risorse aggiuntive per le strutture esterne di un laboratorio generale. Questo protocollo è stato progettato come una valutazione preliminare dei detersivi chimici prima della sperimentazione semiautomatica o completa di tali composti con api di api.
Ci sono sfide per lo screening individuale per la valutazione dei detersivi chimici per le api da miele al di fuori dell'alveare. Ad esempio, le api del miele sono insetti sociali che si affidano a feromoni nell'alveare che influenzano il comportamento 14 . Questo protocollo richiedaL'uso di individui che non ricevono più segnali di feromoni, oltre alla fame. È necessaria la fame per standardizzare le risposte di alimentazione delle singole api. Il tempo di fame è stato determinato da uno studio di 24 ore. Va notato che la fame può avere effetti dannosi sulle singole api di miele. Ad esempio, le api del miele diventano letargiche a 18 h dopo la raccolta dall'alveare. Sulla base di queste osservazioni, le api di miele sono state affamate per 15 h dopo la raccolta dall'alveare.
Le fasi critiche connesse con questo protocollo per evitare lo screening non riuscito includono: (1) condurre le prove dopo almeno 12 ore di fame; (2) evitare di condurre prove dopo la fame superiore ai 18-19 h, in quanto ciò diminuisce l'ape d'api; (3) sostituire gli individui di controllo per ogni prova; E (4) gestire le luci esterne e le ombre di controllo all'interno delle arene. Inoltre, i piatti di Petri dovrebbero essere sostituiti prima di proiettare un nuovo compreen. Occasionalmente, una ape di miele defecare all'interno del piatto di Petri durante la registrazione. Questo in genere non interferisce con la registrazione o la raccolta di dati. Tutti i piatti di Petri devono essere lavati accuratamente dopo ogni schermo per rimuovere gli zuccheri-agarosio e residui composti, nonché le feci delle api.
Questo protocollo è principalmente progettato per schermare composti per la deterrenza alle api da miele, ma può essere facilmente adattato per discernere la deterrenza in altre specie di insetti. Un vantaggio importante nell'utilizzo del software di monitoraggio visivo È che rende una registrazione video completa per lo screening di ogni composto. Se esiste una necessità di rivedere e analizzare ogni registrazione, l'investigatore può selezionare il file di interesse e rieseguire velocemente lo schermo con gli stessi o nuovi parametri. Il software di monitoraggio visivo ha anche la capacità di individuare singoli insetti più piccoli di un'ape di miele. Tuttavia, questo può richiedere un campo visivo ridotto per il campo della fotocamera e meno arenaS da registrare in un unico schermo. La forza di questo protocollo è la capacità di schermare i composti in pochi minuti per gli effetti deterrenti in un ambiente di laboratorio. Come tale, il tempo e il denaro potrebbero essere salvati riducendo una biblioteca composta di interesse a un numero selezionato di candidati per il test sul campo.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Vorremmo ringraziare il dottor Thomas Kuhar per l'utilizzo del software di monitoraggio visivo e delle attrezzature. Ringraziamo James Wilson e Scott O'Neal per la loro assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| 50 mL Erlenmeyer flask | Kimax | 26500-50 | used for making the sugar/agarose cubes |
| Sugar | Kroger | any similar product will sufffice | |
| Deionized water | acquired in house | ||
| Agarose | Apex | 20-102 | used for making the sugar/agarose cubes |
| Mold for agarose cubes (Weigh Boat) | any mold that will provide the researcher with a 1.5 cm x 1.5 cm x 0.3 cm sugar/agarose cube will suffice | ||
| EthoVision XT | Noldus | visual tracking software | |
| 633 nm LEDs | Cyron | HTP904E | These lights were placed into a constructed light box to illuminate the arenas from below. The box was a simple wooden structure with a frosted plastic/plexi glass cover that allowed the light to disperse upwards without any glare. |
| Laptop or PC | Dell | Inspiron One 2305 | necessary for video tracking software. Any pc device capable of runnin tbe visual tracking software will suffice |
| Bee Keeping protective clothing | Dadant & Sons Inc | V0126 | any protective hood and jacket will suffice |
| Hive tool | Dadant & Sons Inc | M00757 | used to open honey bee hive |
| Container for honey bees | any container suitable for housing and storing honey bees will suffice | ||
| Featherweight forceps narrow tip | Bioquip | 4748 | used to select individual honey bees |
| 9 cm (diameter) Petri dish | Fisher Scientific | S01778 | arena used to contain individual honey bees during video tracking |
| Recording Device (Camera) | Basler | acA-1300-60gm | any device that can record the subject clearly and transfer the file to a computer will suffice |
| GraphPad Prism | Graphpad | any statistical software package will suffice |
Riferimenti
- Gallai, N., Salles, J. M., Settele, J., Vaissière, B. E. Economic valuation of the vulnerability of world agriculture confronted with pollinator decline. Ecol Econ. 68 (3), 810-821 (2009).
- van Engelsdorp, D., Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J Invertebr Pathol. 103, Suppl 1. S80-S95 (2010).
- Aizen, M. A., Harder, L. D. The Global Stock of Domesticated Honey Bees Is Growing Slower Than Agricultural Demand for Pollination. Current Biol. 19 (11), 915-918 (2009).
- Smith, K. M., Loh, E. H., Rostal, M. K., Zambrana-torrelio, C. M., Mendiola, L., Daszak, P. Pathogens, Pests, and Economics Drivers of Honey Bee Colony Declines and Losses. Ecohealth. 10, 434-445 (2014).
- Mullin, C. A., Frazier, M., et al. High Levels of Miticides and Agrochemicals in North American Apiaries: Implications for Honey Bee Health. PLoS ONE. 5 (3), (2010).
- Li, Y., Kelley, R. A., Anderson, T. D., Lydy, M. J. Development and comparison of two multi-residue methods for the analysis of select pesticides in honey bees, pollen, and wax by gas chromatography - quadrupole mass spectrometry. Talanta. 140, 81-87 (2015).
- Kakumanu, M. L., Reeves, A. M., Anderson, T. D., Rodrigues, R. R., Williams, M. A., Williams, M. A. Honey Bee Gut Microbiome Is Altered by In-Hive Pesticide Exposures. Front Microbiol. 7, 1-11 (2016).
- Katz, T. M., Miller, J. H., Hebert, A. A. Insect repellents: Historical perspectives and new developments. J Am Acad Dermatol. 58 (5), 865-871 (2008).
- Dickens, J. C., Bohbot, J. D. Mini review: Mode of action of mosquito repellents. Pestic Biochem Phys. 106 (3), 149-155 (2013).
- Lawrence, K. L., Achee, N. L., Bernier, U. R., Mundal, K. D., Benante, J. P. Field Evaluations of Topical Arthropod Repellents in North, Central, and South America. J Med Entomol. 51 (5), 980-988 (2014).
- Collins, A. M., Rubink, W. L., Cuadriello Aguilar,, I, J., Hellmich Ii,, L, R. Use of insect repellents for dispersing defending honey bees (Hymenoptera Apidae). J Econ Entomol. 89 (3), 608-613 (1996).
- Brown, M., Hebert, A. A. Insect repellents: An overview. J Am Acad Dermatol. 36 (2), 243-249 (1997).
- Teeters, B. S., Johnson, R. M., Ellis, M. D., Siegfried, B. D. Using video-tracking to assess sublethal effects of pesticides on honey bees (Apis mellifera L.). Environ Toxicol Chem. 31 (6), 1349-1354 (2012).
- Vallet, A., Cassier, P., Lensky, Y. Ontogeny of the fine structure of the honeybee (Apis mellifera L.) workers and the pheromonal activity of 2-heptanone. J Insect Physiol. 37 (11), 789-804 (1991).
- Free, J. B., Ja Pickett,, Ferguson, aW., Simpkins, J. R., Smith, M. C. Repelling foraging honeybees with alarm pheromones. J Agr Sci. 105 (2), 255(1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon