Method Article
神経成長因子カプセル化のための新規HDL模倣ナノ粒子の調製とキャラクタリゼーション
要約
単純なホモジナイゼーションを用いて、神経成長因子を封入するための新規な高密度リポタンパク質模倣ナノ粒子を調製した。課題、ナノ粒子の調製、 インビトロの特性評価、およびインビボ研究の詳細なプロトコールがこの記事で説明されています。
要約
この記事の目的は、神経成長因子(NGF)負荷、高密度、リポタンパク質(HDL)模倣性ナノ粒子(NP)の調製および特徴付け方法を紹介することである。 HDLは内因性NPであり、治療剤の送達のための媒体として研究されている。 HDL模倣NPを調製するための様々な方法が開発されている。しかしながら、それらは一般に複雑で時間がかかり、工業規模では困難である。この研究では、一段階ホモジナイゼーションを用いて賦形剤を混合し、プロトタイプNPを形成した。 NGFは26kDaの水溶性タンパク質である。 HDL模倣NPの脂質環境へのNGFの封入を容易にするために、プロタミンUSPを用いてNGFとイオン対複合体を形成し、NGF表面の電荷を中和した。次いで、NGF /プロタミン複合体をプロトタイプNPに導入した。アポリポタンパク質AIを最終的にNPの表面上に被覆した。 NGF HDL模倣NPは、長期間に好ましい特性を示した粒度分布、捕捉効率、 インビトロ放出、生物活性、および生体内分布が含まれる。 HDL模倣NPにおけるホモジナイゼーションの注意深い設計と探索により、手順は大幅に単純化され、NPはスケーラブルに作られました。さらに、NPから無負荷NGFを分離し、 in vitro放出試験を確実に行い、NPの生物活性を測定するなどの様々な課題が克服された。
概要
タンパク質、ペプチド、および核酸などの高分子は有望な投薬として出現しており、過去数十年間でかなりの注目を集めています1,2 。彼らの高い有効性と特定の行動様式のために、彼らは癌、免疫疾患、HIV、および関連する病気の治療のための大きな治療可能性を示す3,4。しかしながら、それらの大きな分子サイズ、三次元構造、表面電荷、および親水性のような物理化学的性質は、これらの高分子のin vivo送達を非常に困難にする。これは彼らの臨床的使用を著しく妨げる4 。マイクロ粒子、ポリマーナノ粒子(NP)、リポソーム、および脂質NPなどの薬物送達システムにおける最近の進歩は、これらの課題を克服し、巨大分子のin vivo送達を有意に改善した。ホこれらの送達貨物に関するいくつかの欠点が明らかにされており、薬物負荷能力が低く、捕捉効率が低く、半減期が短く、生物活性が低下し、望ましくない副作用があることが明らかにされている5,6,7,8。有効なキャリアシステムは依然として研究の関心領域である。さらに、薬物を含むNPを特徴付ける分析方法の開発は、小分子よりも巨大分子にとってより困難である。
高密度リポタンパク質(HDL)は、アポリポタンパク質およびリン脂質単分子膜で被覆された脂質コアからなる天然NPである。内在性HDLは、SR-BI、ABCAI、およびABCG1などの標的受容体とのその相互作用を介して、脂質、タンパク質および核酸の輸送において重要な役割を果たす。それは、異なる治療剤の送達のための媒体として探求されている9、 10,11,12 。 HDL模倣NPを調製するための様々な方法が開発されている。透析は一般的なアプローチです。この方法において、NPは、コール酸ナトリウム溶液を用いて脂質膜を水和させることによって形成される。次に、塩を3つの緩衝液で2日間透析することにより除去する( 13) 。超音波処理法は、加熱条件下で脂質混合物を60分間超音波処理することによりNPを製造する。 NPはゲルクロマトグラフィーによりさらに精製される14 。マイクロフルイディクスは、マイクロ流体デバイスを介してNPを生成し、マイクロ流体デバイスは、リン脂質およびアポリポタンパク質AI(Apo AI)溶液を、集束パターンで微小渦を生成することによって混合する。明らかに、これらの方法は、工業規模でのスケールアップには時間がかかり、厳しく、困難な場合があります。
この記事では、神経のための新規なHDL模倣NPの調製および特徴付けを紹介する成長因子(NGF)カプセル化。 NGFは、2つの13.6kDaポリペプチドモノマーを含むジスルフィド結合ポリペプチドホモダイマーである。ホモジナイゼーションによってNPを調製し、続いてNGFをNPにカプセル化する新規手順を開発した。 NGF HDL模倣NPは、粒子サイズ、サイズ分布、ゼータ電位、およびインビトロ放出に関して特徴付けられた 。それらの生物活性を、PC12細胞における神経突起伸長について評価した。マウスの静脈内注射後のNGF HDL模倣NPの体内分布を遊離NGFの体内分布と比較した。
プロトコル
注:すべての手順に含まれている動物試験は、ノーステキサス保健科学センターの施設動物実験および使用委員会の承認を受けています。
1.NGF HDL模倣ナノ粒子の調製
- 賦形剤、ホスファチジルコリン(PC)、スフィンゴミエリン(SM)、ホスファチジルセリン(PS)、オレイン酸コレステリル(CO)およびD-α-トコフェリルポリエチレングリコールサクシネート(TPGS)をエタノールに溶解して1mg / mLの原液を調製する。
注:ストック溶液を等分し、-20℃で保存した。オレイン酸コレステリルは暗いボトルに貯蔵した。 PC、SM、PS、およびCOストック溶液は、それぞれ-20℃で6,13,12および12ヶ月間安定であった。 TPGS溶液は、-20℃で少なくとも12ヶ月間安定であった。 - NGF(水中1mg / mL)10μLをプロタミンUSP(水中1mg / mL)10μLと1.5mLマイクロ遠心チューブで混合し、室温で10分間放置する複合体を形成する。
注:NGFおよびプロタミン原液を等分し、-20℃で保存した。繰返し凍結および解凍はNGFストックには推奨されません。 - ガラスバイアルに、59μLのPC、11μLのSM、4μLのPS、15μLのCO、および45μLのTPGSをガラスバイアルに加える。エタノールを穏やかな窒素気流下で約5分間混合し、蒸発させる。すべての賦形剤は、ガラスバイアルの底部に油状の薄いフィルムを形成すべきである。
- バイアルに1 mLの超純水(1型)を加え、室温で5分間9,500 rpm(8,600 xg)でホモジナイズしてプロトタイプNPを形成する。
- ステップ1.2で調製した複合体をプロトタイプNPに添加し、ガラスバイアル中の小さな撹拌棒を用いて撹拌しながら37℃で30分間インキュベートする。
- 室温でさらに30分間撹拌することによりNPを冷却する。これが冷えた後、106μLのApo AI(1.49mg / mL)を添加し、室温で一晩撹拌して最終NGF HDLを模倣したNP。
2.NGF HDL模倣ナノ粒子のキャラクタリゼーション
- 製造元の指示に従って、粒子分析器(材料表を参照)を使用して、粒子サイズおよびゼータ電位を測定する。
- 架橋アガロースゲルろ過クロマトグラフィーカラムを使用して、非負荷NGFをNGF HDL模倣NPから分離し、NGFの封入効率を決定する。
- カラム調製のために、セファロース4B-CL懸濁液15mLを50mLビーカーに移す。ガラス棒を用いてビーズ懸濁液を撹拌し、カラム(30cm長さ×直径1cm、ガラスフリットを底にして)にいくらかを注ぐ。穏やかにカラムをタップして気泡を取り除く。溶媒を排出させ、ビーズを数分間静置する。
- 残りのサスペンションを追加し続けます。カラムの内壁をすすいでビーズを洗浄します。溶媒レベルがわずかにaになるまで溶媒を排出する固定相の上部に位置する。 1×リン酸緩衝化生理食塩水(PBS、137mM NaCl、2.7mM KCl、8mM Na 2 HPO 4 、および2mM KH 2 PO 4を含有するPBS)20mLでカラムを洗浄し、調整する。
- 無負荷NGFを含む画分を決定するために、200μLのNGF溶液(10μg/ mL)をゲル濾過カラム(長さ25cm×直径1cm)に負荷し、1×PBSで溶出する。
- 合計12の画分(各画分につき1mL)を集め、NGFについてのサンドイッチELISAキットを用いて各画分中のNGFの濃度を測定する。
- サンドイッチELISAキットを使用して、画分6〜10からNGFを検出する。カラムに負荷されていないNGFのクロマトグラムを取得する。 20mLのPBSでカラムを洗浄する。
- NGF HDL模倣NPを含有する画分を決定するために、200μLのNPをカラムに負荷し、1×PBSで溶出する。合計12の画分(各画分につき1mL)を集め、各画分の粒子の強度を測定する。粒度分析器を呼び出す。画分2から4までのNGF NPを検出する。
注:強度は、粒子分析装置によって測定されるパラメータであり、試験溶液中にいくつのナノ粒子が存在し得るかを示す。溶液中に存在するNPが多いほど強度は高くなります。このアプローチによって、本発明者らは、カラムが無負荷NGFからNGF NPを分離できることを確認することができる。 - NGFの捕捉効率を測定するために、200μLのNGF HDL模倣NPをカラムに負荷し、1×PBSで溶出する。合計12の画分を集める(各画分につき1 mL)。
- サンドイッチELISAキットを使用して、画分6〜10から無負荷NGF濃度を測定する。
- 画分6〜10から測定したNGF量を無負荷NGFとして加え、次の式を用いてNGFの捕捉効率を計算する。
%EE =(1-無負荷NGF / NPに添加された総NGF)×100%式(1)
3.NGF HDLのインビトロ放出- ナノ粒子を真似る
- NGF(水中10μg/ mL; n = 4)およびNGF HDL-模倣NP(10μg/ mL; n = 4)を並行して調べる。
- 製造者の指示に従って、8つの透析チューブ(分子量カットオフ:300kDa)を前処理する。
- 放出培地としてPBS中の5%ウシ血清アルブミン(BSA)を調製する。 30 mLの放出培地を50 mLの遠心チューブに加え、振とう速度が135 rpmのシェーカーで37℃まで温めます。交換のためにシェーカーに放出培地をさらに50mL入れる。
- 400μLの放出培地を透析チューブに加え、迅速に200μLの試験サンプルを加えて、透析に十分な容量を作ります。
- チューブを閉じ、迅速に透析チューブをリリース培地(遠心チューブ)に入れます。即座に、時間0のサンプルとして、外部透析チューブから放出培地100μLを抜き取る。後で分析するためにサンプルを直ちに-20℃に置く。新鮮な100μLを加える遠心分離管に培地をリースして取り出されたサンプルを交換する。タイマーを開始します。
- 1,2,4,6,8,24,48および72時間で、100μLの放出培地を回収し、100μLの新鮮な培地と交換する。後で分析するために取り出したサンプルを直ちに-20℃に置く。
- 72時間後、すべてのサンプルを-20℃から取り出し、室温で解凍する。サンドイッチELISAキットを用いて放出サンプルのNGF濃度を測定する。
4. NGF HDL模倣ナノ粒子の生理活性(神経突起伸長試験)
- 10%熱不活性化ウマ血清、5%ウシ胎児血清、100μg/ mLストレプトマイシンおよび100単位/ mLペニシリンを補充したRPMI-1640培地中の培養PC12細胞。加湿インキュベーター内で37℃、5%CO 2で細胞を維持する。
- 細胞が約70〜80%コンフルエンスに達すると、培養培地を除去し、細胞を1×PBS(10cm 2あたり約2mL)で洗浄し、2つの培養表面積)。洗浄液を除去する。 0.25%トリプシン-EDTA溶液(0.25%トリプシンおよび1mM EDTA;培養表面積10cm 2あたり0.5mL)をフラスコに添加し、37℃でインキュベートしてほとんどの細胞が剥がれるまで細胞をトリプシン処理します。
- 2倍量の培地を添加し、5分間180xgでスピンダウンする。上清を除去し、5mLの培地で細胞ペレットを再懸濁する。細胞クラスターを破壊するために、22G、1/2インチの針を通して細胞をろ過する。
- 新しい細胞培養フラスコに1:3の比率で細胞を分割する。一晩インキュベートした後、結合していないPC12細胞を除去する。付着した細胞をさらなる成長のために残す。
- この手順を3回繰り返すことにより、強い接着性を有するPC12の継代培養を選択する。 6ウェルプレートに800μL/ウェルのラット尾コラーゲンI型(100μg/ mL)を予めコートする。
- ステップ4.2で説明したように、選択したPC12細胞をトリプシン処理し、22 G、1/2インチ針で細胞クラスターを破壊する。血球計数器で細胞を数える。細胞をプレートに付着させるために、ステップ4.5のプレコートされた6ウェルプレートに10,000細胞/ウェルの密度で細胞を一晩シードする。
- 0.5,1,5,10,50、および100 ng / mLの濃度を調製するために、培地(手順4.1に記載)で遊離NGF(10μg/ mL)およびNGF HDL模倣NP(10μg/ mL)を希釈する。各ウェルから2mLの培地を除去し、2mLの希釈した遊離NGFまたはNGF HDL模倣NPと交換する。 4日間培養する。
- 4日目に、対応する処置を含む新鮮な培地(ステップ4.1に記載)に培地を交換し、さらに3日間処置を続ける。
- 7日目に、倒立光学顕微鏡で細胞を視覚化し、各ウェルを10倍の倍率でランダムスポットで画像化する。
5.NGF HDL模倣ナノ粒子の生体内分布
- 大人のBALB / cマウス(雄、25〜30 g)を用いてNGF NPの組織分布を推定する。グループあたり3匹のマウスからなる3つのグループに無作為にマウスを分ける。マウスを拘束し、尾部をエタノールで拭いて血管拡張および静脈の可視性を促進するために、円錐形のプラスチック拘束具( 例えば、デカプリコーン)を使用する。
- 100μLの生理食塩水、遊離NGF、またはNGF HDL模倣NPをマウスの各群(3群)に尾静脈を通して40μg/ kgのNGFの用量で注射する。 1 mLシリンジに付属の30 1/2 G針を使用してください。
- 注射30分後に、3%吸入イソフルラン(2L /分の流速で酸素中)を用いてマウスを麻酔する。麻酔の深さを決定するために尾とつまみを実行します。心臓穿刺によって血液を採取する。
- 心臓から約1mLの血液を抜き取る。頸部脱臼によって各マウスを安楽死させる。
- 背臥位にマウス屠体を置きます。外科用はさみを使用して腹部を開き、脂肪と腸を別に移動する肝臓、脾臓、および腎臓を暴露するために綿棒を使用する。これらの組織を採取し、血液をきれいにするために1×PBSですすいでください。
- 直ちに3,400 xgと4℃で5分間血液サンプルを遠心分離して血漿を得る。分析まで血漿および組織を-80℃で保存する。
- 組織サンプルを分析するには、サンプルを-80℃から4℃に移動させ、10倍量の抽出緩衝液(0.05M酢酸ナトリウム、1.0M塩化ナトリウム、1%トリトンX-100、 1%BSA、0.2mMフェニルメタンスルホニルフルオライド、および0.2mM塩化ベンゼトニウム)。 10,000 rpmおよび4℃で5分間ホモジナイズする。
- 手順5.3および5.4に記載されているように、未処置の2匹のマウスを犠牲にして、空の血漿および組織を収集する。空の血漿またはブランク組織ホモジェネートを用いてNGF標準溶液を調製する。
- 上記のように、サンドイッチELISAキットを使用して、血漿および組織ホモジェネート中のNGFの濃度を決定する。
結果
イオン対戦略によって調製されたHDL模倣、α-トコフェロール被覆NGF NPの工学的スキームを図1に示す 。 NGFの表面電荷を中和するために、プロタミンUSPをイオン対剤として用いてNGFと複合体を形成させた。生物活性を保護するために、プロトタイプのHDL模倣NPを、最初にホモジナイゼーションを用いて操作した。次いで、NGF /プロタミン複合体をプロトタイプNPに封入した。均質化は十分なエネルギーを提供し、賦形剤の混合を首尾よく促進した。 3分間の均質化の後、プロトタイプのNPについて一定の粒径(約170nm)が得られた( 図2 )。 Apo AIをプロトタイプNPと異なる条件下でインキュベートした。室温で2時間撹拌した。室温で4時間撹拌し;室温で4時間撹拌し、続いて4℃で一晩インキュベートした。室温で攪拌した。夜。室温で一晩撹拌した場合、Apo AIの26%以上がNPに組み込まれた。 NGF-プロタミン複合体を添加するために、複合体をプロトタイプNPとともに37℃で30分間インキュベートし、Apo AIをこの混合物に添加してNPの表面上のApo AIの最終被覆を仕上げた。本明細書に記載の手順を使用して、最終的なNGF HDL模倣NPは、171.4±6.6nm(n = 3)の粒子サイズを有し、65.9%のNGF捕捉効率を有していた( 表1 )。 NGF HDL模倣NPはわずかに負の電荷を有していた( 表1 )。 NPは狭いサイズ分布を有し、NGFをNPに組み込むことは粒子サイズに影響しなかった( 図3 )。
NGFの捕捉効率を測定するために、無負荷NGFをNGF HLD模倣NPから分離するための様々な方法を評価した。予期しないことに、NGFは分離フィルター(分子量カットオフ:100kDa)を通過できません。ゲルフィルセファデックスG-50、セファデックスG-100、セファクリルS-100を含む分離カラムは、溶出後に両方とも同じ画分に出るので、非負荷NGFおよびNGF HDL模倣NPを分離することはできません。セファロースCL-4Bカラムは、最適化されたサンプルローディング、溶出バッファー、および溶出速度で分離を行った。 図4に示すように、負荷されていないNGFおよびNGF HDL模倣NPは、セファロースCL-4Bカラムで完全に分離された。
透析法を用いて、血液中の生理学的条件を模倣するために含まれた5%BSAを含むPBS中のNGF HDL模倣NPのin vitro放出を研究した 。透析装置(分子量カットオフ:300kDa)のサイズを大きくし、PBSおよびBSAを放出培地に加えることによって、NGFは透析膜と結合せず自由に通過した。その結果、この透析法における遊離NGFの回収率は85%を超えていた( 図5 )。 NGFHDL模倣NPは緩徐放出プロファイルを示し、NGFの約10%がNPから72時間にわたって放出された( 図5 )。
NGF HDL模倣NPの生物活性を試験するために、強力な接着特性を有するPC12細胞の継代培養を選択して神経突起伸長アッセイを実施した。 図6は、細胞を50ng / mLの遊離NGF( 図6A )およびNGF HDL模倣NP( 図6B )で処理したときの神経突起伸長のイメージングを表す。処理濃度が10ng / mLを超えると、神経突起伸長が顕微鏡により明瞭に観察された。これらの高濃度では、遊離NGFおよびNGF HDL模倣NPは、神経突起伸長の効果に有意差を示さなかった。 NGFの濃度が10ng / mLより低い場合、遊離NGFおよびNGF HDL模倣NPの両方について、神経突起伸長を明確に観察することができなかった。生体内分布遊離NGFおよびNGF HDL模倣NPのin vivo挙動を比較するために実験を行った。 図7に示すように、NGF HDL模倣NPは、血漿濃度を有意に増加させ、肝臓、腎臓、および脾臓における取り込みを減少させた。

図1: イオン対戦略によって調製されたNGF HDL模倣ナノ粒子のエンジニアリングスキーム。 NGFは負に荷電した親水性分子である。カチオン性ペプチドであるプロタミンを用いて電荷を中和し、NGFとのイオン対複合体を形成させた。オレイン酸コレステリル、リン脂質およびTPGSは、ホモジナイゼーションによって自己組織化プロトタイプNPを形成した。 NGF /プロタミン複合体はプロトタイプNPに組み込まれた。最後に、Apo AIを、一晩のインキュベーション後にNP表面上にコーティングした。この図は、Prathipati et al。 16。 この図の拡大版を見るには、ここをクリックしてください。
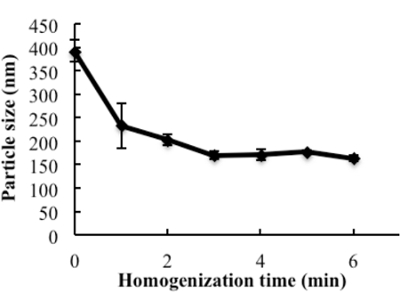
図2: プロトタイプのナノ粒子の粒子サイズに対するホモジナイゼーションの影響。エタノールに溶解した賦形剤PC、SM、PS、CO、およびTPGSをガラスバイアルに加え、溶媒をN 2気流下で蒸発させた。 1mLの水を添加し、9,500rpmで異なる時間ホモジナイズした。その後のナノ粒子の粒径を測定した。データは、平均±標準偏差(n = 4)として示される。この図は、Prathipati et al。 16 。 してくださいこの図のより大きなバージョンを表示するにはここをクリックしてください。

図3:空のHDL模倣ナノ粒子およびNGF HDL模倣ナノ粒子の粒子サイズおよびサイズ分布。粒度および分布は、粒子分析器を用いて測定した。この図は、Prathipati et al。 16 。 この図の拡大版を見るには、ここをクリックしてください。

【図4】PBSにより溶出されたセファロースCL-4Bカラム上の遊離NGFおよびNGF HDL模倣ナノ粒子のクロマトグラム。 200μLの遊離NGF溶液(10μg/ mL)およびNGF NP溶液を、彼はゲルろ過カラムと1倍のPBSで溶出した。両方のサンプルについて合計12の画分(各画分につき1mL)を集めた。各画分中のNP強度を粒子分析器で測定し、各画分中のNGF濃度をSandwich ELISAキットを用いて測定した。この図は、Prathipati et al。 16 。 この図の拡大版を見るには、ここをクリックしてください。

図5: 透析法によって測定されたNGF HDL模倣ナノ粒子の インビトロ 放出。 5%BSAを含むPBSを放出媒体として使用した。 200μLの遊離NGF溶液(10μg/ mL)またはNGF NPを、400μlを補充した透析チューブに添加したLの放出媒体を含む。透析チューブを30mLの予熱した放出媒体に入れた。研究は、37℃、135rpmで振とうしながら行った。 1,2,4,6,8,24,48および72時間で、100μLの放出培地を取り出し、100μLの新鮮な培地と交換した。各サンプルのNGF濃度は、サンドイッチELISAキットを用いて測定した。データは、平均±標準偏差(n = 4)として示される。この図は、Prathipati et al。 16 。 この図の拡大版を見るには、ここをクリックしてください。

図6: PC12細胞における神経突起伸長に対するNGF HDL模倣ナノ粒子の影響。細胞を、50ng / mLの遊離NGF( A )および d NGF HDL-模倣ナノ粒子( B )を7日間投与した。神経突起は、10倍の倍率で倒立光学顕微鏡を使用して画像化した。 この図の拡大版を見るには、ここをクリックしてください。
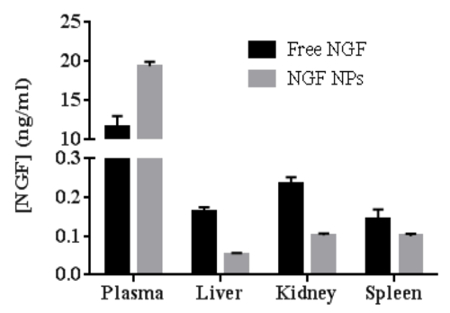
図7: マウスにおける遊離NGFとNGF HDL模倣ナノ粒子の生体内分布の比較(n = 3)。マウスに40mg / kgのNGFを尾静脈注射により投与し、投与後30分で犠牲にした。血液、肝臓、脾臓および腎臓を採取し、Sandwich ELISAキットを用いて各試料中のNGFの濃度を測定した。データは、平均±標準偏差として示される。この図は、Prathipati et al。 16 。"https://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/55584/55584fig7large.jpg" target = "_ blank">この図の拡大版を表示するには、ここをクリックしてください。
| サンプル | 粒径(nm) | PI | NGFのEE% | ゼータ電位(mV) |
| NGFのHDL模倣NP | 171.4±6.6 | 0.239±0.01 | 65.9±1.4 | -12.5±1.9 |
表1:NGF HDL模倣ナノ粒子のキャラクタリゼーション(n = 3)。データは、平均±標準偏差として示される。この表は、Prathipati et al。 16 。
ディスカッション
この研究では、NGFカプセル化のためにHDL模倣NPを調製する簡単な方法を実証する。様々なNP送達系がタンパク質を送達するために研究されている。現在、多くのNP調製物は、透析、溶媒沈殿、および膜水和を含む。これらのプロセスは一般に複雑であり、スケールアップには困難が伴う。このNP発達の間、脂質は容器のガラス壁に強い接着性を有し、薄膜を水和させ、賦形剤を効率的に混合することが困難になることが判明した。天然のHDL NP中の複数の成分を考慮すると、混合はHDL模倣NPの調製に非常に困難かつ重要なものとなった。結果によると、温度および混合時間の増加は、NP形成を助けなかった。ホモジナイザーは、工業的製造における一般的な器具であり、混合のために高いエネルギーおよびせん断力を提供する。この装置をNP調製物に適用することにより、aを有する単分散NP適切なサイズが3分以内に生成され( 図2および図3 )、製造時間が大幅に短縮され、調製手順が単純化された。
巨大分子を治療投与に適用する大きな課題は、送達だけでなく処方でもある。タンパク質は通常水溶性であり、脂質ベースのNPへのタンパク質のカプセル化を妨げる大きなサイズおよび電荷を表面に有する。ポリカチオンであるプロタミンUSPを利用して、NGFとイオン対錯体を形成した。 NGFおよびプロタミンを混合した後、不溶性複合体の形成を明白に示す白色沈殿物が明瞭に観察された。複合体の助けを借りて、NGFの約70%がNP内に閉じ込められ、狭いサイズ分布をした( 表1および図3 )。さらに、製剤開発中にタンパク質の安定性を考慮しなければならなかった。均質化の影響を避けるためにNGF安定性に関しては、ホモジナイゼーション後にNGF複合体を添加するように手順を調整した。非常に温和なインキュベーション条件下(37℃で30分)に、NGF複合体をNPに組み込んだ。 Apo AIを添加するために異なる手順を試験した。しかし、NPの表面に十分なApo AIを負荷するためには、室温での一晩のインキュベーションが依然として必要であった。神経突起伸長アッセイの結果に基づいて、NP調製後のNGFの生物活性は、ここに提示された手順で首尾よく維持された( 図6 )。さらに、HDL模倣NPにNGFを封入することは、生体分布研究( 図7 )によって示されるように、NGFの血液循環を強化した。これらの結果は、NGFがNP送達系を用いてうまく製剤化されたことを示している。 HDL模倣NPはNGFを助けることができ、長い半減期およびインビボ安定性を可能にする。
適切な分析方法を開発することもチャンスですタンパク質ベースのナノメディシンのために使用されている。封入効率およびインビトロ放出を測定するために、無負荷薬物を薬物負荷ナノ粒子から分離することが必須である。特定の分子量カットオフを有する膜は、この目的のために一般的に使用され、小分子に対して良好に機能する。しかし、主にタンパク質のサイズおよび結合特性が類似しているため、未負荷のタンパク質とタンパク質が充填されたナノ粒子を分離することは容易ではありません。遊離NGFおよびNGF HDLが充填されたNPは、膜の分子量カットオフが100kDa(商業的な濾過装置の最大孔径)であるにもかかわらず、膜ベースの濾過装置を用いて分離することができない。いくつかのゲル濾過カラムを試験した後、遊離NGFおよびNGF HDL模倣NPを最終的にセファロースCL-4Bカラムを用いて分離した。しかし、再現性のあるクロマトグラムを得るためには、カラムへの試料の充填量を200μLに保つ必要がありました。溶出剤もまた重要であった。水を使用したときNGFを溶出するために、非常に広いクロマトグラムが得られた。 NGFは画分5〜20から検出された。広いクロマトグラムは、NGFとビーズとの強い相互作用によって引き起こされた可能性がある。 5mMのNaClおよび50mMのNaClなどのいくつかの溶出剤を試験した後、PBSを十分な溶出剤として確認した。さらに、分離課題は、 インビトロ研究のために残った。カラム分離は、測定されるべき放出された試料の数およびそれらがカラムを通過する際のNPからのNGFのさらなる放出の可能性のため、in vitro放出試験には適していない。種々の条件を試験した後、プロトコールに記載の透析法を決定した。結果( 図5 )によれば、遊離NGFは、5%BSAを含有するPBS中で貫通膜(分子量カットオフ:300kDa)を自由に通過することができる。この陽性対照により、NGF HDL模倣NPの放出結果が信頼できるようになった。増加した細孔サイズおよび減少PBSおよびBSAによって引き起こされた膜結合は、透析膜を介するNGFの自由な浸透に寄与した。
前述の問題に加えて、神経突起伸長アッセイに関する別の課題が生じた。 PC12細胞のサブクローンに基づく市販の神経突起伸長アッセイキットがある。しかし、PC12細胞のサブクローンはもはや市販されていない。正常なPC12細胞は、神経突起を非常によく増殖させることができない浮遊細胞であり、実験手順中に失われやすい細胞である。いくつかの失敗の後、強力な接着特性を有する少数のPC12細胞が発見された。したがって、この細胞集団は、プロトコルに記載されているように、いくつかの継代によって選択された。その結果、アッセイは成功裏に実施され、遊離NGFを有するNGF HDL模倣NPの同等の生物活性を実証した( 図6 )。
ここで報告された方法は、HDL模倣NPの調製。私たちはApo AIの26%以上をNPに取り込みました。これは文献で報告されたものより3倍以上高かった16 。 NGFの65%以上がNPに閉じ込められ、文献16よりも2倍高かった。これらのApo AIおよびNGFの両方の捕捉効率の増加により、NPを精製する必要はない可能性がある。その結果、NP調製物は単純化された。 NP調製物中のアンロードされたApo AIおよびNGFは、NGF インビトロ放出( 図6 )およびインビボ生体内分布( 図7 )に影響しなかったが、安定性およびインビトロ細胞研究に影響し得る。ここでの研究は、NP組成および調製手順を変更することによって、Apo AIおよびNGFの取り込み効率をさらに改善することが可能であることを実証する。さらに、新規のHDL模倣NPおよびこれらの研究における戦略を使用して、他のgr(プロタミン)は、特定の増殖因子に適合するように変更することができた。タンパク質製剤の長期保存は困難である。タンパク質を充填したNPを保持する好ましい方法は、それらを乾燥粉末に凍結乾燥することである。しかし、凍結乾燥は、凍結乾燥したNPの再構成後に、粒子サイズを増大させ、タンパク質の取り込み効率を低下させる可能性がある。いくつかの出版物がHDL模倣NPの凍結乾燥について議論している。我々は、新規のHDL模倣NPの凍結乾燥を研究している。最終的に、HDL模倣NPは、長期間(少なくとも6ヶ月)適切に保存することができれば臨床的に適用可能となる可能性がある。
開示事項
著者は何も開示することはない。
謝辞
この研究は、Dong、X.に対するNIH R03 NS087322-01によって支持された。
資料
| Name | Company | Catalog Number | Comments |
| Recombinant Human Beta-NGF | Creative Biomart | NGF-05H | |
| L-a-Phosphatidylcholine (PC) | Avanti | 131601P | 95%, Egg, Chicken |
| Sphingomyelin (SM) | Avanti | 860062P | Brain, Porcine |
| Phosphatidylserine (PS) | Avanti | 840032P | Brain, Porcine |
| Cholesteryl oleate (CO) | Sigma | C9253 | |
| D-α-Tocopheryl polyethylene glycol succinate (TPGS) | BASF | 9002-96-4 | Vitamin E Polyethylene Glycol Succinate |
| Protamine sulfate | Sigma | P3369 | meets USP testing specifications |
| Apolipoprotein A1, Human plasma | Athens Research & Technology | 16-16-120101 | 1mg in 671 µl 10 mM NH4HCO3, pH 7.4 |
| Sepharose 4B-CL | Sigma | CL4B200 | Cross-linked agarose, gel filtration chromatography column filling material |
| Sandwich ELISA Kit for NGF | R&D system | DY008 | |
| Bovine Serum Albumin | Sigma | A2153 | |
| RPMI-1640 medium | GE Healthcare Life Science | SH30096.02 | |
| Horse serum | GE Healthcare Life Science | SH30074.03 | |
| Fetal bovine serum | Gibco | 10082147 | |
| PC12 cells | ATCC | CRL-1721 | |
| Rat tail collagen type I | Sigma | C3867 | |
| Sodium acetate | Sigma | S2889 | |
| Sodium chloride | Sigma | 31414 | |
| Triton X-100 | Sigma | T8787 | |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzethonium chloride | Sigma | B8879 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer | Tekmar | T 25-S1 | |
| Delsa Nano HC particle analyzer | Beckman-Coulter | Delsa Nano HC | |
| Float-A-Lyzer G2 Dialysis Device | Spectrum Laboratories | G235036 | Molecule Cutoff 300 kDa |
| Centrifuge | Eppendoff | 5424R | |
| Polytron homogenizer | Kinematica | PT 1200C | |
| DecapiCone | Braintree Scientific Inc. | DC-M200 |
参考文献
- Bruno, B. J., Miller, G. D., Lim, C. S. Basics and recent advances in peptide and protein drug delivery. Ther Deliv. 4 (11), 1443-1467 (2013).
- Mo, Z. C., Ren, K., Liu, X., Tang, Z. L., Yi, G. H. A high-density lipoprotein-mediated drug delivery system. Adv Drug Deliv Rev. 106 (Pt A), 132-147 (2016).
- Lacko, A. G., Sabnis, N. A., Nagarajan, B., McConathy, W. J. HDL as a drug and nucleic acid delivery vehicle. Front Pharmacol. 6, 247-252 (2015).
- Vaishya, R., Khurana, V., Patel, S., Mitra, A. K. Long-term delivery of protein therapeutics. Expert Opin Drug Deliv. 12 (3), 415-440 (2015).
- Lasic, D. D., Papahadjopoulos, D. . Medical application of liposomes. , (1998).
- Samad, A., Sultana, Y., Aqil, M. Liposomal drug delivery systems: an update review. Curr Drug Deliv. 4 (4), 297-305 (2007).
- Bezemer, J. M., Radersma, R., Grijpma, D. W., Dijkstra, P. J., van Blitterswijk, C. A., Feijen, J. Microspheres for protein delivery prepared from amphiphilic multiblock copolymers: 2. Modulation of release rate. J Control Release. 67 (2-3), 249-260 (2000).
- Patel, A., Patel, M., Yang, X., Mitra, A. K. Recent advances in protein and peptide drug delivery: a special emphasis on polymeric nanoparticles. Protein Pept lett. 21 (11), 1102-1120 (2014).
- Kuai, R., Li, D., Chen, Y. E., Moon, J. J., Schwendeman, A. High-density lipoproteins: nature's multifunctional nanoparticles. ACS Nano. 10 (3), 3015-3041 (2016).
- Gursky, O. Structural stability and functional remodeling of high-density lipoproteins. FEBS Lett. 589 (19 Pt A), 2627-2639 (2015).
- McMahon, K. M., Thaxton, C. S. High-density lipoproteins for the systemic delivery of short interfering RNA. Expert Opin Drug Deliv. 11 (2), 231-247 (2014).
- McMahon, K. M., Foit, L., Angeloni, N. L., Giles, F. J., Gordon, L. I., Thaxton, C. S. Synthetic high-density lipoprotein-like nanoparticles as cancer therapy. Cancer Treat Res. 166, 129-150 (2015).
- Lerch, P. G., Förtsch, V., Hodler, G., Bolli, R. Production and characterization of a reconstituted high density lipoprotein for therapeutic applications. Vox Sang. 71 (3), 155-164 (1996).
- Zhang, Z., Chen, J., Ding, L., Jin, H., Lovell, J. F., Corbin, I. R., Cao, W., Lo, P. C., Yang, M., Tsao, M. S., Luo, Q., Zheng, G. HDL-mimicking peptide-lipid nanoparticles with improved tumor targeting. Small. 6 (3), 430-437 (2010).
- Kim, Y., Fay, F., Cormode, D. P., Sanchez-Gaytan, B. L., Tang, J., Hennessy, E. J., Ma, M., Moore, K., Farokhzad, O. C., Fisher, E. A., Mulder, W. J., Langer, R., Fayad, Z. A. Single step reconstitution of multifunctional high-density lipoprotein-derived nanomaterials using microfluidics. ACS Nano. 7 (11), 9975-9983 (2013).
- Prathipati, P., Zhu, J., Dong, X. D. Development of novel HDL-mimicking α-tocopherol-coated nanoparticles to encapsulate nerve growth factor and evaluation of biodistribution. Eur J Pharm and Biopharm. 108, 126-135 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved