Method Article
הכנה ואפיון של נוזל HDL מחקה ננו-חלקיקים עבור אנקפסולציה גורם העצב הגדילה
In This Article
Summary
Homogenization פשוט שימש להכנת רומן, צפיפות גבוהה, lipoprotein- חיקוי חלקיקים כדי לתמצת את גורם הגדילה העצבים. אתגרים, פרוטוקולים מפורטים להכנת nanoparticle, אפיון במבחנה , וכן ב vivo מחקרים מתוארים במאמר זה.
Abstract
מטרתו של מאמר זה היא להציג שיטות הכנה ואפיון עבור ננו-חלקיקים (NP) של גורם הגדילה העצבי (NGF) - נטען, בצפיפות גבוהה, ליפופרוטאין (HDL). HDLs הם NPs אנדוגני ו כבר נבדקו כמו כלי רכב עבור משלוח של סוכני טיפול. שיטות שונות פותחו כדי להכין HDL מחקה NPs. עם זאת, הם בדרך כלל מסובך, זמן רב, וקשה עבור התעשייה בקנה מידה. במחקר זה, צעד אחד homogenization שימש לערבב את excipients וליצור את NPs אב טיפוס. NGF הוא חלבון מסיס במים של 26 kDa. כדי להקל על אנקפסולציה של NGF לתוך הסביבה שומנים של HDL חיקוי NPs, protamine USP שימש ליצירת מורכבות זוג יון עם NGF לנטרל את החיובים על פני NGF. המתחם NGF / protamine הוכנס אז לתוך NPs אב טיפוס. Apolipoprotein AI היה סוף סוף מצופה על פני השטח של NPs. NGF HDL - חיקוי NPs הראה תכונות מועדפות בטווחS של גודל החלקיקים, הפצה גודל, יעילות מלכודת, שחרור במבחנה , bioactivity, ביודיסטריבוציזציה. עם תכנון זהיר של חקר homogenization ב HDL חיקוי NPs, ההליך היה פשוט מאוד, ואת NPs נעשו מדרגי. יתר על כן, אתגרים שונים, כגון הפרדת NGF פריקה מן NPs, ביצוע מחקרים אמינים במבחנה שחרור, ומדידת הפעילות הביולוגית של NPs, היו להתגבר.
Introduction
מקרומולקולות, כגון חלבונים, פפטידים וחומצות גרעין, החלו להופיע כתרופות מבטיחות וזכו לתשומת לב רבה בעשורים האחרונים 1 , 2 . בשל היעילות הגבוהה שלהם ואת מצבי פעולה ספציפיים, הם מפגינים פוטנציאל טיפולי נהדר לטיפולים של סרטן, מחלות החיסון, HIV, ותנאים קשורים 3 , 4 . עם זאת, תכונות פיזיוכימיות, כגון גודל המולקולרי הגדול שלהם, מבנה תלת מימדי, חיובים משטח, וטבע הידרופילי, להפוך את vivo המסירה של מקרומולקולות אלה מאתגר מאוד. זה פוגע במידה ניכרת בשימוש הקליני שלהם. ההתקדמות האחרונה במערכות מסירת תרופות, כגון מיקרו-חלקיקים, חלקיקים פולימריים (NP), ליפוזומים ושפכי שומנים בדם, התגברה על אתגרים אלו ושיפרה משמעותית את המשלוח ב- vivo של מקרומולקולות. הואנו חושפים כמה חסרונות לגבי המטענים הללו, כולל יכולת טעינה נמוכה של סמים, יעילות מלכודת נמוכה, מחצית חיים קצרה, אובדן ביו-אקטיביות ותופעות לוואי לא רצויות 5 , 6 , 7 , 8 . מערכות הספק אפקטיביות נותרו תחום עניין מחקרי. יתר על כן, הפיתוח של שיטות אנליטיות לאפיין NPs נטען סמים הוא מאתגר יותר עבור מקרומולקולות מאשר מולקולות קטנות.
ליפופרוטאין בצפיפות גבוהה (HDL) הוא NP טבעי המורכב מליבת שומנים המצופה על ידי אפוליפופרוטאינים ו monolayer phospholipid. HDD אנדוגני ממלא תפקיד קריטי בהעברת ליפידים, חלבונים וחומצות גרעין באמצעות האינטראקציה עם קולטני היעד, כגון SR-BI, ABCAI ו- ABCG1. הוא נבדק ככלי להעברת סוכני טיפול שונים 9, 10 , 11 , 12 . שיטות שונות פותחו כדי להכין HDL מחקה NPs. דיאליזה היא גישה פופולרית. בשיטה זו, NPs נוצרים על ידי לחות סרט השומנים באמצעות פתרון cholate נתרן. מלח מוסר מכן באמצעות דיאליזה של יומיים עם שלושה מאגרים 13 . שיטות Sonication לפברק NPs ידי sonicating תערובת השומנים עבור 60 דקות תחת תנאי חימום; NPs הם מטוהרים נוספת באמצעות כרומטוגרפיה ג'ל 14 . Microfluidics מייצר NPs באמצעות מכשיר microfluidic, אשר מתערבב phospholipids ו apolipoprotein AI (Apo AI) פתרונות על ידי יצירת microvortices בדפוס מיקוד 15 . ברור, שיטות אלה יכול להיות זמן רב, קשה, וקשה עבור התעשייה בקנה מידה למעלה.
במאמר זה, אנו מציגים את הכנה ואפיון של NPs חדש HDL חיקוי עבור עצבאנקפסולציה של גורם גדילה (NGF). NGF הוא homiodimer polycptide דיסולפיד מקושר המכיל שני מונומרים פוליפפטיד 13.6-kDa. נוהל חדש להכנת NPs על ידי homogenization, ואחריו אנקפסולציה של NGF לתוך NPs, פותחה. NGP HDL - חיקוי NPs אופיינו עבור גודל החלקיקים, התפלגות גודל, פוטנציאל zeta, ו במבחנה לשחרר. ביואקטיביות שלהם הוערך עבור תולדה neurite בתאי PC12. הפצה ביולוגית של NGP-nff HDL מחקה הושווה לזו של NGF חופשי לאחר הזרקה תוך וריידית בעכברים.
Protocol
הערה: מחקרים בבעלי חיים שנכללו בכל ההליכים אושרו על ידי טיפול בבעלי חיים מוסדיים ושימוש הוועדה באוניברסיטת צפון טקסס בריאות המרכז למדע.
1. הכנת חלקיקי NGF HDL מחקה
- ממיסים את ה- excipients, phosphatidylcholine (PC), sphingomyelin (SM), phosphatidylserine (PS), cholesteryl oleate (CO), ו- D-α-tocopheryl פוליאתילן גליקול succinate (TPGS), באתנול להכין פתרונות מלאי ב 1 מ"ג / מ"ל.
הערה: פתרונות המניות היו aliquoted ומאוחסנים ב -20 מעלות צלזיוס. האוליאט הצ'ולסטרי היה מאוחסן בבקבוקים כהים. ה- PC, SM, PS, ו- CO פתרונות מלאי היו יציבים עד 6, 3, 12, ו 12 חודשים, בהתאמה, ב -20 מעלות צלזיוס. הפתרון TPGS היה יציב לפחות 12 חודשים ב -20 מעלות צלזיוס. - מערבבים 10 μL של NGF (1 מ"ג / מ"ל במים) עם 10 μL של פרוטמין USP (1 מ"ג / מ"ל במים) בצינור microcentrifuge 1.5 מ"ל ולתת לו לעמוד במשך 10 דקות בטמפרטורת החדר כדיטופס מורכב.
הערה: NGF ופתרונות מניות פרוטמין היו aliquoted ומאוחסנים ב -20 מעלות צלזיוס. הקפאה חוזרת והפשרה לא מומלצות במלאי NGF. - הוסף 59 μL של המחשב, μL 11 של SM, 4 μL של PS, 15 μL של CO, ו 45 μL של TPGS בקבוקון זכוכית. מערבבים להתאדות אתנול תחת זרם חנקן עדין במשך כ 5 דקות; כל excipients צריך טופס שמנוני, סרט דק בתחתית בקבוקון זכוכית.
- מוסיפים 1 מ"ל של ultrapure (סוג 1) מים בקבוקון homogenize ב 9,500 סל"ד (8,600 xg) במשך 5 דקות בטמפרטורת החדר כדי ליצור את NPs אב טיפוס.
- מוסיפים את המורכב מוכן בשלב 1.2 כדי NPs אב טיפוס ו דגירה על 37 מעלות צלזיוס למשך 30 דקות עם ערבוב באמצעות סרגל ערבוב קטן בקבוקון זכוכית.
- מגניב את NPs למטה על ידי ערבוב בטמפרטורת החדר למשך 30 דקות נוספות. לאחר זה מתקרר, להוסיף 106 μL של Apo AI (1.49 מ"ג / מ"ל) ומערבבים בטמפרטורת החדר בן לילה כדי ליצור הסופיNGF HDL מחקה NPs.
2. אפיון של חלקיקי NGF HDL מחקה
- למדוד את גודל החלקיקים ואת הפוטנציאל zeta באמצעות Analyzer החלקיקים (ראה את לוח החומרים) בהתאם להוראות היצרן.
- השתמש בטור צולב agarose ג'ל chromatography סינון כדי להפריד בין NGF פריקה מן nps HDF מחקה NPs ולקבוע את יעילות מלכודת של NGF.
- להכנת הכנה, להעביר 15 מ"ל של השערת ספרוס 4B-CL על כוס 50 מ"ל. מערבבים את החרוז ההשעיה באמצעות מוט זכוכית לשפוך קצת לתוך עמודה (30 ס"מ אורך × 1 ס"מ קוטר, עם frit זכוכית בתחתית). בעדינות הקש על הטור כדי להיפטר בועות. אפשר ממס לניקוז החרוזים להתיישב במשך כמה דקות.
- המשך להוסיף את ההשעיה הנותרת. שוטפים את הקיר הפנימי של העמוד כדי לנקות את החרוזים. מסננים את הממס עד רמת הממס מעטBove בראש השלב נייח. שטפו את העמודה עם 20 מ"ל של 1x פוספט שנאגרו מלוחים (PBS, המכיל 137 מ"מ NaCl, 2.7 מ"מ KCl, 8 מ"מ Na 2 HPO 4 , ו 2 mM KH 2 PO 4 ).
- כדי לקבוע את שברים המכילים NGF פריקה, לטעון 200 μL של פתרון NGF (10 מיקרוגרם / מ"ל) על עמודה סינון ג'ל (25 ס"מ אורך x 1 ס"מ קוטר) ו elute עם 1x PBS.
- לאסוף סך של 12 שברים (1 מ"ל עבור כל חלק) ולמדוד את הריכוז של NGF בכל חלק באמצעות ערכת כריך ELISA עבור NGF.
- זיהוי NGF מ שברים 6-10 באמצעות ערכת סנדוויץ ELISA. קבל chromatogram של NGF פריקה על העמודה. שטפו את הטור עם 20 מ"ל של PBS.
- כדי לקבוע את שברים המכילים NGF HDL מחקה NPs, לטעון 200 μL של NPs על עמודה elute עם 1x PBS. לאסוף סך של 12 שברים (1 מ"ל עבור כל חלק) ולמדוד את עוצמתם של חלקיקים בכל שבר Uלשיר את מנתח גודל החלקיקים. זיהוי NPs NGF מ שברים 2 עד 4.
הערה: האינטנסיביות היא פרמטר נמדד על ידי מנתח החלקיקים, אשר מספר כיצד חלקיקים רבים עשויים להתקיים פתרון הבדיקה. ככל שיותר NPs קיימים בפתרון, כך העוצמה גבוהה יותר. לפי גישה זו, אנו יכולים לאשר כי הטור יכול להפריד NPs NPs מ NGF פריקה. - כדי למדוד את יעילות מלכודת של NGF, לטעון 200 μL של NGF HDL- מחקה NPs על עמודה elute עם 1x PBS. לאסוף סך של 12 שברים (1 מ"ל עבור כל חלק).
- למדוד את ריכוז NGF פריקת מ שברים 6 עד 10 באמצעות ערכת סנדוויץ ELISA.
- מוסיפים את כמויות NGF הנמדד מ שברים 6-10 יחד כמו NGF פריקה ולחשב את יעילות מלכודת של NGF באמצעות המשוואה הבאה.
% EE = (1 - פריקה NGF / NGF הכולל נוספה לתוך NP) x 100% משוואה (1)
3. במהדורה חוץ גופית של NGF HDLמחקה ננו-חלקיקים
- מחקר חינם NGF (10 מיקרוגרם / מ"ל במים, n = 4) ו NGF HDL מחקה NPs (10 מיקרוגרם / מ"ל, n = 4) במקביל.
- טרום לטפל 8 צינורות דיאליזה (חתך משקל מולקולרי: 300 kDa) על ידי ביצוע הוראות היצרן.
- הכן 5% אלבומין בסרום שור (BSA) ב PBS כמו המדיום שחרור. הוסף 30 מ"ל של המדיום שחרור צינור 50-מ"ל צנטריפוגות לחמם אותו עד 37 מעלות צלזיוס שייקר עם מהירות סל"ד 135 רועד. מקום אחר 50 מ"ל של המדיום שחרור שייקר להחלפה.
- הוסף 400 μL של המדיום שחרור לתוך צינור דיאליזה במהירות להוסיף 200 μL של המדגם נבדק לעשות מספיק נפח עבור דיאליזה.
- סגור את הצינור במהירות לשים את צינור דיאליזה לתוך המדיום שחרור (צינור צנטריפוגה). מהר לסגת 100 μL של המדיום שחרור מן צינור דיאליזה בחוץ כמו המדגם עבור הזמן 0. מיד לשים את המדגם לתוך -20 מעלות צלזיוס לניתוח מאוחר יותר. הוסף 100 μL של טרי מחדשבינוני השכירות לתוך צינור צנטריפוגה להחליף את המדגם נסוגה. הפעל את הטיימר.
- ב 1, 2, 4, 6, 8, 24, 48, ו 72 שעות, למשוך 100 μL של המדיום שחרור ולהחליף אותו עם 100 μL של המדיום הטרי. מיד לשים את דגימות נסוג לתוך -20 מעלות צלזיוס לניתוח מאוחר יותר.
- לאחר 72 שעות, להוציא את כל הדגימות מ -20 ° C ולהפשיר אותם בטמפרטורת החדר. למדוד את ריכוזים NGF של דגימות שחרור באמצעות ערכת סנדוויץ ELISA.
4. Bioactivity של NGF HDL מחקה חלקיקים (מחקר Neurite Outgrowth)
- התרבות תאים PC12 ב RPMI-1640 בינוני בתוספת 10% החום- inactivated בסרום בסרום, 5% בסרום שור עוברית, 100 מיקרוגרם / מ"ל סטרפטומיצין, ו 100 יחידות / פניצילין מ"ל. לשמור על תאים חממה humidified ב 37 מעלות צלזיוס עם 5% CO 2 .
- כאשר התאים מגיעים ~ 70-80% מפגש, להסיר את המדיום תרבות לשטוף את התאים עם 1x PBS (כ 2 מ"ל לכל 10 ס"מ 2 משטח משטח התרבות). הסר את הפתרון לשטוף. Trypsinize התאים על ידי הוספת 0.25% פתרון טריפסין-EDTA (0.25% טריפסין ו 1 מ"מ EDTA, 0.5 מ"ל לכל 10 ס"מ 2 שטח פני השטח תרבות) כדי הבקבוק ו דגירה על 37 מעלות צלזיוס עד רוב התאים מנותקים.
- הוסף שני כרכים של המדיום תרבות ספין למטה ב XG 180 במשך 5 דקות. הסר את supernatant ו resuspend תא גלולה ב 5 מ"ל של המדיום תרבות. סנן את התאים באמצעות מחט G 22, ½ אינץ 'לשבור אשכולות התא.
- פיצול התאים ביחס של 1: 3 לתוך בקבוק חדש תרבות התא. לאחר הדגירה בן לילה, להסיר תאים PC12 ללא חיבור. אפשר לתאים המצורפים להישאר לצמיחה נוספת.
- חזור על הליך זה עבור 3 מעברים כדי לבחור את תת התרבות של PC12 כי יש תכונה הדבקה חזקה. מראש מעיל צלחת 6-היטב עם 800 μL / גם של זנב חולדה זנב קולגן סוג אני (100 מיקרוגרם / מ"ל).
- Trypsinize PC12 תאים שנבחרו כמתואר בשלב 4.2 ולסנן אותם דרך22 G, חצי אינץ מחט לשבור את אשכולות התא. לספור את התאים עם hemocytometer. זרע את התאים לילה בצפיפות של 10,000 תאים / גם צלחת מראש מצופה היטב 6 בשלב 4.5 כדי לאפשר לתאים לצרף את הצלחת.
- לדלל חינם NGF (10 מיקרוגרם / מ"ל) ו NGF HDL לחקות NPs (10 מיקרוגרם / מ"ל) עם המדיום התרבות (המתואר בשלב 4.1) להכין 0.5, 1, 5, 10, 50, 100 ng / מ"ל ריכוזים. הסר 2 מ"ל של מדיום מכל היטב ולהחליף עם 2 מ"ל של NGF חינם מדולל או NGF HDL מחקה NPs. תרבות במשך 4 ימים.
- ביום 4, שנה את המדיום בינוני עד טרי (המתואר בשלב 4.1) המכיל את הטיפול המתאים ולהמשיך את הטיפול במשך 3 ימים נוספים.
- ביום 7, לדמיין את התאים עם מיקרוסקופ אור הפוכה ואת התמונה כל היטב כתמים אקראיים תחת הגדלה 10X.
5. Biodistribution של NGF HDL- מחקה חלקיקים
- השתמש מבוגר BALB / c עכברים (זכר, 25-30 גרם) כדי tEst את התפלגות רקמות NGPs NGF. באופן אקראי לחלק את העכברים לשלוש קבוצות של 3 עכברים לכל קבוצה. השתמש קונוס פלסטיק בצורת קונוס ( למשל, decapicone) כדי לרסן עכבר ולנגב את הזנב עם אתנול כדי לקדם vasodilation ואת הנראות של הווריד.
- להזריק 100 μL של מלוחים או NGF חינם, או NGF HDL לחקות NPs לכל קבוצה של עכברים (3 קבוצות) דרך הוורידים הזנב במינון של 40 מיקרוגרם / ק"ג של NGF. השתמש מחט 30½ G המצורפת מזרק 1 מ"ל.
- ב 30 דקות לאחר ההזרקה, להרדים את העכברים באמצעות isoflurane בשאיפה 3% (בחמצן בקצב הזרימה של 2 L / min). בצע זנב קמצוץ קמצוץ כדי לקבוע את עומק ההרדמה. איסוף דם על ידי לנקב לב.
- משוך כ 1 מ"ל של דם מהלב. להרדים כל עכבר על ידי נקע בצוואר הרחם.
- מניחים את פגר העכבר בשכיבה הגב. פתח את הבטן באמצעות מספריים כירורגיים להעביר שומן ומעי בצדבאמצעות צמר גפן כדי לחשוף את הכבד, הטחול והכליות. קציר אלה רקמות ולשטוף אותם 1x PBS לנקות את הדם.
- מיד צנטריפוגה דגימות דם ב 3,400 XG ו 4 מעלות צלזיוס למשך 5 דקות כדי לקבל את הפלזמה. חנות פלזמה ורקמות ב -80 מעלות צלזיוס עד הניתוחים.
- כדי לנתח את דגימות רקמה, להזיז את הדגימות מ -80 מעלות צלזיוס עד 4 מעלות צלזיוס ו להשעות 100 מ"ג של מדגם רקמה בנפח 10x של חיץ החילוץ (0.05 M אצטט אצטט, 1.0 M כלורי נתרן, 1% טריטון X-100, 1% BSA, 0.2 mM phenylmethanesulfonyl פלואוריד, ו 0.2 mM benzethonium כלורי). Homogenize ב 10,000 סל"ד ו 4 מעלות צלזיוס למשך 5 דקות.
- להקריב שני עכברים untreated לאסוף ריק פלזמה ורקמות, כמתואר צעדים 5.3 ו - 5.4. הכן פתרונות סטנדרטיים NGF באמצעות הומוגנטים ריק פלזמה ריק או homogenates ריק.
- לקבוע את ריכוזי NGF ב homogenates פלזמה ורקמות באמצעות ערכת סנדוויץ ELISA, כמתואר לעיל.
תוצאות
ערכת הנדסה של HDL מחקה, α-tocopherol מצופה NGF NPs שהוכנו על ידי אסטרטגיה יון זוג מוצג באיור 1 . כדי לנטרל את המטענים על פני השטח של NGF, פרוטמין USP שימש כסוכן יון זוג כדי ליצור מורכבת עם NGF. כדי להגן על bioactivity, אב טיפוס HDL - חיקוי NPs היו מהונדסים, תחילה באמצעות homogenization; לאחר מכן, מורכבות NGF / protamine היה encapsulated לתוך NPs אב טיפוס. Homogenization בתנאי מספיק אנרגיה בהצלחה לקדם את ערבוב של excipients. לאחר homogenization 3 דקות, גודל החלקיקים עקבי (סביב 170 ננומטר) התקבלו עבור NPs אב טיפוס ( איור 2 ). Apo AI הודגר עם NPs אב טיפוס בתנאים שונים, כולל 2 שעות של ערבוב בטמפרטורת החדר; 4 שעות של ערבוב בטמפרטורת החדר; 4 שעות של ערבוב בטמפרטורת החדר, ואחריו הדגירה לילה ב 4 מעלות צלזיוס; וממשיכים בטמפרטורת החדרלילה. מעל 26% של Apo AI שולבה NPs כאשר עורר בטמפרטורת החדר בן לילה. כדי להוסיף את מורכבות NGF-protamine, המתחם הודגר עם NPs אב טיפוס במשך 30 דקות על 37 מעלות צלזיוס ולאחר מכן Apo AI נוספה לתערובת כדי לסיים את הציפוי הסופי של Apo AI על פני השטח של NPs. באמצעות ההליך המתואר כאן, הסופי NGF HDL מחקה NPs היו גודל החלקיקים של 171.4 ± 6.6 ננומטר (n = 3), עם 65.9% יעילות NGF מלכודת ( טבלה 1 ). NGF HDL - חיקוי NPs היה מטען שלילי קל ( טבלה 1 ). NPs היה הפצה גודל צר, שילוב NGF לתוך NPs לא השפיע על גודל החלקיקים ( איור 3 ).
כדי למדוד את יעילות מלכודת של NGF, שיטות שונות הוערכו נפרדת נפרדת NGF מ NGF NF לחקות NPs. באופן בלתי צפוי, NGF לא יכול לעבור מסנן הפרדה (חתך משקל מולקולרי: 100 kDa). ג'לטורים, כולל הספדקס G-50, הספדקס G-100 ו- Sephacryl S-100, אינם יכולים להפריד בין NPF ו- NGF HDL לחיקוי NPs, שכן שניהם מופיעים באותם שברים לאחר החילוף. בעמודה CL-4B של ספרוס ביצע את ההפרדה עם טעינת המדגם המותאמת, חיץ elution, ואת קצב elution. כפי שמוצג בתרשים 4 , נפרדו לחלוטין NPs NGF ו - NGF HDL - חיקויים מופרדים לחלוטין בעמודה CL-4B של ספרוס.
שיטת דיאליזה שימשה לחקר השחרור במבחנה של NPF HDL-Mimicking NPs ב- PBS עם 5% BSA, אשר נכלל כדי לחקות את התנאים הפיזיולוגיים בדם. על ידי הגדלת גודל של מכשיר דיאליזה (חתך משקל מולקולרי: 300 kDa) ועל ידי הוספת PBS ו BSA למדיום שחרור, NGF לא נקשר עם קרום דיאליזה וחופש בחופשיות. כתוצאה מכך, ההתאוששות של NGF חינם בשיטה זו דיאליזה היה מעל 85% ( איור 5 ). NGFHDL-mimicking NPs הראה פרופיל שחרור איטי, וכ 10% של NGF שוחרר מן NPs מעל 72 שעות ( איור 5 ).
כדי לבדוק את bioactivity של NGF HDL לחקות NPs, תת התרבות של תאים PC12 שהיה בעל מאפייני הדבקה חזקה נבחרה לבצע assay תולדה neurite. איור 6 מייצג את הדמיה של תולדה neurite כאשר התאים טופלו 50 NG / מ"ל חינם NGF ( איור 6 א ) ו NGF HDL לחקות NPs ( איור 6 ב ). כאשר ריכוז הטיפול היה גבוה מ -10 ng / mL, תולדת הניורית נצפתה בבירור על ידי המיקרוסקופ. בריכוזים גבוהים אלה, NGF ו- NGF ללא חיקוי NPs לא הראו הבדל משמעותי בהשפעה של תולדה של ניוריטים. כאשר הריכוז של NGF היה נמוך מ -10 ng / mL, לא ניתן היה לראות את תולדת הניורית בבירור, הן עבור NGF והן עבור NGP של NGF HDL-Mimicking. ביו-חלוקהUdies בוצעו כדי להשוות את התנהגויות vivo של NGF חינם NGF HDL מחקה NPs. כפי שמוצג באיור 7 , NPF HDL- מחקה NPs הגדילה משמעותית את ריכוז הפלזמה והקטין את ספיגת הכבד, הכליות והטחול.

איור 1: תוכנית הנדסה של NGF HDL מחקה חלקיקים שהוכנו על ידי אסטרטגיה זוג יון. NGF הוא מולקולה הידרופילית טעונה שלילית. פפטיד קטיוני, פרוטמין, שימש לנטרול המטענים ויצר קומפלקס של יונים עם NGF. Cholesteryl oleate, phospholipids, ו TPGS יצרו עצמית הרכבה NPs אב טיפוס על ידי homogenization. המכלול NGF / פרוטאמין שולב לתוך NPs אב טיפוס. לבסוף, אפו AI היה מצופה על פני NP לאחר הדגירה לילה. נתון זה שונה מ Prathipati et al. 16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
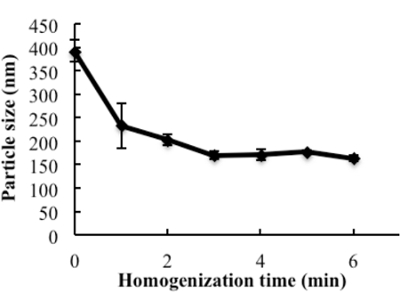
איור 2: השפעת homogenization על גודל החלקיקים של חלקיקים אב טיפוס. את excipients, PC, SM, PS, CO, ו TPGS, אשר מומס באתנול, נוספו צלוחיות זכוכית, ממס הוא התאדה תחת זרם N 2 . 1 מ"ל של מים נוספה ו homogenized ב 9,500 סל"ד עבור פעמים שונות. גודל החלקיקים של חלקיקים הבאים נמדדו. הנתונים מוצגים כסטיית תקן ± (n = 4). נתון זה שונה מ Prathipati et al. 16 . בבקשה, בבקשהCk כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 3: גודל החלקיקים ואת גודל ההפצה של חלקיקים HDL חיקוי ריק NGF ו- HDL חיקוי חלקיקים. גודל החלקיקים והפצות נמדדו באמצעות מנתח החלקיקים. נתון זה שונה מ Prathipati et al. 16 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 4: Chromatograms של NGF חינם NGF ו- HDF חיקוי חלקיקים על עמודה CL-4B ספרוס eluted ידי PBS. 200 μL של פתרון NGF חינם (10 מיקרוגרם / מ"ל) ו NGF פתרון NP נטענו על גבי Tהוא טור ג'ל סינון eluted עם 1x PBS. סך של 12 שברים (1 מ"ל עבור כל חלק) נאספו עבור שתי הדגימות. עוצמת NP בכל חלק נמדדה על ידי מנתח החלקיקים, ואת ריכוז NGF בכל חלק נמדד באמצעות ערכת סנדוויץ ELISA. נתון זה שונה מ Prathipati et al. 16 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 5: שחרור במבחנה של NGF HDL חיקוי חלקיקים נמדד בשיטת דיאליזה. PBS עם 5% BSA שימש מדיום שחרור. 200 μL של פתרון NGF חינם (10 מיקרוגרם / מ"ל) או NGP NPs נוספו צינור דיאליזה בתוספת 400 μL של המדיום שחרור. צינור דיאליזה הוכנס לתוך 30 מ"ל של מדיום מראש חימם לשחרר. המחקר בוצע על 37 מעלות צלזיוס עם 135 סל"ד רועד. ב 1, 2, 4, 6, 8, 24, 48, ו 72 שעות, 100 μL של המדיום שחרור הוסר והוחלף עם 100 μL של המדיום הטרי. ריכוז NGF במדגם זה נמדד באמצעות ערכת סנדוויץ ELISA. הנתונים מוצגים כסטיית תקן ± (n = 4). נתון זה שונה מ Prathipati et al. 16 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 6: השפעת NGF HDL חיקוי חלקיקים על תולדה neurite בתאים PC12. תאים טופלו 50 NG / מ"ל חינם NGF ( א ) D ngf hl לחקות חלקיקים ( ב ) במשך 7 ימים. Neurite היה צילמו באמצעות מיקרוסקופ אור הפוך תחת הגדלה 10X. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
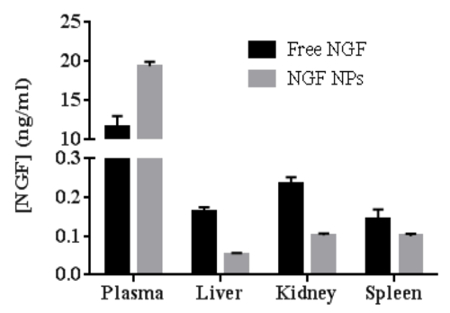
איור 7: השוואה בין ביו-חלוקה בין חלקיקי NGF ו- NGF HDL-free nimoparticles בעכברים (n = 3). העכברים ניתנו עם 40 מ"ג / ק"ג של NGF על ידי הזרקת הווריד הזנב ו הוקרבו ב 30 דקות לאחר הממשל. הדם, הכבד, הטחול והכליות נאספו, והריכוז של NGF בכל מדגם נמדד באמצעות ערכת סנדוויץ 'ELISA. הנתונים מוצגים כסטיית תקן ± ממוצע. נתון זה שונה מ Prathipati et al. 16 ."Http://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/55584/55584fig7large.jpg" target = "_ blank"> לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| לִטעוֹם | גודל החלקיקים (ננומטר) | פאי | EE% של NGF | פוטנציאל Zeta (mV) |
| NGF HDL מחקה NPs | 171.4 ± 6.6 | 0.239 ± 0.01 | 65.9 ± 1.4 | 12.5 ± 1.9 |
טבלה 1: אפיון של חלקיקי NGF HDL מחקים (n = 3). הנתונים מוצגים כסטיית תקן ± ממוצע. טבלה זו שונתה מ- Prathipati et al. 16 .
Discussion
במחקר זה, אנו מדגימים שיטה פשוטה להכין NPs HDL מחקה עבור אנקפסולציה NGF. מערכות שונות של משלוח NP נחקרו על מנת לספק חלבונים. נכון לעכשיו, ההכנות NP רבים כוללים דיאליזה, משקעים ממס, ואת הסרט הידרציה. תהליכים אלה הם בדרך כלל מסובך ומאתגר בקנה מידה. במהלך פיתוח NP זה, נקבע כי השומנים היו הדבקה חזקה על הקיר זכוכית של המכולה, אשר הובילה את הקשיים לחות את הסרט הדק ומערבבים ביעילות את excipients. בהתחשב במספר רכיבים טבעי HDL NPs, ערבוב הפך מאוד מאתגר חיוני להכנת NPs HDL מחקה. על פי התוצאות, הגדלת הטמפרטורה זמן ערבוב לא סייע היווצרות NP. Homogenizer הוא מכשיר נפוץ בייצור התעשייתי ומספק אנרגיה גבוהה כוח גזירה עבור ערבוב. על ידי יישום מכשיר זה כדי NP הכנה, monodispersed NPs עםגדלים pproprioc הופקו תוך 3 דקות ( איור 2 ו איור 3 ), אשר הקטינה באופן משמעותי את זמן הייצור ופשוט הליך הכנה.
האתגר הגדול להחיל מקרומולקולות על הממשל הטיפולי הוא לא רק מסירה, אלא גם ניסוח. חלבונים הם בדרך כלל מסיסים במים ויש להם גדלים גדולים וחיובים על המשטחים שלהם, אשר מונעים את אנקפסולציה של חלבונים לתוך NPS מבוססי שומנים. Protamine USP, פוליקציה, נוצל כדי ליצור קומפלקס זוג יון עם NGF. לאחר ערבוב NGF ו protamine, המשקע הלבן, אשר הצביע על היווצרות של המסיסה מסיס היה נצפה בבירור. בעזרת המתחם, כ -70% של NGF היה לכוד בתוך NPs, עם התפלגות גודל צר ( טבלה 1 איור 3 ). יתר על כן, יציבות של חלבונים היה צריך להיחשב במהלך פיתוח ניסוח. כדי למנוע את ההשפעה של homogenizationעל יציבות NGF, הנוהל הותאם כדי להוסיף קומפלקס NGF לאחר homogenization. תחת מצב הדגירה קלה מאוד (30 דקות על 37 מעלות צלזיוס), מורכבות NGF שולב NPs. הליכים שונים נבדקו כדי להוסיף Apo AI; עם זאת, הדגירה לילה בטמפרטורת החדר היה עדיין צורך לטעון מספיק Apo AI על פני השטח של NPs. בהתבסס על התוצאות של assay תולדת neurite, bioactivity של NGF לאחר הכנה NP נשמר בהצלחה עם הנוהל המוצג כאן ( איור 6 ). יתר על כן, אנקפסולציה NGF לתוך NPs HDL מחקה משופרת את זרימת הדם של NGF, כפי שצוין על ידי מחקרים biiodistribution ( איור 7 ). תוצאות אלו מראות כי NGF התגבש בהצלחה עם מערכת אספקה של NP. ה- NPs המחקים את ה- HDL יכולים לסייע ל- NGF, ומאפשרים מחצית חיים ארוכה ויציבות ב- vivo .
פיתוח שיטות אנליטיות מתאימות הוא גם צ'הLlenging מבוסס nanomedicines חלבון. כדי למדוד את יעילות מלכודת ובמהדורה חוץ גופית , זה חובה להפריש סמים נפרקים מן חלקיקים נטען סמים. ממברנות עם חתכים משקל מולקולרי מסוים משמשים בדרך כלל למטרה זו ועובדים היטב עבור מולקולות קטנות. עם זאת, לא קל להפריד חלבונים פורקים חלבונים נטען חלבונים, בעיקר בגלל גדלים דומים ומאפיינים מחייב של חלבונים. NGF ו NGF HDL נטען HDP לא ניתן להפריד באמצעות מכשיר סינון מבוסס קרום, אם כי משקל המולקולה לחתוך את הממברנה הוא 100 kDa (גודל הנקבוביות הגדול ביותר עבור מכשירי סינון מסחריים). לאחר מספר עמודות סינון ג'ל נבדקו, NGF חינם NGF ו - HDL מחקה NPs הופרדו לבסוף באמצעות טור CL-4B Sepharose. עם זאת, טוען המדגם אל העמודה היה צריך להישמר ב 200 μL כדי להשיג chromatograms לשחזור. גם סוכני ההזהרה היו בעלי חשיבות. כאשר המים היו בשימושכדי elute NGF, chromatogram רחב מאוד הושג; NGF זוהה שברים 5 עד 20. Chromatogram רחב יכול היה להיגרם על ידי אינטראקציה חזקה בין NGF לבין חרוזים. לאחר כמה סוכני elution, כגון 5 מ"מ NaCl ו 50 מ"מ NaCl, נבדקו, PBS אושרה כסוכן elution מספיק. יתר על כן, האתגר ההפרדה נשאר ללימודי חוץ גופית . הפרדת עמודה אינה מתאימה ללימודי שחרור במבחנה בגלל מספר הדגימות שפורסמו ונמדדת והפוטנציאל לשחרור נוסף של NGF מה- NPs כאשר הם עוברים את העמודה. לאחר בדיקת תנאים שונים, נקבעה שיטת הדיאליזה המתוארת בפרוטוקול. על פי התוצאות ( איור 5 ), NGF חופשי יכול לעבור באופן חופשי דרך קרום (חתך משקל מולקולה: 300 kDa) ב PBS המכיל 5% BSA. עם שליטה חיובית זו, את התוצאה של שחרור NGF HDL- מחקה NPs הפך אמין. גודל הנקבוביות גדל וירידהכמו מחייב קרום הנגרמת על ידי PBS ו- BSA תרמו לחדירה חופשית של NGF דרך קרום דיאליזה.
בנוסף לנושאים הנ"ל, אתגר נוסף עם assay assayrowth neurite התעוררה. יש מסחרי neurite outayrowth ערכת assay כי הוא מבוסס על תת subclone של תאים PC12. עם זאת, subclone של תאים PC12 הוא כבר לא זמין מסחרית. תאי PC12 רגילים הם תאים צפים שאינם גדלים neurites טוב מאוד וכי הם קל לאבד במהלך ההליכים הניסוי. לאחר מספר כשלים, התגלה אוכלוסיה קטנה של תאי PC12 שהיו בעלי שטח הדבקה חזק. לפיכך, אוכלוסיית תאים זו נבחרה באמצעות מספר קטעים, כמתואר בפרוטוקול. כתוצאה מכך, assay בוצע בהצלחה מדגים את bioactivity דומה של NGF HDL לחקות NPs עם NGF חינם ( איור 6 ).
השיטה המדווחת כאן היא הליך פשוט עבור ההכנה של HDL לחקות NPs. לקחנו מעל 26% של Apo AI על NPs, אשר היה מעל פי 3 גבוה יותר מאשר דיווחו בספרות 16 . מעל 65% של NGF היה לכוד ב NPs, אשר היה פי 2 גבוה יותר מאשר בספרות 16 . עם אלה מגביר את יעילות מלכודת הן Apo AI ו NGF, ייתכן שלא יהיה צורך לטהר את NPs. כתוצאה מכך, ההכנה NP היה פשוט. APO AI נטען NGF בהכנת NP לא השפיעו על NGF במבחנה שחרור ( איור 6 ) ואת in vivo biodistribution ( איור 7 ), אבל זה יכול להשפיע על יציבות במחקרים חוץ גופית . מחקרים כאן מראים כי ניתן לשפר עוד יותר את יעילות מלכודת של Apo AI ו NGF על ידי שינוי NP הרכב והכנת נהלים. יתר על כן, הרומן HDL- מחקה NPs ואת אסטרטגיות במחקרים אלה ניתן להשתמש כדי לטעון אחרים grגורמים, למרות סוכן יון (פרוטמין) יכול להיות שונה כדי להתאים את גורם הצמיחה הספציפי. אחסון לטווח ארוך של ניסוחים חלבון הוא מאתגר. הדרך המועדפת לשמור על NPs טעון חלבון היא lyophilize אותם אבקות יבשות. עם זאת, lyophilization יכול להגדיל את גודל החלקיקים ולהפחית את יעילות מלכודת של החלבון לאחר הכינון מחדש של NPs lyophilized. פרסומים מעטים דנו lyophilization של HDL לחקות NPs. אנחנו לומדים את lyophilization של NPs חדש HDL- מחקה. בסופו של דבר, HDL מחקה NPs יכול להיות מיושם קלינית כאשר הם יכולים להיות מאוחסנים כראוי במשך תקופה ארוכה של זמן (לפחות 6 חודשים).
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי NIH R03 NS087322-01 ל- Dong, X.
Materials
| Name | Company | Catalog Number | Comments |
| Recombinant Human Beta-NGF | Creative Biomart | NGF-05H | |
| L-a-Phosphatidylcholine (PC) | Avanti | 131601P | 95%, Egg, Chicken |
| Sphingomyelin (SM) | Avanti | 860062P | Brain, Porcine |
| Phosphatidylserine (PS) | Avanti | 840032P | Brain, Porcine |
| Cholesteryl oleate (CO) | Sigma | C9253 | |
| D-α-Tocopheryl polyethylene glycol succinate (TPGS) | BASF | 9002-96-4 | Vitamin E Polyethylene Glycol Succinate |
| Protamine sulfate | Sigma | P3369 | meets USP testing specifications |
| Apolipoprotein A1, Human plasma | Athens Research & Technology | 16-16-120101 | 1mg in 671 µl 10 mM NH4HCO3, pH 7.4 |
| Sepharose 4B-CL | Sigma | CL4B200 | Cross-linked agarose, gel filtration chromatography column filling material |
| Sandwich ELISA Kit for NGF | R&D system | DY008 | |
| Bovine Serum Albumin | Sigma | A2153 | |
| RPMI-1640 medium | GE Healthcare Life Science | SH30096.02 | |
| Horse serum | GE Healthcare Life Science | SH30074.03 | |
| Fetal bovine serum | Gibco | 10082147 | |
| PC12 cells | ATCC | CRL-1721 | |
| Rat tail collagen type I | Sigma | C3867 | |
| Sodium acetate | Sigma | S2889 | |
| Sodium chloride | Sigma | 31414 | |
| Triton X-100 | Sigma | T8787 | |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzethonium chloride | Sigma | B8879 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer | Tekmar | T 25-S1 | |
| Delsa Nano HC particle analyzer | Beckman-Coulter | Delsa Nano HC | |
| Float-A-Lyzer G2 Dialysis Device | Spectrum Laboratories | G235036 | Molecule Cutoff 300 kDa |
| Centrifuge | Eppendoff | 5424R | |
| Polytron homogenizer | Kinematica | PT 1200C | |
| DecapiCone | Braintree Scientific Inc. | DC-M200 |
References
- Bruno, B. J., Miller, G. D., Lim, C. S. Basics and recent advances in peptide and protein drug delivery. Ther Deliv. 4 (11), 1443-1467 (2013).
- Mo, Z. C., Ren, K., Liu, X., Tang, Z. L., Yi, G. H. A high-density lipoprotein-mediated drug delivery system. Adv Drug Deliv Rev. 106 (Pt A), 132-147 (2016).
- Lacko, A. G., Sabnis, N. A., Nagarajan, B., McConathy, W. J. HDL as a drug and nucleic acid delivery vehicle. Front Pharmacol. 6, 247-252 (2015).
- Vaishya, R., Khurana, V., Patel, S., Mitra, A. K. Long-term delivery of protein therapeutics. Expert Opin Drug Deliv. 12 (3), 415-440 (2015).
- Lasic, D. D., Papahadjopoulos, D. . Medical application of liposomes. , (1998).
- Samad, A., Sultana, Y., Aqil, M. Liposomal drug delivery systems: an update review. Curr Drug Deliv. 4 (4), 297-305 (2007).
- Bezemer, J. M., Radersma, R., Grijpma, D. W., Dijkstra, P. J., van Blitterswijk, C. A., Feijen, J. Microspheres for protein delivery prepared from amphiphilic multiblock copolymers: 2. Modulation of release rate. J Control Release. 67 (2-3), 249-260 (2000).
- Patel, A., Patel, M., Yang, X., Mitra, A. K. Recent advances in protein and peptide drug delivery: a special emphasis on polymeric nanoparticles. Protein Pept lett. 21 (11), 1102-1120 (2014).
- Kuai, R., Li, D., Chen, Y. E., Moon, J. J., Schwendeman, A. High-density lipoproteins: nature's multifunctional nanoparticles. ACS Nano. 10 (3), 3015-3041 (2016).
- Gursky, O. Structural stability and functional remodeling of high-density lipoproteins. FEBS Lett. 589 (19 Pt A), 2627-2639 (2015).
- McMahon, K. M., Thaxton, C. S. High-density lipoproteins for the systemic delivery of short interfering RNA. Expert Opin Drug Deliv. 11 (2), 231-247 (2014).
- McMahon, K. M., Foit, L., Angeloni, N. L., Giles, F. J., Gordon, L. I., Thaxton, C. S. Synthetic high-density lipoprotein-like nanoparticles as cancer therapy. Cancer Treat Res. 166, 129-150 (2015).
- Lerch, P. G., Förtsch, V., Hodler, G., Bolli, R. Production and characterization of a reconstituted high density lipoprotein for therapeutic applications. Vox Sang. 71 (3), 155-164 (1996).
- Zhang, Z., Chen, J., Ding, L., Jin, H., Lovell, J. F., Corbin, I. R., Cao, W., Lo, P. C., Yang, M., Tsao, M. S., Luo, Q., Zheng, G. HDL-mimicking peptide-lipid nanoparticles with improved tumor targeting. Small. 6 (3), 430-437 (2010).
- Kim, Y., Fay, F., Cormode, D. P., Sanchez-Gaytan, B. L., Tang, J., Hennessy, E. J., Ma, M., Moore, K., Farokhzad, O. C., Fisher, E. A., Mulder, W. J., Langer, R., Fayad, Z. A. Single step reconstitution of multifunctional high-density lipoprotein-derived nanomaterials using microfluidics. ACS Nano. 7 (11), 9975-9983 (2013).
- Prathipati, P., Zhu, J., Dong, X. D. Development of novel HDL-mimicking α-tocopherol-coated nanoparticles to encapsulate nerve growth factor and evaluation of biodistribution. Eur J Pharm and Biopharm. 108, 126-135 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved