Method Article
シルクナノ粒子の製造および薬物送達アプリケーション
要約
ナノ粒子は、適応症の広い範囲のための薬物送達システムを有望として浮上しています。ここでは、リバースエンジニアリングカイコの絹を使用して、絹のナノ粒子を製造するためのシンプルで強力な方法を記載します。これらの絹ナノ粒子は容易に治療的ペイロードとロードされ、その後、薬物送達用途のために探索することができます。
要約
絹は、その優れた機械的性質、生体適合性および生分解性、並びに保護及びその後のトリガに応答して、ペイロードを放出する能力の生物医学的及び医薬用途のための有望なバイオポリマーです。シルクは、様々な材料の形式に製剤化することができるが、絹ナノ粒子は、有望な薬物送達システムとして浮上しています。そこで、この記事では、安定したシルクのナノ粒子を生成するために使用することができます再生絹溶液を得リバースエンジニアリングの絹の繭のための手順を説明しています。これらのナノ粒子は、その後、薬物がロードされ、潜在的な抗癌薬物送達システムとして調査、特徴付けられます。簡単に言うと、絹の繭は逆の、繭を脱ガムすることにより、第1工学絹の溶解に続いて、水性シルク溶液を得、クリーンアップされています。次に、再生絹溶液は絹のナノ粒子を得るために、ナノ沈殿に供される - シンプルだが強力な方法それは、均一なナノ粒子を生成します。絹ナノ粒子は、そのサイズ、ゼータ電位、水性媒体中で形態および安定性、ならびに化学療法ペイロードを捕捉し、ヒト乳癌細胞を死滅させるそれらの能力に応じて特徴付けられます。全体的に、記載された方法は、潜在的なナノ医療としての使用を含む、容易に無数の用途のために検討することができます均一な絹ナノ粒子を、もたらします。
概要
細胞および組織を標的とする - 例えば、タンパク質、ペプチドおよび小分子薬物 - ナノサイズの薬物送達システムは、多くの場合、薬物放出を制御するために、および治療的ペイロードの多様なセットを提供するために使用されます。これらの治療のペイロードは、しばしば、リポソーム、(デンドリマーを含む)、水溶性ポリマー、およびマイクロおよびナノ粒子1のような種々の高分子薬物担体に組み込まれています。 (典型的には1nm〜1000nmでのサイズ範囲の)ナノ粒子は、広く、特に抗癌薬物送達2ため、潜在的な薬物担体として検討されています。薬物送達のためのより多くのナノ粒子が、今の臨床試験4に入っているように、日常の臨床実践3へのアブラキサンの導入に成功したが(120nmでのサイズのアルブミンベースのナノ粒子は、パクリタキセルでロード)、フィールドを触媒しました。固形腫瘍は、一般的に、そのn個を意味する貧しいリンパの流れを示し、漏出性血管を持っています200ナノメートルまでのanoparticlesは、受動的に静脈内投与後、これらの腫瘍を標的とすることになります。この受動的ターゲティング現象は、強化された透過性および保持(EPR)効果と呼ばれ、最初の1986年5で報告された。EPR効果が与えられた薬物用量場合の腫瘍微小環境内の薬剤濃度の50〜100倍の増加につながることができます薬物ペイロードは担体なしではなく、遊離薬物より高分子薬物担体アプローチを用いて送達されます。抗がん薬物送達のために設計された薬物担持ナノ粒子は、腫瘍微小環境に到達するために持っていると、薬物がその所望の治療効果3を達成するためにするために、多くの場合、通常はエンドサイトーシス取り込みによって、特定の細胞内区画を入力する必要があります。細胞内薬物送達のために設計されたナノ粒子は、細胞へのゲートウェイ、ならびに薬物耐性メカニズムを克服するための経路として、エンドサイトーシスを利用します。ナノ粒子からの薬物放出は、しばしば、特にOに設計されていますリソソームにおけるccur( すなわち 、リソソーム薬物送達)ナノ粒子のキャリア(リソソームpHは約4.5)のpH応答性薬物放出やキャリア7からペイロードを解放するリソソーム酵素のためのトリガーとして機能することができる6。
材料の多くの異なるクラスは、ナノ粒子( 例えば、金属および多くの有機及び無機材料)を生成するために使用することができます。しかし、生体高分子は、その既知の生体適合性、生分解性および低毒性8の魅力材料として浮上しています。多くの生体高分子は、アルブミン、アルギン酸塩、キトサン、シルクなど、探索されています。これらの中で、絹は、薬物送達システム9への開発のための有望な候補として浮上しています。様々な種類の絹は( 例えば 、 カイコ )( 例えば 、Nephilaのclavipes)クモおよびカイコなどの節足動物の数、によって製造されています。カイコ絹ははるかにEXTENを使用されています、異常にクモの糸よりもカイコは完全に家畜化されているので、そのシルクは、このように再現可能な出発物質を表します。カイコ絹は、食品医薬品局(FDA)は、特に縫合材料として、ヒトへの使用のための材料を承認しています。それは、ヒトにおける強固な安全記録を有しており、 生体内 10 で分解することが知られています。絹の分解プロフィールは、時間(低結晶性絹)から12ヶ月以上の範囲(高結晶性絹)に微調整することができます。シルク分解産物は非毒性であり、本体10に代謝されます。絹の構造は、薬物放出制御のための良い材料作り、低分子量化合物と高分子タンパク質薬11を結合する能力を付与します。タンパク質薬剤( 例えば、抗体)は、免疫系による変性、凝集、タンパク質分解的切断およびクリアランスを受けやすいです。しかし、シルクは、そのナノ結晶の再の緩衝能力に治療用タンパク質を安定化gionsナノスケール11で水分含量を調整する能力。これらのユニークな機能は、物理的な保護を提供し、ペイロードモビリティ11を削減し、典型的には、他の(バイオ)ポリマーでは見られません。例えば絹ベースのヒドロゲル12、フィルム13〜15ナノ粒子16,17のための多くの抗癌薬物送達システムは、現在(18,19参考文献に概説)、これらの機能を活用するために開発されています
ここで、絹のナノ粒子は、拡張された時間枠にわたってそのサイズと電荷を決定することによって特徴づけられました。ドキソルビシン、臨床的に関連する抗癌剤は、薬物装填絹ナノ粒子で処理したトリプルネガティブヒト乳癌細胞における薬物負荷および細胞毒性研究のためのモデル薬物として使用しました。
プロトコル
カイコの繭からリバースエンジニアリングシルクソリューションの調製
注:この方法は、他の場所12,27記載されているプロトコルに基づいています。
- 5ミリメートルのx 5ミリメートル片にハサミで乾燥繭の5グラムをカット。あらゆる汚れたレイヤーを削除します。
- 炭酸ナトリウムの4.24グラムを秤量し、蒸留水を沸騰の2 Lに慎重にこれを追加します。
注:これは、0.02M炭酸ナトリウム溶液が得られます。 - 絹繊維を脱ガムする60分間沸騰炭酸ナトリウム溶液と沸騰にカット繭片を追加します。均質な試料処理を確実にするために時々絹をかき混ぜます。
- 精練された絹を削除し、20分間蒸留水1Lで洗浄します。洗浄工程を少なくとも3回繰り返します。
- 洗浄絹を削除し、余分な液体を除去した後、ほどく/手で絹を引っ張るようにうまくそれを絞ります。一晩乾燥空気にドラフト内でアンタイド絹を置きます。これは、典型的には、脱ガムの3.6gのを生じます同類繊維。
- 次の日、5グラムの空気乾燥脱ガム絹繊維を秤量し、50ミリリットルのビーカーの底にしっかりとシルクを詰めます。
- 新鮮9.3 MのLiBr溶液を調製します。 4ミリリットルのLiBr比に1グラムの絹を使用してのLiBrシルク繊維を溶解させます。蒸発を防止し、絹を60℃で完全に溶解させるためにアルミホイルで絹のLiBrサンプルをカバーします。このステップは、4時間を要し、時折攪拌することにより支援されます。
- 5分間水中で透析カセット(3,500ダの分子量カットオフ)を濡らします。 15ミリリットルの透析カセットに15ミリリットルに絹のLiBr溶液を注入し、気泡を除去するために、針と注射器を使用しています。
- 蒸留水1Lに対して透析( すなわち 、初日の3変更)し、再び次の朝と夕方に( すなわち 、2二日目の変化)、そして再び上の1、3、6時間目に水を変更翌朝(三日目、すなわち 、1変化します)。
- シルクsolutiを収集透析カセットと遠心9,500×gで5℃で20分間、溶液からの。上清を回収し、二回以上、この遠心分離プロセスを繰り返します。
- 空の計量ボート(W1)の重量を測定し、絹溶液1mlを追加します。再び(W2)の重量を記録し、次いで一晩60ºCで計量ボートを残すことによって、試料を乾燥させます。次に、全乾燥重量(W3)(乾燥シルクやボートの重さ)を決定します。シルク溶液(w / v)の濃度である:%=(W3-W1 / W2-W1)×100。
リバース・エンジニアリングシルクソリューションからシルクナノ粒子の作製
- > 75%の(v / v)のアセトン溶液を維持しながら、アセトンをシルク溶液を滴下(w / v)の5%を加えます。例えば、34ミリリットルのアセトンに5%(w / v)のシルク溶液を滴下(50滴/分の速度で10μL/ドロップ)の9ミリリットルを追加します。
- 4℃で2時間、48,000×gで沈殿物を遠心。
- 上清を吸引し、PELLEを再懸濁第スパチュラでペレットを取り除く、次いで20 mlの蒸留水を添加することにより、蒸留水でT。へらからペレットを除去するために、ピペットチップを使用してください。 、30秒間30%の振幅で超音波プローブを使用して、2つの超音波処理サイクル、続いて20秒間蒸留水で容量遠心管上部までボルテックスしました。
- 少なくとも2倍の遠心分離および再懸濁ステップを繰り返します。
- 使用するまで4℃で2.3ストアに詳述するように、蒸留水6mlにペレットを再懸濁。細胞培養研究のために、絹ナノ粒子ストックは、γ17を照射することができます。
シルクナノ粒子濃度の3決意
- 4℃で2時間、48,000×gで遠心分離シルクナノ粒子。
- 30秒間30%の振幅で2超音波処理サイクルに続いて、蒸留水3ml中のすべてのナノ粒子を集めます。
- 2ミリリットルと1ミリリットルロットに絹のナノ粒子の3ミリリットル株式を分割し、広報に移します2ミリリットルのチューブを電子秤量。 2ミリリットルのサンプルの総重量を記録します。使用するまで4℃で1ミリリットルをたくさん保管してください。この1mLのサンプルを、較正曲線を生成するために使用されます。
- その後、スナップ凍結し、一晩凍結乾燥機で2ミリリットルシルクナノ粒子の多くを凍結乾燥します。凍結乾燥後、2ミリリットルチューブを再秤量し、2ミリリットルのサンプル中にもともと存在していた絹のナノ粒子(ミリグラム)の量を計算します。
- 5点較正曲線(0.04から7 mg / mlで)を生成するために蒸留水で1mLの絹ナノ粒子ストックを希釈します。サンプルは吸光度の最大値を超えていないことを確認してください。
- 600nmでの各標準希釈液の吸光度を決定します。これは最高の96ウェルプレートのセットアップを使用して行われます。標準曲線のための濃度(mg / mlで)対プロット吸光度。その後、懸濁液中のシルクナノ粒子の濃度を決定するために、日常的に、この標準曲線を使用しています。
ドキソルビシンロードシルクナノ粒子の4準備
- ドキソルビシン溶液の調製
- 蒸留水8mlに塩酸ドキソルビシンの1.2ミリグラムを溶解させます。
- 116μgの/ mlの(0.2マイクロモル/ミリリットル)の作業ストックを得、蒸留水で10mlにメイクアップ。
- ドキソルビシン装填シルクナノ粒子の調製
- 2ミリリットルチューブシルクナノ粒子の10、30または50 mg / mlで200μlの0.2モル/ mlのドキソルビシン溶液を2ミリリットルを混ぜます。
- 回転ミキサー上で一晩、室温(25℃)でシルクドキソルビシンサスペンションをインキュベートします。
- 次に、30分間、194000×gでシルクドキソルビシンサスペンションを遠心分離します。蒸留水でドキソルビシンロードシルクナノ粒子を洗浄し、二回、この手順を繰り返します。
- (このサンプルは封入効率を決定するために使用される)、上清をプールし、総容量に注意してください。
- 4ºC国連で光とストアから守る、蒸留水にドキソルビシンロードシルクナノ粒子を再懸濁使用ゴマ。
- カプセル化効率及び薬物負荷の決意
- 黒のマイクロタイタープレートへのステップ4.2.4からの上清をピペットで200μlの。
- 固定された光電子増倍管設定でドキソルビシン関連の蛍光を測定するために、蛍光マイクロプレートリーダーを使用してください。
- 590 nmの485 nmおよび発光波長に励起波長を設定し、蛍光値を記録します。
- ドキソルビシン較正曲線を生成します。測定は同一の機器の設定( すなわち、固定された光電子増倍管設定で)で取得されていることを確認します。較正曲線を使用して、組み合わせた上清中のドキソルビシン濃度を計算します。 3つの独立した実験では、この測定を繰り返します。
- カプセル化効率を決定するために、式(1)を使用します。

シルクナノの5キャラクタリゼーション粒子
- 新たに調製されたとストアドシルクナノ粒子のサイズおよびゼータ電位の評価。
- 4℃と25℃の蒸留水にストアシルクナノ粒子。
- 動的光散乱(DLS)を用いて0日目、14及び28の絹のナノ粒子のサイズ及びゼータ電位を測定します。タンパク質17用蒸留水の1.33と1.60に屈折率を設定します。ユーザ・インタフェース・ソフトウェアを有する粒子サイズを計算します。
- 走査型電子顕微鏡(SEM)によるシルクナノ粒子の形態学的評価。
- SEMスタブ上にカーボン接着剤のディスクを置き、その後、シリコンウエハを添付します。
- 1mg / mlの濃度に絹ナノ粒子を希釈します。ピペットシリコンウェーハ上に10μlのサンプルを、-80℃でサンプルを凍結し、一晩、製造元の説明書に従って凍結乾燥システムを使用して凍結乾燥します。
- コート金でサンプルの厚さは20nmまでの層低真空スパッターコーターを用いて。
注:インストゥルメントの設定は、モデルによって異なります。ここで使用されるモデルは、完全に自動化されており、厚さのみによって動作します。 - 5 kVので走査型電子顕微鏡および40,000倍の倍率で画像サンプル。
コントロールのインビトロ細胞毒性とドキソルビシンロードシルクナノ粒子6.
- シルクナノ粒子への曝露後の細胞の生存率。
- 10%(v / v)のFBSを含むRPMI 1640中で培養MDA-MB-231細胞。組織培養のプレートの細胞がポリスチレンで処理し、37℃で加湿した5%CO 2雰囲気中でインキュベートします。日常的に2〜3日毎に80%コンフルエンスで継代培養。
- 96ウェルプレート中で2×10 4細胞/ cm 2の密度でプレートMDA-MB-231細胞。細胞は一晩を回復することを可能にします。
- μgの自由に拡散ドキソルビシン0.001(i)を追加し、(ii)は0.001〜0.5 mgのシルクナノ粒子および0.1mgシルクナノ粒子96ウェルプレート(最終容量ウェル当たり100μlの)に0.001から1μgのドキソルビシンを装填し。
- 72時間目(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT、PBS中に5mg / ml)を添加することによって、細胞の生存率および最大半量阻害濃度(IC 50)を決定する。インキュベート5時間、注意深くピペットでウェルを排出し、ジメチルスルホキシド100μlでホルマザンを溶解させる。560 nmの吸光度を測定します。3つの独立した実験では、この測定を繰り返します。
注:未処理の対照の吸光度値は、100%の細胞生存度に対する基準値としての役割を果たす。
- シルクナノ粒子に曝露された細胞のSEM。
- 2×10 4細胞/ cm 2の密度でシード無菌カバーガラス上でMDA-MB-231細胞。細胞は一晩を回復することを可能にします。 72時間のための所望の処理条件に細胞を公開します。
- ディで洗浄し、30分間、PBS中の2%(v / v)のグルタルアルデヒドで細胞を固定他の場所28に詳述したようstilled水二回、エタノール系列で脱水し、臨界点は、サンプルを乾燥させます。
- 金でサンプルが厚い低真空スパッタコーターを使用して、20 nmのアップ層コートをスパッタ。
注:インストゥルメントの設定は、モデルによって異なります。ここで使用されるモデルは、完全に自動化されており、厚さのみによって動作します。 - 画像5 kVの700倍の倍率の電子加速を使用して、SEMによるサンプル。
結果
以前に17に詳述するように、データを統計的に分析しました。スチューデントのt検定は、複数のサンプルについてボンフェローニの多重比較事後検定に続くサンプル対および一元配置分散分析(ANOVA)のために使用しました。次のようにアスタリスクは統計的有意性を示している:* P <0.05及び** P <0.001。すべてのデータは独立した実験の数を示す標準偏差(SD)と括弧内の数字は平均値±として提示されています。
再生絹溶液を調製し、続いてナノ析出( 図1)を介して、絹ナノ粒子を生成するために、アセトンに滴下しました。この方法は、(多分散性指数:0.1)均一を生じ、負の表面電荷を有する、球状、絹ナノ粒子(1.1±106.5 nm)を(-49.57 mVの±0.6)( 図2および3)。シルクナノ粒子ST水中での能力は、粒子サイズ、ゼータ電位および形態( 図2及び3)を監視することによって、最大28日間評価しました。 28日間の貯蔵期間にわたり、4℃または25℃のいずれかで、粒子サイズ、電荷( 図2)または形態の有意な変化は( 図3)は観察されませんでした。
ドキソルビシンは、薬物負荷のための臨床的に関連する化学療法モデル薬物として、およびインビトロ細胞毒性研究に使用しました。三つの異なるシルクナノ粒子濃度(10、30および50mg / ml)を絹ナノ粒子の薬物負荷能力を評価しました。 10、30および50mg / mlのシルクナノ粒子( すなわち 、2、6、または10絹のMGとドキソルビシンの232μgの)のためのドキソルビシン封入効率はそれぞれ73±2.2、87±1.8および97±0.2%であった( 図4A )。ドキソルビシン-LOの粒子径とゼータ電位aded絹ナノ粒子(10 mg)を測定し、10 mgの絹ナノ粒子対照と比較しました。ドキソルビシンロードシルクナノ粒子のゼータ電位が大幅に43.52±0.37 mVの( 図4C)に49.57±0.6 mVのから減少した粒子サイズは、薬物負荷( 図4B)の後に変化しませんでした。
ドキソルビシンを送達し、続いて、癌細胞を死滅させる薬物装填絹ナノ粒子の能力は、in vitroで評価しました。ヒト乳癌MDA-MB-231細胞を、絹ナノ粒子、自由に拡散ドキソルビシン又はドキソルビシン装填絹ナノ粒子に曝露しました。細胞生存率は、72時間の暴露期間後に評価しました。自由に拡散ドキソルビシン及びドキソルビシン装填絹ナノ粒子のIC 50値は、絹ナノ粒子はIC 50> 5 mg / mlで( 図5A)を有し、それぞれが、0.48 / mlの0.24μgの/ mlでした。0.1μgのと同等の薬物用量では、自由に拡散ドキソルビシンおよびドキソルビシンロードシルクナノ粒子は、それぞれ83±11および65±11%、( 図5B)の細胞生存率に有意な減少を引き起こしました。しかし、自由に拡散ドキソルビシンは、ドキソルビシンロードシルクナノ粒子よりも実質的に大きい細胞毒性を示しました。これらの定量的測定は、定性的なSEM画像( 図5c)によって裏付けられました。ここで、対照培養物は、高い細胞密度および優勢間葉系MDA-MB-231の表現型を示しました。同様の観察は、絹のナノ粒子に暴露された培養物のために作られました。しかしながら、ドキソルビシンに暴露された培養物は、顕著に異なる細胞表現型を示しました。同等のドキソルビシン用量で、自由に拡散ドキソルビシン及びドキソルビシン装填絹ナノ粒子で処理されたMDA-MB-231細胞は、細胞数の大幅な減少を示しました。また、多くの細胞が非常に広いと広がる形態を有していました。文化のexpドキソルビシン装填絹ナノ粒子にosedは、原形質膜( 図5C)に関連付けられたナノ粒子(及びそれらの凝集物)の証拠を示しました。
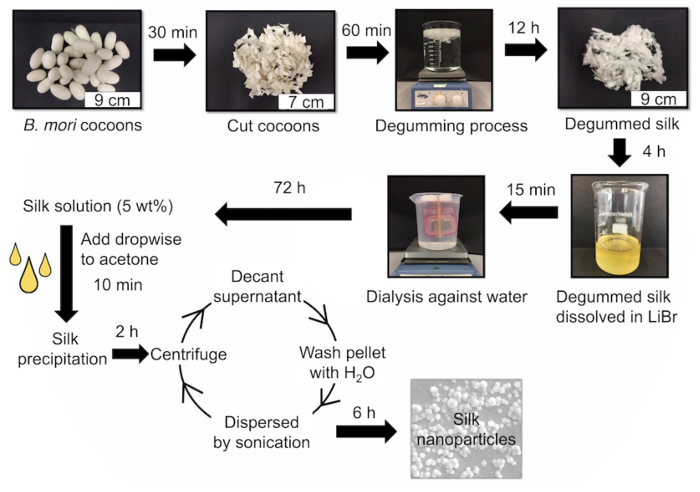
図1:重要なステップは、リバースエンジニアリング、シルク液、シルクナノ粒子を生成するためにまず、絹の繭が逆脱ガム絹繊維を得るために( すなわち 、沸騰)60分間脱ガムし、それらをカットし、によって設計されています。繊維は、9.3 MのLiBr中に溶解し、次いで72時間、水に対して透析します。 Vシルク溶液/ wの水性5%絹ナノ粒子を生成するために使用されます。アセトンへの絹の滴下は、絹ナノ沈殿をもたらします。シルクナノ粒子を洗浄し、その後の使用のために収集されている。 このの拡大版をご覧になるにはこちらをクリックしてください。図。

図2:シルクナノ粒子のサイズ及び電荷特性評価 4°Cと25°Cで絹ナノ粒子の粒径及びゼータ電位28日間。 SD±;エラーバーは、プロットシンボル内に隠されているときに表示されていない、N = 3 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:4℃および25℃で保存した絹ナノ粒子の品質評価28日間シルクナノ粒子を走査型電子顕微鏡を用いて画像化した(スケールバー=1μM)。 PLEASEこの図の拡大版をご覧になるにはこちらをクリックしてください。

図4:ドキソルビシンロードシルクナノ粒子のキャラクタリゼーション(DOX-のSNP)シルクナノ粒子の異なる量(のSNP)に応じて、232μgのドキソルビシンの(A)の封入効率;。絹ナノ粒子の2,6及び10mg。 2mgのシルクナノ粒子と比較した場合、10および5mgシルクナノ粒子のカプセル化効率が大幅に増加しました。 (B)粒径および絹ナノ粒子(絹ナノ粒子の10 mg)を制御するために比べドキソルビシン装填された絹ナノ粒子(C)ゼータ電位。統計的に、サンプルペアの有意差は、スチューデントのt検定を用いて決定しました。複数のサンプルは、ボンフェローニの多重比較事後検定に続く一元配置ANOVAにより評価しました。 * P&#60; 0.05、** P <0.001、SD±;エラーバーは、プロットシンボル内に隠されているときに表示されていない、N = 3 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5: 絹ナノ粒子およびヒト乳癌細胞におけるドキソルビシン装填絹ナノ粒子の インビトロ 細胞毒性 シルクナノ粒子(のSNP)との72時間の処置サイクルの後、MDA-MB-231細胞の(A)細胞生存率(0.01ミリグラム。 / ml)を、ウェルあたりのボリュームは100μlのでした。 (B)0.1 mgのシルクナノ粒子を有する72時間の処理サイクル後のMDA-MB-231細胞の細胞生存率、自由に拡散ドキソルビシン(DOX)やシルクナノ粒子の0.1 mgの0.1μgのは、ドキソルビシンの0.1μgの(DOX-Sを搭載しましたNPS)。細胞生存率は統計的に自由に拡散ドキソルビシンおよび対照と比較した場合、ドキソルビシンの0.1μgの担持絹製ナノ粒子の0.1ミリグラムの0.1μgのへの曝露後に減少しました。 (I)培地(対照)に曝露されたMDA-MB-231細胞の(C)SEM像、(II)0.1 mgの絹ナノ粒子、自由に拡散ドキソルビシン(III)を0.1μg、および(iv)ドキソルビシン装填絹ナノ粒子で同等の用量(スケールバー=50μm)を。統計分析は、平均値±SD、NSは=有意でない、ボンフェローニの多重比較事後検定に続く一元配置ANOVA、* P <0.05、** P <0.001によって行いました。エラーバーは、プロットシンボル内に隠されているときに表示されていない、N = 3 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
種々の方法が20をブレンドするポリビニルアルコール、噴霧乾燥21,22塩析、毛細管マイクロドット23を印刷し 、超臨界CO 2沈殿24(参照26に概説)ナノ析出16,25を含む、絹ナノ粒子を製造するために利用可能です。しかし、その全体的なシンプルさのために、ナノ析出は、絹のナノ粒子を生成するための最も人気のある手法です。したがって、この研究の目的は、ナノ沈殿がリソソーム抗癌剤の送達を含む適用範囲に使用することができる絹ベースのナノ粒子を製造するために絹を、リバースエンジニアリングに適用することでした。
過去10年間、ナノ析出は、タンパク質ベースのナノ粒子29の製造のための最も一般的な手順の一つとなっています。私たちの研究グループ16,17およびその他25,26,30,31が正常にこの技術を適用していますシルクへノロジー。ここで、我々は絹ナノ粒子の生成のためのシンプルでありながら堅牢な段階的なプロトコルを提示します。アセトンナノ沈殿、サイズが均一であると、ナノメートルサイズの範囲内、典型的には収まる球状シルク粒子が得られます。アセトン、メタノール、エタノール、イソプロパノール、ブタノール16,25のような溶媒よりも好ましい連続相として浮上しています。アセトンはネイティブおよび再生絹ソリューション32内に存在する準安定100-200 nmのサイズの球状のミセル構造と比較した場合、水和の減少したレベルを有するナノ粒子が得られます。しかしながら、ここに記載したものと潜在的に異なる特性を有する絹(ナノ)粒子を生成するために、溶媒混合物と脱ガム時間の変化を探索する範囲があります。ここで説明するプロトコルは、負の表面電荷を有する、均一な球状のナノサイズのシルク粒子(106.5±1.1 nm)での製造を可能にする連続相、アセトン(-49.57を利用します77; 0.6 mVの)、それは疎水性、結晶性の絹のチェーン16,17のタイトなパッキングを持っています。全体的に、記載された手順が少しハンズオン時間を必要とし、リバースエンジニアリング、水性シルク溶液( 図1)から絹ナノ粒子が得られます。この手順の主要な機能のいくつかは、60分精練された絹、適切なドロップサイズ(約10μL/ドロップ)および50滴/分の最大滴下速度の使用を含みます。これらの主要な機能の遵守は14%の典型的な収量をもたらします。これらのナノ粒子は、堅牢であり、私たちは、彼らが安定しており、28日の貯蔵期間にわたってその物理的特性を変化させないという証拠を提供します。しかしながら、記載された方法の潜在的な注意点は、広いサイズ範囲(狭い多分散指数を維持しながら、すなわち、マイクロメートルスケールにナノメートルの粒子を生成する)を介して粒子を生成するための不在です。
粒子の大きさ、電荷および形状を制御することは、Iであります固形腫瘍33を標的とする場合は特に、薬物送達のためのmportant。 100 nmのサイズ範囲の粒子は、腫瘍標的用として理想的な候補を浮上しています。従って、100nmのサイズの絹ナノ粒子は、固形腫瘍の治療のための抗癌薬物送達システムとしての潜在的な候補です。シルクナノ粒子は、それらを簡単に静電的相互作用16の利用を通じて正に帯電した薬物を装填しレンダリング負の表面電荷を、持っています。しかし、電荷のほか、追加の薬剤特性( 例えば、のlogD)も薬物負荷に影響を与えると34を放出することが知られています。本研究では、ドキソルビシン、弱塩基性抗癌剤は、モデル薬物候補として選択しました。薬物負荷試験( 図4)が増加シルクナノ粒子濃度が増加したドキソルビシンのカプセル化効率につながっていることを示しました。シルクナノ粒子10mgをドキソルビシンの232μgのをカプセル化することができます。シルクナの薬物負荷noparticles、今度は、ドキソルビシン、シルク電荷相互作用が、この特定の薬物担体の組み合わせのために重要であることを確認する直接的な実験的証拠が有意に減少した表面電荷を有する絹ナノ粒子が得られました。
我々は以前絹ナノ粒子がリソソーム薬物送達システム16,17として機能することができるという証拠を提供しました。ここで、我々は、ヒト乳癌MDA-MB-231細胞株を治療するためのドキソルビシン装填絹ナノ粒子を用いた試験を示します。診療所35で治療することは困難である( - / PR - - / HER2 ER)、これらの細胞は、高度に侵襲性のトリプルネガティブ乳がんに由来します。したがって、この患者集団に合わせた薬物送達システムを設計することは多大な利益をもたらすことが期待されます。薬物負荷の不存在下で、絹のナノ粒子は、細胞生存率(IC 50値> 5 mg / mlで)( 図5a、c)に影響を与えませんでした。しかし、エクイで価の用量は、有意に高い細胞毒性は、ドキソルビシン装填絹ナノ粒子( 図5b)よりも自由に拡散ドキソルビシンで観察されました。自由に拡散し、粒子に結合した薬物のin vitroでの細胞の薬物動態の違いは、この観察を説明します。薬物装填ナノ粒子の取り込みはエンドサイトーシスに依存しているのに対し、自由に拡散薬剤は急速に、拡散によって、原形質膜を通過することができます。それにもかかわらず、ナノ粒子のエンドサイトーシス取り込みは、薬物の保持を向上させ、薬剤耐性機構3を克服することができます。しかし、ナノ粒子媒介性抗癌薬物送達の真の利点は、それが受動的腫瘍標的化を容易にし、薬物動態を改善するために、EPR効果を利用することです。したがって、ナノ粒子ベースの薬物送達アプローチの使用は、完全にin vivoで評価することができます。 in vitro試験では制限があります( すなわち 、EPR効果の欠如)フルcharactを排除薬物送達システム7のこれらのタイプのerization。
要約すると、説明した方法論は、一貫したサイズおよび表面電荷の球状絹ナノ粒子の容易な製造を可能にします。これらの絹のナノ粒子は、広範囲の用途に使用することができる( 例えば 、化粧品、ナノパターニング、セラノスティクス、潤滑剤、nanotoxicity研究のための制御粒子のためのテンプレート)抗癌剤の送達プラットフォームとしてのそれらの使用を含みます。
開示事項
The authors have nothing to disclose.
謝辞
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
資料
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
参考文献
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved