Method Article
Photoredox触媒を用いた可視光媒介分散重合によるワームのようなミセルの簡便な合成
要約
This article describes a process for producing polymeric self-assembled nanoparticles using visible light mediated dispersion polymerization. Using low energy visible light to control the polymerization allows for the reproducible formation of self-assembled worm-like micelles at high solids content.
要約
Presented herein is a protocol for the facile synthesis of worm-like micelles by visible light mediated dispersion polymerization. This approach begins with the synthesis of a hydrophilic poly(oligo(ethylene glycol) methyl ether methacrylate) (POEGMA) homopolymer using reversible addition-fragmentation chain-transfer (RAFT) polymerization. Under mild visible light irradiation (λ = 460 nm, 0.7 mW/cm2), this macro-chain transfer agent (macro-CTA) in the presence of a ruthenium based photoredox catalyst, Ru(bpy)3Cl2 can be chain extended with a second monomer to form a well-defined block copolymer in a process known as Photoinduced Electron Transfer RAFT (PET-RAFT). When PET-RAFT is used to chain extend POEGMA with benzyl methacrylate (BzMA) in ethanol (EtOH), polymeric nanoparticles with different morphologies are formed in situ according to a polymerization-induced self-assembly (PISA) mechanism. Self-assembly into nanoparticles presenting POEGMA chains at the corona and poly(benzyl methacrylate) (PBzMA) chains in the core occurs in situ due to the growing insolubility of the PBzMA block in ethanol. Interestingly, the formation of highly pure worm-like micelles can be readily monitored by observing the onset of a highly viscous gel in situ due to nanoparticle entanglements occurring during the polymerization. This process thereby allows for a more reproducible synthesis of worm-like micelles simply by monitoring the solution viscosity during the course of the polymerization. In addition, the light stimulus can be intermittently applied in an ON/OFF manner demonstrating temporal control over the nanoparticle morphology.
概要
非球形(および他の)ナノ粒子形態の合成は、伝統的に明確に定義された両親媒性ジブロック(またはマルチ)の共重合体の合成および精製始まる多段階の自己組織化手順を使用して達成されました。最も一般的な自己組織化技術の一つは、1990年代にアイゼンバーグによって普及し、ブロック1-3のいずれかの溶媒の選択をゆっくり加え、続いて、両方のポリマーブロックのための一般的な溶媒中の両親媒性ブロック共重合体の溶解に関与し。選択的な溶媒(通常は水)が添加されると、ブロック共重合体は、ポリマーナノ粒子を形成する自己集合を受けます。ナノ粒子の最終的な形態(または形態の混合物)は、各ポリマーブロック、水の添加速度と共通の溶媒の性質の相対的な長さなどの要因の多数によって決定されます。しかしながら、このアプローチは、一般的にのみnanoparの製造を可能にします比較的低い固形分含有量(1重量%未満)でticlesので、その実用的なスケーラビリティ4を制限します。また、このような蠕虫状ミセル等の「中間」相の再現可能な形成は、この非球形形態5を安定化するために必要なパラメータの狭い範囲のために困難であることができます。
重合によって誘導される自己集合(PISA)のアプローチは、部分的に非常に高い固形分含量(典型的には10〜30重量%)6でナノ粒子合成を可能にする、その場で自己組織化を駆動するために、重合プロセス自体を利用して、アイゼンバーグアプローチの欠点に対処します-8。典型的なPISAアプローチにおいて、リビング重合プロセスは、反応媒体中に最初は可溶性であるが、不溶性ポリマーを形成するモノマーと溶剤可溶性マクロ開始剤(またはマクロCTA)を拡張するチェーンに使用されます。 PISAアプローチは、系統的に元の数を試験することにより、ワームのようなミセルを合成するために使用されています perimentalパラメータおよび合成「ロードマップ」5,9として詳細な相図を使用して。
その挑戦的な合成にもかかわらず、彼らの球状の対応に対するそれらの興味深い特性によるワームのようなナノ粒子に大きな関心が寄せられています。例えば、我々は、PISAのアプローチを用いて合成麻薬ロード短期および長期のワームのようなミセルは球状ミセルやベシクル10と比較して、 インビトロでの細胞毒性において有意に高かっ持っていることを実証しています。他のin vivoモデル11におけるナノ粒子のアスペクト比と血液循環時間との相関関係を示しています。他のものは、適切なPISA方法論を用いてウォーム状ナノ粒子の合成は、ナノ繊維のナノスケールの絡み合いに起因する巨視的ゲルが得られることを示しています。これらのゲルは、それらの熱可逆性ゾルゲル動作12により滅菌ゲルとしての可能性を実証しました。
"ontent>このプロトコルは、単純に、重合中に溶液粘度を観察することによって、ワームのようなミセルの形成のその場での監視を可能にする方法を説明している。同様のワームのようなミセルゲルの以前の研究では、その臨界温度以上、これらを実証しましたナノ粒子は、可逆ウォーム球転移を受けるので、高温で易流動性分散体を形成する。これまでに、これらのシステムは、制御された重合13,14を開始するために熱的に敏感なアゾ化合物を利用しているので、ゲル化が容易にこれらのシステムにおいて観察されないことが熱重合。これらの研究から中に、それはより低い温度でPISA派生したナノ粒子を合成すると、 その場で 、このゲル化挙動の観察を可能にすることができるという仮説が立てられました。最近ではナノ粒子を得るためにPISAのプロセスを媒介する容易な室温の光重合技術の使用を報告しました異なる形態15。ここでは、可視化プロトコルは、重合中に、溶液の粘度挙動を観察することにより、ワーム状ミセルの再現可能な合成のために提示されています。容易に商業的に入手可能な発光ダイオード(LED)(λ= 460nmで、0.7ミリワット/ cm 2で)を用いて分散重合が進行します。
プロトコル
1.合成とPOEGMAマクロCTAのキャラクタリゼーション
- 、オリゴ(エチレングリコール)メチルエーテルメタクリレート(OEGMA)〜(12 gで4×10 -2モル)、4-シアノ-4-(phenylcarbonothioylthio)ペンタン酸(CPADB)(0.224 gの8×10 -4モル)を添加2,2'-アゾビス(2-メチルプロピオニトリル)(AIBN)を100mlの丸底フラスコに(16.4ミリグラム、0.1ミリモル)を、50mlのアセトニトリル(MeCN中)。
- 適切なサイズのゴム隔壁と鋼線を用いてフラスコを密封し、氷水浴で<4℃に室温からフラスコを冷却します。
- 通気口としての第2の21のG針(0.8ミリメートルX 38ミリメートル)の演技で21 G針(0.8ミリメートルX 120ミリメートル)を介して、反応混合物中に直接窒素をバブリングすることにより30分間フラスコを脱酸素。
- 氷水浴に浸漬することにより重合をクエンチし、空気にコンテンツを露出する前に5.5時間、70℃の油浴にフラスコを置きます。
- 交流の下で攪拌することによってのMeCNを削除します圧縮空気と〜テトラヒドロフラン40ml(THF)に再溶解し、粗混合物をontinuousストリーム。
- 急速に撹拌し、石油スピリットの混合物(沸点40〜60℃)とジエチルエーテルの400ミリリットルにフラスコ滴下の内容を追加します(70:30、v / v)を、上清がもはや曇っなるまで攪拌しないように続けています。
注:氷浴で冷却し、沈殿プロセスを加速するために使用することができます。 - 〜40mLのTHF中の上清および再溶解ポリマー残渣をデカント。
- 沈殿処理を繰り返し、残留OEGMAモノマーの完全な除去を確実にするために、少なくとも2回以上(1.5〜1.7ステップ)。 4時間真空オーブン(20℃、10ミリバール)で、圧縮空気と乾燥の連続ストリームの下で最初に攪拌することにより、精製POEGMAマクロCTAから余分な溶媒を除去します。
- 以前に報告された方法を用いて、核磁気共鳴(NMR)によってPOEGMAマクロCTAの数平均分子量(M N、NMR)を決定
15アップ。ポリマー分散度(D)を計算するゲル浸透クロマトグラフィー15(GPC)(移動相及び較正のための適切な基準としてジメチルアセトアミド)を使用。
注:上記の合成を使用したが(1.1から1.8ステップ)POEGMA MとマクロCTA nは、NMR = 9000、およびD <1.15が得られるはずです。合成POEGMAマクロCTAの分子量(および分散)は、ここに提示合成異なる場合(7,000の間- 1,000グラム/モル)、蠕虫状ミセルの形成は、( インサイツゲル化によって示されるように)はまだ使用して発生することができその後のPISAの方法論は、わずかに変更された反応時間ではある(セクション2)で発表しました。
PISAを使用して-PBzMAナノ粒子B POEGMA-の調製
Ru(bpyで)3 Clで2。6H 2 Oのエタノール(EtOH)中の1mg / mlのストック溶液を準備します。溶媒の蒸発を最小限に抑えるために冷蔵庫にストック溶液を保管してください。綿ウールの小さな塊がきつく、それをパック助けるために第2のピペットを使用してパスツールピペットを差し込みます。約5cmの列を与えるために脱脂綿プラグ付きピペット内に塩基性酸化アルミニウムを注ぎます。カラムを通して〜BZMAの3ミリリットルを渡すとdeinhibited BZMAの溶離液を収集することにより、商業BZMAでモノメチルエーテルヒドロキノン阻害剤を除去します。POEGMAマクロCTA(〜9000グラム/モル; 76.9 mgであり、8.5×10 -6モル)を追加します。、(0.301グラム、1.71×10 -3モル)BZMAをdeinhibited、ルテニウム(BPY)3 Cl 2の6H 2 O(128μgの、 1.71×10 -7モル、4ミリリットルのガラスバイアルに1mg / mlのエタノールストック溶液の128μl)を、0.383ミリリットルのMeCNおよび1.402ミリリットルのEtOH(1.913ミリリットル全溶媒、80重量%、20(v / v)の%のMeCN) 。ステップ1.2から1.3に概説されているよう脱酸素手順を実行します。2000ミリリットルのガラスビーカー内のバイアルを置きます( 図2)は、青色LEDストリップが並んで(λ 最大 = 460nmで、0.7ミリワット/ cm 2)を磁気攪拌しながら、室温で照射します。日常的に20時間後に反応バイアルを監視し、バイアルは( 図3)が反転したときに高粘度液が自立ゲルを形成する場合、反応器からそれを削除。
注意:ここで紹介する条件を用いて、青色光照射の約24時間でなければならない自立ゲルを得るための合計時間を。光照射用原子炉の小さな差(物理的な寸法、強度など )は、蠕虫状ミセルのin situ形成を達成するためにわずかに変更された条件(具体的には、反応時間)を必要とするかもしれません。反応器から除去した後、数分間空気にナノ粒子ゲルを露出させ、暗所で直立密閉バイアルを格納することによって重合をクエンチしました。
ナノ粒子形態の3透過型電子顕微鏡(TEM)イメージング
粗製のnanopaの約40ミリグラムを配置4ミリリットルのガラスバイアル中(セクション2から)rticleゲル。連続的にボルテックスミキサーを用いて、ナノ粒子ゲルを攪拌し、少なくとも5分間にわたってエタノール滴下を4mlを加えます。ゲルは、溶媒の添加の間、自由流動ソリューションとなるべきです。
注:ゲルがあまりにも急速にか十分に撹拌EtOHで希釈されている場合は、ナノ粒子のいくつかの沈殿が発生する可能性があります。ステップ3.3を参照してください。グラスウールを通して濾過することにより希釈されたナノ粒子からの任意の肉眼で見える凝集物を除去。以前に報告された手順に従って希釈されたサンプルの(酢酸ウラニル染色)のTEM撮影を行う。15
結果
本研究では、二段階重合プロトコルは、PISAのアプローチ( 図1)を用いて、蠕虫状ミセルの合成に使用されます。第1のステップでは、OEGMAの重合が続く重合工程において安定化剤として使用することができるPOEGMAマクロCTAを得て行われます。最終的にナノ粒子の形成をもたらすエタノール中PBzMAの不溶性による分散条件下でPET-RAFT重合が進行します。重合の間、最初に透明な反応混合物は分散重合に応じて白濁が観察することができ、最終的にはウォーム様ミセルの形成を示す高粘性のゲル様状態( 図3)に遷移します。 「リビング」重合の徴候が低いポリマー分散度(D <1.3)と分子ワットとの間に良好な相関関係で( 図1A)は明らかです8およびモノマー転化。また、GPCトレース( 図1B)は 、いくつかの高分子終了および低分子量のテーリングは、このシステムで観察されているが、変換を変化させることで、主に単峰性の分布を示しています。重要なことには、これら「デッド」ポリマー鎖は、純粋な蠕虫状ミセルの形成を阻害するのに十分な量ではありません。変換の増加に伴って分子量分布のシフトは、鎖長の狭い分布を有する-PBzMAジブロック共重合体B POEGMA-の優勢な形成を示唆しています。
図2Aは、1メートルの商用LEDストリップ(λ= 460nmで、4.8 W / m)を2リットルのビーカー内部に巻回されたこの実験で使用される光反応装置のセットアップを示します。我々の実験では、それはまた、同様の青色光強度( 図1B)を有する家庭用ランプはPET-RAFT Pにおいても使用できることが決定されましたISAプロセス。
図4は、蠕虫状ミセル形態の形成は、このような可変バイアルの種類及び試薬組成物としても、光源を間欠的に適用される場合、異なる反応条件下で達成可能であることを示しています。これは、ほとんどの光重合系での重合速度への光の侵入の強い影響にもかかわらず、PET-RAFT PISAプロトコルでのゲル化挙動は依然としてワームのようなミセル形成のための信頼できる指標として使用できることを意味します。典型的には、 現場外の TEM画像は、蠕虫状ミセル形成の証拠を提供するために必要とされるので、これは重要な結果です。別に観察されたゲル化挙動から、純粋に蠕虫状ミセルの形成は、(酢酸ウラニル染色で)TEMによりナノ粒子のかなりの量(> 100)の形態を観察することによって確認する必要があります。部分的な小胞の形態が認められた場合、照射時間が減少されるべきです。球状ミセルが観察された逆ならば、照射時間は、わずかに増加する必要があります。
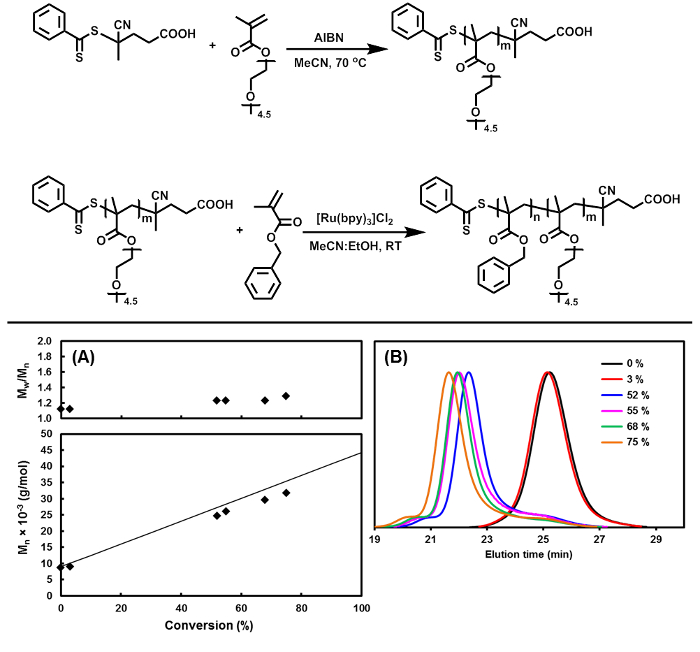
PET-RAFT、リビング重合技術を使用してワームのようなミセルを合成するための図1の反応スキーム。(上)PISAのアプローチを使用して、ワームのようなミセルの合成のための二つのステップのアプローチ。 (下記)速度論的研究を実証する(A)PISAの重合中分子量及び高分子分散の進化及び(B)換算でのゲルパーミエーションクロマトグラフィー(GPC)の分子量分布の進化。文献15から許可を得て適応。著作権(2015)米国化学会。 大きい版?を表示するには、こちらをクリックしてください。この図のn個。

図異なる可視光用原子炉の2.デジタル写真 。 (A)青と並ぶ本研究で使用した円形反応器は、ストリップのLED(λ 最大 = 460nmで、0.7ミリワット/ cm 2)でした。 (B)も、このプロトコルで使用することができ、5Wの電球を取り付けた家庭用ランプ。 この図の拡大版をご覧になるにはこちらをクリックしてください。

15時間後の重合前のPISA重合。画像が撮影された(A) 媒介PET-RAFT、(B)の 図3. 代表デジタル写真sおよび可視光照射の24時間後(C)。重合中、最初は透明な反応混合物が濁り、最終的に蠕虫状ミセルの中でその場形成を示す自立ゲル状態に遷移する。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図 -PBzMAジブロックコポリマーは、蠕虫状ミセルを得たPET-RAFT PISAのアプローチを使用して形成さ Bは POEGMA-の 4 特性とTEM像の異なる重合条件を用いて形成されたウォーム様ミセルのTEM像(及びデジタル写真挿入)。 (A)及び(C)は (Bに対し、24時間照射しました。万グラム/モルPOEGMAマクロCTAを使用した場合))ゲル化の前に39時間(合計ON / OFF照射時間を要しました。それぞれの場合において、高粘度のゲルは、蠕虫状ミセルの形成の特徴であるが形成されます。文献15から許可を得て適応。著作権(2015)米国化学会。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
この可視化プロトコルは、単にゲル様挙動の発生を観察することにより、ウォーム様ミセルの形成を監視する能力を示します。このアプローチの有用性は、他の方法と比較して、重合中にワームの形成をモニターする能力にあります。この手順は、自己組織化POEGMA- Bの -PBzMA両親媒性ジブロックコポリマーを得るために、2つの市販のモノマー(OEGMAとBZMA)の二段階重合法を用いて行うことができます。
図2のものと比較して異なる反応器形状を有する反応器、光強度等が 、蠕虫状ミセルゲルを得るためにわずかに変更された条件を必要とし得ることに留意すべきです。ルテニウム系触媒の吸収特性のために、重合は青色の可視光の下で妥当な速度で発生する可能性があります。原理的には、異なる光吸収特性を有する他の触媒を使用することもできます。ケアは、そうでなければ、巨視的な析出物が形成し始めることが長すぎる反応器内のワームゲルを残さないように注意する必要があります。ナノ粒子は、小胞構造に再編成しようとしたが、高粘性媒体によって阻害されるので、これは発生します。重合は自立ゲル様状態の最初の観察を超えて反応器内に保持されたときにいくつかのケースでは、我々は、TEM画像を介して部分的な小胞(クラゲまたはタコ構造)の形成を観察しました。
この技術の接近性を高めるために、このプロトコルで報告PET-RAFT PISA重合は、外部温度調節(冷却ファン、水浴等 )なしで、室温で行いました。さらに、低ワットのLEDストリップが重合(5℃未満)の過程でバイアルの温度で観察可能な増加を生成しません。十分に重合速度がINH、温度に強く依存することが知られている一方50℃で重合した場合にも巨視的ゲル様の挙動を誘発する蠕虫状ミセルの能力のibitionが観察されていません。
(平均して)短いウォーム様ミセルを得ることは、反応媒体が自立状態に達したが、粘度の顕著な増加を有する前に、光源を除去することによっても可能です。分析のためのこれらの「よりソフト」ゲル(降水なし)の希釈は自立ゲルと比較して有意に容易であるため、このアプローチは有利かもしれません。同様にして、球状ミセルは、さらに照射時間を減少させることによって得ることができます。通常、重合中の曇りの最初の発症後。
原理的には、異なるsolvophillicモノマーの範囲は、代わりに、重合速度と自己組織化パラメータがいくつかの最適化OEGMA( 例えば 、ポリ(2-ヒドロキシエチルメタクリレート)、ポリ(メタクリル酸)を使用することができます必要とされるであろう。マクロCTAの単独重合の高いlivingnessは、後続のPISA重合の効率を高めるために証明されるべきです。しかし、限り、十分に純粋なワーム状ミセル相は、重合の過程の間に存在するように、ゲル化が依然として発生する可能性があります。提示されたアプローチの有用性は、異なる長さのマクロCTA安定剤が有意蠕虫状ミセルを形成するための手順を再最適化することなく使用することができるという事実にあります。このプロトコルでは、POEGMAマクロCTAは、熱開始RAFTプロトコルを用いて合成したが、我々はまた、均一なPET-RAFTプロトコル16を使用して、高鎖末端忠実にPOEGMAを生成する能力を実証しました。 BZMAに構造的に類似のモノマーも蠕虫状ミセルゲル17を形成することが報告されているが、単量体の限られた数はyieに制御されたラジカル分散重合を受けることができる可能性があります重要なゲル化特性を有するLDワームのようなミセル。
(反応バイアルジオメトリを含む)は、異なる原子炉のセットアップは、ほとんどの光重合系で重合速度を変化させることにつながることができますが、視覚的に蠕虫状ミセルのその場形成に監視する能力は、PET-RAFT PISAのアプローチを使用している場合、この制限を克服するのに役立ちます。その結果、重合時間を実現正確な原子炉の設定に応じて変更することができます。これはよく蠕虫状ミセル相は、高純度かつ高収率で製造するのが困難であることが知られている、しかし、提示のアプローチでは、> 10重量%固形分でウォーム状粒子を生成することができます。重要なことに、これらの粒子の形成がかなり蠕虫状ミセル合成のみ重合をクエンチし、 現場外 TEM撮像を行った後に確認することができる以前の報告よりも重合中に監視することができます。
Importantly、再現性の高い固体含量でのこれらの高アスペクト比のナノ粒子を生成する能力は、特に、薬物送達担体として、生物学的分野における多くの用途のために重要な意味を持ちます。多くの研究は、それらの球状対応11または様々な細胞取り込み挙動10と比較して、このような増加した血液循環時間などの生物学的環境における非球面形態の興味深い挙動を示しました。これらの粒子は、エタノール溶液中で合成されている一方、本発明者らは以前に、適切な透析条件下で、これらのPISAナノ粒子の形態は、水溶液10中に保持することができることを実証しました。このアプローチの利点は、まず、生物学的研究のために水の中に透析前にエタノール分散条件の下で水難溶性の治療薬をカプセル化する能力にあります。また、これらの細長い粒子は、多様な細胞取り込みBEHを示す可能性がありますそのウイルス様形態による球状の構造にavior相対。
開示事項
The authors have nothing to disclose.
謝辞
CB is thankful for his Future Fellowship from Australian Research Council (ARC-FT12010096) and UNSW Australia.
資料
| Name | Company | Catalog Number | Comments |
| 4-Cyano-4- (phenylcarbonothioylthio)pentanoic acid (CPADB) | Sigma-Aldrich | 722995-5G | |
| Oligo(ethylene glycol) methyl ether methacrylate (OEGMA) | Sigma-Aldrich | 447935-500ML | Average Mn 300, contains 100 ppm MEHQ as inhibitor, 300 ppm BHT as inhibitor |
| 2,2′-Azobis(2-methylpropionitrile) (AIBN) | Sigma-Aldrich | ||
| Ru(bpy)3Cl2.6H2O | Sigma-Aldrich | 544981-1G | |
| Benzyl methacrylate (BzMA) | Sigma-Aldrich | 409448-1L | Contains monomethyl ether hydroquinone as inhibitor |
| Aluminium oxide (basic) | Chem-Supply Pty Ltd Australia | AL08371000 | |
| 95% Ethanol (EtOH) | Sucrogen Bio Ethanol | 80889 | |
| Acetonitrile (MeCN) | Chem-Supply Pty Ltd Australia | RP1005-G2.5L | |
| Tetrahydrofuran (THF) | Chem-Supply Pty Ltd Australia | TA011-2.5L | |
| Petroleum Spirits (40-60 °C) | Chem-Supply Pty Ltd Australia | PA044-2.5L | |
| Diethyl Ether | Chem-Supply Pty Ltd Australia | EA0362.5L | |
| Dimethylacetamide (DMAc) | VWR International Australia | ALFA22916.M1 | For GPC analysis |
| Pasteur pipettes (230 mm) | Labtek | 355.050.503 | |
| Glass beakers | Labtek | 025.01.902 (2L)/ 2110654 (1L) | 2 L beaker is for attaching LED strips to form the circular reactor |
| Commercial LED strip | EcoLab | n/a | λ = 460 nm, 4.8 W/m |
| 4 ml Glass Vials | Labtek | APC502214B | |
| 0.9 ml Quartz Cuvette | Starna Scientific Ltd | 21/Q/2 | |
| Needle (0.8 mm x 38 mm) | Beckton Dickson | 302017 | For deoxygenating reactions |
| Needle (0.8 mm x 120 mm) | B Braun Australia | 4665643 | For deoxygenating reactions |
| Sleeve stopper septa (rubber septum) | Sigma-Aldrich | z564680/z564702 | |
| Stirring hotplates | VWR International Australia/In Vitro Technologies | 97018-488/RADRR91200 | |
| Vortex mixer | VWR International Australia | 412-0098 | |
| Vacuum oven | In Vitro Technologies | MEMVO200 |
参考文献
- Yu, Y., Eisenberg, A. Control of Morphology through Polymer−Solvent Interactions in Crew-Cut Aggregates of Amphiphilic Block Copolymers. J. Am. Chem. Soc. 119 (35), 8383-8384 (1997).
- Zhang, L., Eisenberg, A. Thermodynamic vs Kinetic Aspects in the Formation and Morphological Transitions of Crew-Cut Aggregates Produced by Self-Assembly of Polystyrene-b-poly(acrylic acid) Block Copolymers in Dilute Solution. Macromolecules. 32 (7), 2239-2249 (1999).
- Zhang, L., Eisenberg, A. Multiple Morphologies of 'Crew-Cut' Aggregates of Polystyrene-b-poly(acrylic acid) Block Copolymers. Science. 268 (5218), 1728-1731 (1995).
- Yu, K., Zhang, L., Eisenberg, A. Novel Morphologies of "Crew-Cut" Aggregates of Amphiphilic Diblock Copolymers in Dilute Solution. Langmuir. 12 (25), 5980-5984 (1996).
- Blanazs, A., Ryan, A. J., Armes, S. P. Predictive Phase Diagrams for RAFT Aqueous Dispersion Polymerization: Effect of Block Copolymer Composition, Molecular Weight, and Copolymer Concentration. Macromolecules. 45 (12), 5099-5107 (2012).
- Ladmiral, V., Semsarilar, M., Canton, I., Armes, S. P. Polymerization-induced self-assembly of galactose-functionalized biocompatible diblock copolymers for intracellular delivery. J. Am. Chem. Soc. 135 (36), 13574-13581 (2013).
- Sugihara, S., Blanazs, A., Armes, S. P., Ryan, A. J., Lewis, A. L. Aqueous Dispersion Polymerization: A New Paradigm for in Situ Block Copolymer Self-Assembly in Concentrated Solution. J. Am. Chem. Soc. 133 (39), 15707-15713 (2011).
- Wan, W. M., Hong, C. Y., Pan, C. Y. One-pot synthesis of nanomaterials via RAFT polymerization induced self-assembly and morphology transition. Chem. Comm. (39), 5883-5885 (2009).
- Semsarilar, M., Jones, E. R., Blanazs, A., Armes, S. P. Efficient Synthesis of Sterically-Stabilized Nano-Objects via RAFT Dispersion Polymerization of Benzyl Methacrylate in Alcoholic Media. Adv. Mater. 24 (25), 3378-3382 (2012).
- Karagoz, B., et al. Polymerization-Induced Self-Assembly (PISA) - control over the morphology of nanoparticles for drug delivery applications. Polym. Chem. 5 (2), 350-355 (2014).
- Geng, Y., et al. Shape effects of filaments versus spherical particles in flow and drug delivery. Nat Nano. 2 (4), 249-255 (2007).
- Blanazs, A., et al. Sterilizable gels from thermoresponsive block copolymer worms. J. Am. Chem. Soc. 134 (23), 9741-9748 (2012).
- Pei, Y., Thurairajah, L., Sugita, O. R., Lowe, A. B. RAFT Dispersion Polymerization in Nonpolar Media: Polymerization of 3-Phenylpropyl Methacrylate in n-Tetradecane with Poly(stearyl methacrylate) Homopolymers as Macro Chain Transfer Agents. Macromolecules. 48 (1), 236-244 (2015).
- Fielding, L. A., Lane, J. A., Derry, M. J., Mykhaylyk, O. O., Armes, S. P. Thermo-responsive Diblock Copolymer Worm Gels in Non-polar Solvents. J. Am. Chem. Soc. 136 (15), 5790-5798 (2014).
- Yeow, J., Xu, J., Boyer, C. Polymerization-Induced Self-Assembly Using Visible Light Mediated Photoinduced Electron Transfer-Reversible Addition-Fragmentation Chain Transfer Polymerization. ACS Macro Lett. 4 (9), 984-990 (2015).
- Xu, J., Jung, K., Corrigan, N. A., Boyer, C. Aqueous photoinduced living/controlled polymerization: tailoring for bioconjugation. Chem. Sci. 5 (9), 3568-3575 (2014).
- Pei, Y., et al. RAFT dispersion polymerization of 3-phenylpropyl methacrylate with poly[2-(dimethylamino)ethyl methacrylate] macro-CTAs in ethanol and associated thermoreversible polymorphism. Soft Matter. 10 (31), 5787-5796 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved