Method Article
腹腔内卵巣癌転移の定量
要約
Ovarian cancer metastasis is characterized by numerous diffuse intra-peritoneal lesions, such that accurate visual quantitation of tumor burden is challenging. Herein we describe a method for in situ and ex vivo quantitation of metastatic tumor burden using red fluorescent protein (RFP)-labeled tumor cells and optical imaging.
要約
Epithelial ovarian cancer (EOC) is the leading cause of death from gynecologic malignancy in the United States. Mortality is due to diagnosis of 75% of women with late stage disease, when metastasis is already present. EOC is characterized by diffuse and widely disseminated intra-peritoneal metastasis. Cells shed from the primary tumor anchor in the mesothelium that lines the peritoneal cavity as well as in the omentum, resulting in multi-focal metastasis, often in the presence of peritoneal ascites. Efforts in our laboratory are directed at a more detailed understanding of factors that regulate EOC metastatic success. However, quantifying metastatic tumor burden represents a significant technical challenge due to the large number, small size and broad distribution of lesions throughout the peritoneum. Herein we describe a method for analysis of EOC metastasis using cells labeled with red fluorescent protein (RFP) coupled with in vivo multispectral imaging. Following intra-peritoneal injection of RFP-labelled tumor cells, mice are imaged weekly until time of sacrifice. At this time, the peritoneal cavity is surgically exposed and organs are imaged in situ. Dissected organs are then placed on a labeled transparent template and imaged ex vivo. Removal of tissue auto-fluorescence during image processing using multispectral unmixing enables accurate quantitation of relative tumor burden. This method has utility in a variety of applications including therapeutic studies to evaluate compounds that may inhibit metastasis and thereby improve overall survival.
概要
上皮性卵巣癌(EOC)2015年に米国での推定21290新たな診断と推定14180人が死亡1で、婦人科悪性腫瘍による死亡の最も一般的な原因です。女性の大多数(> 75パーセント)が拡散腹腔内転移および予後不良によって特徴づけ後期疾患(ステージIIIまたはIV)と診断されています。ファーストライン化学療法後の腹腔内疾患再発も一般的であり、死亡率2,3の主要な原因を表します。 EOCは、単一細胞または多細胞集合体のような直接の近隣腹膜臓器への原発腫瘍からの伸長だけでなく、原発腫瘍の表面からの細胞の解離または脱落によって両方を含むユニークな機構により、転移します。彼らは剥離誘導アポトーシスレジスト4を特徴とする細胞は、腹腔内に流されています。小屋腫瘍細胞が腹膜リンパドレナージとtをブロックとして腹膜腹水の蓄積は、一般的ですumorsは血管透過性を変化させ、増殖因子を産生します。彼らは固定し、複数の広く普及二次病変3,5を生成するために増殖し、そこで小屋腫瘍細胞の一部は、腸、肝臓、大網および腸間膜を含む腹膜臓器や構造の表面に付着します。血行性転移はまれです。したがって、臨床管理は、一般的に(どんなに小)すべての可視腫瘍の切除のように定義された「最適な減量」を含む腫瘍縮小手術、で構成されていません。完全な細胞減少は、全生存期間6,7の有意な増加と関連していると識別し、病変の除去<0.5 cmという課題に関連しています。
小動物モデルは、疾患の進行の理解を改善するのにも同様に予後バイオマーカーおよび新規な化学療法又は併用療法アプローチのテストの同定卵巣癌研究における有用性が証明されています。プライマリとして卵巣癌の発生率および転移の部位が腹腔で、EOC転移の同所性モデルは、腹腔内疾患の分析および特徴づけを伴います。画像腫瘍細胞の能力における最近の改善がなされているが、単一細胞レベルで、まだEOCの転移性腫瘍量を定量化において著しい困難が存在します。これらの課題は数、サイズおよび転移性病変の解剖学的位置に起因し発生します。さらに、正常な宿主細胞と区別するために、癌細胞を標識する必要性が存在します。以前の研究では、抗体ベースの標識プロトコール又はルシフェラーゼ8,9による腫瘍細胞のトランスフェクションを利用しています。癌細胞の直接の蛍光標識は、最初に1997年10で千島および共同研究者によって報告された。蛍光標識は、外因性基質の添加を必要と絶妙な腫瘍細胞特異性を提供する、癌転移11,12を追跡するためのより効果的な手段を提供しません。
本明細書において、我々は、マウスID8卵巣癌細胞13免疫コンピテントC57 / BL6マウスに赤色蛍光タンパク質(RFP)からなる同系同所性異種移植片モデルを使用して、転移性疾患の定量分析のための光学撮像方法-タグ説明します。私たちは、組織の自家蛍光を除去しながら撮影を生体内で組み合わせ、ex vivoでの相対的腫瘍量の定量化の新規な方法を示しています。この手法は、卵巣癌の臓器特異的な転移に特異的な遺伝子、エピジェネティックなまたは微小環境の改変および/または治療法の効果を評価するために設計された研究において潜在的な有用性を有します。
プロトコル
すべてのin vivo試験は、ノートルダム動物実験委員会の大学によって承認され、雌のC57 / BL6Jマウスを用いました。
1.マウス卵巣癌細胞の培養
- 次のようにID8マウス卵巣癌細胞培養培地を作る:4%ウシ胎児血清(FBS)、1%ペニシリン/ストレプトマイシン、5μg/ mlのインスリン、5μg/ mlのトランスフェリンを補充したダルベッコ改変イーグル培地(DMEM)の1 Lおよび5 ngの/ mlの亜セレン酸ナトリウム。
- RFPおよび選択マーカー(遺伝子ブラスチシジン)を発現する、商業的に調達するレンチウイルス粒子を用いた赤色蛍光タンパク質(RFP)を発現するID8マウス卵巣癌細胞13に伝達します。緑色蛍光タンパク質を用いることができるが、より弱い蛍光シグナルを提供します。
- 直前伝達に、培養細胞50 - 70%、最終1ミリリットルポリブレン(5μg/ mlのを含んで合流し、(ペニシリン/ストレプトマイシンなし)新鮮な培地を追加濃度)。
- 静かにピペットRFP-レンチウイルス(20μl)をシャーレに滴下し、72時間、37 O Cでインキュベートします。培地を除去し、24時間新鮮な培地で培養します。培地(5μg/ mlの)にブラストサイジンを添加することにより形質導入された細胞の選択を開始し、蛍光顕微鏡( 図1.)を用いて赤血球を監視します。
- 文化の組織培養皿に約10 6個の細胞を播種し、細胞単層がコンフルエントになるまで、光学顕微鏡を用いて毎日可視化することにより、ID8媒体におけるRFPタグ付き細胞。
- ときにコンフルエントは、トリプシン(0.25%、3分)を使用して細胞を採取し、細胞が分離されるまで、37°C のインキュベーターにフラスコを返します。
- 血清を含むID8培地を6 mlのトリプシンを中和します。アップピペットと皿の底に対して下落し、15ミリリットルコニカルチューブに移します。 2分間1,200rpmで遠心分離し、その後、GLを使用して、培地を吸引お尻ピペット。
- 優しく温かいPBS 6mlに再懸濁し、上記1.5のように遠心分離することにより、リン酸緩衝生理食塩水(PBS)で細胞を洗浄。 5×10 6細胞/ mlの最終濃度になるようにPBSに再懸濁します。注射まで暖かい細胞(37 O C)を保管してください。
2.腹腔内ID8細胞の注入およびin vivoイメージングで
- 腹腔内(IP)注射を介して、1000万個の細胞の合計のための暖かいID8-PBS溶液2mLで各マウスに注入します。腫瘍細胞は毎週ライブイメージングで約10週間のためにin vivoで成長させます。
- すぐに(0.5リットル/分のO 2流量で2.5%流量)イソフルランを用いて、各マウスを麻酔後、マウスの重量を量ると、その後の注射と毎週以下。注:マウスはない腫瘍負荷の定量的尺度ではなく、研究を通して、個々のマウスの物理的な進行のより一般的な対策として、秤量しました。マウスは、重量を量りますTSは、自分の前の重み値と比較しました。
- イソフルランチャンバー内に配置することにより、マウスを麻酔。手順全体で2.5%の流量イソフルランへの曝露のためにノーズコーンにマウスの頭部を配置することによって、スキャン中に一定の麻酔を維持します。
- 黒い髪は、蛍光信号の減衰の原因となるよう、各マウスの胴体と腹部の毛を除去するために、脱毛クリームを使用してください。マウスは、脱毛クリームの適用後に温水で浸し、室温でペーパータオルで乾燥させます。
- 麻酔をかけながら、小動物撮像光学系を用いて、各マウスの全身をスキャンします。各時点で、コホート内のすべてのマウスをスキャンします。次の2段階のプロトコル ( 図2A)を使用します。
- ステップ1で、440nmで、460nmで、4の励起フィルタを用いて5画像の合計を収集するためにマルチスペクトル取得を実行し、蛍光標識(RFP)腫瘍細胞を観察し80 nmで、520 nmおよび540 nmであり、600nmでの発光フィルター。 15秒の標準的な露出、2×2ビニング、160ミリメートルのFOV、および1.1のF ストップ :次の取得パラメータを使用します。
- 全動物を観察するステップ2では、オープン励起フィルター(白色光)、オープン発光フィルター、2×2ビニングおよび16 cmとFOVと0.2秒の標準的な露出を使用して反射画像を取得します。注:実際の撮影時間は約1分です。
3.マウスの解剖と画像取得
- ライブイメージングは、腹水の広範な腹腔内疾患や動物展示蓄積(腹部膨満によって証明されるように)の存在を示し、体重の減少または増加20%以上、無気力や苦痛の他の徴候た場合、CO 2を用いて、各マウスを安楽死させます麻酔は、頸椎脱臼が続きます。
- 尖ったdissectioを使用して、マウスの腹側正中線に沿って前方に皮膚をカットn個のはさみ、胸郭の下に太ももの上から。スキン層のみ( 図2BI)を切断するために細心の注意を払ってください。静かに腹膜壁に穴を開けないようにしてくださいされ、腹膜組織から皮膚を分離します。
- 尖った解剖ハサミを使用して、皮膚の2つのフラップを作成するには、両方の胸郭の底部と太も もの上部に沿って横方向に切断した ( 図2B II、III)。
- 皮膚弁が開いて引っ張られ、小動物の光学イメージングシステム( 図3A、B)を使用して、 その場でその臓器で各マウスをスキャンして、その腹側(下向き腹膜腔)に各マウスを置きます。
- 2.4.1.-2.4.2で説明したのと同様の画像取得パラメータを使用します。
- 肝臓、網/膵臓、胃、絞り、小腸、大腸、左右腹膜、卵巣、kidne含む個々の腹腔の器官を抽出することにより、マウスを解剖続けますYS、腸間膜脂肪パッド。
- 観察し、列挙し、各臓器に目に見える腫瘍を記録します。各腫瘍の直径を測定するためにキャリパーを使用します。
- 媒体として2と5ミリメートルと同じ大きさ5mm以上の間に、 小さなとして、直径2ミリメートルよりも腫瘍が少なく指定します。
- 各器官のための所定の位置を特定する臓器スキャンテンプレート ( 図4)に臓器を置きます。湿った臓器を維持するためにPBSを使用してください。
- 小動物の光イメージングシステム( 図3C、D)を用いて、臓器の各シートをスキャンします。
- ステップ2.4で説明したのと同じ画像取得パラメータを使用します。
- スキャンした後、10%ホルムアルデヒドで場所器官は、組織学のために、その後の処理を可能にします。
目における腫瘍量の4定量電子蛍光画像
- 各マルチスペクトル走査において自家蛍光の量を低減するために、第一の小動物イメージングシステムで使用可能なソフトウェアを使用してファイルをunmix。
- インビボでのスペクトルファイルで 、Autofluor続い:最初のRFPロード未撹拌画像ウィンドウにおけるインビボレッドファイルでをし、Unmixを選択します。
- 16ビット.TIFF(スケーリングされていない)形式として.bipファイルをエクスポートします。
- ( その場での臓器とのex vivoでの器官、その後、完全なマウス本体)ImageJソフトウェアを使用してください。
- ImageJので臓器スキャンテンプレートファイルの16ビットの.tiffファイルを開くために>ファイルを開くを使用してください。
- 画像の下に>、>明るさ/コントラストを調整して 最小値を 0に表示され 、 最大値は 35353に値を表示した後で設定することを選択します画像>ルックアップテーブルは 、 レッドホットを選択します。注:様々な動物モデルが異なる輝度レベルが必要になりますが、与えられた研究を通して一貫明るさを保つことが重要です。
- フリーハンド選択ツールを使用して、各臓器の周りの関心の選択(ROI)のフリーフォーム領域を描き、各臓器の表面積を計算するために、 測定ツール (CTRL + M)を使用します。スプレッドシートの各臓器の表面積を記録。
- 各臓器の周りに描かれたROIと、右ROI内でクリックして、唯一の臓器が含まれるように重複を選択します。
- しきい値>調整>画像の下に、個々の臓器を見ながら、ONL選択するために、+ 1200の下位閾値レベルと+ 1700の上限閾値レベルに画像のしきい値を設定することを選択しますyの最も明るい蛍光を発する領域と暗い背景を選択するためにチェックしてください。 [OK]を選択します。注:上記のように、以前に最も明るい領域は、分析工程のために選択されるように画像がImageJの中のしきい値スライダーの手動操作が必要な場合があります。種々の疾患モデルは、異なる閾値の制約が必要となるが、与えられた試験を通して一貫性の閾値レベルを維持することが重要です。
- 分析の下で> サイズを変更し 、 粒子の分析 (ピクセル^ 2)10 -インフィニティには、 表示に選択します 。 アウトライン 、唯一の「結果の表示」を選択し、地域とこれらの明るい領域の生の統合密度の両方を測定するために[OK]をクリックし確認してください、みなさ腫瘍。
- 表面積の値とに表示される各腫瘍選択の生統合密度を記録臓器表面領域を含む同じスプレッドシート内の結果テーブル。
- 分析>ツールの下に>キャリブレーションバーは 、臓器の画像にキャリブレーションスケールバーを追加します。注:この例では、これは白に黒、 ラベルカラーに右上 、 塗りつぶしの色に場所を変更することで行われた、 ラベルの数 5に、0に小数点以下の桁数 、12にフォントサイズやズーム 4.0と太字テキストを有効にする要因 。
- ... 名前を付けて保存]> [ファイルの下で、.TIFFと.JPEGとしてモンタージュを保存します。
- 臓器の.JPEGファイルを開くことがファイルを開く>を使用し 、[ 挿入]> [テキストボックスの下に、臓器の3行のそれぞれの下のテキストボックスを作成することにより、臓器ラベルを追加します。
- マウス番号順にImageJの中の全身スキャンの16ビットの.tiffの各ファイルを開くことが[ファイル]> [開く]を使用してください。
- イメージ>調整>明るさ/コントラストの下では、 最小値を 0に表示され 、 最大は + 35353に値を表示してからイメージ>ルックアップテーブルの下に設定 レッドホットを選択すること。
- [ファイル]> [名前を付けて保存 ]の下...、。 ティフや.JPEGなどのモンタージュを保存します。
5.データ解析
- 各マウスの各臓器のために、それぞれ、腫瘍選択領域と生の統合密度を追加し、各マウスの総臓器腫瘍領域を記録します。
- 記録領域と生integratを正規化対応する臓器の表面積( 表1)により、総腫瘍面積と総生集積密度の値を分割して各臓器のサイズED濃度値。
- 正規化された腫瘍の表面積及び正規化生の統合された濃度値( 図5A、B)の両方の平均を計算し、プロットします。
- 視覚的に転移性病変に対する各臓器の検査時に肉眼で見えた腫瘍をカウントしたものに、これらの平均値を比較します。
結果
卵巣癌の転移機構は、複数の小さい(<2ミリメートル)の病変を含め、種々のサイズの多数の病変からなる高度に拡散腹腔内転移によって特徴付けられます。したがって、RFP標識腫瘍細胞の使用( 図1)と光学イメージングは、手動の計数および病変サイズの測定に代わる方法を提供します。経時的な腫瘍量の進展は、毎週の腹水の潜在的な存在を評価するためにマウスおよび腹囲の測定を秤量することによって決定することができる。 インビボ光学イメージングは、腫瘍負荷( 図2)を評価するための補完的なアプローチを提供します。卵巣癌は、腹腔内の複数の部位に転移し、サイト固有の転移の分子ドライバは現時点では不明です。全体の腫瘍負荷の決意に加えて、次の犠牲注意深く切開は、部位特異的PAを評価し、定量化するために行うことができます転移のtterns。したがって、個々の器官のex vivoでの評価( 図3C、D)と組み合わせてその場で腹膜臓器( 図3A、B)の光学イメージングは、全体的な対臓器特異的腫瘍量に関する有用なデータを提供することができます。 図3に示すスキャンは、腫瘍負荷の程度を変化させて、マウスの腹腔内および個々の器官をスキャンした結果を表します。信号に有意な差が見られるマウスB、( 図3D)のものと同じ臓器と比較した場合、例えば、 図3Cは、大網/膵臓、卵巣およびマウスAの腸間膜の中で最も腫瘍負荷を示しています。臓器走査テンプレート( 図4)を使用することは、臓器特異的腫瘍負荷の同定に役立ちます。差動腫瘍負荷の観察は、腫瘍面積および腫瘍シグナル強度( 表1、図5)の観点から定量的の両方が確認されています。
これらの図と表に示した結果は、任意の偽陽性シグナルを避けるために0 35353 +のように、の最小値と最大表示範囲を用いて分析しましたそして、自家蛍光は、組織ではオフに与えられました。 図2および図3に見られる信号の様々な程度を撮像し、この方法を使用して定量化することができる腫瘍負荷の広い範囲を示します。 表1のデータは、両方の腫瘍表面積および腫瘍のシグナル強度を定量化に適用可能なこの広い範囲を示しています。マウスBに比べてマウスAの網/膵臓で見たときに、例えば、正規化された腫瘍の表面積はさらに、信号強度の大きな範囲も網におけるマウスBよりもマウスAで26倍に例示されています/マウスAとBの膵臓;マウスAの正規化された生の集積密度は、これらの結果は、compariの有効性を実証するマウスBのそれよりも56倍大きいですいくつかの試験の腫瘍量をngのは、さらなる組織学的分析を必要としない、この迅速な方法を使用して、腫瘍面積および腫瘍シグナル強度の両方の点で、互いに対して施します。
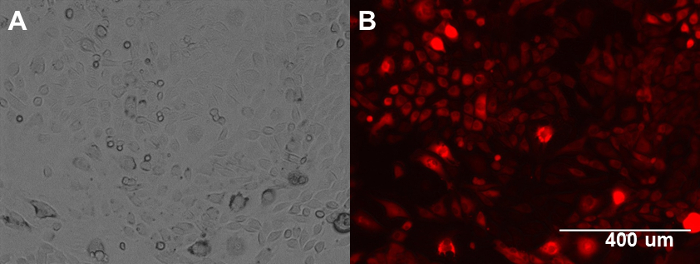
ID8細胞の図1. ID8マウス卵巣癌細胞エクスプレスRFP。(A)位相画像。(B)ID8細胞の蛍光画像。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2. 腹腔内腫瘍量とC56 / BL6マウスのライブ光イメージング。(A)脱毛クリームは海を除去するために使用しましたスキャンする前に、マウスの腹側表面からrの。最初の腹側正中線と横方向の切開部を示す(B)図。 この図の拡大版をご覧になるにはこちらをクリックしてください。

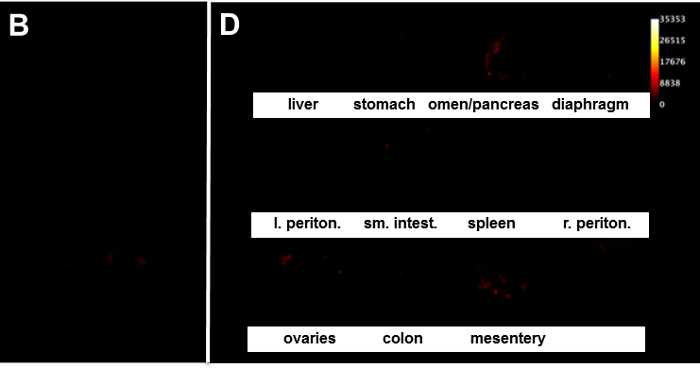
図3。 腹腔内腫瘍量のエンドポイントスキャン 。(A、B)マウスは、最初のマウスの腹側表面の開口部以下のその場 (腹側を下) にある器官で画像化されている。個々の器官の(C、D)イメージングを。各器官は、解剖視覚腫瘍負荷を記録し、分析のために臓器走査テンプレート上に配置されます。ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
4. オルガンスキャンテンプレート図 。解剖器官は、走査中に個々の器官の位置の識別を維持するために、臓器走査テンプレート上に配置されます。
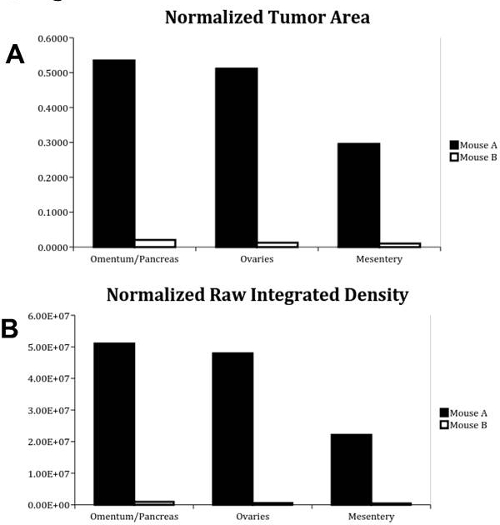
。プロトコルに記載のように、 表1に示すように、 大網/膵臓、卵巣および腸間膜データについては、図5正規化された定量データを分析したマウスAは、パネル(a)に走査マウスを指します。マウスBは、パネル3Bにスキャンマウスを意味する。(A)正規化された腫瘍面積。これら三つの器官の蛍光シグナルの定量分析は、比で行い、定量しました両方のマウスについての全臓器表面積(B)正規化された生の集積密度の腫瘍表面積。これら三つの器官の蛍光信号の定量分析が行われ、両方のマウスについての全器官表面積生集積密度の比で定量化しました。
| 大網/膵臓 | |||
| 正規化された腫瘍領域 | 正規化された生の集積密度 | ||
| マウスA | 0.5346 | 5.11E + 07 | |
| マウスB | 0.0203 | 8.97E + 05 | |
| 卵巣 | |||
| 正規化された腫瘍領域 | 正規化された生の集積密度 | ||
| マウスA | 4.79E + 07 | ||
| マウスB | 0.0123 | 5.62E + 05 | |
| 腸間膜 | |||
| 正規化された腫瘍領域 | 正規化された生の集積密度 | ||
| マウスA | 0.2951 | 2.22E + 07 | |
| マウスB | 0.0098 | 4.15E + 05 | |
表1.正規化腫瘍面積と正規化された生マウスAとマウスBのポスト解剖とスキャンの両方の大網/膵臓、卵巣および腸間膜における統合密度値、各臓器は、全臓器の表面積に対する腫瘍領域の割合との強度を決定するためにセグメント化し、その蛍光を定量化しましたこれらの腫瘍領域についての蛍光。それらは正と負の両方の対照群内の最も強い蛍光シグナルを有していたとして大網/膵臓、卵巣及び腸間膜を選択しました。
ディスカッション
免疫不全マウスで実施されなければならない、ヒト卵巣癌細胞を用いた研究とは対照的に、上述のプロトコルは、免疫C57 / BL6マウスおよび同系マウスの卵巣癌細胞を利用します。これは、腫瘍の進行および転移における免疫浸潤の潜在的な役割の評価を可能にしながら、腹部の表面に黒い髪の存在は、撮像感度が低いレンダリングします。撮像前に毛を除去する脱毛剤の使用は、画像取得を向上させるが、特に長手方向の撮影を必要とする実験のために、時間がかかります。ヘアレス「ヌード」マウスは、このプロトコルで使用することができ、脱毛ベースの脱毛を必要としません。さらに、ヌードマウスは、機能する免疫系を欠いているので、また、免疫系の寄与を分析中であることを特徴とした実験に、ヒト卵巣癌細胞の増殖を評価するために利用することができます。
またintraperの深さということに留意すべきです光学的蛍光イメージングは、一般的に5ミリメートルよりも大きな深さで腫瘍を検出しませんようitoneal腫瘍はまた、技術的な課題を提示します。さらに、腹水の罹患率及び腹水腫瘍細胞の存在は、さらなる合併症を提供します。我々は、同じ細胞株を注射した場合でも、腹水の形成に重要なマウス・ツー・マウスの変動を観察しました。したがって腹水の存在下で、この方法は、エンドポイントの器官特異的腫瘍量の分析ではなく、進行のルーチン長手イメージングのために好適です。現在のケースでは、腫瘍負荷の劇的な変化は、4 5匹のマウスのコホートは、通常、統計分析のために十分となるように、例えばマウスの間で注目されました。腫瘍負荷が少なく劇的な違いの場合には、追加の実験対象は、統計的検出力に到達するために必要とされます。本明細書に示された例は、腫瘍容積が有意に異なるが、光学蛍光イメージングをするために使用することができます臓器特異的腫瘍負荷の非常に小さい差異を検出、(図示しない)小さな病変の重量またはノギスベースの測定と比較した場合に特に.Resolution及び感度は細胞系及び撮像システムによって変化します。本発明の場合、直径が400ミクロンほどの小さな転移性インプラントは分解し、定量化することができます。造影コンピュータ断層撮影(CT)、磁気共鳴(MR)イメージング、陽電子放射断層撮影(PET)などの別の方法は、長手方向の撮像14,15について記載されています。組み合わせ解剖学的および機能的イメージングを含むモダリティが開発16の下にも記載されています。
腫瘍負荷の定量化のためのこの提案された方法に関しては、蛍光閾値[ステップ4.3.5。]の決意は、器官の画像に見られる蛍光の強度に基づいていることに留意すべきである[ステップ4.3.2。]そしてrelat唯一の最も蛍光領域を含むように、ユーザによって選択されています臓器の残りの部分にアイブ。変化閾値は、この研究で使用される最終的な閾値を決定する前に、分析に使用しました。決定されると、これらの同じしきい値は、研究者によって行われた初期の視覚的分析により、転移性組織とみなされるものの定量化の一貫性を確保するために、分析あらゆる臓器のために使用しました。これらのしきい値の決意は、手順における重要なステップであり、潜在的に、個々の研究者によって決定される他の1つのプロジェクトごとに異なる可能性があります。この場合、大きな下限しきい値のみ最高強度の蛍光シグナルを捕捉するように使用されました。分析対象のすべての臓器のために、この同じ閾値を使用することにより、分析し、その結果は、マウスのこのコホートの文脈の中で比較定量的な結果を提供します。この方法は、腫瘍面積の絶対値の定量化が制限されるが、それは、同じAの間の相対的な正規化された腫瘍量を比較する研究者の能力ができNDマウスのコホート内の異なる器官。このアプローチは肉眼で見えない腫瘍の定量化を含むことに留意すべきです。
技術的に困難な最適な腫瘍減量手術をレンダリング、複数の組織や臓器に関わる広く普及腹腔内癌腫症におけるEOC結果のユニークな転移メカニズム。完全な細胞減少は正に全生存率と相関するように、腹腔内転移を戦うための新しい治療戦略の開発が保証されることになります。治療効果の評価は、しかし、臓器特異転移の評価を含む腫瘍量の正確な定量、に依存しています。慎重にex vivoでの臓器イメージングと組み合わせた臓器自家蛍光について補正し、その場で RFPタグ化腫瘍細胞の光学イメージングを使用して、我々は腹腔内臓器特異的腫瘍負荷を定量化する手法を開発しました。興味深いことに、我々の分析は示していますこのモデルにおける転移の好ましい部位は、腫瘍負荷/面積によって定義されるように、卵巣癌(網、卵巣、小腸、腸間膜)2,4,5の女性に見られるものと同様です。したがって、このアプローチは、転移性疾患を標的とするように設計された実験的な治療薬の評価に将来の有用性を有するべきです。
開示事項
この記事では、ブルカー・バイオスピン主催のマルチモーダル前臨床イメージングに特別な問題の一部です。
謝辞
This research was supported by research grants RO1CA109545 and RO1CA086984 to M.S.S. by the National Institutes of Health/National Cancer Institute and by an award from the Leo and Ann Albert Charitable Trust (to M.S.S.).
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium | Corning | 10-014-CM | |
| Fetal bovine serum | Gibco | 10437-028 | |
| penicillin/streptomycin | |||
| Insulin-transferrin-sodium selenite media supplement | Sigma | I-1884 | |
| Bruker Xtreme small animal imaging system | Bruker Corp. | ||
| Bruker Multispectral software | Bruker Corp | ||
| lentiviral particles with Red fluorescent protein | GenTarget, Inc. | LVP023 | |
| trypsin for cell culture | Corning | 25-053-CI | |
| PBS | Corning | 21-040-CM | |
| depilatory cream (such as Nair Hair Remover Lotion) | purchases from drugstore | n/a | |
| ImageJ software | http://imagej.nih.gov/ij/ | free download | |
| dissecting tools (forceps) | Roboz Surgical Instrument | RS 5130 | |
| dissecting tools (Scissors) | Roboz Surgical Instrument | RS 5910 |
参考文献
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Halkia, E., Spiliotis, J., Sugarbaker, P. Diagnosis and management of peritoneal metastases from ovarian cancer. Gastroenterology Research and Practice. 2012, 541842-541854 (2012).
- Barbolina, M. V., et al. Microenvironmental regulation of ovarian cancer metastasis. Cancer Treatment and Research. 149, 319-334 (2009).
- Lengyel, E., et al. Epithelial ovarian cancer experimental models. Oncogene. 33 (28), 3619-3633 (2014).
- Harter, P., duBois, A. The role of surgery in ovarian cancer with special emphasis on cytoreductive surgery for recurrence. Current Opinion in Oncology. 17 (5), 505-514 (2005).
- Bristow, R. E., Puri, I., Chi, D. S. Cytoreductive surgery for recurrent ovarian cancer: a meta-analysis. Gynecologic Oncology. 112 (1), 265-274 (2009).
- Hoffman, R. M. In vivo imaging of metastatic cancer with fluorescent proteins. Cell Death and Differentiation. 9, 786-789 (2002).
- Sweeney, T. J., et al. Visualizing the kinetics of tumor-cell clearance in living animals. Proceedings of the National Academy of Science USA. 96, 12044-12049 (1999).
- Chishima, T., et al. Cancer invasion and micrometastasis visualized in live tissue by green fluorescent protein expression. Cancer Research. 57, 2042-2047 (1997).
- Bouvet, M., et al. Real-time optical imaging of primary tumor growth and multiple metastatic events in a pancreatic cancer orthotopic model. Cancer Research. 62, 1534-1540 (2002).
- Hoffman, R. M. The Multiples Uses of Fluorescent Proteins to Visualize Cancer in vivo. Nature Reviews. 5, 796-806 (2005).
- Roby, K. F., et al. Development of a syngeneic mouse model for events related to ovarian cancer. Carcinogenesis. 21 (4), 585-591 (2000).
- Rampurwala, M., Ravoori, M. K., Wei, W., Johnson, V. E., Vikram, R., Kundra, V. Visualization and quantification of intraperitoneal tumors by in vivo computed tomography using negative contrast enhancement strategy in a mouse model of ovarian cancer. Translational Oncology. 2 (2), 96-106 (2009).
- Kim, T. J., et al. Antitumor and antivascular effects of AVE8062 in ovarian carcinoma. Cancer Research. 67, 9337-9345 (2007).
- Picchio, M., et al. Advanced ovarian carcinoma: usefulness of [(18)F]FDG-PET in combination with CT for lesion detection after primary treatment. Quarterly Journal of Nuclear Medicine. 47, 77-84 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved