Method Article
La cuantificación de la intra-peritoneal del cáncer ovárico Metástasis
* Estos autores han contribuido por igual
En este artículo
Resumen
Ovarian cancer metastasis is characterized by numerous diffuse intra-peritoneal lesions, such that accurate visual quantitation of tumor burden is challenging. Herein we describe a method for in situ and ex vivo quantitation of metastatic tumor burden using red fluorescent protein (RFP)-labeled tumor cells and optical imaging.
Resumen
Epithelial ovarian cancer (EOC) is the leading cause of death from gynecologic malignancy in the United States. Mortality is due to diagnosis of 75% of women with late stage disease, when metastasis is already present. EOC is characterized by diffuse and widely disseminated intra-peritoneal metastasis. Cells shed from the primary tumor anchor in the mesothelium that lines the peritoneal cavity as well as in the omentum, resulting in multi-focal metastasis, often in the presence of peritoneal ascites. Efforts in our laboratory are directed at a more detailed understanding of factors that regulate EOC metastatic success. However, quantifying metastatic tumor burden represents a significant technical challenge due to the large number, small size and broad distribution of lesions throughout the peritoneum. Herein we describe a method for analysis of EOC metastasis using cells labeled with red fluorescent protein (RFP) coupled with in vivo multispectral imaging. Following intra-peritoneal injection of RFP-labelled tumor cells, mice are imaged weekly until time of sacrifice. At this time, the peritoneal cavity is surgically exposed and organs are imaged in situ. Dissected organs are then placed on a labeled transparent template and imaged ex vivo. Removal of tissue auto-fluorescence during image processing using multispectral unmixing enables accurate quantitation of relative tumor burden. This method has utility in a variety of applications including therapeutic studies to evaluate compounds that may inhibit metastasis and thereby improve overall survival.
Introducción
Cáncer de ovario epitelial (EOC) es la causa más común de muerte por neoplasia ginecológica, con un estimado de 21.290 nuevos diagnósticos en los EE.UU. en 2015 y un estimado de 14.180 muertes 1. La gran mayoría (> 75%) de las mujeres son diagnosticadas con enfermedad en etapa tardía (estadio III o IV) caracteriza por metástasis difusa intra-peritoneal y mal pronóstico. Recurrencia de la enfermedad en la cavidad peritoneal después de la quimioterapia de primera línea también es común y representa una causa importante de mortalidad 2,3. EOC metástasis por un mecanismo único que implica tanto la extensión directa del tumor primario a los órganos peritoneales vecinos, así como por la disociación o desprendimiento de las células de la superficie del tumor primario como células individuales o agregados multicelulares. Las células se desprenden en la cavidad peritoneal, en el que se resisten a la apoptosis inducida por el desprendimiento-4. La acumulación de ascitis peritoneal es común, como las células tumorales arrojar bloquean el drenaje linfático peritoneal y tumors producen factores de crecimiento que alteran la permeabilidad vascular. Una parte de las células tumorales cobertizo se adhieren a la superficie de los órganos peritoneales y estructuras, incluyendo el intestino, el hígado, epiplón y mesenterio, después de lo cual se anclan y proliferan para producir múltiples lesiones secundarias ampliamente difundidos 3,5. metástasis hematógena es infrecuente. Por lo tanto, el manejo clínico consiste comúnmente de la cirugía citorreductora incluyendo "citorreducción óptima", definida como la resección de todo el tumor visible (no importa cuán pequeño). Citorreducción completa se asocia con un aumento significativo en la supervivencia global 6,7 y se asocia con el reto de la identificación y eliminación de las lesiones <0,5 cm.
los pequeños modelos animales han demostrado utilidad en la investigación del cáncer de ovario en la mejora de nuestra comprensión de la evolución de la enfermedad, así como en la identificación de biomarcadores pronósticos y ensayo de nuevas quimioterapias o aproximaciones de la terapia de combinación. A medida que la primariasitio de la incidencia de cáncer de ovario y de la metástasis es la cavidad peritoneal, modelos ortotópico de EOC metástasis implica el análisis y caracterización de la enfermedad intraperitoneal. Aunque ha habido recientes mejoras en la capacidad de las células tumorales de imagen, incluso a nivel de células individuales, aún existen dificultades significativas en la cuantificación de la carga tumoral metastásica del COE. Estos retos surgen debido a la cantidad, el tamaño y la localización anatómica de las lesiones metastásicas. Además existe una necesidad de células de cáncer de etiqueta para distinguirlas de las células huésped normales. Estudios anteriores han utilizado protocolos de etiquetado a base de anticuerpos o transfección de células tumorales con 8,9 luciferasa. El marcaje fluorescente directa de las células cancerosas se informó por primera vez por Chishima y compañeros de trabajo en 1997 10. Los marcadores fluorescentes no requieren la adición de sustrato exógeno y proporcionan exquisita especificidad de las células tumorales, proporcionando un medio más eficaz para rastrear la metástasis del cáncer 11,12 .
Aquí se describe un método de formación de imágenes ópticas para el análisis cuantitativo de la enfermedad metastásica utilizando un modelo de xenoinjerto ortotópico singénico compuesto por proteína fluorescente roja (RFP)-etiquetados murino ID8 células de cáncer de ovario 13 y C57 / BL6 ratones inmunocompetentes. Se demuestra un nuevo método de cuantificación relativa de la carga tumoral combinando in vivo y ex vivo de formación de imágenes con la eliminación de tejido auto-fluorescencia. Este enfoque tiene utilidad potencial en estudios diseñados para evaluar el efecto de específico genética, epigenéticos o micro-ambientales modificaciones y / o modalidades de tratamiento en la metástasis de órganos específicos de cáncer de ovario.
Protocolo
Todos los estudios in vivo fueron aprobados por la Universidad de Notre Dame Cuidado de Animales y el empleo Comisión y utilizaron ratones C57 / BL6J femeninos.
1. Cultivo de células murino cáncer de ovario
- Hacer que el medio de cultivo ID8 murino de ovario de células de cáncer de la siguiente manera: 1 L de de Eagle modificado por Dulbecco (DMEM) suplementado con 4% de suero bovino fetal (FBS), 1% penicilina / estreptomicina, 5 mg / ml de insulina, 5 mg / ml de transferrina y 5 ng / ml selenito de sodio.
- Transducir ID8 células de cáncer de ovario murino 13 para expresar la proteína roja fluorescente (RFP) utilizando partículas lentiviral adquiridos comercialmente que expresan RFP y un marcador de selección (gen blasticidin). Tenga en cuenta que la proteína fluorescente verde se puede utilizar, pero proporciona una señal de fluorescencia más débiles.
- Inmediatamente antes de la transducción, las células de cultivo de 50 - 70% de confluencia y añadir medio fresco (sin penicilina / estreptomicina) que incluye 1 ml de polibreno (5 mg / ml finalconcentración).
- Suavemente la pipeta RFP-lentivirus (20 l) gota a gota en el plato y se incuba a 37 ° C durante 72 horas. Retire medio y se incuban con medio fresco durante 24 horas. Comience la selección de células transducidas mediante la adición de blasticidin al medio de cultivo (5 g / ml) y monitorear de células rojas usando microscopía de fluorescencia (Figura 1).
- Cultivar las células RFP-etiquetados en medio ID8 por la siembra de aproximadamente 10 6 células en una placa de cultivo de tejidos y la visualización de todos los días usando un microscopio de luz hasta que la monocapa de células confluentes es.
- Cuando confluentes, cosechar las células utilizando tripsina (0,25%, 3 min) y regresar el matraz al 37 ° C incubadora hasta se separan las células.
- Neutralizar la tripsina con 6 ml de medio de cultivo que contiene suero ID8. Pipetear arriba y abajo contra la parte inferior del plato, a continuación, transferir a un tubo cónico de 15 ml. Centrifugar a 1200 rpm durante 2 min, a continuación, aspirar el medio utilizando un glpipeta culo.
- Lavar las células con solución salina tamponada con fosfato (PBS) resuspendiendo suavemente en 6 ml PBS caliente y centrifugando como en 1.5 anteriormente. Vuelva a suspender en PBS hasta una concentración final de 5 x 10 6 células / ml. Mantenga las celdas calientes (37 ° C) hasta la inyección.
2. intra-peritoneal inyección de células ID8 imagen in vivo y
- Inyectar cada ratón con 2 ml de la solución caliente ID8-PBS durante un total de 10 millones de células a través de la inyección intra-peritoneal (ip). Permiten que las células tumorales que crecen in vivo durante aproximadamente 10 semanas, con imágenes en vivo semanalmente.
- Inmediatamente después de la inyección y cada semana a partir de entonces, pesan los ratones y luego anestesiar cada ratón utilizando isofluorano (velocidad de flujo de 2,5% en / min O flujo de 0,5 L 2). Nota: Los ratones se pesaron, y no como una medida cuantitativa de la carga tumoral, sino más bien una medida más general de la progresión física ratón individual durante todo el estudio. Los ratones pesanTS se compararon con sus propios valores de los pesos anteriores.
- Anestesiar a los ratones mediante la colocación de una cámara de isofluorano. Mantener la anestesia constante, mientras que la exploración mediante la colocación de la cabeza del ratón en la ojiva de la exposición a isofluorano caudal 2,5% durante todo el procedimiento.
- Use crema depilatoria para quitar el pelo en el torso y el abdomen de cada ratón, como el cabello negro hará que la atenuación de la señal de fluorescencia. Los ratones se bañan con agua tibia después de la aplicación de la crema depilatoria y se secaron con toallas de papel RT.
- Si bien anestesiado, escanear todo el cuerpo de cada ratón utilizando un pequeño sistema de imagen óptica animal. Analiza todos los ratones en una cohorte en cada momento. Utilizar el protocolo siguiente paso dos (Figura 2):
- En el paso 1, para observar las células tumorales marcadas con fluorescencia (RFP), ejecutar la adquisición multiespectral para recoger un total de 5 imágenes utilizando filtros de excitación de 440 nm, 460 nm, 480 nm, 520 nm y 540 nm, y un filtro de emisión de 600 nm. Utilice los siguientes parámetros de adquisición: una exposición estándar de 15 segundos, 2 x 2 binning, FOV de 160 mm, y la abertura F de 1,1.
- En el paso 2, para observar el animal entero, adquirir una imagen de reflectancia usando un filtro de excitación abierta (luz blanca), un filtro de emisión abierta, una exposición estándar de 0,2 segundos con 2 x 2 binning y un campo de visión de 16 cm. Nota: El tiempo de imagen real es ~ 1 min.
3. Ratón La disección y Adquisición de imágenes
- Cuando la imagen en vivo muestra la presencia de la enfermedad intra-peritoneal o animales extensa acumulación de exposiciones de la ascitis (como se evidencia por la distensión abdominal), la pérdida o ganancia de peso corporal superior a 20%, letargo u otros signos de angustia, la eutanasia de cada ratón utilizando CO 2 anestesia seguido por dislocación cervical.
- Cortar la piel anteriormente a lo largo de la línea media ventral del ratón, utilizando puntas dissection tijeras, desde la parte superior de los muslos de la parte inferior de la caja torácica. Tenga mucho cuidado al cortar a través de sólo la capa de la piel (Figura 2Bi). separar suavemente la piel del tejido peritoneal, asegurándose de no romper la pared peritoneal.
- Con unas tijeras de disección puntiagudas, cortados lateralmente tanto a lo largo de la parte inferior de la caja torácica y la parte superior de los muslos para crear dos colgajos de piel (Figura 2B ii, iii).
- Colocar cada ratón en su lado ventral (cavidad peritoneal mirando hacia abajo) con los colgajos de piel abrió y escanear cada ratón con sus órganos in situ utilizando el pequeño sistema de formación de imágenes ópticas de los animales (Figura 3A, B).
- Utilizar los mismos parámetros de adquisición de imágenes como se describe en 2.4.1.-2.4.2.
- Continuar la disección del ratón mediante la extracción de órganos peritoneales individuales incluyendo el hígado, epiplón / páncreas, estómago, diafragma, intestino delgado, intestino grueso, izquierda y derecha peritoneo, ovarios, kidneys, mesenterio y la almohadilla de grasa.
- Observar, enumerar y registrar los tumores visibles en cada órgano. Utilice un calibre para medir el diámetro de cada tumor.
- Designar los tumores de menos de 2 mm de diámetro tan pequeño, en entre 2 y 5 mm como medio y superior a 5 mm de grande.
- Colocar los órganos en la plantilla de exploración de órganos (Figura 4) que identifica una posición predeterminada para cada órgano. Utilice PBS para mantener los órganos húmedo.
- Analiza cada hoja de órganos utilizando el pequeño sistema de formación de imágenes ópticas de los animales (Figura 3 C, D).
- Utilizar los mismos parámetros de adquisición de imágenes como se describe en el paso 2.4.
- Después de la exploración, lugar órganos en formol al 10% para permitir el tratamiento posterior para la histología.
4. La cuantificación de la carga tumoral en THImágenes de fluorescencia de correo
- Con el fin de reducir la cantidad de auto-fluorescencia en cada exploración multiespectral, primero unmix los archivos usando software disponible con el sistema de imagen pequeña animal.
- Cargar en primer lugar la solicitud de ofertas: En Vivo ficha espectral, seguido por el Autofluor: En Vivo archivo de rojo en la ventana Imágenes sin mezclar y seleccione Deshacer mezcla.
- Exportar los archivos .bip como formato de 16 bits .tiff (sin escala).
- Utilice el software ImageJ (ex vivo órganos y luego el cuerpo completo del ratón con órganos in situ).
- Utilice Archivo> Abrir para abrir los archivos .tiff 16 bits de los archivos de plantilla de exploración de órganos en ImageJ.
- Bajo Imagen> Ajustar> Brillo / Contraste, optar por establecer el mínimo valor visualizado a 0 y el máximo valor visualizado a 35.353 y luego bajoImagen> tablas de búsqueda, seleccionar candente. Nota: Los distintos modelos animales se requieren diferentes niveles de brillo, pero es importante para mantener el brillo constante a través de un estudio determinado.
- Con la herramienta Selección a mano alzada, dibujar una región de forma libre de la selección interés (ROI) alrededor de cada órgano y utilizar la herramienta Medición (CTRL + M) para calcular la superficie de cada órgano; grabar la superficie de cada órgano en una hoja de cálculo.
- Con el retorno de la inversión dibujado alrededor de cada órgano, haga clic derecho en el ROI y seleccione Duplicar para incluir sólo el órgano.
- Mientras observa el órgano individual, en virtud de Imagen> Ajustar> Umbral, optar por establecer el umbral de la imagen a un nivel inferior del umbral de + 1200 y un umbral de nivel superior de + 1700 para seleccionar ONLy las regiones más brillantes y fluorescentes de verificación para seleccionar el fondo oscuro; seleccione Aceptar. Nota: Las imágenes pueden requerir la manipulación manual de los controles deslizantes de umbral en ImageJ manera que las áreas más brillantes son seleccionados previamente para la etapa de análisis, como se muestra arriba. Diferentes modelos de enfermedad se requieren diferentes limitaciones de umbral, pero es importante para mantener los niveles de umbral consistentes a lo largo de un determinado estudio.
- Bajo Análisis> Análisis de Partículas, cambiar el tamaño (píxeles ^ 2) a 10-Infinity, optar por mostrar: contornos, comprobar para seleccionar sólo "Mostrar resultados" y haga clic en OK para medir tanto las áreas y densidades integradas primas de estas regiones brillantes, Los tumores que se consideren.
- Registre los valores de la zona de superficie y la densidad aparente Integrado de cada selección del tumor que aparece en el tabla de resultados en la misma hoja de cálculo con las superficies de órganos.
- Bajo Análisis> Herramientas> Calibración de bar, añadir una barra de escala de calibración de las imágenes de los órganos. Nota: En este ejemplo, esto se hace cambiando la ubicación de Arriba a la derecha, el color de relleno de Negro, la etiqueta de color al blanco, el número de etiquetas a 5, el número de decimales a 0, el tamaño de fuente a 12 y el zoom factor a 4.0 y que permite el texto en negrita.
- En Archivo> Guardar como ..., salvo el montaje como .tiff y .jpeg.
- Utilice Archivo> Abrir para abrir el archivo .jpeg de los órganos y luego en Insertar> Cuadro de texto , añadir etiquetas de órganos mediante la creación de un cuadro de texto por debajo de cada una de las tres filas de órganos.
- Utilice Archivo> Abrir para abrir cada uno de los archivos .tiff 16 bits de los escáneres de cuerpo completo en ImageJ en orden de número de ratón.
- Bajo Imagen> Ajustar> Brillo / Contraste, optar por establecer el valor mínimo que se muestra a 0 y el máximo valor visualizado a + 35353 a continuación, en Imagen> tablas de búsqueda, seleccionar candente.
- En Archivo> Guardar como ..., guardar el montaje como un. TIFF y .jpeg.
Análisis 5. Datos
- Añadir las áreas de selección de tumores y densidades integradas primas, respectivamente, para cada órgano de cada ratón y registrar el área total del tumor de órganos para cada ratón.
- Normalizar el área de grabado y integrat primalos valores de densidad ed para el tamaño de cada órgano dividiendo el área total del tumor y los valores de densidad integradas primas totales por el área de superficie del órgano correspondiente (Tabla 1).
- Calcular y representar gráficamente la media de ambas las áreas de superficie tumor normalizados y los valores de densidad integrados bruto normalizado (Figura 5A, B).
- Compare estos valores medios a los obtenidos mediante el recuento visual de los tumores que eran visibles a simple vista durante la inspección de cada órgano para lesiones metastásicas.
Resultados
El mecanismo metastásica de cáncer de ovario se caracteriza por metástasis intra-peritoneal altamente difusa compuesta de numerosas lesiones de tamaño variable, incluyendo múltiples (<2 mm) lesiones pequeñas. Por lo tanto, el uso de células tumorales RFP marcado (Figura 1) y de formación de imágenes óptico proporciona un método alternativo para el conteo manual y la medición de tamaño de la lesión. El desarrollo de la carga tumoral con el tiempo se puede determinar pesando semanal de los ratones y la medición de la circunferencia abdominal para medir potencial presencia de ascitis. Imagen óptica in vivo proporciona un enfoque complementario para evaluar la carga tumoral (Figura 2). El cáncer de ovario se metastatiza a múltiples sitios en la cavidad peritoneal y los conductores moleculares de la metástasis de sitio específico son actualmente desconocidos. Además de la determinación de la carga tumoral global, después del sacrificio disección cuidadosa se puede realizar para evaluar y cuantificar pa específica del sitiotterns de metástasis. Por lo tanto, la imagen óptica de los órganos peritoneales en situ (Figura 3A, B) combinados con la evaluación ex vivo de órganos individuales (Figura 3C, D) puede proporcionar datos útiles en general vs carga tumoral específica de órgano. Las exploraciones presentados en la Figura 3 representan los resultados de la exploración de las cavidades abdominales y órganos individuales de los ratones con un grado variable de la carga tumoral. Por ejemplo, la Figura 3C muestra la carga más tumor en el epiplón / páncreas, ovarios y mesenterio de ratón A. Cuando se compara con los mismos órganos en el ratón B, se observa una diferencia significativa en la señal (Figura 3D). El uso de la plantilla de la exploración de órganos (Figura 4) ayuda en la identificación de la carga tumoral específica de órgano. La observación de la carga tumoral diferencial se confirmó cuantitativamente tanto en términos de área de la superficie del tumor y la intensidad de la señal del tumor (Tabla 1, Figura 5).
Los resultados que se muestran en estas figuras y la tabla se analizaron mediante un rango de visualización mínima y máxima de 0 a + 35353 a fin de evitar cualquier señal de falsos positivos y autofluorescencia emitida por los tejidos. Los diversos grados de señal visto en la Figura 2 y 3 ilustran la amplia gama de carga tumoral que se pueden obtener imágenes y se cuantificó usando este método. Los datos de la Tabla 1 ilustra este gran rango de aplicabilidad en la cuantificación de ambos superficie tumor y la intensidad de la señal del tumor. Por ejemplo, cuando se mira en el epiplón / páncreas de ratón A en comparación con la de B de ratón, el área de superficie del tumor normalizado es 26 veces mayor en ratón Un ratón de B. Además, la gran gama de intensidad de señales es también ejemplifica en el epiplón / páncreas de ratones A y B; la densidad integrada bruto normalizado de ratón A es 56 veces mayor que la de ratón B. Estos resultados demuestran la validez de Comparing de la carga tumoral de varias pruebas somete respecto a la otra, tanto en términos de área de la superficie del tumor y la intensidad de la señal del tumor, el uso de este método rápido que no requiere más análisis histológico.
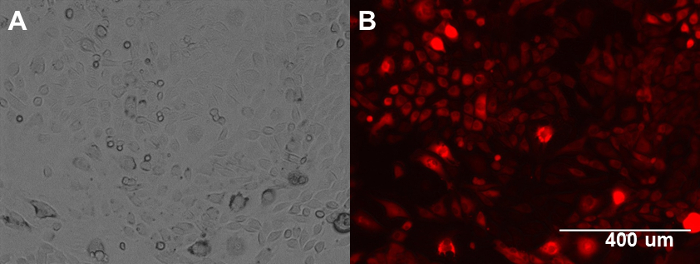
Figura 1. Las células ID8 murino cáncer ovárico de la RFP Express. (A) Imagen de fase de células ID8. (B) Imagen de fluorescencia de las células ID8. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. imágenes ópticas en vivo de C56 / BL6 ratón las con carga tumoral intraperitoneal. (A) Crema depilatoria se utiliza para eliminar Hai r de la superficie ventral del ratón antes de la digitalización. (B) Diagrama que muestra la línea media ventral inicial y incisiones laterales. Haga clic aquí para ver una versión más grande de esta figura.

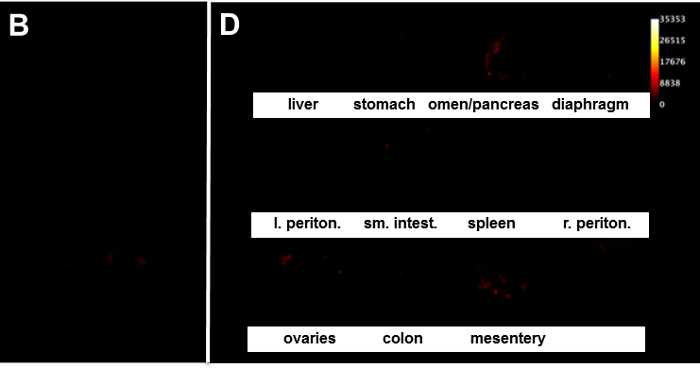
Figura 3. Punto de barrido de intra-peritoneal carga tumoral. (A, B) Los ratones son fotografiada por primera vez con órganos in situ (parte ventral hacia abajo) después de la apertura de la superficie ventral del ratón. (C, D) Obtención de imágenes de órganos individuales. Cada órgano se disecciona, la carga tumoral visual registró, y se coloca sobre la plantilla de exploración de órganos para su análisis.target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
Figura 4. Plantilla de barrido de órganos. órganos diseccionados se colocan en la plantilla de exploración de órganos para mantener la identificación posicional de órganos individuales durante la exploración.
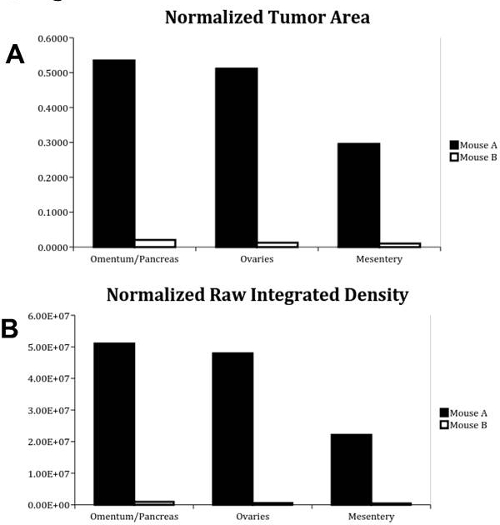
.. Figura 5. Datos Normalizados cuantitativo para el epiplón / páncreas, ovarios y el mesenterio Los datos se analizaron como se describe en el Protocolo y como se muestra en la Tabla 1 ratón Un ratón se refiere al escaneado en el panel 3A; B de ratón se refiere al ratón escaneado en el panel 3B. (A) área del tumor normalizado. Se llevó a cabo análisis de la señal de fluorescencia cuantificación de estos tres órganos y se cuantifica en términos de una relaciónde la superficie tumoral con toda el área de superficie del órgano, tanto para los ratones. (B) Normalizado densidad integrada en bruto. Se llevó a cabo análisis de la señal de fluorescencia cuantificación de estos tres órganos y se cuantifica en términos de una relación de la densidad integrada en bruto a toda el área de superficie del órgano para ambos ratones.
| Epiplón / Páncreas | |||
| Normalizada de la zona del tumor | Normalizado densidad aparente Integrated | ||
| Un ratón | 0.5346 | 5.11E + 07 | |
| B de ratón | 0,0203 | 8.97E + 05 | |
| ovarios | |||
| Normalizada de la zona del tumor | Normalizado densidad aparente Integrated | ||
| Un ratón | 4.79E + 07 | ||
| B de ratón | 0.0123 | 5.62E + 05 | |
| Mesenterio | |||
| Normalizada de la zona del tumor | Normalizado densidad aparente Integrated | ||
| Un ratón | 0.2951 | 2.22E + 07 | |
| B de ratón | 0.0098 | 4.15E + 05 | |
Cuadro 1. Tumor Normalizado Normalizado Área y sin procesarLos valores de densidad integrados en el epiplón / páncreas, ovarios y el mesenterio de ambos ratón Un ratón y B. Publicar disección y escaneo, cada órgano se segmentados y su fluorescencia cuantificaron para determinar la proporción de la superficie total del tumor superficie del órgano y las intensidades de la fluorescencia para estas áreas tumorales. Se han seleccionado los epiplón / páncreas, ovarios y mesenterio, ya que tenían las señales de fluorescencia más intensa dentro de ambos grupos de control positivo y negativo.
Discusión
En contraste con los estudios que utilizan las células de cáncer de ovario humanos que deben ser realizados en ratones inmunodeficientes, el protocolo descrito anteriormente utiliza los ratones inmunocompetentes C57 / Bl6 y las células de cáncer de ovario murinos singénicos. Si bien esto permite la evaluación de la posible función de los infiltrados inmunes en la progresión tumoral y la metástasis, la presencia de pelo oscuro en la superficie abdominal hace menos sensible de formación de imágenes. El uso de un depilatorio para eliminar el vello antes de la imagen mejora la adquisición de la imagen, pero consume mucho tiempo, especialmente para experimentos que requieren de imagen longitudinal. ratones sin pelo 'desnudos pueden ser utilizados en este protocolo y no requieren la eliminación del vello basada en depilatoria. Además, los ratones desnudos carecen de un sistema inmune que funciona, por lo que también se pueden utilizar para evaluar el crecimiento de células de cáncer de ovario humano en los experimentos en el que la contribución del sistema inmune no está bajo análisis.
También hay que señalar que la profundidad de intrapertumores itoneal también presenta desafíos técnicos, como imágenes de fluorescencia óptica generalmente no detectar tumores a profundidades mayores de 5 mm. Además, la prevalencia de la ascitis fluido y la presencia de células tumorales de ascitis proporcionan complicaciones adicionales. Hemos observado una variabilidad significativa-ratón-a-ratón en la formación de fluido de ascitis, incluso cuando se inyectan con la misma línea celular. Así, en la presencia de ascitis, este método es preferible para el análisis de punto final de la carga de tumor-órgano específico en lugar de formación de imágenes longitudinal rutina de progresión. En el caso actual, los cambios dramáticos en la carga tumoral se observaron entre los ejemplos de los ratones, de tal manera que las cohortes de cuatro a cinco ratones por lo general será suficiente para el análisis estadístico. En el caso de las diferencias menos dramáticos en la carga tumoral, serán necesarios los sujetos experimentales adicionales para alcanzar el poder estadístico. Mientras que los ejemplos mostrados en este documento difieren de forma significativa en el volumen tumoral, imágenes de fluorescencia óptica puede ser usado paradetectar diferencias mucho más pequeñas de la carga tumoral específico de órgano, especialmente en comparación con peso o medidas basadas en la pinza en lesiones pequeñas (no mostrados) .Resolution y sensibilidad variará con la línea celular y el sistema de imagen. En el presente caso, los implantes metastásicos tan pequeñas como 400 micras de diámetro se pueden resolver y cuantificados. Los métodos alternativos que incluyen la tomografía con contraste computarizada (CT), resonancia magnética (RM), y tomografía por emisión de positrones (PET) se han descrito para la imagen longitudinal 14,15. Modalidades, incluyendo la imagen anatómica y funcional combinado también están en desarrollo 16.
En lo que respecta a este método propuesto para la cuantificación de la carga tumoral, hay que señalar que la determinación de los umbrales de fluorescencia [Paso 4.3.5.] Se basa en la intensidad de la fluorescencia se ve en las imágenes de órganos [Paso 4.3.2.] y es elegido por el usuario para incluir sólo las regiones más fluorescentes relative al resto del órgano. Diferentes valores de umbral se utilizaron en el análisis antes de determinar los valores de umbral finales utilizados en este estudio. Una vez determinado, se utilizaron estos mismos umbrales en todos los órganos analizados con el fin de garantizar la coherencia en la cuantificación de lo que se considera el tejido metastásico mediante el análisis visual inicial realizado por el investigador. La determinación de estos umbrales es un paso crítico en el procedimiento y, potencialmente, podrían variar de un proyecto a otro según lo determinado por el investigador individual. En este caso, se utilizó un gran umbral más bajo con el fin de capturar sólo las señales de fluorescencia más elevada intensidad. Mediante el uso de este mismo umbral para cada órgano analizado, el análisis y los resultados ofrecen resultados cuantitativos comparativos en el contexto de esta cohorte de ratones. Si bien este método está limitado en la cuantificación de los valores absolutos de área de la superficie del tumor, que permite a los investigadores la capacidad de comparar la carga tumoral en relación normalizada entre la misma unand diferentes órganos dentro de las cohortes de ratones. Cabe señalar que este enfoque incluye la cuantificación de los tumores que no son visibles a simple vista.
El mecanismo metastásica única de resultados de EOC en carcinomatosis intraperitoneal ampliamente difundido que implican múltiples tejidos y órganos, rindiendo cirugía citorreductora óptima técnicamente difícil. Como citorreducción completa se correlaciona positivamente con la supervivencia global, se sigue que el desarrollo de nuevas estrategias terapéuticas para combatir la metástasis intra-peritoneal se justifica. Evaluación de la eficacia terapéutica, sin embargo, depende de la cuantificación exacta de la carga tumoral, incluyendo la evaluación de la metástasis específica de órgano. El uso de imágenes ópticas de las células tumorales RFP-etiquetado in situ corregida para la autofluorescencia de órganos, junto con el ex de imágenes de órganos cuidado vivo, hemos desarrollado un método para cuantificar la carga tumoral intraperitoneal de órganos específicos. Curiosamente, nuestros análisis muestranque los sitios preferidos de la metástasis en este modelo, tal como se define por el área de carga / superficie del tumor, son similares a los encontrados en mujeres con cáncer de ovario (epiplón, ovario, intestino, mesenterio) 2,4,5. Por lo tanto, este enfoque debe tener utilidad en el futuro la evaluación de terapias experimentales diseñadas para concentrar la enfermedad metastásica.
Divulgaciones
Este artículo es parte de una edición especial sobre Imaging Multimodal Preclínica, patrocinado por Bruker Biospin.
Agradecimientos
This research was supported by research grants RO1CA109545 and RO1CA086984 to M.S.S. by the National Institutes of Health/National Cancer Institute and by an award from the Leo and Ann Albert Charitable Trust (to M.S.S.).
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium | Corning | 10-014-CM | |
| Fetal bovine serum | Gibco | 10437-028 | |
| penicillin/streptomycin | |||
| Insulin-transferrin-sodium selenite media supplement | Sigma | I-1884 | |
| Bruker Xtreme small animal imaging system | Bruker Corp. | ||
| Bruker Multispectral software | Bruker Corp | ||
| lentiviral particles with Red fluorescent protein | GenTarget, Inc. | LVP023 | |
| trypsin for cell culture | Corning | 25-053-CI | |
| PBS | Corning | 21-040-CM | |
| depilatory cream (such as Nair Hair Remover Lotion) | purchases from drugstore | n/a | |
| ImageJ software | http://imagej.nih.gov/ij/ | free download | |
| dissecting tools (forceps) | Roboz Surgical Instrument | RS 5130 | |
| dissecting tools (Scissors) | Roboz Surgical Instrument | RS 5910 |
Referencias
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Halkia, E., Spiliotis, J., Sugarbaker, P. Diagnosis and management of peritoneal metastases from ovarian cancer. Gastroenterology Research and Practice. 2012, 541842-541854 (2012).
- Barbolina, M. V., et al. Microenvironmental regulation of ovarian cancer metastasis. Cancer Treatment and Research. 149, 319-334 (2009).
- Lengyel, E., et al. Epithelial ovarian cancer experimental models. Oncogene. 33 (28), 3619-3633 (2014).
- Harter, P., duBois, A. The role of surgery in ovarian cancer with special emphasis on cytoreductive surgery for recurrence. Current Opinion in Oncology. 17 (5), 505-514 (2005).
- Bristow, R. E., Puri, I., Chi, D. S. Cytoreductive surgery for recurrent ovarian cancer: a meta-analysis. Gynecologic Oncology. 112 (1), 265-274 (2009).
- Hoffman, R. M. In vivo imaging of metastatic cancer with fluorescent proteins. Cell Death and Differentiation. 9, 786-789 (2002).
- Sweeney, T. J., et al. Visualizing the kinetics of tumor-cell clearance in living animals. Proceedings of the National Academy of Science USA. 96, 12044-12049 (1999).
- Chishima, T., et al. Cancer invasion and micrometastasis visualized in live tissue by green fluorescent protein expression. Cancer Research. 57, 2042-2047 (1997).
- Bouvet, M., et al. Real-time optical imaging of primary tumor growth and multiple metastatic events in a pancreatic cancer orthotopic model. Cancer Research. 62, 1534-1540 (2002).
- Hoffman, R. M. The Multiples Uses of Fluorescent Proteins to Visualize Cancer in vivo. Nature Reviews. 5, 796-806 (2005).
- Roby, K. F., et al. Development of a syngeneic mouse model for events related to ovarian cancer. Carcinogenesis. 21 (4), 585-591 (2000).
- Rampurwala, M., Ravoori, M. K., Wei, W., Johnson, V. E., Vikram, R., Kundra, V. Visualization and quantification of intraperitoneal tumors by in vivo computed tomography using negative contrast enhancement strategy in a mouse model of ovarian cancer. Translational Oncology. 2 (2), 96-106 (2009).
- Kim, T. J., et al. Antitumor and antivascular effects of AVE8062 in ovarian carcinoma. Cancer Research. 67, 9337-9345 (2007).
- Picchio, M., et al. Advanced ovarian carcinoma: usefulness of [(18)F]FDG-PET in combination with CT for lesion detection after primary treatment. Quarterly Journal of Nuclear Medicine. 47, 77-84 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados