Method Article
自主ダイブ水中へのトレーニングラット:哺乳類ダイビング応答の調査
要約
Detailed instructions are provided on how to train rats to voluntarily dive underwater through a 5 m long Plexiglas maze. Because the brains of rats have been very well characterized, voluntarily diving rats may help elucidate the central pathways of the mammalian diving response.
要約
Underwater submergence produces autonomic changes that are observed in virtually all diving animals. This reflexly-induced response consists of apnea, a parasympathetically-induced bradycardia and a sympathetically-induced alteration of vascular resistance that maintains blood flow to the heart, brain and exercising muscles. While many of the metabolic and cardiorespiratory aspects of the diving response have been studied in marine animals, investigations of the central integrative aspects of this brainstem reflex have been relatively lacking. Because the physiology and neuroanatomy of the rat are well characterized, the rat can be used to help ascertain the central pathways of the mammalian diving response. Detailed instructions are provided on how to train rats to swim and voluntarily dive underwater through a 5 m long Plexiglas maze. Considerations regarding tank design and procedure room requirements are also given. The behavioral training is conducted in such a way as to reduce the stressfulness that could otherwise be associated with forced underwater submergence, thus minimizing activation of central stress pathways. The training procedures are not technically difficult, but they can be time-consuming. Since behavioral training of animals can only provide a model to be used with other experimental techniques, examples of how voluntarily diving rats have been used in conjunction with other physiological and neuroanatomical research techniques, and how the basic training procedures may need to be modified to accommodate these techniques, are also provided. These experiments show that voluntarily diving rats exhibit the same cardiorespiratory changes typically seen in other diving animals. The ease with which rats can be trained to voluntarily dive underwater, and the already available data from rats collected in other neurophysiological studies, makes voluntarily diving rats a good behavioral model to be used in studies investigating the central aspects of the mammalian diving response.
概要
The diving response consists of a suite of autonomic reflexes seen in animals of all vertebrate classes 1. In response to submersion under water, this reflexly-induced response consists of apnea, bradycardia and an alteration of blood flow that maintains flow to the heart, brain and exercising muscles while limiting flow to viscera and non-exercising muscles 2. Many of the metabolic and cardiorespiratory aspects of the mammalian diving response have been well investigated 2,3, including those in humans 4,5. However, what has been relatively lacking, until recently, is investigation of the central integrative aspects of the diving response. What happens within the brainstem, and what is the neuronal step-by-step pathway, that connects afferent inputs to efferent outputs during this autonomic reflex? Answering these questions will require an appropriate animal model 6. An adage in comparative physiology, the Krogh principle 7, is that for every research question there is some animal of choice on which the problem can be most conveniently studied. A most appropriate animal for studying the central aspects of the diving response is the rat 6,8. In large part this is due to the fact that the brains of rats have been very well characterized, both anatomically and functionally, and many rat brain atlases are available 6. Additionally the rat is particularly useful in cardiorespiratory research, because the physiology of the rat is well known across all major organ systems, and the rat is well regarded as an animal model in systems biology 6. Finally, the laboratory rat is the domesticated version of the wild Rattus norvegicus, an animal that routinely swims and dives underwater 6. Based on these considerations, the rat is a good choice for studies investigating the central aspects of the mammalian diving response. In comparison, using marine animals to investigate the central aspects of the mammalian diving response would be much more difficult. This is due in large part to marine animals having comparatively large and non-uniformly sized brains, and the relative difficulty and high cost of housing these animals.
Rats have previously been used to investigate many aspects of the mammalian diving response, primarily in situations involving forced underwater submergence 9-12. However many studies in marine and aquatic animals have shown that there can be a differential response to diving based upon whether the submergence was forced or voluntary 2,13. Diving animals may show an extremely intense bradycardia during forced diving but a much less intense bradycardia during voluntary diving. The “stress” of forced submergence can significantly change the cardiovascular responses of diving in many animals 14. Small rodents such as muskrats also show a more intense diving response during forced submergence than during voluntary diving 15,16. Thus, if rats are to be used to investigate the central aspects of the mammalian diving response, investigators should be aware that a rat forcibly submerged underwater may produce a response different from that of a voluntarily diving rat.
The goal of this article is to provide detailed instructions on how to train rats to voluntarily dive underwater. These procedures are not technically difficult, but can be time-consuming. The training is conducted in such a way as to reduce the stressfulness that could otherwise be associated with forced underwater submergence. This voluntary diving technique should minimize activation of central stress pathways and thus better allow investigation of the central aspects of the diving response. By itself, training rats to voluntarily dive underwater generates no data that can be used to investigate the central aspects of the mammalian diving response. Therefore examples of how voluntarily diving rats have been used in conjunction with other physiological and neuroanatomical research techniques, and how the basic dive training may need to be modified to accommodate theses other techniques, are also provided.
プロトコル
注:中西部の大学で行われ、本明細書に記載の実験プロトコールは、中西部の大学IACUCによって承認された。
1.ルームの要件
- 温水と冷水を実行している処置室、床に、タンクから一般的に排水を水を除去する方法を固定します。
- ダイビングタンクを配置する研究·テーブルを使用してください。床排水溝付きの客室は、一般的に排水のために輪郭であるため、ゴム栓を切り倒し、テーブルトップ、ひいてはタンク内の水面のことを確認するためにテーブルの脚の下に置いて、レベルです。
2.ダイビングタンク
- ダイビングタンク建設
- 側壁( 図1)のためにプレキシグラスの一番下のための厚いプレキシグラスで3/4と1/2を使用して(100×60×15 cm)の長方形のタンクを構築します。恒久的にシアノアクリレートセメントまたはsolvenを用いて一緒にタンクの外側プレキシグラス片を取り付けるそのようなトリクロロメタンなどのts。
- 85×15センチの片に切断リムーバブル1/2インチ厚のプレキシグラスを使って、5チャネルの長さでそれぞれ約100センチ、中にタンクを分割。恒久的にこれらのチャンネル分周器の位置にスロットすることができその中にタンクの底やエッジに溝を配置します。
- 水中ダイブ「トンネルのための "屋根"を作成するチャンネル分周器からの水平プレキシグラス片を一時停止します。
- タンク場所の一角に取り外し可能な調達プラットフォーム、「フィニッシュエリア」、ラットが水の外に運ぶと、水泳やダイビングの試行の間休ませるために。ラットは通常、自分自身をグルーミングし、フィニッシュエリアにいる間彼らの毛皮から水を除去する。ラットは訓練試行間のプラットフォーム上に残るを保証するためにフィニッシュエリアのエッジの周り背の高い側面を置きます。
- フィニッシュエリアからタンクの反対側の隅にのみ迷路への水中へのアクセスを許可するチャンバーを配置。これは取り外し可能な "開始REA」のみの潜水試験のために使用されます。
注:スタート室内のプラットフォームの上に座っている間、ラットが水の中に下げられるダイビング裁判の開始時に、それゆえ、このプラットフォームは、「エレベーター」と呼ばれている。
注:スタートエリア、フィニッシュエリア、及び全てのチャンネルデバイダーがタンクから取り外し可能で、モジュール設計を使用してください。ラットを混乱してしまった場合、水中、作品はすぐにからラットを救うために分解することができる間、特に、1)すべてのチャンネル分周器を除去した後に水でタンクを充填し、空に容易にするため、および2):これは二つの理由のために行われている水。
- 水でタンクを充填し空にする
- 水でタンクを埋める
- 各トレーニングセッションの開始時に、約12cmの深さまで、新鮮な32℃の水道水でタンクを充填する。暖かいまたは冷たいポケットを最小限に抑えるためにタンク内の水を攪拌する。
注:通常、それは12匹のラットを訓練するのに約2時間かかります。この間水の温度は約4℃低下する。トレーニングセッションの終わりまでに水は約28℃に冷却する。 30℃の水ではなく、室温の水に比べ、この温水を使用して、ラットへの温熱なので、反復的なトレーニング中の熱損失を最小にする。
- 各トレーニングセッションの開始時に、約12cmの深さまで、新鮮な32℃の水道水でタンクを充填する。暖かいまたは冷たいポケットを最小限に抑えるためにタンク内の水を攪拌する。
- 水でタンクを空にする
- 各トレーニングセッションの最後に、そのような1インチの内径の管4メートルの長片として、大きなホースを使用してタンクから水を排出。完全に空気のポケットがチューブにない確実に、タンク内のチューブを沈める。素早く床ドレンにチューブの一方の端を置く。結果としてサイフォン効果はタンクから水を排水します。
- サイフォンを維持するために、水面下のチューブのタンクの端を維持しながら、水の完全な排水を容易にするために、エッジタンクを傾ける。
注:あるいは、そしてよりむしろサイフォン、タンクの底近くでタップをインストールし、接続しますタンクからのホースが床ドレンにタップします。
- 水でタンクを埋める
3.ラットアレルゲンの検討事項
- 取扱い及びラットを訓練するたびに使い捨て手袋を着用してください。手袋は常にラット尿を含むであろうタンク内の水との接触を制限する。
注:ラットはトレーニング中に濡れになり、部屋には「ウェット - ラット」匂いで満たされます。結果的に抗ヒスタミン薬の予防的体制は、ラットのアレルギーの影響を防止または制限することがあります。彼らは、ラットのアレルゲンに対して敏感になるべきトレーナーはまた、使い捨て防塵マスク、またはN95マスクを着用する必要があるかもしれません。
4.スイムトレーニング
- 毎日の水泳訓練
注:個人の経験は、若いラットはより良く、より速く迷路を学び、したがって、成体ラットを使用することに好適である35グラム新たに離乳ラットを用いたトレーニングを開始することを示しています。- 水でタンクを埋める。 2.2.1を参照してください。
- 挿入フィニッシュ5水泳チャネルを作成するための領域とチャネルデバイダ。
- 最初のトレーニングセッション中に静かにフィニッシュエリアから水約3~5から2cm手でラットを下げる。
注:これらは、第1の浮遊感に遭遇として水ラットへの導入に際しては、非定常表示されます。最終的に近くのフィニッシュエリアに到達し、水を終了する方法を見つけるためにしようとしているときにラットは非協調方式で約パドルます。原因泳ぐ彼らの生得的な能力のために、その後の試験でラットはフィニッシュエリアに向けて、より協調的で泳ぎます。
注:自分の足が捜査の手にあるように下からラットをサポートします。静かに水の中にラットを下げ、そして彼らはむしろ水にそれらをドロップするよりも、手から離れて泳ぐましょう。 - 試験の間、ラットは、少なくとも1分間、フィニッシュエリアに残るう。彼らは「安全な」場所としてフィニッシュエリアとみなすようにするために、ラットは新郎と探求できるようにすることです裁判の間行く。これは単に試験を完了し、すぐに次の試行を開始するために水の中にそれをバックに位置決めしているラットをつかむと対照的である。
注:脳内の報酬回路の活性化を防止するために、トレーニング中に外部の報酬( すなわち 、食品)を使用しないでください。 - フィニッシュエリアの待機期間の後、静かに次の試行を開始する前に、1分間ラットを開催しています。水中への繰り返しのエントリがラットは非常に濡れるようになりますし、それらを乾燥して低体温症を防ぐことができますので、静かにこの公判前のホールド中にタオルでラットを乾かす。
- 4.1.3を繰り返します。 4.1.5スルー。各ラットは、毎日の水泳トレーニングセッション中に訓練されるために3から5治験を完了します。
- すべてのチャンネル分周器を外し、タンクからエリアを終える。
- タンクからの水を空にします。 2.2.2を参照してください。
- 週刊水泳トレーニングスケジュール
- 規範毎日のトレーニングセッション(4.1を参照。)週5日間、理想的に同時に毎日。
- 首尾前日に交渉した距離からの最初のトライアルを開始します。増加した距離から2番目と3番目の試験を開始します。
- 各後続の毎日のトレーニングセッションにラットを水及びフィニッシュエリア内に配置される場所との間の距離を増加させる。最初のいくつかのトレーニングセッション5-10 CMでこの距離を増やす。ラットは水泳より快適に表示された後30〜50 CMによって距離を増やす。
- ラットが泳ぐチャネルの直線部分を泳ぐことを学んでいる間に水泳距離の大きな増加を使用してください。これとは対照的に、ヘアピンを泳ぐことを学ぶことは2-3のトレーニングセッションがかかる場合がありますチャネルの間になります。
注:多くの場合、フィニッシュエリアで待機している間に、ラットは泳ぐために水を再入力し、かつ/または、まだフィニッシュエリアプラットフォームの上に座っている間に頭の水中水没。 - 全体5チャネルの成功した水泳を確実にするために3週間にわたって、この毎日のトレーニングプロトコルを繰り返します。この繰り返し訓練プロトコルは、迷路は、左と右のヘアピンターンを交互に含み、特に以来、迷路が正常に完了したことを保証します。
5.ダイブトレーニング
注:ラットが正常に迷路を通して水泳を交渉することを学んだ後、彼らはダイビングの訓練を開始する準備が整いました。
- 初期のダイビングトレーニング(初日)
- スタートチャンバーを挿入します。 (2.2.1を参照してください。)水でタンクを埋める。確保水位がスタートエリアへの開口部以下1cmである。
- フィニッシュエリアを挿入し、チャンネル分周器は、5つのスイミングチャネルを作成する。
- 最初のダイビングセッション中に開始チャンバ内に水の中にエレベーターに低下するラットを訓練。迷路へのアクセスが開始チャンバの底部からのものである。ラットが簡単に迷路にスタート室から泳ぐことができるように、この最初のセッションの間に水位が十分に低い。ラットが迷路に水泳を続けることができるフィニッシュエリア。
- 試験の間、ラットは、少なくとも1分間、フィニッシュエリアに残るう。
注:脳内の報酬回路の活性化を防止するために、トレーニング中に外部の報酬( すなわち 、食品)を使用しないでください。 - フィニッシュエリアの待機期間の後、静かに次の試行を開始する前に、1分間ラットを開催しています。静かにこの公判前のホールド中にタオルでラットを乾かす。
- 5.1.3を繰り返します。 5.1.5スルー。この最初のダイブトレーニングセッション中に訓練される各ラットについての3試験を完了します。
- 、すべてのチャネル仕切りを取り外し、チャンバを起動し、タンクからエリアを終える。
- タンクからの水を空にします。 2.2.2を参照してください。
- 初期のダイビングトレーニング(二日目)
- スタートチャンバーを挿入します。 (2.2.1を参照してください。)水でタンクを埋める。水位がわずかにスタートエリアへの開口部を超えていることを確認してください。
- フィニッシュエリアを挿入し、チャンネル分周器は、5つのスイミングチャネルを作成する。
- 第二潜水中ラットが迷路を入力し、スタート室の縁の下に頭を浸ししなければスタートチャンバーを終了するように、トレーニングセッションは、水位が上昇した。ラット初ダイブとしてこれを考えてみましょう。ラットはその後フィニッシュエリアに迷路水泳を続けることができる。
- ラットは臨床試験の間に少なくとも1分間フィニッシュエリアに残りましょう。
注:脳内の報酬回路の活性化を防止するために、トレーニング中に外部の報酬( すなわち 、食品)を使用しないでください。 - フィニッシュエリアの待機期間の後、静かに次の試行を開始する前に、1分間ラットを開催しています。静かにこの公判前のホールド中にタオルでラットを乾かす。
- 5.2.3を繰り返します。 5.2.5スルー。このダイブトレーニングセッション中に訓練される各ラットについての3試験を完了します。
- 、すべてのチャネル仕切りを取り外し、チャンバを起動し、タンクからエリアを終える。
- タンクからの水を空にします。 2.2.2を参照してください。
- 初期のダイビングのトレーニング(THIRD日)
- スタートチャンバーを挿入します。水でタンクを埋める(2.2.1を参照。)、水位がスタートエリアへの開口部を超えていることを確実にする。
- フィニッシュエリアを挿入し、チャンネル分周器は、5つのスイミングチャネルを作成する。長さ5cmダイビングトンネルを作成するためにスタートエリアのすぐ外側プレキシグラスの水平部分を置きます。
- 第三のダイビングのトレーニングセッション中にラットは、スタート室の縁の下にその頭を浸し、スイムチャネルのオープンウォーターに到達する水中5センチ泳ぐことがあります。ラットはその後フィニッシュエリアに迷路水泳を続けることができる。
注:開始領域に配置されると、ラットは、自分の水中潜水を開始し、従って、これらは、「自発的な」ダイブであると考えられる。 - ラットは臨床試験の間に少なくとも1分間フィニッシュエリアに残りましょう。
注:脳内の報酬回路の活性化を防止するために、トレーニング中に外部の報酬( すなわち 、食品)を使用しないでください。 - フィニッシュエリアの待機期間の後、静かに次の試行を開始する前に、1分間ラットを開催しています。静かにこの公判前のホールド中にタオルでラットを乾かす。
- 5.3.3を繰り返します。 5.3.5スルー。このダイブトレーニングセッション中に訓練される各ラットについて3〜5治験を完了します。
- 、すべてのチャネル仕切りを取り外し、チャンバを起動し、タンクからエリアを終える。
- タンクからの水を空にします。 2.2.2を参照してください。
- 週刊ダイビングのトレーニングスケジュール
- (5.3参照。)週5日間、理想的には同じ時刻に毎日、毎日のトレーニングセッションを実施。
- 首尾前日に交渉した距離からの最初のトライアルを開始します。増加ダイビング距離が第二と第三の試験を開始します。
- 後続の各毎日のトレーニングセッションとラットは水中泳ぐする必要が距離を延長するために追加の水平仕切りを追加することによって、ダイブトンネルの長さを増加させる。最初のいくつかのトレーニングセッション増加THI用5〜10センチメートルによるsの距離。ラットはダイビングをより快適に表示された後30〜50 CMによって距離を増やす。
注:連続した試験中にしようとしたダイビングの距離を拡張しすぎるしないでください。必要であれば、短いダイビング距離を提供するために、水平方向のチャンネルカバーの端を持ち上げます。ダイビング試験中にラットはダイビングトンネルの終わりに到達し、水中好転し始めていない場合は、迅速にチャネルカバーの端を持ち上げ、そしてラットが表面化し、彼の水泳を続けることができる。これが成功して、より長いダイビング距離を完了するために、ラットを可能にします。この正の強化は、各ダイブトライアル付き水中トンネルを通って前進したラットを維持します。 - ラットが泳ぐチャネルの直線部分をダイビングを学んでいる間に潜水距離の大きな増加を使用してください。これとは対照的に、ヘアピンの周りにダイビングを学ぶことは2-3のトレーニングセッションがかかる場合がありますチャネルの間になります。
注:フィニッシュエリアで待機している間に、しばしば、ラットは再入力します番目まだフィニッシュエリアプラットフォームの上に座っている間泳ぐ、および/またはそれらの頭部を水中水没する電子水。 - 全体5チャネルの成功ダイビングを確実にするために3週間にわたって、この毎日のトレーニングプロトコルを繰り返します。この繰り返し訓練プロトコルは、迷路は、左と右のヘアピンターンを交互に含み、特に以来、迷路が正常に完了したことを保証します。
注:フル6週水泳やダイビングのトレーニングスケジュールは、300グラムの体重に到達するために35グラムを新たに離乳したラットの成長と一致している。 - 毎日のトレーニングセッションが完了しており、ラットはホームケージに戻された後、ラットはすぐにグルーミングを通じて毛皮を乾燥確保、または必要であれば、彼らの毛皮が乾燥するまで暖かいラットを保つために彼らのケージの下に加熱パッドを配置。
6.実験的変奏曲
注:基本的な実験設定および動物の訓練は上記に記載されている。しかし、行動訓練のみPR関心のあるデータを収集するために、他の実験技術で使用されるモデルをovides。基本的なプロトコルは、ダイビング応答の特定の側面を調査するために修正される。これらの修飾の例には、これらの生理学的および神経解剖学的技術を使用してデータを収集するためのいくつかの考慮事項は、以下の通りである。
- 埋め込み可能な遠隔測定トランスミッタ
- 訓練終了後、水泳、ダイビングのラットから拍動性の動脈血圧を送信するために、市販の遠隔測定送信機を使用しています。手術と術後の回復に関する手順については、ローカルIACUCの承認を得る。彼らのトランスミッタ用に会社によって提案移植手順に従ってください、と水にラットを返す前に、手術からの完全な回復を確実にする。
- ラットが水にあるときに無線信号を受信するアンテナが近くにあることを確認してください。
注:水は、無線信号を減衰させ、したがって近距離無線信号ね水中を移動するEDSは、タンクの寸法の制限要因になります。 - それは迷路を進むにつれてラットに従うことを、むしろラットケージサイズのアンテナよりも、ハンドヘルドアンテナワンドを使用してください。ラットは水中である間、無線信号が失われないことを保証するために、ラットを30 cm以内ワンドアンテナを保つ。
- 末尾カニューレ
- チャンネル分周器と水平ピース迷路を通じてその進行中のラットの背後に沿ってカニューレ証跡ようにダイビングトンネルの屋根を作成するを再設計。
注:チャンネルのモジュール設計が最も重要であり、また、迅速な水中迷路からラットの回復できるようにする必要があります。カニューレ思わぬ障害とラットから外れるようになった場合には、水中カニューレが急速に再接続されていない場合は一方で、ラットはすぐにブリードアウト性があります。 - 自発的にダイビングラットにおいて動脈圧および心拍数を記録するために後続の動脈カニューレを使用する。としてPE50の90センチの部分を使用してください末尾のカニューレ。
注:このカニューレの長さは依然ラットが迷路を経て進行することを可能にしながら、圧力変換器にラットを接続するために十分な長さで、まだカニューレデッドスペースを最小にするのに十分に短く、十分な忠実度を可能にするために圧力変換器に十分接近している動脈圧力信号。 - そのような副交感神経と交感神経作動薬および拮抗薬などの薬剤を注入する、または心拍出量の分布を決定するトレーサーまたは染料を注入するために末尾の静脈(または動脈)カニューレを使用してください。
- ラットは水中カテコールアミンレベルまたは血液化学を決定するために水中であるが、静脈(または動脈)カニューレを用いて、ラットから血液サンプルを引き出す。
注:末尾のカニューレの長さを最小限にし、採血の際にカニューレデッドスペースを占めている。
- チャンネル分周器と水平ピース迷路を通じてその進行中のラットの背後に沿ってカニューレ証跡ようにダイビングトンネルの屋根を作成するを再設計。
- 活性化脳幹ニューロンの検出
- 同定するFos蛋白の免疫学的検出を使用してくださいダイビング応答の一部である脳幹の年度特定の領域。
注:心肺反射の繰り返しの開始時には、その反射回路の一部である脳幹の神経細胞が活性化のFosと呼ばれるタンパク質を産生するようになることができます。 - 繰り返し24ダイブの合計2時間迷路を5分ごとにラットを潜る。
注:また、ニューロンのFos産生を誘導する他のプロトコルを使用することもできる。ストレスに対する応答に関与する脳幹ニューロンの活性化を回避するために、反復される動作は、行動訓練の一部として含まれるべきである。
- 同定するFos蛋白の免疫学的検出を使用してくださいダイビング応答の一部である脳幹の年度特定の領域。
- ダイビング中の血液コルチコステロンレベル
- 水泳やダイビング中のストレスラットの経験のレベルの指標としてコルチコステロンを使用してください。
- コルチコステロン分析用の血液を得るためには、3自主的な泳ぎや潜水後のラット15分の尾静脈から0.1ミリリットルの血液サンプルを描画します。
注:予備実験は15分では、suであることを示した循環中にコルチコステロンの産生および放出を可能にし、血漿コルチコステロンレベルのピークを生じさせるfficient時間。コルチコステロンレベルは概日リズムを持っているので、すべての血液が日の同じ時間に描きスケジュールし、研修のタイミングと一致した。
結果
記載さ水泳やダイビングの訓練手続きが正常に完了し、水の下で時潜水ラットが経験したストレスを減らすことができます。血中コルチコステロンレベルは、反復的な毎日のトレーニングが自主的なダイビングに関連付けられているstressfulnessを減少させることを示しており、訓練を受けたラットは、ヒト( 図2; 17)で毎日処理されているよりも、ダイビングにはよりストレス見当たらない。逆に、ダイビングプロトコルで訓練を受けていないラットは自発的なダイビングストレスの多い( 図2; 17)を見つける。さらに、両方の訓練を受け、訓練を受けていないラットは最もストレスの多い(; 17 図2)に強制ダイビングを見つける。
と末尾のカニューレ( 図4; 21-23);水泳、自主的なダイビング、強制ダイビングラットから心臓血管の応答は、注入された遠隔測定デバイス(8,17-20 図3)を用いて記録されています。すぐに自主的な時に水没し、単一のビート内、心拍数が減少することにより78%および25%の17で動脈血圧が低下することを意味する。これらの結果は、自主的にダイビングラットは通常、他のダイビングの動物で見られる同じ心肺変化を示すことを示している。および自主潜水中の脳血流23を含む心拍出量22の分布を決定するために、後続の動脈カニューレは、自発的なダイビング(21、図4)に関連付けられた徐脈を排除ムスカリン拮抗薬アトロピンを注入するために使用されてきた。後続カニューレはまた、ラットは、それらが18を沈めている間に動脈低酸素血症、および高炭酸ガスを増加し、既存の化学受容ドライブが自主ダイビング21へ循環応答に影響を及ぼさないことを無視するを示すために使用されてきた。
ラミナIおよび腹側延髄後角(MDH)のII内のニューロンのFosドゥリンを表明gの自発的なダイビング、これらのニューロンは、ダイビング応答(; 24、図5)の初期脳幹求心リレーを構成することができる。そのような尾昇圧エリア(CPA)などの重要な脳幹心肺制御領域は、核強力に発現solitaries(NTS)、吻側腹外側延髄(RVLM)、およびperibrachialの領域は、すべてのショーは水泳25と比較して自主的な潜水中のFosラベリングを増加させた。長い期間がダイブ18を強制した後に脳幹の化学感受性の領域におけるニューロンはフォスを発現する。
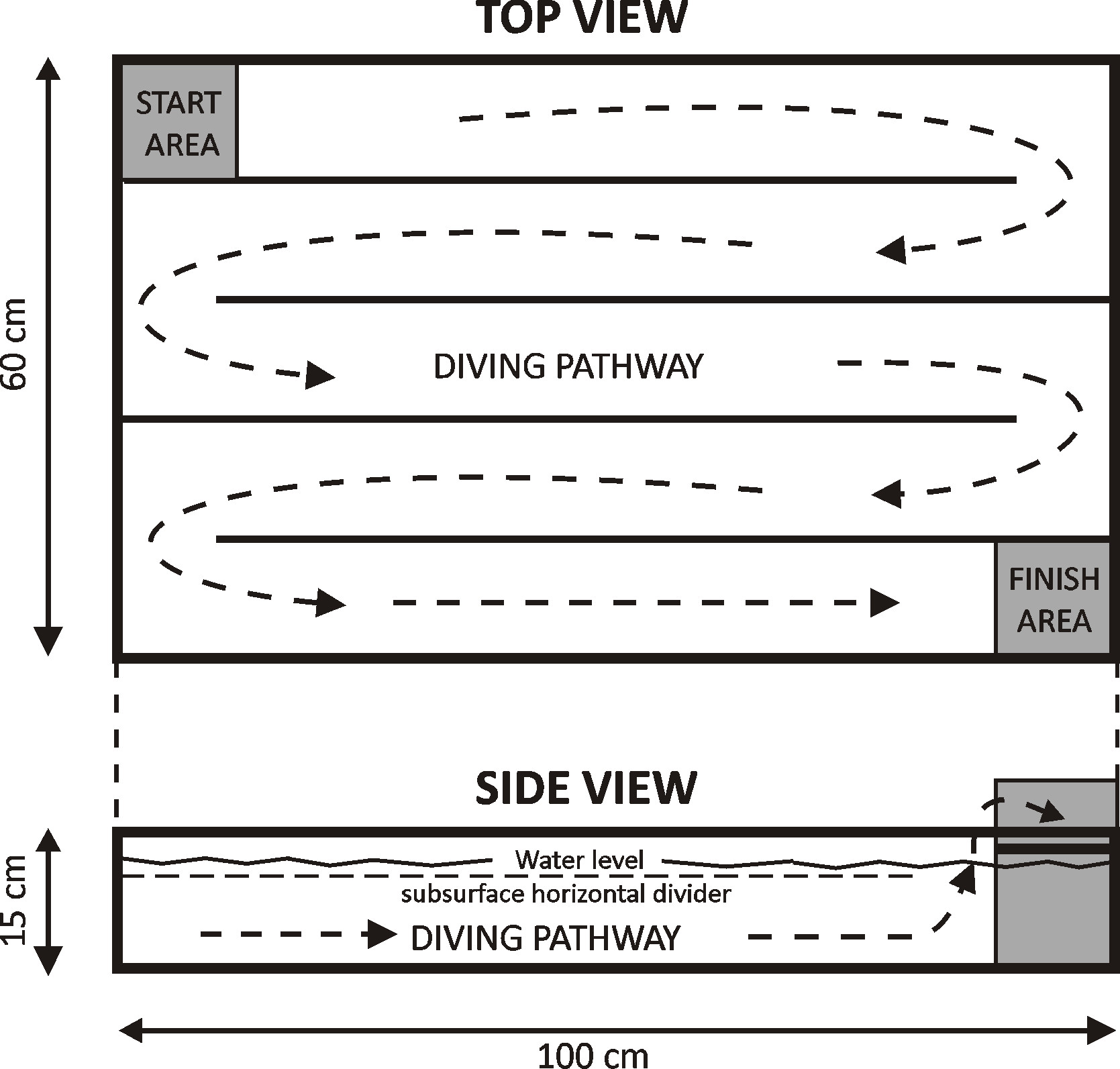
図1:ダイビングタンクの概略 Aプレキシグラスタンク(100×60×15 cm)を5 1メートル長いチャンネルで構成される単純な迷路を作成するために使用された。タンクを30℃の水道水を充填し、そしてラットを最初にnegotiatに訓練された電子スタートエリア(左上)からフィニッシュエリア(右下)に、水面に泳ぐことによって迷路。ラットはその後迷路を潜るように訓練された、2〜3センチメートル水面下に置かれ、水平プレキシグラス片によって水中に保つ。 [この図は、26から変更されている]

図2:コルチコステロンの測定 。血液は、ラット尾静脈がそれらのケージに残っラットから(平均±SE)(ナイーブ)のコルチコステロン濃度を測定するために使用された、10分/日のために処理したラットは、(取扱)から描き泳ぐとダイビング(トレーニングを受けた)ように訓練したラット、およびラットそれは水泳やダイビングのトレーニング(訓練を受けていない)を受信していない。訓練されたラットは彼らの水泳トレーニング(バーの左セット)を完了した後にコルチコステロンを測定し、後に訓練されたラットは、彼らの自主的なdiv要素を完了した電子トレーニング(バーのセンター集合)、および訓練されたラットは彼らの強制ダイブトレーニング(バーの右のセット)を完了した後。図1は、値がナイーブよりも有意に大きいことを示します。 2値が処理さよりも有意に大きいことを示します。図3は、値が訓練されたよりも有意に大きいことを示している。 *訓練を受けたラットにおいて、強制的に潜水時の値は自主的なダイビング時よりも有意に大きいことを示しています。 [この図は、17から変更されている]

図3:遠隔測定送信機からの動脈血圧トレース水泳中の拍動性の動脈血圧(左の列)を示す生データトレース、自主的なダイビング(中央の列)と、迷路を泳ぐように訓練したラットやダイビングからダイビング(右列)を余儀なくされた。 TRAIがなかったラットから(下の行)と寧手順(上列)。水面に泳ぐことはそのような心血管系の変化を生じなかったのに対し、ダイビング水中(自発的および強制的な水没の両方)は、即時の徐脈および動脈圧の遅い発症増加をもたらした。トレースの下のバーは、水没の期間を示している。トレース内の改行は遠隔測定信号が失われた期間を示している。 [この図は、17から変更されている]

図4:アトロピンダイビング徐脈を排除します 。アトロピン前処理後の拍動性動脈血の前に自発的にダイビングラット(A)の圧力及び(B)のオリジナル音源。トレースは、後続の動脈カニューレを用いて得た。アトロピン前処置の前に、動脈圧が水没時に若干減少したが、T鶏は、ダイビングの残りのためのプレダイブより大きく増加しました。心拍数は、隣接する脈圧間隔から決定した。水没時にはダイビングの期間持続した即時かつ実質的な徐脈があった。アトロピンの前処理による副交感神経遮断後の徐脈を除去した。潜水中の動脈圧の上昇があった。トレースの下のバーは、水没の期間を示している。 [マカロック、未発表]

図5:MDH内のFosラベリング。水中潜るように訓練したラットにおける三叉延髄後角(MDH)および脊髄三叉管(SP5)の顕微鏡写真。繰り返しなしのFosラベリングがないダイビングしなかった対照ラットでは、(A)(B)水泳ラットにおいて非常に点灯があるSP5内のFos MDH(大矢印)でラベルまたはparatrigeminal核(小さ な矢印)TLE。(C)のダイビングラットに比べてMDH(大矢印)とparatrigeminal核(小さ な矢印)の両方で腹ラベリングよりフォスがある水泳とコントロールラット。パネル(A)に挿入し、パネルのACの吻側 - 尾側の位置を示しています。パネルC中のスケールバーは100μmである。 [この図は、24から変更されている]

図6:ダイビングラットから活性化カテコールアミンニューロン。顕微鏡写真は非潜水対照ラット(A、C、およびE)と自発的にダイビングラット(B、D、およびF)のmedullasを示す。脳組織を免疫組織学的に両方のFosのANのために処理したdはチロシンヒドロキシラーゼ(TH)、ブラウンTHの細胞体および黒Fosの核を生成する。実線の矢印はFosのTH +二重標識されたニューロンを識別しながら、開いた矢印は、単一の標識されたTH陽性ニューロン識別する。 A1のニューロンAおよびB C1ニューロンにおいて同定されるがCで識別され、D. A5ニューロンは、EおよびFよりFosおよびA1、C1に見られる二重標識THにおいて同定されており、ダイビングラット以外のA5領域非ダイビング対照ラットで。 Eキャリブレーションバーは、パネルAF用であり、250μmである。 Fの挿入図でキャリブレーションバーは、すべてのインセットのためであり、50μmである。 [この図は、26から変更されている]
ディスカッション
食品6のために採餌しながら、彼らの野生の形でラットは、缶と半水生環境を活用行い、そして意志しばしばダイビング水中。したがって、ラットは非常に簡単に自発的に水中ダイビングを訓練することができることにも驚くべきことではない。記載されたトレーニングの手順は、ほとんどの成体ラット脳アトラス(〜300グラム)で使用されるボディサイズに、新たに離乳したラットをもたらすであろう、6週まで続くことがある。したがって、これらの訓練された動物からの脳はより容易に匹敵するこれらのアトラス内で識別解剖学的構造になります。
スタートエリアに配置された後、ほとんどのラットは、20秒以内に水中水泳を開始します。しかし、時折、ラットは、その自主的なダイビングを開始する前に、5分以上かかります。それは水中トンネル内にラットを強制的に、この段階では魅力的かもしれないが、これは一般的に負の経験を持つ水を関連付けるからラットを防止するために避けるべきである。げっ歯類は頑固月のiniti可能味方トレーニングセッション中に潜ることを拒否するが、彼らは水を終了する唯一の方法は迷路ダイブを完了することによってであると認識すると、それらは通常、すぐにスタートエリアに配置された後、彼らのダイブを開始する。
繰り返しと系統的トレーニング手順の重要な側面は、それらがラットによって経験される応力を低減するような方法で行われることである。ラットは、特に試験の間に仕上げエリアにいる間、自分の環境を探索させること、さらにストレスを減らすように思われる。ラットは、多くの場合、泳ぐために水を再入力、および/または、まだフィニッシュエリアプラットフォームの上に座っている間に頭の水中に沈めます。これはラットが、本質的に水嫌悪ではないことを示唆している。さらに、ラットは水泳やダイビング、または少ない糞17でフィニッシュエリアで待機して、日々のトレーニング結果の間に糞便ペレットを製造することは珍しいことではありませんしながら。一般的には少ないが、ラットが訓練中であると強調し、より少ないPEllets彼らが生成されます。作成した任意の糞は、比較的きれいな水を保つために、できるだけ早く水またはフィニッシュエリアから削除されます。
ラットは時折流血の鼻を得ることができ、鼻の通路への水のガス注入の結果である可能性があり、スイミングやダイビング、しばらく。血液の出現は、鼻粘膜内の浸透ストレスに起因し得る。裁判の間にフィニッシュエリア内ながらラットは自分自身をグルーミングします。鼻から結果の血液などのトレーニングセッションの過程で、特に目の周り、ラットにわずかに赤みを帯びた色合いを与え、ラットの頭と鼻の上に再配布得ることができます。また、時折ラットはストレスの多いダイビング見つけおよび/ または((5.4.3の後の注を参照。これを防ぐ方法について)振り向くとダイビング水中ながら迷子によってすなわち、)負のダイビング経験を持っている場合があります。これらのラットではポルフィリンは、ストレスRESPONSシグナリング、彼らの目の隅に表示される場合があります電子メール。
ダイビングタンクの大きさがある程度部屋の要件を決定する。記載されタンクはラットが5メートル長いプレキシグラスを通じて水面下で2〜3センチ泳ぐように設計されている10〜15秒17,19,24,26,27の水中遊泳期間を与えるために迷路。実験は、長い期間ダイブからの応答を測定するように設計されるべきである、または水中深くダイビングから、タンクは再設計する必要があるかもしれません。部屋要件は、その後も再設計されたダイビングタンクの寸法に合わせて変更することができます。手術室で利用可能な床ドレンがない場合、タンクからの水は、その後、従来の方法で他の場所に空にすることができる60ガロンゴミ缶のような大きな容器に収集することができる。
Fosの技術はさらにダイビング応答の脳幹回路の一部である神経細胞を同定し、特徴付けるために、他のニューロンの検出方法を利用することができる。例えば、自発的中に活性化された横方向A7領域26,27内に、およびグロボーサニューロン;チロシンヒドロキシラーゼ染色と併せてFosの検出は、A1、C1、A2、A5及びサブ青斑核領域(26、図6)におけるカテコールアミン作動性ニューロンを同定したダイビング。また、逆行性トレーサーコレラ毒素と一緒にFosの検出は、自主的なダイビング20の間に活性化されている疑核の外部形成以内に心臓迷走神経運動ニューロンの細胞体を同定した。
ダイビングの呼吸循環応答の中枢神経統合を調査するとの理由6,8,28の数のために重要である。ダイビング応答が長時間呼吸することなく水没水中を維持する、ヒトを含む動物を可能にします。ダイビング応答は脳幹恒常性制御の機能的再編成を示し、最も強力なPAの一つを示している動物で観察自律神経反射のtterns。ダイビング応答は三叉神経、心臓反射、咽頭反射、および/または、乳幼児突然死症候群の一部として、ヒトにおける臨床的に重要であり得る。最後に、ラットの脳幹内に存在する神経回路を理解することは、求心性の信号は、基本的な脳幹自律神経反射を変更する方法皮質判断するのに役立ちます。これらの考慮事項のすべては、本質的に価値のある興味深い哺乳類ダイビング応答の中心的な側面の研究を行う。記載されている手順を使用すると、自発的に水中強制潜っ動物の使用意志よりも哺乳類の潜水応答の中心的な態様のより良い調査が可能になりますダイビングをラットを訓練する。記載1のように、トレーニング手順は)CNSストレス回路の活性化を低減し、外部の報酬が使用されないため、2)CNSの報酬回路を活性化しないためである。
開示事項
著者はStoelting社のコンサルタントであり、商業的目的のためにそれらにマカロックダイブタンク迷路の全体的なデザインと仕様を提供しました。
謝辞
研究は研究スポンサープログラムの中西部大学事務所からの資金によってサポートされています。また、中西部の大学動物施設とエリック·ウォーレンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| McCulloch Diving Tank Maze | Stoelting Company | 60139 | |
| 1 inch internal diameter tubing | Fisher | 14-169-63 | Used to fill or drain tank |
| Plexiglas rodent restraint device (Economy flat bottomed restrainer) | Braintree | FB-M/L | For forced dives |
| Telemetric transmitters | DSI | Model PA-C40 (270-0040-008) | Used to transmit pulsatile arterial blood pressure |
| Hand-held antenna wand | DSI | Model RLA 3000 (272-5007) | Used to ensure radio antenna is near to transmitter while rat is negotiating underwater maze |
| Intramedic PE50, 0.023" ID | Fisher | 14-170-12B | Used as trailing arterial cannula |
| N95 mask - Moldex #2300N Series | Fisher | 19-003-246D | Used to limit inhalation of rat allergens |
参考文献
- Butler, P. J., Jones, D. R. Advances in Comparative Physiology and Biochemistry. Lowenstein, O. 8, Academic Press. 179-364 (1982).
- Butler, P. J., Jones, D. R. Physiology of diving birds and mammals). Physiol. Rev. 77, 837-899 (1997).
- Butler, P. J. Metabolic regulation in diving birds and mammals. Resp. Physiol. Neurobiol. 141, 297-315 (2004).
- Foster, G. E., Sheel, A. W. The human diving response, its function, and its control. Scand. J. Med. Sci. Sports. 15, 3-12 (2005).
- Lindholm, P., Lundgren, C. E. G. The physiology and pathophysiology of human breath-hold diving. J. Appl. Physiol. 106, 284-292 (2009).
- McCulloch, P. F. Animal models for investigating the central control of the mammalian diving response. Front. Physiol. 3, 1-16 (2012).
- Krogh, A. The progress of physiology. Am. J. Physiol. 90, 243-251 (1929).
- Panneton, W. M., Gan, Q., Juric, R. The rat: a laboratory model for studies of the diving response. J. Appl. Physiol. 108, 811-820 (2010).
- Lin, Y. C. Autonomic nervous control of cardiovascular responses during diving in the rat. Am. J. Physiol. 227, 601-605 (1974).
- Lin, Y. C., Baker, D. G. Cardiac output and its distribution during diving in the rat. Am. J. Physiol. 228, 733-737 (1975).
- Huang, T. F., Peng, Y. I. Role of the chemoreceptors in diving bradycardia in the rat. Jap. J. Physiol. 26, 395-401 (1976).
- Fahlman, A., Bostrom, B. L., Dillon, K. H., Jones, D. R. The genetic component of the forced diving bradycardia response in mammals. Front. Physiol. 2, 1-7 (2011).
- Blix, A. S., Folkow, B. Handbook of Physiology. Shepher, J. T., Abboud, F. M. , American Physiological Society. 917-944 (1984).
- Kooyman, G. L. Diverse Divers. 200, Springer-Verlag. (1989).
- MacArthur, R. A., Karpan, C. M. Heart rates of muskrats diving under simulated field conditions: persistence of the bradycardia response and factors modifying its expression. Can. J. Zool. 67, 1783-1792 (1989).
- McCulloch, P. F., Jones, D. R. Cortical influences on diving bradycardia in muskrats (Ondatra zibethicus). Physiol. Zool. 63, 1098-1117 (1990).
- McCulloch, P. F., Dinovo, K. M., Connolly, T. M. The cardiovascular and endocrine responses to voluntary and forced diving in trained and untrained rats. Am. J. Physiol. Regul. Integr. Comp. Physiol. 298, 224-234 (2010).
- Panneton, W. M., Gan, Q., Dahms, T. E. Cardiorespiratory and neural consequences of rats brought past their aerobic dive limit. J. Appl. Physiol. 109, 1256-1269 (2010).
- Chotiyanonta, J. S., DiNovo, K. M., McCulloch, P. F. Bilateral sectioning of the anterior ethmoidal nerves does not eliminate the diving response in voluntarily diving rats. Physiol. Reports. 1, (2013).
- Panneton, W. M., Anch, A. M., Panneton, W. M., Gan, Q. Parasympathetic preganglionic cardiac motoneurons labeled after voluntary diving. Front. Physiol. 5, 1-10 (2014).
- McCulloch, P. F., Ollenberger, G. P., Bekar, L. K., West, N. H. Trigeminal and chemoreceptor contributions to bradycardia during voluntary dives in rats. Am. J. Physiol. Regul. Integr. Comp. Physiol. 273, 814-822 (1997).
- Ollenberger, G. P., Matte, G., Wilkinson, A. A., West, N. H. Relative distribution of blood flow in rats during surface and submerged swimming. Comp. Biochem. Physiol. A. 119, 271-277 (1998).
- Ollenberger, G. P., West, N. H. Distribution of regional cerebral blood flow in voluntarily diving rats. J. Exp. Biol. 201, 549-558 (1998).
- McCulloch, P. F. Activation of the trigeminal medullary dorsal horn during voluntary diving in rats. Brain Res. 1051, 194-198 (2005).
- Panneton, W. M., et al. Activation of brainstem neurons by underwater diving in the rat. Front. Physiol. 3, 1-13 (2012).
- McCulloch, P. F., Panneton, W. M. Activation of brainstem catecholaminergic neurons during voluntary diving in rats. Brain Res. 984, 42-53 (2003).
- McCulloch, P. F. Globosa neurons: a distinct subgroup of noradrenergic neurons in the caudal pons of rats. Brain Res. 964, 164-167 (2003).
- Panneton, W. M. The mammalian diving response: an enigmatic reflex to preserve life. Physiology. 28, 284-297 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved