Method Article
筋ジストロフィー患者から人工多能性幹細胞の生成:尿由来細胞の効率的な統合·フリーリプログラミング
要約
This protocol entails detailed procedures for isolation of urine derived cells from muscular dystrophy patients; their efficient and rapid reprogramming through Sendai virus transduction.
要約
異栄養性心筋症は、筋ジストロフィーのあまり理解結果である。筋ジストロフィーの患者から誘導された多能性幹細胞(iPS細胞)を生成するインビトロ疾患モデル系のための貴重な細胞源であり、薬剤スクリーニング研究のために使用することができる。患者由来の尿細胞はジストロフィー性心筋1をモデル化するために、誘導多能性幹細胞への成功した再プログラミングに使用されてきた。ベクター系を統合する安全性の問題に対処する、我々は、筋ジストロフィーの患者から採取した尿細胞に山中因子の形質導入のための非組み込み型センダイウイルスベクターを使用してプロトコルを提示する。このプロトコルは、2〜3週間以内に完全に再プログラムされたクローンを生成します。多能性細胞は、流路13によりベクターフリーです。これらの異栄養性IPSCは、心筋細胞に分化し、病気のメカニズムを研究または薬物スクリーニングするために使用することができる。
概要
心筋症は、デュシェンヌ型とベッカー型筋ジストロフィー(MD)患者の死亡原因の第2位である。 X連鎖ジストロフィン遺伝子の変異が1で発生するものの:3500男性の出生、非常に少ない、プログレッシブ心筋の損傷につながる分子や細胞のイベントについて知られている。筋ジストロフィー患者由来のヒト誘導多能性幹細胞は、基礎疾患の機構を研究するために、薬剤は、1,2のスクリーニングに使用するための新規なツールとして浮上している。
皮膚生検または血液サンプルの予想不快感は、研究参加の同意を与えるために若い患者及び/またはその保護者を説得することができる。尿サンプルは、再プログラミング方法に修正可能である体細胞の非侵襲的な供給源である。我々は最近、筋ジストロフィー患者から採取した尿細胞は培養することができることを示しかつ効率的に山中因子とレトロウイルス形質導入を用いて、iPS細胞(に再プログラムしているあるOct3 / 4、Sox2の、Klf4及びc-Myc; OSKM)1。レトロウイルス遺伝子送達の欠点は、宿主染色体への初期化遺伝子のランダムな統合です。この制限を克服するために、我々は、尿細胞再プログラミングのための非組み込み型センダイウイルスを使用している。
このプロトコルは、さらなる研究のための心筋細胞または他の細胞型に分化させることができる筋ジストロフィー患者から単離された尿細胞のセンダイウイルス再プログラミングについて詳しく説明します。このプロトコルは、他の患者の特定の疾患に適合させることができる。
プロトコル
注:患者、および/またはその保護者は、研究を承認した治験審査委員会に参加するためにインフォームドコンセントを与える必要があります。
1.バッファとメディアの準備
- 洗浄緩衝液:リン酸緩衝食塩水(PBS)の99 mlの100×ペニシリン/ストレプトマイシン溶液を1ml(100 U / mlペニシリン+ストレプトマイシン100μg/ mlの)を追加し、洗浄緩衝液100mlを調製する。
- 尿中前駆細胞(UPC)ミディアム:ケラチノサイト無血清(KSF)ミディアム+前駆細胞培地を等量混ぜ、UPC媒体を作製した。
- KSF中:上皮成長因子の5 ng / mlの(EGF)、ウシ下垂体抽出物の50 ng / mlの(BPE)、コレラ毒素の30 ng / mlの、およびペニシリン/ストレプトマイシン溶液(100 Uを追加し、ケラチノサイト培地を調製するために/ mlペニシリン、500ミリリットルKSF培地に100μg/ mlのストレプトマイシン)。
- 前駆細胞培地:10%FBSでハム-F12培地とサプリメントの四分の一を含むDMEMの4分の3の追加、0.4 / mlのヒドロコルチゾン、0.1nMのコレラ毒素、5 / mlのインスリン、1.8×10 -4 Mのアデニン/ mlのトランスフェリン、2をx 10 -9 Mのトリヨードサイロニン、10ng / mlのEGF、およびペニシリン/ストレプトマイシン溶液を5μg。
- のhES培地:/ 20%KO血清代替(K-SR)を追加し1×MEM非必須アミノ酸、2mMのL-グルタミン、100μMのβメルカプトエタノール、20ng / mlのbFGFおよびペニシリン/ストレプトマイシン400 mlのDMEM F12培地。
2.尿サンプルコレクション
- 尿の十分な量(〜30〜40ミリリットル)を収集することができることを保証するために採尿に30分前に流体を飲むように患者に指示します。
- 患者および/またはその保護以下の項目を含む尿採取キットを与える:(1)滅菌またはクリーンキャッチ尿サンプルを入手する方法についての説明書、(2)湿った抗菌toilettes、及び(3)を100mlの滅菌標本コレクションカップ。サンプルを収集するために患者に指示します。
- 直ちに氷上に尿サンプルを配置し、laboraに移転クーラーでトーリー。すぐに細胞単離のための尿を処理します。遅延が避けられない場合には、細胞の生存率の損失を最小限に抑えて、最大4時間氷上で試料を保存する。
3.単離と尿細胞の拡大
注:BSL2生物学的安全キャビネット内無菌条件下で、次の手順を実行します。
- 滅菌ピペットを用いて、転送尿サンプルを50ml遠心管に無菌である。 RTで10分間、400×gで遠心分離する。
- チューブ内の1ミリリットルを残して上清を吸引。細胞ペレットを乱さないように注意してください。
- 再懸濁洗浄緩衝液7mlの中に複数の管からペレットを組み合わせて、RTで10分間、400×gで遠心分離を繰り返し。
- 慎重に細胞ペレット及び上清〜0.2〜0.5ミリリットルを残して、上清を吸引除去する。尿中前駆細胞(UPC)培地2〜3mlの中で再懸濁し、国連の4〜6ウェルにサスペンションを転送コートした24ウエルプレート。
- 72時間後、ウェル当たり新鮮UPC培地の0.5ミリリットルと文化を補完し、2〜3日ごとに後の培地に変更します。プレートに付着していない赤血球と扁平上皮細胞を培地変更で削除されます。
- 4-6日後の培養を監視します。
注:小2-4細胞コロニーが現れ始めます。細胞は、それぞれタイプIまたは腎上皮のタイプII(RE)のセル3を表す丸めまたは伸長される。 - 細胞が表示されたら、彼らは急速な拡大期を受けることになるので、2〜3日毎に培地を変更します。
- 細胞がプレーティング後9-15日を中心に、80〜90%のコンフルエンスに到達すると、さらなる拡大のために24ウェルプレートの2-4ウェル上に細胞(15,000-18,000細胞/ cm 2)を解離して通過。細胞継代1(P1)としてこれをマークします。
- フローサイトメトリー分析を介して系統仕様の尿細胞を特徴づける、immunohistochemiCalの染色または逆転写酵素 - ポリメラーゼ連鎖反応(RT-PCR)を介し。
- 長期間の凍結保存のために(DMEM、10%血清および10%DMSOを補った)孤立した尿細胞(セクション4)を再プログラムまたは凍結培地にそれらを凍結する。
センダイウイルスを使用する4.尿細胞リプログラミング
注:トランスフェクションエージェントを操作しながら適切な取り扱いとPPE(個人用保護具)の使用が推奨されます。 BSL2生物学的安全キャビネット内無菌状態で、次の手順を実行します。薬剤および/またはトランスフェクトされた細胞をトランスフェクトする適切な処分は、環境と健康の危険のリスクを回避することをお勧めします。以下に詳述するように、尿細胞の再プログラミングについては、メーカーのフィーダー依存プロトコルへの変更を加えて仙台リプログラミングキットを使用しています。
- センダイウイルスを用いた高効率な再プログラミングを確保するために、使用が急速である尿細胞の1-5通路LYは分裂。細胞が十分に複製または老化にならない場合は、彼らが効率的に再プログラムしないので、それらを捨てる。
- 6ウェルプレートの2つのウェルにおける種子ウェル当たり60,000個の細胞。マーク·デイ-2としてこの。細胞播種密度を調整し(5×10 4から 9×10 4個の細胞をウェルあたり)0日によって80〜90%コンフルエンスに到達するために必要である。
- 0日目(細胞を播種後48時間)で、4 OSKM因子のそれぞれを含む仙台リプログラミングベクター(SeVの)を調製。予め温めUPC培地1mlにベクトルの各々を加える。尿細胞を再プログラミングするための十分である、1〜1.5のMOI(5〜7.5×10 5 CIU)を使用します。メディアを吸引し、ゆっくりと尿細胞の1ウェルに1ミリリットルUPC +のSeVを追加します。形質導入ネガティブコントロールとして第2のウェルを使用してください。
- 1日目に、新鮮なUPC媒体とUPC + SeVの媒体を交換してください。いくつかの細胞死は、ウイルス細胞毒性によるものでは24時間後に見られている。
- 再プログラムCLONの効率に応じて、Eの形成とコンパクトな形態は、6日目または7まで毎日培地を変え続ける。
- 前に形質導入した細胞(5日目または6)、マイトマイシンC(3時間、10μg/ ml)を0.1に5×10 4細胞/ cm 2の密度で処理された、MEFのメッキをMEFフィーダープレートを準備の解離の一日%のゼラチンは100ミリメートル2培養皿をコーティングした。
- 次の日(6日目または7)、0.25%トリプシンで細胞を解離UPC培地プレートに5×10 4細胞を再懸濁する- 2×10 5細胞/ 100のmm 2のMEFフィーダープレート。
- 次の日は、hES培地に切り替えて、毎日培地を変更します。形質転換細胞を監視するために、顕微鏡下で細胞を観察します。
注:細胞は、特徴的な敷石状形態を有するクローンの凝集体を形成し、細胞質の比率(12-18日後に形質導入)に高い核を有する。 - 形質導入後2〜3週間以内に、コロニーをピックアップし、CLONのための新しいプレートに移すアル展開。
- 37℃で1時間、TRA-1-81抗体で細胞をインキュベートすることによって、IPSCクローンを選択するための生細胞染色を行う CO 2インキュベーター中で37℃で1時間、特定の蛍光色素結合二次抗体との対比染色に続いてCO 2インキュベーター内でC°。
- 小さな等しい大きさの小片(クローンあたり4-6個)にクロスハッチ大きなTRA-1-81陽性のIPSCクローンに26 G 1.5インチの針を使用してください。
- マトリゲル(10μgの/ cm 2程度)の各ウェルに複数のクローンから10-20クロスハッチング部分をピックアップし、転送するために滅菌ピペットチップを使用して、hES培地で24ウェルプレートをコーティングさ。
注:単一のウェルに個々にメッキ単一のクローンからの小品が展開または多能性を維持していない。 - 再プログラムされたクローンは、マトリゲル表面に取り付けられた後のIPSC媒体へのhESからの変化24〜48時間。
- マトリ被覆プレート上のメンテナンス時に、手動でSCRAPE-オフあらゆる分化した細胞または完全に再プログラムし、多能性ジストロフィーIPSC(MD-IPSC)のクローンを濃縮するためにピペットチップを用いてMEFフィーダー細胞を汚染する。
- 個々のクローンは、〜100μmのサイズに達した後、3分間の0.48 mMのEDTA(エチレンジアミン四酢酸)溶液を用いて解離および5μMY27632補充したIPSC培地に懸濁MD-iPS細胞の小細胞凝集体(、RhOなどキナーゼ阻害剤をめっきすることによってクローンを拡大する)新鮮なマトリゲル上で(を10μg/ cm 2)をコーティングした12ウェルプレート。毎日のIPSC媒体を変更します。
- 各クローンの完全な再プログラミングはOSKM遺伝子および多能性マーカー(のOct3 / 4、TRA-1-81)の免疫組織化学染色の両方の遺伝子発現解析によって決定することができる。多能性の可能性の厳格な評価は完全に再プログラムIPSC線が三胚葉に分化することができる確認するために用いられるべきである。これは、胚様体(EB)形成および分化アッセイによって、またはターどちら達成することができる血腫形成アッセイ。
結果
(それぞれ97.37パーセント、97.09パーセント、および97.3%; 図1Aおよび図1B)は、ヒト尿から単離されたほとんどの前駆細胞は、CD44、CD73、およびCD146などの尿路上皮前駆細胞および周皮細胞のマーカーに対して陽性である。これらの細胞は、α平滑筋アクチン、およびビメンチン( 図1B)のような他の間葉系マーカーを発現した。サイトケラチン-7(CK-7)、ウロプラキン(UP)-Ia&-IIIa、尿路上皮細胞系列のマーカー( 図1C)の弱い発現が存在するようにRT-PCR分析は、培養物中の細胞の混合集団の証拠を与える。
再プログラミングステップは、図2Aに概略的に要約されている。代表的な画像は、プロトコル( 図2B)を通じて異なる時点の間、細胞の形態を示す。尿細胞は、再プログラミング中に石畳のパターン(4日目)に細長い、II型細胞(0日目)から変換する。 BY 12日目、典型的な多能性クローン(IPSC)が見られ、フィーダーフリーの条件下でのそれらの多能性形態(IPSC-P2)を維持することができるされている。 TRA-1-81のためのライブ細胞染色は、再プログラムされたクローン( 図2C)を識別します。
ベクターおよびトランスジーンフリー多能性クローンの生成を確認するために、RT-PCRは、センダイウイルスゲノムおよび外因OSKM因子の各々に対するプライマーを用いて行われる。内因性再プログラミング因子のアップレギュレーションはまた、このステップで確認することができる。外来遺伝子の発現はもはや通路13によって検出されないが、内因性因子のアップレギュレーションは、( 図3A)が見られる。免疫蛍光染色は、iPS細胞における多能性マーカーの発現を確認する(あるOct3 / 4、TRA-1-81を、 図3B)。尿細胞で見られる内因性のリプログラミング遺伝子の発現は、他の体細胞の供給源と比較して、より高い効率1に再プログラムするために、これらの細胞を導くことができる。 EXPRESジストロフィン遺伝子およびタンパク質のシオンは、免疫蛍光染色、ウェスタンブロット(WB)とRT-PCR分析( 図3C-E)によって確認される。ジストロフィンのための野生型UCのとiPS細胞の免疫蛍光染色は、iPS細胞で明らかに核局在11を実証するが、非常に少数のUCSはポジティブ( 図3C)を表明した。細胞におけるジストロフィン発現を確認するために、ジストロフィンのためのイムノブロット分析は、ユビキタスジストロフィンアイソフォーム(DP71)は、野生型iPS細胞で生産優勢アイソフォームであることを明らかにし、ジストロフィー性IPSCは、ジストロフィン遺伝子の発現を欠いている間検出不可能DP71発現( 図3D)を有する。ジストロフィンのエキソンの欠失変異は削除エキソンに隣接する特異的プライマーを用いて、ジストロフィー性IPSCに確認することができる。野生型性IPSCがジストロフィン転写増幅( 図3E)を実証する一方、無PCR増幅は、ジストロフィー性IPSCに検出されない。
ページ内= "常に"> 
孤立した尿細胞(UCS)の図1.キャラは尿路上皮前駆細胞、間葉系および平滑筋系統を示している。のUCSの(A)フローサイトメトリー分析は、尿路上皮と周皮細胞のマーカーCD44、CD73およびCD146に対するコンジュゲート抗体でプローブした。 CD44、αSMAとビメンチンとのUCSの(B)免疫蛍光染色。 α-平滑筋アクチン(αSMA)の遺伝子発現が陽性対照に匹敵する一方、陽性対照試料と比較して(C)UCのの遺伝子発現プロフィールが弱いCK-7の発現およびUP-IaおよびUP-IIIaのを示している。 こちらをクリックしてくださいこの図の拡大版を表示します。
アップロード/ 52032 / 52032fig2highres.jpg "幅は=" 700px "/>
性IPSCを生成するためにUCの図2.リプログラミング。再プログラミングのタイムラインの(A)概略図。 (B)0日(センダイウイルス形質導入)、4日(形態転移)、12日目にSeVの伝達の際のUCSの異なる形態を表す画像、(多能性クローンはMEF上新興)とフィーダーを含まない条件下での特性IPSCクローン(IPSCをマトリゲル上の-P2)。 (C)TRA-1-81 17日目での多能性コロニーを同定するためのライブセルイメージング。 この図の拡大版をご覧になるにはこちらをクリックしてください。
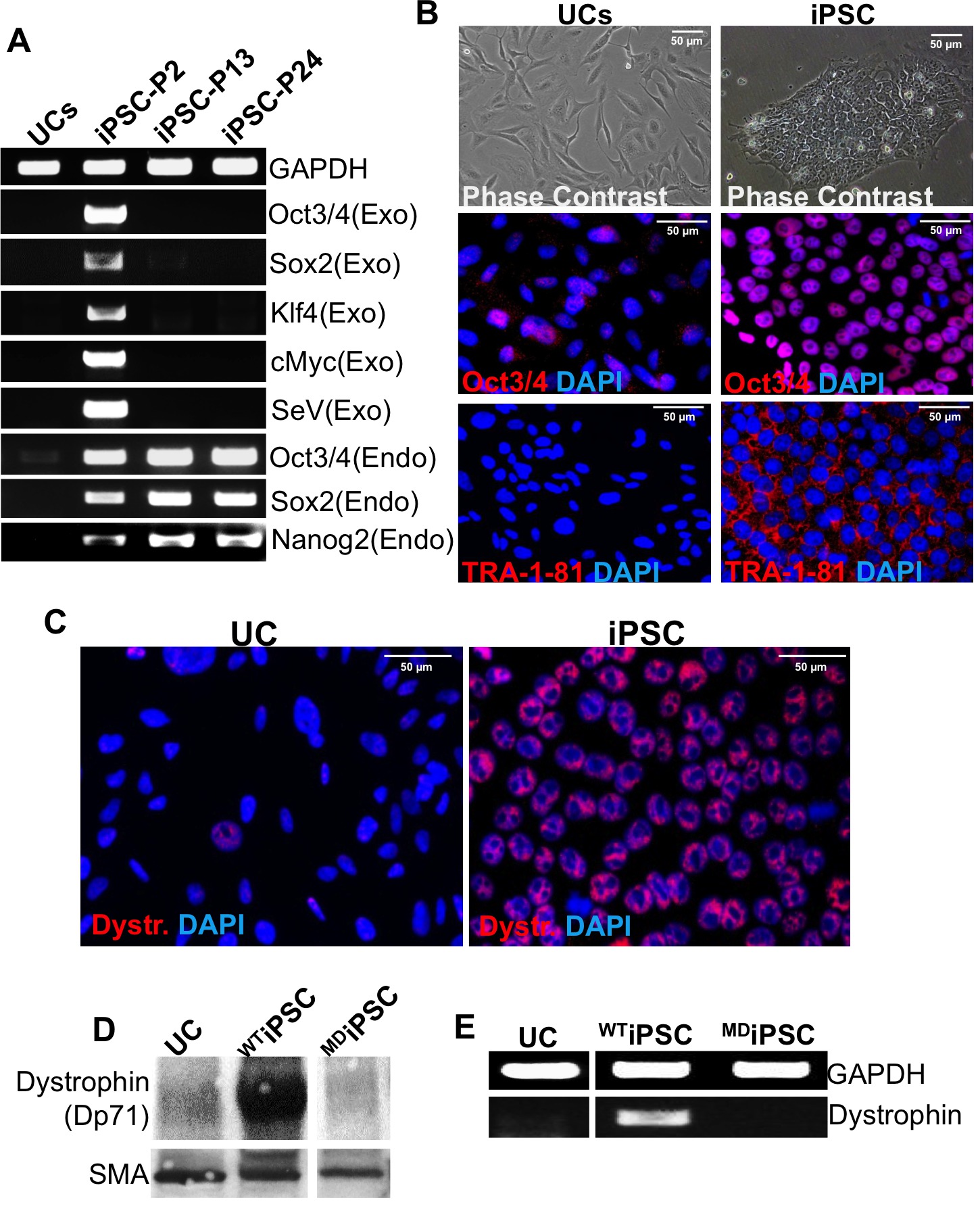
ウイルスゲノムおよび導入遺伝子フリー性IPSCの図3世代。(A)遺伝子発現解析の内在性遺伝子発現は全体で解決しないながら通路13(IPSC-P13)による通路2(IPSC-P2)でのSeVゲノムとOSKM導入遺伝子の存在とその消失を示しています。 UCの、得られるiPS細胞でのOct3 / 4、TRA-1-81染色を比較する(B)位相差画像および免疫蛍光。 (C)ジストロフィンは、野生型と比較して、UCの野生型のiPS細胞で免疫蛍光によって検出され、および(D)特定のジストロフィンアイソフォーム(DP71)は、WBによって確認することができる。 (E)RT-PCR解析は、野生型UCのとiPS細胞に比べて異栄養性IPSCにおける具体的なジストロフィンのエクソンの削除を確認するために使用されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 試薬/材料/機器の名称 | 会社 | カタログ番号 | 注釈 |
| GAPDH-フォワードプライマー | IDT社 | コメントに与えられた配列 | GTGGACCTGACCTGCCGTCT |
| GAPDH-リバースプライマー | IDT社 | コメントに与えられた配列 | GGAGGAGTGGGTGTCGCTGT |
| CK7-フォワードプライマー | IDT社 | コメントに与えられた配列 | TGGTGCTGAAGAAGGATGTG |
| CK7-リバースプライマー | IDT社 | コメントに与えられた配列 | CACGCTGGTTCTTGATGTTG |
| アップ-IA-フォワードプライマー | IDT社 | コメントに与えられた配列 | ACGTCCTACACCCACCGTGA |
| アップ-IA-リバースプライマー | IDT社 | コメントに与えられた配列 | ACCCCACGTGTAGCTGTCGAT |
| アップ-IIIA-フォワードプライマー | IDT社 | 配列Gコメント欄でiven | ACAAACAGAGGGTGGGAGGA CAG |
| アップ-IIIA-リバースプライマー | IDT社 | コメントに与えられた配列 | AGAAGGGCAGGGAGCCCAGG |
| αSMA、フォワードプライマー | IDT社 | コメントに与えられた配列 | ACCCACAATGTCCCCATCTA |
| αSMA、リバースプライマー | IDT社 | コメントに与えられた配列 | TGATCCACATCTGCTGGAAG |
| OCT3 / 4(外因性)-forwardプライマー* | IDT社 | *ライフテック-Cytotuneキット | CCCGAAAGAGAAAGCGAACCAG |
| OCT3 / 4(外因性)-reverseプライマー* | IDT社 | *ライフテック-Cytotuneキット | AATGTATCGAAGGTGCTCAA |
| Sox2の(外因性)-forwardプライマー* | IDT社 | *ライフテック-Cytotuneキット | ATGCACCGCTACGACGTGAG CGC |
| Sox2の(外因性)-ReversEプライマー* | IDT社 | *ライフテック-Cytotuneキット | AATGTATCGAAGGTGCTCAA |
| KLF4(外因性)-forwardプライマー* | IDT社 | *ライフテック-Cytotuneキット | TTCCTGCATGCCAGAGGAGCCC |
| KLF4(外因性)-reverseプライマー* | IDT社 | *ライフテック-Cytotuneキット | AATGTATCGAAGGTGCTCAA |
| CMYC(外因性)-forwardプライマー* | IDT社 | *ライフテック-Cytotuneキット | TAACTGACTAGCAGGCTTGTCG |
| CMYC(外因性)-reverseプライマー* | IDT社 | *ライフテック-Cytotuneキット | TCCACATACAGTCCTGGATGAT GATG |
| センダイウイルス(外因性)-forwardプライマー* | IDT社 | *ライフテック-Cytotuneキット | GGATCACTAGGTGATATCGAGC |
| センダイウイルス(外因性)-reverseプライマー* | IDT社 | *ライフテック-Cytotuneキット | ACCAGACAAGAGTTTAAGAGA TATGTATC |
| OCT3 / 4(内因性)-forwardプライマー | IDT社 | コメントに与えられた配列 | CAGTGCCCGAAACCCACAC |
| OCT3 / 4(内因性)-reverseプライマー | IDT社 | コメントに与えられた配列 | GGAGACCCAGCAGCCTCAAA |
| Sox2の(内因性)-forwardプライマー | IDT社 | コメントに与えられた配列 | CAAGATGCACAACTCGGAGA |
| Sox2の(内因性)-reverseプライマー | IDT社 | コメントに与えられた配列 | GTTCATGTGCGCGTAACTGT |
| ジストロフィンフォワードプライマー | IDT社 | コメントに与えられた配列 | GGCAAAAACTGCCAAAAGAA |
| ジストロフィンリバースプライマー | IDT社 | コメントに与えられた配列 | GACCTGCCAGTGGAGGATTA |
ぷりの表1.リストマーシーケンス。
ディスカッション
性IPSCを使用して、心血管疾患のモデリングは、遺伝的寄与4-6を理解するための一般的なアプローチになってきている。患者から細胞サンプルを取得するいくつかの予期せぬ困難、特に幼い子供たちは、そのような尿収集などの非侵襲的アプローチのオプションを提供することによって回避することができる。この若い患者集団では、再プログラミングのための十分な尿細胞を得るのに十分な尿量を収集することはしばしば困難である。前採尿に流体30分を飲むように若い患者をコーチングすることは尿細胞単離の成功を向上させます。しかし、繰り返し尿コレクションがこの集団に必要な場合があります。我々は、合わせて、筋ジストロフィーを有する患者からのUCの単離および培養を最適化するために、2つの異なるプロトコル3,7を適応している。
誘導多能性幹細胞は、筋ジストロフィーpatienから皮膚線維芽細胞または尿細胞のいずれかから生成されているTS 1,2。しかし、両方の再プログラミングプロトコルは体細胞に再プログラミング因子を導入するレンチウイルスに依存した。導入遺伝子は、無作為に宿主ゲノムに組み込まれ、(8に概説)導入遺伝子の再活性化または突然変異誘発のいずれかが発生する場合、この組み込み型ウイルス送達方法は、問題となる可能性がある。したがって、我々は、非統合的に9における尿細胞にOSKM導入遺伝子を形質導入するセンダイウイルスを使用して、これらの技術に改良された。
UCのを再プログラムするセンダイウイルスを使用するこの方法は、より高い導入効率9,10非統合アプローチの利点を提供しています。筋ジストロフィー患者から採取した尿細胞は、2〜3週間後に形質導入以内に再プログラムされている。これらの再プログラミング反応速度論は、レンチウイルス形質導入1を使用してUCの再プログラミングに匹敵する。このプロトコルは、尿細胞の再プログラミングのためのフィーダーなしの方法を確立するためにスケーリングすることができますが、あること筋ジストロフィー患者から単離された尿細胞のセンダイウイルス形質導入を用いた効率的な方法をる。記載され、この方法は完全に継代2 ATにフィーダーなしの条件を転送する前に、多能性MDクローンを確立するために、フィーダー層としてのMEFに依存しています。
ジストロフィンタンパク質のDP71アイソフォームの核の分布が長い異なる胚期細胞モデル11,12で確立されている。初期の前駆細胞/胚期細胞の核マトリックス画分中DP71この遍在的な発現は、核のアーキテクチャおよび細胞周期調節12における役割を示唆している。私たちの再プログラム野生型性IPSCは、DP71を表現。しかし、異栄養性IPSCにおけるその不在は、再プログラミングまたはジストロフィー細胞の多能性の可能性を阻害しない。結論として、ジストロフィー遺伝子突然変異は再プログラム性IPSCで保存されている。それジストロフィー心筋症をモデル化するための効率的なツールとなっています。
開示事項
The authors declare that they have no competing financial interests.
謝辞
Development of this protocol was supported by the Advancing a Healthier Wisconsin and the National Center for Advancing Translational Sciences, National Institutes of Health, through Grant Number 8UL1TR000055. Its contents are solely the responsibility of the authors and do not necessarily represent the official views of the NIH.
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 4 Oz. Specimen Cup with Lid | STL Medical Supply | M9AMSAS340 | For Urine Sample Collection |
| 15 ml BD-Falcon Tubes | Fisher Scientific | 352097 | |
| 50 ml BD-Falcon Tubes | Fisher Scientific | 352098 | |
| Round Glass Coverslips | Fisher Scientific | 12-545-81 | |
| CytoTune-iPS Sendai Reprogramming Kit | Life Technologies | A1378-001 | |
| PBS, pH 7.4 | Life Technologies | 10010-023 | |
| Pen-Strep w/o Glutamine | Life Technologies | 15140-122 | Warm in 37 °C water bath before use |
| RPMI Medium 1640 | Life Technologies | 11875-093 | Warm in 37 °C water bath before use |
| B-27 Supplement w/Insulin (50x) | Life Technologies | 17504-044 | Warm in 37 °C water bath before use |
| B-27 Supplement w/o Insulin (50x) | Life Technologies | 0050129SA | Warm in 37 °C water bath before use |
| DMEM/F12 (1:1) | Life Technologies | 11330-032 | Warm in 37 °C water bath before use |
| Versene, 1:5,000 | Life Technologies | 15040066 | Warm in 37 °C water bath before use |
| bFGF (10 µg) | Life Technologies | 13256-029 | Warm in 37 °C water bath before use |
| Cell Counter Cartridges | Life Technologies | C10228 | |
| Knockout Serum (500 ml Bottle) | Life Technologies | 10828-028 | Warm in 37 °C water bath before use |
| Recovery Cell Culture Freezing Medium | Life Technologies | 12648-010 | |
| Keratinocyte-SFM (1x), Liquid | Life Technologies | 17005-042 | Warm in 37 °C water bath before use |
| DMEM, High Glucose, Glutamax | Life Technologies | 10566-016 | Warm in 37 °C water bath before use |
| Ham's F-12 Nutrient Mix | Life Technologies | 11765-054 | Warm in 37 °C water bath before use |
| EGF Recombinant Human Protein, Liquid Form | Life Technologies | PHG0311L | Warm in 37 °C water bath before use |
| Insulin, Human Recombinant, Zinc Soln | Life Technologies | 12585-014 | Warm in 37 °C water bath before use |
| TeSR-E8 | Stem Cell Technologies | 5940 | Warm in 37 °C water bath before use |
| ROCK Inhibitor (Y-27632) | Selleck | S1049 | Warm in 37 °C water bath before use |
| Matrigel | BD Biosciences | 354277 | hESC Qualified Matrix, LVED Free |
| RNeasy Mini Kit | Qiagen | 74104 | |
| iScript cDNA Synthesis Kit | Bio-Rad | 170-8890 | |
| DreamTaq Green PCR Master Mix (2x) | Thermo-Scientific | K1081 | |
| FBS-Qualified | Sigma Aldrich | F6178 | Warm in 37 °C water bath before use |
| Adenine Bioreagent | Sigma Aldrich | A2786-5G | Warm in 37 °C water bath before use |
| Cholera Toxin from Vibrio cholerae | Sigma Aldrich | C8052-.5MG | Warm in 37 °C water bath before use |
| Hydrocortisone | Sigma Aldrich | H0888-1G | Warm in 37 °C water bath before use |
| Holo-transferrin from human | Sigma Aldrich | T0665-50MG | Warm in 37 °C water bath before use |
| 3,3',5-Triiodo-L-thyronine sodium salt | Sigma Aldrich | T6397-100MG | Warm in 37 °C water bath before use |
| DAPI | Santa Cruz Biotechnology | SC-3598 | |
| Fluoromount Aquous mounting medium | Sigma Aldrich | F4680 | |
| 16% Paraformaldehyde | Alfa-Aesar | 43368 | |
| Antibodies | |||
| Mouse anti CD44 - labeled with FITC | BD Biosciences | 560977 | |
| Mouse anti CD146 - labeled with PE | BD Biosciences | 561013 | |
| Mouse anti CD73 - labeled with PE | BD Biosciences | 561014 | |
| Mouse anti-α-smooth muscle actin | Sigma Aldrich | A2547 | |
| Mouse anti-Vimentin | Abcam | ab8978-100 | |
| Mouse Anti - TRA-1-81 | Life Technologies | 411100 | |
| Rabbit anti Oct 3/4 | Santa Cruz Biotechnology | SC-9081 | |
| Mouse Anti Dystrophin | Leica Biosystems | NCL-DYSB | |
参考文献
- Guan, X., et al. Dystrophin-deficient cardiomyocytes derived from human urine: New biologic reagents for drug discovery. Stem Cell Research. 12 (2), 467-480 (2014).
- Dick, E., et al. Exon Skipping and Gene Transfer Restore Dystrophin Expression in Human Induced Pluripotent Stem Cells-Cardiomyocytes Harboring DMD Mutations. Stem Cells Dev. 22 (20), 2714-2724 (2013).
- Zhou, T., et al. Generation of human induced pluripotent stem cells from urine samples. Nat Protoc. 7 (12), 2080-2089 (2012).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient. Nat Rev Mol Cell Biol. 13 (11), 713-726 (2012).
- Carvajal-Vergara, X., et al. Patient-specific induced pluripotent stem-cell-derived models of LEOPARD syndrome. Nature. 465 (7299), 808-812 (2010).
- Sun, N., et al. Patient-Specific Induced Pluripotent Stem Cells as a Model for Familial Dilated Cardiomyopathy. Science Translational Medicine. 4 (130), 130ra147 (2012).
- Zhang, Y., et al. Urine derived cells are a potential source for urological tissue reconstruction. J Urol. 180 (5), 2226-2233 (2008).
- Bayart, E., Cohen-Haguenauer, O. Technological overview of iPS induction from human adult somatic cells. Curr Gene Ther. 13 (2), 73-92 (2013).
- Malik, N., Rao, M. S. A review of the methods for human iPSC derivation. Methods Mol Biol. 997, 23-33 (2013).
- Nakanishi, M., Otsu, M. Development of Sendai virus vectors and their potential applications in gene therapy and regenerative medicine. Curr. Gene Ther. 12 (5), 410-416 (2012).
- González-Ramírez, R., Morales-Lázaro, S. L., Tapia-Ramírez, V., Mornet, D., Cisneros, B. Nuclear and nuclear envelope localization of dystrophin Dp71 and dystrophin-associated proteins (DAPs) in the C2C12 muscle cells: DAPs nuclear localization is modulated during myogenesis. J Cell Biochem. 105 (3), 735-745 (2008).
- Villarreal-Silva, M., Centeno-Cruz, F., Suárez-Sánchez, R., Garrido, E., Cisneros, B. Knockdown of dystrophin Dp71 impairs PC12 cells cycle: localization in the spindle and cytokinesis structures implies a role for Dp71 in cell division. PloS One. 6 (8), e23504 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved