Method Article
迅速な細菌同定および抗生物質感受性試験のための血液培養ペレットの調製
要約
陽性の血液培養からの急速な細菌ペレット製剤は、MALDI-TOFによる識別、グラム染色、抗生物質感受性試験およびPCRに基づく試験のような用途のための試料とすることができる。結果は、急速に血流感染症に罹患している患者の転帰を改善するために臨床医に伝えることができる。
要約
血流感染および敗血症は、罹患率および死亡率の主な原因である。菌血症を患っている患者の成功した結果は、最適な抗生物質治療を導くために、感染因子の迅速な同定に依存する。陽性の血液培養からのグラム染色の解析が急速に行われ、すでに大幅に抗生物質投与計画に影響を与えることができます。しかし、感染因子の正確な同定は、依然として最適な標的治療を確立するために必要とされる。ここでは、ディスク拡散アッセイまたは自動ASTシステムによるMALDI-TOF MSによる同定、抗生物質感受性試験(AST)などのいくつかの本質的なダウンストリームアプリケーションのための試料とすることができる陽性の血液培養から簡単かつ迅速に細菌ペレット製剤を提示自動化されたPCRベースの診断試験による。血液培養、細菌のペレットに直接適用これらの異なる識別およびASTシステムの性能は非常にSiである通常、寒天プレート上で増殖させた単離されたコロニーから得られた性能にmilar。従来のアプローチと比較して、細菌ペレットの迅速な取得が有意に識別およびASTの両方を報告する時間が短縮される。したがって、血液培養陽性以下、MALDI-TOFによって同定はそれぞれ8〜18時間内、自動ASTシステムやディスク拡散アッセイによりASTの結果に対し、1時間未満以内に報告することができる。同様に、迅速なPCRに基づくアッセイの結果は、菌血症の報告後2時間未満で臨床医に伝えることができる。まとめると、これらの結果は、血液培養細菌ペレットの迅速な調製が同定およびASTのターンアラウンド時間に、従って、血流感染に罹患している患者の成功した結果に大きな影響を与えることを示している。
概要
入院患者における血流感染および敗血症は、罹患率および死亡率の主な原因である。したがって、感染血流に関連した死亡率は、入院患者の37%に約14%で観察され、集中治療室に35%の患者1-3を増加させることができる。感染性病原体の迅速な同定は、最適な抗菌処理を案内すると、抗菌薬治療4,5の成功の結果を高めるために極めて重要である。陽性の血液培養からのグラム染色の迅速な分析がすでに抗菌療法6,7が、感染性因子の正確な同定の適応に重要な影響を持っている患者への最適な適応抗生物質治療を提供するために必要である。例えば、異なる抗生物質による治療レジメンは、グラム染色によって区別することが困難であり、腸球菌および連鎖球菌による菌血症以下に実装されなければならない。同様に、種での識別がLEVエルは、8ラクタムβに増加した抵抗性を付与する染色体がAmpC遺伝子をコードするグラム陰性腸内細菌を検出する必要がある。
血液培養陽性の場合、従来の診断アプローチは、生化学検査、異なる選択培地上での成長および自動化された微生物同定システムを含むさまざまなアプローチを有する追加のインキュベーションの前に識別の数時間を必要とする別の寒天プレート上の感染性病原体を、継代培養することである。従来の診断アプローチの結果までの時間は約1〜3日間である。
微生物の迅速な同定のためのマトリックス支援レーザー脱離/イオン化飛行時間型質量分析(MALDI-TOF)技術の出現は、迅速に陽性の血液から直接、また、寒天プレート上で増殖させたコロニーから微生物しかしを識別するための新しいツールを提供している培養物( 図1)9-12。のTh血液培養から感染性病原体を識別するために、MALDI-TOFのEの使用は、数分の代わりに伝統的な方法が必要とする時間と曜日に、結果までの時間を削減しました。 Croxatto ら 13で説明したように、MALDI-TOF同定の効率は、微生物の純度と量など、さまざまなパラメータに依存しています。これらの2つの基準が簡単に寒天プレート上で増殖させた個別のコロニーから得られたが、MALDI-TOF識別を妨害する可能性が複数の細胞およびタンパク質の成分を含んでいてそのような血液培養などの複雑なサンプルからの細菌の濃縮および精製のための分析前処理が必要である。
血液培養から各種微生物'単離方法は、サポニンまたは細菌抽出9,14、血清分離方法10のための他の中性洗剤法を含む多くの研究が、溶解遠心分離方法12において使用されているなどsepsityperキットとして市販ソリューションを提供しています。当社の細菌学診断研究所は、MALDI-TOFによる細菌や酵母の迅速同定および自動識別システム( 図2)15 を許可し 、塩化アンモニウム赤血球溶解に基づく簡単な血液培養細菌ペレット製剤を開発しました。この血液培養ペレット製剤はまた、グラム染色、メチシリン耐性黄色ブドウ球菌 (MRSA)の迅速な検出、およびと抗生物質感受性試験用のPOCT-PCRのような自動化されたPCRベースの診断テストのような他の直接下流のアプリケーションのためのサンプルを提供自動化されたASTシステムおよび/ または寒天プレート上のディスク拡散アッセイ( 図3)による。
Prod'hom らが説明したように、本 研究では、血液培養細菌ペレットを製造するための異なるステップを説明します。15( 図4)。また、解除しますMALDI-TOF 15による同定、識別(ID)と、 腸内細菌やブドウ球菌および自動化されたPCR-のための自動化されたシステム16と抗生物質感受性試験(AST):血液培養ペレット上で実行できる主なアプリケーションの3のためのプロトコルをスクライブMRSA 17の検出のためのベースの診断テスト。
プロトコル
このプロトコルが開発され、日常的なツールとして実装される前に、当社の機関の研究開発プロセスや倫理的なルールに従う検証されています。
塩化アンモニウム赤血球溶解手順による血液培養細菌ペレットの調製
- その後の遠心分離のための血液培養陽性の調製。
- 血液培養キャップを滅菌する。ボトルのキャップ上に70%エタノールを追加し、それを燃やす。
注:層流フードの下に、この手順を実行しないでください。 - 層流フードにボトルを移動します。 20のGシリンジで血液培養の5ミリリットルを収集します。
- 滅菌水(H 2 O)の45ミリリットルを含有する50 mlの遠心チューブに血液培養の5ミリリットルを加え、サンプルを混ぜる。
- 血液培養キャップを滅菌する。ボトルのキャップ上に70%エタノールを追加し、それを燃やす。
- 溶解遠心分離による血液培養細菌ペレットの調製。
- 室温で10分間、1,000×gでサンプルを遠心。
- レモ実験室の真空ポンプで(主にH 2 Oおよび血液細胞を含む)上清VEの。
- 溶液(0.15 M NH 4 Clを、1mMのKHCO 3)を溶解自家製塩化アンモニウム1mlにペレットを再懸濁する。削って、チューブをボルテックスでペレットを分解し、室温で10分間、140×gでサンプルを遠心する。
- 主に赤血球の破片が含まれている上澄みを捨てる。
- ペレットは、出血性のままでいる場合、さらに残留赤血球を溶解するために、ペレットを洗浄し、滅菌蒸留H 2 O 2ml中にペレットを再懸濁する。 RTで10分間、140×gでサンプルを遠心し、上清を捨てる。
- H 2 O200μlにペレットを再懸濁
- さまざまな選択的および非選択寒天培地上で血液培養のサブカルチャー。
- 20のGシリンジで血液培養の1ミリリットルを収集します。
- 血液培養intの1滴を接種血液寒天、チョコレート寒天、マッコンキー寒天とシェドラー寒天上の4つの象限O。
- 5%のCO 2雰囲気下で37℃で血液寒天、チョコレート寒天プレートをインキュベートし、通常の大気中のマッコンキー寒天および嫌気性条件のシェドラー寒天プレート。
- 異なるメディア上の細菌の増殖に従ってください。
- 細菌の純度を確認してください。
MALDI-TOF MSによる2識別
- 血液ペレットからの直接同定。
- 転送1 MALDIターゲットプレート上の血液ペレットμlの42℃の加熱プラットフォーム上それが乾燥させます。
- 1μlの70%ギ酸でサンプルをオーバーレイし、42℃の加熱プラットフォーム上それが乾燥させます。
- MALDIマトリックスを1μl(50%アセトニトリル-2.5%トリフルオロ酢酸中のα-シアノ-4 - ヒドロキシ桂皮酸の飽和溶液)を試料にオーバーレイし、42℃の加熱プラットフォーム上それが乾燥させます。
- MALに進んでください製造業者によって記載されるようにMALDI-TOF MSシステムとDI-TOF MS分析。
- 識別スコアは、種レベルで無効である場合(スコア<2を持つインスタンスの場合)、血液ペレットサンプルのタンパク質抽出を行う。
- 血液培養ペレットからのタンパク質抽出後の同定。
- RTで2分間13000×gで、70%エタノール及び遠心1mlでペレットを20μlを混ぜる。
- 上澄みを捨て、ペレットに70%のギ酸を25μlと100%アセトニトリル25μlのを追加。ペレットを再懸濁するために積極的に渦。ボルテックスの前にピペットチップでそれらを分解してタフなペレットを再懸濁。
- 室温で2分間13000×gで遠心分離する。転送1 MALDIターゲットプレート上の上清液(抽出されたタンパク質が含まれている)と、42℃の加熱プラットフォーム上それが乾燥させます。 2.1.2で説明したように進んでください。
3細菌Identificationと自動微生物系による抗生物質感受性試験
- 自動化された微生物のシステムとの細菌同定およびASTのための細菌懸濁液の調製。
- 自動化された微生物のシステムと互換性の無菌0.45%NaCl溶液3 mlを含有するプラスチックチューブを準備します。
- 0.6〜0.8のマクファーランド濁度に応じた細菌懸濁液を得るために、0.45%NaCl溶液中に血液培養ペレットの十分な量を加える。濃度計機を用いて濁度を測定します。
注:血液培養細菌ペレットの容積が0.6から0.8のマクファーランド濁度を達成するために、50〜200μlのごとに異なります。
- 製造業者によって記載されるように識別のための自動化されたグラム陽性(GP)またはグラム陰性(GN)カードおよびグラム陽性球菌およびグラム陰性菌の抗菌薬感受性試験のための自動化されたASTカードを接種する。
注:IdentificatioMALDI-TOF MSの識別スコア値が> 2であればnはGPまたはGNカードが適用されない。血液寒天培地(GPとGN)とマッコンキー寒天(GN)プレート上の細菌懸濁液を継代培養することにより、細菌懸濁液の純度を確認してください。
ディスク拡散アッセイによる4抗生物質感受性試験
ディスク拡散アッセイは、抗菌薬感受性試験(EUCAST、バージョン3.0、2013年4月、www.eucast.org)に関する欧州委員会によって記述されている。
- 細菌懸濁液の調製は、ディスク拡散アッセイによる抗菌薬感受性試験を実行する。
- 無菌の0.9%NaCl溶液3mlを含有するガラス管を準備する。
- 0.5のマクファーランド濁度に応じた細菌懸濁液を得るために0.9%NaCl溶液中の血液培養ペレットの十分な量を加える。濃度計機を用いて濁度を測定します。
注:血液培養物の容量細菌ペレットを0.6から0.8のマクファーランド濁度を達成するために、50〜200μlに変化します。 - 細菌懸濁液をボルテックスする。
- ミューラーヒントン寒天(MH)またはミューラー·ヒントン寒天培養しにくい有機体寒天(MHF)への細菌懸濁液の接種は(MHが5%脱線維素ウマ血液および20mg、β-ニコチンアミドアデニンジヌクレオチド/ L添加)。
- 細菌懸濁液に滅菌綿棒を浸し、軽くガラス管の内壁に綿棒を回して余分な水分を取り除く。
- 三方向スワブによって、又は自動プレートローテーターを用いて、MH / MHF寒天プレートの表面全体に均一に細菌懸濁液を広げる。
- 接種した寒天プレート上の抗菌ディスクの応用。
- 手動で乾燥した接種した寒天プレートの表面上または感受性ディスクディスペンサーを使用して、密接にディスクを適用する。
- 適切なテンペでプレートをインキュベート抗菌薬感受性試験EUCASTディスク拡散法(バージョン3.0、2013年4月、www.eucast.org)に記載されているようratureと雰囲気。
5。MRSAの検出のための自動化されたPCRベースの診断テスト
- マイクロピペットを用いて、20秒の間、PCRベースの診断検査キットと渦を自動化されたMRSAに付属のサンプル用試薬バイアルに血液培養ペレットを50μlを移す。
- 1ミリリットルのマイクロピペットを使用して、カートリッジの試料ポートに試料を分注する。自動化されたPCRシステムにカートリッジを挿入し、製造業者によって記載されるようにアッセイを開始します。
結果
Prod'hom ら 15による研究において、78人の患者から122血液培養陽性の塩化アンモニウム溶解遠心分離によって得られた細菌ペレットを、MALDI-TOF MSにより分析した。 122血液培養陽性のうち、95(77.9%)が正しく属レベルでの種レベル一つ(0.8%)で同定された。残りの26(21.3%)の血液培養ペレットMALDI-TOFによって信頼性の識別を与えなかった。このうち、21が13連鎖球菌と5コアグラーゼ陰性ブドウ球菌を含むグラム陽性菌であった。重要なことは、13未確認の連鎖球菌のうち10は、しばしば困難な溶解カプセルを有し、Sの種からほとんど区別されている肺炎球菌であったMALDI-TOF MSを用いてミティスグループ 。五グラム陰性菌は、4つの難溶解二つ肺炎桿菌二Haemopを含む細菌種のカプセル化され、その中MALDI-TOFによって同定されなかった門インフルエンザ。このように、MALDI-TOFによる正確な同定は、寒天プレート11上に成長させた細菌コロニーの従来の同定から取得された識別の84.1%に比べて効率的なパフォーマンスを表す血液培養ペレットの78.7%、で得られた。
細菌同定(ID)およびASTのための自動化された微生物のシステムの性能は、クラスタ内のグラム陽性球菌およびグラム陰性細菌について陽性血液培養の278細菌ペレットを試験した。これらの結果は、適切なメディア16にプラスの血液培養の継代培養の次の寒天プレート上で増殖させたコロニーから自動化された微生物系カードを用いて得られた従来の結果と比較した。 MALDI-TOF MSによる細菌ペレットの識別に失敗した場合、微生物同定システムのIDカードを使用して直接的同定を使用することができる。 MALDI-TOF MSとの正確な同定することによって、最終の識別と比較すると微生物同定システムIDカードは、 腸内細菌の99%、ブドウ球菌の74%、非発酵グラム陰性菌の71%、他のグラム陽性球菌の33%で観察された。細菌ペレットの8%には識別を与えなかったのに対し、誤認は、全症例の11%で観察された。 87 腸内細菌科及び133ブドウ球菌などの細菌のペレット220の合計は、自動化された微生物系AST GN26およびAST 580のカード16とASTについて分析した。結果は主要な誤差(ME)のような非常に大規模なエラー(VME)などの偽の影響を受けやすいと偽耐性を定義し、解釈の合意結果、米国食品医薬品局(FDA)によって与えられた定義に従って分析した。寒天プレート上で増殖させたコロニーから接種と比較して、血液培養ペレットの直接接種から得たASTは0.1%で、VMEや腸内細菌科 0.3%、ME、および0.7%VMEやブドウ球菌0.1%MEを示した。 ASTのため、パフォーマンス血液培養ペレットに直接接種したカードは、FDAによって受け入れ性能基準と一致している。
スパを標的とするPCRベースの核酸増幅技術MRSAの試験の性能は、mecA遺伝子およびSCC遺伝子は、直接MALDI-TOF MS 17によって識別黄色ブドウ球菌血液培養細菌のペレットに適用した。 106例に基づいて、メチシリン耐性の検出は、99%の感度および100%の特異性を示した。興味深いことに、血液培養陽性から核酸増幅技術結果を報告するための期間の中央値は、同様の結果を報告するために、MALDI-TOF識別からの期間の中央値に対し、201分(範囲100から430)と同等であった(範囲97分に等しかった25〜 250)。

図1 前後のMALDI-TOFの時代。サンプルのO / N個のサブカルチャーを含む従来の診断のアプローチと比較して、MALDI-TOF MS識別は診断研究所にサンプルを送達後数分以内に行うことができます。 こちらをクリックしてくださいこの図の拡大版を表示します。
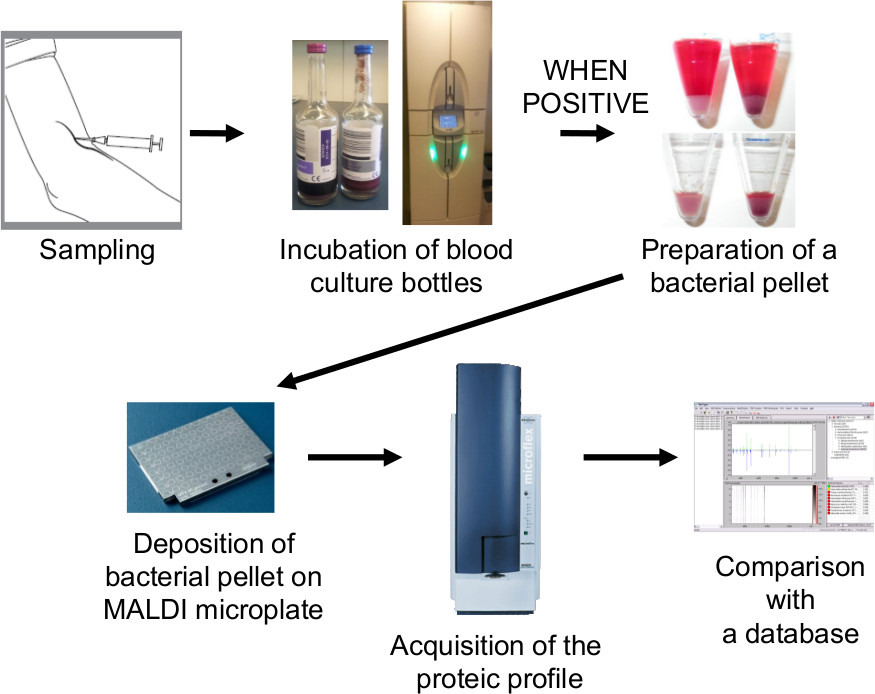
サンプリングからのMALDI-TOF MSの識別に血液培養処理の図2のワークフロー。血液培養が陽性である場合には、細菌ペレットを塩化アンモニウム溶解遠心分離することによって調製される。この細菌ペレットをMALDI-TOF MSにより直接同定のために使用される。 MALDI-TOF MSの識別は30〜60分のfo内で得ることができる llowing血液培養陽性。 この図の拡大版をご覧になるにはこちらをクリックしてください。
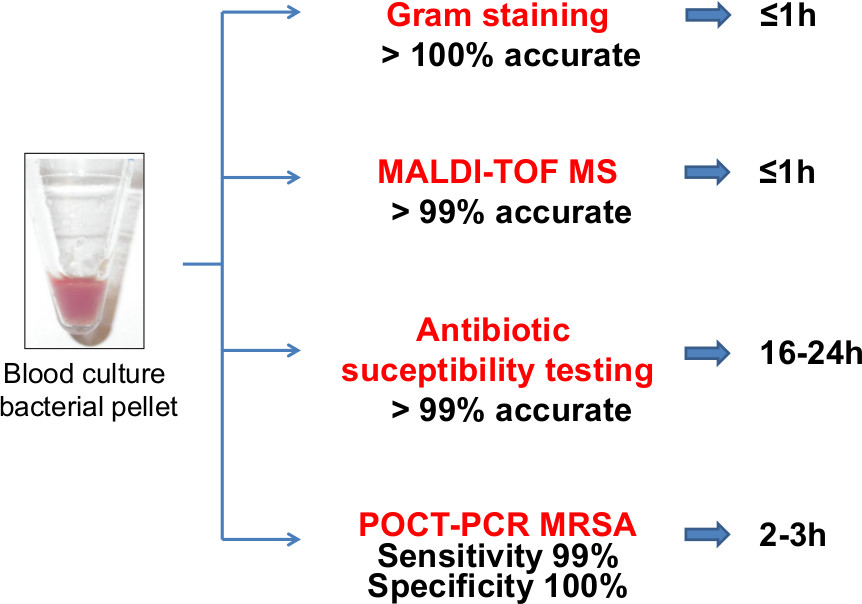
そのようなMRSAの検出のためのケア検査PCRのポイント(POCT-PCR)などの自動システムおよび/ またはディスク拡散アッセイおよび迅速なPCRベースのテストを使用して、グラム染色、MALDI-TOF MS同定、ASTを含む、図3の多くの下 流のアプリケーションが血液培養細菌ペレット上で直接実行すること。細菌の血液培養ペレットからの直接検査が大幅に血流感染に罹患している患者の転帰を改善するために極めて重要であるIDおよびAST結果を報告するためのターンアラウンド時間を短縮する。 5fig3highres.jpg "ターゲット=" _ブランク」>この図の拡大版をご覧になるにはこちらをクリックしてください。
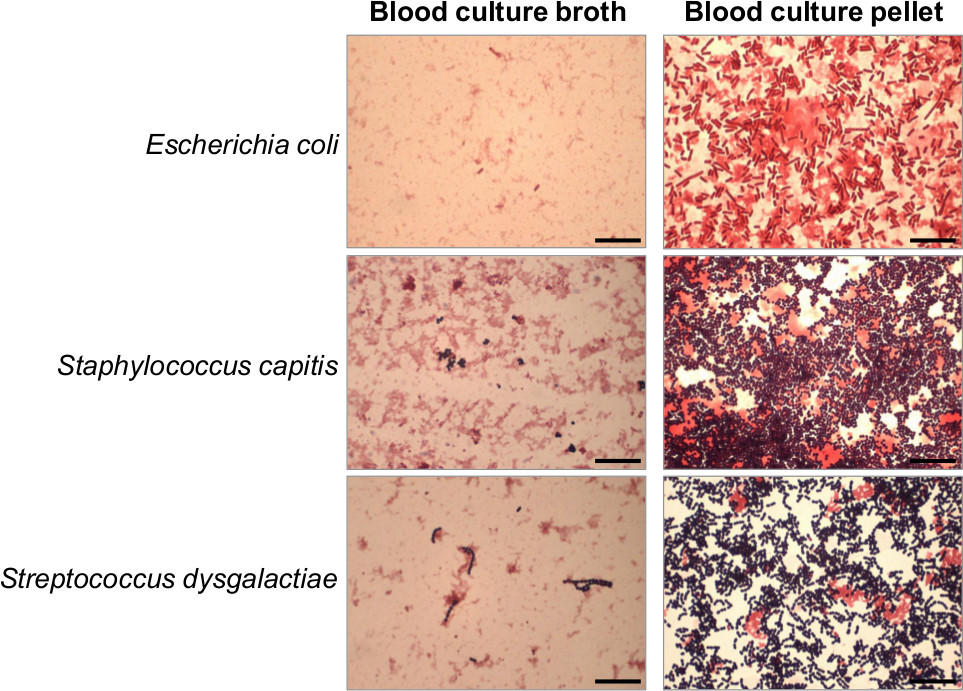
図4は、塩化アンモニウム溶解遠心分離プロトコルは、陽性の血液培養ブロスから濃縮されたおよび精製された細菌ペレットの製造を可能にする。 大腸菌の血液培養陽性のグラム染色は、コアグラーゼ陰性ブドウ球菌白癬およびストレプトコッカスディスガラクティエの前および製造後に行わ血液培養細菌ペレット。クラスタおよび鎖中の連鎖球菌におけるブドウ球菌の古典的な形態は、より容易に血液培養細菌ペレットよりもネイティブの血液培養液中に観察される。 =25μmのスケールバー。= "_ブランク」>この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
従来の血液培養陽性診断アプローチと比較して、塩化アンモニウム溶解遠心分離法を用いて、細菌ペレットの迅速な取得が24時間と48時間と24によってASTを報告する時間( 図1および 16による識別を報告するための時間を短縮3)。
適切な抗生物質治療の迅速な導入が血流感染に罹患している患者の転帰を改善するために極めて重要である。このようにして、約8から16時間で得られた急速なASTが続き、1時間内で感染性物質の早期発見は、敗血症患者の臨床管理において大きな影響を表しています。グラム染色の迅速な報告がすでに抗菌薬治療に大きな影響に関連付けられており、従って、患者の罹患率および死亡率6,7の減少にされています。血液培養細菌ペレットのグラム染色は、感度を高めるために行うことができるときBLのグラム染色OOD培養液を陰性または弱陽性( 図4)。しかし、ネイティブの血液培養ブロス上で実行グラム染色は、鎖中のクラスタ内のブドウ球菌や連鎖球菌などの典型的な形態を観察することをお勧めします。グラム染色は、ケース8の20%のみで、追加の影響を与えたのに対し、血流感染202例に行われた最近の前向き研究では、血液培養ペレットからのMALDI-TOF MS同定は、症例の35.1%に抗生物質治療での影響を示した。そのような腸内細菌科のAmpC産生として増加した抗生物質耐性に関連する細菌は、MALDI-TOF MSにより同定した興味深いことに、臨床管理上のグラム染色およびMALDI-TOF MSの識別報告との衝突の最大差が観察された。同様に、Martiny らは、MALDI-TOF MSの迅速な同定が回顧スタッドのに対し、症例の13.4%に抗生物質治療の適応を留めることが示されているStoneking らによって行わyは。菌血症を引き起こす微生物の迅速な同定が初期養生法によりまたは抗生物質18,19のスペクトルを低減することでカバーされていない追加的な抗生物質を投与することにより、いずれの場合の77%に経験的治療を調整することに役立つ可能性が示唆。また、このような核酸増幅技術MRSAなど迅速PCRに基づくアッセイの使用は、S.以下S.罹患している患者未満、4時間に最も適切な抗生物質療法を提供するために許可された血液培養ペレットからのMALDI-TOF MSによる黄色ブドウ球菌の識別黄色ブドウ球菌菌血症17。ペニシリンアレルギーを有する患者を除外すると、核酸増幅技術の使用は、MRSAは、26.1%から8.1%のグリコペプチドなどの抗MRSA抗生物質の誤用の有意な減少を可能にした。一緒に、これらのデータは、グラム染色、MALDI-TOF MSの識別および迅速なPCRベースの急速な逐次報告血液培養ペレットからのssayが大幅に抗生物質療法、したがって、臨床管理だけでなく、血流感染症に罹患している患者の転帰を改善している。
MALDI-TOF MSは、従来のMALDI-TOF MSによって得られた84.1%の識別率と比較して非常に良好なパフォーマンスである血液培養ペレットの78.7%正確な同定を、許可された寒天プレート上で増殖させた純粋なコロニーに対して実施。もっとこと血流感染の50%がそのような腸内細菌 、 黄色ブドウ球菌 、 緑膿菌や腸球菌などの細菌種によって引き起こされます。これらの細菌は、効率的にそう正に血液培養細菌ペレット上で直接実行MALDI-TOF MS同定の良好な性能に影響をMALDI-TOF MSによって同定される。 MALDI-TOF MSによる一部の細菌種の同定のための低性能があり、血液培養ペレットで行っ主に同様の要因によるもの寒天プレート上で増殖させ、純粋なコロニーから、従来の識別のために観察されたものより。例えば、このような連鎖球菌はミティスグループとコアグラーゼ陰性ブドウ球菌に属するものとして、いくつかの微生物種は密接に関連しており、MALDI-TOF MSによる低精度で同定した。また、グラム陽性細菌の細菌細胞壁の特定の組成物、又は肺炎桿菌などの細菌種で観察された密なカプセルの存在は、溶解効率、したがって、MALDI-TOF MS同定の性能を低下させる。最後に、嫌気性細菌の同定のためのMALDI-TOF MSの低い性能は、主にMALDI-TOFデータベース内のこれらの細菌の不完全乏しい表現によるものである。
純粋なコロニーから、従来の識別に比べて血液培養ペレットからのMALDI-TOF MS同定の小さなパフォーマンスの低下は残留血液のプロテインCが原因である可能性がありomponentsまたは溶解、遠心分離後に得られた細菌の量が不十分に。同様に、単離されたコロニーを接種したものと比較して、血液培養ペレットを直接接種し、自動化微生物系カードで観察された差異は、このような細菌の成長を妨害し得るタンパク質、血液細胞及び血液培地化合物などの残留血液培養成分によって引き起こされ得る微生物系カード自動識別及びASTの両方に重大な影響を有することができる。さらに、自動化された微生物系により得られるAST結果は、従来のアプローチと比較して有意な相違を提示することが知られているいくつかの抗生物質の結果を検証するために、血液培養細菌ペレット上で直接実行ディスク拡散アッセイによって確認される必要がある。しかし、血液培養ペレットと自動化された微生物系カードの直接接種は、腸内細菌とstaphyの両方に優れたIDおよびASTパフォーマンスを提示lococci。
このように、血液培養陽性の塩化アンモニウム溶解遠心分離により得られた細菌ペレットを直接そのような従来の手法と比較して有意に減少しTATのIDおよびASTなどの必須の結果の迅速な報告を可能にするいくつかのダウンストリーム·アプリケーションを実行するために検証されています。また、このような拡張スペクトルβ-ラクタマーゼ(ESBLは)検査などの追加アプリケーションが血液培養陽性の類似の溶解遠心分離で検証されてきた、彼らはまた、この作品に記載されているプロトコルを用いて得られた細菌ペレットに適用され得ることを示唆している20方法論。
開示事項
著者は、彼らが競合する金融利害がないことを宣言します。
謝辞
私たちは、実験室での技術を実装するために彼らの助けのためにローザンヌ大学病院センターの細菌学研究室の技術者に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 20 G needle | Terumo, Leuven, Belgium | NN-2038R | |
| 50 ml Falcon tube | BD, Franklin Lakes, NJ, USA | 352070 | 50 ml centrifuge tubes |
| Ammonium chlorure | Merck, Darmstadt, Germany | 101145 | |
| Potassium hydrogen carbonate | Fluka, St. Louis, MO, USA | 60340 | |
| Formic acid | Sigma-Aldrich, St. Louis, MO, USA | F0507 | Flammable, corrosive |
| α-Cyano-4-hydroxycinnamic acid | Fluka, St. Louis, MO, USA | 70990 | Acute toxicity |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO, USA | 271004 | Flammable, acute toxicity |
| Trifluoroacetic acid | Sigma-Aldrich, St. Louis, MO, USA | T6508 | Corrosive, acute toxicity |
| Vitek 2 60 instrument | Biomérieux, Marcy-l'Etoile, France | 27202 | automated microbial system instrument |
| Vitek 2 Gram-positive (GP) card | Biomérieux, Marcy-l'Etoile, France | 21342 | automated GP identification card |
| Vitek 2 AST-P580 card | Biomérieux, Marcy-l'Etoile, France | 22233 | automated microbial AST system |
| Vitek 2 Gram-negative (GN) card | Biomérieux, Marcy-l'Etoile, France | 21341 | automated GN identification card |
| Vitek 2 AST-N242 card | Biomérieux, Marcy-l'Etoile, France | 413391 | automated microbial AST system |
| Xpert MRSA | Cepheid, Sunnyvale, Ca, USA | GXMRSA-100N-10 | nucleic acid amplification technology MRSA |
| GeneXpert IV instrument | Cepheid, Sunnyvale, Ca, USA | GXIV-4-D | nucleic acid amplification technology instrument |
| Microflex LT MALDI-TOF MS instrument | Bruker Daltonics, Bremen, Germany | BDAL microflex LT/SH | |
| MSP 96 target steel BC | Bruker Daltonics, Bremen, Germany | 280799 | MALDI target plate |
| Densitometer Densicheck instrument | Biomérieux, Marcy-l'Etoile, France | 27208 | |
| MALDI Sepsityper kit 50 | Bruker Daltonics, Bremen, Germany | 8270170 | |
| Mac Conkey agar | Biolife, Milano, Italy | 4016702 | |
| Mueller-Hinton agar | Oxoid, Hampshire, England | CM0337 | Mueller-Hinton agar (MH) |
| MHF agar | Biomérieux, Marcy-l'Etoile, France | 43901 | Mueller-Hinton agar-fastidious organisms agar (MHF) |
| BD columbia III agar | BD, Franklin Lakes, NJ, USA | 254071 | blood agar |
| BD chocolate agar | BD, Franklin Lakes, NJ, USA | 254089 | chocolate agar |
| BD schaedler agar | BD, Franklin Lakes, NJ, USA | 254084 | Schaedler agar |
参考文献
- Alberti, C., et al. Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study. Intensive care medicine. 28, 108-121 (2002).
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Critical care medicine. 29, 1303-1310 (2001).
- Vincent, J. L., et al. Sepsis in European intensive care units results of the SOAP study. Critical care medicine. 34, 344-353 (2006).
- Micek, S. T., et al. Empiric combination antibiotic therapy is associated with improved outcome against sepsis due to Gram-negative bacteria a retrospective analysis. Antimicrob Agents Chemother. 54, 1742-1748 (2010).
- Seifert, H. The clinical importance of microbiological findings in the diagnosis and management of bloodstream infections. Clin Infect Dis. 48, S238-S245 (2009).
- Barenfanger, J., et al. Decreased mortality associated with prompt Gram staining of blood cultures. American journal of clinical pathology. 130, 870-876 (2008).
- Munson, E. L., Diekema, D. J., Beekmann, S. E., Chapin, K. C., Doern, G. V. Detection and treatment of bloodstream infection: laboratory reporting and antimicrobial management. J Clin Microbiol. 41, 495-497 (2003).
- Clerc, O., et al. Impact of matrix-assisted laser desorption ionization time-of-flight mass spectrometry on the clinical management of patients with Gram-negative bacteremia a prospective observational study. Clin Infect Dis. 56, 1101-1107 (2013).
- Meex, C., et al. Direct identification of bacteria from BacT/ALERT anaerobic positive blood cultures by MALDI-TOF MS MALDI Sepsityper kit versus an in-house saponin method for bacterial extraction. Journal of medical microbiology. 61, 1511-1516 (2012).
- Moussaoui, W., et al. Matrix-assisted laser desorption ionization time-of-flight mass spectrometry identifies 90% of bacteria directly from blood culture vials. Clin Microbiol Infect. 16, 1631-1638 (2010).
- Seng, P., et al. Ongoing revolution in bacteriology routine identification of bacteria by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Clin Infect Dis. 49, 543-551 (2009).
- Stevenson, L. G., Drake, S. K., Murray, P. R. Rapid identification of bacteria in positive blood culture broths by matrix-assisted laser desorption ionization-time of flight mass spectrometry. J Clin Microbiol. 48, 444-447 (2010).
- Croxatto, A., Prod&34hom, G., Greub, G. Applications of MALDI-TOF mass spectrometry in clinical diagnostic microbiology. FEMS Microbiol Rev. 36, 380-407 (2012).
- Chen, J. H., et al. Direct bacterial identification in positive blood cultures by use of two commercial matrix-assisted laser desorption ionization-time of flight mass spectrometry systems. J Clin Microbiol. 51, 1733-1739 (2013).
- Prod&34hom, G., Bizzini, A., Durussel, C., Bille, J., Greub, G. Matrix-assisted laser desorption ionization-time of flight mass spectrometry for direct bacterial identification from positive blood culture pellets. J Clin Microbiol. 48, 1481-1483 (2010).
- Prod&34hom, G., Durussel, C., Greub, G. A simple blood-culture bacterial pellet preparation for faster accurate direct bacterial identification and antibiotic susceptibility testing with the VITEK 2 system. Journal of medical microbiology. 62, 773-777 (2013).
- Clerc, O., et al. Matrix-assisted laser desorption ionization time-of-flight mass spectrometry and PCR-based rapid diagnosis of Staphylococcus aureus bacteraemia. Clin Microbiol Infect. , (2013).
- Martiny, D., et al. Impact of rapid microbial identification directly from positive blood cultures using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry on patient management. Clin Microbiol Infect. 19, E568-E581 (2013).
- Stoneking, L. R., et al. Would earlier microbe identification alter antibiotic therapy in bacteremic emergency department patients. The Journal of emergency medicine. 44, 1-8 (2013).
- Nordmann, P., Dortet, L., Poirel, L. Rapid detection of extended-spectrum-beta-lactamase-producing Enterobacteriaceae. J Clin Microbiol. 50, 3016-3022 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved