Method Article
Vorbereitung einer Blutkultur Pellet Rapid Identifizierung von Bakterien und Antibiotika Empfindlichkeitsprüfung
In diesem Artikel
Zusammenfassung
Eine schnelle Bakterienpellet Herstellung von einer positiven Blutkultur kann als eine Probe für Anwendungen wie die Identifizierung durch MALDI-TOF, Gram-Färbung, antibiotische Resistenzprüfung und PCR-basierte Tests verwendet werden. Die Ergebnisse können schnell auf Ärzte mitgeteilt, das Ergebnis von Patienten mit Infektionen der Blutbahn zu verbessern.
Zusammenfassung
Blutstrominfektionen und Sepsis sind eine der Hauptursachen für Morbidität und Mortalität. Der Erfolg von Patienten mit Bakteriämie, hängt von einer schnellen Identifizierung des Erregers zu führen optimale Behandlung mit Antibiotika. Die Analyse der Gram Flecken aus positiver Blutkultur kann schnell durchgeführt werden und bereits erhebliche Auswirkungen auf die antibiotische Therapie. Jedoch ist die genaue Identifikation des Erregers erforderlich, um die optimale gezielte Behandlung etablieren. Wir stellen Ihnen hier eine einfache und schnelle Zubereitung von Bakterienpellet einer positiven Blutkultur, die als Probe für mehrere wesentliche Downstream-Anwendungen wie Identifikation durch MALDI-TOF-MS, antibiotische Empfindlichkeitsprüfung (AST) durch Scheibendiffusionstest oder automatisierte AST-Systemen verwendet werden können und durch automatisierte PCR-basierten Diagnosetests. Die Leistung dieser direkt auf die Blutkultur Bakterienpellets angewendet unterschiedliche Identifikationssysteme und AST ist sehr similar auf die Leistung in der Regel aus isolierten Kolonien auf Agar-Platten gezüchtet wurden. Im Vergleich zu herkömmlichen Ansätzen, die schnelle Beschaffung eines Bakterienpellet reduziert die Zeit, um sowohl Identifikation und AST zu melden. So kann nach einer Blutkultur Positivität Identifizierung durch MALDI-TOF in weniger als 1 Stunde in der Erwägung Ergebnisse AST durch automatisierte Systeme AST oder Scheibendiffusionstests innerhalb von 8 bis 18 h, jeweils angegeben werden. Ebenso können die Ergebnisse einer schnellen PCR-basierten Assays, um den Kliniker mitgeteilt weniger als 2 Stunden nach dem Bericht einer Bakteriämie. Zusammen zeigen diese Ergebnisse, dass die rasche Erstellung eines Blutkultur Bakterienpellet hat einen signifikanten Einfluss auf die Identifizierung und AST Bearbeitungszeit und damit auf das erfolgreiche Ergebnis von Patienten mit Infektionen der Blutbahn.
Einleitung
Bakteriämien und Sepsis bei hospitalisierten Patienten sind eine der Hauptursachen von Morbidität und Mortalität. So ist die Sterblichkeit im Zusammenhang mit Infektionen Blutbahn in etwa 14% bis 37% der stationären Patienten beobachtet und kann auf 35% auf Intensivstationen Patienten 1-3 erhöhen. Die schnelle Identifizierung des Erregers ist entscheidend zu führen optimale antimikrobielle Behandlung und den erfolgreichen Abschluss der antimikrobiellen Therapie 4,5 zu erhöhen. Die schnelle Analyse von Gram Flecken aus positiver Blutkultur hat bereits einen erheblichen Einfluss auf die Anpassung der antimikrobiellen Therapie 6,7, aber eine genaue Identifizierung des Erregers erforderlich, um die am besten geeigneten Antibiotika-Behandlung für die Patienten zu schaffen. Zum Beispiel haben unterschiedliche Antibiotika-Behandlung nicht ausreichend, um folgende Bakteriämie mit Enterokokken und Streptokokken, die nur schwer durch Gram-Färbung unterscheiden, sind umgesetzt werden. Ebenso Identifikation an der Art Level ist erforderlich, um Gram-negative Enterobakterien erkennen eine chromosomale ampC Gen, das eine erhöhte Resistenz gegenüber 8-Lactamen β kodiert.
Mit einer positiven Blutkultur ist die herkömmliche diagnostische Ansatz, um die Infektionserreger auf verschiedenen Agar-Platten, die mehrere Stunden zusätzliche Inkubation vor der Identifikation mit verschiedenen Ansätzen, einschließlich biochemische Tests, Wachstum auf verschiedenen Selektionsmedien und automatische Identifikationssysteme erfordert mikrobiellen Subkultur. Die Zeit, um Ergebnisse einer herkömmlichen diagnostischen Ansatz von etwa 1 bis 3 Tagen.
Die Entstehung der Matrix-unterstützte Laser-Desorption / Ionisation Time-of-Flight Massenspektrometrie (MALDI-TOF)-Technologie für die schnelle Identifizierung von Mikroorganismen wurde ein neues Werkzeug schnell Mikroorganismen von Kolonien auf Agar-Platten gezüchtet, sondern auch direkt von der positiven Identifizierung Blut bereitgestellt Kulturen (Abbildung 1) 9-12. The Verwendung von MALDI-TOF, um einen infektiösen Erreger aus Blutkulturen zu identifizieren deutlich die Zeit, um Ergebnisse zu ein paar Minuten anstelle von den Stunden und Tagen nach traditionellen Verfahren erforderlich ist, reduziert. Wie von Croxatto et al. Diskutiert 13 stützt sich die Effizienz der MALDI-TOF-Identifizierung von verschiedenen Parametern wie Reinheit und Menge des Mikroorganismus. Diese beiden Kriterien sind leicht von diskreten Kolonien auf Agar-Platten gezüchtet wurden, aber benötigt eine vorge analytischen Behandlung für bakterielle Anreicherung und Reinigung von komplexen Proben wie Blutkultur, die mehrere zelluläre und Protein-Komponenten, die mit MALDI-TOF-Identifikations stören kann enthalten.
Verschiedene Mikroorganismen Isolierungsverfahren aus Blutkulturen wurden in einer Reihe von Studien einschließlich Saponin oder andere milde Detergentien Verfahren zur Extraktion bakterieller 9,14, Serumtrennverfahren 10 verwendet Lyse Zentrifugationsverfahren 12 und kommerziell Lösungen wie das sepsityper-Kit. Unsere Bakteriologie Diagnoselabor hat einen einfachen Blutkultur Bakterienpellet Zubereitung auf Basis von Ammoniumchlorid-Lyse Erythrozyten, die eine schnelle Identifizierung von Bakterien und Hefe durch MALDI-TOF-und automatisierte Identifikationssysteme (Abbildung 2) 15 erlauben entwickelt. Dieses Blutkultur Pelletzubereitung stellen auch eine Probe für andere direkte nachgeschalteten Anwendungen wie Gram-Färbung, automatisierte PCR-basierten diagnostischen Tests wie POCT-PCRs zum schnellen Nachweis von Methicillin-resistenten Staphylococcus aureus (MRSA) und antibiotische Resistenzprüfung mit automatisierte AST-Systeme und / oder Plattendiffusionstests auf Agarplatten (Abbildung 3).
In dieser Arbeit wurden die verschiedenen Schritte zur Herstellung des Blutkulturbakterienpellet beschreiben wir, wie durch Prod'hom et al erläutert. 15 (Figur 4). Wir werden auch DESchreiber die Protokolle für drei der wichtigsten Anwendungen, die auf die Blutkultur Pellet durchgeführt werden können: Identifizierung mittels MALDI-TOF-15, Identifikation (ID) und Antibiotika-Empfindlichkeitsprüfung (AST) mit den automatisierten Systemen 16 für Enterobacteriaceae und Staphylokokken und automatisierte PCR- basierten diagnostischen Test zum Nachweis von MRSA 17.
Protokoll
Dieses Protokoll wurde entwickelt und validiert nach den Forschung und Entwicklungsprozesse und ethische Regeln unserer Einrichtung, bevor er als Routinewerkzeug implementiert.
1. Herstellung einer Blutkulturbakterienpellet durch Ammoniumchlorid Erythrozyten-Lyseverfahren
- Vorbereitung einer positiven Blutkultur für nachfolgende Zentrifugation.
- Sterilisieren Blutkultur Kappe. Fügen Sie 70% Ethanol auf die Kappe der Flasche und zu brennen.
HINWEIS: Führen Sie diesen Schritt unter einer Steril ausführen nicht. - Bewegen Sie die Flasche an einer Steril. Sammeln von 5 ml der Blutkultur mit einer 20 G Spritze.
- Fügen Sie die 5 ml Blutkultur in einem 50 ml-Zentrifugenröhrchen mit 45 ml sterilem Wasser (H 2 O) und die Probe zu mischen.
- Sterilisieren Blutkultur Kappe. Fügen Sie 70% Ethanol auf die Kappe der Flasche und zu brennen.
- Herstellung einer Blutkultur Bakterienpellet durch Zentrifugation Lyse.
- Zentrifugieren der Probe bei 1.000 xg für 10 min bei RT.
- Remove Überstand mit einer Labor-Vakuumpumpe (die hauptsächlich H 2 O und Blutzellen enthält).
- Das Pellet in 1 ml hausgemachte Ammoniumchlorid Lyse-Lösung (0,15 M NH 4 Cl, 1 mM KHCO 3). Brechen die Pellets durch Kratzen und durch Vortexen das Rohr und Zentrifugieren der Probe bei 140 g für 10 min bei RT.
- Überstand verwerfen, die hauptsächlich rote Blutkörperchen Schutt.
- Wenn die Pellets blieben hämorrhagischen, das Pellet in 2 ml sterilem destilliertem H 2 0 weiter lysieren restliche rote Blutzellen und das Pellet zu waschen. Zentrifugieren Sie die Probe bei 140 g für 10 min bei RT und den Überstand verwerfen.
- Resuspendieren des Pellets in 200 ul H 2 O
- Subkultur der Blutkultur auf verschiedenen selektiven und nicht-selektiven Agar-Medien.
- Sammeln von 1 ml der Blutkultur mit einer 20 G Spritze.
- Impfen 1 Tropfen Blutkultur into vier Quadranten auf Blut-Agar, Schokolade-Agar, McConkey Agar-Agar und Schaedler.
- Bei 37 ° C wird die Blut-Agar-und Schokoladen-Agar-Platten in einer 5% CO 2 Atmosphäre, McConkey Agar in einer Normalatmosphäre und die Scha Agarplatte in anaeroben Bedingungen.
- Folgen bakterielle Wachstum auf verschiedenen Medien.
- Überprüfen Sie für bakterielle Reinheit.
2. Identifizierung durch MALDI-TOF-MS
- Direkte Identifizierung aus dem Blut Pellets.
- Transfer 1 ul Blut Pellet auf einem MALDI-Target Platte und lassen Sie es trocken auf einem 42 ° C Heizungs Plattform.
- Überlagern die Probe mit 1 ul 70% iger Ameisensäure und lassen Sie es trocken auf einem 42 ° C Heizungs Plattform.
- Überlagern die Probe mit 1 ul MALDI-Matrix (gesättigte Lösung von α-Cyano-4-Hydroxy-Säure in 50% Acetonitril-2.5% Trifluoressigsäure) und lassen Sie es trocken auf einem 42 ° C Heizungs Plattform.
- Fahren Sie mit MALDI-TOF-MS-Analyse mit einem MALDI-TOF-MS-System, wie durch den Hersteller beschrieben.
- Wenn die Identifikations Punktzahl ist ungültig auf Artenebene (zum Beispiel mit einem Score <2), führen Sie eine Proteinextraktion des Blutes Pelletprobe.
- Identifikation nach Proteinextraktion aus der Blutkultur Pellets.
- Mix 20 ul Pellet mit 1 ml 70% Ethanol und Zentrifugation bei 13.000 × g für 2 min bei RT.
- Überstand verwerfen und fügen Sie 25 ul von 70% Ameisensäure und 25 ul 100% Acetonitril zum Pellet. Vortex kräftig, um die Pellets zu suspendieren. Resuspendieren harten Pellets, indem Sie sie mit Pipettenspitzen vor Verwirbelung.
- Zentrifugieren bei 13.000 × g für 2 min bei RT. Übertragung 1 ul der Überstand (die extrahierten Proteine enthalten) auf einem MALDI-Target Platte und lassen Sie es trocken auf einem 42 ° C Heizungs Plattform. Gehen Sie wie in 2.1.2 beschrieben.
3. Bakterielle Identification und Antibiotika Empfindlichkeitsprüfung mit einem automatisierten System-Mikrobielle
- Herstellung einer Bakteriensuspension zur Identifizierung von Bakterien und AST mit einem automatisierten mikrobiellen Systems.
- Vorbereiten einer Kunststoffröhrchen, das 3 ml steriler 0,45% iger NaCl-Lösung mit dem automatisierten mikrobielle System kompatibel.
- Hinzufügen einer ausreichenden Menge des Blutkulturpellet in 0,45% NaCl-Lösung, um eine Bakteriensuspension, entsprechend einer McFarland Trübungs von 0,6 bis 0,8 zu erhalten. Messen Sie die Trübung mit einem Densitometer Maschine.
HINWEIS: Das Volumen des Blutkulturbakterienpellet variiert von 50 bis 200 ul, um ein McFarland Trübungs von 0,6 bis 0,8 zu erreichen.
- Impfen die automatisierten Gram-positive (GP) oder Gram-negative (GN) Karten für die Identifikation und die automatisierten AST-Karten für antimikrobielle Empfindlichkeitsprüfung von Gram-positive Kokken und Gram-negative Bakterien, wie vom Hersteller beschrieben.
HINWEIS: identifizierun mit GP oder GN-Karten wird nicht angewendet, wenn MALDI-TOF-MS-Identifizierung Score-Wert> 2. Überprüfen Sie die Reinheit der Bakteriensuspension durch Subkultivierung der Bakteriensuspension auf Blutagar (GP und GN) und MacConkey-Agar (GN) Platten.
4. Antibiotika Empfindlichkeitsprüfung von Festplattendiffusionstest
Die Scheibe Diffusionstest wird von der Europäischen Ausschusses für antimikrobielle Empfindlichkeitsprüfung (EUCAST, Version 3.0, im April 2013 www.eucast.org) beschrieben.
- Herstellung einer Bakteriensuspension antimikrobiellen Empfindlichkeitsprüfung von Plattendiffusionstest durchzuführen.
- Vorbereiten einer Glasröhrchen mit 3 ml steriler 0,9% NaCl-Lösung.
- Hinzufügen einer ausreichenden Menge des Blutkulturpellet in 0,9% NaCl-Lösung, um eine Bakteriensuspension, entsprechend einer McFarland Trübungs von 0,5 zu erhalten. Messen Sie die Trübung mit einem Densitometer Maschine.
HINWEIS: Das Volumen der BlutkulturBakterienpellet variiert von 50 bis 200 ul, um ein McFarland Trübungs von 0,6 bis 0,8 zu erreichen. - Mischen Sie den Bakteriensuspension.
- Inokulation von Bakteriensuspension auf Mueller-Hinton-Agar (MH) oder Mueller-Hinton-Agar-Agar anspruchsvolle Organismen (MHF) (MH, ergänzt mit 5% defibriniertes Pferdeblut und 20 mg / l β-Nicotinamid-Adenin-Dinucleotid).
- Tauchen Sie ein steriles Wattestäbchen in der Bakteriensuspension und entfernen Sie vorsichtig die überschüssige Flüssigkeit durch Drehen Sie den Tupfer an der Innenwand der Glasröhre.
- Verbreiten Sie die Bakteriensuspension gleichmäßig auf die gesamte Oberfläche des MH / MHF-Agar-Platte durch Tupfen in drei Richtungen oder durch Verwendung eines automatischen Plattendreher.
- Anwendung von antimikrobiellen Festplatten auf Agar-Platten angeimpft.
- Gelten genau die Scheiben auf der Oberfläche der getrockneten geimpft Agar-Platten manuell oder mit Hilfe eines Platten Anfälligkeit Spender.
- Die Platte auf der entsprechenden Tempetur und die Atmosphäre wie in der antimikrobiellen Empfindlichkeitsprüfung EUCAST Plattendiffusionsmethode beschrieben (Version 3.0, im April 2013 www.eucast.org).
5. Automatische PCR-basierten diagnostischen Test zum Nachweis von MRSA
- Mit einer Mikropipette, Transfer 50 ul der Blutkultur Pellet in die Probenflasche mit dem Reagenz MRSA automatisierte PCR-basierten diagnostischen Test-Kit und Wirbel während 20 Sekunden zur Verfügung gestellt.
- Verwendung einer 1 ml-Mikropipette zu verzichten, die Probe in die Probenöffnung der Patrone. Setzen Sie die Patrone in den automatisierten PCR-System und starten Sie den Test, wie vom Hersteller beschrieben.
Ergebnisse
In der Studie von Prod'hom et al. 15 durchgeführt wurden Bakterienpellets durch Ammoniumchlorid-Lyse Zentrifugation von 122 positive Blutkultur von 78 Patienten erhalten durch MALDI-TOF MS analysiert. Von 122 positiven Blutkultur wurden 95 (77,9%) richtig auf Artenebene und eine (0,8%) an der Gattungsebene identifiziert. Die restlichen 26 (21,3%) Blutkultur-Pellets gab keine sichere Identifizierung mittels MALDI-TOF. Unter denen waren 21 gram-positive Bakterien, darunter 13 Streptokokken und 5 Koagulase-negative Staphylokokken. Wichtig ist, dass 10 der 13 identifizierten Streptokokken waren Streptococcus pneumoniae, die oft besitzen eine schwer zu lysieren Kapsel und sind kaum von Arten der S. mitis-Gruppe mit MALDI-TOF-MS. Fünf Gram-negativen Bakterien wurden durch MALDI-TOF identifiziert, von denen vier schwer zu lysieren verkapselten Bakterien-Spezies, die zwei Klebsiella pneumoniae und zwei Haemophilus influenzae. Somit wurde eine korrekte Identifizierung von MALDI-TOF in 78,7% der Blutkultur-Pellets, die eine effiziente Leistung im Vergleich zu den 84,1% der Identifikation von herkömmlichen Identifizierung von Bakterienkolonien auf Agarplatten gezüchtet wurden 11 darstellt, erhalten.
Die Leistung des automatischen mikrobiellen System zur bakteriellen Identifikation (ID) und AST wurde auf 278 Bakterienpellets von positiven Blutkultur für Gram-positive Kokken in Cluster und Gram-negative Bakterien getestet. Diese Ergebnisse wurden mit den herkömmlichen automatisierten mikrobiellen Systemkarten von Kolonien auf Agar-Platten nach der Subkultivierung von positiven Blutkultur auf geeigneten Medien gezüchtet 16 erhaltenen Ergebnissen verglichen. Direkte Identifikation mit mikrobiellen Identifizierungssystem ID-Karten können verwendet werden, wenn die Identifizierung des Bakterienpellet durch MALDI-TOF-MS ausgefallen ist. Im Vergleich zu einer endgültigen Identifizierung durch MALDI-TOF-MS, eine korrekte Identifizierung mitmikrobiellen Identifizierungssystem ID-Karten wurde in 99% der Enterobacteriaceae, 74% der Staphylokokken, 71% der nicht-fermentative Gram-negative Bakterien und 33% andere Gram-positive Kokken beobachtet. Eine Fehlinterpretation wurde in 11% der Fälle beobachtet Gesamtwohingegen 8% der Bakterienpellets gab keine Identifikation. Insgesamt wurden 220 Bakterienpellets mit 87 Enterobacteriaceae und 133 Staphylokokken wurden für AST mit automatisierten mikrobielle System AST GN26 und AST 580 Karten 16 analysiert. Die Ergebnisse wurden nach Definitionen, die von der US Food and Drug Administration (FDA) für interpretierende Ergebnisse Vereinbarung gegeben, das als sehr großen Fehler (VME) und einer falschen beständig als Hauptfehler (ME) eine falsche anfällig definiert analysiert. AST von der direkten Inokulation von Blutkultur-Pellet im Vergleich zu der Impfung von Kolonien auf Agar-Platten gezüchtet erhalten wurden, zeigten 0,1% und 0,3% VME ME für Enterobacteriaceae und 0,7% und 0,1% VME ME für Staphylokokken. Daher kann die Performance ASTKarten direkt mit Blutkultur-Pellets geimpft sind in Übereinstimmung mit den Leistungskriterien von der FDA akzeptiert.
Die Leistung des PCR-basierten Nukleinsäure-Verstärkungstechnologie MRSA-Test gezielt den Wellnessbereich, mecA und SCC-Gene wurde direkt auf Staphylococcus aureus Blutkultur Bakterienpellets durch MALDI-TOF-MS-17 identifiziert angewendet. Basierend auf 106 Fällen die Erfassung von Methicillin-Resistenz zeigten eine Sensitivität von 99% und eine Spezifität von 100%. Interessant ist, dass die mediane Zeit bis die Nukleinsäureverstärkungstechnologie ergibt sich aus Blutkultur Positivität Bericht wurde gleich 201 min (Bereich 100-430), während die mediane Zeit von MALDI-TOF-Identifizierung zu berichten ähnliche Ergebnisse gleich 97 min (Bereich war 25- 250).

Abbildung 1. Pre-und Post-MALDI-TOF-Ära. Vergleich zu herkömmlichen Diagnoseansätze, die eine O / N-Subkultur der Probe gehören, können MALDI-TOF-MS-Identifizierung innerhalb weniger Minuten folgende Proben Lieferung an den Diagnostik-Labor durchgeführt werden. Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
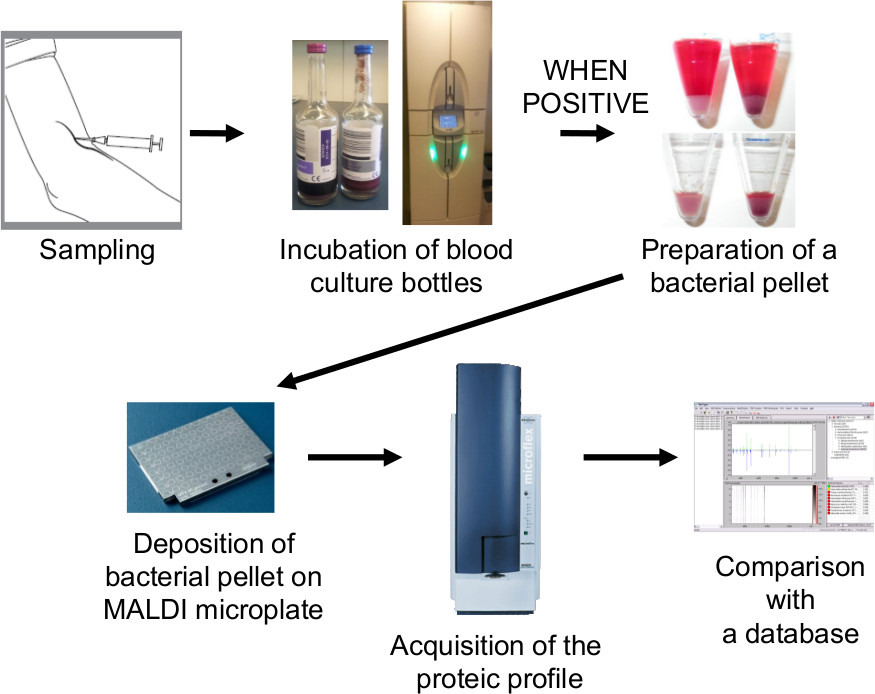
Abbildung 2. Workflow-Verarbeitung von Blutkultur von der Probenahme bis MALDI-TOF-MS-Identifizierung. Wenn Blutkulturen positiv sind, ist eine bakterielle Pellet durch Ammoniumchlorid-Lyse Zentrifugation vorbereitet. Diese bakterielle Pellet wird dann zur direkten Identifizierung von MALDI-TOF-MS verwendet wird. MALDI-TOF MS-Identifizierung kann innerhalb von 30 bis 60 min erhalten werden fo llowing Blutkultur Positivität. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
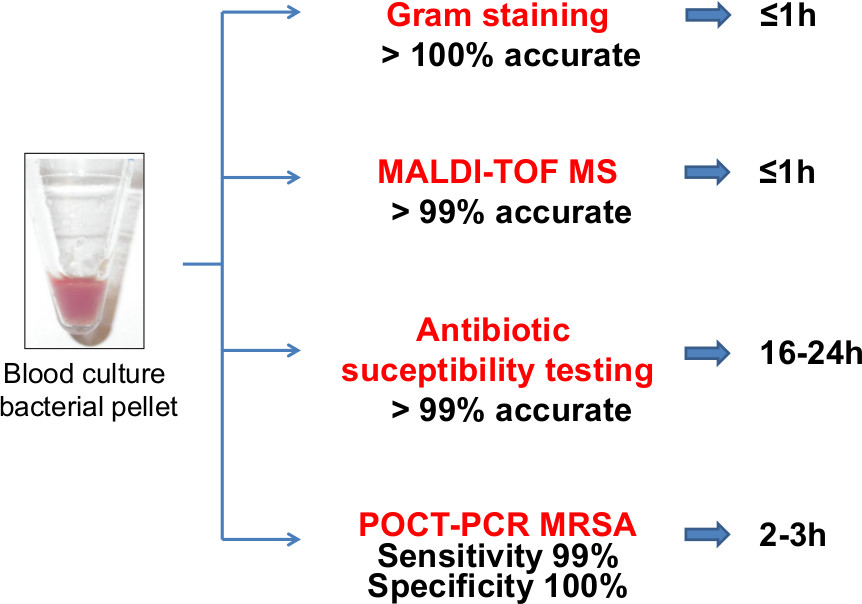
Abbildung 3. Viele Downstream-Anwendungen einschließlich Gram-Färbung, MALDI-TOF-MS-Identifizierung, AST mit automatisierten Systemen und / oder Festplattendiffusionstests und Rapid-PCR-basierte Tests wie Point of Care Test PCRs (POCT-PCR) zum Nachweis von MRSA direkt auf die Blutkultur Bakterienpellet durchgeführt werden. Direkte Tests aus den Bakterienblutkultur-Pellets die Turn-around-Zeit, ID und AST Ergebnisse zu berichten, welche entscheidende ist, das Ergebnis von Patienten mit Infektionen der Blutbahn zu verbessern deutlich verringern. 5fig3highres.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
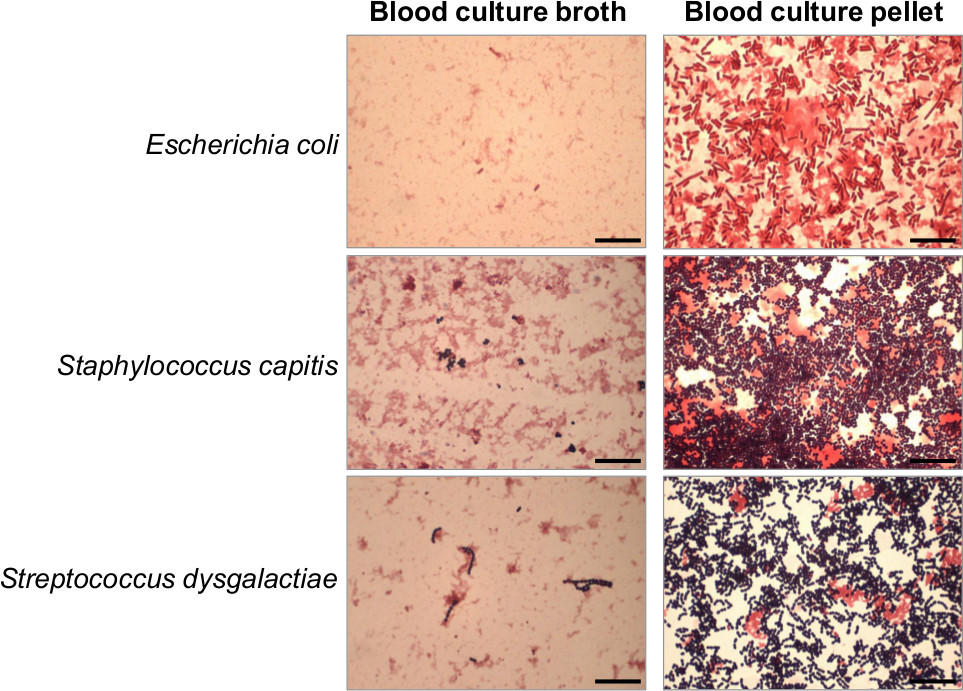
Figur 4. Die Ammoniumchlorid-Lyse Zentrifugation Protokoll ermöglicht die Herstellung eines angereicherten und gereinigten Bakterienpellet aus positiven Blutkulturbrühen. Gram-Färbung der positiven Blutkultur von Escherichia coli, Koagulase-negativen Staphylococcus capitis und Streptococcus dysgalactiae vor und nach der Herstellung durchgeführt, der Blutkultur Bakterienpellet. Die klassischen Morphologien von Staphylokokken und Streptokokken in Clustern in Ketten sind leichter in der nativen Blutkulturbrühe als in der Blutkultur Bakterienpellet beobachtet. Maßstab = 25 um.= "_blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Im Vergleich zu herkömmlichen positiven Blutkultur diagnostische Ansätze, die schnelle Beschaffung eines Bakterienpellet mit Hilfe der Ammoniumchlorid-Lyse Zentrifugation Ansatz reduzieren die Zeit, um die Identifizierung von 16 bis 24 h und die Zeit bis AST von 24 bis 48 Stunden zu melden (Abbildungen 1 und berichten 3).
Rasche Einführung von geeigneten Antibiotika-Therapie ist entscheidend, um das Ergebnis von Patienten mit Infektionen der Blutbahn zu verbessern. Somit stellt die Früherkennung der Erreger innerhalb von 1 h, gefolgt von einer schnellen AST in etwa 8 bis 16 h erhalten einen großen Einfluss auf die klinische Behandlung von Patienten mit Sepsis. Die schnelle Meldung von Gram-Färbung ist bereits mit einem großen Einfluss auf die antimikrobielle Therapie und damit mit einer Abnahme der Patienten Morbidität und Mortalität 6,7 in Verbindung gebracht. Die Gram-Färbung des Blutkulturbakterienpellet kann getan werden, um die Empfindlichkeit zu erhöhen, wenn die Gram-Färbung des BLOOD Kulturbrühe negativ oder schwach positiv (Abbildung 4). Allerdings ist die Gram-Färbung auf dem nativen Blutkulturbrühe durchgeführt empfohlen, typische Morphologien wie Staphylokokken in Clustern oder Streptokokken in Ketten zu beobachten. In einer aktuellen prospektiven Studie an 202 Fällen von Infektion der Blutbahn durchgeführt, zeigte MALDI-TOF-MS-Identifizierung von Blutkultur-Pellets eine Auswirkung in Antibiotika-Therapie in 35,1% der Fälle in der Erwägung, Gram-Färbung hatte nur eine zusätzliche Wirkung in 20% der Fälle 8. Interessanterweise ist die maximale Differenz zwischen der Wirkung Gram-Färbung und MALDI-TOF MS-Identifizierung Berichte über klinische Behandlung wurde beobachtet, wenn Bakterien wie AmpC- produzierende Enterobacteriaceae mit erhöhter Antibiotikum-Resistenz wurden durch MALDI-TOF-MS identifiziert. Ebenso Martiny et al. Haben gezeigt, dass die MALDI-TOF-MS schnelle Identifizierung kann die Anpassung der Antibiotika-Therapie in 13,4% der Fälle, während eine rückwirkende Ohr befestigeny von Stoneking et al. vorgeschlagen, dass eine schnelle Identifizierung von Mikroorganismen verursacht Bakteriämie kann eine angepaßte empirische Therapie in 77% der Fälle entweder durch Verabreichung eines zusätzlichen Antibiotikum nicht durch die anfängliche Therapie oder durch eine Verringerung der Bandbreite der Antibiotika fallenden 18,19 . Darüber hinaus ist die Verwendung einer schnellen PCR-basierten Assays, wie die Nukleinsäure-Amplifikation Technologie MRSA folgenden S. aureus Identifizierung durch MALDI-TOF-MS von Blutkultur Pellets erlaubt, den am besten geeigneten Antibiotika-Therapie in weniger als 4 Stunden, um Patienten mit S. bereitzustellen aureus-Bakteriämie 17. Bei Ausschluss von Patienten mit Penicillin-Allergie, die Verwendung von Nukleinsäureverstärkungstechnologie MRSA erlaubt eine signifikante Reduktion der anti-MRSA Antibiotika Missbrauch wie Glycopeptide von 26,1% auf 8,1%. Zusammen legen diese Daten nahe, dass eine schnelle sequentielle Meldung der Gram-Färbung, MALDI-TOF MS-Identifizierung und schnelle PCR-Basis einssay von Blutkultur-Pellets werden die Antibiotika-Therapie und damit die klinische Behandlung sowie das Ergebnis von Patienten mit Infektionen der Blutbahn deutlich zu verbessern.
MALDI-TOF MS erlaubt eine 78,7% korrekte Identifizierung von Blutkultur-Pellets, die eine sehr gute Leistung im Vergleich zu einer Rate von 84,1% Identifizierung von herkömmlichen MALDI-TOF-MS durchgeführt, erhalten auf reine Kolonien auf Agar-Platten gezüchtet ist. Mehr als 50% der Blutstrominfektion durch bakterielle Spezies, wie Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa und Enterokokken verursacht wird. Diese Bakterien werden effizient durch MALDI-TOF-MS, die wahrscheinlich positiv auf die gute Leistung der MALDI-TOF-MS-Identifizierung direkt auf Blutkultur Bakterienpellets durchgeführt identifiziert. Die geringe Leistung für die Identifizierung von einigen Bakterienspezies durch MALDI-TOF-MS durchgeführt, auf den Blutkultur Pellets ist im Wesentlichen auf ähnliche Faktorenals für die herkömmliche Identifizierung von reinen Kolonien auf Agar-Platten gezüchtet beobachtet. Beispielsweise mehrere mikrobielle Spezies wie Streptokokken der Gruppe mitis und Koagulase-negative Staphylokokken gehören, sind eng miteinander verbunden und mit geringer Genauigkeit durch MALDI-TOF-MS identifiziert. Darüber hinaus ist eine spezielle Zusammensetzung der Bakterienzellwand von Gram-positiven Bakterien oder das Vorhandensein eines in der bakteriellen Spezies, wie Klebsiella pneumoniae beobachtet dichte Kapsel deutlich die Lyse Wirkungsgrad und damit die Leistung der MALDI-TOF MS-Identifizierung zu verringern. Schließlich ist die geringe Leistung der MALDI-TOF-MS zur Identifizierung von anaeroben Bakterien, vor allem aufgrund einer unvollständigen und schlechte Darstellung dieser Bakterien in der MALDI-TOF-Datenbank.
Die kleine Minderleistungen von MALDI-TOF MS-Identifizierung von Blutkultur-Pellets im Vergleich zu herkömmlichen Kontroll aus reinem Kolonien können durch Restblut-Protein CBAUTEILE oder eine unzureichende Menge der Bakterien nach der Lyse-Zentrifugation erhalten. Ebenso sind die mit dem automatisierten mikrobielle Systemkarten direkt mit Blutkultur-Pellets im Vergleich zu denen mit isolierten Kolonien beimpft kann durch Restblutkultur-Komponenten wie Proteine, Blutzellen und Blut Medium Verbindungen verursacht werden, die mit Bakterienwachstum in der stören kann geimpft beobachteten Unterschiede automatisierte mikrobiellen Systemkarten und kann einen erheblichen Einfluss sowohl auf Identifizierung und AST. Außerdem sind die Ergebnisse von AST automatisierten mikrobiellen Systemen erhalten müssen vom Scheibendiffusionsassays auch direkt auf Blutkulturbakterienpellets durchgeführt, um die Ergebnisse einiger Antibiotika bekannt, erhebliche Unterschiede im Vergleich zu herkömmlichen Ansätzen einen Token überprüft werden. , Direkte Inokulation der automatisierten mikrobielle Systemkarten mit Blutkultur-Pellets stellt jedoch eine hervorragende Leistung und AST-ID sowohl für Enterobacteriaceae und staphykokken.
So das Bakterienpellet durch Ammoniumchlorid-Lyse Zentrifugation von positiven Blutkulturen gewonnen wurde validiert, um mehrere Downstream-Anwendungen ermöglichen eine rasche Mitteilung der wesentlichen Ergebnisse wie ID-und AST in einem deutlich reduzierten TAT im Vergleich zu herkömmlichen Ansätzen direkt durchzuführen. Darüber hinaus haben weitere Anwendungen, wie Breitspektrum-β-Lactamasen (ESBL) Tests auf ähnliche Lyse Zentrifugation positive Blutkultur validiert Methodologien 20 darauf hindeutet, dass sie auch auf dem Bakterienpellet mit dem in dieser Arbeit beschriebenen Protokoll gewonnen wurde.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren.
Danksagungen
Wir danken den Technikern der Bakteriologie-Labor der Universitätsklinik von Lausanne für ihre Hilfe, die Techniken im Labor umzusetzen.
Materialien
| Name | Company | Catalog Number | Comments |
| 20 G needle | Terumo, Leuven, Belgium | NN-2038R | |
| 50 ml Falcon tube | BD, Franklin Lakes, NJ, USA | 352070 | 50 ml centrifuge tubes |
| Ammonium chlorure | Merck, Darmstadt, Germany | 101145 | |
| Potassium hydrogen carbonate | Fluka, St. Louis, MO, USA | 60340 | |
| Formic acid | Sigma-Aldrich, St. Louis, MO, USA | F0507 | Flammable, corrosive |
| α-Cyano-4-hydroxycinnamic acid | Fluka, St. Louis, MO, USA | 70990 | Acute toxicity |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO, USA | 271004 | Flammable, acute toxicity |
| Trifluoroacetic acid | Sigma-Aldrich, St. Louis, MO, USA | T6508 | Corrosive, acute toxicity |
| Vitek 2 60 instrument | Biomérieux, Marcy-l'Etoile, France | 27202 | automated microbial system instrument |
| Vitek 2 Gram-positive (GP) card | Biomérieux, Marcy-l'Etoile, France | 21342 | automated GP identification card |
| Vitek 2 AST-P580 card | Biomérieux, Marcy-l'Etoile, France | 22233 | automated microbial AST system |
| Vitek 2 Gram-negative (GN) card | Biomérieux, Marcy-l'Etoile, France | 21341 | automated GN identification card |
| Vitek 2 AST-N242 card | Biomérieux, Marcy-l'Etoile, France | 413391 | automated microbial AST system |
| Xpert MRSA | Cepheid, Sunnyvale, Ca, USA | GXMRSA-100N-10 | nucleic acid amplification technology MRSA |
| GeneXpert IV instrument | Cepheid, Sunnyvale, Ca, USA | GXIV-4-D | nucleic acid amplification technology instrument |
| Microflex LT MALDI-TOF MS instrument | Bruker Daltonics, Bremen, Germany | BDAL microflex LT/SH | |
| MSP 96 target steel BC | Bruker Daltonics, Bremen, Germany | 280799 | MALDI target plate |
| Densitometer Densicheck instrument | Biomérieux, Marcy-l'Etoile, France | 27208 | |
| MALDI Sepsityper kit 50 | Bruker Daltonics, Bremen, Germany | 8270170 | |
| Mac Conkey agar | Biolife, Milano, Italy | 4016702 | |
| Mueller-Hinton agar | Oxoid, Hampshire, England | CM0337 | Mueller-Hinton agar (MH) |
| MHF agar | Biomérieux, Marcy-l'Etoile, France | 43901 | Mueller-Hinton agar-fastidious organisms agar (MHF) |
| BD columbia III agar | BD, Franklin Lakes, NJ, USA | 254071 | blood agar |
| BD chocolate agar | BD, Franklin Lakes, NJ, USA | 254089 | chocolate agar |
| BD schaedler agar | BD, Franklin Lakes, NJ, USA | 254084 | Schaedler agar |
Referenzen
- Alberti, C., et al. Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study. Intensive care medicine. 28, 108-121 (2002).
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Critical care medicine. 29, 1303-1310 (2001).
- Vincent, J. L., et al. Sepsis in European intensive care units results of the SOAP study. Critical care medicine. 34, 344-353 (2006).
- Micek, S. T., et al. Empiric combination antibiotic therapy is associated with improved outcome against sepsis due to Gram-negative bacteria a retrospective analysis. Antimicrob Agents Chemother. 54, 1742-1748 (2010).
- Seifert, H. The clinical importance of microbiological findings in the diagnosis and management of bloodstream infections. Clin Infect Dis. 48, S238-S245 (2009).
- Barenfanger, J., et al. Decreased mortality associated with prompt Gram staining of blood cultures. American journal of clinical pathology. 130, 870-876 (2008).
- Munson, E. L., Diekema, D. J., Beekmann, S. E., Chapin, K. C., Doern, G. V. Detection and treatment of bloodstream infection: laboratory reporting and antimicrobial management. J Clin Microbiol. 41, 495-497 (2003).
- Clerc, O., et al. Impact of matrix-assisted laser desorption ionization time-of-flight mass spectrometry on the clinical management of patients with Gram-negative bacteremia a prospective observational study. Clin Infect Dis. 56, 1101-1107 (2013).
- Meex, C., et al. Direct identification of bacteria from BacT/ALERT anaerobic positive blood cultures by MALDI-TOF MS MALDI Sepsityper kit versus an in-house saponin method for bacterial extraction. Journal of medical microbiology. 61, 1511-1516 (2012).
- Moussaoui, W., et al. Matrix-assisted laser desorption ionization time-of-flight mass spectrometry identifies 90% of bacteria directly from blood culture vials. Clin Microbiol Infect. 16, 1631-1638 (2010).
- Seng, P., et al. Ongoing revolution in bacteriology routine identification of bacteria by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Clin Infect Dis. 49, 543-551 (2009).
- Stevenson, L. G., Drake, S. K., Murray, P. R. Rapid identification of bacteria in positive blood culture broths by matrix-assisted laser desorption ionization-time of flight mass spectrometry. J Clin Microbiol. 48, 444-447 (2010).
- Croxatto, A., Prod&34hom, G., Greub, G. Applications of MALDI-TOF mass spectrometry in clinical diagnostic microbiology. FEMS Microbiol Rev. 36, 380-407 (2012).
- Chen, J. H., et al. Direct bacterial identification in positive blood cultures by use of two commercial matrix-assisted laser desorption ionization-time of flight mass spectrometry systems. J Clin Microbiol. 51, 1733-1739 (2013).
- Prod&34hom, G., Bizzini, A., Durussel, C., Bille, J., Greub, G. Matrix-assisted laser desorption ionization-time of flight mass spectrometry for direct bacterial identification from positive blood culture pellets. J Clin Microbiol. 48, 1481-1483 (2010).
- Prod&34hom, G., Durussel, C., Greub, G. A simple blood-culture bacterial pellet preparation for faster accurate direct bacterial identification and antibiotic susceptibility testing with the VITEK 2 system. Journal of medical microbiology. 62, 773-777 (2013).
- Clerc, O., et al. Matrix-assisted laser desorption ionization time-of-flight mass spectrometry and PCR-based rapid diagnosis of Staphylococcus aureus bacteraemia. Clin Microbiol Infect. , (2013).
- Martiny, D., et al. Impact of rapid microbial identification directly from positive blood cultures using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry on patient management. Clin Microbiol Infect. 19, E568-E581 (2013).
- Stoneking, L. R., et al. Would earlier microbe identification alter antibiotic therapy in bacteremic emergency department patients. The Journal of emergency medicine. 44, 1-8 (2013).
- Nordmann, P., Dortet, L., Poirel, L. Rapid detection of extended-spectrum-beta-lactamase-producing Enterobacteriaceae. J Clin Microbiol. 50, 3016-3022 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten