Method Article
で産生された組換えジスルフィド豊富な毒タンパク質に印加される高スループット定量的発現スクリーニングおよび精製
要約
定量的スクリーニング、ハイスループット発現および小規模大腸菌培養物からの融合タンパク質の精製、分析のためのプロトコルを説明し、ジスルフィドに富む動物毒タンパク質標的の発現に適用される。
要約
大腸菌(E.coli)は、構造的および機能的研究のための組換えタンパク質の生産に最も広く使用される発現系である。多くのタンパク質は、不溶性の形態で発現されているので、タンパク質を精製することは時々困難である。困難または複数のターゲットを操作するときには、そのため迅速可溶性発現のための条件を識別するために、高スループット(HTP)小規模のタンパク質発現スクリーニング(1-4 5ml培養物)を使用することをお勧めします。ラボの種々の構造ゲノミクスプログラムに対応するため、(組換えタンパク質の0.1 mg / Lの培養物の範囲内)の定量的およびHTPタンパク質発現スクリーニングプロトコルは、何千ものタンパク質上に実装され、検証された。プロトコルは、液体ハンドリングロボットを用いて自動化しただけでなく、特殊な装置なしに手動で行うことができる。
ジスルフィド豊富な毒タンパク質が増している治療薬のリードとしての可能性の認識を高める。彼らは、非常に強力かつ選択的なことができますが、その複雑なジスルフィド結合ネットワークは、それらを製造するために挑戦します。 FP7、欧州Venomicsプロジェクト(の一員としてwww.venomics.eu )、私たちの課題は、機能的な特徴付けのための新規毒液タンパク質の何千もの生産を目的に成功した生産戦略を開発することである。ジスルフィド結合イソメラーゼのDsbCの酸化還元特性に助けられ、私たちは、 大腸菌中の酸化、機能的な毒ペプチドの発現のための私達のHTP制作パイプラインに適合大腸菌細胞質。プロトコルはまた、多様なジスルフィドリッチタンパク質の産生に適用可能である。ここでは、私たちのパイプラインは、動物の毒タンパク質の産生に適用さを証明している。プロトコルは、本明細書に記載してit可溶性ジスルフィドリッチタンパク質週できるだけ少ないで得られる可能性が高い。小さなスケールから、目を使用する可能性がありますeは、質量分析によって酸化状態を検証するために、パイロット研究において特徴づけのため、又は感受性マイクロアッセイのためのタンパク質を精製した。
概要
ゲノミクスおよび新規タンパク質の発見の加速された速度の進歩によって動機付けられ、ハイスループット·パイプラインは、最適なタンパク質産生戦略のスクリーニングおよび同定のための従来のアプローチを並列化するために開発されている。潜在的な最適化すべき変数に変化する式は1,2菌株 、これらに限定されないが、温度3,4、メディア2,3、ターゲットは5変異体、融合パートナー6-13、14,15シャペロンとの共発現は、細胞質あるいはペリプラズム発現16〜18、及び精製バッファー成分3。バッチ間のばらつきを抑制しつつ、高スループットのアプローチを実装することにより、多数の変数または多くのターゲットは、高い効率と並行して試験することができる。我々の経験では、戦略は(温度、メディア、曝気など)および精製条件(同RESI同じカルチャを使用して、スケールアップの際に良好な再現性を提供しますnは、緩衝液など)を含む。いくつかのハイスループットプラットフォーム、すなわちそのような融合パートナーは、発現株または温度19-23変化するパラメータ等を介して、可溶性タンパク質発現のための条件を識別するために過去10年間に使用されてきた。
我々は最近、可溶性ジスルフィドリッチタンパク質11の発現のための私達のハイスループットスクリーニング法を使用していました。選択されたタンパク質は、有毒な供給源からだけであったが、植物、ブタ、ウシ及びヒトを含む広範囲の種からのジスルフィドリッチな酵素阻害剤を含んでいた。実験は、12の異なる融合パートナーと28ジスルフィド網状タンパク質の溶解性と折り畳みに3の異なる発現株の効果を比較した。我々は(収率および得られた可溶性タンパク質の数の両方で)株BL21(DE3)での生産のための融合パートナーとしてのDsbCを使用してpLysSを大幅outproducedひずみとの融合の他の組み合わせは11をテストしたことを明らかにした。ザ·この実験の結果は、ジスルフィドリッチな標的の発現のためのより適したものに(広範囲のタンパク質の発現をスクリーニングするために使用されている)当初の一般的なハイスループット·パイプライン22,24を適合させるための基礎を形成した。動物の毒からジスルフィドリッチタンパク質は、特に重要である。毒は、薬理学的および治療的潜在値と、生物活性ペプチドおよびタンパク質の複雑な混合物である。しかし、ジスルフィド結合含有タンパク質の発現は、容易ではありません。これらのタンパク質は、一般的に一から七のジスルフィド結合の間で含まれており、アクティブにするために、正しいジスルフィド結合パターンを用いて酸化されなければならない。現在、プラットフォームは、FP7、欧州VENOMICSプロジェクト(www.venomics.eu)の一部として、ジスルフィドリッチな動物毒多数のタンパク質の発現をスクリーニングおよび標的の数千のハイスループット発現のための新規なプロトコルをベンチマーキングするために使用されている。ここでは、自動化された方法ジスルフィドリッチに動物毒タンパク質を印加( 図1参照)の高スループットの小規模発現スクリーニングおよび精製の ために設けられている。ジスルフィドリッチペプチドやタンパク質のための戦略は、精製および酸化還元活性融合パートナー、DsbCは、標的タンパク質に切断可能なHIS-DsbCの融合を作成します( 図2を参照)のための彼のタグを利用しています。
プロトコルの焦点は、本明細書ロボットとHTP電気泳動を処理液を用いて自動化であるが、これらの方法はまた、高スループットの手動アプローチに適している、基本的なセットアップでさえ研究室は高価な機器のための任意の必要条件なしにプロトコルを利用できることを意味。精製および分析(ジスルフィドリッチタンパク質に固有のものではありませ)への変換のためのマニュアルのプロトコルは、他の場所で24公開されており、ここでは繰り返さない。再結合によって生成される発現クローンからの手動手順のスループット(、可溶性タンパク質レベルの分析にナショナルクローニング25)、96(SDS-PAGE検出を使用して)または384(4×96であるドットブロット及びSDS-PAGE 26を使用して)週培養() 図1を参照。 (例えば、キャリパーGXIIラボチップシステム22と同様に、液体処理ロボットおよびドットブロット26又はHTP電気泳動を使用した半自動化された方法で行われる場合、これを増加させることができる 結果の分析のための)最大1152まで(12×96)一週間にわたって並行して培養、本明細書に記載される。正規振盪インキュベーターに十分な通気のための短い軌道高速振盪インキュベーターの使用を必要とディープウェル96(DW96)形式、(振盪で増殖させた培養物とは対照的に使用できるように、培養は24(DW24)形式深いウェル中で行われる800rpmで)。自動誘導培地27の使用はまた、手動誘導ステップを排除し、式を簡素化します。研究所ではすでに、事前定義された式とプリを使用した場合でもfication条件が、これらは単に効率を向上させるために、このHTPシステムに直接転送することができる。ジスルフィドリッチタンパク質のためのハイスループットスクリーニングパイプラインの詳細な概略図を図3に設けられている。パイプライン中のパラメータはボランティアタンパク質生産のための最も有用な条件を選択させ広範なスクリーニング実験11、22、に基づいて選択した。
特徴付けは、サンプルの数十マイクログラムが十分な、または敏感な機能アッセイ及び結合アッセイ(例えば、低容積HTPパッチクランプシステム28)のためのパイロットスタディにおける小規模表現から直接精製タグ付きタンパク質を行うことができる。同じであっても、切断後に、タグなしのターゲット上で実行される、タグおよびプロテアーゼを設けすることができる(逆相HPLCによって、など)を除去する。品質管理はまた、(予想されたサイズおよび酸化番目を確認するために質量分析法によって行うことができるATE)や、純度や異質性を確認するクロマトグラフィー法()29。時々 、切断が不要な、あるいは望ましくない(特に難溶性タンパク質のため30,31)ので、このプロトコルの切断にはオプションのタグ。それにもかかわらず、全ての構築物内で直接( 図2および考察を参照されたい)切断後、天然のタンパク質を産生する標的遺伝子の前にTEVプロテアーゼ切断部位(ENLYFQ / [G] 32)がある。融合タグの切断が所望される場合、切断は、効率性を分析する必要に応じて条件を最適化し、後続のスケールアップ実験の収率の信頼できる推定値を得るために小さなスケールで(溶出画分または「カラム上 ')試験することができる。
実験の目的や期待に応じて、アフィニティ精製の間に使用されるビーズの量は2つのオプションがあります。パイロットアッセイまたはMSのために精製するために(可能な限り多くのタンパク質を捕捉できるようにする、又はextrapolに)スケールアップ利回りのために食べた樹脂を200μlの最終容量は、システムが飽和する前に、1から100 mg / Lの文化の範囲内の可溶性タンパク質の検出を可能とする、使用されるべきである)8.1節の(プロトコル(Aを参照) 。実験の目的は、可溶性タンパク質の低量の検出である場合は、樹脂の50μlの最終体積は、(B(プロトコルを参照して0.1〜25 mg / Lの培養物の範囲内の可溶性タンパク質の検出を可能にする、適切である)セクション8.2)である。
必要に応じて生産は可溶性発現のために識別条件を用いてさらなる構造的および機能的研究のために精製された標的のミリグラム量を得るために、スケールアップすることができる。 AFMBで使用スケールアッププロトコルの詳細は他の場所で議論されている22,24。
実験装置、プロトコル内の重要なステップに関連するさらなる詳細は、変更及びトラブルシューティングおよび技術の限界は、ディスクで提供されussion。実験開始前の議論をお読みください。
我々は、各ステップで90%の成功率を期待するプロトコルの全体にわたって(例えば、培養物の少なくとも90%が、任意の所与の段階で成長しなければならない)。実験におけるいずれかのステップの成功率が90%を下回るとサンプルが廃棄され、実験が構築物の完全な回収のために繰り返される。これは試験したタンパク質に高度に依存するであろうしかし、この成功率は、可溶性タンパク質として発現構築物の番号又は100%の効率で切断する構築物の割合には適用できない。
ロボットワークテーブルのセットアップのための具体的な詳細は、各プロトコルのために提供される別のワークテーブルのセットアップに必要とされるが、それらは適合させることができる(また、 図4を参照)。ロボットハードウェア(テカン)を96マルチチャンネルアーム(MCA96)、ロボットマニピュレータ(ローマ)と8チャンネル液体ハンドリングヘッド(で構成されていますLIHA)。 MCA96が利用できない場合MCA96を利用するすべてのステップもLIHAがステップ間に洗浄する必要があるので、彼らは時間がかかります、LIHAを使用して行うことができる。ロボットは、技術的に無菌環境ではありませんが、抗生物質を含めることは、一般的には、汚染や無菌性に問題がないことを保証します。
プロトコル
パートA:変換とテスト式
クローニング22および精製への変換のためのマニュアルの手順は、他の場所で24議論されている。形質転換プロトコルは、完全にロボット26上で実行することができますが、手動でそれを行うには通常より時間が効率的です。そのためのプロトコルは、ここにミックスが手動で行う熱ショックを受け、変換からの発現前培養および変換のメッキの接種から始める。マニュアルのクローニングおよびトランスフォーメーション手続きの詳細については、関連する参考文献22,24を参照してください。
1。前培養及びめっき
- (位置については、図4を参照)ロボットワークテーブルを準備します。
- 150ミリリットルの無菌LB培地を含有する300ml入れトラフ(アンピシリン(100μg/ ml)を補充したに/クロラムフェニコール(34μg/ ml)を、適切な抗生物質または他の)位置8。
- 無菌DWを入れる11位の96。17位の14に彼らの蓋を(各ウェル中の2ミリリットル寒天を含む)4Xあらかじめ用意した24ウェルLB寒天(AMP / CAM)組織培養プレートを置く。
- 13位の(96変換がヒートショック後のミックスを含む)の変換プレートを置きます。これは、液体前培養し、LB寒天プレートに接種するために使用されます。 18位の無菌200μlのピペットチップの箱を置く。
- の各ウェル内の1ミリリットルのLBブロスの最終容量があるまで、96のマルチチャンネルアーム(MCA96)と200μlのヒント、吸引LBブロス(ポジション8)を200μlを使用して、位置11でのDW96に分配することを繰り返しDW96。これは、液体前培養になります。
- ロボットマニピュレータ(ローマ)を使用して、最初の24ウェルLB寒天プレートの蓋を取り外し、メッキが、その板に終了するまで(ホテルのキャリア中など)別の場所に置きます。
- (LIHA)ヘッドを扱う8チャンネルの液体を使用して、吸引し、Tの50μLをミックス位置13での形質転換混合の彼の最初の列。形質転換混合のこのボリュームは十分にLB寒天をカバーするだけで十分です。
- 最初の4つのチャンネルを、( 図5に示すように)14位の第24ウェルLB寒天プレートの最初の列に分注する。
- 最後の4チャンネルを、最初の24ウェルLB寒天プレートの2列目の上に分注する。
- 徹底的に分注後にすべてのヒントを洗う。
- 24ウェルに、図5に設けられたスキームを使用して-すべての変換は96から転送する、位置14で第一プレート上にプレーされるまで、このプロセスを続ける。
- 最初のプレートが完了したら、蓋を交換し、15位に次のプレートからふたを削除するためにローマを使用しています。次の3プレート用メッキ方式を使用して続行します。
- めっきが完了すると、1,200 rpmまでのTe-シェイクを設定し、形質転換混合物の均一な分布を有するように1分間、すべてのプレートを振盪する。
- MCA96と元のピペットチップを使用して、吸引し、残りの形質転換混合物(位置13)を60μlを混合し、11位でのLBブロスを含むDW96に分注する。
- 培養エアレーションを可能にするために、通気性接着フィルム付きDW96の前培養を封印。
- 最高速のO / N(シェーカー軌道に依存800分の200 rpm)で37℃の振盪培養器内の場所。
- LB寒天プレートは、乾燥するまで(10分)から、その蓋つきのフード内に配置する必要があります。その後、彼らは次の朝まで37℃プレートインキュベーターで反転配置されます。
- 次の日、前培養は、自動誘導培地およびグリセロールストックを調製するためのテスト式に接種するために使用される。バックアップとして、冷蔵庫に寒天プレートを置く。必要に応じて、寒天プレートまたはグリセロールストックから出発して、テスト式を直接新鮮なLBの前培養物を接種することによって再度行うことができる。
DW24 ZYPの2。準備-5052プレート
注:この手順では、4X DW24プレートのセットごとに完了するのに約5分かかります。
- 各コンポーネントのレシピがあります- 96の文化(464ミリリットルZY媒体、250μlの2Mの硫酸マグネシウム、10ミリリットルを50倍5052、25ミリリットルの20倍のNPSは、この順番でそれぞれの複製のための500ミリリットルZYP-5052自動誘導培地を構成する適切な抗生物質を補充した、 表1に)提供した。
- ロボットワークテーブルを準備します。
- 5位と6位の2 300ミリリットルの谷、〜250ミリリットルの媒体を含む各を置く。位置14から17で4無菌DW24プレートを入れてください。18位の200μlのヒントを入れてください。
- ZYP-5052200μlの位置5から、MCA96と200μlのヒントを吸引使用し、位置14において第DW24プレートに分注する。これを5回の合計でください(4ヒントは、合計一度に一つのウェルに分注するでしょう4ミリリットルの)。位置で残りの3×DW24プレートについて繰り返し15から17、SWIT最後の2 DW24プレート用の6位にZYP-5052にチン。
試験発現培養の3。接種および成長
NOTE:接種は4倍DW24プレートのセットごとに完了するのに約10分を要し、成長がO / Nを継続する
- ロボットワークテーブルを準備します。
- 位置11に(ステップ1.15から)の前培養を含むDW96プレートを置く。位置14から17に(ステップ2.3から)ZYP-5052培地を含む4 DW24プレートを置く。
- 図5に設けられたスキームを使用してテスト式培養(1/40希釈)に接種するためにLIHA吸引位置11からの前培養液100μlを使用した。96ウェル前培養の各列間の洗浄ステーションで徹底的LIHAヘッドを洗浄します。
- 通気性フィルムとDW24プレートをシールし、4時間(400分の200 rpm)しながら37℃でインキュベートする。これは、増殖期の間の時間であるglucosメディアからの電子は、優先的に27を枯渇する。
- 17℃に温度を下げる4時間とグルコースの枯渇後に、ラクトースは、この作品22で、BL21(DE3)pLysSを、またはロゼッタ2(DE3)pLysSをするための最適な成長条件を提供し、発現の誘導につながる、代謝されると開始します。 O / Nを表現するために、細胞を残すグリセロールストックを作るために、残りの前培養を使用しています。
グリセロールストックの4。準備
NOTE:グリセロールストックを冷凍障害が発生した場合に、異なる場所に格納される三連でなされるべきである。
- ロボットワークテーブルを準備します。
- グリセロールストックを収容するために7に5位のマイクロタイタープレートを置く。 8位の100%グリセロールを50ミリリットルでいっぱい300ミリリットルトラフを置く。11位の各ウェルに(ステップ3.2の後に)前培養物800μLを含むDW96を入れてください。18位の200μlのヒントを入れてください。
- SLOを使用したW吸引及び分配速度、前培養を含むDW96にグリセロールを追加しMCA96と200μlのヒントを参考にしてください。
- グリセロールの吸引物200μL(位置から8)。
- (11位の)150μLを分注最初に、残りのグリセリンは、先端の下部に到達することができるように20秒間一時停止する。残りの50μLを分注する。
- 彼らは完全に混合するまで、同じチップを使用して、11位のDW96文化とグリセリンを混ぜて。グリセロールの最終濃度は20%である。吸引液140 DW96からμLと5位の最初のマイクロタイタープレートに分注する。
- 残りの各マイクロタイタープレートのためのステップ4.3を繰り返し(位置6および7)。
- -80℃で、プラスチック製の粘着テープや店舗、各マイクロタイタープレートをシール廃棄前に抗菌剤で除染、DW96の残りの文化を捨てる。
5。培養物の増殖を評価する
注意:これは、通常、最終OD 600は通常、ほとんどの文化(これらの条件で12前後)で同じであるように、最終的な成長率を評価することは必要ではなく、成長しないが、任意の培養は注目すべきである。
- (ステップ3.4から)各培養液50μlを取り、培地150μLを含む平底、明確なマイクロタイタープレートに分注する。
- 考慮に4倍希釈を考慮して、OD 600を測定します。非常によく成長しなかったことをいずれかがある場合は、最終的な分析のためにこれを注意してください。
6。細胞を回収
注:この手順を完了するのに約45分かかります。
- 10分間3000×gで(ステップ3.4から)4X DW24プレートを遠心分離し、抗菌剤を含有する廃棄物容器に上清を捨てる。余分な培地を除去するために吸収性の紙の上に、逆さま、プレートをタップします。
- 一方、溶解の100ミリリットルを用意リゾチーム(最終濃度0.25 mg / mlで)を含有する緩衝液(50mMトリス、300mMのNaCl、10mMのイミダゾールpH8で、または他の好適な緩衝液)。
- ロボットワークテーブルを準備します。
- 5位の300ミリリットルトラフに溶解バッファーを入れた。11位のクリーンDW96を入れてください。位置14〜17(ステップ6.1からの)細胞ペレットを含む4×DW24プレートを置く。 18位の200μlのヒントを置く。
- MCA96と200μlのヒント、吸引位置5からの溶解バッファー125μLを使用し、(位置14〜17)各DW24プレートに分注する。繰り返します。注:4のヒントはDW24プレートの各ウェル中の1ミリリットルの最終容量のために、一度に一つのウェルに分注するでしょう。
- ペレットを再懸濁し、15分間のTe-シェイク(1,000 rpm)を使用して、位置14〜17でプレートを振る。
- ペレットを再懸濁されたら、Lを使用して、(14番目の最初のDW24の最初の列、4)にサンプル1から550μLを吸引するLIHAの最初の4チャンネルを使用LIHA吸引のAST 4チャンネルのサンプルの550μlの5(第DW24の2列目)8。 11位のDW96の最初の行に分注する。
- 繰り返し手順6.6、細胞懸濁液の全てがDW96に転送されるようになっている。
- 試料の各セットの後に洗浄ステーションにLIHAのヒントを洗う。
- 繰り返しますが、 図5に設けられたスキームを使用して、各DW24プレートの各列(位置15〜17)のために6.8に6.6を繰り返します。プラスチックフィルムで封をします。
- 即日もしくは短期的な凍結、1時間で最低-80℃で保存、上の精製のためにそうでなければ、-20℃で保存する
パートB:精製および分析
7。細胞溶解
注:この手順が完了するまでに約60分かかります。
- Aの振盪インキュベーター中で約15分間再懸濁するために(RT又は37℃)の水浴中(ステップ6.10)から凍結細胞懸濁液を解凍10分dditional。培養は、粘性になるはず。
- DNA分解酵素原液を500μlを取り、 硫酸マグネシウム株式の1ミリリットルと混ぜる。手動で8チャンネルピ ペットまたはロボットLIHAと、DNaseおよび20mMのMgSO 4を10μgの/ mlの最終濃度を与えるために、DW96の各ウェルに15μlずつ分注する。
- ビニールテープでプレートを再密封し、さらに15分間振る。この時点で、培養は非粘性である必要があります。すべての文化はもはや粘性であること(目視検査による)を慎重に確認していません。注:いくつかの文化がサンプルとオーバーフローや総詰まりに不均一な圧力を発生させる、まだ(DNA分解酵素が誤っていくつかのウェルに適切に分配し忘れたり、されなかった場合など)は、フィルターが目詰まりします粘性であれば、これは非常に重要ですフィルタープレートは、精製中に発生する可能性があります。
- 全細胞溶解物のSDS-PAGEサンプルについて、溶解物を吸引し、10μlを含む96ウェルPCRプレートに分注する4×SDS-PAGE試料緩衝液10μlおよび水20μl。 95℃で3分間変性させ、分析(合計分)まで凍結する。 HTP電気泳動システムが利用可能である場合、サンプルは、サンプル調製のためのこの代わりに、次の部品メーカーの推奨プロトコル上で分析することができる。サンプルの分析に関する詳細はセクション10を参照してください。
8。ニッケルアフィニティー精製
注:遅い吸引速度は全ての樹脂の懸濁液をピペッティングするために使用されるべきで、懸濁液はかなりの厚さであるように。過乾燥樹脂が結合能力の減少をもたらすであろう。精製のために、指定されたイミダゾール濃度は、ニッケルアフィニティー樹脂に適用可能である。別のイオン( 例えば 、コバルト)を使用する場合、濃度に応じて調整されるべきである。
- - 1-100 mg / Lの(最終的な樹脂容量=200μL)の範囲で検出するためのNiアフィニティ精製
注:T彼の精製手順は、4までの一日で行うことができることを意味し、完了するのに約1.5時間を要する。- ロボットワークテーブルを準備します。
- 結合緩衝液(50mMトリス、300mMのNaCl、10mMのイミダゾールpH8)に、洗浄緩衝液(50mMトリス、300mMのNaCl、50mMのイミダゾールpH8)に、溶出緩衝液(50mM Tris、300mMのをを含有する300mlトラフを置く位置でのNaCl、250mMのイミダゾールpH8)に6〜8であった。
- 樹脂スラリーのために5位の空の300ミリリットルトラフのままにしておきます。 9位のおよび10は、プレートホルダーを置く。 10位の上に、SPEブロックとフィルター/レシーバープレート(20ミクロン)でDW96を置く。
- 位置14に(ステップ7.3)からの溶解物を含むDW96を入れてください。位置18および19には、それぞれ、200μlの広いボアのヒントと200μlのヒントを置く。ホテルでの洗浄や溶出のために2つの予備DW96プレートを置く。注:ホテルが利用できない場合、それらはまた、作業台に代替サイトに置くことができた。
- 準備105平衡化した33%の樹脂スラリー(35ミリリットル樹脂+結合緩衝液70ml)中の溶液。すぐに手続きを開始する前に、5位の谷に樹脂懸濁液を追加します。
- MCA96と200μlの広いボアのヒント(位置18)を使用して、徹底的に位置14での溶解液を含むDW96に樹脂スラリーを200μlを吸引し、分配する前に、5位の樹脂スラリーを混合する。二回繰り返すことにより、樹脂スラリーの600μL各吸引する前に樹脂懸濁液を混合、溶解物に添加されています。
- 結合のために可能にし、ペレット化から樹脂を防ぐために、位置14でMCA96を用いて10分間混合工程を実行します。
- 位置14から吸引し、9位のフィルタープレート上に(200μLロット)800μLを分注するには、各吸引がそうで樹脂がDW96の一番下に保持される前に混合。
- にプレートを通して溶解液をフィルター処理するのに約90秒の10位の上の真空をオンにし樹脂を乾燥しないように注意しながら、フロースルーを収集するDW96。真空の電源をオフにします。
- 樹脂のすべてがフィルタープレートにしてあるように繰り返して、8.1.5と8.1.6を繰り返します。
- ROMAアームを使用すると、次の洗浄ステップは、廃棄物に直接移動するように9を配置し、フロースルー10位のホテルに別のサイト( 例えば 、へを含むDW96を転送するために、位置10からフィルタープレートを保持するSPEのブロックを移動手続きが終了するまでキャリア)。
- (19位の)200μlのヒントの新しいセットで、(位置6から)結合バッファー800μlの合計で(9位の)樹脂を洗浄し、バッファが通過するまでの位置9で真空を適用。もう一度繰り返します。
- 50 mMイミダゾール洗浄を収集し、(位置10)先頭へ戻る上のSPEブロックとフィルタープレートを移動させるために10位の新鮮DW96を配置するROMAアームを使用してください。
- 位置10に位置7からの洗浄緩衝液800μl加え、ターンバッファが通過するまでの真空。真空のスイッチをオフにします。
- ROMAで、SPEブロックとフィルタープレート9を配置すると、ホテルに洗浄試料を含むDW96を削除し、手順の最後まで取って保管してください。
- (ポジション9上に位置7からの)洗浄バッファーの別の800μlで樹脂を洗浄、バッファが通過するまで真空を適用する。もう一度繰り返します。
- 10位の新鮮DW96を配置し、溶出を収集するために、トップに戻って、SPEブロックとフィルタープレートを配置するためにローマを使用しています。
- (ポジション9上に位置8から)の溶出緩衝液500μlの合計を追加し、3分間その場でインキュベートする。すべてのバッファが通過するまで真空をオンにします。
- オプション:高度タンパク質を発現させるため、第二溶出がステップ8.1.14と8.1.15のように新鮮なDW96に行うことができます。
- SDS-PAGEまたはHTP電気泳動用のフロースルーのサンプルを取り、洗浄、溶出/秒。
- は、4X SDS-PAGE試料緩衝液10μlおよび水20μlを含有する96ウェルPCRプレートに10μlずつ分注する。洗浄および溶出のSDS-PAGEサンプルについて/ sの4×SDS-PAGE試料緩衝液10μlを含有するPCRプレートに30μlずつ分注する。 95℃で3分間変性させ、分析まで凍結する。
- HTP電気泳動サンプルについては、メーカーの指示に従ってください。サンプルの分析に関する詳細はセクション10を参照してください。
- ロボットワークテーブルを準備します。
- B - 0.1〜25 mg / Lの(最終的な樹脂容量=50μL)の範囲で検出するためのNiアフィニティ精製
注:この精製手順は、12までの一日で行うことができることを意味し、完了するまでに約30分を要する。- ロボットワークテーブルを準備します。
- 結合緩衝液(50mMトリス、300mMのNaCl、10mMのイミダゾールpH8)に、洗浄緩衝液(50mMトリス、300mMのNaCl、50 mMイミダゾールpHを8)を含有する300mlトラフを置くそれぞれの位置6〜8、および溶出緩衝液(50mMトリス、300mMのNaCl、250mMイミダゾールpHを8)。
- 樹脂スラリーのために5位の空の300ミリリットルトラフのままにしておきます。 9位のおよび10は、プレートホルダーを置く。 10位の上に、SPEブロックとフィルター/レシーバープレート(20ミクロン)でDW96を置く。
- 位置14に(ステップ7.3)からの溶解物を含むDW96を入れてください。位置18および19には、それぞれ、200μlの広いボアのヒントと200μlのヒントを置く。ホテルの溶出のために予備の96ウェルマイクロタイタープレートを置く。注:ホテルが利用できない場合にも、作業台に代替サイトに置くことができた。
- 平衡化した25%の樹脂スラリー(12.5ミリリットル樹脂+結合緩衝液37.5ミリリットル)の50ミリリットルを用意します。すぐに手続きを開始する前に、5位の谷に樹脂懸濁液を追加します。
- MCA96と200μlの広いボアのヒント(18位)、徹底的に吸引する前に、5位の樹脂スラリーを混合しの塗料を使用して位置14での溶解液を含むDW96に樹脂スラリーを200μlnsing。
- 結合を可能にする10分間1400 rpmでのTe-シェイクを使用して、振とうしながら、室温でインキュベートする。
- 位置14から吸引し、10位のフィルタープレート上にワイドボアのヒント(位置18)を使用して、完全な1200μL(200μLロット)を分注する。各吸引する前に混ぜるそうで樹脂がDW96の下部に保持されます。
- 樹脂を乾燥しないように注意しながら、フロースルーを収集するためにDW96にプレートを通して溶解液をフィルター処理するのに約30秒間10位の上の真空をオンにします。真空の電源をオフにします。
- ROMAアームを使用して、次の洗浄ステップは、廃棄物に直接移動するように9を配置し、フロースルー10位の中に別のサイト( 例えば 、へを含むDW96を転送するために、位置10からフィルタープレートを保持するSPEのブロックを移動ホテル事業)手続きが終了するまで。
- 200μで(19位の)Lチップは、(位置6からの)結合バッファー800μlの合計で(9位の)樹脂を洗浄し、バッファが通過するまでの位置9で真空を適用します。繰り返します。
- 50 mMイミダゾール洗浄を収集し、(位置10)先頭へ戻る上のSPEブロックとフィルタープレートを移動させるために10位の新鮮DW96を配置するROMAアームを使用してください。
- バッファが通過するまでに真空をオンに、位置10に位置7からの洗浄緩衝液150μLを加える。真空のスイッチをオフにします。
- ROMAで9を配置するために、SPEブロックとフィルタープレートを取り外して、ホテルに洗浄試料を含むDW96は、手続きが終了するまで、横に置いておいてください。
- (ポジション9上に位置7からの)洗浄バッファーの別の800μlで樹脂を洗浄、バッファが通過するまで真空を適用する。繰り返します。
- 9位のマイクロプレートを配置し、目を収集するために、トップに戻って、SPEブロックとフィルタープレートを配置するためにROMAを使用E溶出。
- (ポジション9上に位置8から)溶出バッファー190μLを加え、3分間その場でインキュベートする。すべてのバッファが通過するまで真空を適用します。
- SDS-PAGEまたはHTP電気泳動用のフロースルー、洗浄および溶出のサンプルを取る。
- フロースルーのSDS-PAGEサンプルについて、4×SDS-PAGE試料緩衝液10μlおよび水20μlを含有する96ウェルPCRプレートに10μlずつ分注する。洗浄および溶出のSDS-PAGEサンプルについて/ sの4×SDS-PAGE試料緩衝液10μlを含有するPCRプレートに30μlずつ分注する。 95℃で3分間変性させ、分析まで凍結する。
- HTP電気泳動サンプルについては、メーカーの指示に従ってください。サンプルの分析に関する詳細はセクション10を参照してください。
- ロボットワークテーブルを準備します。
9。タグ切断(オプション)
- ステップ8.1.15(および8から(溶出されたタンパク質をTEVプロテアーゼ(2 mg / mlの)を追加します。1/10の比の1.16)または工程8.2.14)(v / v)である。
- 穏やかに振盪しながら、O / N(温度感受性タンパク質または4℃)、室温でインキュベートする。
- 切断の終了時に10 4×SDS-PAGEサンプル緩衝液又はHTP電気泳動サンプルに関するメーカーの指示に従っを含むPCRプレートに30μlずつ分注する。
- 96ウェルの0.22μmフィルタープレートを通して(ステップ9.2から)残りの切断混合物を濾過し、真空を適用することにより、可溶性のフロースルーDW96内を集める。これはセクション8.1と8.2での溶出工程のためのように、液体処理ロボットに真空サイトの一つ( 例えば 、位置10)で行うことができます。これは、切断中に沈殿した任意のタンパク質を除去します。
- 濾過後、4×SDS-PAGE試料緩衝液10μlを含有するPCRプレートに30μlずつ分注するか、HTP電気泳動試料として調製。これは、切断前のタンパク質の比較を可能にする、切断後の混合物とゾルUBLEタンパク質が切断後に残っているとその後のスケールアップ実験で期待される結果の良い指標を提供します。サンプルの分析に関する詳細はセクション10を参照してください。
結果10。分析
- 例えば、カリパーラボチップ(Caliper LabChip)等のSDS-PAGE、ドットブロット又はHTP電気泳動システム上での精製試料を分析することによって、可溶性タンパク質を発現する構築物を同定する。
- 可溶性タンパク質を生産する構成要素を識別するために、最初の溶出サンプルを分析します。可溶性構築物が同定されたほとんどの場合においてのみ、溶出サンプルを、分析に費やす時間を最小限にするために、分析される。
- タンパク質が溶出されていない場合は、それが発現し、樹脂に適切に結合しなかったかどうかを確認するために洗浄し、フロースルーのサンプルを実行します。
- 全く可溶性タンパク質を検出することができないの構築物について、タンパク質を発現させたかどうかを確認するために、全細胞溶解物を実行します。
注:ここに1つの制限は、もしP関心対象のroteinは上記の背景発現レベルを提示していない、タンパク質を表示することができない場合があり、偽陰性をもたらし得る。これは、タンパク質が付着してアフィニティー樹脂に析出し、これが偽陰性または過小評価推奨プロトコル(この作品では珍しいイベント)を使用して、収量の可能性がありすることが常に可能であることに留意しなければならない。タンパク質は(白ペレットを数分/時間で溶出した後に表示されている)、溶出の際に沈殿する場合には、バッファ組成物(例えば、塩濃度)を変更および/または最適化するために、示差走査蛍光定量アッセイを実施することをお勧めしますバッファ。樹脂の小さいサンプルは、SDS-PAGEサンプル緩衝液に再懸濁し、タンパク質は、樹脂上に保持されているかどうかを検出するために煮沸することができる。 - タンパク質が発現していなかったが、OD 600が再成長や文化を再分析は十分高いものではなかった場合には細胞は、成長する新しい式戦略を追求するか、しなかった場合。 >
- 劈開サンプルが分析される場合には、各構築物は、切断前にAN隣接レーンでの切断後に表示することができるように、それらは分析を簡単にするため、サイドバイサイドの方法で分析されるべきである。
- 溶出濃度の直接定量を与える方法を用いない限り、定量化は、280nm(A280)での吸光度を測定することにより、陽性試料について実行されるべきである。
- 最も高い発現可溶性構築物を同定するために、タンパク質収量の推定値を提供するために、アカウントへのタンパク質の共効率的消光を取り、ブランクとして溶出緩衝液を使用して、A280を測定する。
- 水溶性の利回りの最も信頼性の高い比較のために、それは第5で撮影した(OD 600測定を使用)文化の密度によって収量を正規化することをお勧めします。すべての文化がほぼ同じ密度に成長した場合、正規化はありません必要に。
- 試料は、液体クロマトグラフィー - 質量分析(LC / MS)により溶出または切断試料から直接分析することができる。
- 代替的に、をZipTipピペットチップまたは液体クロマトグラフィー法を用いて(イミダゾール及び存在し得る任意の緩衝塩を除去するために)最初に脱塩し、マトリックス支援レーザー脱離/イオン化飛行時間型(MALDI-TOF)又はエレクトロスプレーイオン化を(使用する分析ESI)質量分析法。
- 小スケール機能研究は、予想通り、タンパク質の機能があるかどうかを確認するために行うことができる。より多量の機能のために必要とされる場合には、スケールアップ培養を行うことができ、大きさや酸化状態一旦拡大培養物からテスト関数が小さなスケールで確認されている。
結果
代表的な結果をVENOMICSパイプラインから96ジスルフィドリッチタンパク質の発現スクリーニングのために、図6に示されている。タンパク質は残基の数を増加させること、次いで、ジスルフィド結合の数を増加させることによって配置されている。ペプチドは、HIS-タグおよびDsbCは融合パートナーと細胞質中で発現させた。推奨される培養条件を用いる場合、12のOD 600は、通常達成される。ペプチドを、ニッケル親和性樹脂の50μlの最終容量で8.2-Bプロトコルを使用して精製したので、約25 mg / Lの融合タンパク質の最大値は、この実験で検出することができた。
図6Aは、カリパーラボチップ(Caliper LabChip)システム(切断前の融合を示す)および融合タンパク質mg / L培養で得外挿に基づいて、スコアリングシステム(0.1〜2 mg / Lの培養物のレベルで、2からの電気泳動結果を示す10 mg / Lの培養物、10〜25 mg / Lの文化なし Tが検出されました。)期待通りに切断されたDsbCタグは、通常ではなく27kDaのよりも、約32 kDaの動作することに注意してください。同様に、DsbCは融合も予想よりも高い約5 kDaのを実行します。ターゲットの多くのために我々は完全な融合(上のバンド)を参照していないだけでなく、融合パートナーは、単独(下のバンド)。これらのターゲットのいくつかのために培養条件を最適化するだけではDsbCは、最終的な収量の増加を可能にすることに比較して、完全な融合(上のバンド)の比率を向上させることができます。得点だけ無傷の融合のレベルに基づいています。唯一の16 96のうち、タンパク質は、融合レベルで検出することができなかった。これは、83%の全体的な成功レベルに対応する。検出することができた80のタンパク質のうち、これらのうちの45は2 mg / Lの培養物(56%)よりも高いレベルで検出された。 (この例では、プロトコルB 8.2〜25 mg / Lの融合タンパク質の最大値を検出することができるを用いても)標的との融合に依存して、タンパク質収量は2〜100 mg / Lの培養物の範囲である。
T ">現在のジスルフィド結合の数( 図6(b)に示す)による成功の分析では、最低の成功レベルが6ジスルフィドを含むターゲットに対して66%であることと、(1と7の間)を試験のジスルフィド結合のすべての数値のための合理的な成功を示しています債券。等電点及び残基の数( 図6Cに示されている)に基づく式の成功の分布の分析は、両方の発現に成功目標とプロット全体に散らばって検出されなかったターゲットに、技術は特に偏りを示さない。図6Dは、DTTで還元試料の前後に、単一のターゲットのエレクトロスプレーイオン化質量分析(ESI-MS)から得られた質量分析結果の一例を示す図である。通常、このような網羅的な質量分析解析は、しかし完全なdemonstratioの目的のために、(還元試料を分析する必要がない)実行する必要がないであろうNは、両方の結果を示している。図示ターゲットは4ジスルフィド結合を有する5.7 kDaのジスルフィドリッチ毒液タンパク質である。左のスペクトルは、それがさらなる介入なしに切断し、脱塩した後だったので、前のDTTによる還元に対するタンパク質の結果を示す。右側のスペクトルは、余分なDTTを除去するための脱塩に続くDTTによる還元後のタンパク質を示しています。実験大衆に対応するイオンは、スペクトル上の矢印でマークされ、各イオンのための指定は、緑で表示されます。 (タンパク質のための先行削減(-DTT)へと縮小(+ DTT)の後に)これらのイオンのために計算された実験的な親質量は表に示します。質量(減少したサンプルのための先行削減、5717.6 Daのサンプルのための5709.6 DA)は8ダの質量差を示す。 2 Daの質量差が、1酸化されたジスルフィド結合の存在に対応する(予想通り)、従って8ダルトンの質量差は4ジスルフィド結合の存在を示すで非還元サンプル。

記載の半自動化された機器とのハイスループット発現スクリーニングプロトコルの図1略図。このプロトコルを使用して、96から384の条件は手動の方法を使用して一週間に一人で試験することができる、または最大1152の条件。発現プラスミドは、多数のターゲットが一度にサブクローン化することができるように、組換えクローニング技術を用いて構築される。一旦可溶性発現条件が同定されており、切断が行われ、所望の場合、タンパク質は、酸化および純度、マイクロアッセイおよび/または大規模生産を確認するための品質管理に進むことができる。
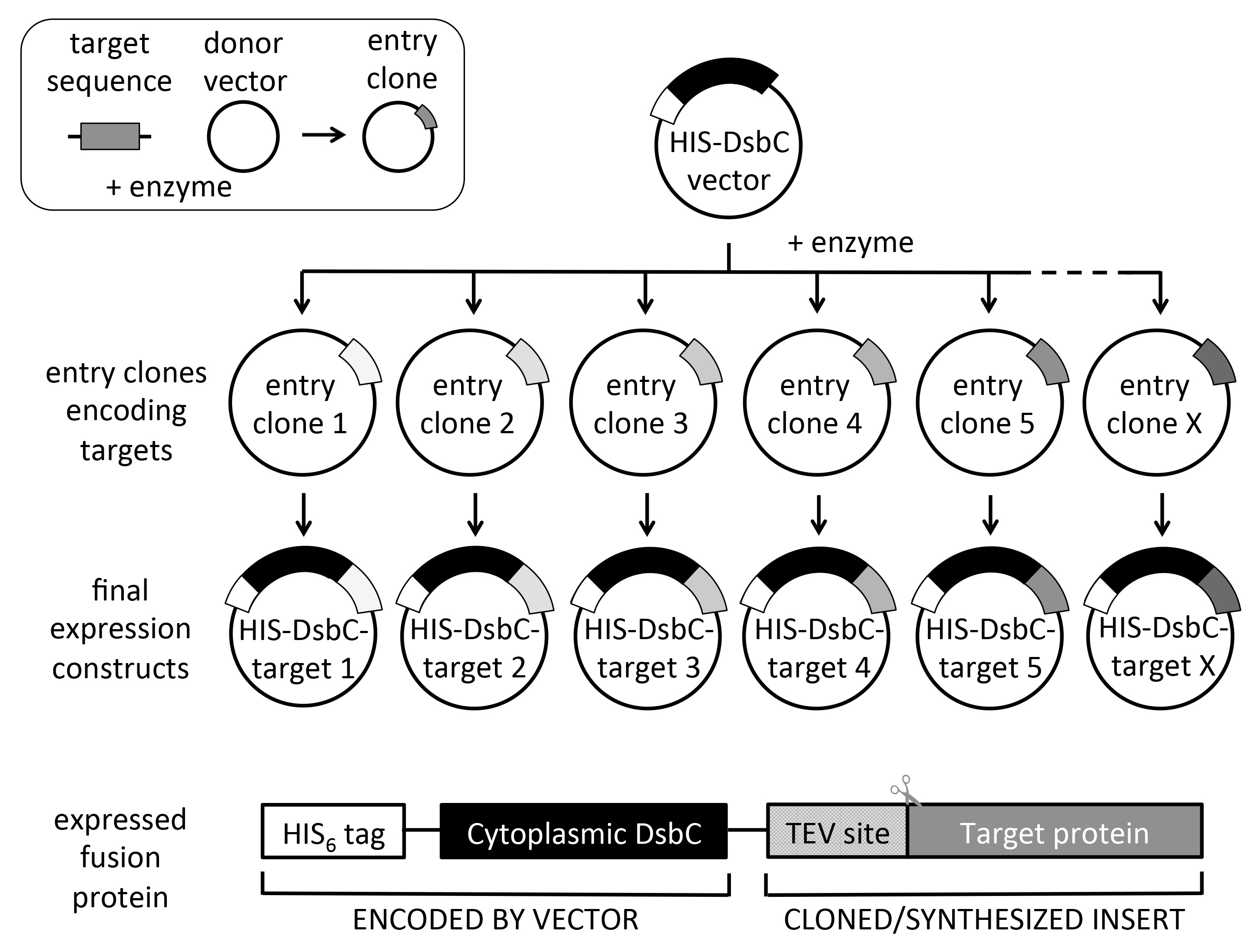
図2。ユニバーサル組換えクローニングのための回路図と設計を構築します。対象エントリクローンから、複数の発現ベクターは、ハイスループット様式(週で最大6×96エントリークローン)の単一の実験でサブクローン化することができる。発現されたタンパク質は、ニッケルアフィニティー精製にHISタグをコードしている。 DsbCは(細胞質発現のためにそのペリプラズムシグナル配列を欠く)融合パートナーは、溶解度を増加および/または折り畳みと標的タンパク質の正しい酸化を助けるために使用される。タグの切断が所望される場合に、ターゲットコード配列がN-末端TEVプロテアーゼ部位(ENLYFQ)を含むべきであることに留意されたい。左上の挿入図は、PCRまたは遺伝子合成により得ることができるドナーベクターと標的配列を使用して、エントリークローンの生成を示す。エントリークローンはまた、商業的なエントリークローンコレクションから得ることができる。複数の組換えクローニングシステムは、しかし、我々はゲートウェイの体系を利用して、ご利用いただけますM、回路図に示すように。

図3。複数のジスルフィドの豊富なターゲットのハイスループットスクリーニングのパイプライン。目標は、最初は、BL21(DE3)pLysSをEの細胞質中のHIS-DsbCの融合体として表現される自動誘導培地(ZYP-5052)を使用して、17分の37℃で大腸菌 。精製は、HTP電気泳動(又はドットブロット/ SDS-PAGEによる)により、可溶性構築物の検出に続いて、ニッケル樹脂上で行われる。発現スクリーニングの最初のラウンドが失敗した場合に、代替的な培養条件が試されている。構築物は、十分に高い収率、マイクロアッセイおよび品質管理において可溶性タンパク質を産生する場合に実行することができ、必要に応じて、大規模生産を追求することができる。水溶性の利回りが十分に高くないターゲットの場合、発現スクリーニングは、代替STRAを続行することができますインした後、温度が他の融合パートナーとペリプラズム発現。オプションのステップは、破線のボックスで示されている。

HTPプラットフォームの図4ロボットのワークテーブルのセットアップ代替ワーク·テーブルを使用することもできるが、我々の液体ハンドリングロボットワークテーブルのレイアウトは、示されている、利用可能な等価なサイトが提供される。セットアップは(8チャンネル液体ハンドリングヘッド(LIHA))、4箇所で2マイクロプレートキャリアごと(MP4、1-4および5-8位)、2箇所で真空ステーションのための洗浄ステーション(WS)で構成されています2ポジションごと(TE-シェーカーは、14〜15と16〜17位)し、キャリアと3位(MP3は、11〜13位)、2プレートシェーカー付きマイクロプレートキャリア、(TE-VACSは、9と10位) 3ポジションを使い捨てチップのために(DITI、18〜20位)。加えて再2ホテルディープウェルプレート用の担体(図示せず)マイクロプレート用の1である。液体処理ロボットに搭載されているハードウェアは、使い捨てチップ、周りにプレート/機器を動かし、固定チップを備えた8チャネル液体ハンドリングヘッド(LIHA)とロボットマニピュレータ(ローマ)で使用するための96のマルチチャンネルアーム(MCA96)ですワークテーブル。位置の番号付けは、プロトコルの全体にわたって参照される。

図5 4つの24ウェルプレート中に単一の96ウェルプレートから転送するための模式図。

図6。代表的な結果は96ジスルフィド豊富な毒プロの発現の画面に表示されますteins。タンパク質は、細胞質中のHIS-DsbCの融合体として発現させ、ニッケル樹脂を50μl(プロトコル8.2-B)を用いて精製した。A)式のスクリーニングの結果、仮想ゲルを示すと発現収量得点。仮想ゲルのコントラストは非常に弱い又は強いバンドを補償するためにレーンを調整された。上のバンドは、インタクトな融合タンパク質単独融合タグに対応する下位バンドに対応する、いくつかの標的のために二つのバンドを見ることができることに留意されたい。B)それぞれの発現レベルで発現されたタンパク質の割合でジスルフィド結合の数と比較しタンパク質。各群におけるタンパク質の実際の数は、グラフ上に重ねている。C)等電点(pI)および残基の数に基づいて、発現レベルの分布D)5.7 kDaのジスルフィドリッチな毒のための質量分析結果の一例4ジスルフィド結合を有するタンパク質。上のスペクトル左側の前、DTTによる還元と右側のスペクトルにタンパク質を示しているタンパク質はDTTで還元した後、脱塩を示しています。実験大衆に対応するイオンは、矢印でマークされ、その割り当ては緑で表示されています。前削減へと縮小後のタンパク質のための実験的な質量は、表に示されており、8ダの質量差を示し、還元剤を添加する前に酸化されたタンパク質の存在に対応している。 この図の拡大版を表示するには、こちらをクリックしてください。 。
| コンポーネント | レシピ | コメント |
| ZY | 〜928ミリリットル 10グラムリプトン 5gの酵母エキス 925ミリリットルの水 | 混合し、次いで滅菌するオートクレーブ。 |
| 2男のMgSO 4 | 100ミリリットル 49.3グラムのMgSO 4·7H 2 O 約60 mlの水 | 溶解するまで攪拌して滅菌するオートクレーブ。 |
| 50X 5052 | 1 L 250グラムのグリセロール 730ミリリットルの水 25gのグルコース 100グラムのα-乳糖 | 順番に追加するすべて溶解するまでの熱の上に攪拌して滅菌するオートクレーブ。 |
| 20X NPS | 1 L 900ミリリットルの水 66グラム(NH 4)2 SO 4 136グラムのKH 2 PO 4 142グラムのNa 2 HPO 4 | 順番に追加し、すべて溶解し、その後滅菌するオートクレーブまで撹拌。 |
ZYP-5052培地の成分については、表1。レシピ。
ディスカッション
水溶性、折りたたまれた、機能的なタンパク質の発現のための単一のユニバーサルプロトコルがありません。 、コストと時間の効率的であると、複数のターゲットを扱うほとんどの研究室やタンパク質コア施設は、したがって、目標の大半を、可溶性の活性タンパク質を得るために、変数の最高の「一般的な」組み合わせを見つけるためのスクリーニングのハイスループットタンパク質発現を使用しています。私たちは、ジスルフィド豊富なペプチドおよびタンパク質11の可溶性発現のために一般的に適用可能な融合パートナーであるとのDsbCを同定した。 DsbCの融合およびハイスループット方法を用いて、一週間以内に複数の標的の可溶性発現が11で観察することができ、次いで、導入部で論じたものなどの追加の変数は、さらなる最適化を必要とするターゲットでその後のラウンドでスクリーニングすることができる。本明細書に記載されたプロトコルは、ジスルフィドに富むタンパク質およびペプチドの発現を目的としている。しかし、expに希望するユーザーのためのハイスループット様式でRESS非網目状タンパク質は、対応するプロトコルは、以前に公表されており、他の場所22,24見出すことができる。
高スループットのセットアップは(同時に可溶性発現または複数の標的遺伝子のための(様々な融合タグを含む)の発現構築物の多数のスクリーニングのための異なった多数のタンパク質のスクリーニングなど、多数のアプリケーションに最適ですまたは複数の発現が成功率を向上させるために)単一のターゲットの構築物。プラットフォームはまた、多数のターゲットに新しいプロトコルのベンチマークと検証のために使用することができる。他のアプリケーションは、単一の難しいターゲットの変異体のスクリーニング、 例えば 、全ての相同分子種または同じファミリーのメンバー、または1の実験では、単一の標的の変異体のパネルの生産の成功をテストするためにあります。また、このプロトコルは、共発現ベクター(ウィットと組み合わせて使用されているH 1は、プルダウン正しい複合体形成および化学量論33を確認するために、より徹底した生物物理学的分析を行ったタンパク質-タンパク質複合体の予備的な特性評価を可能にするために)タンパク質のみをタグ付けされた。精製されたタンパク質の量は、マイクロアッセイ(官能試験、タンパク質-DNA 34またはタンパク質-タンパク質相互作用アッセイ)のために時々に適している。ハイスループット発現スクリーニング戦略にはいくつかの利点がある:(i)多数のターゲットをテストする能力、または単一の実験で多数の変数と、(ii)限られたバッチ間のばらつき、(三)は深い井戸を使用してより小さな規模で働くのシンプルさと使いやすさ、(iv)の拡張性と再現性、より大きなスケールでは、自動化のための(V)の可能性、および(vi)の追跡のシンプルさとハンドリング(個々のチューブの無いラベル、少なく)を混合中の個々のチューブの取り扱いをよりプレートフォーマットを使用するか、クローンの交換時に導入されたミス。
プロトコルのセクションで説明されていないが、以下に簡単に説明される実験の準備のため、いくつかの重要な考慮事項があります。より完全な議論についてはこれまでの出版物24を参照してください。最大効率のためには、ターゲットの多数のサブクローン作成を簡素化するために、ハイスループットクローニングに適したシステムを持っていることが有益である。 VENOMICSプロジェクトの初期段階のために、我々は週にクローンの数百のペースで任意のデスティネーションベクターにサブクローニングを可能にする汎用性の高いGateway組換えシステム25を利用する。 Gateway組換えクローニングのためのプロトコルは、Invitrogen社のウェブサイトでご覧になれます。ハイスループットクローニングのため他の選択肢は、37のクローンを作成ライゲーションに依存しないクローニング(LIC)35,36および制限フリー(RF)が含まれています。エントリークローンのコレクションから、鋳型DNAからPCRにより含め、表現のための標的遺伝子を得るために複数の方法があります。またはVENOMICSプロジェクト用に選択された戦略である合成遺伝子、。合成遺伝子は、遺伝子の両端に組換え部位に注文することができ、遺伝子合成は、(まれな大腸菌コドンを排除するために)標的遺伝子配列を容易にコドン最適化を可能にする。これはお勧めしますが、必須ではない。希少コドンの数が多い、ロゼッタ2(高度大腸菌内で発現されていない希少コドン用tRNAを運ぶ)(DE3)pLysSをが含まれているコドン最適化することなくターゲットの場合、BL21(DE3)pLysSをより良く適している。細胞質の通常還元環境でのジスルフィド結合の還元を制限可能な菌株があ りますが、私たちの手で、彼らは、通常の大腸菌と同じくらい成功していない大腸菌は 11株。分析スケールアフィニティー精製は、可溶性融合タンパク質を回収し、収率を定量化するために、試験発現培養物から行われる。定量的データは日に取得することができる培養物を100mg / L - 0.1の範囲内で発現された融合タンパク質の可溶性電子収量。ターゲットが可溶性でない場合、別の融合パートナーが追求される前に、別の発現および誘導温度、株または媒体を試験することができる。ジスルフィドが豊富なタンパク質の可溶性発現のために、我々は以前に細胞質発現のための11のDsbC>のDsbA> GST> MBP> TRX> HIS-タグとして融合パートナーの効果をランク付けした。ペリプラズム発現は、ジスルフィドが豊富なターゲットの成功折りたたみを助けることができるもう一つの可能性である。ペリプラズムは、細胞質よりも低い還元環境で、ジスルフィド結合を支援するための有用な酸化還元シャペロンが含まれています。 DsbCは、DsbAの、およびMBPタンパク質は通常、彼らの周辺質のシグナル配列によってペリプラズムに局在している。これは折り畳みを助けるために、細胞膜周辺腔にジスルフィド豊富な目標を指示するために、これらのタグを活用する機会を提供する。難治性のターゲットでは、次のステップはPになります(これは、このプロトコルの範囲の外にあり、ここでは3 9で議論されることはありません)封入体からの不溶性Hisタグのターゲットをurify、可溶化し、リフォールディング。これは、1つまたは2つのジスルフィド結合を有する標的に対して非常に単純であるが、ジスルフィド結合の数が増加するにつれてますます難しくなることができる。あるいは、そして特に4個以上のジスルフィド結合を有するタンパク質およびペプチドのためには、例えば、酵母、昆虫または哺乳動物発現などのより複雑な生産システムを試すことが有益であり得る。
小型化と自動化の進歩により、HTPの電気生理学ラボオンチップ技術28は、間違いなく機能解析のための将来の道になります。我々は(おそらく構造的研究を除いて)ほとんどの目的のために、これは大規模な文化のための必要性を否定することを想定。小規模培養物は、発現条件をスクリーニングするために有用であるだけでなく、接尾を提供することができるようになるだけでなくこれらの小型化された機能アッセイのためのサンプルのficient量。機能的特徴付けのために十分な量で並列に複数のターゲットを生産する能力を培養し、そのプラットフォームのこれらの種類を使用することのコストを下げるため、組換えタンパク質の発現および特徴付けは、コストと時間が有効になります。
プロトコルは、本明細書欧州FP7 VENOMICSプロジェクトの初期段階において、ジスルフィドリッチなペプチドおよびタンパク質の発現に適用されている。毒は頻繁に興味深い薬理可能性を持っている生理活性ペプチドの優れた供給源である。しかし、それらの製造、それらの複雑なジスルフィド結合パターンと小型サイズのため困難である。本明細書に記載のようなハイスループットプラットフォームを用いて、VENOMICSプロジェクトは、自然界で観察される多様性を再現する10,000の新規毒ペプチドのライブラリーを生成することを目的とする。このライブラリは、ジスルフィド-Rの特徴付けのために利用されます新薬の開発を目的とした潜在的な薬理または治療への応用とICHペプチド。プラットフォームは、現在VENOMICSプロジェクトで使用するための新しいプロトコルをベンチマーキングし、検証するために使用されている。
開示事項
The authors declare that they have no competing financial interests.
謝辞
この作品はVENOMICSプロジェクト、第七フレームワーク·プログラム(FP7 HEALTH 2011年から2015年)を通じて278346°欧州プロジェクト無償Nでサポートされていました。 VENOMICSプロジェクトは、ヨーロッパのいくつかの研究機関や企業間のコラボレーションです。
AFMB、エクス·マルセイユ大学(フランス)、CEAサクレ(フランス)、NZYTech(ポルトガル)、SistemasGenomicos(スペイン)、大学·ド·リエージュ(ベルギー)、VenomeTech(フランス)、Vitamib(フランス)、ニュージーランドファーマ(デンマーク)
この作品は、統合された構造生物学(FRISBI)ANR-10-INSB-05から01のためのフランスのインフラストラクチャによってサポートされていました。
著者はまた、ビデオの撮影のための準備を支援するために氏ジェレミーTurchettoに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Tecan Freedom EVO 200 liquid handling robot | Tecan Group Ltd. | Protocols can be adapted to any liquid handling robot with a vacuum manifold for plates. http://www.tecan.com/platform/apps/product/index.asp?MenuID=2694&ID=5270&Menu=1&Item=21.1.8 | |
| 96-well PCR (PCR96) plates | Greiner Bio-One | 652270 | http://us.gbo.com/bioscience/detail/2504/ |
| LB medium | Autoclaved for sterility. | ||
| Antibiotic stocks | Kanamycin (50 mg/ml), ampicillin (100 mg/ml), chloramphenicol (34 mg/ml in ethanol), store stocks at −20 °C. Use a 1:1,000 dilution. | ||
| Deep-well 96 (DW96) plate with 2.42 ml volume capacity | Greiner Bio-One | 780270 | Autoclaved for sterility. http://us.gbo.com/bioscience/detail/2462/ |
| Expression vectors | For the expression of target constructs. Store at −20 °C. | ||
| BL21 (DE3) pLysS competent cells | Or alternative E. coli expression strain of the user's choice. Store at −80 °C. | ||
| Breathseal breathable adhesive film | Greiner Bio-One | 676050 | |
| PCR machine with 96-well plate block | For the transformation heat shock and boiling of SDS-PAGE/Caliper samples. | ||
| 24-well sterile tissue culture plates | Greiner Bio-One | 662165 | http://us.gbo.com/bioscience/detail/2220/ |
| LB-agar | Autoclaved for sterility. | ||
| 200 μl sterile disposable tips | Tecan Group Ltd. | 30 038 617 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Multitron shaking incubator, with 3 mm throw | Infors | AJ103 | Not essential, a regular shaking incubator can also be used. http://www.infors-ht.com/index.php/en/ |
| Plate incubator | |||
| Microtiter plate | For glycerol stocks and elution using purification protocol B. | ||
| Glycerol | For the preparation of glycerol stocks. | ||
| 200 μl disposable tips | Tecan Group Ltd. | 30 038 616 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Adhesive tape pads | Qiagen | 19570 | http://www.qiagen.com/Products/Catalog/Lab-Essentials-and-Accessories/Tape-Pads |
| Bactinyl | Orapi Group | Or equivalent microbial disinfectant. | |
| ZYP-5052 medium | See Table 1 for recipes of components. | ||
| Deep well 24 (DW24) plates, 10 ml capacity | Whatman | 7701-5102 | Autoclaved for sterility. http://www.whatman.com/UNIPLATECollectionandAnalysisMicroplates.aspx#7701-5102 |
| Flat-bottomed, clear microtiter plate | Greiner Bio-One | 655101 | For absorbance readings. http://us.gbo.com/bioscience/detail/2029/ |
| Plate reading spectrophotometer | Optional. For measuring OD600 of cultures. | ||
| Centrifuge with rotor for deep well plates | Suitable for 3,800 x g. | ||
| Lysozyme | 50 mg/ml in water. Store at −20 °C. | ||
| Imidazole ACS grade | Merck | IX0005-1 | A high quality grade of imidazole must be used so that it will not interfere with A280 readings for calculating protein yield. |
| Lysis buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 containing 0.25 mg/ml lysozyme (or your preferred buffer). Add lyzozyme from stocks each time and do not store for extended periods. | ||
| Water bath | |||
| Plate sonicator (Ultrasonic processor XL, adapted for deep well plates) | Misonix Inc. | Not essential. Lysozyme alone is normally sufficient for nearly complete lysis. | |
| DNase | 2 mg/ml stock in water, filter sterilized. Store aliquots at −20 °C. | ||
| Magnesium sulphate (MgSO4) | 2 M stock in water, autoclaved. | ||
| SDS-PAGE or Caliper sample buffer | |||
| Binding buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Wash buffer | 50 mM Tris, 300 mM NaCl, 50 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Elution buffer | 50 mM Tris, 300 mM NaCl, 250 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| 96-well Receiver/Filter Plate 20 µm, 1.8 ml capacity | Macherey-Nagel | 740686.4 | http://www.mn-net.com/ProductsBioanalysis/Accessories/tabid/10909/language/en-US/Default.aspx |
| 200 μl disposable wide bore tips | Tecan Group Ltd. | 30 050 348 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Ni Sepharose 6 Fast Flow resin | GE Healthcare | 17-5318-02 | For purification of target fusion proteins. Store at 4 °C. Wash and equilibrate before use. http://www.gelifesciences.com/webapp/wcs/stores/servlet/productById/en/GELifeSciences/17531802 |
| Tobacco Etch Virus (TEV) protease | Optional, for cleavage. 2 mg/ml, without reducing agents in storage buffer. Store at −80 °C. | ||
| 96-well 0.22 µm filter plate | Millipore | MSGV N22 10 | Optional. To filter the soluble fraction after cleavage. http://www.millipore.com/catalogue/item/msgvn2210 |
| SDS-PAGE/dot blot equipment or Caliper Labchip GXII equipment | Electrophoresis apparatus and choice of gel type is at the user’s discretion. | ||
| Spectrophotometer and cuvettes | For measuring absorbance at 280 nm (A280) to calculate yield of soluble proteins. Not required if the analysis is done on the Caliper. | ||
| ZipTip pipette tips | Millipore | Optional. The type of ZipTip is at the user's discretion. C4 resin should be used for larger proteins, while for peptides C18 may be better. Alternative methods for desalting of samples may also be used to clean up samples before further quality control. http://www.millipore.com/catalogue/module/c5737#0 | |
| Materials are listed in the order in which they are required in the Protocol section. Reagents can be stored at room temperature unless noted otherwise. Reference numbers for the author’s preferred choice of materials are provided, however equivalent products may also be suitable. For reagents where the brand will not influence the outcome of the experiment, the company details have been omitted. | |||
参考文献
- Berrow, N. S., et al. Recombinant protein expression and solubility screening in Escherichia coli: a comparative study. Acta Crystallographica Section D-Biological Crystallography. 62, 1218-1226 (2006).
- Correa, A., Oppezzo, P. Tuning different expression parameters to achieve soluble recombinant proteins in E. coli: advantages of high-throughput screening. Biotechnol J. 6, 715-730 (2011).
- Graslund, S., et al. Protein production and purification. Nat Methods. 5, 135-146 (2008).
- Vera, A., Gonzalez-Montalban, N., Aris, A., Villaverde, A. The conformational quality of insoluble recombinant proteins is enhanced at low growth temperatures. Biotechnol Bioeng. 96, 1101-1106 (2007).
- Graslund, S., et al. The use of systematic N- and C-terminal deletions to promote production and structural studies of recombinant proteins. Protein Expr Purif. 58, 210-221 (2008).
- Bird, L. E. High throughput construction and small scale expression screening of multi-tag vectors in Escherichia coli. Methods. 55, 29-37 (2011).
- Davis, G. D., Elisee, C., Newham, D. M., Harrison, R. G. New fusion protein systems designed to give soluble expression in Escherichia coli. Biotechnol Bioeng. 65, 382-388 (1999).
- Kapust, R. B., Waugh, D. S. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein science: a publication of the Protein Society. 8, 1668-1674 (1999).
- LaVallie, E. R., Lu, Z., Diblasio-Smith, E. A., Collins-Racie, L. A., McCoy, J. M. Thioredoxin as a fusion partner for production of soluble recombinant proteins in Escherichia coli. Methods Enzymol. 326, 322-340 (2000).
- Marblestone, J. G., et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein science: a publication of the Protein Society. 15, 182-189 (2006).
- Nozach, H., et al. High throughput screening identifies disulfide isomerase DsbC as a very efficient partner for recombinant expression of small disulfide-rich proteins in E. coli. Microb Cell Fact. 12, 37(2013).
- Sachdev, D., Chirgwin, J. M. Fusions to maltose-binding protein: control of folding and solubility in protein purification. Methods Enzymol. 326, 312-321 (2000).
- Smith, D. B. Generating fusions to glutathione S-transferase for protein studies. Methods Enzymol. 326, 254-270 (2000).
- de Marco, A., Deuerling, E., Mogk, A., Tomoyasu, T., Bukau, B. Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli. BMC Biotechnol. 7, 32(2007).
- Hatahet, F., Nguyen, V. D., Salo, K. E., Ruddock, L. W. Disruption of reducing pathways is not essential for efficient disulfide bond formation in the cytoplasm of E. coli. Microb Cell Fact. 9, 67(2010).
- de Marco, A. Recent contributions in the field of the recombinant expression of disulfide bonded proteins in bacteria. Microb Cell Fact. 11, 129(2012).
- Katzen, F., Beckwith, J. Disulfide bond formation in periplasm of Escherichia coli. Methods Enzymol. 348, 54-66 (2002).
- Klint, J. K., et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm of E. coli. PloS One. 8, e63865(2013).
- Braud, S., et al. Dual expression system suitable for high-throughput fluorescence-based screening and production of soluble proteins. Journal of Proteome Research. 4, 2137-2147 (2005).
- Douzi, B. G. A., et al. A new system for expressing recombinant animal toxins in E. coli. (Collection Rencontres en Toxicologie, Publications de la SFET, Chatenay-Malabry). Advances and new technologies in toxinology. , 149-152 (2010).
- Groisillier, A., et al. MARINE-EXPRESS: taking advantage of high throughput cloning and expression strategies for the post-genomic analysis of marine organisms. Microb Cell Fact.. 9, 45(2010).
- Vincentelli, R., et al. High-throughput protein expression screening and purification in Escherichia coli. Methods. 55, 65-72 Forthcoming.
- Xiao, R., et al. The high-throughput protein sample production platform of the Northeast Structural Genomics Consortium. Journal of Structural Biology. 172, 21-33 (2010).
- Saez, N. J., Vincentelli, R. Ch3 High-throughput expression screening and purification of recombinant proteins in E. coli. Structural Genomics: General Applications : Methods in Molecular Biology. Chen, Y. W. 1091, Humana Press. 33-53 (2014).
- Katzen, F. Gateway (R) recombinational cloning: a biological operating system. Expert. Opin. Drug Discov. 2, 571-589 (2007).
- Vincentelli, R., Canaan, S., Offant, J., Cambillau, C., Bignon, C. Automated expression and solubility screening of His-tagged proteins in 96-well format. Analytical Biochemistry. 346, 77-84 (2005).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expr Purif. 41, 207-234 (2005).
- Spencer, C. I., et al. Ion channel pharmacology under flow: automation via well-plate microfluidics. Assay Drug Dev Technol. 10, 313-324 (2012).
- Sala, E., de Marco, A. Screening optimized protein purification protocols by coupling small-scale expression and mini-size exclusion chromatography. Protein Expr Purif. 74, 231-235 (2010).
- Moon, A. F., Mueller, G. A., Zhong, X., Pedersen, L. C. A synergistic approach to protein crystallization: combination of a fixed-arm carrier with surface entropy reduction. Protein science: a publication of the Protein Society. 19, 901-913 (2010).
- Zanier, K., et al. Structural basis for hijacking of cellular LxxLL motifs by papillomavirus E6 oncoproteins. 339, Science. New York, N.Y. 694-698 (2013).
- Kapust, R. B., Tozser, J., Copeland, T. D., Waugh, D. S. The P1' specificity of tobacco etch virus protease. Biochemical and Biophysical Research Communications. 294, 949-955 (2002).
- Vincentelli, R., Romier, C. Expression in Escherichia coli: becoming faster and more complex. Current Opinion in Structural Biology. 23, 326-334 (2013).
- Jolma, A., et al. DNA-binding specificities of human transcription factors. Cell. 152, 327-339 (2013).
- Aslanidis, C., de Jong, P. J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Research. 18, 6069-6074 (1990).
- Haun, R. S., Serventi, I. M., Moss, J. Rapid, reliable ligation-independent cloning of PCR products using modified plasmid vectors. BioTechniques. 13, 515-518 (1992).
- van den Ent, F., Lowe, J. RF cloning: a restriction-free method for inserting target genes into plasmids. Journal of Biochemical and Biophysical Methods. 67, 67-74 (2006).
- Vincentelli, R., et al. High-throughput automated refolding screening of inclusion bodies. Protein science: a publication of the Protein Society. 13, 2782-2792 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved