Method Article
High Throughput Screening Expression quantitative et purification appliquée à recombinant disulfure riches protéines venin produit dans
Dans cet article
Résumé
Un protocole pour l'expression de criblage à haut débit quantitatif et la purification d'analyse de protéines de fusion à partir de cultures d'Escherichia coli à petite échelle est décrite et appliquée à l'expression de protéines cibles du venin d'animaux riches en disulfures.
Résumé
Escherichia coli (E. coli) est le système d'expression le plus largement utilisé pour la production de protéines recombinantes pour des études structurales et fonctionnelles. Cependant, est parfois difficile purification de protéines depuis de nombreuses protéines sont exprimées sous une forme insoluble. Lorsque vous travaillez avec des cibles difficiles ou plusieurs, il est donc recommandé d'utiliser un débit élevé (HTP) de dépistage de l'expression des protéines sur une petite échelle (1-4 ml de cultures) pour identifier rapidement les conditions pour l'expression soluble. Pour faire face aux diverses génomique programmes structurels du laboratoire, une analyse quantitative (dans une plage de 0,1-100 mg / L de la culture de la protéine recombinante) et la protéine de HTP protocole de dépistage d'expression a été mis en place et validé sur des milliers de protéines. Les protocoles ont été automatisées à l'aide d'un robot de manipulation de liquide, mais peut également être effectuée manuellement sans matériel spécialisé.
Protéines de venin disulfure riches gagnentaccroître la reconnaissance de leur potentiel en tant que fils de médicaments thérapeutiques. Ils peuvent être très puissant et sélectif, mais leurs réseaux de liaison disulfure complexes rendre difficile à produire. En tant que membre du projet européen FP7 VENOMICS ( de www.venomics.eu ), notre défi consiste à élaborer des stratégies de production réussies dans le but de produire des milliers de nouvelles protéines de venin pour la caractérisation fonctionnelle. Assistée par les propriétés redox de liaison disulfure isomérase DsbC, nous avons adapté notre pipeline de production de PTH pour l'expression de peptides oxydés, de venins fonctionnels dans le E. cytoplasme coli. Les protocoles sont également applicables à la production de protéines riches en disulfures diverses. Ici, nous démontrons notre pipeline appliqué à la production de protéines de venin animal. Avec les protocoles décrits dans ce document, il est probable que les protéines riches en disulfures solubles sont obtenus en moins d'une semaine. Même à petite échelle, il est possible d'utiliser ee purifié les protéines de validation de l'état d'oxydation par spectrométrie de masse, pour la caractérisation dans des études pilotes, ou de micro-dosages sensibles.
Introduction
Motivé par l'avancement de la génomique et accélération du taux de découverte de nouvelles protéines, les pipelines à haut débit ont été développés pour paralléliser les approches traditionnelles pour le dépistage et l'identification de stratégies optimales de production de protéines. Variables potentielles à être optimisés comprennent, mais ne sont pas limités à, des souches expression variant de 1,2, température de 3,4, 2,3 médias, cible 5 variantes, les partenaires de fusion 6-13, co-expression de chaperons 14,15, cytoplasmique ou expression 16-18, et tampons de purification composants périplasmiques 3. En mettant en œuvre des approches à haut débit, de nombreuses variables ou plusieurs cibles peuvent être testés en parallèle avec un haut niveau d'efficacité, tout en limitant la variation de lot à lot. Dans notre expérience, la stratégie donne également une bonne reproductibilité sur échelle à l'aide de la même culture (température, médias, aération, etc) et les conditions de purification (même résin, des tampons, etc). Plusieurs plates-formes à haut débit ont été utilisés dans la dernière décennie pour déterminer les conditions d'expression de la protéine soluble, notamment par le biais des paramètres variables tels que les partenaires de fusion, souches d'expression ou de la température 19-23.
Nous avons récemment utilisé notre approche de criblage à haut débit pour l'expression de protéines disulfure riche solubles 11. Les protéines sélectionnées ne sont pas seulement des sources venimeux, mais aussi inclus inhibiteurs de l'enzyme disulfure riche d'une grande variété d'espèces, y compris les plantes, les cochons, les vaches et les humains. L'expérience a comparé les effets des 12 partenaires de fusion différents et de trois souches différentes d'expression sur la solubilité et le pliage des 28 protéines disulfure-réticulé. Nous avons démontré que l'utilisation de DsbC comme un partenaire de fusion pour la production dans la souche BL21 (DE3) pLysS largement outproduced (à la fois le rendement et le nombre de protéines solubles obtenus) toute autre combinaison de tension et de fusion testé 11. Larésultats de cette expérience ont servi de base pour l'adaptation de notre pipeline originale général à haut débit (qui a été utilisé pour le criblage d'expression d'une large gamme de protéines) 22,24 dans une plus adapté pour l'expression des cibles riches en disulfures. protéines disulfure-riche à partir de venins d'animaux sont d'un intérêt particulier. Venins sont un mélange complexe de peptides et protéines bioactifs, avec une valeur potentielle de vue pharmacologique et thérapeutique. Cependant, l'expression de protéines disulfure contenant une liaison n'est pas anodin. Ces protéines contiennent généralement comprise entre une à sept liaisons disulfure, et doivent être oxydés avec les motifs de liaison par disulfure correctes afin d'être actives. Actuellement, la plate-forme est utilisée pour le criblage de l'expression d'un grand nombre de protéines de venin animal disulfure riches dans le cadre du projet européen FP7 VENOMICS (de www.venomics.eu) et l'étalonnage de nouveaux protocoles pour l'expression à haut débit de milliers de cibles . Ici, un procédé automatiséest prévu pour un débit élevé à petite échelle de dépistage de l'expression et la purification (voir la figure 1) appliquée à disulfure riche protéines de venin des animaux. La stratégie de disulfure peptides et des protéines riches utilise une HIS pour la purification et le partenaire de fusion à activité redox, DsbC, créant clivables fusions HIS-DsbC aux protéines cibles (voir la figure 2).
Bien que l'accent des protocoles est ici automatisation à l'aide d'une électrophorèse liquide de robot et HTP manutention, ces méthodes sont également appropriés pour une approche manuelle à haut débit, ce qui signifie que même les laboratoires avec une configuration de base peuvent profiter des protocoles sans aucune condition préalable pour un équipement coûteux . Protocoles manuels pour la transformation de purification et d'analyse (non spécifique aux protéines disulfure riches) ont été publiés ailleurs 24 et ne seront pas répétées ici. Le débit de la procédure manuelle (clone à partir de l'expression, produit par recombinaisonclonage nationale 25, à l'analyse des niveaux de protéines solubles) est de 96 (en utilisant la détection SDS-PAGE) ou 384 (4 x 96; aide de dot blot et SDS-PAGE 26) cultures par semaine (voir la figure 1). Ceci peut être augmentée si elle est effectuée d'une manière semi-automatique (à l'aide d'un robot de manipulation de liquide et dot blot ou 26 électrophorèse sur HTP, comme avec un système Étrier GXII LabChip 22 pour l'analyse des résultats) à jusqu'à 1152 (12 x 96) des cultures en parallèle sur une semaine, tels que décrits ici. La culture est réalisée en puits profond de 24 (DW24) de format ainsi que les incubateurs serrant réguliers peuvent être utilisés à la différence de cultures cultivé en puits profond de 96 (DW96) format, ce qui nécessite l'utilisation de courts orbitales incubateurs serrant à haute vitesse pour une aération suffisante (secouant à 800 rpm). L'utilisation des médias auto-induction 27 simplifie également l'expression, éliminant l'étape manuel d'induction. Même lorsque les laboratoires utilisent déjà l'expression et puri prédéfiniconditions de fication, ceux-ci peuvent être transférées directement dans ce système de HTP tout simplement pour améliorer l'efficacité. Un schéma détaillé du pipeline de criblage à haut débit pour des protéines disulfure riche est fourni à la figure 3. Les paramètres du pipeline ont été sélectionnés sur la base de nombreuses expériences de dépistage 11, 22, qui nous a permis de choisir les conditions les plus utiles pour la production de protéines.
Caractérisation peut être effectuée sur les protéines marquées purifiés directement à partir d'expressions à petite échelle dans les études pilotes où des dizaines de microgrammes d'échantillon est suffisant, ou pour les tests fonctionnels sensibles et les analyses de liaison (par exemple, les systèmes faible volume patch HTP de serrage 28). La même chose peut même être effectuée sur les cibles non marquées après clivage, à condition que le tag et la protéase sont supprimés (par exemple, par HPLC en phase inverse). contrôle de la qualité peut également être effectuée par spectrométrie de masse (à confirmer la taille attendue et l'oxydation stmangeaient) ou des méthodes chromatographiques (pour confirmer la pureté ou l'hétérogénéité) 29. Parfois marquer le clivage n'est pas nécessaire ou même souhaitable (notamment pour des protéines peu solubles 30,31), alors dans ce protocole clivage est facultative. Quoiqu'il en soit, dans toutes les constructions, il est une protéase site de clivage TEV (ENLYFQ / [G] 32) précédant directement le gène cible pour produire une protéine native après clivage (voir la figure 2 et discussion). Si le clivage de la balise de fusion est souhaitée, le clivage peut être testé (sur la fraction d'élution ou 'sur la colonne') à petite échelle pour analyser l'efficacité, optimiser les conditions si nécessaire et obtenir des estimations fiables de rendements pour les expériences à grande échelle qui en découlent.
Il ya deux options pour le volume de billes utilisées au cours de la purification par affinité, selon les objectifs et les attentes de l'expérience. Pour être en mesure de capturer autant de protéines que possible (pour purifier pour des essais pilotes ou MS, ou à Extrapolmangeait des rendements d'échelle-up) un volume final de 200 ul de résine doit être utilisée, ce qui permet la détection de la protéine soluble dans l'intervalle de 1 à 100 mg / L de culture avant la saturation du système (voir protocole (A) à la section 8.1) . Toutefois, si le but de l'expérience est la détection de faibles quantités de protéines solubles puis un volume final de 50 ul de résine est approprié, permettant la détection de la protéine soluble dans l'intervalle de 0,1 à 25 mg / L de culture (voir protocole (B ) à la section 8.2).
La production peut être élargi, si nécessaire, pour obtenir quelques milligrammes de cibles purifiées pour poursuivre des études structurelles et fonctionnelles en utilisant les conditions définies pour l'expression soluble. Les détails de protocoles échelle-up utilisés à AFMB ont été discutés ailleurs 22,24.
D'autres détails relatifs à l'installation expérimentale, les étapes critiques dans le protocole, les modifications et le dépannage et les limites de la technique sont fournis dans le disqueussion. S'il vous plaît lire la discussion avant de commencer les expériences.
Tout au long des protocoles que nous attendons un taux de 90% de réussite à chaque étape (par exemple, au moins 90% des cultures doit se développer à n'importe quelle étape donnée). Si le taux de n'importe quelle étape de l'expérience de succès tombe en dessous de 90%, les échantillons sont rejetés et l'expérience se répète pour la collection complète des constructions. Cependant, ce taux de réussite n'est pas applicable au nombre de constructions qui expriment des protéines solubles ou la proportion de constructions qui clivent avec 100% d'efficacité, car ce sera très dépendante des protéines testées.
Les détails spécifiques pour la mise en place de la table de travail du robot sont fournies pour chaque protocole (voir également la figure 4), mais ils peuvent être adaptés selon les besoins de la table de travail de remplacement set-ups. Le matériel de robot (Tecan) est constitué d'un bras 96-multicanal (MCA96), manipulateur robotisé (Roma) et la tête de manipulation de liquide à 8 canaux (LihA). Toutes les étapes en utilisant le MCA96 peuvent également être effectuées en utilisant le LihA si un MCA96 n'est pas disponible, mais ils prendront plus de temps parce que le LihA devra être lavé entre les étapes. Alors que le robot n'est pas techniquement un environnement stérile, l'inclusion d'antibiotiques assure qu'il n'y a généralement pas de problèmes de contamination ou de stérilité.
Protocole
Partie A: Transformation et expression de test
Procédures manuelles pour le clonage 22 et la transformation de purification sont discutés ailleurs 24. Le protocole de transformation peut être effectuée entièrement sur le robot 26, mais il est généralement plus efficace le temps de le faire manuellement. Par conséquent, les protocoles ici commencent à partir de l'inoculation des pré-cultures d'expression et placage de la transformation de la transformation choqué de chaleur mélange fait manuellement. Pour plus de détails sur les procédures manuelles de clonage et de transformation voir les références pertinentes 22,24.
1. Précultures et placage
- Préparer la table de travail du robot (voir la figure 4 pour les postes):
- Mettre une auge 300 ml contenant 150 ml de bouillon LB stérile (supplémenté avec de l'ampicilline (100 ug / ml) / Chloramphenicol (34 ug / ml), ou d'un autre antibiotique approprié) à la position 8.
- Mettez un DW stérile96 à la position 11. Mettez pré-établi à 24 puits LB agar 4x (Amp / Cam) des plaques de culture tissulaire (contenant 2 ml de gélose dans chaque puits) avec leurs couvercles sur des positions 14 à 17.
- Mettez la plaque de transformation (contenant la transformation 96 mélange après choc thermique) à la position 13. Ceci sera utilisé pour inoculer les pré-cultures liquides et des plaques de gélose LB. Mettez une boîte de pointes de pipette 200 ul stériles à la position 18.
- Utilisation du bras 96 multicanal (MCA96) et 200 conseils de pi, aspirer 200 pi de bouillon LB (position 8), et distribuer dans le DW96 à la position 11. Répétez jusqu'à ce que il ya un volume final de 1 ml de bouillon LB dans chaque puits de la DW96. Cela va devenir la préculture liquide.
- Utilisation du robot manipulateur (Roma), retirer le couvercle de la première de 24 puits plaque de gélose LB et placer ailleurs (par exemple dans un véhicule de l'hôtel) jusqu'à ce que le placage est terminé pour cette plaque.
- Utilisation de la manutention (LihA) tête liquide à 8 canaux, mélanger puis aspirer 50 pi de til la première colonne de mélange de transformation à la position 13. Ce volume de mélange de transformation est juste assez pour bien couvrir le LB-Agar.
- Avec les quatre premiers canaux, distribuer sur la première colonne de la première plaque de 24 puits de gélose LB en position 14 (comme représenté sur la figure 5).
- Avec les quatre derniers canaux, passer sur la deuxième colonne de la première plaque de 24 puits de gélose LB.
- Lavez tous les conseils soigneusement après la distribution.
- Continuez ce processus jusqu'à ce que toutes les transformations ont été plaqué sur la première plaque à la position 14, le transfert de 96 - à 24 puits en utilisant le schéma présenté à la figure 5.
- Une fois la première plaque a été terminé, utilisez les Roms pour remplacer le couvercle et retirez le couvercle de la plaque suivante à la position 15. Continuer à utiliser le système de dépôt pour les trois prochaines plaques.
- Une fois le placage est terminé, réglez le Te-Shake à 1200 rpm et agiter toutes les plaques pendant 1 min pour avoir une répartition homogène du mélange de transformation.
- Utilisation de la MCA96 et les embouts de pipette originaux, mélanger puis aspirer 60 pi de mélange de transformation restant (position 13) et distribuer dans le DW96 contenant du bouillon LB à la position 11.
- Sceller les pré-cultures DW96 avec un film adhésif respirant pour permettre l'aération de la culture.
- Placer dans un incubateur à 37 ° C sous agitation à vitesse maximale O / N (200/800 tours par minute selon agitation).
- Les plaques d'agar LB doivent être placés dans une hotte avec leurs couvercles off à sec (10 min). Ensuite, ils sont placés à l'envers dans un 37 ° C incubateur plaque jusqu'à ce que le lendemain matin.
- Le jour suivant, la préculture est utilisée pour ensemencer l'expression de test dans du milieu d'auto-induction et pour la préparation de solutions mères de glycerol. Mettez les plaques d'agar dans un réfrigérateur, comme un retour. En cas de besoin, à partir des plaques d'agar ou les stocks de glycérol, l'expression de test pourrait être refaite en inoculant une préculture LB frais directement.
2. Préparation de DW24 ZYP-5052 Plaques
NOTE: Cette procédure prend environ 5 minutes à remplir pour chaque jeu de plaques 4x DW24.
- Maquillage 500 ml ZYP-5052 moyenne auto-induction pour chaque répétition de 96 cultures (moyennes 464 ml ZY, 250 pi 2 M MgSO 4, 10 ml 50x 5052, 25 ml 20x NPS, dans cet ordre - les recettes pour chaque composant sont fourni dans le Tableau 1) complété avec les antibiotiques appropriés.
- Préparer la table de travail du robot:
- Mettez deux 300 ml creux, contenant chacune ~ 250 ml de milieu à la position 5 et 6. Mettez quatre plaques DW24 stériles à des positions 14 à 17. Mettez 200 conseils de pi à la position 18.
- Utilisation de la MCA96 et 200 conseils de pi, aspirer 200 pi de ZYP-5052 à partir de la position 5 et distribuer dans la première plaque de DW24 à la position 14. Pour ce faire, un total de 5 fois (4 Conseils distribuera dans un seul puits à la fois pour un total de 4 ml). Répétez l'opération pour les 3 plaques x DW24 restants à des positions 15 à 17, Switching à la ZYP-5052 à la position 6 pour les deux dernières DW24 plaques.
3. Inoculation et la croissance des cultures d'expression de test
NOTE: L'inoculation prend environ 10 min à remplir pour chaque jeu de plaques 4x DW24, et la croissance continue O / N.
- Préparer la table de travail du robot:
- Mettez la plaque de DW96 contenant les pré-cultures (de l'étape 1.15) en position 11. Mettez les quatre DW24 plaques contenant du milieu ZYP-5052 (de l'étape 2.3) à des positions 14 à 17.
- Utilisation de l'aspiration LihA 100 pi de préculture de la position 11 à inoculer les cultures d'expression de test (1/40 de dilution) en utilisant le schéma présenté à la figure 5. Lavez la tête LihA à fond à la station de lavage entre chaque colonne des pré-cultures de 96 puits.
- Sceller les plaques avec DW24 film respirant et incuber à 37 ° C sous agitation (200/400 rpm) pendant 4 heures. C'est le moment de la phase de croissance au cours de laquelle glucose du milieu sera préférentiellement épuisé 27.
- Réduire la température à 17 ° C. Après 4 h et épuisement du glucose, le lactose va commencer à être métabolisés, ce qui conduit à l'induction de l'expression, en fournissant des conditions de croissance optimales pour BL21 (DE3) pLysS ou 2 Rosetta (DE3) pLysS, dans ce travail 22. Laisser les cellules à exprimer O / N. Utilisez la préculture restant à faire des stocks de glycérol.
4. Préparation des stocks de glycérol
REMARQUE: les stocks de glycérol devraient être faits en triple pour être stockées dans différents endroits en cas de panne de congélateur.
- Préparer la table de travail du robot:
- Mettre des plaques de microtitration à la position 5 à 7 pour loger les stocks de glycerol. Mettez 300 ml bac rempli avec 50 ml de 100% de glycérol en position 8. Mettez un DW96 contenant 800 pi de préculture (après l'étape 3.2) dans chaque puits à la position 11. Mettez 200 conseils de pi à la position 18.
- L'utilisation d'un sloaspiration et la distribution de vitesse w, utilisez le MCA96 et 200 conseils de pi pour ajouter du glycérol dans le DW96 contenant les pré-cultures.
- Aspirer 200 ul de glycerol (à partir de la position 8).
- Distribuer 150 pl (en position 11), puis une pause de 20 secondes pour permettre à la glycérine restante pour atteindre la partie inférieure de la pointe. Répartir les 50 pi restants.
- En utilisant les mêmes conseils, mélanger la culture et de la glycérine dans la DW96 à la position 11 jusqu'à ce qu'ils soient bien mélangés. La concentration finale de glycérol est de 20%. Aspirer 140 ul de la DW96 et distribuer dans la première plaque de microtitration en position 5.
- Répéter l'étape 4.3 pour chaque plaque de microtitration restante (positions 6 et 7).
- Sceller chaque microplaque avec du ruban adhésif en plastique et conserver à -80 ° C. Jeter la culture restant dans le DW96, décontamination avec un agent antimicrobien avant élimination.
5. L'évaluation de la croissance des cultures
NOTE: Il n'est généralement pas nécessaire d'évaluer le taux de croissance final la DO finale 600 est généralement le même pour la plupart des cultures (environ 12 dans ces conditions), mais des cultures qui ne poussent pas à noter.
- Prenez 50 pi de chaque culture (de l'étape 3.4) et distribuer dans une plaque de microtitration clair à fond plat contenant 150 pi de milieu.
- Mesurer la DO 600, en tenant compte de la dilution d'un facteur 4. S'il y en a qui n'ont pas grandi très bien, notez ce pour l'analyse finale.
6. Récolte des cellules
NOTE: Cette procédure prend environ 45 minutes à compléter.
- Centrifuger les plaques 4x DW24 (de l'étape 3.4) à 3000 g pendant 10 min, puis jeter le surnageant dans un conteneur de déchets contenant un agent antimicrobien. Appuyez sur les plaques, à l'envers, sur du papier absorbant pour éliminer tout excès du milieu.
- Entre-temps, préparer 100 ml de lyseun tampon (50 mM de Tris, 300 mM NaCl, 10 mM d'imidazole pH 8, ou un autre tampon préféré) contenant du lysozyme (concentration finale de 0,25 mg / ml).
- Préparer la table de travail du robot:
- Mettez le tampon de lyse dans un bac de 300 ml à la position 5. Mettez un DW96 propre à la position 11. Mettez les 4 plaques de DW24 x contenant les culots cellulaires (de l'étape 6.1) dans des positions 14-17. Mettez 200 conseils de pi à la position 18.
- Utilisation de la MCA96 et 200 conseils de pi, aspirer 125 pi de tampon de lyse de la position 5 et distribuer dans chaque plaque DW24 (positions 14-17). Répétez. NOTE: 4 conseils vous distribuer dans un seul puits à la fois pour un volume final de 1 ml dans chaque puits des plaques DW24.
- Agiter les plaques à des positions 14-17 en utilisant le Te-Shake (1000 rpm) pendant 15 min à remettre en suspension les boulettes.
- Une fois que les pastilles sont remises en suspension, en utilisant les quatre premiers canaux de la LihA pour aspirer des échantillons de 550 ul de 1 à 4 (de la première colonne de la première DW24, en position 14), puis en utilisant la last 4 voies de la ponction LihA 550 pi d'échantillons de 5 à 8 (la deuxième colonne de la première DW24). Répartir dans la première rangée de la DW96 à la position 11.
- Répéter l'étape 6.6, de telle sorte que la totalité de la suspension cellulaire est transférée à la DW96.
- Après chaque série d'échantillons laver les conseils LihA dans la station de lavage.
- Répétez les étapes 6.6 à 6.8 pour chaque colonne de chaque plaque DW24 (positions 15-17) selon le schéma établi dans la Figure 5. Sceller avec du film plastique.
- Pour la purification, le même jour ou le gel à court terme, conserver à -80 ° C pendant un minimum de 1 heure, sinon stocker à -20 ° C.
Partie B: Purification et analyse
7. Lyse cellulaire
NOTE: Cette procédure prend environ 60 minutes à compléter.
- Décongeler les suspensions de cellules congelées (6,10) à partir de l'étape dans un bain d'eau (à la température ambiante ou 37 ° C) pendant environ 15 min et remettre en suspension dans l'incubateur agitateur pour un unSUPPLEMENTAIRES 10 min. Les cultures devraient devenir visqueux.
- Prenez 500 pi de DNase actions et mélanger avec 1 ml de MgSO 4 stock. Manuellement à l'aide d'une pipette à 8 canaux ou avec le robot LihA, dispenser 15 pi dans chaque puits de la DW96, pour donner une concentration finale de 10 pg / ml de DNase et 20 mM MgSO4.
- Re-sceller la plaque avec du ruban plastique et secouer pendant 15 min. A ce stade, les cultures doivent être non-visqueux. Vérifiez soigneusement (par examen visuel) que toutes les cultures ne sont plus visqueux. NOTE: Ceci est essentiel, si certaines cultures sont encore visqueux (par exemple, si la DNase a été accidentellement oubliée ou pas distribuée de façon appropriée dans certains puits), le filtre se bouche, générant une pression inégale sur les échantillons et le débordement ou le colmatage total de la plaque de filtre pourrait se produire au cours de la purification.
- Pour les échantillons de SDS-PAGE de l'ensemble du lysat cellulaire, aspiration 10 pi de lysat et distribuer dans une plaque de 96 puits PCR contenant10 ul de 4x tampon d'échantillon SDS-PAGE et 20 pi d'eau. Dénaturer pendant 3 min à 95 ° C et congeler jusqu'à l'analyse (fraction totale). Si un système d'électrophorèse HTP est disponible, les échantillons peuvent être analysés sur ce lieu suivant le protocole recommandé par le fabricant pour la préparation des échantillons. Pour plus de détails concernant l'analyse des échantillons voir la section 10.
8. Ni Affinity Purification
REMARQUE: Une vitesse d'aspiration lente devrait être utilisée pour le pipetage de toutes les suspensions de résine, comme les suspensions sont assez épais. Sur-séchage de la résine se traduira par une réduction de la capacité de liaison. Pour la purification, les concentrations d'imidazole spécifiées sont applicables à la résine d'affinité au nickel. Si des ions de substitution (par exemple, cobalt) sont utilisés, les concentrations doivent être ajustées en conséquence.
- A - Ni purification d'affinité pour la détection dans la gamme de 1 à 100 mg / L (volume de résine final = 200 ul)
NOTE: Tsa procédure de purification prend environ 1,5 heures à compléter, ce qui signifie que jusqu'à 4 peuvent être réalisées en une seule journée.- Préparer la table de travail du robot:
- Placer 300 ml de creux contenant un tampon de liaison (Tris 50 mM, 300 mM NaCl, 10 mM d'imidazole pH 8), un tampon de lavage (Tris 50 mM, 300 mM NaCl, 50 mM d'imidazole, pH 8) et du tampon d'élution (Tris 50 mM, 300 mM NaCl, 250 mM imidazole, pH 8) en positions 6 et 8, respectivement.
- Laisser un vide de 300 ml creux en position 5 pour la suspension de résine. À la position 9 et 10 détenteurs de la plaque de vente. À la position 10 mettre un DW96 avec le bloc de SPE et la plaque filtre / récepteur (20 mm) sur le dessus.
- Mettez le DW96 contenant le lysat (de l'étape 7.3) en position 14. A la position 18 et 19 mettre les 200 conseils de forage pi de large et 200 conseils de pi, respectivement. Mettez deux plaques DW96 de rechange pour le lavage et l'élution dans un hôtel. NOTE: Ils pourraient aussi être mis sur un autre site sur la table de travail si un hôtel est indisponible.
- Préparer 105ml de suspension équilibrée de 33% de résine (35 ml de résine + 70 ml de tampon de liaison). Ajouter la suspension de résine à l'auge à la position 5 immédiatement avant de commencer la procédure.
- Utilisation de la MCA96 et 200 conseils d'alésage pi de large (position 18), mélanger la pâte de résine à la position 5 à fond avant d'aspirer et de distribution de 200 pi de suspension de résine dans le DW96 contenant le lysat à la position 14. Répétez deux fois pour que 600 pl de suspension de résine a été ajouté au lysat, le mélange de la suspension de résine avant chaque aspiration.
- Effectuer une étape de mélange de 10 min en utilisant le MCA96 en position 14 pour permettre la liaison et d'empêcher la résine de granulation.
- Aspirer à partir de la position 14 et se dispenser 800 pi (200 pi dans les lots) sur la plaque de filtre en position 9, le mélange avant chaque aspiration sinon la résine sera retenu au fond de la DW96.
- Tourner le vide sur la position 10 à environ 90 secondes pour filtrer le lysat travers la plaque dans l'DW96 à recueillir le flux continu, en prenant soin de ne pas sécher la résine. Tournez le vide hors tension.
- Répéter les étapes 8.1.5 et 8.1.6 de sorte que la totalité de la résine est alors dans la plaque de filtration.
- Utilisation du bras RoMa déplacer le bloc de SPE tenant la plaque de filtre à partir de la position 10 à la position 9 de sorte que l'étape de lavage suivante va directement à la déchets et transférer le DW96 contenant le flux continu à la position 10 à un autre site (par exemple, dans un hôtel transporteur) jusqu'à la fin de la procédure.
- Avec une nouvelle série de 200 conseils de pi (position 19), laver la résine (en position 9) avec un total de 800 pi de tampon de liaison (de la position 6), et d'appliquer le vide à la position 9 jusqu'à ce que le tampon a traversé . Répéter une fois de plus.
- Utilisez le bras RoMa de placer une nouvelle DW96 en position 10 pour recueillir le lavage de 50 mM d'imidazole et déplacer le bloc de SPE et de la plaque de filtre de retour au sommet (poste 10).
- Ajouter 800 ul de tampon de lavage de la position 7 sur la position 10, tourner lavide jusqu'à ce que le tampon est passé à travers. Éteignez la vide.
- Avec la ROMA, retirer le bloc de SPE et de la plaque de filtre à la position 9 et la DW96 contenant l'échantillon de lavage à l'hôtel, et garder de côté jusqu'à la fin de la procédure.
- Laver la résine avec encore 800 ul de tampon de lavage (de la position 7 sur la position 9), appliquer le vide jusqu'à ce que le tampon est passé à travers. Répéter une fois de plus.
- Utilisez les Roms de placer une nouvelle DW96 en position 10 et placez le bloc de SPE et de la plaque de filtre de retour au sommet de recueillir l'élution.
- Ajouter un total de 500 ul de tampon d'élution (de la position 8 sur la position 9) et incuber in situ pendant 3 min. Allumez le vide jusqu'à ce que tout tampon a traversé.
- Facultatif: Pour très exprimant des protéines, une seconde élution peut être réalisée dans une nouvelle DW96 comme dans les étapes 8.1.14 et 8.1.15.
- Prélever des échantillons de l'écoulement, laver et élution / s pour SDS-PAGE ou électrophorèse HTP.
- Pour les échantillons SDS-PAGE de l'écoulement, dispense 10 pi dans une plaque de 96 puits PCR contenant 10 pi de 4X tampon d'échantillon SDS-PAGE et 20 pi d'eau. Pour les échantillons de SDS-PAGE du lavage et l'élution / s dispenser 30 pi dans des plaques de PCR contenant 10 ul de 4x tampon d'échantillon SDS-PAGE. Dénaturer pendant 3 min à 95 ° C et congeler jusqu'à l'analyse.
- Pour les échantillons d'électrophorèse HTP, suivez les instructions du fabricant. Pour plus de détails concernant l'analyse des échantillons voir la section 10.
- Préparer la table de travail du robot:
- B - Ni purification d'affinité pour la détection dans la gamme de 0,1 à 25 mg / L (volume de résine final = 50 pi)
NOTE: Cette procédure de purification prend environ 30 minutes à compléter, ce qui signifie que jusqu'à 12 peut être réalisée en une seule journée.- Préparer la table de travail du robot:
- Placer 300 ml de tampon de liaison contenant des auges (50 mM de Tris, 300 mM NaCl, 10 mM d'imidazole pH 8), le tampon de lavage (Tris 50 mM, 300 mM NaCl, 50 mM d'imidazole pH 8)et un tampon d'élution (50 mM de Tris, 300 mM NaCl, 250 mM imidazole, pH 8) en positions 6 et 8, respectivement.
- Laisser un vide de 300 ml creux en position 5 pour la suspension de résine. À la position 9 et 10 détenteurs de la plaque de vente. À la position 10 mettre un DW96 avec le bloc de SPE et la plaque filtre / récepteur (20 mm) sur le dessus.
- Mettez le DW96 contenant le lysat (de l'étape 7.3) en position 14. A la position 18 et 19 mis 200 pi conseils de grand calibre et 200 conseils de pi, respectivement. Mettez une plaque de microtitration de 96 puits de secours pour l'élution dans un hôtel. NOTE: Ce pourrait également être mis sur un autre site sur la table de travail si un hôtel est indisponible.
- Préparer 50 ml de suspension équilibrée de 25% de résine (12,5 ml de résine + 37,5 ml de tampon de liaison). Ajouter la suspension de résine à l'auge à la position 5 immédiatement avant de commencer la procédure.
- Utilisation de la MCA96 et 200 conseils d'alésage pi de large (position 18), mélanger la pâte de résine à la position 5 à fond avant d'aspirer et DispeNsing 200 ul de suspension de résine dans le DW96 contenant le lysat à la position 14.
- Incuber à température ambiante sous agitation à l'aide du Te-Shake à 1400 rpm pendant 10 min pour permettre la liaison.
- Aspirer à partir de la position 14 et se dispenser de la pleine 1,200 pi (dans 200 ul lots) en utilisant la pointe d'alésage large (position 18) sur la plaque de filtre en position 10. Mélanger avant chaque aspiration sinon la résine sera retenu au fond de la DW96.
- Tournez le vide à la position 10 sur environ 30 secondes pour filtrer le lysat à travers la plaque dans le DW96 pour recueillir le flux continu, en prenant soin de ne pas sécher la résine. Tournez le vide hors tension.
- Utilisation du bras Roma, déplacer le bloc de SPE à maintenir la plaque de filtre de la position 10 à la position 9 de sorte que l'étape de lavage suivant va directement aux déchets et transférer le DW96 contenant le flux continu à la position 10 à un autre site (par exemple, dans un support d'hôtel) jusqu'à la fin de la procédure.
- Avec les 200 μl Les pointes (19) en position, lavage de la résine (en position 9) avec un total de 800 ul de tampon de liaison (de la position 6), et d'appliquer le vide à la position 9 jusqu'à ce que le tampon est passé à travers. Répétez.
- Utilisez le bras RoMa de placer le DW96 frais à la position 10 pour recueillir le lavage de 50 mM d'imidazole et déplacer le bloc de SPE et de la plaque de filtre de retour au sommet (poste 10).
- Ajouter 150 ul de tampon de lavage à partir de la position 7 sur la position 10, tourner le vide jusqu'à ce que le tampon est passé à travers. Éteignez la vide.
- Avec la ROMA retirer le bloc de SPE et de la plaque de filtre à la position 9 et la DW96 contenant l'échantillon de lavage à l'hôtel, et garder de côté jusqu'à la fin de la procédure.
- Laver la résine avec encore 800 ul de tampon de lavage (de la position 7 sur la position 9), appliquer le vide jusqu'à ce que le tampon est passé à travers. Répétez.
- Utilisez les Roms de placer la microplaque à la position 9 et placez le bloc de SPE et de la plaque de filtre de retour au sommet de recueillir èmee élution.
- Ajouter 190 pi de tampon d'élution (de la position 8 sur la position 9) et incuber in situ pendant 3 min. Appliquer le vide jusqu'à ce que tout tampon a traversé.
- Prélever des échantillons de l'écoulement, lavage et élution pour SDS-PAGE ou électrophorèse HTP.
- Pour les échantillons de SDS-PAGE de l'écoulement, distribuer 10 ul dans une plaque de 96 puits PCR contenant 10 pi de 4X tampon d'échantillon SDS-PAGE et 20 pi d'eau. Pour les échantillons de SDS-PAGE du lavage et l'élution / s dispenser 30 pi dans des plaques de PCR contenant 10 ul de 4x tampon d'échantillon SDS-PAGE. Dénaturer pendant 3 min à 95 ° C et congeler jusqu'à l'analyse.
- Pour les échantillons d'électrophorèse HTP, suivez les instructions du fabricant. Pour plus de détails concernant l'analyse des échantillons voir la section 10.
- Préparer la table de travail du robot:
9. Décolleté Tag (Facultatif)
- Ajouter la protease TEV (2 mg / ml) de la protéine éluée (de l'étape 08.01.15 (et 8.1,16) ou de l'étape 2.8.14) dans un rapport de 1/10 (v / v).
- Incuber à température ambiante (ou à 4 ° C pour des protéines sensibles à la température) O / N avec agitation douce.
- A la fin du clivage distribuer 30 ul dans une plaque PCR contenant 10 pi de 4x tampon d'échantillon SDS-PAGE ou suivre les instructions du fabricant pour les échantillons d'électrophorèse HTP.
- Filtrer le mélange de clivage restant (de l'étape 9.2) par l'intermédiaire d'un 96 puits de 0,22 um plaque de filtration et de recueillir l'écoulement continu soluble dans un DW96 en appliquant le vide. Cela peut être fait à l'un des sites de vide (par exemple, la position 10) sur le robot de manipulation de liquide, comme pour les étapes d'élution dans les sections 8.1 et 8.2. Cela supprime toute protéine qui précipite lors du clivage.
- Après filtration, distribuer 30 ul dans une plaque PCR contenant 10 pi de 4x tampon d'échantillon SDS-PAGE ou préparer que des échantillons d'électrophorèse HTP. Ceci permet la comparaison de la protéine avant un clivage, le mélange après le clivage et le solprotéine uble restant après clivage et donne de bonnes indications sur les résultats attendus dans les expériences à grande échelle qui en découlent. Pour plus de détails concernant l'analyse des échantillons voir la section 10.
10. Analyse des résultats
- Identifier les constructions exprimant la protéine soluble par l'analyse des échantillons de la purification par électrophorèse en SDS-PAGE, transfert en point ou d'un système d'électrophorèse sur HTP tel que l'étrier LabChip.
- Analyser les échantillons d'élution premier à identifier des structures de production de protéines solubles. Dans la plupart des cas, seuls les échantillons d'élution sont analysées si les constructions solubles sont identifiés, afin de minimiser le temps consacré à l'analyse.
- Si la protéine n'est pas dans l'élution, exécuter les échantillons de lavage et accréditives pour voir si elle a été exprimée et ne se lie pas correctement à la résine.
- Pour des constructions où aucune protéine soluble peut être détectée toute la course lysat de cellules pour voir si la protéine a été exprimée.
REMARQUE: Une limitation ici est que si le protein d'intérêt n'est pas présente les niveaux d'expression de fond ci-dessus, il peut ne pas être possible de voir la protéine et pourrait conduire à un faux négatif. Il est à noter qu'il est toujours possible pour des protéines à coller et précipitent sur la résine d'affinité, ce qui pourrait conduire à un faux négatif ou une sous-estimation du rendement en utilisant le protocole recommandé (un événement rare dans cet ouvrage). Dans le cas où la protéine précipite par élution (un culot blanc est visible une minute quelques / heure après élution), il est recommandé de modifier la composition de la mémoire tampon (par exemple, concentration en sel) et / ou d'effectuer un test à balayage différentiel de la fluorimétrie à optimiser l' des tampons. Un petit échantillon de la résine peut également être remis en suspension dans du tampon d'échantillon SDS-PAGE et on fait bouillir pour détecter si une protéine est retenue sur la résine. - Si la protéine n'est pas exprimée, mais les cellules ne se développer, poursuivre une nouvelle stratégie d'expression, ou si la DO 600 n'était pas assez élevé repousser et réanalyser la culture. >
- Si les échantillons de clivage doivent être analysés, ils doivent être analysés d'une manière côte à côte, de sorte que chaque produit d'assemblage peut être établi avant un clivage après le clivage dans des voies adjacentes, afin de simplifier l'analyse.
- A moins d'utiliser un procédé qui donne une quantification directe de la concentration d'élution, la quantification doit être effectuée pour les échantillons positifs par mesure de l'absorbance à 280 nm (A280).
- Mesurer la A280, en prenant le coefficient d'extinction de la protéine en compte et en utilisant le tampon d'élution comme une ébauche, pour fournir une estimation de rendement en protéines dans le but d'identifier les produits d'assemblage exprimant solubles plus élevées.
- Pour la comparaison des rendements plus fiable solubles, il est recommandé de normaliser les rendements par la densité de la culture (en utilisant la mesure de la DO 600), qui a été prise à la section 5. Si toutes les cultures ont atteint à peu près la même densité, la normalisation n'est pas requise.
- Les échantillons peuvent être analysés directement à partir de l'élution ou de l'échantillon de clivage par spectrométrie de masse-chromatographie en phase liquide (LC / MS).
- Sinon, dessaler premier (pour éliminer l'imidazole et des sels tampons qui peuvent être présents) à l'aide des embouts de pipette ZipTip ou des méthodes de chromatographie en phase liquide, puis analyser par désorption laser assistée par matrice / ionisation temps de vol (MALDI-TOF) ou ionisation par électrospray ( ESI) spectrométrie de masse.
- Études fonctionnelles à petite échelle peuvent être réalisés pour vérifier si la fonction de la protéine est comme prévu. Si de grandes quantités sont nécessaires pour la fonction, une culture de mise à l'échelle peut être faite et la fonction testée à partir de la culture plus grande taille et une fois l'état d'oxydation ont été confirmés à petite échelle.
Résultats
Les résultats représentatifs sont présentés dans la figure 6 pour le criblage de l'expression de 96 disulfure riche protéines du pipeline de VENOMICS. Les protéines sont disposées par l'augmentation du nombre de liaisons disulfure alors l'augmentation du nombre de résidus. Les peptides ont été exprimées dans le cytoplasme d'une HIS et DsbC partenaire de fusion. Lors de l'utilisation des conditions de culture recommandées, une DO600 de 12 est normalement réalisée. Les peptides ont été purifiés en utilisant le protocole 8.2-B avec un volume final de 50 ul de résine d'affinité de nickel, donc un maximum de protéine ~ 25 mg / L de fusion ont pu être détectés dans cette expérience.
La figure 6A montre le résultat de l'électrophorèse du système Étrier LabChip (montrant la fusion avant de clivage) et le système de notation sur la base de l'extrapolation pour donner en mg / L de culture de la protéine de fusion (à des niveaux de 0,1 à 2 mg / L de culture, de 2 à 10 mg / L de culture, de 10 à 25 mg / L de culture et pas t détectée.) Notez que la balise DsbC clivé fonctionne normalement à environ 32 kDa, plutôt que de 27 kDa comme prévu. De même, les fusions DsbC courent aussi autour de 5 kDa plus élevés que prévu. Pour beaucoup des objectifs que nous nous voyons non seulement la fusion intacte (bande supérieure), mais aussi le partenaire de fusion seul (bande inférieure). Pour certains de ces objectifs l'optimisation des conditions de culture peut améliorer le rapport de la fusion intacte (bande supérieure) par rapport à DsbC seul permettant une augmentation du rendement final. La notation est basée seulement sur le plan de fusion intacte. Protéines seulement 16 sur 96 n'ont pas pu être détectées au niveau de la fusion. Cela correspond à un taux de réussite global de 83%. Parmi les 80 protéines qui pourraient être détectés, 45 d'entre eux ont été détectés à des niveaux supérieurs à 2 mg / L la culture (56%). En fonction de la cible et de la fusion, les rendements en protéines sont généralement dans la gamme de 2 à 100 mg / L de culture (bien que dans cet exemple en utilisant le protocole 8.2 B un maximum de protéine ~ 25 mg / L de fusion peut être détecté).
t "> Une analyse de la réussite par le nombre de liaisons disulfures présents (voir figure 6B) montre un succès raisonnable pour tous les numéros de liaisons disulfures testés (entre 1 et 7), avec le niveau de réussite plus faible étant de 66% pour les cibles contenant 6 disulfure liaisons. Une analyse de la distribution de la réussite de l'expression basée sur le point isoélectrique et le nombre de résidus (représenté sur la figure 6C) montre pas de biais particulier pour la technique, à la fois les cibles et les cibles qui n'ont pas été détectés dispersés à travers le terrain exprimées avec succès.La figure 6D montre un exemple des résultats de spectrométrie de masse obtenus à partir de spectrométrie de masse par ionisation (ESI-MS) pour une seule cible, avant et après réduction de l'échantillon avec le DTT. Normalement, une telle analyse par spectrométrie de masse exhaustive n'aurait pas besoin d'être effectué (un échantillon réduit ne doit pas être analysé), mais pour les fins de demonstratio approfondien nous avons montré les deux résultats. L'objectif affiché est de 5,7 kDa disulfure protéine riche de venin avec 4 ponts disulfures. Le spectre de gauche montre les résultats pour la protéine avant la réduction de la TNT, comme il était après clivage et de dessalage sans autre intervention. Le spectre sur la droite montre la protéine après réduction avec TNT suivie par dessalage pour éliminer tout excès de DTT. Les ions correspondant aux masses expérimentales sont marqués par des flèches sur le spectre et la désignation pour chaque ion est représenté en vert. Les masses de parents expérimentaux calculés pour ces ions (pour la protéine avant la réduction (TNT) et après réduction (+ TNT)) sont présentés dans le tableau. Les masses (5709,6 Da pour l'échantillon avant la réduction et de 5717,6 Da pour l'échantillon réduit) présentent une différence de masse de 8 Da. A la différence de masse de 2 Da correspond à la présence d'une liaison disulfure oxydé, donc une différence de masse de 8 Da indique la présence de quatre liaisons disulfure (comme prévu) dansl'échantillon non réduit.

Figure 1. Représentation schématique du protocole de dépistage de l'expression à haut débit. L'utilisation de ce protocole, 96-384 conditions peuvent être testés par une seule personne en une semaine en utilisant des méthodes manuelles, ou jusqu'à 1152 conditions avec l'équipement semi-automatique décrite. Les plasmides d'expression sont construits en utilisant une technologie de clonage de recombinaison de telle sorte que de nombreuses cibles peuvent être sous-clonés en une seule fois. Conditions d'expression Une fois solubles ont été identifiés et le clivage effectué, si vous le souhaitez, la protéine peuvent procéder à un contrôle de qualité pour vérifier l'oxydation et de la pureté, microassays et / ou la production à grande échelle.
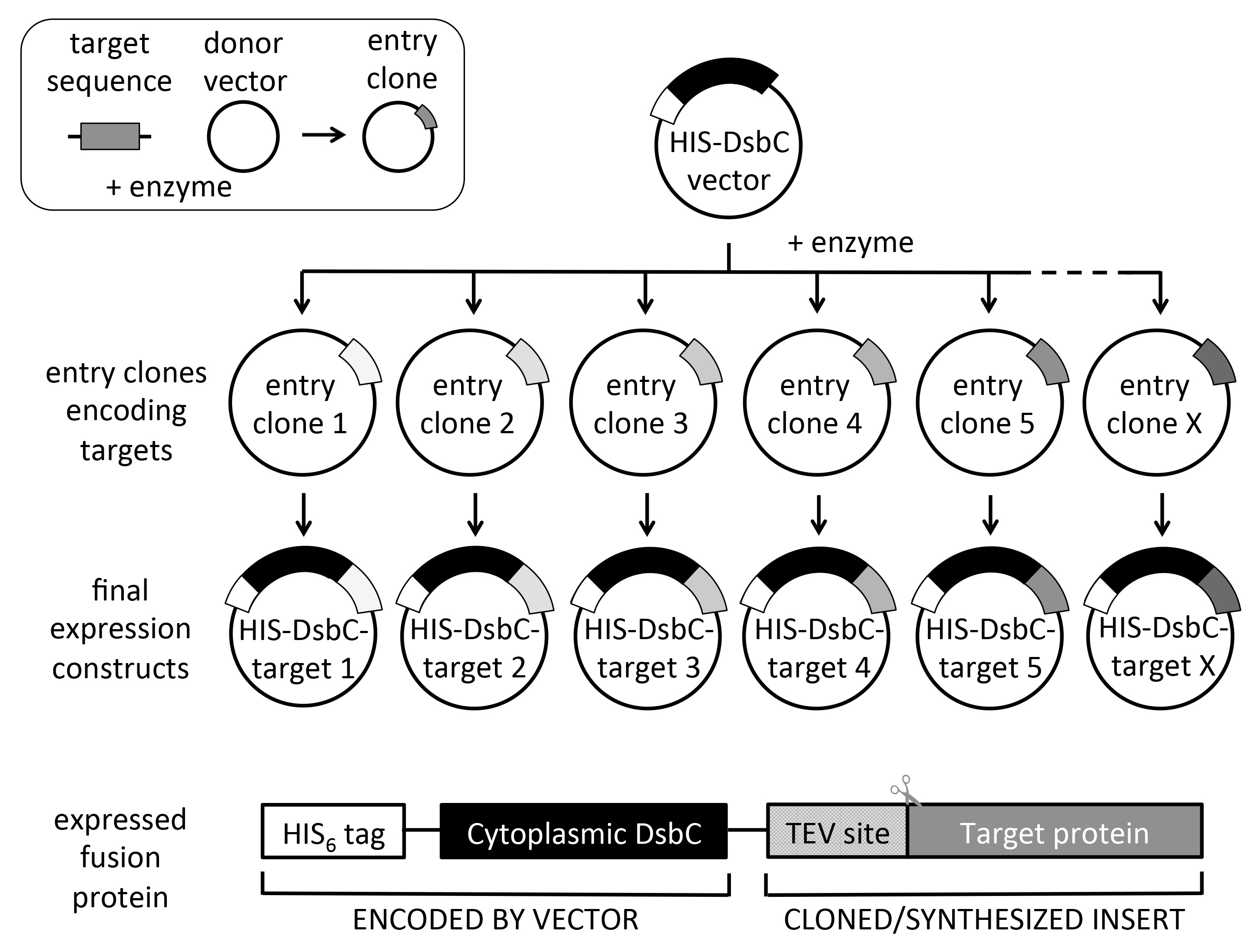
Figure 2. Schéma de clonage par recombinaison universel et construire conception. Partir de l'entrée clones cibles, plusieurs vecteurs d'expression peuvent être sous-clonés dans une expérience unique dans un mode à haut débit (jusqu'à 6 x 96 clones d'entrée en une semaine). La protéine exprimée code pour un mot-clé pour le nickel purification d'affinité SA. Le DsbC (dépourvu de sa séquence signal périplasmique pour l'expression cytoplasmique) partenaire de fusion est utilisé pour augmenter la solubilité et / ou des aides de pliage et de l'oxydation correcte de la protéine cible. A noter que la séquence codant pour la cible doit contenir une protéase TEV site N-terminal (ENLYFQ) si tag clivage est souhaitée. L'encart en haut à gauche montre la production de clones d'entrée en utilisant un vecteur donneur et les séquences cibles, qui peut être obtenu par PCR ou par synthèse de gènes. clones d'entrée peuvent également être obtenus à partir de collections de clones d'entrée commerciaux. Systèmes de clonage de recombinaison multiples sont disponibles, mais nous utilisons le syste passerellem, comme représenté sur le schéma.

Pipeline de dépistage Figure 3. Haut débit pour objectifs de disulfure riche multiples. Cibles sont d'abord exprimé sous forme de fusions-SA DsbC dans le cytoplasme des cellules BL21 (DE3) pLysS E. coli à 37/17 ° C en utilisant un milieu auto-induction (ZYP-5052). La purification est effectuée sur une résine de nickel suivie d'une détection des constructions solubles par électrophorèse HTP (ou avec dot blot / SDS-PAGE). Si le premier tour de dépistage de l'expression échoue, les conditions de culture alternatifs sont jugés. Si les constructions produisent des protéines solubles des rendements suffisamment élevés, microassays et contrôle de la qualité peut être effectuée et, si nécessaire, la production à grande échelle peut être poursuivi. Pour les cibles où les rendements solubles ne sont pas suffisamment élevé, le dépistage d'expression peut continuer stra alternatifins et des températures puis des autres partenaires de fusion et expression périplasmique. Les étapes optionnelles sont indiquées par des cadres en pointillés.

Figure 4. Configuration Robot Table de travail pour la plate-forme de HTP. L'aménagement de notre liquide manipulation robot de table de travail est représenté, bien que les tables de travail alternatifs peuvent également être utilisées, à condition qu'il existe des sites équivalents disponibles. L'installation se compose d'une station de lavage (WS) pour le (tête 8 canaux manipulation de liquides (LihA)), deux supports de microplaques avec 4 positions chacun (MP4, les positions 1-4 et 5-8), une station de vide à 2 positions (Te-aspirateurs, les positions 9 et 10), un support de microplaque à 3 positions (MP3, les positions 11-13), deux shakers plaque avec 2 positions chacune (Te-Shakers, les positions 14-15 et 16-17) et un support pour embouts jetables avec 3 positions (diti, les positions 18-20). En outre, l're sont deux transporteurs de l'hôtel pour les plaques à puits profonds et un pour microplaques (non représenté). Le matériel installé sur le robot de manipulation liquide est un bras de 96 multicanal (MCA96) pour une utilisation avec des embouts jetables, une tête 8 canaux manipulation de liquides (LihA) avec des pointes fixes et un robot manipulateur (Roma) qui se déplace plaques / équipements autour de la table de travail. La numérotation des positions est désignée dans l'ensemble du protocole.

Figure 5. Schéma pour le transfert à partir d'une plaque à 96 puits unique en quatre plaques à 24 puits.

Figure 6. Résultats représentatifs sont présentés pour l'écran de l'expression de 96 disulfure riche venin proprotéines. Les protéines ont été exprimées sous forme de fusions-SA DsbC dans le cytoplasme et purifiés en utilisant 50 pi de résine de nickel (protocole 8.2-B). A) Expression résultats du dépistage, montrant gel virtuel et de notation pour le rendement d'expression. Le contraste dans le gel virtuel a été ajusté voie-à-voie afin de compenser pour des bandes très faibles ou intenses. A noter que pour certains objectifs deux bandes sont visibles, la bande supérieure correspond à la protéine de fusion intacte et la bande inférieure correspondant à l'étiquette de fusion seul. B), la proportion de protéines exprimées à chaque niveau d'expression par rapport au nombre de liaisons disulfure dans la protéine. Le nombre réel de protéines dans chaque groupe est superposée sur le graphique. C) La distribution des niveaux d'expression basée sur le point isoélectrique (pI) et le nombre de résidus. D) Un exemple des résultats de spectrométrie de masse pour un disulfure riche venin 5,7 kDa protéine avec 4 liaisons disulfure. Le spectre surle côté gauche montre la protéine avant la réduction de la TNT et le spectre sur le côté droit montre la protéine réduite avec la TNT, puis dessalé. Les ions correspondant aux masses expérimentales sont marqués par des flèches et leurs missions sont indiquées en vert. Les masses expérimentales pour la protéine avant réduction et après réduction sont indiquées dans le tableau et présentent une différence de masse de 8 Da, correspondant à la présence de la protéine oxydée avant l'addition de l'agent réducteur. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure .
| Composant | Recette | Commentaire |
| ZY | ~ 928 ml 10 g de tryptone 5 g d'extrait de levure 925 ml d'eau | Mélanger puis autoclave pour stériliser. |
| 2 M MgSO 4 | 100 ml 49,3 g MgSO 4 · 7H 2 O ~ 60 ml d'eau | Remuer jusqu'à dissolution puis autoclave pour stériliser. |
| 50x 5052 | 1 L 250 g de glycérol 730 ml d'eau 25 g de glucose 100 g de α-lactose | Ajouter dans l'ordre, remuer sur feu jusqu'à ce que tous dissous alors autoclave pour stériliser. |
| 20x NPS | 1 L 900 ml d'eau 66 g (NH 4) 2 SO 4 136 g de KH 2 PO 4 142 g Na 2 HPO 4 | Ajouter dans l'ordre et remuer jusqu'à ce que tous dissous alors autoclave pour stériliser. |
Tableau 1. Recette pour les composants de milieu ZYP-5052.
Discussion
Il n'existe pas de protocole universel unique pour l'expression de protéines fonctionnelles, solubles, plié. Pour être le coût en temps et en efficacité, la plupart des laboratoires ou des protéines installations de base de travail avec plusieurs cibles utilisent donc une expression élevée de la protéine de débit de dépistage pour trouver la meilleure combinaison «générique» de variables pour obtenir une protéine active soluble pour la majorité des cibles. Nous avons identifié DsbC comme étant un partenaire de fusion généralement applicable pour l'expression soluble de peptides et de protéines 11 disulfure riche. En utilisant des fusions DsbC et méthodes à haut débit, dans une semaine l'expression soluble de cibles multiples peut être observée 11 et d'autres variables, telles que celles décrites dans l'introduction, peut être projeté dans les rondes subséquentes sur ces objectifs qui nécessitent une optimisation plus poussée. Les protocoles décrits ici sont destinés à l'expression des protéines et des peptides disulfure riche. Cependant, pour les utilisateurs qui souhaitent expprotéines non réticulées ress de manière à haut débit, les protocoles correspondants ont déjà été publiés et peuvent être trouvés ailleurs 22,24.
La configuration à haut débit est idéale pour de nombreuses applications, y compris la projection d'un grand nombre de protéines différentes pour l'expression soluble ou la projection d'un grand nombre de constructions d'expression (y compris les balises différentes de fusion) pour plusieurs gènes cibles en même temps ( ou l'expression multiple construit pour une seule cible) afin d'améliorer les taux de réussite. La plate-forme peut également être utilisée pour l'étalonnage et la validation de nouveaux protocoles sur un grand nombre de cibles. D'autres applications incluent le dépistage de variantes pour une seule cible difficile, par exemple, tous les orthologues ou des membres d'une même famille, ou pour tester le succès de la production d'un panel de mutants d'une seule cible dans une expérience. Ce protocole a également été utilisée en combinaison avec des vecteurs co-expression (with une protéine marquée seulement) pour permettre à la tirer vers le bas et la caractérisation préliminaire de complexes protéine-protéine suivie d'une analyse plus approfondie biophysique pour confirmer la formation d'un complexe de rectification et de stoechiométrie 33. La quantité de protéine purifiée est parfois approprié pour micro-essais (essais de fonctionnement, protéine-ADN 34 protéine-protéine ou des dosages d'interaction). Il existe plusieurs avantages à la stratégie de dépistage d'expression à haut débit: (i) la possibilité de tester un grand nombre de cibles ou d'un grand nombre de variables dans une expérience unique, (ii) variation limitée de lot à lot, (iii) l' simplicité et la facilité de travailler à une plus petite échelle en utilisant des puits profonds, (iv) l'évolutivité et la reproductibilité à plus grande échelle, (v) le potentiel de l'automatisation, et (vi) la simplicité de suivi et de manutention (aucun étiquetage des tubes individuels, moins des erreurs introduites lors de l'utilisation du format de plaque que de la manipulation des tubes individuels dans le mélange ou l'échange des clones).
Même s'il n'est pas mentionné dans la section de protocole, il ya plusieurs considérations importantes pour la préparation de l'expérience qui sera brièvement ci-dessous. Pour une discussion plus approfondie s'il vous plaît voir notre publication précédente 24. Pour une efficacité maximale, il est avantageux d'avoir un système adapté à haut débit clonage, de simplifier le sous-clonage d'un grand nombre de cibles. Pour la phase initiale du projet VENOMICS, nous utilisons le système polyvalent de recombinaison passerelle 25 qui permet le sous-clonage dans un vecteur quelconque de destination à un rythme de centaines de clones par semaine. Protocoles pour Gateway recombinaison clonage peuvent être trouvés sur le site Invitrogen. D'autres solutions de rechange pour haut débit clonage comprennent ligature clonage indépendant (LIC) 35,36 et libre de restriction (RF) de clonage 37. Il ya plusieurs façons d'obtenir des gènes cibles d'expression, y compris par PCR de l'ADN matrice, de collections de clones d'entrée ou quegènes synthétiques, ce qui est la stratégie choisie pour le projet VENOMICS. Des gènes synthétiques peuvent être commandés avec des sites de recombinaison à chaque extrémité de la synthèse de gène et le gène permet une optimisation des codons facile de la séquence du gène cible (pour exclure les codons rares de E. coli). Ceci est recommandé mais pas indispensable. Pour les cibles sans optimisation des codons qui contiennent un grand nombre de codons rares, Rosetta 2 (DE3) pLysS (qui porte ARNt pour les codons rares qui ne sont pas fortement exprimés dans E. coli) peuvent être mieux que BL21 (DE3) pLysS. Bien qu'il existe des souches disponibles qui limitent la réduction des liaisons disulfures dans l'environnement en réduisant normalement du cytoplasme, dans nos mains, ils n'ont pas eu le succès régulier E. 11 souches de coli.Purification par affinité à l'échelle analytique est réalisée à partir des cultures d'expression de test, afin de récupérer les protéines de fusion solubles et quantifier les rendements. Les données quantitatives peuvent être obtenus sur ee rendements solubles de protéines de fusion exprimées dans un intervalle de 0,1 à 100 mg / L de culture. Si une cible n'est pas soluble, les températures alternatives d'expression et d'initiation, des souches ou des médias peuvent être testés avant différents partenaires de fusion sont poursuivis. Pour l'expression soluble de protéines disulfure riche, nous nous sommes classés précédemment l'effet de partenaires de fusion comme DsbC> DsbA> TPS> MBP> TRX> HIS pour l'expression cytoplasmique 11. Expression périplasmique est une autre possibilité qui pourrait aider le pliage succès des objectifs de disulfure riche. Le périplasme est un environnement réducteur inférieur et le cytoplasme contient des chaperons redox utiles pour faciliter une liaison disulfure. DsbC, DsbA, et des protéines MBP sont habituellement localisées dans le périplasme par leurs séquences de signaux périplasmiques. Cela offre la possibilité d'exploiter ces balises pour orienter les objectifs de disulfure riche à l'espace périplasmique afin d'aider pliage. Pour les cibles difficiles, la prochaine étape serait de purify la cible HIS-étiqueté insoluble de corps d'inclusion, solubiliser et replier (cela est hors de la portée de ce protocole et ne sera pas discutée ici 3 9). Cela peut être assez simple pour des cibles avec seulement un ou deux ponts disulfures, mais devient de plus en plus difficile que le nombre de liaisons disulfure augmente. En variante, et en particulier pour les protéines et les peptides ayant au moins quatre liaisons disulfure, il peut être intéressant d'essayer les systèmes de production plus complexes telles que la levure, d'insecte ou de mammifère expression.
Avec les progrès de la miniaturisation et de l'automatisation, HTP électrophysiologie laboratoire sur une puce technologies 28 sera sans aucun doute la voie de l'avenir pour des analyses fonctionnelles. Nous envisageons que pour la plupart des buts (peut-être à l'exception des études structurales) ce qui annulerait le besoin de cultures à grande échelle. Cultures à petite échelle ne seront pas seulement utile pour le criblage des conditions d'expression, mais aussi être en mesure de fournir sufFicient quantités d'échantillons pour ces tests fonctionnels miniaturisés. La capacité de produire des cibles multiples en parallèle dans des quantités suffisantes pour la caractérisation fonctionnelle fera baisser les coûts de mise en culture et l'utilisation de ces types de plates-formes, l'expression et la caractérisation des protéines recombinantes seront plus coût-efficacité et de temps.
Les protocoles ci-dessus ont été appliquées à l'expression des peptides et des protéines disulfure riche dans la phase initiale du projet européen FP7 VENOMICS. Venins sont une excellente source de peptides bioactifs qui ont souvent un potentiel pharmacologique intéressant. Cependant, leur production est difficile en raison de leurs habitudes disulfure liaison complexes et de petite taille. Utilisation de plates-formes à haut débit telles que celle décrite ici, le projet VENOMICS vise à générer une bibliothèque de 10 000 nouveaux peptides de venin de reproduire la diversité observée dans la nature. Cette bibliothèque sera exploitée pour la caractérisation de disulfure-rpeptides ich avec potentiel pharmacologique ou des applications thérapeutiques dans le but de développer de nouveaux médicaments. La plate-forme est actuellement utilisé pour l'étalonnage et la validation de nouveaux protocoles pour l'utilisation dans le projet VENOMICS.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Ce travail a été soutenu par le projet VENOMICS, subvention de projet européen N ° 278 346 à travers le septième programme-cadre (7e PC SANTÉ 2011-2015). Le projet VENOMICS est une collaboration entre plusieurs institutions de recherche et les entreprises en Europe:
AFMB, Aix-Marseille Université (France), CEA Saclay (France), NZYTech (Portugal), SistemasGenomicos (Espagne), Université de Liège (Belgique), VenomeTech (France), Vitamib (France), Zealand Pharma (Danemark)
Ce travail a été soutenu par l'infrastructure française pour la biologie structurale intégrée (FRISBI) ANR-10-INSB-05-01.
Les auteurs tiennent également à remercier M. Jeremy Turchetto pour aider à la préparation de la prise de vue de la vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Tecan Freedom EVO 200 liquid handling robot | Tecan Group Ltd. | Protocols can be adapted to any liquid handling robot with a vacuum manifold for plates. http://www.tecan.com/platform/apps/product/index.asp?MenuID=2694&ID=5270&Menu=1&Item=21.1.8 | |
| 96-well PCR (PCR96) plates | Greiner Bio-One | 652270 | http://us.gbo.com/bioscience/detail/2504/ |
| LB medium | Autoclaved for sterility. | ||
| Antibiotic stocks | Kanamycin (50 mg/ml), ampicillin (100 mg/ml), chloramphenicol (34 mg/ml in ethanol), store stocks at −20 °C. Use a 1:1,000 dilution. | ||
| Deep-well 96 (DW96) plate with 2.42 ml volume capacity | Greiner Bio-One | 780270 | Autoclaved for sterility. http://us.gbo.com/bioscience/detail/2462/ |
| Expression vectors | For the expression of target constructs. Store at −20 °C. | ||
| BL21 (DE3) pLysS competent cells | Or alternative E. coli expression strain of the user's choice. Store at −80 °C. | ||
| Breathseal breathable adhesive film | Greiner Bio-One | 676050 | |
| PCR machine with 96-well plate block | For the transformation heat shock and boiling of SDS-PAGE/Caliper samples. | ||
| 24-well sterile tissue culture plates | Greiner Bio-One | 662165 | http://us.gbo.com/bioscience/detail/2220/ |
| LB-agar | Autoclaved for sterility. | ||
| 200 μl sterile disposable tips | Tecan Group Ltd. | 30 038 617 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Multitron shaking incubator, with 3 mm throw | Infors | AJ103 | Not essential, a regular shaking incubator can also be used. http://www.infors-ht.com/index.php/en/ |
| Plate incubator | |||
| Microtiter plate | For glycerol stocks and elution using purification protocol B. | ||
| Glycerol | For the preparation of glycerol stocks. | ||
| 200 μl disposable tips | Tecan Group Ltd. | 30 038 616 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Adhesive tape pads | Qiagen | 19570 | http://www.qiagen.com/Products/Catalog/Lab-Essentials-and-Accessories/Tape-Pads |
| Bactinyl | Orapi Group | Or equivalent microbial disinfectant. | |
| ZYP-5052 medium | See Table 1 for recipes of components. | ||
| Deep well 24 (DW24) plates, 10 ml capacity | Whatman | 7701-5102 | Autoclaved for sterility. http://www.whatman.com/UNIPLATECollectionandAnalysisMicroplates.aspx#7701-5102 |
| Flat-bottomed, clear microtiter plate | Greiner Bio-One | 655101 | For absorbance readings. http://us.gbo.com/bioscience/detail/2029/ |
| Plate reading spectrophotometer | Optional. For measuring OD600 of cultures. | ||
| Centrifuge with rotor for deep well plates | Suitable for 3,800 x g. | ||
| Lysozyme | 50 mg/ml in water. Store at −20 °C. | ||
| Imidazole ACS grade | Merck | IX0005-1 | A high quality grade of imidazole must be used so that it will not interfere with A280 readings for calculating protein yield. |
| Lysis buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 containing 0.25 mg/ml lysozyme (or your preferred buffer). Add lyzozyme from stocks each time and do not store for extended periods. | ||
| Water bath | |||
| Plate sonicator (Ultrasonic processor XL, adapted for deep well plates) | Misonix Inc. | Not essential. Lysozyme alone is normally sufficient for nearly complete lysis. | |
| DNase | 2 mg/ml stock in water, filter sterilized. Store aliquots at −20 °C. | ||
| Magnesium sulphate (MgSO4) | 2 M stock in water, autoclaved. | ||
| SDS-PAGE or Caliper sample buffer | |||
| Binding buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Wash buffer | 50 mM Tris, 300 mM NaCl, 50 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Elution buffer | 50 mM Tris, 300 mM NaCl, 250 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| 96-well Receiver/Filter Plate 20 µm, 1.8 ml capacity | Macherey-Nagel | 740686.4 | http://www.mn-net.com/ProductsBioanalysis/Accessories/tabid/10909/language/en-US/Default.aspx |
| 200 μl disposable wide bore tips | Tecan Group Ltd. | 30 050 348 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Ni Sepharose 6 Fast Flow resin | GE Healthcare | 17-5318-02 | For purification of target fusion proteins. Store at 4 °C. Wash and equilibrate before use. http://www.gelifesciences.com/webapp/wcs/stores/servlet/productById/en/GELifeSciences/17531802 |
| Tobacco Etch Virus (TEV) protease | Optional, for cleavage. 2 mg/ml, without reducing agents in storage buffer. Store at −80 °C. | ||
| 96-well 0.22 µm filter plate | Millipore | MSGV N22 10 | Optional. To filter the soluble fraction after cleavage. http://www.millipore.com/catalogue/item/msgvn2210 |
| SDS-PAGE/dot blot equipment or Caliper Labchip GXII equipment | Electrophoresis apparatus and choice of gel type is at the user’s discretion. | ||
| Spectrophotometer and cuvettes | For measuring absorbance at 280 nm (A280) to calculate yield of soluble proteins. Not required if the analysis is done on the Caliper. | ||
| ZipTip pipette tips | Millipore | Optional. The type of ZipTip is at the user's discretion. C4 resin should be used for larger proteins, while for peptides C18 may be better. Alternative methods for desalting of samples may also be used to clean up samples before further quality control. http://www.millipore.com/catalogue/module/c5737#0 | |
| Materials are listed in the order in which they are required in the Protocol section. Reagents can be stored at room temperature unless noted otherwise. Reference numbers for the author’s preferred choice of materials are provided, however equivalent products may also be suitable. For reagents where the brand will not influence the outcome of the experiment, the company details have been omitted. | |||
Références
- Berrow, N. S., et al. Recombinant protein expression and solubility screening in Escherichia coli: a comparative study. Acta Crystallographica Section D-Biological Crystallography. 62, 1218-1226 (2006).
- Correa, A., Oppezzo, P. Tuning different expression parameters to achieve soluble recombinant proteins in E. coli: advantages of high-throughput screening. Biotechnol J. 6, 715-730 (2011).
- Graslund, S., et al. Protein production and purification. Nat Methods. 5, 135-146 (2008).
- Vera, A., Gonzalez-Montalban, N., Aris, A., Villaverde, A. The conformational quality of insoluble recombinant proteins is enhanced at low growth temperatures. Biotechnol Bioeng. 96, 1101-1106 (2007).
- Graslund, S., et al. The use of systematic N- and C-terminal deletions to promote production and structural studies of recombinant proteins. Protein Expr Purif. 58, 210-221 (2008).
- Bird, L. E. High throughput construction and small scale expression screening of multi-tag vectors in Escherichia coli. Methods. 55, 29-37 (2011).
- Davis, G. D., Elisee, C., Newham, D. M., Harrison, R. G. New fusion protein systems designed to give soluble expression in Escherichia coli. Biotechnol Bioeng. 65, 382-388 (1999).
- Kapust, R. B., Waugh, D. S. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein science: a publication of the Protein Society. 8, 1668-1674 (1999).
- LaVallie, E. R., Lu, Z., Diblasio-Smith, E. A., Collins-Racie, L. A., McCoy, J. M. Thioredoxin as a fusion partner for production of soluble recombinant proteins in Escherichia coli. Methods Enzymol. 326, 322-340 (2000).
- Marblestone, J. G., et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein science: a publication of the Protein Society. 15, 182-189 (2006).
- Nozach, H., et al. High throughput screening identifies disulfide isomerase DsbC as a very efficient partner for recombinant expression of small disulfide-rich proteins in E. coli. Microb Cell Fact. 12, 37(2013).
- Sachdev, D., Chirgwin, J. M. Fusions to maltose-binding protein: control of folding and solubility in protein purification. Methods Enzymol. 326, 312-321 (2000).
- Smith, D. B. Generating fusions to glutathione S-transferase for protein studies. Methods Enzymol. 326, 254-270 (2000).
- de Marco, A., Deuerling, E., Mogk, A., Tomoyasu, T., Bukau, B. Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli. BMC Biotechnol. 7, 32(2007).
- Hatahet, F., Nguyen, V. D., Salo, K. E., Ruddock, L. W. Disruption of reducing pathways is not essential for efficient disulfide bond formation in the cytoplasm of E. coli. Microb Cell Fact. 9, 67(2010).
- de Marco, A. Recent contributions in the field of the recombinant expression of disulfide bonded proteins in bacteria. Microb Cell Fact. 11, 129(2012).
- Katzen, F., Beckwith, J. Disulfide bond formation in periplasm of Escherichia coli. Methods Enzymol. 348, 54-66 (2002).
- Klint, J. K., et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm of E. coli. PloS One. 8, e63865(2013).
- Braud, S., et al. Dual expression system suitable for high-throughput fluorescence-based screening and production of soluble proteins. Journal of Proteome Research. 4, 2137-2147 (2005).
- Douzi, B. G. A., et al. A new system for expressing recombinant animal toxins in E. coli. (Collection Rencontres en Toxicologie, Publications de la SFET, Chatenay-Malabry). Advances and new technologies in toxinology. , 149-152 (2010).
- Groisillier, A., et al. MARINE-EXPRESS: taking advantage of high throughput cloning and expression strategies for the post-genomic analysis of marine organisms. Microb Cell Fact.. 9, 45(2010).
- Vincentelli, R., et al. High-throughput protein expression screening and purification in Escherichia coli. Methods. 55, 65-72 Forthcoming.
- Xiao, R., et al. The high-throughput protein sample production platform of the Northeast Structural Genomics Consortium. Journal of Structural Biology. 172, 21-33 (2010).
- Saez, N. J., Vincentelli, R. Ch3 High-throughput expression screening and purification of recombinant proteins in E. coli. Structural Genomics: General Applications : Methods in Molecular Biology. Chen, Y. W. 1091, Humana Press. 33-53 (2014).
- Katzen, F. Gateway (R) recombinational cloning: a biological operating system. Expert. Opin. Drug Discov. 2, 571-589 (2007).
- Vincentelli, R., Canaan, S., Offant, J., Cambillau, C., Bignon, C. Automated expression and solubility screening of His-tagged proteins in 96-well format. Analytical Biochemistry. 346, 77-84 (2005).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expr Purif. 41, 207-234 (2005).
- Spencer, C. I., et al. Ion channel pharmacology under flow: automation via well-plate microfluidics. Assay Drug Dev Technol. 10, 313-324 (2012).
- Sala, E., de Marco, A. Screening optimized protein purification protocols by coupling small-scale expression and mini-size exclusion chromatography. Protein Expr Purif. 74, 231-235 (2010).
- Moon, A. F., Mueller, G. A., Zhong, X., Pedersen, L. C. A synergistic approach to protein crystallization: combination of a fixed-arm carrier with surface entropy reduction. Protein science: a publication of the Protein Society. 19, 901-913 (2010).
- Zanier, K., et al. Structural basis for hijacking of cellular LxxLL motifs by papillomavirus E6 oncoproteins. 339, Science. New York, N.Y. 694-698 (2013).
- Kapust, R. B., Tozser, J., Copeland, T. D., Waugh, D. S. The P1' specificity of tobacco etch virus protease. Biochemical and Biophysical Research Communications. 294, 949-955 (2002).
- Vincentelli, R., Romier, C. Expression in Escherichia coli: becoming faster and more complex. Current Opinion in Structural Biology. 23, 326-334 (2013).
- Jolma, A., et al. DNA-binding specificities of human transcription factors. Cell. 152, 327-339 (2013).
- Aslanidis, C., de Jong, P. J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Research. 18, 6069-6074 (1990).
- Haun, R. S., Serventi, I. M., Moss, J. Rapid, reliable ligation-independent cloning of PCR products using modified plasmid vectors. BioTechniques. 13, 515-518 (1992).
- van den Ent, F., Lowe, J. RF cloning: a restriction-free method for inserting target genes into plasmids. Journal of Biochemical and Biophysical Methods. 67, 67-74 (2006).
- Vincentelli, R., et al. High-throughput automated refolding screening of inclusion bodies. Protein science: a publication of the Protein Society. 13, 2782-2792 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon