Method Article
中枢神経系から細胞を変換するためのレンチウイルスベクターの生産
要約
このプロトコルでは、生産、精製、およびレンチウイルスベクターの滴定について説明します。我々は初代培養神経細胞やアストロサイトにおけるレンチウイルスベクターによる遺伝子送達の例を示します。私たちの方法は、他の細胞型にも適用される場合があります in vitroでと。
要約
Efficient gene delivery in the central nervous system (CNS) is important in studying gene functions, modeling neurological diseases and developing therapeutic approaches. Lentiviral vectors are attractive tools in transduction of neurons and other cell types in CNS as they transduce both dividing and non-dividing cells, support sustained expression of transgenes, and have relatively large packaging capacity and low toxicity 1-3. Lentiviral vectors have been successfully used in transducing many neural cell types in vitro 4-6 and in animals 7-10.
Great efforts have been made to develop lentiviral vectors with improved biosafety and efficiency for gene delivery. The current third generation replication-defective and self-inactivating (SIN) lentiviral vectors are depicted in Figure 1. The required elements for vector packaging are split into four plasmids. In the lentiviral transfer plasmid, the U3 region in the 5' long terminal repeat (LTR) is replaced with a strong promoter from another virus. This modification allows the transcription of the vector sequence independent of HIV-1 Tat protein that is normally required for HIV gene expression 11. The packaging signal (Ψ) is essential for encapsidation and the Rev-responsive element (RRE) is required for producing high titer vectors. The central polypurine tract (cPPT) is important for nuclear import of the vector DNA, a feature required for transducing non-dividing cells 12. In the 3' LTR, the cis-regulatory sequences are completely removed from the U3 region. This deletion is copied to 5' LTR after reverse transcription, resulting in transcriptional inactivation of both LTRs. Plasmid pMDLg/pRRE contains HIV-1 gag/pol genes, which provide structural proteins and reverse transcriptase. pRSV-Rev encodes Rev which binds to the RRE for efficient RNA export from the nucleus. pCMV-G encodes the vesicular stomatitis virus glycoprotein (VSV-G) that replaces HIV-1 Env. VSV-G expands the tropism of the vectors and allows concentration via ultracentrifugation 13. All the genes encoding the accessory proteins, including Vif, Vpr, Vpu, and Nef are excluded in the packaging system. The production and manipulation of lentiviral vectors should be carried out according to NIH guidelines for research involving recombinant DNA (http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf). An approval from individual Institutional Biological and Chemical Safety Committee may be required before using lentiviral vectors. Lentiviral vectors are commonly produced by cotransfection of 293T cells with lentiviral transfer plasmid and the helper plasmids encoding the proteins required for vector packaging. Many lentiviral transfer plasmids and helper plasmids can be obtained from Addgene, a non-profit plasmid repository (http://www.addgene.org/). Some stable packaging cell lines have been developed, but these systems provide less flexibility and their packaging efficiency generally declines over time 14, 15. Commercially available transfection kits may support high efficiency of transfection 16, but they can be very expensive for large scale vector preparations. Calcium phosphate precipitation methods provide highly efficient transfection of 293T cells and thus provide a reliable and cost effective approach for lentiviral vector production.
In this protocol, we produce lentiviral vectors by cotransfection of 293T cells with four plasmids based on the calcium phosphate precipitation principle, followed by purification and concentration with ultracentrifugation through a 20% sucrose cushion. The vector titers are determined by fluorescence- activated cell sorting (FACS) analysis or by real time qPCR. The production and titration of lentiviral vectors in this protocol can be finished with 9 days. We provide an example of transducing these vectors into murine neocortical cultures containing both neurons and astrocytes. We demonstrate that lentiviral vectors support high efficiency of transduction and cell type-specific gene expression in primary cultured cells from CNS.
プロトコル
1。レンチウイルスベクターのパッケージング
レンチウイルスベクターは、レンチウイルストランスファーベクターとリン酸カルシウムトランスフェクション法により293T細胞にパッケージングするために必要な他のプラスミドのトランスフェクションによって生成されます。我々は、このプロトコルでは10〜100 mmの組織培養皿を使用しています。これは、スケールアップまたはダウンしてアプリケーションに応じてすることができます。 293T細胞株は、10%ウシ胎児血清(FBS)、100単位/ mlペニシリン、37°Cで100μg/ mlのストレプトマイシンを添加し、高グルコース(4500 mg / L)をしてダルベッコ改変イーグル培地(DMEM)で維持され5%CO 2インキュベーター。
- 培地中の10〜100 mmの組織培養皿(3×10 6細胞/シャーレ)に30〜40%コンフルエントでシード293T細胞。インキュベーターにセルを返します。
- 20から24時間の培養後、細胞密度を確認してください。細胞はトランスフェクション時の約80%コンフルエントでなければなりません。
- 50 mlチューブを準備します。 4.4ミリリットルを追加TE79/10(1 mMのトリス、0.1mMのEDTA、pH7.9)を引いた、次のプラスミドDNAの合計量。 100μgのレンチウイルストランスファープラスミド( 図1)、58μgのpMDLg / pRRE、31μgののpCMV-G、25μgのPRSV-REV、600μlの2M CaCl 2を追加します。穏やかに混合する。
- 別の50 mlチューブを準備します。 5ミリリットル2倍HBS(0.05 MのHEPES、0.28 MのNaCl、1.5mMののNa 2 HPO 4、pHは7.12)を追加します。
- 10 mlのピペットでDNA-CaCl 2の混合物を取って、チューブをボルテックスしながら滴下し、2×HBSを含むチューブに追加します。
- 30分間室温(RT)で沈殿反応を保持します。
- インキュベーターから培養皿を取り外します。ボルテックスでよく沈殿反応を混在させること。細胞を含む各100 mmディッシュに懸濁液1 mlを追加します。懸濁液を静かに皿の中の培地を旋回しながらゆっくりと滴下しなければなりません。インキュベーターにこれらの料理を返し、5時間放置する。
- 培養液から培地を除去します。 6mMのBUナトリウムを含む6 mlの新鮮な培地を追加します。各ディッシュにtyrate。インキュベーターに文化を返します。構文内の蛍光レポーターがある場合は、一晩培養後、蛍光顕微鏡下でレポーター遺伝子の発現を確認してください。それがユビキタスプロモーター(例えば、CMVプロモーター)により駆動されている場合は、通常細胞の80%以上は、レポーター遺伝子を発現する。
- トランスフェクションの2日後(40から44 h)は、2〜50 mlのチューブ(約30ml各チューブ)に10皿から上清を収集します。 -80℃の冷凍庫で上清を凍結したり、次のステップに進みます。
2。ベクターの濃度および精製
- 新たに10分間上清中に任意の細胞破片を除去するために収集または900グラム(2000回転程度)で上清を融解を遠心分離します。
- 0.2μmのSFCAシリンジフィルターを60 mlの注射器を取り付けます。シリンジに50 mlチューブから上清を移します。ポリアロマーの遠心チューブに上清をフィルタリングします。
- 5 mlのピペットで5ミリリットルの20%スクロース(PBSで調製)を取る。挿入上清を含む遠心管の底までピペット。徐々にベクトル上清の下でのショ糖溶液を追加します。別のチューブから上清について、この手順を繰り返します。
- °Cで4時間ベックマンSW28スイングローターで11000回転と4で上清を遠心分離します。
- 上清を除去します。各遠心チューブに150μlの4%の乳糖を(PBS中で調製)を追加します。ペレットを再懸濁します。
- すべての遠心チューブから1.5 mlチューブに濃縮されたベクトルを転送します。 15分間チューブを氷上にしておきます。
- ピペッティングによりベクトル懸濁液を混ぜる。 1分間、フルスピード(16000約g)で遠心してスピン。
- 新しい1.5 mlチューブに上清を移します。 20μlのアリコートに最終的なサンプルを分割し、-80℃の冷凍庫でそれらを格納します。
3。ベクターの滴定
- シード5×10 4 /ウェルの10%FBSを添加し1ミリリットルDMEM培地で12ウェルプレートでHT1080細胞の。
- overnig後HT文化は、1つのウェルから細胞をカウントし、細胞数を獲得。
- 培養液で濃縮されたベクトルの:5倍希釈(および1:625; 1:125 25 1:5、1)を行います。別々のウェルに各希釈ベクトルの私は、液を追加します。サンプルは、精度を向上させるために複製される場合があります。
- 各ウェルを含むベクトルやベクトルせずにウェルに1μlの4 mg / mlのポリブレン(Hexadimethrine臭)を追加します。静かにプレートを振とうして混合します。 48時間インキュベーターに戻す。
- 細胞培養ウェルから培地を除去します。 PBSで各ウェルを洗浄します。細胞に250μlの1X trypsine-EDTA溶液を追加します。細胞は(3-5分)デタッチされたときに、1 mlの培地を追加します。ピペッティングにより細胞を再懸濁します。 1.5 mlの遠心チューブに細胞懸濁液を移します。
- 6分間900gで遠心します。蛍光レポーター遺伝子(例えばGFP)とのベクトルの場合、FACS分析のために3.7に進みます。レポーターせずにベクトルの場合、リアルタイム定量PCRは3.8に進みます。
- 蛍光を含むベクトルのrescentレポーター遺伝子、上清を除去し、PBS中3.7%ホルムアルデヒド300μlでペレットを再懸濁します。 FACS分析によりレポーター陽性細胞の割合を決定します。力価はミリリットルの濃ベクトル当たり形質導入ユニット(TU / ml)として表されます。
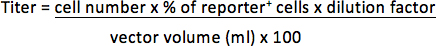
1月25日μL(0.04μl)をベクトルと30%の細胞はレポーター陽性であると、例えば1×10 5細胞が形質導入された場合、力価は次のようになります。
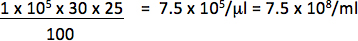
唯一の希釈液を使用して力価を計算するために追加された陽性細胞の割合とベクトル量との間に直線関係に落ちる。最後の力価は、ベクトルの少なくとも2つの異なる量の伝達経路から得られた抗体価の平均値である必要があります。
- せずにベクトルの蛍光レポーター遺伝子は、製造業者のプロトコルに従って別途準備DNA Mini Kit(キアゲン社)を用いてHT1080細胞からゲノムDNAを抽出します。プライマー(HIV-1のPBS / PSI領域17)の5'-CCGTTGTCAGGCAACGTG-3 'および5'-AGCTGACAGGTGGTGGCAAT-3'とABI PRISM 7000配列検出システム(Applied Biosystems)を用いてゲノムDNAのベクター配列を増幅、およびTaqManプローブ5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'。ゲノムにおけるシングルコピー遺伝子であるアルブミン遺伝子(2コピー/細胞)もプライマー5'-TGAAACATACGTTCCCAAAGAGTTT-3 'および5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3'、およびプローブ5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-TAMRA-3で増幅された"内部統制として。次のプログラムで製造元の指示に従って、96ウェルプレートにコピーベクターの数とPCR法によるアルブミンを決定します15秒50℃2分間、95℃で10分間、および95の35サイクルのC°Cと60°Cで2分間。既知濃度のプラスミドの10倍希釈系列(コピーのように表さ数)の鋳型配列を含有するにも未知サンプルの定量化のための標準曲線を作成するために増幅されるべきである。力価はミリリットルの濃ベクトル当たり統合ユニット(IU / ml)として表されます。

4。大脳新皮質文化の伝達
ニューロンとグリアの両方を含む新皮質の培養物は、前述の18として二段階めっきプロシージャを使用して、マウスの大脳皮質から調製される。 14から16日間の妊娠で胎児マウスから得られたneocortexの複数形は、10%FBS、24ウェル組織培養プレートに20mMグルコースおよび2mMグルタミンを添加したMEMで以前に確立されたグリア細胞単層上に播種されています。
- in vitroで 5日後、neocで10μMシトシンアラビノシド(ARA-C)を追加する非神経細胞分裂を阻害するortical文化。文化の2日間細胞を続行します。
- 5〜10分間37の暖かい培養培地は、°Cの水浴。 ARA-Cは新鮮な培養液(500μL/ウェル)とを含む培地に置き換えます。
- 文化への理想のMOI(標的細胞の数にベクター粒子数の比率感染多重度)を持つベクトルを追加します。 24時間培養を継続します。我々は、プライマリ皮質培養で(通常は5)1-10 MOIを使用しています。
- 新鮮な培地で培養液を交換してください。培養を継続します。ベクターコンストラクトにレポーター遺伝子がある場合は、2日間導入後、蛍光顕微鏡で細胞を確認してください。レポーター遺伝子の発現は、ベクターの設計と使用量に応じて、導入後のニューロン2-7に表示されます。
5。代表的な結果
このプロトコルの範囲で生産レンチウイルスベクターの力価は10 8 -10 10 IU / mlで、whichは、in vitroおよび in vivo の両方で CNSから種々の細胞型の伝達に適しています。 表1および図2は、このプロトコルによって生成されたベクターを用いた代表的な結果を示しています。我々は、形質導入 シナプシン(SYN)プロモーターまたはグリア線維性酸性タンパク質(GFAP)のプロモーターによって制御される緑色蛍光タンパク質(GFP)を発現するレンチウイルスベクターによるマウスの新皮質の文化。七日間の導入後、私たちはそれぞれ、抗NeuNおよび抗GFAP抗体を用いて神経細胞やアストロサイトを標識するために免疫染色を行っ。 表1及び図に示すように。図2Aは 、ニューロンの90%(NeuN +細胞)を介して、シナプシンプロモーターを有するベクターで形質導入した後にGFPを発現していないアストロサイト(GFAP +細胞)は、このレポーター遺伝子を発現する。 GFAPプロモーターは、ベクターコンストラクト( 図2B)、アストロサイトの約80%(GFAP +細胞)発現に使用される場合のGFP、GFAPとNeuNで標識した細胞でのGFPの発現の有無と局在によって確認としてすべてのGFP +細胞はアストロサイトがあります。これらの結果は、レンチウイルスベクターは、中枢神経系および細胞特異的遺伝子発現から細胞に導入遺伝子を提供する非常に効率的であることを示す適切なプロモーターが使用されているときに達成することができます。
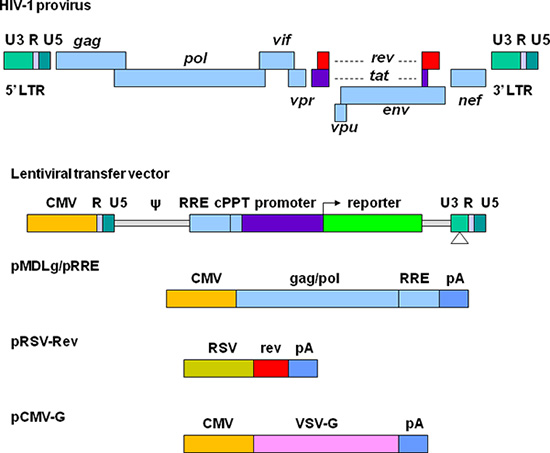
図1。 HIVベースのレンチウイルスベクターとパッケージングプラスミドの概略図。HIV-1プロウイルスは上部に表示されます。ベクトル生産のための要素は4つの異なるプラスミドに分けられています。プラスミドレンチ転送は、U3領域はパッケージングシグナル(ψ)、RRE配列を、中央polypurine路(cPPT)、目的の遺伝子(例えば、サイトメガロウイルス(CMV)プロモーターに置換されているハイブリッドの5 'LTRを含む蛍光選択肢のプロモーターと一緒にレポーター)、および3 'LTRのシス調節配列は完全にU3領域から削除されます。 pMDLg / pRREは、CMVプロモーターの制御下でHIV-1からgagおよびpol遺伝子とRRE配列を含んでいる。 PRSV-RevはRSVプロモーターにより駆動されるリビジョンのコーディング配列を含んでいます。のpCMV-Gは、CMVプロモーターの制御下でVSV-G蛋白質遺伝子を含んでいます。 PAは、ヒトβ-グロビン遺伝子からのポリアデニル化シグナルを示しています。

図2。マウス新皮質の混合培養におけるレポーター遺伝子の発現は、細胞型特異的プロモーターを担持するレンチウイルスベクターで導入した。培養はLV-SYN-GFP(A)または(B)MOI 5でLV-GFAP-GFPベクターを形質導入した。七日間の導入後、細胞は、抗NeuN又は抗GFAP抗体で免疫染色した。上部のパネルには、GFPの蛍光を示し、中央のパネルには、免疫染色を示し、下側のパネルは、(GFP:緑色、NeuN又はGFAP:赤)の画像をマージされます。
| ベクトル | 神経細胞におけるGFP +細胞 | GFP +アストロサイトにおける |
| LV-SYN-GFP | 92.2±7.3 | 0 |
| LV-GFAP-GFP | 0 | 78.3±11.5 |
表1。マウスの新皮質の培養物中のGFP発現の比較は、異なるプロモーター運ぶレンチウイルスベクターで導入した。
マウス新皮質の培養物は、(5×10 5 /ウェルで24ウェルプレート)MOI 5でLV-SYN-GFPまたはLV-GFAP-GFPで形質導入した。導入7日後には、文化は固定されており、NeuN又はGFAPのために免疫染色した。 GFPとNeuN / GFAPを発現する細胞の数は、実験条件ごとに10分野からの画像で計数した。値は、ニューロンの割合(NeuN +細胞)を表すか、また、GFPレポーター遺伝子を発現するアストロサイト(GFAP +細胞)。示された値は、平均±SD、3つの独立した実験からである。
ディスカッション
このプロトコルでは、新皮質の培養物中のこれらのベクトルのレンチウイルスベクターと、アプリケーションの生産を示している。我々は、これらの方法で製造されたベクターを用いた効率的な細胞型固有の伝達を示した。シナプシンプロモーターが使用されている場合、GFPの発現は厳密には特定のニューロンである。 GFAPプロモーターが使用されている場合、GFPの発現はアストロサイトで排他的です。ない細胞タイプ特異的発現が必要とされていない場合は、ユビキタスプロモーターを使用することができます。我々はubiqutinとホスホグリセリン酸キナーゼ(PGK)プロモーターの両方が新皮質の文化6で高レベルの遺伝子発現を駆動することができました。レンチウイルスベクターによって駆動される遺伝子発現は、プロモーターの選択(例えば、タイプ固有のユビキタスまたはセル)または特定の組織またはアプリケーションをターゲットとする別のエンベロープ蛋白質またはベクトル疑似を用いて発現や細胞の種類の特定のレベルに合わせてカスタマイズすることができます。例えば、狂犬病G蛋白質またはVSV-Gの融合でシュードD狂犬病蛋白質は、逆行性軸索輸送19,20をサポートしています 。一過性トランスフェクションプロトコルは、異なるエンベロープタンパク質を有するベクターのパッケージングを可能にします。
レンチウイルスベクターは、一般的に精製工程なしで超遠心分離によって濃縮されています。これらの未精製のベクターは、多くの細胞型に適しています。しかし、初代神経培養は、細胞毒性のバッチ変動にバッチで、その結果、プロデューサー細胞からの汚染物質に敏感です。 20%ショ糖クッション精製工程では、ベクトルが一貫して非毒性の一次ニューロンでできます。私たちは、動物への一次ニューロンと注入の伝達のために精製されたベクトルを使用することをお勧めします。ベクトル製剤の大規模以上の純度が必要な場合は、このようなアフィニティークロマトグラフィー21とアニオン交換膜クロマトグラフィー22のような他の精製技術は、使用することができます。長期的な伝達は、一般的に初代神経培養中で要求されるように、特別な注意がベクターの調製時に汚染を最小限に抑えるように注意する必要があります。 0.2μMフィルタとベクトルの濃度の間にオートクレーブポリアロマーの遠心チューブを使用してベクトル上清を渡すと、この目的を果たすでしょう。上清の大ボリュームはフィルタリングする必要がある場合は、ボトルトップフィルタを使用することができます。酪酸ナトリウムは、プロモーター23の活性を刺激することが報告されています。プロデューサー細胞のトランスフェクション後の培地への酪酸ナトリウムの添加は、10以上の襞24ベクトルの力価を高めることができます。ポリブレン(hexadimethrine臭)が広く、それによってベクトルの細胞間相互作用25を容易に、負電荷を中和することにより、レトロウイルス遺伝子導入の効率を向上させるために遺伝子の転送プロトコルのために使用されています。私たちの手で、ポリブレンは、新皮質の培養におけるニューロンに対して毒性が強い。したがって、ポリブレンは、プライマリ神経培養を伝達では避けるべきである。がある場合ベクトルの蛍光レポーター、それはFACS分析によってベクトルの力価を決定すると便利です。ないレポーターが利用可能でない場合、またはレポーター遺伝子を標的細胞におけるベクターの統合を検出するための組織特異的プロモーター、定量PCRによって駆動されたときにベクトルの統合は、導入遺伝子の発現は独立して、より良い選択肢となります。ベクトルのすべての統合されたコピーが機能しているとして、FACS分析によって決定される特定のベクトルの力価は定量PCRのそれよりも低くなります。ベクトルの力価は、ベクター調製物の定量RT-PCRによりELESAまたはベクトルゲノムRNAでHIV p24の蛋白質を測定することによって決定することができます。しかし、これらの方法が原因不可避的にパッケージングプロセスと成功した標的細胞26を伝達しません機能の粒子中に生成された欠陥のあるウイルス粒子のかなりの数が少なく正確です。このプロトコルによって行われたベクターは、in vitroおよびin ROにin vivoの両方で正常に使用されているへこみの脳27。ベクターによる遺伝子発現は、培養細胞でも同じ細胞型6,28 の in vivoシステムでは必ずしも同一ではありませんように調査官は、個別にそれらのシステムでテストする必要があります。レンチウイルスベクターは、広く過剰発現のために使用したり、CNSの細胞型の様々な目的の遺伝子をノックダウンされています。神経科学の研究者は彼らの研究アプリケーションのレンチウイルスベクターを開発するために我々のプロトコルは、有用でなければなりません。
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、ワシントン大学、プログラム、プロジェクトグラントNS032636(BJS)にNIH神経青写真コアグラント(P30 NS057105、BJS)によってサポートされており、神経疾患のためのホープセンターでされました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| DMEM | Sigma-Aldrich社 | D5796 | |
| MEM | インビトロジェン | 11090-081 | |
| ウシ胎仔血清 | ハイクローン | SV3001403 | |
| PBS | メディアテック | 21から040-CM | |
| トリプシン-EDTA | Sigma-Aldrich社 | T3924 | |
| 酪酸ナトリウム | Sigma-Aldrich社 | B5887 | |
| Hexadimethrineブロマイド(ポリブレン) | Sigma-Aldrich社 | H9268 | |
| 293T細胞 | ATCC | CRL-11268 | |
| HT1080細胞 | ATCC | CCL-121 | |
| ファルコン100×20ミリメートル組織cultureの皿 | BDバイオサイエンス | 353003 | |
| 1×3½polyallomoerの遠心チューブに | Beckman-Coulter社 | 326823 | |
| 0.2ミクロンのシリンジフィルタ | コーニング | 431219 | |
| 別途準備DNA Miniキット | キアゲン | 51304 |
参考文献
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499(2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10(2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved