Method Article
サイト固有の細菌染色体工学:ΦC31インテグラーゼを介したカセット取引所(IMCE)
要約
既製のアクセプター株、と呼ばれる着陸パッド株に興味のある外来DNAを統合するための迅速かつ効率的な方法が記載されている。メソッドは、ΦC31インテグラーゼの結合と表現を通して、与えられた菌株の人工着陸パッドの座にDNAカセットの部位特異的に統合することができます。
要約
細菌の染色体を安定的にメガ塩基の範囲1に外来DNAを維持するために使用されることがあります。染色体への統合は、このようなプラスミド複製、プラスミドの安定性、プラスミド不和合性、プラスミドコピー数の変動などの問題を回避します。このメソッドは、 放線菌ファージ(Φ)C31 2,3から、サイト固有のインテグラーゼを使用しています。 attBとattP(それぞれ34と39 bpの、)4:ΦC31インテグラーゼは、2つの特定のDNA部位の間の直接的な組換えを触媒する。この組換えは、安定していると5を戻すことはできません。スペクチノマイシン耐性遺伝子、aadA(SPR)、およびE.から成る"ランディングパッド"(LP)シーケンスattP部位によって挟まれた大腸菌 β-グルクロニダーゼ遺伝子(uidA)Sinorhizobium根粒、Ochrobactrum anthropiと、遺伝子間領域におけるAgrobacterium tumefaciensの染色体に組み込まれており、 午前それぞれpCの軌跡、そしてTETA軌跡、S.根粒は、このプロトコルで使用されています。スタッファー赤色蛍光タンパク質(RFP)遺伝子と抗生物質耐性遺伝子に隣接するattB部位を含む可動性ドナーベクターも構築されている。この例では、ゲンタマイシン耐性プラスミドpJH110が使用されます。 RFP遺伝子の 6は SPH I と Pst Iを用いて所望の構築物で置き換えることができますまたattB部位に隣接した合成構造などpK19mob 7のような可動性ベクターにサブクローン化されたかもしれません。 ΦC31インテグラーゼ遺伝子の発現(pHS62 8からクローニングされた)pRK7813 9可動性プラスミド広宿主範囲に、lacプロモーターによって駆動されます。
tetraparental交配プロトコルは、それによってドナーカセットでLPシーケンスにマーカーを置き換えるLP株にドナーカセットを転送するために使用されます。これらの細胞はトランジスタです。S-組込み体。トランス組込み体は、0.5%の典型的な効率で形成される。トランス組込み体は、通常、抗生物質感受性または5 - ブロモ-4 - クロロ-3 - インドリル-β-D-グルクロン酸(X-gluc)を使用して青白色スクリーニングでスクリーニング第一500〜1,000コロニー内にあります。このプロトコルは、トランス組込み体を作成し、単離するための交配と選択プロシージャが含まれています。
プロトコル
1。文化の生産
- TY 10(5 g / lのトリプトン、3 g / lの酵母エキス、0.44 g / lの塩化カルシウムの脱水)、およびLB 11(10 g / lのトリプトン、5g / lの酵母エキス、5gの/:滅菌液体培地を準備します。塩化ナトリウム、pH 7)。
- 50μg/ mlのスペクチノマイシンとTYメディアの5ミリリットルに():SmUW227(建設はリクエストを承り構造の詳細を痛め、別の場所で説明されるS.根粒 LP-ひずみ:)は、単一のコロニーから接種する。 E.:与えられた抗生物質を補充する、LB液体培地5ml中に以下の菌株を接種する大腸菌は DH5α12 10μg/ mlのテトラサイクリンでpJC2、プラスミドインテグラーゼの発現を含む。E.大腸菌 MT616 13、動員、10μg/ mlのクロラムフェニコール、およびE.大腸菌 DH5α5μg/ mlのゲンタマイシンをpJH110、ドナープラスミドカセットを含む。
- インキュベートE. 37&一晩大腸菌株度、一定に振とうしながらC。インキュベートS.振盪しながら2日間の30℃における根粒菌株 。 S.を得ることが可能である大規模な接種(飽和文化の1:500継代培養)で一晩根粒の文化。
2。文化の調製とミキシング
- 30秒間17000×gで遠心分離によって細胞ペレットを集め、1 mlの滅菌0.85%NaClでの再懸濁することにより、各株の培養液1.5 mlを洗って、一回繰り返します。
- 滅菌した0.85%NaClで100μlのペレットを再懸濁します。
- 個別に平野TY寒天プレート上でそれぞれの株に洗浄した文化の10μlを見つける。これらのスポットは、コントロールスポットです。
- E.除く各株の40μlを加え大腸菌 DH5α滅菌チューブにpJC2を含む12、ミックス、プレーンTY寒天プレート上で、この混合物の120μlを見つける。このスポットはno-インテグラーゼ陰性コントロールです。
- 無菌tに各株の40μlを加えUBE、ミックス、スポット平野TY寒天プレート上で、この混合物160μlの。このスポットはIMCE交配スポットです。
- スポットが層流フード内で乾燥させます。
- シール板と30°Cで一晩インキュベートします。
3。トランス組込み体の単離
- 200μg/ mlのストレプトマイシン(SmUW227はストレプトマイシン14に高レベルの耐性を付与する突然変異を運ぶRm1021に基づいています)、30μg/ mlのゲンタマイシンを添加したTY寒天プレート上にストリークコントロールスポットとIMCEスポット。
- IMCE効率の計算については、約再懸濁し¼500μlの滅菌0.85%NaClでのIMCE交配スポット。 10 -7〜10倍希釈系列を作成します。 TY寒天プレート上10 -5を介してプレート希釈液10 -2は 、トランス組込み体を選択するために、200μg/ mlのストレプトマイシンおよび30μg/ mlのゲンタマイシンを補った。 10 -3 THRプレート希釈液トランス組込み体と潜在的な受信者の両方を選択するために、200μg/ mlのストレプトマイシンを補充したTY寒天プレート上でウワーッ10 -7、合計受信者、すなわち。
- マーカーレストランス組込み体を単離するための無菌の0.85%NaClで500μlに約IMCE交配スポットの四半期に再懸濁します。 10 -6〜10倍希釈系列を作成します。プレート希釈液200μg/ mlのストレプトマイシンおよび200μg/ mlのX-glucを添加した4 TY寒天プレート上で10 -6〜10 -4。
- 3日間30℃でプレートをインキュベートします。
- 緑色の光(525 nm)の下に、赤のフィルタ(> 610 nm)で15を介してビューRFPトランス組込み体。
- トランス組込み体のCFUは、全受信者のCFUと比較してパーセントIMCE効率を計算します。トランス組込み体の約半分は、敏感な彼らは、白とスペクチノマイシン作る真のカセット交換を受けています。
- マーカーレストランス組込み体(Wを見つけるにはここでドナーベクターは、白いコロニー(拡張潜伏期間、室温で1-2余分な日、X-gluc経由してコロニーの分化を向上させるための画面)pJH110のようにGmのrを含んでいませんが、これはS.必要である根粒 SmUW227)、抗生物質および100μg/ mlのスペクチノマイシンを含むTY寒天プレートなしのTY寒天プレート上でスクリーニングすることによってコロニーのスペクチノマイシン感受性を確認します。
4。代表的な結果
ストレプトマイシンとゲンタマイシン制御筋を添加したTY上でのインキュベーションの3日後には成長しているべきではありません。 IMCEストリークは、図2に見られるように、第二連勝で頭筋上のコンフルエントな成長と多くの植民地を持っている必要があります。合計受信者へのトランス組込み体の割合として表されるトランス統合の効率は、0.5%の範囲でなければなりません。約トランス組込み体の半分はスペクチノマイシンに敏感と白になります彼らは真のカセット交換を受けて表示しています。緑色の光(525 nm)の下、赤フィルター(> 610 nm)で15を介して見たときpJH110からテスターのRFPドナーカセットを含有するトランス組込み体は、識別可能なRFP蛍光を表示する必要があります。
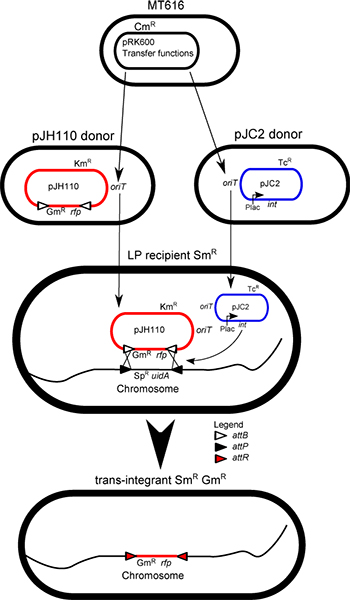
図1コンジュゲートの混合図:pRK600からの転送遺伝子の発現による支援は、プラスミドのすべてが細胞から細胞へランダムに転送されます。 IMCE、インテグラーゼ(int)はヘルパープラスミドpJC2とドナープラスミドpJH110に必要な2つのプラスミドのLP-株の買収により、混合物中のトランス組込み体の作成 にこの転送の結果、。プラスミド非複製ドナー(pJH110)からドナーカセットはLP-マーカー(Spの損失、その結果、染色体上にLP-カセットのマーカーとΦC31インテグラーゼ活性を介して交換されrとuidA)で処理し、得られたトランスインテグラのドナーカセットのメンテナンス(RFPとのGm R)。
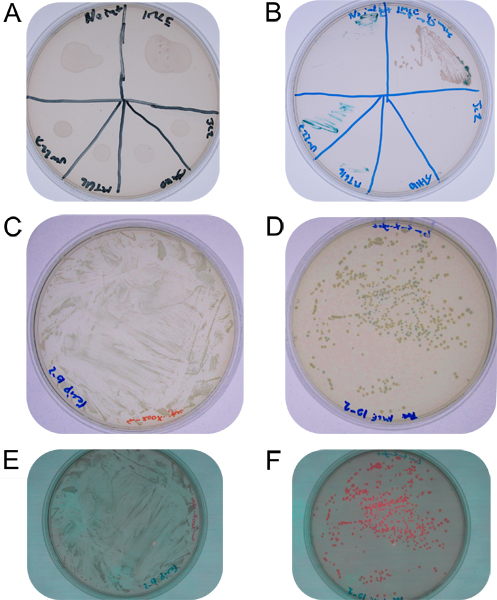
図2。 :寒天表面上の乾燥した細胞混合物を示す非選択TYプレート上に嵌スポットプレートB:上からストレプトマイシン、ゲンタマイシン-X-glucプレート上にストリーク嵌スポットは、Sに、時計回りIMCEを全くインテグ制御を残っていない根粒、E.大腸菌 DH5αを含むpJC2制御、E.大腸菌 DH5aはpJH110コントロールを含む、E.大腸菌 MT616制御、およびS.根粒 UW227コントロールC:。TYストレプトマイシン-X-gluc寒天上で交配スポット再懸濁の10 -2希釈D:TYストレプトマイシン、ゲンタマイシン-X-gluc寒天(青コロニーは単一の組換え体であり、上の交配スポット再懸濁の10 -2希釈白色コロニーは、真の受けたカセット交換)E:。蛍光性の欠如を示すTYストレプトマイシン-X-gluc寒天上で交配スポット再懸濁の10 -2希釈F:2つのレベルを示すTYストレプトマイシン、ゲンタマイシン-X-gluc寒天上で交配スポット再懸濁の10 -2希釈蛍光の(明るいコロニーは青色のコロニーに対応しており、読み取りしかしコロニーが、真のカセット交換なしでlacプロモーターからのリードスルーでのみ、その即時プロモーターとRFPが含まれて受けたベクター配列からプロモーターに起因すると考えられる高いRFPを発現している不在であるベクトル、)。
ディスカッション
IMCE技術は、以前に設計された株のLP-遺伝子座への単一attB挟まれたDNAカセットの効率的な統合が可能になります。希望するコンストラクトがドナーカセットを作成するRFPの代わりにクローン化されると、技術は非常に堅牢な作り、その後のDNA精製と変換を必要としません。それは抗生物質耐性は、トランス組込み体の作成とない他の要因によるものであることを確実にするために、適切な成長のコントロールが含まれていることが重要です。
IMCEは約0.5%の効率でトランス組込み体を生成します。対照的に、相同組換えを介した二重クロスオーバーは、10 -6程度の頻度で発生します。 λ-赤16、別のファージベースのシステムを介して遺伝子改変は、特定の相同性を必要とし、E.の外の効果を変化させた大腸菌 17。まだ別のオプション、TN7部位特異的組換えは、attTn7サイト18が必要です、。 ΦC31インテグラーゼは、異種ホスト4,19で効率的な活性を示しています。 ΦC31インテグラーゼの使用はホストの前のエンジニアリングを必要とするが、それは特定の門に限定されません。 IMCEは、任意のドナーカセットが潜在的に任意のLP-株に統合することができることを考えると効率化とモジュール化の利点があります。これは、単一のクローンライブラリは、機能的遺伝子発現の要求またはシングルコピーの遺伝的相補性が望まれているために、複数のホストで上映されている必要があり研究に最適です。
統合する構造のサイズが正常にライゲーションを介してドナーベクターにクローニングすることができるDNAのサイズによって制限されます。ゲートウェイの宛先20を含むドナーベクターを使用し、大規模な挿入コスミド/ fosmidライブラリに特に有用であることができます。ドナーベクターの抗生物質耐性マーカーはまたTを選択するために使用されるかもしれません彼伝達、またはゲノムエレクトロ21を介して二つの異なるトランス組込み体を交配することによってDNA断片をポストIMCEを重複しての組み立て。この設計上の考慮事項は、LP-株のLP-遺伝子座における非常に大規模な構造物の組立のために許可する必要があります。これは、代謝工学や合成生物学におけるアプリケーションのための合成遺伝子構築物の取り込みのために特に有用であるかもしれません。
開示事項
利害の衝突が宣言されません。
謝辞
親切なインテグラーゼクローンを提供するためのマーガレットCMスミスへ
からの資金調達のサポート:
ゲノムカナダ/ゲノムプレーリー
NSERC発見と戦略プロジェクトの助成金
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ストレプトマイシン | Bioshopカナダ社 | STP101 | |
| スペクチノマイシン | Bioshopカナダ社 | SPE201 | |
| ゲンタマイシン | Bioshopカナダ社 | GTA202 | |
| Choramphenicol | Bioshopカナダ社 | CLR201 | |
| テトラサイクリン | Bioshopカナダ社 | TET701 | |
| カナマイシン | Bioshopカナダ社 | KAN201 | |
| 細菌学的等級寒天 | Bioshopカナダ社 | AGR001 | |
| トリプトン | Bioshopカナダ社 | TRP402 | |
| 酵母エキス | Bioshopカナダ社 | YEX401 | |
| 塩化ナトリウム | Bioshopカナダ社 | SOD001 | |
| 塩化カルシウム | Bioshopカナダ社 | CCL444 | |
| X-gluc | ゴールドバイオ株式会社 | G1281C1 | |
| 大腸菌 MT616株 | リクエストも承ります | また、我々の研究室の外で使用 | |
| 大腸菌 pJC2株 | リクエストにより、家の中で、利用可能な | ||
| 大腸菌 pJH110株 | requesによって家の中で、利用可能なトン | ||
| SmUW227ひずみ | リクエストにより、家の中で、利用可能な |
参考文献
- Itaya, M., Tsuge, K., Koizumi, M., Fujita, K. Combining two genomes in one cell: Stable cloning of the Synechocystis PCC6803 genome in the Bacillus subtilis 168 genome. Proc. Natl. Acad. Sci. U.S.A. 102, 15971-15976 (2005).
- Kushtoss, S., Rao, R. N. Analysis of the Integration Function of the Streptomycete Bacteriophage FC31. J. Mol. Biol. 222, 897-908 (1991).
- Brown, W. R., Lee, N. C., Xu, Z., Smith, M. C. Serine recombinases as tools for genome engineering. Methods. 53, 372-379 (2011).
- Groth, A. C., Olivares, E. C., Thyagarajan, B., Calos, M. P. A phage integrase directs efficient site-specific integration in human cells. Proc. Natl. Acad. Sci. U.S.A. 97, 5995-6000 (2000).
- Rowley, P. A., Smith, M. C., Younger, E. A motif in the C-terminal domain of FC31 integrase controls the directionality of recombination. Nuc. Acid. Res. 36, 3879-3891 (2008).
- Campbell, R. E. A monomeric red fluorescent protein. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882 (2002).
- Schafer, A. Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19: selection of defined deletions in the chromosome of Corynebacterium glutumicum. Gene. 145, 69-73 (1994).
- Thorpe, H. M., Smith, M. C. In vitro site-specific integration of bacteriophage DNA catalyzed by a recombinase of the resolvase/invertase family. Proc. Natl. Acad. Sci. 95, 5505-5510 (1998).
- Jones, J. D., Gutterson, N. An efficient mobilizable cosmid vector, pRK7813, and its use in a rapid method for marker exchange in Pseudomonas fluorescens strain HV37a. Gene. 61, 299-306 (1987).
- Beringer, J. E. R Factor transfer in Rhizobium leguminosarum. J. Gen. Microbiol. 84, 188-198 (1974).
- Lennox, E. S. Transduction of linked genetic characters of the host by bacteriophage P1. Virology. 1, 190-206 (1955).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166, 557-580 (1983).
- Charles, T. C., Finan, T. M. Genetic map of Rhizobium meliloti megaplasmid pRmeSU47b. J. Bacteriol. 172, 2469-2476 (1990).
- Leigh, J. A., Signer, E. R., Walker, G. C. Exopolysaccharide-deficient mutants of Rhizobium meliloti that form ineffective nodules. Proc. Natl. Acad. Sci. U.S.A. 82, 6231-6235 (1985).
- Heil, J. R., Nordeste, R. F., Charles, T. C. The fluorescence theatre: a cost-effective device using theatre gels for fluorescent protein and dye screening. Can. J. Microbiol. 57, 339-342 (2011).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc. Natl. Acad. Sci. U.S.A. 97, 6640-6645 (2000).
- Lesic, B., Rahme, L. G. Use of the lambda Red recombinase system to rapidly generate mutants in Pseudomonas aeruginosa. BMC Mol. Biol.. 9, 20-20 (2008).
- Choi, K. -H., Schweizer, H. P. mini-Tn7 insertion in bacteria with single attTn7 sites: example Pseudomonas aeruginosa. Nat. Protocols. 1, 153-161 (2006).
- Thomason, L. C., Calendar, R., Ow, D. W. Gene insertion and replacement in Schizosaccharomyces pombe mediated by the Streptomyces bacteriophage FC31 site-specific recombination system. Molecular Genetics and Genomics. 265, 1031-1038 (2001).
- Katzen, F. Gateway recombinational cloning: a biological operating system. Expert Opin. Drug Discovery. , 571-586 (2007).
- Charles, T. C., Doty, S. L., Nester, E. W. Construction of Agrobacterium strains by electroporation of genomic DNA and its utility in analysis of chromosomal virulence mutations. Appl. Environ. Microbiol. 60, 4192-4194 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved