Method Article
モデル遺伝生物として使用するためのメダカ胚のマイクロインジェクション
要約
メダカとゼブラフィッシュは、脊椎動物のゲノム機能の遺伝的解剖のための補完的です。このプロトコルは、メダカ胚に成功したマイクロインジェクション、実験室でのメダカとゼブラフィッシュを用いた発生学と遺伝学的解析のための重要な手法のためのキーポイントを強調しています。
要約
このビデオでは、我々は1細胞期のメダカ胚にマイクロインジェクションの技術を実証する。メダカは、遺伝子と発生学の両方の分析を可能にし、ゲノムワイドな表現型主導型の変異画面はゼブラフィッシュとマウスのように、1アウト実施された脊椎動物のモデル生物の一つである小規模な産卵淡水魚です。メダカとゼブラフィッシュの間に関連する遺伝子の機能重複の発散は、単一の種2の識別不能な新規な表現型の同定を可能にする、このようにメダカとゼブラフィッシュは、脊椎動物のゲノム機能の遺伝的解剖のために補完的である。
胚透明であり、外部からの開発メダカを利用するには、マイクロインジェクションは、作るための過剰発現やノックダウン、目的の遺伝子、およびDNAのラベリング細胞のmRNAまたはアンチセンスオリゴヌクレオチドのためにセルトレーサーを注入するために必要不可欠な技術です。トランスジェニック系統。
プロトコル
1。嵌合と卵を収集
- 女性と男性のメダカは、容易に肛門と背びれの大きさや形によって区別することができます。男性の肛門フィンは女性のそれに比べて大きく、平行四辺形の形をしたです。女性のしりびれは小さく、三角形に整形。男性の背びれは、最後の二つの光線の間にはっきりと目に見える深いノッチを持っています。
- メダカは、毎日40卵にレイアップし、メダカの雌は、それらがタンク内の工場で取り除かれる前に数時間のために添付ファイルのフィラメントによって彼らの腹でクラスタ化された卵を運びます。
- 女性はネットでキャッチされ、片手で両側から軽く内側に保持することができます。卵は、その後、静かに他の手の人差し指と腹からからかわすることができます。女性はその後、タンクに戻すことができます。卵は鈍ピンセットや指で胚のメディアで満たされた6センチメートルペトリ皿に移してください。
- それらは小さな交配ボックスに保存されているときにメダカのペアはめったに戦うしません。それらが供給することができ、卵は数ヶ月のカップルのために毎日同じペアから収集できるようにそのため、彼らは水の流れと一つの小さなタンクに保管することができます。
- それは、排卵がメダカの雌で毎日発生するので、メスの魚が、男性なしで保管すべきではないことが重要である。そうでなければ、女性は卵を提供し、体調不良になることはできません。
2。クリーニング胚
- 9センチメートルペトリ皿の蓋に置かれた紙やすりにガラスピペット(P2000グリットサイズ、防水)でクラスタ化されていない卵を移す。余分な培地を除去しますが、胚の乾燥を防ぐために十分な量が残っていることを確認してください。
- ゆっくりと最小限の圧力を適用すると絨毛膜の外表面の毛の一部を削除するには約45〜60秒間サンドペーパーの表面に指を平行に保ち、人差し指を使って紙やすりで胚をロールバックします。この予防措置は、お互いの下胚の破砕の危険性を最小限に抑えることが一度に5月7日胚よりも多くをロールバックしないでください。
- 胚の培地の新鮮な皿にきれいに胚を移す。
3。マイクロインジェクションの間に胚を保持するためにアガロースプレートを作る
胚を1.5%アガロースでプレキシガラスの金型(図1)で作成された注入の間に谷で開催されています。アガロースの濃度は適切に胚を保持することが重要です。
- 最初に、アガロースのフレームはプレキシガラスの金型を保持すること。 9センチメートルペトリ皿に0.5センチメートル深さに水に1.5%アガロースを注ぎ、それが完全に固まるまで待ちます。金型のサイズよりちょうど大きいアガロースの領域を切り抜きます。
- カット領域を塗りつぶすとは気泡がトラップしないとアガロースが固まるまで待っているように金型を配置する1.5%アガロースを注ぐ。このアガロースプレートはsolidifactionをスピードアップするために冷蔵庫に保存することができます。
- 卵を保持するために谷を作成するための金型を削除します。必要に応じ° Cまで4℃金型、カバーや店舗を浸すのに十分な胚の培地を追加。

図1マイクロインジェクションのためのアガロースプレートでのトラフを製造するために使用されるカスタムメイドのモールドの模式図。
4。メダカ胚のマイクロインジェクション
メダカでは、DNA、RNA、モルフォリノオリゴヌクレオチドとトレーサーの染料は、64細胞期胚ではなく、ゼブラフィッシュのように、卵黄1の細胞質中に絨毛膜を介してマイクロインジェクションされています。細胞質はメダカで小さいと見えにくくなるので、そのようなローダミン-デキストランなどの色素を注入することにより、実際にはこのスキルを開発することをお勧めします。トレーサーとしてフェノールレッドのほかにも注射の確認を可能にするために奨励されています。
メダカ胚を取り巻く絨毛膜が丈夫なので、短く、強いと広い注射針は、(図2)が必要です。フィラメント含有ガラスは、毛細血管からこの強力な幅広い注射針を準備します。
- トレーサーとしてフェノールレッドを使用して注射液を調製し、エッペンドルフmicroloaderと後ろから針に読み込みます。空気ポンプインジェクターに針を接続してください。
- 卵は、1細胞期に注入する受精後できるだけ早く収集し、クラスタを解除する必要があります。より多くの胚は、細胞分裂を停止する氷(ではない30分以上)にそれらを格納することにより注入することができる。
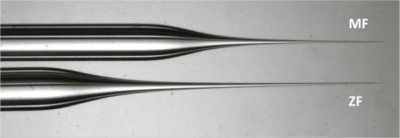
図2メダカとゼブラフィッシュ針の比較。 MFの針の先端に注意してください(上)短いとメダカ胚を取り巻く厳しい絨毛膜に穴を開けるためのより強力なので広いです。 - アガロースプレートに卵を移し、ピンセットで谷に位置合わせをしてください。ちょうど注射の前に1細胞の細胞質の細胞膜が目でヒットすることができるように、五卵は回転させることが必要垂直に電子が針。 1細胞の細胞質は、最も密な油滴と卵の側とは反対側の小さな油滴を欠いている領域を探すことによって見つけることができます。特定のエリアは、側面から表示することによって、細胞質であることを確認することができます。
- 針の近くに卵に置きます。優しく絨毛膜に針の先端を触ったり、microforceps(図3)を使用して針の先端を開きます。注入物質の少量の流出に見られるべきである。
- 絨毛膜の針の内側の先端を配置する絨毛膜を介して穿刺。は逆流が厳しい絨毛膜(保圧および噴射圧力は500 - 700hPAの場合は、80 100hPAの設定)を介して穿刺時に高い圧力が原因で発生しないようにするため、比較的高いようにインジェクタの保持圧力を調整します。
- 急激にその膜を突っついによって細胞質に針の先端を挿入します。
卵黄に針の先端を挿入することは避けてください。ゼブラフィッシュとは異なり、卵黄中に注入材料は、細胞質中に転送されません。ときに細胞質の境界がぼやけているのに対し(図4)卵黄に注入すると注入された液体は明確な境界を持っている。
時折針は、アガロース/破片によってブロックになることがあります。鉗子は、触れる/再度改行針の端を、閉塞を除去するために使用することができます。針が注入中の任意の時点で中断した場合、バブリングは胚の培地で見られるだろうとあなたが注入される物質は失われます。注射はアガロースのチャネルに沿って上から下へと金型を介して、左から右に体系的に行われるべきである。 - 注入された胚は、胚の培地を含むきれいな皿に移し、適切な温度で開発する必要があります。

図3。注射前に針の先端を破る。 1:近い胚の絨毛膜に針の先端を移動させ、2:絨毛膜をタッチ、チップを破る静かに前後に針を移動させる、3:注入物質の少量が針の端から流れ出るときにこれは破損を確認先端の。
5。代表的な結果

図4。注入メダカ胚の代表画像。パネル1細胞期メダカの胚の細胞質へのローダミン - デキストランの正しい注射の代表画像を示す。パネルBは、1細胞期メダカの胚の卵黄嚢にローダミン-デキストランの不正確な注入の代表画像を示す。パネルCとDは約30時間後に注射でAとBそれぞれのパネルから胚を示しています。 EM:胚、前方はCとDとビューが背側であるパネルで上向きである。染料が間違って卵黄嚢に注入したとして、パネルDの胚の体が赤ではないことに注意してください。 BとDの矢印は、卵黄嚢に間違って注入されたローダミン-デキストランが異なる円形境界を注意して示している。 AとBの点線は、1細胞の細胞質の輪郭を示すため、ビューは横方向です。
ディスカッション
このビデオでは、我々は1細胞期のメダカ胚に細胞トレーサー、mRNAは、DNAまたはアンチセンスオリゴヌクレオチドを注入する方法を示しています。このテクニックは、私たちはリアルタイムで、生体内で様々な発生過程を研究することができました。それはaffordsこのプロセスとそれに続く詳細な分析が大幅に脊椎動物の器官形成と基礎細胞生物学の我々の理解を高めるために可能性を秘めている。そのような知識はために重要である、と再生医療の治療用途をもたらす可能性があります。
謝辞
この作品は、MRCからの助成金によって支えられて。
資料
| Name | Company | Catalog Number | Comments | |
| 4" fine net | Tools | J K Aquatics Ltd. | MD001 | Used to capture fish during egg harvesting. |
| Embryo medium | Reagent | Home made | 200ml 50X stock solution, 1ml 1%methyleneblue in H2O/10 liter RO water (50X stock solution: NaCl 14.7g, KCl 0.6g, CaCl2 2H2O 2.4g, MgSO4 7H2O 4.0g/1 litre RO water. | |
| Fine waterproof sandpaper - p2000 grit size | Tools | Hermes Abrasives Ltd. | Very fine grit size for rolling/cleaning embryos with chorions. | |
| Borosilicate glass capillaries | Tool | Harvard Apparatus | GC100-10F | For making microinjection needles. |
| Micropipette puller | Equipment | Narishige International | Model PP-830 | For making microinjection needles. |
| Eppendorf microloader | Tool | Eppendorf | 5242956.003 | For loading microinjection needles. |
| Microinjector apparatus | Equipment | Eppendorf | Model 5242. | |
| Micromanipulator | Equipment | Narishige International | Model MN151. | |
| Agarose injection plate | Tools | Home made | For holding embryos during injection. |
参考文献
- Furutani-Seiki, M., Sasado, T., Morinaga, C. A systematic genome-wide screen for mutations affecting organogenesis in Medaka, Oryzias latipes. Mech Dev. 121, 647-658 (2004).
- Furutani-Seiki, M., Wittbrodt, J. Medaka and zebrafish, an evolutionary twin study. Mech. Dev. 121, 629-6237 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved