Method Article
Microiniezione di embrioni Medaka per essere utilizzato come organismo modello genetico
In questo articolo
Riepilogo
Medaka e zebrafish sono complementari per la dissezione genetica delle funzioni del genoma dei vertebrati. Questo protocollo mette in evidenza i punti chiave per il successo microiniezione in embrioni Medaka, una tecnica importante per l'analisi embriologiche e genetiche utilizzando Medaka zebrafish e in un laboratorio.
Abstract
In questo video, dimostriamo la tecnica della microiniezione in una cella di embrioni fase Medaka. Medaka è un piccolo deposizione delle uova di pesce d'acqua dolce che permette le analisi genetiche ed embriologica ed è uno degli organismi modello vertebrato, in cui sono state effettuate genome-wide schermi mutante fenotipo-scacciati 1, come nel pesce zebra e il mouse. Divergenza di sovrapposizione funzionale di geni correlati tra Medaka zebrafish e consente l'identificazione di fenotipi romanzo che sono identificabili in una singola specie 2, così Medaka e zebrafish sono complementari per la dissezione genetica delle funzioni del genoma dei vertebrati.
Per usufruire di pesce Medaka cui gli embrioni sono trasparenti e sviluppano esternamente, microiniezione è una tecnica essenziale per iniettare cellule traccianti per le cellule etichettatura, mRNA o anti-senso oligonucleotidi per eccesso di esprimere e bussare a tendina geni di interesse, e di DNA per fare linee transgeniche.
Protocollo
1. Accoppiamento e raccolta delle uova
- Medaka maschio e femmina può essere facilmente distingue per la dimensione e la forma delle pinne anali e dorsali. Le pinne anali dei maschi sono più grandi e parallelogramma di forma rispetto a quella delle femmine. La pinna anale femminile è più piccolo e di forma triangolare. La pinna dorsale maschio ha una tacca profonda ben visibile tra le ultime due raggi.
- Medaka deporre fino a 40 uova al giorno e femmine Medaka trasportare uova raggruppate a loro ventre da filamenti attaccamento per diverse ore prima di essere spogliato presso gli impianti nel serbatoio.
- Le femmine possono essere catturati in una rete e mantenuto all'interno delicatamente da entrambi i lati da una mano. Le uova possono essere delicatamente preso in giro dalla pancia con il dito indice dell'altra mano. La femmina può essere restituito al serbatoio. Le uova dovrebbero essere trasferiti ad un piatto di 6 centimetri Petri riempite con i media embrione da pinze contundente o con un dito.
- Coppie Medaka raramente combattere quando sono tenuti in una scatola di accoppiamento di piccole dimensioni. Pertanto, essi possono essere tenuti in una vasca piccola con flusso d'acqua in modo che possano essere alimentati e le uova possono essere ritirati presso lo stesso paio tutti i giorni per un paio di mesi.
- E 'importante che i pesci femmina non deve essere tenuto senza maschi, dal momento che l'ovulazione avviene ogni giorno nelle femmine Medaka. In caso contrario, le femmine non in grado di offrire uova e diventare male.
2. Embrioni di pulizia
- Trasferimento non clustered uova con una pipetta di vetro di carta vetrata (grana P2000, impermeabile) posta nel coperchio di un piatto nove centimetri Petri. Rimuovere l'eccesso di media, ma garantire un volume sufficiente resta contro l'essiccamento della embrioni.
- Ruotare delicatamente embrioni sulla carta vetrata con il dito indice, applicando una pressione minima e mantenendo le dita parallele alla superficie della carta vetrata per circa 45-60 secondi per rimuovere alcuni dei peli superficie esterna del corion. Non tiro più di embrioni di 5-7 in una sola volta questa precauzione per minimizzare il rischio di schiacciare gli embrioni sotto l'altro.
- Trasferimento degli embrioni puliti per un piatto fresco di medio dell'embrione.
3. Fare piastre di agarosio per lo svolgimento di embrioni durante la microiniezione
Gli embrioni sono tenuti in depressioni durante l'iniezione fatti con uno stampo in plexiglass 1,5% agarosio (Figura 1). La concentrazione di agarosio è importante tenere gli embrioni in modo corretto.
- Innanzitutto, una cornice di agarosio a tenere lo stampo in plexiglass. Versare 1,5% di agarosio in acqua ad una profondità 0,5 centimetri in un piatto nove centimetri Petri e attendere che si solidifica completamente. Tagliare una zona del agarosio appena più grande della dimensione dello stampo.
- Versare 1,5% agarosio per riempire l'area taglio e luogo lo stampo in modo che non formino bollicine d'aria e attendere agarosio solidifica. Questa piastra di agarosio può essere conservato in frigorifero per accelerare solidifaction.
- Togliere lo stampo per creare depressioni per tenere le uova. Aggiungi medio abbastanza embrione di immergere lo stampo, coprire e conservare a 4 ° C fino al momento dell'uso.

Figura 1. Schematica di misura stampo usato per preparare mangiatoie in lastre agarosio per la microiniezione.
4. Microiniezione di embrioni Medaka
In Medaka, il DNA, l'RNA, gli oligonucleotidi morfolino e coloranti traccianti sono microiniettati attraverso il corion nel citoplasma di quelle 1 64-cellula embrionale fase piuttosto che il tuorlo come in zebrafish. Poiché il citoplasma è più piccolo e meno visibile in Medaka, pratica iniettando coloranti come rodamina-destrano si raccomanda di sviluppare questa abilità. L'aggiunta di rosso fenolo come tracciante è anche incoraggiati a consentire la conferma di iniezioni.
Come il corion circostante embrioni Medaka è dura, una breve e ago per l'iniezione forte e ampia è necessario (Figura 2). Preparare questo ago forte iniezione di gamma da un filamento di vetro contenenti capillare.
- Preparare la soluzione di iniezione con rosso fenolo come tracciante e caricarla in l'ago dalla parte posteriore con un microloader Eppendorf. Collegare l'ago alla pompa iniettore aria.
- Le uova devono essere raccolti e non clustered il più presto possibile dopo la fecondazione di iniettare al unicellulare stadio. Più embrioni può essere iniettato memorizzandoli su ghiaccio (non più di 30 minuti) per arrestare la divisione cellulare.
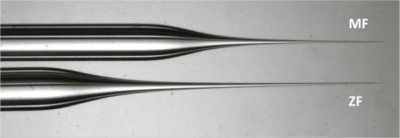
Figura 2. Confronto di aghi Medaka e zebrafish. Si noti la punta dell'ago MF (in alto) è più corta e più larga quindi più forte per pungere il corion duro circostante embrioni Medaka. - Trasferire le uova nella piastra di agarosio e allinearle in depressioni con una pinza. Poco prima iniezione, cinque uova dovrebbero essere ruotata in modo la membrana cellulare delle cellule di un citoplasma può essere colpito da ªe aghi perpendicolarmente. Citoplasma della sola cellula può essere trovata con la ricerca di una zona priva di piccole goccioline di olio che si trova di fronte al lato dell'uovo con gocce di olio più denso. L'area identificata può essere confermato di essere il citoplasma dalla visione di lato.
- Posizionare l'ago vicino alle uova. Aprire la punta dell'ago delicatamente toccando la punta dell'ago al corion o utilizzando microforceps (Figura 3). Una piccola quantità di sostanza di iniezione deve essere visto per defluire.
- Puntura attraverso il corion di inserire la punta di un ago all'interno del corion. Regolare la pressione di mantenimento degli iniettori ad essere relativamente elevata, per garantire che non reflusso si verifica a causa della pressione alta sulla puntura attraverso il corion dura (impostazioni di 80-100hPA per la pressione holding e 500-700hPa per la pressione di iniezione).
- Inserire la punta dell'ago nel citoplasma da bruscamente colpendo la sua membrana.
Evitare di inserire la punta di un ago nel tuorlo. A differenza di zebrafish, materiale iniettato nel tuorlo non sarà trasferito nel citoplasma. Liquidi iniettati avere una delimitazione distinta quando iniettato nel tuorlo, mentre il confine è sfocata, quando nel citoplasma (Figura 4).
Occasionalmente l'ago potrebbe diventare bloccato da agarosio / detriti. Pinze possono essere utilizzate per toccare / rebreak fine dell'ago e rimuovere il blocco. Se l'ago break in qualsiasi momento durante l'iniezione, spumeggiante si vedrà nel medio embrione e la sostanza si inietta andranno persi. Le iniezioni devono essere praticate sistematicamente dall'alto verso il basso lungo i canali di agarosio e da sinistra a destra attraverso lo stampo. - Embrioni iniettati dovrebbero essere trasferiti in un piatto pulito contenente medio embrione e sviluppato a temperatura adeguata.

Figura 3. Rompere la punta dell'ago prima dell'iniezione. 1: Spostare punta dell'ago vicino al corion dell'embrione; 2: Toccare il corion e spostare l'ago avanti e indietro con delicatezza per rompere punta; 3: quando una piccola quantità di sostanza iniezione esce alla fine dell'ago ciò conferma la rottura della punta.
5. Rappresentante risultati

Figura 4. Immagini rappresentative di embrioni iniettati Medaka. Un pannello mostra un'immagine rappresentativa di iniezione corretta rodamina-destrano nel citoplasma di un embrione stadio unicellulare Medaka. Pannello B mostra un'immagine rappresentativa di iniezione errata di rodamina-destrano nel sacco vitellino di un embrione stadio unicellulare Medaka. Pannelli C e D mostrano gli embrioni da pannelli A e B rispettivamente di circa 30 ore dopo l'iniezione. EM: embrione, è anteriore verso l'alto in pannelli C e D e di vista è dorsale. Si noti il corpo dell'embrione nel pannello D non è rosso come il colorante è stato erroneamente iniettato nel sacco vitellino. Frecce in B e D indicano rodamina-destrano iniettata in modo non corretto nel sacco vitellino nota il confine distinte circolari. Linee tratteggiate in A e B indicano sagoma di citoplasma di una cellula, vista laterale.
Discussione
In questo video, si dimostra un metodo per tracciante cellulare, mRNA, DNA o anti-senso iniezione oligonucleotide in una cella di embrioni fase Medaka. Questa tecnica ci ha permesso di studiare vari processi di sviluppo in-vivo in tempo reale. Questo processo e la successiva analisi dettagliata che offre ha il potenziale per migliorare significativamente la nostra comprensione della organogenesi vertebrati e la biologia delle cellule sottostanti. Tale conoscenza può essere importante per, e la resa applicazioni terapeutiche nel campo della medicina rigenerativa.
Riconoscimenti
Questo lavoro è stato sostenuto da un finanziamento della MRC.
Materiali
| Name | Company | Catalog Number | Comments | |
| 4" fine net | Tools | J K Aquatics Ltd. | MD001 | Used to capture fish during egg harvesting. |
| Embryo medium | Reagent | Home made | 200ml 50X stock solution, 1ml 1%methyleneblue in H2O/10 liter RO water (50X stock solution: NaCl 14.7g, KCl 0.6g, CaCl2 2H2O 2.4g, MgSO4 7H2O 4.0g/1 litre RO water. | |
| Fine waterproof sandpaper - p2000 grit size | Tools | Hermes Abrasives Ltd. | Very fine grit size for rolling/cleaning embryos with chorions. | |
| Borosilicate glass capillaries | Tool | Harvard Apparatus | GC100-10F | For making microinjection needles. |
| Micropipette puller | Equipment | Narishige International | Model PP-830 | For making microinjection needles. |
| Eppendorf microloader | Tool | Eppendorf | 5242956.003 | For loading microinjection needles. |
| Microinjector apparatus | Equipment | Eppendorf | Model 5242. | |
| Micromanipulator | Equipment | Narishige International | Model MN151. | |
| Agarose injection plate | Tools | Home made | For holding embryos during injection. |
Riferimenti
- Furutani-Seiki, M., Sasado, T., Morinaga, C. A systematic genome-wide screen for mutations affecting organogenesis in Medaka, Oryzias latipes. Mech Dev. 121, 647-658 (2004).
- Furutani-Seiki, M., Wittbrodt, J. Medaka and zebrafish, an evolutionary twin study. Mech. Dev. 121, 629-6237 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon