Method Article
Criosezione e immunocolorazione della retina del topo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Viene descritto un protocollo per la preparazione di criosezioni retiniche di topo e l'esecuzione dell'immunocolorazione sui fotorecettori. Questo articolo consente ai ricercatori di produrre in modo coerente sezioni congelate della retina di topo con morfologia ben conservata e risultati di immunocolorazione di alta qualità.
Abstract
Il sezionamento tissutale e l'immunoistochimica sono tecniche essenziali negli studi istologici e patologici delle malattie retiniche utilizzando modelli animali. Questi metodi consentono esami dettagliati delle morfologie dei tessuti e la localizzazione di proteine specifiche all'interno del tessuto, che forniscono preziose informazioni sui processi e sui meccanismi della malattia. I mouse sono il modello più utilizzato per questo scopo. Tuttavia, poiché i bulbi oculari dei topi sono piccoli e le retine dei topi sono tessuti estremamente delicati, ottenere sezioni retiniche di alta qualità e immagini di immunocolorazione dai bulbi oculari dei topi è in genere difficile. Questo studio descrive un protocollo migliorato per la criosezione della retina di topo e l'esecuzione dell'immunoistochimica. Un punto essenziale di questo protocollo prevede il rivestimento del bulbo oculare con uno strato di super colla, che impedisce la deformazione dei bulbi oculari durante i processi di rimozione della cornea, estrazione del cristallino e incorporamento. Questo passaggio garantisce che l'integrità delle morfologie retiniche sia ben preservata. Questo protocollo evidenzia le considerazioni tecniche critiche e le strategie di ottimizzazione per produrre costantemente sezioni retiniche di alta qualità e ottenere eccellenti risultati di immunocolorazione.
Introduzione
La criosezione e l'immunoistochimica (IHC) sono tecniche indispensabili nella ricerca biomedica, in particolare per lo studio di strutture biologiche complesse come la retina1. Queste metodologie avanzate sono fondamentali per comprendere l'intricata composizione cellulare e l'organizzazione molecolare della retina. Forniscono ai ricercatori la capacità di studiare la funzionalità e la patologia retinica a un livello dettagliato, offrendo intuizioni fondamentali per l'avanzamento delle conoscenze in questo campo.
La criosezione svolge un ruolo fondamentale nel mantenimento dell'integrità morfologica del tessuto retinico. Garantisce che la delicata struttura della retina rimanga intatta, consentendo l'utilizzo di sezioni in successivi studi di immunofluorescenza con elevata precisione e affidabilità. Rispetto ad altri metodi, come l'inclusione di paraffina, la criosezione presenta vantaggi significativi in quanto preserva meglio sia la morfologia dei tessuti che l'antigenicità, rendendola particolarmente adatta per la colorazione immunoistochimica2. La tecnica della sezione congelata è ampiamente adottata per lo studio di una serie di tessuti complessi e persino di strutture cellulari fini3, consentendo analisi precise della loro architettura.
L'IHC è una tecnica di laboratorio potente e versatile che consente di visualizzare la localizzazione di specifiche proteine all'interno dei tessuti. Questa tecnica è diventata una pietra miliare sia in ambito clinico che di ricerca, dove è ampiamente utilizzata per la diagnostica, il monitoraggio delle malattie e le indagini biologiche. Il successo di un esperimento IHC dipende in larga misura da una meticolosa preparazione del campione, da un'attenta manipolazione del tessuto e da un controllo preciso delle condizioni di immunocolorazione. Piccole variazioni nel protocollo possono avere un grande impatto sulla qualità dei risultati, sottolineando l'importanza della standardizzazione e dell'ottimizzazione1.
Se combinati, la criosezione e l'IHC offrono vantaggi senza pari per i ricercatori che cercano di esplorare la distribuzione spaziale, i livelli di espressione e le interazioni cellulari di varie proteine all'interno della retina. Queste metodologie consentono indagini dettagliate sui meccanismi molecolari alla base dello sviluppo, della funzione e della malattia retinica. Tali intuizioni sono particolarmente preziose nello studio dei disturbi della retina, tra cui la degenerazione maculare legata all'età, la retinopatia diabetica e la retinite pigmentosa. Chiarendo la fisiopatologia di queste condizioni, la criosezione e l'IHC contribuiscono all'identificazione di potenziali biomarcatori e allo sviluppo di nuove strategie terapeutiche.
Nonostante la sua utilità, lavorare con le retine di topo presenta sfide uniche. I topi sono ampiamente utilizzati come modelli animali nella ricerca oftalmica grazie alla loro somiglianza genetica con l'uomo e alla loro struttura retinica ben caratterizzata. Tuttavia, ottenere criosezioni di alta qualità è intrinsecamente difficile a causa delle piccole dimensioni e della natura delicata del tessuto retinico del topo. Questo studio fornisce una metodologia dettagliata per la criosezione e l'esecuzione di IHC su retine di topo, evidenziando considerazioni tecniche critiche e offrendo strategie di ottimizzazione per affrontare queste sfide. Perfezionando queste tecniche, i ricercatori possono ottenere risultati coerenti e di alta qualità, facendo progredire lo studio della biologia e della patologia retinica.
Protocollo
La procedura ha aderito alle linee guida stabilite dall'Associazione per la ricerca in visione e oftalmologia per l'uso degli animali nella ricerca. L'approvazione è stata ottenuta dal Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC) dell'Ospedale Provinciale del Popolo del Sichuan. Per questo protocollo sono stati utilizzati topi maschi C57Bl/6J, di età compresa tra due e tre mesi e del peso di 25-30 g. Un elenco completo dei reagenti e delle attrezzature utilizzate in questo studio è fornito nella Tabella dei materiali.
1. Preparazione del reagente
- 1x buffer PBS
- Pesare 8 g di NaCl, 1,42 g di Na2HPO4, 0,42 g di KH2PO4 e 0,2 g di KCl utilizzando una bilancia. Trasferirli in un becher e aggiungere una quantità adeguata di acqua bidistillata (ddH2O) per sciogliere i componenti. Versare la soluzione in un matraccio tarato da 1 L e regolare il volume a 1 L con ddH2O.
- Soluzione di paraformaldeide (PFA) al 4%
- Aggiungere 0,4 g di polvere di PFA e 15 μL di NaOH 1 M in una provetta conica da 15 mL contenente 8 mL di tampone PBS 1x. Mettere la provetta in un bagnomaria impostato a 60 °C per sciogliere completamente la polvere di PFA. Regolare il volume finale a 10 ml con 1x PBS.
- Soluzione di blocco IHC
- Combinare 1 mL di siero d'asino normale, 20 μL di NaN3 al 20%, 200 μL di Triton X-100 al 20% e 18,78 mL di tampone PBS 1x. Mescolare accuratamente.
- Soluzione di saccarosio al 30%
- Sciogliere 15 g di saccarosio in 40 mL di 1x tampone PBS. Regolare il volume a 50 ml con 1 tampone PBS e mescolare fino a completa dissoluzione.
- Soluzione di anticorpi secondari IHC
- Diluire l'anticorpo anti-coniglio di capra coniugato Alexa Fluor 488 in un rapporto 1:300 e DAPI in un rapporto 1:2.000 utilizzando il tampone bloccante preparato.
2. Criosezione del bulbo oculare del mouse
- Sezionamento del bulbo oculare
- Anestetizzare un topo C57Bl/6 di 3 mesi (circa 25 g) mediante iniezione intraperitoneale di tribromoetanolo al 2% alla dose di 15 μL/g di peso corporeo. Sacrificare il topo usando la lussazione cervicale (seguendo i protocolli approvati istituzionalmente).
- Segna il lato superiore del bulbo oculare con un pennarello blu sulla sclera (Figura 1A). Rimuovi i bulbi oculari usando le forbici.
- Se è presente del sangue sulla superficie del bulbo oculare, pulirlo delicatamente con un panno privo di lanugine. Sotto un microscopio da dissezione, rimuovere con cura i muscoli extraoculari attaccati ai bulbi oculari.
- Fissazione
- Trasferire i bulbi oculari sezionati in una provetta da microcentrifuga a fondo tondo da 2 ml contenente 1 ml di PFA al 4%. Fissare i bulbi oculari per 10 minuti. Successivamente, trasferire i bulbi oculari in una capsula di Petri capovolta di 3 o 6 cm.
- Al microscopio da dissezione, praticare una piccola incisione (circa 1-2 mm) sulla cornea utilizzando una pinza fine e forbici oftalmiche. Riposizionare i bulbi oculari nella soluzione di PFA al 4% per ulteriori 2 ore di fissazione sul ghiaccio (Figura 1B).
- Crioprotezione
- Rimuovere il fissativo e lavare i bulbi oculari tre volte con 1 soluzione tampone PBS. Trasferire i bulbi oculari in una provetta da microcentrifuga a fondo tondo da 2 ml contenente 1 ml di soluzione di saccarosio al 30% per crioprotezione a 4 °C. Lascia che i bulbi oculari si depositino sul fondo del tubo o lasciali per una notte.
- Rivestimento del bulbo oculare
- Trasferisci un bulbo oculare su una capsula di Petri capovolta con il lato della cornea rivolto verso l'alto. Tamponare la soluzione in eccesso dalla cornea con un panno privo di lanugine. Immergere un segmento di 2-3 cm di corda da tennis nella colla (composta da cianoacrilati) contenuta in una provetta da microcentrifuga da 0,2 mL, quindi rimuoverla rapidamente.
- Sotto un microscopio da dissezione, attacca un'estremità della corda da tennis con la super colla residua al centro della cornea umida. Lasciare solidificare la colla per 10-20 s. Afferra l'altra estremità della corda da tennis e immergi il bulbo oculare in una provetta da microcentrifuga da 200 μL riempita di super colla, assicurandoti che la sclera sia completamente immersa per circa 1 s.
- Rimuovere rapidamente il bulbo oculare e immergerlo nel PBS (Figura 1C). La colla sulla superficie della sclera si solidificherà immediatamente.
- Rimozione della cornea
- Tamponare l'eccesso di PBS sulla superficie della colla solidificata con un panno privo di lanugine. Sotto un microscopio da dissezione, rimuovere la cornea con le forbici oftalmiche tenendo la corda da tennis attaccata.
- Incorporamento
- Usando una pinza, estrarre con cautela la lente dall'oculare. Assorbire l'eventuale soluzione di saccarosio in eccesso intrappolata all'interno dell'oculare con una striscia di salvietta priva di lanugine. Trasferire l'oculare in uno stampo da incasso riempito con il composto per la temperatura di taglio ottimale (OCT).
- Riempire completamente l'oculare con OCT. Posizionare l'oculare in modo che sia rivolto verso la parete laterale dello stampo da inclusione, assicurandosi che il piano sagittale sia parallelo al fondo dello stampo. Usa il segno blu sulla sclera come riferimento. Trasferire lo stampo per incorporare contenente l'oculare in un congelatore a -80 °C (Figura 1D). L'oculare verrà congelato entro cinque minuti.
- Criosezione
- Trasferire l'oculare congelato in un criostato impostato a -20 °C e lasciarlo equilibrare all'interno della camera per 30 minuti. Sezionare l'oculare con uno spessore di 12 μm. Montare le sezioni su vetrini caricati positivamente per un uso successivo.
3. Colorazione immunoistochimica
- Cottura
- Posizionare le sezioni congelate sui vetrini e cuocerle in forno a 37 °C per 30-60 minuti per garantire una corretta adesione del tessuto al vetrino.
- Lavaggio
- Usando una penna PAP, disegna un cerchio attorno alle sezioni della diapositiva. Immergere il vetrino in un barattolo Coplin contenente 1x tampone PBS. Metti il barattolo Coplin su uno shaker lento e lava le sezioni per 2 × 10 minuti per rimuovere il composto OCT.
- Blocco e permeabilizzazione
- Posizionare il vetrino orizzontalmente in una camera di umidità. Aggiungere la soluzione bloccante alle sezioni cerchiate e lasciare che il blocco e la permeabilizzazione a temperatura ambiente per 30 minuti.
- Incubazione degli anticorpi primari
- Aspirare con cautela la soluzione bloccante dal vetrino. Aggiungere l'anticorpo primario, diluito nella soluzione bloccante, alle sezioni. Incubare le sezioni nella camera di umidità a 4 °C per una notte per garantire un legame ottimale dell'anticorpo all'antigene bersaglio.
- Incubazione secondaria degli anticorpi
- Aspirare la soluzione di anticorpi primari e lavare il vetrino due volte con 1x PBS per 2 × 10 minuti. Aggiungere l'anticorpo secondario appropriato, miscelato con DAPI, e diluito nella soluzione bloccante.
- Incubare le sezioni in una camera di umidità buia a temperatura ambiente per 1 ora per consentire il legame secondario degli anticorpi e la controcolorazione con DAPI.
- Montante
- Aspirare la soluzione di anticorpi secondari e sciacquare il vetrino con 1x PBS per 2 × 10 minuti. Usa un Kimwipe per rimuovere il PBS rimanente sulla diapositiva.
- Applicare una quantità adeguata di mezzo di montaggio antisbiadimento sulle sezioni e coprirle con un vetrino coprioggetti. Conservare i campioni montati a 4 °C al buio per preservare la fluorescenza e prevenire il fotosbiancamento.
4. Imaging
- Acquisire segnali di fluorescenza dalle sezioni retiniche immunocolorate utilizzando un microscopio confocale a scansione laser. Regola le impostazioni per una risoluzione e una sensibilità ottimali per acquisire segnali di fluorescenza chiari e distinti.
- Assicurarsi che vengano utilizzati filtri appropriati per rilevare le lunghezze d'onda specifiche dei fluorofori impiegati nell'esperimento.
Risultati
Seguendo il protocollo sopra descritto, gli occhi di topi C57Bl/6J wild-type di 1 mese sono stati fissati in PFA al 4%. I campioni fissati sono stati quindi incorporati nell'OCT e criosezionati. Le sezioni sono state immunocolorate con un anticorpo anti-PDE6B e controcolorate con DAPI per marcare i nuclei. La PDE6B è una proteina di fototrasduzione specificamente espressa nelle cellule dei fotorecettori dei bastoncelli4. Rispetto ai protocolli tradizionali, questo protocollo migliora significativamente sia la morfologia delle retine di topo che la qualità delle immagini in immunofluorescenza, fornendo una grande coerenza. I risultati rappresentativi dimostrano il successo dell'immunocolorazione delle criosezioni retiniche utilizzando l'anti-PDE6B (Figura 2). I segmenti esterni dei fotorecettori erano chiaramente marcati con anti-PDE6B. Tutti i segmenti esterni dei fotorecettori apparivano morfologicamente intatti e i singoli segmenti erano distinguibili. Non è stato osservato alcun distacco di retina nella sezione. Inoltre, i segmenti interni e lo strato nucleare esterno sono rimasti intatti.
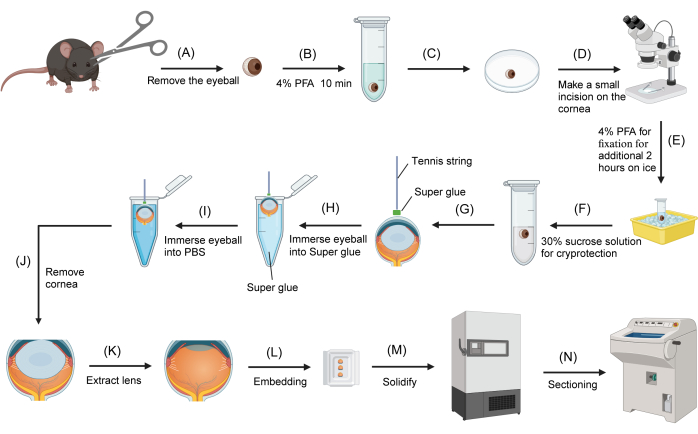
Figura 1: Procedura di criosezione dell'occhio di topo. (A) I bulbi oculari vengono rimossi dai topi sacrificati utilizzando le forbici. (B) I bulbi oculari vengono trasferiti in una provetta da microcentrifuga a fondo tondo da 2 ml contenente il 4% di PFA e fissati per 10 minuti. (C) Un bulbo oculare viene trasferito sulla superficie di una capsula di Petri rovesciata di 3 cm. (D) Al microscopio da dissezione, viene praticata una piccola incisione (circa 1 mm) sulla cornea. (E) Il bulbo oculare viene riportato al fissativo PFA al 4% per un ulteriore fissaggio sul ghiaccio per 2 ore. (F) Il fissativo viene sostituito con saccarosio al 30% per la crioprotezione. (G) La corda da tennis viene immersa nella super colla e l'estremità è attaccata alla superficie centrale della cornea. (H) Dopo che la corda da tennis è stata saldamente attaccata alla cornea, l'altra estremità della corda viene tenuta e il bulbo oculare viene immerso nella colla. (I) Il bulbo oculare viene immediatamente rimosso dalla super colla e immerso nel PBS. (J) Il bulbo oculare viene rimosso dal PBS e la cornea viene tagliata via con le forbici, tenendo l'estremità libera della corda da tennis. (K) La lente viene estratta con una pinza. (L) L'oculare viene trasferito in uno stampo da incasso riempito con OCT. (M) Lo stampo da incasso viene trasferito in un congelatore a -80 °C. (N) Il blocco OCT congelato contenente l'oculare viene sezionato utilizzando un criostato. Clicca qui per visualizzare una versione più grande di questa figura.
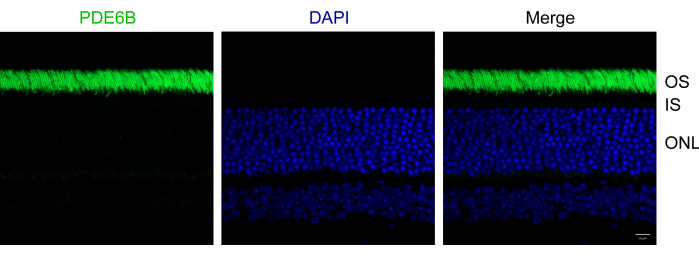
Figura 2: Immagini in immunofluorescenza di sezioni retiniche di topo. Le sezioni retiniche sono state immunocolorate con anti-PDE6B (verde) e controcolorate con DAPI (blu). OS, segmento esterno; IS, segmento interno; ONL, strato nucleare esterno. Barra della scala: 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Una serie di fattori influenza la qualità delle sezioni di tessuto, tra cui la composizione della soluzione di fissaggio, il tempo di fissazione e crioprotezione e i metodi di inclusione5. Quando si enuclea il bulbo oculare dal topo, è essenziale rimuovere i muscoli extraoculari e altro tessuto connettivo attaccato al bulbo oculare. Se non rimossi correttamente, questi tessuti possono causare la deformazione del bulbo oculare durante l'estrazione dall'orbita, portando potenzialmente al distacco della retina. Durante il processo di fissazione, è necessario praticare un'incisione sulla cornea per rilasciare la pressione intraoculare (IOP). Senza questa incisione, il bulbo oculare può restringersi, con conseguente deformazione e distacco della retina. L'aumentata permeabilità del bulbo oculare durante la fissazione consente alla IOP di forzare l'efflusso di umore acqueo dallo spazio intraoculare. Praticando un'incisione nella cornea, la pressione interna del bulbo oculare viene alleviata, il che aiuta a prevenire il restringimento e consente al fissativo di penetrare più efficacemente nello spazio intraoculare per una fissazione ottimale.
La retina è composta da 10 strati di tessuti strutturalmente distinti e delicati. Per preservare l'integrità morfologica, è fondamentale fissare correttamente il tessuto. La soluzione di PFA è comunemente usata come fissativo6, in quanto può essere preparata al momento. L'uso di una soluzione di formalina preconfezionata dovrebbe essere evitato, poiché è soggetto all'ossidazione7, che può portare a una scarsa fissazione e a una morfologia retinica compromessa. Inoltre, la fissazione non deve superare le 2 ore, poiché la fissazione prolungata può causare un'eccessiva autofluorescenza, in particolare nelle cellule dell'epitelio pigmentato retinico (RPE), che può interferire con l'interpretazione dei risultati. Questo problema è spesso osservato nelle sezioni retiniche in paraffina, poiché queste sono tipicamente preparate da bulbi oculari che sono stati fissati per lunghi periodi, a volte durante la notte o anche più a lungo.
In precedenza abbiamo dimostrato che rivestire il bulbo oculare con uno strato di super colla migliora significativamente la qualità delle criosezioni retiniche di topo8. Inizialmente, si utilizzava una punta di pipetta per stendere la super colla sulla superficie della sclera; Tuttavia, questo metodo occasionalmente faceva aderire il bulbo oculare alla superficie di supporto, come la capsula di Petri. Per risolvere questo problema, la tecnica di rivestimento è stata modificata immergendo il bulbo oculare nella colla dopo aver attaccato un segmento di corda da tennis alla cornea9, come descritto nel protocollo sopra. Il segmento della corda da tennis attaccato funge da impugnatura per una facile manipolazione e facilita il successivo taglio e rimozione della cornea.
La distribuzione dei fotorecettori non è omogenea in tutta la retina del topo. In particolare, i fotorecettori dei coni S sono prevalentemente localizzati sul lato inferiore delle retine C57Bl/6J, mentre i coni ML sono distribuiti in modo più uniforme in tutta la retina10. Pertanto, marcare il bulbo oculare prima dell'enucleazione è essenziale per garantire l'orientamento desiderato (dorso-ventrale o nasale-temporale) durante l'elaborazione.
Tuttavia, ci sono limitazioni a questo protocollo. Il topo non viene perfuso prima del sacrificio. Quando l'obiettivo per la marcatura è il sistema vascolare retinico e viene utilizzato un anticorpo secondario anti-topo, può verificarsi una marcatura non specifica dei tessuti vascolari da parte dell'anticorpo secondario. In questi casi, si consiglia di perfondere il mouse prima di sacrificarlo per evitare questo problema.
In sintesi, è stato descritto un protocollo che consente ai ricercatori di produrre costantemente criosezioni retiniche di topo di alta qualità per l'immunocolorazione. Questo protocollo è relativamente facile da seguire, il che lo rende particolarmente utile per i ricercatori con esperienza limitata.
Divulgazioni
Gli autori non hanno conflitti da rivelare.
Riconoscimenti
Questo progetto di ricerca è stato sostenuto dalla National Natural Science Foundation of China (82371059 (H.Z.), 82102470 (J.W.)), Sichuan Science and Technology Program (2023JDZH0002 (H.Z.)).
Materiali
| Name | Company | Catalog Number | Comments |
| -80 °C freezer | Haier | DW-86L626 | |
| Adhesion microscope slides | CITOTEST | 80312-3161 | |
| Alexa488-Goat anti-Rabbit | Proteintech | SA00006-2 | |
| C57BL/6J mouse | The Jackson Laboratory | 664 | |
| Cryosection microtome | Leica | N/A | |
| Cryostat | LEICA | N/A | |
| DAPI | Cell Signaling Technology | 4083S | |
| Dissecting microscope | ZEISS | 3943030830 | |
| Donkey serum | Solarbio | S9100 | |
| Embedding molds | Thermo Fisher Scientific | 1841 | |
| Fine dissection scissors | RWD | S13001-10 | |
| Fine forceps | RWD | F11020-11 | |
| Fluoromount aqueous mounting medium | Sigma-Aldrich | F4680 | |
| Incubator | Shanghai Yuejin | N/A | |
| KCl | Sigma-Aldrich | 1049330500 | |
| KH2PO4 | Sigma-Aldrich | 1048771000 | |
| Kimwipes | Thermo Fisher Scientific | FIS-06666 | |
| Laser confocal microscope | ZEISS | N/A | |
| Microscope cover Glass | CITOTEST | 80340-3610 | |
| Na2HPO4 | Sigma-Aldrich | 1065860500 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NaOH | Sigma-Aldrich | 1091371003 | |
| O.C.T compound | Sakura | 4583 | |
| Pap pen | Sigma-Aldrich | Z672548 | |
| PFA | Sigma-Aldrich | 441244 | |
| Rabbit anti-PDE6B | Proteintech | 22063-1-AP | |
| Shaker | SCILOGEX | 8042210200 | |
| Spring scissors | RWD | S11036-08 | |
| Sucrose | BioFroxx | 1245GR500 | |
| Super glue | Deli | 7147S | |
| Tennis string (1.24 mm) | Gosen | TS761 | |
| Tribromoethanol | Macklin | T831042 | |
| Triton X-100 | Solarbio | IT9100 |
Riferimenti
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: Revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Vet Pathol. 51 (1), 42-87 (2014).
- Usukura, E., et al. A cryosectioning technique for the observation of intracellular structures and immunocytochemistry of tissues in atomic force microscopy (AFM). Sci Rep. 7 (1), 6462 (2017).
- Park, P. S. Supramolecular organization of rhodopsin in rod photoreceptor cell membranes. Pflugers Arch. 473 (9), 1361-1376 (2021).
- Boonstra, H., Oosterhuis, J. W., Oosterhuis, A. M., Fleuren, G. J. Cervical tissue shrinkage by formaldehyde fixation, paraffin wax embedding, section cutting and mounting. Virchows Arch A Pathol Anat Histopathol. 402 (2), 195-201 (1983).
- Stradleigh, T. W., Ishida, A. T. Fixation strategies for retinal immunohistochemistry. Prog Retin Eye Res. 48, 181-202 (2015).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. J Oral Maxillofac Pathol. 16 (3), 400-405 (2012).
- Li, L., et al. An improved method for preparation of mouse retinal cryosections. Eur J Histochem. 64 (3), 3154 (2020).
- Yang, J., et al. A quick protocol for the preparation of mouse retinal cryosections for immunohistochemistry. Open Biol. 11 (7), 210076 (2021).
- Szel, A., et al. Unique topographic separation of two spectral classes of cones in the mouse retina. J Comp Neurol. 325 (3), 327-342 (1992).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon