Method Article
Cryosectionnement et immunomarquage de la rétine de souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un protocole pour la préparation de cryocoupes rétiniennes de souris et la réalisation d’immunomarquage sur les photorécepteurs est décrit. Cet article permet aux chercheurs de produire de manière cohérente des coupes rétiniennes congelées de souris avec une morphologie bien préservée et des résultats d’immunomarquage de haute qualité.
Résumé
La section tissulaire et l’immunohistochimie sont des techniques essentielles dans les études histologiques et pathologiques des maladies rétiniennes à l’aide de modèles animaux. Ces méthodes permettent d’examiner en détail la morphologie des tissus et de localiser des protéines spécifiques dans le tissu, ce qui fournit des informations précieuses sur les processus et les mécanismes de la maladie. Les souris sont le modèle le plus largement utilisé à cet effet. Cependant, étant donné que les globes oculaires de souris sont petits et que les rétines de souris sont des tissus extrêmement délicats, il est généralement difficile d’obtenir des coupes rétiniennes de haute qualité et des images d’immunomarquage à partir de globes oculaires de souris. Cette étude décrit un protocole amélioré pour la cryosection des rétines de souris et la réalisation de l’immunohistochimie. Un point essentiel de ce protocole consiste à recouvrir le globe oculaire d’une couche de super colle, qui empêche la déformation des globes oculaires lors des processus d’ablation de la cornée, d’extraction du cristallin et d’enrobage. Cette étape permet de s’assurer que l’intégrité des morphologies rétiniennes est bien préservée. Ce protocole met en évidence les considérations techniques critiques et les stratégies d’optimisation pour produire constamment des coupes rétiniennes de haute qualité et obtenir d’excellents résultats d’immunomarquage.
Introduction
La cryosection et l’immunohistochimie (IHC) sont des techniques indispensables dans la recherche biomédicale, notamment pour l’étude de structures biologiques complexes telles que la rétine1. Ces méthodologies avancées font partie intégrante de la compréhension de la composition cellulaire complexe et de l’organisation moléculaire de la rétine. Ils offrent aux chercheurs la possibilité d’étudier la fonctionnalité et la pathologie de la rétine à un niveau détaillé, offrant des informations essentielles pour faire progresser les connaissances dans ce domaine.
La cryosection joue un rôle essentiel dans le maintien de l’intégrité morphologique du tissu rétinien. Il garantit que la structure délicate de la rétine reste intacte, ce qui permet d’utiliser des coupes dans des études immunofluorescentes ultérieures avec une précision et une fiabilité élevées. Par rapport à d’autres méthodes, telles que l’enrobage de paraffine, la cryosection présente des avantages significatifs car elle préserve mieux la morphologie et l’antigénicité des tissus, ce qui la rend particulièrement adaptée à la coloration immunohistochimique2. La technique de la section congelée est largement adoptée pour l’étude d’une gamme de tissus complexes et même de structures cellulaires fines3, permettant des analyses précises de leur architecture.
L’IHC est une technique de laboratoire puissante et polyvalente qui permet de visualiser la localisation de protéines spécifiques dans les tissus. Cette technique est devenue une pierre angulaire dans les milieux cliniques et de recherche, où elle est largement utilisée pour le diagnostic, la surveillance des maladies et les investigations biologiques. Le succès d’une expérience IHC dépend en grande partie d’une préparation méticuleuse des échantillons, d’une manipulation soigneuse des tissus et d’un contrôle précis des conditions d’immunomarquage. De petites variations dans le protocole peuvent avoir un impact considérable sur la qualité des résultats, ce qui souligne l’importance de la normalisation et de l’optimisation1.
Lorsqu’elles sont combinées, la cryosection et l’IHC offrent des avantages inégalés aux chercheurs qui cherchent à explorer la distribution spatiale, les niveaux d’expression et les interactions cellulaires de diverses protéines au sein de la rétine. Ces méthodologies permettent d’étudier en détail les mécanismes moléculaires sous-jacents au développement, à la fonction et à la maladie de la rétine. De telles informations sont particulièrement précieuses dans l’étude des troubles rétiniens, notamment la dégénérescence maculaire liée à l’âge, la rétinopathie diabétique et la rétinite pigmentaire. En élucidant la physiopathologie de ces affections, la cryosection et l’IHC contribuent à identifier des biomarqueurs potentiels et à développer de nouvelles stratégies thérapeutiques.
Malgré son utilité, travailler avec des rétines de souris présente des défis uniques. Les souris sont largement utilisées comme modèles animaux dans la recherche ophtalmique en raison de leur similitude génétique avec les humains et de leur structure rétinienne bien caractérisée. Cependant, l’obtention de cryosections de haute qualité est intrinsèquement difficile en raison de la petite taille et de la nature délicate du tissu rétinien de souris. Cette étude fournit une méthodologie détaillée pour la cryosection et la réalisation d’IHC sur les rétines de souris, en mettant en évidence les considérations techniques critiques et en proposant des stratégies d’optimisation pour relever ces défis. En affinant ces techniques, les chercheurs peuvent obtenir des résultats cohérents et de haute qualité, faisant progresser l’étude de la biologie et de la pathologie de la rétine.
Protocole
La procédure a respecté les directives établies par l’Association pour la recherche en vision et en ophtalmologie pour l’utilisation d’animaux dans la recherche. L’approbation a été obtenue du Comité institutionnel de protection et d’utilisation des animaux (IACUC) de l’Hôpital populaire de la province du Sichuan. Des souris mâles C57Bl/6J, âgées de deux à trois mois et pesant de 25 à 30 g, ont été utilisées pour ce protocole. Une liste complète des réactifs et de l’équipement utilisés dans cette étude est fournie dans la table des matériaux.
1. Préparation du réactif
- 1x tampon PBS
- Peser 8 g de NaCl, 1,42 g de Na2HPO4, 0,42 g de KH2PO4 et 0,2 g de KCl à l’aide d’une balance. Transférez-les dans un bécher et ajoutez une quantité appropriée d’eau doublement distillée (ddH2O) pour dissoudre les composants. Verser la solution dans une fiole jaugée de 1 L et régler le volume à 1 L avec jdH2O.
- Solution de paraformaldéhyde (PFA) à 4 %
- Ajouter 0,4 g de poudre de PFA et 15 μL de NaOH 1 M dans un tube conique de 15 mL contenant 8 mL de 1 tampon PBS. Placez le tube dans un bain-marie réglé à 60 °C pour dissoudre complètement la poudre PFA. Ajustez le volume final à 10 ml avec 1x PBS.
- Solution de blocage IHC
- Combinez 1 ml de sérum d’âne normal, 20 μL de 20 % de NaN3, 200 μL de Triton X-100 à 20 % et 18,78 ml de 1 tampon PBS. Mélanger.
- Solution à 30 % de saccharose
- Dissoudre 15 g de saccharose dans 40 mL de 1 tampon PBS. Ajustez le volume à 50 ml avec 1 tampon PBS et mélangez jusqu’à dissolution complète.
- Solution d’anticorps secondaires IHC
- Diluez l’anticorps anti-lapin conjugué à l’Alexa Fluor 488 à un rapport de 1:300 et le DAPI à un rapport de 1:2 000 à l’aide du tampon de blocage préparé.
2. Cryosectionnement du globe oculaire de souris
- Dissection du globe oculaire
- Anesthésier une souris C57Bl/6 âgée de 3 mois (environ 25 g) par injection intrapéritonéale de tribromoéthanol à 2 % à une dose de 15 μL/g de poids corporel. Sacrifiez la souris en utilisant une luxation cervicale (en suivant les protocoles approuvés par l’institution).
- Marquez la face supérieure du globe oculaire à l’aide d’un marqueur bleu sur la sclérotique (figure 1A). Retirez les globes oculaires à l’aide de ciseaux.
- S’il y a du sang à la surface du globe oculaire, essuyez-le doucement à l’aide d’une lingette non pelucheuse. À l’aide d’un microscope à dissection, retirez avec précaution les muscles extraoculaires attachés aux globes oculaires.
- Fixation
- Transférez les globes oculaires disséqués dans un tube de microcentrifugation à fond rond de 2 ml contenant 1 ml de PFA à 4 %. Fixez les globes oculaires pendant 10 min. Par la suite, transférez les globes oculaires dans une boîte de Pétri inversée de 3 ou 6 cm.
- Sous un microscope à dissection, faites une petite incision (environ 1 à 2 mm) sur la cornée à l’aide d’une pince fine et de ciseaux ophtalmiques. Remettez les globes oculaires dans la solution de PFA à 4 % pour une durée supplémentaire de 2 h de fixation sur la glace (figure 1B).
- Cryoprotection
- Retirez le fixateur et lavez les globes oculaires trois fois avec 1 solution tampon PBS. Transférez les globes oculaires dans un tube de microcentrifugation à fond rond de 2 ml contenant 1 ml de solution de saccharose à 30 % pour une cryoprotection à 4 °C. Laissez les globes oculaires se déposer au fond du tube ou laissez-les toute la nuit.
- Revêtement du globe oculaire
- Transférez un globe oculaire sur une boîte de Pétri inversée avec le côté cornée vers le haut. Épongez l’excès de solution de la cornée à l’aide d’une lingette non pelucheuse. Trempez un segment de corde de tennis de 2 à 3 cm dans la colle (composée de cyanoacrylates) contenue dans un tube de microcentrifugation de 0,2 ml, puis retirez-le rapidement.
- Sous un microscope à dissection, fixez une extrémité de la corde de tennis avec de la super colle résiduelle au centre de la cornée humide. Laissez la colle se solidifier pendant 10 à 20 s. Saisissez l’autre extrémité de la corde de tennis et trempez le globe oculaire dans un tube de microcentrifugation de 200 μL rempli de super colle, en vous assurant que la sclère est complètement immergée pendant environ 1 s.
- Retirez rapidement le globe oculaire et plongez-le dans du PBS (Figure 1C). La colle sur la surface de la sclère se solidifiera immédiatement.
- Ablation de la cornée
- Épongez l’excès de PBS sur la surface de la colle solidifiée à l’aide d’une lingette non pelucheuse. Sous un microscope à dissection, retirez la cornée avec des ciseaux ophtalmiques tout en tenant la corde de tennis attachée.
- Encastrement
- À l’aide d’une pince, extrayez soigneusement la lentille de l’œilleton. Absorbez tout excès de solution de saccharose piégé dans l’œilleton avec une bande de lingette non pelucheuse. Transférez l’œilleton dans un moule d’enrobage rempli du composé de température de coupe optimale (OCT).
- Remplissez complètement l’œilleton avec de l’OCT. Positionnez l’œilleton de manière à ce qu’il fasse face à la paroi latérale du moule d’enrobage, en veillant à ce que le plan sagittal soit parallèle au fond du moule. Utilisez le repère bleu sur la sclérotique comme référence. Transférez le moule d’enrobage contenant l’œilleton dans un congélateur à -80 °C (Figure 1D). L’œilleton sera congelé dans les cinq minutes.
- Cryosectionnement
- Transférez l’œilleton congelé dans un cryostat réglé à -20 °C et laissez-le s’équilibrer dans la chambre pendant 30 min. Sectionnez l’œilleton à une épaisseur de 12 μm. Montez les sections sur des lames de verre chargées positivement pour une utilisation ultérieure.
3. Coloration immunohistochimique
- Cuisson
- Placez les sections congelées sur des lames et faites-les cuire dans un four à 37 °C pendant 30 à 60 minutes pour assurer une bonne adhérence du tissu à la lame.
- Lavage
- À l’aide d’un stylo PAP, dessinez un cercle autour des sections de la diapositive. Plongez la diapositive dans un bocal Coplin contenant 1 tampon PBS. Placez le pot Coplin sur un agitateur lent et lavez les sections pendant 2 × 10 minutes pour éliminer le composé OCT.
- Blocage et perméabilisation
- Placez la lame horizontalement dans une chambre d’humidité. Ajouter la solution de blocage aux sections encerclées et permettre le blocage et la perméabilisation à température ambiante pendant 30 min.
- Incubation primaire de l’anticorps
- Aspirez soigneusement la solution de blocage de la lame. Ajouter l’anticorps primaire, dilué dans la solution bloquante, dans les sections. Incuber les sections dans la chambre d’humidité à 4 °C pendant la nuit pour assurer une liaison optimale de l’anticorps à l’antigène cible.
- Incubation secondaire d’anticorps
- Aspirez la solution d’anticorps primaire et lavez la lame deux fois avec 1x PBS pendant 2 × 10 min. Ajouter l’anticorps secondaire approprié, mélangé à du DAPI et dilué dans la solution bloquante.
- Incuber les sections dans une chambre d’humidité sombre à température ambiante pendant 1 h pour permettre la liaison secondaire des anticorps et la contre-coloration avec DAPI.
- Montage
- Aspirez la solution d’anticorps secondaire et rincez la lame avec 1x PBS pendant 2 × 10 min. Utilisez un Kimwipe pour effacer tout PBS restant sur la diapositive.
- Appliquez une quantité appropriée de support de montage anti-décoloration sur les sections et couvrez-les d’une lamelle. Stockez les échantillons montés à 4 °C dans l’obscurité pour préserver la fluorescence et éviter le photoblanchiment.
4. Imagerie
- Acquérez des signaux de fluorescence à partir des coupes rétiniennes immunomarquées à l’aide d’un microscope confocal à balayage laser. Ajustez les paramètres pour une résolution et une sensibilité optimales afin de capturer des signaux de fluorescence clairs et distincts.
- S’assurer que des filtres appropriés sont utilisés pour détecter les longueurs d’onde spécifiques des fluorophores utilisés dans l’expérience.
Résultats
En suivant le protocole décrit ci-dessus, les yeux de souris C57Bl/6J de type sauvage âgées de 1 mois ont été fixés dans 4 % de PFA. Les échantillons fixés ont ensuite été intégrés dans l’OCT et cryosectionnés. Les coupes ont été immunomarquées avec un anticorps anti-PDE6B et contre-colorées avec du DAPI pour marquer les noyaux. La PDE6B est une protéine de phototransduction spécifiquement exprimée dans les cellules photoréceptrices des bâtonnets4. Par rapport aux protocoles traditionnels, ce protocole améliore significativement à la fois la morphologie des rétines de souris et la qualité des images immunofluorescentes, offrant une grande cohérence. Les résultats représentatifs démontrent une immunocoloration réussie des cryosections rétiniennes à l’aide d’anti-PDE6B (Figure 2). Les segments externes des photorécepteurs ont été clairement marqués avec de l’anti-PDE6B. Tous les segments externes des photorécepteurs semblaient morphologiquement intacts, et des segments individuels étaient discernables. Aucun décollement de la rétine n’a été observé dans la coupe. De plus, les segments internes et la couche nucléaire externe sont restés intacts.
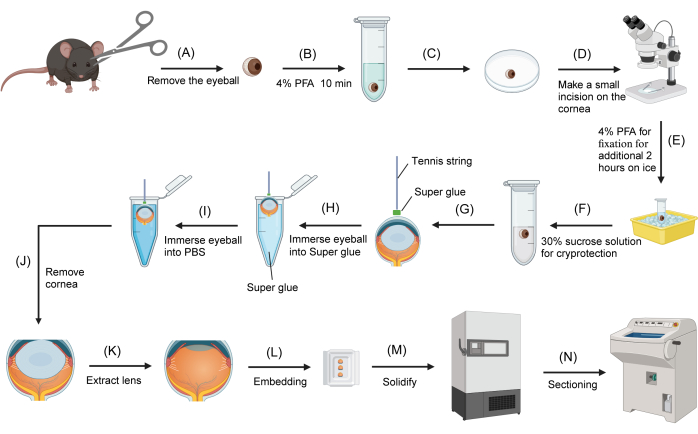
Figure 1 : Procédure de cryosection des yeux de souris. (A) Les globes oculaires sont retirés des souris sacrifiées à l’aide de ciseaux. (B) Les globes oculaires sont transférés dans un tube de microcentrifugation à fond rond de 2 mL contenant 4 % de PFA et fixés pendant 10 min. (C) Un globe oculaire est transféré à la surface d’une boîte de Pétri inversée de 3 cm. (D) Sous un microscope à dissection, une petite incision (environ 1 mm) est pratiquée sur la cornée. (E) Le globe oculaire est renvoyé dans le fixateur PFA à 4 % pour une fixation supplémentaire sur la glace pendant 2 h. (F) Le fixateur est remplacé par du saccharose à 30 % pour la cryoprotection. (G) La corde de tennis est trempée dans de la super colle et l’extrémité est fixée à la surface centrale de la cornée. (H) Une fois que la corde de tennis est fermement attachée à la cornée, l’autre extrémité de la corde est maintenue et le globe oculaire est immergé dans la colle. (I) Le globe oculaire est immédiatement retiré de la super colle et immergé dans du PBS. (J) Le globe oculaire est retiré du PBS et la cornée est coupée avec des ciseaux, en tenant l’extrémité libre de la corde de tennis. (K) L’objectif est extrait à l’aide d’une pince. (L) L’œilleton est transféré dans un moule d’enrobage rempli d’OCT. (M) Le moule d’enrobage est transféré dans un congélateur à -80 °C. (N) Le bloc OCT congelé contenant l’œilleton est sectionné à l’aide d’un cryostat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
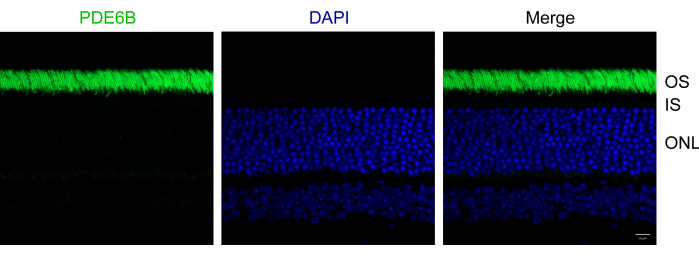
Figure 2 : Images immunofluorescentes de coupes rétiniennes de souris. Les coupes rétiniennes ont été immunomarquées avec de l’anti-PDE6B (vert) et contre-colorées avec du DAPI (bleu). OS, segment externe ; IS, segment interne ; ONL, couche nucléaire externe. Barre d’échelle : 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Un certain nombre de facteurs influencent la qualité des coupes de tissus, notamment la composition de la solution de fixation, le temps de fixation et de cryoprotection et les méthodes d’enrobage5. Lors de l’activation du globe oculaire de la souris, il est essentiel de retirer les muscles extraoculaires et autres tissus conjonctifs attachés au globe oculaire. S’ils ne sont pas correctement retirés, ces tissus peuvent provoquer une déformation du globe oculaire lors de l’extraction de l’orbite, entraînant potentiellement un décollement de la rétine. Au cours du processus de fixation, une incision doit être pratiquée sur la cornée pour relâcher la pression intraoculaire (PIO). Sans cette incision, le globe oculaire peut rétrécir, entraînant une déformation et un décollement de la rétine. L’augmentation de la perméabilité du globe oculaire lors de la fixation permet à la PIO de forcer l’efflux d’humeur aqueuse de l’espace intraoculaire. En faisant une incision dans la cornée, la pression interne du globe oculaire est soulagée, ce qui aide à prévenir le rétrécissement et permet au fixateur de pénétrer plus efficacement dans l’espace intraoculaire pour une fixation optimale.
La rétine se compose de 10 couches de tissus structurellement distincts et délicats. Pour préserver l’intégrité morphologique, il est crucial de bien fixer les tissus. La solution PFA est couramment utilisée comme fixateur6, car elle peut être fraîchement préparée. L’utilisation d’une solution de formol préfabriquée doit être évitée, car elle est sujette à l’oxydation7, ce qui peut entraîner une mauvaise fixation et une morphologie rétinienne compromise. De plus, la fixation ne doit pas dépasser 2 h, car une fixation prolongée peut provoquer une autofluorescence excessive, en particulier dans les cellules de l’épithélium pigmentaire rétinien (EPR), ce qui peut interférer avec l’interprétation des résultats. Ce problème est souvent observé dans les coupes rétiniennes à la paraffine, car celles-ci sont généralement préparées à partir de globes oculaires qui ont été fixés pendant de longues périodes, parfois pendant la nuit ou même plus longtemps.
Nous avons précédemment démontré que le revêtement du globe oculaire avec une couche de super colle améliore considérablement la qualité des cryosections rétiniennes de souris8. Initialement, une pointe de pipette était utilisée pour étaler de la super colle sur la surface de la sclérotique ; Cependant, cette méthode a parfois fait adhérer le globe oculaire à la surface de support, telle que la boîte de Pétri. Pour résoudre ce problème, la technique de revêtement a été modifiée en trempant le globe oculaire dans la colle après avoir fixé un segment de corde de tennis à la cornée9, comme décrit dans le protocole ci-dessus. Le segment de corde de tennis attaché sert de poignée pour une manipulation facile et facilite la coupe et l’ablation ultérieures de la cornée.
La distribution des photorécepteurs n’est pas homogène sur la rétine de la souris. Plus précisément, les photorécepteurs du cône S sont principalement localisés sur le côté inférieur des rétines C57Bl/6J, tandis que les cônes ML sont répartis plus uniformément dans toute la rétine10. Par conséquent, le marquage du globe oculaire avant l’énucléation est essentiel pour assurer l’orientation souhaitée (dorsale-ventrale ou nasale-temporale) pendant le traitement.
Cependant, il existe des limites à ce protocole. La souris n’est pas perfusée avant le sacrifice. Lorsque la cible du marquage est le système vasculaire rétinien et qu’un anticorps secondaire anti-souris est utilisé, un marquage non spécifique des tissus vasculaires par l’anticorps secondaire peut se produire. Dans de tels cas, nous vous recommandons de perfuser la souris avant de la sacrifier pour éviter ce problème.
En résumé, un protocole a été décrit qui permet aux chercheurs de produire régulièrement des cryosections rétiniennes de souris de haute qualité pour l’immunomarquage. Ce protocole est relativement facile à suivre, ce qui le rend particulièrement utile pour les chercheurs ayant une expérience limitée.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce projet de recherche a été soutenu par la Fondation nationale des sciences naturelles de Chine (82371059 (H.Z.), 82102470 (J.W.)), Sichuan Science and Technology Program (2023JDZH0002 (H.Z.)).
matériels
| Name | Company | Catalog Number | Comments |
| -80 °C freezer | Haier | DW-86L626 | |
| Adhesion microscope slides | CITOTEST | 80312-3161 | |
| Alexa488-Goat anti-Rabbit | Proteintech | SA00006-2 | |
| C57BL/6J mouse | The Jackson Laboratory | 664 | |
| Cryosection microtome | Leica | N/A | |
| Cryostat | LEICA | N/A | |
| DAPI | Cell Signaling Technology | 4083S | |
| Dissecting microscope | ZEISS | 3943030830 | |
| Donkey serum | Solarbio | S9100 | |
| Embedding molds | Thermo Fisher Scientific | 1841 | |
| Fine dissection scissors | RWD | S13001-10 | |
| Fine forceps | RWD | F11020-11 | |
| Fluoromount aqueous mounting medium | Sigma-Aldrich | F4680 | |
| Incubator | Shanghai Yuejin | N/A | |
| KCl | Sigma-Aldrich | 1049330500 | |
| KH2PO4 | Sigma-Aldrich | 1048771000 | |
| Kimwipes | Thermo Fisher Scientific | FIS-06666 | |
| Laser confocal microscope | ZEISS | N/A | |
| Microscope cover Glass | CITOTEST | 80340-3610 | |
| Na2HPO4 | Sigma-Aldrich | 1065860500 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NaOH | Sigma-Aldrich | 1091371003 | |
| O.C.T compound | Sakura | 4583 | |
| Pap pen | Sigma-Aldrich | Z672548 | |
| PFA | Sigma-Aldrich | 441244 | |
| Rabbit anti-PDE6B | Proteintech | 22063-1-AP | |
| Shaker | SCILOGEX | 8042210200 | |
| Spring scissors | RWD | S11036-08 | |
| Sucrose | BioFroxx | 1245GR500 | |
| Super glue | Deli | 7147S | |
| Tennis string (1.24 mm) | Gosen | TS761 | |
| Tribromoethanol | Macklin | T831042 | |
| Triton X-100 | Solarbio | IT9100 |
Références
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: Revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Vet Pathol. 51 (1), 42-87 (2014).
- Usukura, E., et al. A cryosectioning technique for the observation of intracellular structures and immunocytochemistry of tissues in atomic force microscopy (AFM). Sci Rep. 7 (1), 6462 (2017).
- Park, P. S. Supramolecular organization of rhodopsin in rod photoreceptor cell membranes. Pflugers Arch. 473 (9), 1361-1376 (2021).
- Boonstra, H., Oosterhuis, J. W., Oosterhuis, A. M., Fleuren, G. J. Cervical tissue shrinkage by formaldehyde fixation, paraffin wax embedding, section cutting and mounting. Virchows Arch A Pathol Anat Histopathol. 402 (2), 195-201 (1983).
- Stradleigh, T. W., Ishida, A. T. Fixation strategies for retinal immunohistochemistry. Prog Retin Eye Res. 48, 181-202 (2015).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. J Oral Maxillofac Pathol. 16 (3), 400-405 (2012).
- Li, L., et al. An improved method for preparation of mouse retinal cryosections. Eur J Histochem. 64 (3), 3154 (2020).
- Yang, J., et al. A quick protocol for the preparation of mouse retinal cryosections for immunohistochemistry. Open Biol. 11 (7), 210076 (2021).
- Szel, A., et al. Unique topographic separation of two spectral classes of cones in the mouse retina. J Comp Neurol. 325 (3), 327-342 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon