Method Article
Isolamento di cellule stromali mesenchimali umane derivate dal cordone ombelicalead altoMFGE8
In questo articolo
Riepilogo
L'isolamento delle MSCalteMFGE8 di BAMBI, uno dei tre principali sottogruppi che costituiscono UC-MSC umane eterogenee, è utile per comprendere appieno le caratteristiche e le funzioni di questo sottotipo per la sua futura applicazione per migliorare l'efficacia clinica in malattie specifiche. Qui, presentiamo un metodo per lo smistamento di BAMBIhighMFGE8high UC-MSC.
Abstract
Le cellule mesenchimali stromali/staminali derivate dal cordone ombelicale (UC-MSC) presentano una bassa immunogenicità e potenti effetti immunomodulatori per il trattamento di varie malattie. Le UC-MSC umane sono una popolazione eterogenea composta da tre sottopopolazioni principali con diverse forme cellulari, tassi di proliferazione, capacità di differenziazione e funzioni di regolazione immunitaria. In precedenza, le UC-MSCad altoMFGE8di BAMBI, il primo sottogruppo isolato con successo dalle UC-MSC, non riuscivano ad alleviare la nefrite lupica. Pertanto, la funzione e il meccanismo sottostante di questo sottogruppo nella terapia delle MSC per le malattie rimangono sconosciuti. È necessario isolare e studiare ulteriormentele UC-MSCad altoMFGE8 di BAMBI in termini di fenotipo, metabolismo e funzione per comprendere completamente la natura di questo sottogruppo di MSC. In questo protocollo, descriviamo un metodo dettagliato per isolare la sottopopolazioneBAMBI ad altoMFGE8 da UC-MSC umane. La sottopopolazione di UC-MSC è marcata con due marcatori di superficie, BAMBI e MFGE8, mediante smistamento con citometria a flusso. Le cellule isolate vengono coltivate e verificate mediante analisi di citometria a flusso. I geni specifici espressi nelle UC-MSC alte MFGE8di BAMBIsonoidentificati mediante RT-qPCR. Questo protocollo consente di ottenere un sorting cellulare altamente efficiente e puro e descrive i profili dei marcatoridelle UC-MSCBAMBI ad altoMFGE8.
Introduzione
Le cellule stromali/staminali mesenchimali umane (MSC) sono progenitori somatici in grado di differenziarsi in osteociti, adipociti, condrociti e altri tipi di cellule1. Le MSC sono state isolate per la prima volta dal midollo osseo e sono ampiamente derivate dal cordone ombelicale, dal tessuto adiposo e da altri tessuti2. Poiché le UC-MSC sono facilmente ottenibili e mostrano una bassa immunogenicità ed effetti immunosoppressivi, sono ampiamente applicate negli studi clinici per il trattamento di varie malattie 3,4,5. Sebbene la terapia con MSC mostri un potenziale promettente per il trattamento delle malattie, gli effetti terapeutici sono incoerenti tra gli individui6. Tuttavia, il motivo dell'instabilità della terapia con MSC non è ancora chiaro.
Le fluttuazioni molecolari, la morfologia, la capacità di differenziazione e la funzione terapeutica comprendono l'eterogeneità delle MSC. Alcuni studi hanno anche postulato che le MSC costituiscano sottopopolazioni con funzioni diverse 7,8 e hanno esplorato l'eterogeneità delle MSC tramite il sequenziamento dell'RNA a singola cellula (scRNA-seq)9,10. I risultati hanno rivelato che le UC-MSC umane hanno sottopopolazioni distinte con specifiche caratteristiche trascrittomiche, mentre pochi studi hanno isolato con successo le cosiddette sottopopolazioni di MSC. In precedenza abbiamo sezionato le UC-MSC umane in tre sottogruppi in base alle loro firme tramite scRNA-seq e analisi bioinformatiche, in cui la sottopopolazione di BAMBIad altoMFGE8UC-MSC è stata ulteriormente purificata e testata funzionalmente11. Tuttavia, questo sottogruppo non è riuscito ad alleviare la nefrite lupica. Pertanto, è necessario testare gli effetti terapeutici delle MSCalteMFGE8 di BAMBI in altri disturbi per comprendere le loro funzioni autentiche.
Questo protocollo descrive i metodi per isolare il sottogruppoBAMBI highMFGE8 high da UC-MSC umane tramite smistamento cellulare attivato da fluorescenza (FACS) mediante citometria a flusso e le caratteristiche del sottogruppoBAMBI highMFGE8 high.
Protocollo
Questo studio è stato condotto in conformità con i principi stabiliti nella Dichiarazione di Helsinki del 1989 e approvato dal Comitato Etico presso l'Ospedale Affiliato Drum Tower della Nanjing University Medical School (numero di approvazione: 202019701). I cordoni ombelicali umani sono stati ottenuti da madri sane presso l'Affiliated Drum Tower Hospital della Nanjing University Medical School dopo il travaglio naturale, che hanno dato il loro consenso informato per il loro uso in questo lavoro. Le UC-MSC primarie sono state isolate dal cordone ombelicale umano, come precedentemente riportato11.
1. Coltura e identificazione delle UC-MSC prima dell'isolamento
- Una volta che le MSC raggiungono il 70-80% di confluenza (P0), lavare le cellule una volta con PBS e aggiungere 1 mL di tripsina-EDTA allo 0,25% per 2 minuti a 37 °C. Quindi, aggiungere 9 mL di terreno completo per neutralizzare la tripsina, trasferire la sospensione cellulare in una provetta da centrifuga da 15 mL e centrifugare a 300 × g per 5 minuti per raccogliere le cellule. Scartare il surnatante e aggiungere il terreno completo appropriato per risospendere le cellule. Trasferire le cellule in ciascuna piastra in tre fiasche T75 (P1) e la coltura in un incubatore cellulare a 37 °C e 5% di CO2.
- Dopo aver fatto passare le UC-MSC 2x tramite tripsinizzazione, a P3, raccogliere le cellule attraverso gli stessi passaggi descritti nel passaggio 1.1. Dopo la centrifugazione, scartare il surnatante. Risospendere le cellule nel tampone di colorazione FACS (1x PBS contenente il 2% di FBS) e contarle. Aggiungere il tampone di colorazione FACS a una concentrazione finale di 5-10 × 106 cellule/mL e mantenere la sospensione cellulare sul ghiaccio.
- Distribuire 100 μl per provetta di questa sospensione cellulare in diverse provette da 1,5 mL. Aggiungere controlli isotipici e anticorpi FACS contro CD29, CD73, CD90, CD105, CD14, CD34, CD45, CD79 e HLA-DR (tutti a 1:200) alle cellule a 4 °C per 30 minuti.
- Lavare le cellule 2 volte con il tampone di colorazione FACS e centrifugare a 300 × g per 5 minuti. Scartare il surnatante e risospendere i precipitati in 200 μL di tampone di colorazione FACS per l'analisi della citometria a flusso per identificare i marcatori MSC.
2. Isolamento di UC-MSC alte MFGE8di BAMBImediante citometria a flusso
- Coltura di UC-MSC a una densità di circa 5-10 × 106 cellule durante l'isolamento di BAMBIhighMFGE8high UC-MSCs. Dissociare le cellule con EDTA 0,5 mM per 5 minuti fino a quando iniziano ad avere una morfologia rotonda, aggiungere il terreno completo per trasferire le cellule in una provetta conica da 15 mL e pipettare la sospensione cellulare su e giù più volte per preparare una sospensione a cellula singola. Utilizzare 10 μl di sospensione cellulare per contare le cellule e calcolare il numero totale di cellule raccolte. Centrifugare la provetta conica con la sospensione cellulare a 300 × g per 5 minuti per raccogliere le cellule.
- Risospendere le cellule in 1 mL di terreno completo fino a una concentrazione finale di 5-10 × 106 cellule/mL e mantenere la sospensione cellulare in ghiaccio.
- Dividere le cellule in quattro provette per microcentrifuga da 1,5 mL (solo celle vuote; cellule marcate con BAMBI; celle marcate con MFGE8; e cellule marcate con BAMBI e MFGE8).
- Aggiungere anticorpi primari a concentrazioni appropriate (MFGE8 e BAMBI, entrambi a 1:100) alle provette, mescolare e incubare le cellule a temperatura ambiente per 15 minuti.
- Lavare una volta le cellule marcate con 1x PBS e centrifugare a 300×g per 5 minuti. Scartare il surnatante. Risospendere le cellule in 1 mL di terreno completo, aggiungere anticorpi secondari fluorescenti coniugati (IgG H&L Alexa Fluor 488 e Alexa Fluor 647 di capra anti-coniglio, tutti a 1:1.000) alle cellule, mescolare e incubare le cellule a temperatura ambiente per 15 minuti al buio.
- Lavare una volta le celle marcate con 1x PBS, come descritto al punto 2.5. Risospendere le cellule in 500 μL di terreno completo, filtrare attraverso un filtro cellulare da 70 μm per eliminare grumi e detriti e trasferire il filtrato in una provetta da 15 mL per lo smistamento della citometria a flusso.
- Far scorrere la provetta di cellule vuote senza aggiungere un anticorpo (controllo negativo) e regolare la dispersione diretta (FSC) e la dispersione laterale (SSC) per superare la scala della popolazione negativa con la colorazione anticorpale.
- Esegui le singole provette cellulari marcate con anticorpi (ad esempio, MFGE8 + IgG H&L Alexa Fluor 488 di capra anti-coniglio, o BAMBI + IgG ANTI-CONIGLIO DI CAPRA H&L Alexa Fluor 647) come controllo di gating per determinare dove inizia la positività nel grafico.
- Eseguire le provette del campione sperimentale per ordinare e raccogliere la popolazione cellulareBAMBI ad altoMFGE8.
- Placcare le MSC BAMBIhighMFGE8high in una piastra a 24 pozzetti e coltivare le cellule in un incubatore cellulare a 37 °C e 5% di CO2.
- Quando le MSC BAMBIhighMFGE8selezionate sono cresciute per due passaggi per ottenere un numero sufficiente di cellule, dissociare le cellule ed eseguire un'analisi post-selezione per garantire la purezza delle popolazioni cellulari selezionate mediante citometria a flusso, come descritto nei passaggi 2.1-2.9. In alternativa, esaminare la purezza delle cellule selezionate con l'immunofluorescenza convenzionale rispetto all'espressione umana di BAMBI e MFGE8 se il numero di cellule raccolte è troppo piccolo.
3. Caratterizzazione dellealte MSC di BAMBIad alto MFGE8
- Coltiva le MSC BAMBIhighMFGE8selezionate in una piastra a 12 pozzetti, esamina la loro morfologia cellulare al microscopio e confrontale con quella delle MSC non selezionate.
NOTA: In generale, le cellule adaltoMFGE8 di BAMBI crescono più velocemente delle UC-MSC non selezionate. - Quando le cellule sono confluenti per circa il 90% nella piastra a 12 pozzetti, aspirare il terreno di coltura cellulare, lavare le cellule una volta con 1x PBS e aggiungere 500 μL di reagente di estrazione dell'RNA alle cellule. Agitare lentamente la piastra a temperatura ambiente (RT) per 5 min.
- Pipettare la miscela e trasferirla in una provetta priva di RNasi e DNasi. Aggiungere 100 μl di cloroformio, tappare la provetta e agitare energicamente la miscela agitando per 15 s. Quindi, lasciare che il tubo rimanga in RT per 3 minuti.
- Centrifugare la provetta per 15 minuti a 11.000 × g e 4 °C.
- Trasferire circa 200 μl dello strato acquoso superiore in una nuova provetta. Aggiungere lo stesso volume di isopropanolo e pipettare accuratamente su e giù più volte. Quindi, lasciare riposare il composto a RT per 10 minuti.
- Centrifugare per 15 minuti a 11.000 × g e 4 °C. Scartare il surnatante.
- Aggiungere 500 μl di etanolo al 75% al pellet nella provetta e capovolgere delicatamente la provetta più volte.
- Centrifugare la provetta per 5 minuti a 6.000 × g e 4 °C. Scartare il surnatante. Ripetere la centrifugazione una volta per 10 s a 6.000 × g, aspirare con cura il liquido rimanente tramite pipetta e asciugare la provetta a RT.
- Aggiungere 10 μL di acqua priva di RNasi per sciogliere il pellet di RNA e misurare la concentrazione di RNA utilizzando uno spettrofotometro.
- Seguire le istruzioni del produttore per sintetizzare il cDNA del primo filamento fino a 1 μg di RNA totale.
- Utilizzare un kit qPCR per rilevare e quantificare l'espressione genica, secondo le istruzioni del produttore.
NOTA: Le sequenze dei primer di DNA utilizzati sono elencate nella Tabella 1.
Risultati
La Figura 1 mostra i profili di espressione dei marcatori di superficie cellulare delle UC-MSC umane. Le MSC in coltura erano fortemente positive per l'espressione di CD44, CD73, CD90 e CD105 e negative per l'espressione di CD14, CD34, CD45, CD79 e HLA-DR. Le MSCalte di BAMBIMFGE8sono state selezionate da UC-MSC umane coltivate e la loro espressione di BAMBI e MFGE8 è stata rianalizzata mediante citometria a flusso dopo l'espansione per 3-4 passaggi (Figura 2). In questo processo, la frequenza delle MSCalteMFGE8di BAMBI fluttuava a seconda del donatore e del metodo di dissociazione (Figura 3 e Figura 4). La Figura 5 mostra una serie di geni altamente espressi nelle MSCalte di BAMBIad altoMFGE8 rispetto alle MSC non selezionate, come determinato mediante RT-qPCR.
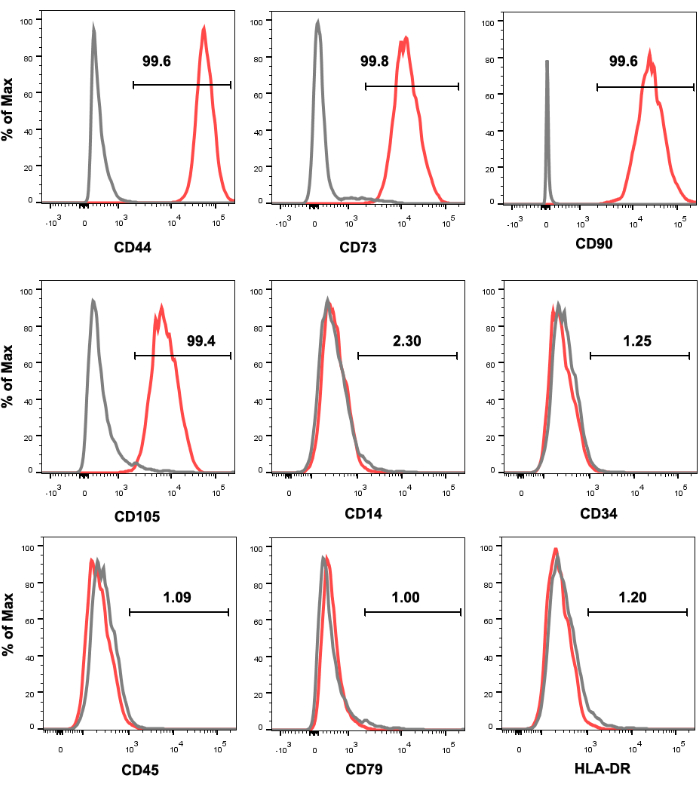
Figura 1: Immunofenotipizzazione delle UC-MSC identificate mediante analisi di citometria a flusso. Le UC-MSC sono positive per CD44, CD73, CD90 e CD105 e negative per CD14, CD34, CD45, CD79 e HLA-DR. L'istogramma nero rappresenta il controllo dell'isotipo anticorpale e l'istogramma rosso rappresenta il segnale anticorpale. Abbreviazioni: UC-MSCs = cellule mesenchimali stromali/staminali derivate dal cordone ombelicale; HLA-DR = antigene leucocitario umano-DR. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Purezza delle MSCad altoMFGE8 di BAMBI dopo la selezione mediante analisi di citometria a flusso. Vengono mostrati i risultati dell'analisi in citometria a flusso di UC-MSC senza colorazione con anticorpi (in alto a sinistra) e con colorazione MFGE8 e BAMBI prima (in alto, al centro) e dopo lo smistamento delle cellule (in alto a destra). Vengono mostrati anche i risultati della colorazione MFGE8 singola (in basso a sinistra) e BAMBI (in basso a destra). Abbreviazioni: BAMBI = proteina morfogenica ossea e inibitore legato alla membrana dell'activina; MFGE8 = fattore di crescita epidermico del globulo grasso del latte 8; MSC = cellule mesenchimali stromali/staminali. Clicca qui per visualizzare una versione più grande di questa figura.
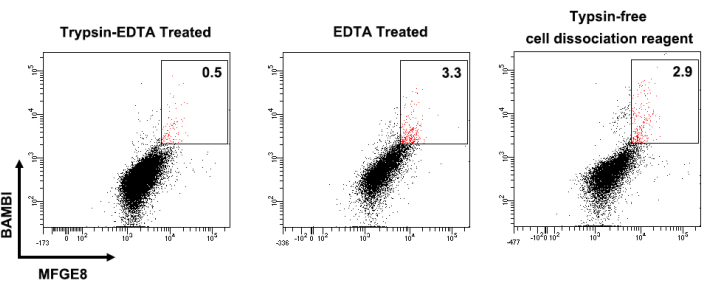
Figura 3: Diverse frequenze di MSCad altoMFGE8 di BAMBI dissociate con metodi diversi. Vengono mostrati i risultati dell'analisi di citometria a flusso di UC-MSC dello stesso donatore sottoposto a dissociazione tripsina-EDTA (a sinistra), solo trattamento con EDTA (al centro) e reagente di dissociazione cellulare privo di tripsina (a destra). Abbreviazioni: BAMBI = proteina morfogenica ossea e inibitore legato alla membrana dell'activina; MFGE8 = fattore di crescita epidermico del globulo grasso del latte 8; MSC = cellule mesenchimali stromali/staminali; TE = tripsina-EDTA. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: La frequenza delle MSCalteMFGE8di BAMBI da diversi donatori. Le frequenze delle MSCalteMFGE8di BAMBI variano tra i campioni del donatore 1 (a sinistra), 2 (al centro) e 3 (a destra). Abbreviazioni: BAMBI = proteina morfogenica ossea e inibitore legato alla membrana dell'activina; MFGE8 = fattore di crescita epidermico del globulo grasso del latte 8; MSC = cellule mesenchimali stromali/staminali. Clicca qui per visualizzare una versione più grande di questa figura.
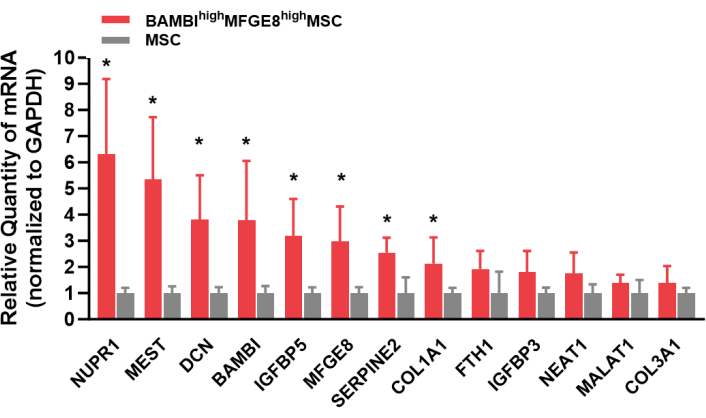
Figura 5: Geni di firma altamente espressi nelle MSCaltedi BAMBI MFGE8esaminate mediante RT-qPCR. Abbreviazioni: BAMBI = proteina morfogenica ossea e inibitore legato alla membrana dell'activina; MFGE8 = fattore di crescita epidermico del globulo grasso del latte 8; MSC = cellule mesenchimali stromali/staminali; RT-qPCR = reazione a catena della polimerasi quantitativa a trascrizione inversa. T-test dello studente. *, P<0.05. Clicca qui per visualizzare una versione più grande di questa figura.
| Abbecedario | Sequenza in avanti (5'-3') | Sequenza inversa (5'-3') |
| BAMBI | CGCCACTCCAGCTACATCTT | CAGTGGGCAGCATCACAGTA |
| COL1A1 | CAAAGAAGGCGGCAAAGGTC | CACGCTGTCCAGCAATACCT |
| COL3A1 | CCTTCGACTTCTCTCCAGCC | TTTCGTGCAACCATCCTCCA |
| Centrale | GGCTGGACCGTTTCAACAGA | GATGGCATTGACAGCGGAAG |
| PULITO1 | CACAGGCAGGGGAAATGTCT | TGCTGCGTATGCAAGTCTGA |
| FTH1 | AGCTCTACGCCTCCTACGTT | CCTGAAGGAAGATTCGGCCA |
| Pannello IGFBP3 | GCCAGCGCTACAAAGTTGAC | ATGTGTACACCCCTGGGACT |
| Pannello IGFBP5 | TCCCCACGTGTGTTCATCTG | AAATGGGATGGACTGAGGCG |
| MALAT1 | TGGGGGAGTTTCGTACTGAG | TCTCCAGGACTTGGCAGTCT |
| MEST | TGGGAGCTCTTGCCTCTGTA | AGAATCGACACTGTGGACCG |
| MFGE8 | TGTCTTCCCCTCGTACACCT | AGAAGGTCACACGCACAGAC |
| SERPINE2 | GTCCTCGTCAACGCAGTGTA | GTCCTCGTCAACGCAGTGTA |
| NUPR1 | CCTTCCCACCAGCAACCAG | GGTAGGAATGGGCCAGGCTA |
| GAPDH | TCAGTGGTGGACCTGACCTG | TGCTGTAGCCAAATTCGTTG |
Tabella 1: Sequenze dei primer di DNA utilizzati in questo protocollo.
Discussione
Questo protocollo descrive come isolare e arricchire la sottopopolazioneBAMBI highMFGE8 high da UC-MSC umane. Il metodo è importante per ulteriori studi sulla morfologia, la crescita e la funzione di questo sottogruppo di MSC. Alcuni passaggi sono fondamentali per il successo dell'isolamento e l'elevata resadelle celle BAMBIad altoMFGE8.
In primo luogo, l'aspetto tecnico più critico da considerare è l'uso di una soluzione di dissociazione cellulare appropriata nel presente protocollo. Sebbene la tripsina-EDTA convenzionale allo 0,25% venga utilizzata per dissociare le MSC per il passaggio, è meglio utilizzare una soluzione EDTA priva di enzimi per selezionare il sottogruppoBAMBI ad altoMFGE8 perché il trattamento con tripsina riduce la resadelle alte MSC BAMBIad altoMFGE8 quando vengono selezionate (Figura 3). Una possibile ragione potrebbe essere che la tripsina compromette la distribuzione delle proteine transmembrana MFGE8 e BAMBI sulla superficie cellulare come avviene per altre proteine12. Al contrario, l'uso della soluzione EDTA ha scarso effetto sull'espressione della superficie cellulare di MFGE8 e BAMBI. In secondo luogo, il protocollo di smistamento delle celle descrive le impostazioni dei parametri per la selezione delleMSC BAMBI highMFGE8. È necessario stabilire un campione bianco e singoli campioni marcati con anticorpi per controllare con precisione l'esatto alto MSC di BAMBIad altoMFGE8 per lo smistamento FACS.
A differenza della tripsinizzazione, il distacco delle UC-MSC umane mediante EDTA è raccomandato per lo smistamento delle MSCalte di BAMBIad altoMFGE8 in questo protocollo. Tuttavia, altre modifiche che coinvolgono metodi di dissociazione cellulare lieve, come la Dispasi e il Triplo E13,14, possono essere applicabili anche per la raccolta di MSCad altoMFGE8 di BAMBI, ma devono essere verificate. In particolare, la dissociazione a lungo termine delle UC-MSC dovrebbe essere evitata poiché un'eccessiva dissociazione tende a ridurre la vitalità cellulare. Inoltre, gli inibitori di ROCK (ad es. Y-27632 a 10 μM), che prevengono l'apoptosi cellulare15, possono essere aggiunti al terreno di coltura cellulare per aumentare la sopravvivenza delle MSC BAMBIad altoMFGE8selezionate riducendo il loro grado di apoptosi. Inoltre, si raccomanda di rivalutare la purezzadelle MSC ad altoMFGE8 di BAMBI in espansione regolare dopo la selezione per garantire che mantengano la loro identità primaria, soprattutto prima di eseguire ulteriori test di analisi funzionale.
Sebbene non vi fosse alcuna correlazione tral'alto rapporto MSC MFGE8diBAMBI e il sesso, i rapporti di UC-MSC alti di BMAMBIMFGE8sono stati acquisiti da donatori diversi (Figura 4). In particolare, la proporzione della sottopopolazioneBAMBI HighMFGE8 High può variare a seconda dei diversi passaggi o delle condizioni colturali. Se la percentuale di celluleBAMBI ad altoMFGE8 nella popolazione UC-MSC è estremamente piccola, l'attuale protocollo non sarà ben applicabile. Altre limitazioni di questo protocollo includono danni cellulari relativamente gravi causati dal metodo di smistamento FACS, che porta facilmente alla morte cellulare di una percentuale di MSCad altoMFGE8 di BAMBI dopo lo smistamento cellulare. Inoltre, gli attuali metodi di selezione degli anticorpi primari e secondari in due fasi richiedono più tempo e sono meno efficienti per la selezione cellulare. Le future applicazioni degli anticorpi BAMBI e MFGE8 direttamente coniugati con la fluorescenza sono preferibili per aumentare l'efficienza di selezionedelle alte MSC di BAMBIad altoMFGE8.
L'isolamento di ciascuna sottopopolazione di MSC miste è indispensabile per rivelare le loro funzioni autentiche e i meccanismi sottostanti nel trattamento delle malattie. Pertanto, il presente metodo fornisce uno strumento di base e vitale per raggruppare e studiare ulteriormente le UC-MSCBAMBI highMFGE8per comprenderne completamente la natura. L'ottimizzazione futura delle condizioni di coltura cellularead altoMFGE8 di BAMBI produrrà un gran numero di queste cellule nel settore per la terapia con cellule staminali per pazienti specifici in clinica.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (sovvenzione n. 82271843).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tube | Corning | Axygen MCT-060-A | |
| 1.5 mL microcentrifuge tubes | Beijing Labgic Technology | MCT-001-150 | |
| 100 mm cell culture dish | Beijing Labgic Technology | 12311 | |
| 12 well plate | Beijing Labgic Technology | 11210 | |
| 15 mL centrifuge tube | Nanjing Vazyme Material Technology | TCF00115 | |
| 24 well plate | Beijing Labgic Technology | 11310 | |
| 50 mL centrifuge tube | Nanjing Vazyme Material Technology | TCF00150 | |
| 5 mL Round-Bottom Tubes | Corning | FALCON 352003 | |
| 70 μm cell strainer | Falcon | 352350 | Dilution: 1:1000 |
| APC anti-human CD79a (Igα) Antibody | BioLegend | 333505 | 581 Dilution: 1:200 |
| APC/Cyanine7 anti-human CD73 (Ecto-5'-nucleotidase) Antibody | BioLegend | 344022 | G46-6 Dilution: 1:200 |
| APC-Cy7 Mouse IgG1, κ Isotype Control | BD Bioscience | 557873 | MOPC-31C (Isotype Control) Dilution: 1:200 |
| BAMBI antibody | Bioss | bs-12418R | |
| Brilliant Violet 510 anti-mouse/human CD44 Antibody | BioLegend | 103044 | 5E10 Dilution: 1:200 |
| Brilliant Violet 510 Rat IgG2b, κ Isotype Ctrl Antibody | BioLegend | 400646 | MOPC-21 (Isotype Control) Dilution: 1:200 |
| CD105 (Endoglin) Monoclonal Antibody APC | eBioscience | 17-1057-42 | HM47 Dilution: 1:200 |
| Cell Counting Chamber Slides | Shanghai QIUJING | XB-K-25 | |
| Centrifuge | Beijing BAIYANG | BY-320C | |
| ChamQ Universal SYBR qPCR Master Mix | Vazyme | Q711-02 | |
| Chloroform | XILONG Scientific | 13700908 | |
| DMEM/F-12 (1:1) basic (1x) | Gibco | C11330500BT | |
| EDTA (0.5 M), pH 8.0, Rnase free | Invitrogen | AM9260G | Dilution: 1:1000 |
| Ethanol | XILONG Scientific | 12803405 | |
| Fetal Bovine Serum (FBS) | Gibco | 10099-141C | |
| FITC Mouse Anti-Human CD34 | BD Bioscience | 555821 | IM7 Dilution: 1:200 |
| FITC Mouse Anti-Human CD45 | BD Bioscience | 555482 | AD2 Dilution: 1:200 |
| FITC Mouse Anti-Human HLA-DR | BD Bioscience | 555811 | SN6 Dilution: 1:200 |
| Flow Cytometer | BD Bioscience | FACSAria™ III Cell SorterAria | |
| Flowjo | BD Bioscience | V10 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | abcam | ab150113 | HI30 Dilution: 1:200 |
| Goat Anti-Rabbit IgG H&L (AlexaFluor 594) | abcam | ab150080 | Dilution: 1:1000 |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | R223-01 | |
| Inverted Microscopes | Nikon | ECLIPSE Ts2 | |
| Isopropyl Alcohol | XILONG Scientific | 12802505 | |
| MFGE8 antibody | Biorbyt | orb388429 | Dilution: 1:100 |
| Microcentrifuge | Thermo Fisher Scientific | FRESCO 21 | |
| Mouse IgG1 kappa Isotype Control APC | eBioscience | 17-4714-42 | P3.6.2.8.1 (Isotype Control) Dilution: 1:200 |
| Mouse IgG1 kappa Isotype Control FITC | eBioscience | 11-4714-42 | eBMG2b (Isotype Control) Dilution: 1:200 |
| Mouse IgG2b kappa Isotype Control FITC | eBioscience | 11-4732-42 | RTK4530 (Isotype Control) Dilution: 1:200 |
| PBS (10x) | Sangon Biotech (Shanghai) | E607016-0500 | |
| PE-Cy5 Mouse Anti-Human CD90 | BD Bioscience | 555597 | P3.6.2.8.1 (Isotype Control) Dilution: 1:200 |
| PE-Cy5 Mouse IgG1 κ Isotype Control | BD Bioscience | 550618 | |
| Penicillin-Streptomycin 100x | Cytiva | SV30010 | Dilution: 1:100 |
| Real-Time PCR System | Applied Biosystems byThermo Fisher Scientific | Q6 | |
| RNase-free water | QIAGEN | 129112 | |
| Spectrophotometer | Thermo Fisher Scientific | NanoDrop One(840-317400) | |
| Sterile micropipette tips | Beijing Labgic Technology | Dilution: 1:100 | |
| T75 cell culture flask | Beijing Labgic Technology | 13212A | |
| Thermal Cycler | Applied Biosystems byThermo Fisher Scientific | Veriti | |
| Tri reagent | Sigma Aldrich | T9424 | |
| Typsin-EDTA Solution | Bio-Channel Biotechnology | BC-CE-005 | |
| Water-Jacketed CO2 Incubator | Thermo Fisher Scientific | 3111 |
Riferimenti
- Liechty, K. W., et al. Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat Med. 6 (11), 1282-1286 (2000).
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. J Hematol Oncol. 14 (1), 24 (2021).
- Xie, Z., et al. Tnf-alpha-mediated m(6)a modification of elmo1 triggers directional migration of mesenchymal stem cell in ankylosing spondylitis. Nat Commun. 12 (1), 5373 (2021).
- Mcguire, J. J., et al. Mesenchymal stem cell-derived interleukin-28 drives the selection of apoptosis resistant bone metastatic prostate cancer. Nat Commun. 12 (1), 723 (2021).
- Yuan, X., et al. Mesenchymal stem cell therapy induces flt3l and cd1c(+) dendritic cells in systemic lupus erythematosus patients. Nat Commun. 10 (1), 2498 (2019).
- Wang, D., et al. Umbilical cord mesenchymal stem cell transplantation in active and refractory systemic lupus erythematosus: A multicenter clinical study. Arthritis Res Ther. 16 (2), R79 (2014).
- Ortiz, L. A., et al. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects. Proc Natl Acad Sci U S A. 100 (14), 8407-8411 (2003).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: Implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Wang, Z., et al. Single-cell transcriptome atlas of human mesenchymal stem cells exploring cellular heterogeneity. Clin Transl Med. 11 (12), e650 (2021).
- Chen, P., et al. Single-cell and spatial transcriptomics decodes wharton's jelly-derived mesenchymal stem cells heterogeneity and a subpopulation with wound repair signatures. Adv Sci (Weinh). 10 (4), e2204786 (2023).
- Chen, H., et al. Dissecting heterogeneity reveals a unique bambi(high) mfge8(high) subpopulation of human uc-mscs. Adv Sci (Weinh). 10 (1), e2202510 (2022).
- Tsuji, K., et al. Effects of different cell-detaching methods on the viability and cell surface antigen expression of synovial mesenchymal stem cells. Cell Transplant. 26 (6), 1089-1102 (2017).
- Lai, T. Y., et al. Different methods of detaching adherent cells and their effects on the cell surface expression of fas receptor and fas ligand. Sci Rep. 12 (1), 5713 (2022).
- Avinash, K., Malaippan, S., Dooraiswamy, J. N. Methods of isolation and characterization of stem cells from different regions of oral cavity using markers: A systematic review. Int J Stem Cells. 10 (1), 12-20 (2017).
- Galvao, I., et al. Rock inhibition drives resolution of acute inflammation by enhancing neutrophil apoptosis. Cells. 8 (9), 964 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon