Method Article
Isolierung von humanen mesenchymalen Stromazellen mitBAMBI-Gehalt anhohemMFGE8-Nabelschnurgehalt
In diesem Artikel
Zusammenfassung
Die Isolierung von BAMBI-hohenMFGE8-hohen MSCs, einer der drei Hauptuntergruppen der heterogenen humanen UC-MSCs, ist hilfreich, um die Eigenschaften und Funktionen dieses Subtyps für seine zukünftige Anwendung zur Verbesserung der klinischen Wirksamkeit bei bestimmten Erkrankungen vollständig zu verstehen. Hier stellen wir eine Methode zur Sortierung von BAMBIhochMFGE8hoch UC-MSCs vor.
Zusammenfassung
Aus der Nabelschnur gewonnene mesenchymale Stroma-/Stammzellen (UC-MSCs) weisen eine geringe Immunogenität und starke immunmodulatorische Wirkungen bei der Behandlung verschiedener Krankheiten auf. Humane UC-MSCs sind eine heterogene Population, die aus drei Hauptsubpopulationen mit unterschiedlichen Zellformen, Proliferationsraten, Differenzierungsfähigkeiten und immunregulatorischen Funktionen besteht. Zuvor wurde festgestellt, dassBAMBI-hoheMFGE8-hohe UC-MSCs, die erste Untergruppe, die erfolgreich aus UC-MSCs isoliert wurde, die Lupusnephritis nicht lindern konnte. Daher ist die Funktion und der zugrundeliegende Mechanismus dieser Untergruppe in der MSC-Therapie bei Krankheiten unbekannt. Es ist notwendig, BAMBI-hoheMFGE8-hohe UC-MSCs in Bezug auf ihren Phänotyp, ihren Metabolismus und ihre Funktion zu isolieren und weiter zu untersuchen, um die Natur dieser MSC-Untergruppe vollständig zu verstehen. In diesem Protokoll beschreiben wir eine detaillierte Methode zur Isolierungder BAMBI-High-MFGE8-High-Subpopulation aus humanen UC-MSCs. Die Subpopulation der UC-MSCs wird durch durchflusszytometrische Sortierung mit zwei Oberflächenmarkern, BAMBI und MFGE8, markiert. Die isolierten Zellen werden kultiviert und durch Durchflusszytometrie verifiziert. Die spezifischen Gene, die in denBAMBI-hohenMFGE8-hohen UC-MSCs exprimiert werden, werden mittels RT-qPCR identifiziert. Dieses Protokoll führt zu einer hocheffizienten und reinen Zellsortierung und beschreibt die Markerprofile der BAMBIhighMFGE8high UC-MSCs.
Einleitung
Humane mesenchymale Stroma-/Stammzellen (MSCs) sind somatische Vorläuferzellen, die in der Lage sind, sich in Osteozyten, Adipozyten, Chondrozyten und andere Zelltypen zu differenzieren1. MSCs wurden zuerst aus dem Knochenmark isoliert und stammen weitgehend aus der Nabelschnur, dem Fettgewebe und anderen Geweben2. Da UC-MSCs leicht zu beschaffen sind und eine geringe Immunogenität und immunsuppressive Wirkung aufweisen, werden sie in klinischen Studien häufig zur Behandlung verschiedener Krankheiten eingesetzt 3,4,5. Obwohl die MSC-Therapie ein vielversprechendes Potenzial für die Behandlung von Krankheiten zeigt, sind die therapeutischen Wirkungen bei den Individuen uneinheitlich6. Der Grund für die Instabilität der MSC-Therapie ist jedoch noch unklar.
Molekulare Fluktuationen, Morphologie, Differenzierungsfähigkeit und therapeutische Funktion bilden die Heterogenität der MSC. Einige Studien haben auch postuliert, dass MSCs Subpopulationen mit unterschiedlichen Funktionen darstellen 7,8 und die MSC-Heterogenität mittels Einzelzell-RNA-Sequenzierung (scRNA-seq) untersucht9,10. Die Ergebnisse zeigten, dass humane UC-MSCs unterschiedliche Subpopulationen mit spezifischen transkriptomischen Merkmalen aufweisen, während es nur wenigen Studien gelungen ist, sogenannte MSC-Subpopulationen zu isolieren. Zuvor haben wir humane UC-MSCs anhand ihrer Signaturen mittels scRNA-seq und bioinformatischer Analyse in drei Untergruppen zerlegt, wobei die BAMBI-Subpopulationmit hohemMFGE8-hohem UC-MSC-Gehalt weiter gereinigt und funktionell getestet wurde11. Diese Untergruppe konnte die Lupusnephritis jedoch nicht lindern. Daher ist es notwendig, die therapeutische Wirkung von BAMBIhochMFGE8hoch MSCs bei anderen Erkrankungen zu testen, um ihre authentischen Funktionen zu verstehen.
Dieses Protokoll beschreibt Methoden zur Isolierungder BAMBI highMFGE8 high Subgruppe aus humanen UC-MSCs mittels fluoreszenzaktivierter Zellsortierung (FACS) mittels Durchflusszytometrie und die Eigenschaftender BAMBI highMFGE8 high Subgruppe.
Protokoll
Diese Studie wurde in Übereinstimmung mit den Grundsätzen der Deklaration von Helsinki von 1989 durchgeführt und von der Ethikkommission des Affiliated Drum Tower Hospital der Nanjing University Medical School genehmigt (Zulassungsnummer: 202019701). Menschliche Nabelschnüre wurden von gesunden Müttern am Affiliated Drum Tower Hospital der Nanjing University Medical School nach natürlichen Wehen gewonnen, die ihre informierte Zustimmung zu ihrer Verwendung in dieser Arbeit gaben. Primäre UC-MSCs wurden, wie bereits berichtet, aus humanen Nabelschnüren isoliert11.
1. UC-MSC-Kultur und Identifizierung vor der Isolierung
- Sobald die MSCs 70-80% Konfluenz (P0) erreichen, waschen Sie die Zellen einmal mit PBS und fügen Sie 1 ml 0,25% Trypsin-EDTA für 2 min bei 37 °C hinzu. Fügen Sie dann 9 ml vollständiges Medium hinzu, um das Trypsin zu neutralisieren, übertragen Sie die Zellsuspension in ein 15-ml-Zentrifugenröhrchen und zentrifugieren Sie 5 Minuten lang bei 300 × g , um die Zellen zu sammeln. Entsorgen Sie den Überstand und fügen Sie das entsprechende vollständige Medium hinzu, um die Zellen zu resuspendieren. Die Zellen in jeder Schale werden in drei T75-Kolben (P1) überführt und in einem Zellinkubator bei 37 °C und 5 % CO2 kultiviert.
- Nachdem Sie die UC-MSCs 2x durch Trypsinisierung passiert haben, ernten Sie die Zellen bei P3 mit den gleichen Schritten, die in Schritt 1.1 beschrieben wurden. Nach dem Zentrifugieren ist der Überstand zu verwerfen. Resuspendieren Sie die Zellen in FACS-Färbepuffer (1x PBS mit 2% FBS) und zählen Sie sie. Geben Sie FACS-Färbepuffer bis zu einer Endkonzentration von 5-10 × 106 Zellen/ml und halten Sie die Zellsuspension auf Eis.
- Verteilen Sie 100 μL pro Röhrchen dieser Zellsuspension auf verschiedene 1,5 mL Röhrchen. Geben Sie Isotypkontrollen und FACS-Antikörper gegen CD29, CD73, CD90, CD105, CD14, CD34, CD45, CD79 und HLA-DR (alle bei 1:200) bei 4 °C für 30 min in die Zellen.
- Waschen Sie die Zellen 2x mit dem FACS-Färbepuffer und zentrifugieren Sie sie bei 300 × g für 5 min. Den Überstand verwerfen und die Ausfällungen in 200 μl FACS-Färbepuffer für die durchflusszytometrische Analyse zur Identifizierung von MSC-Markern resuspendieren.
2. Isolierung von BAMBI-hohen MFGE8-hohen UC-MSCs durch Durchflusszytometrie
- Kultur von UC-MSC mit einer Dichte von ca. 5-10 × 106 Zellen bei der Isolierung von BAMBI-hohen MFGE8-hohen UC-MSCs. Dissoziieren Sie die Zellen 5 Minuten lang mit 0,5 mM EDTA, bis sie eine runde Morphologie annehmen, fügen Sie das gesamte Medium hinzu, um die Zellen in ein konisches 15-ml-Röhrchen zu übertragen, und pipettieren Sie die Zellsuspension mehrmals auf und ab, um eine Einzelzellsuspension herzustellen. Verwenden Sie 10 μl der Zellsuspension, um die Zellen zu zählen und die Gesamtzahl der geernteten Zellen zu berechnen. Zentrifugieren Sie das konische Röhrchen mit der Zellsuspension bei 300 × g für 5 min, um die Zellen zu sammeln.
- Resuspendieren Sie die Zellen in 1 ml vollständigem Medium auf eine Endkonzentration von 5-10 × 106 Zellen/ml und halten Sie die Zellsuspension auf Eis.
- Teilen Sie die Zellen in vier 1,5-ml-Mikrozentrifugenröhrchen auf (nur leere Zellen; BAMBI-markierte Zellen; MFGE8-markierte Zellen; und sowohl BAMBI- als auch MFGE8-markierte Zellen).
- Geben Sie primäre Antikörper in geeigneten Konzentrationen (MFGE8 und BAMBI, beide bei 1:100) in die Röhrchen, mischen Sie die Zellen und inkubieren Sie sie 15 Minuten lang bei Raumtemperatur.
- Waschen Sie die markierten Zellen einmal mit 1x PBS und zentrifugieren Sie sie 5 Minuten lang bei 300×g. Entsorgen Sie den Überstand. Resuspendieren Sie die Zellen in 1 ml vollständigem Medium, fügen Sie den Zellen konjugierte fluoreszierende Sekundärantikörper (Ziegen-Anti-Kaninchen-IgG H&L Alexa Fluor 488 und Alexa Fluor 647, alle im Verhältnis 1:1.000) hinzu, mischen Sie die Zellen und inkubieren Sie die Zellen 15 Minuten lang bei Raumtemperatur im Dunkeln.
- Waschen Sie die markierten Zellen einmal mit 1x PBS, wie in Schritt 2.5 beschrieben. Resuspendieren Sie die Zellen in 500 μl vollständigem Medium, filtrieren Sie durch ein 70-μm-Zellsieb, um Klumpen und Ablagerungen zu entfernen, und überführen Sie das Filtrat in ein 15-ml-Röhrchen für die Durchflusszytometrie-Sortierung.
- Führen Sie das leere Zellröhrchen ohne Zugabe eines Antikörpers (Negativkontrolle) durch und passen Sie die Vorwärtsstreuung (FSC) und die Seitenstreuung (SSC) an, um die Skala der negativen Population mit Antikörperfärbung zu begrenzen.
- Führen Sie die einzelnen Antikörper-markierten Zellröhrchen (d. h. MFGE8 + Ziegen-Anti-Kaninchen-IgG H&L Alexa Fluor 488 oder BAMBI + Ziegen-Anti-Kaninchen-IgG H&L Alexa Fluor 647) als Gating-Kontrolle aus, um zu bestimmen, wo die Positivität im Diagramm beginnt.
- Führen Sie die Versuchsprobenröhrchen aus, um die BAMBI-Population mithohem MFGE8-Gehalt zu sortieren und zu sammeln.
- Tellern Sie die sortierten BAMBIhighMFGE8high MSCs in eine 24-Well-Platte und kultivieren Sie die Zellen in einem Zellinkubator bei 37 °C und 5% CO2.
- Wenn die sortiertenBAMBI highMFGE8 high MSCs zwei Passagen lang gewachsen sind, um genügend Zellen zu erhalten, dissoziieren Sie die Zellen und führen Sie eine Nachsortieranalyse durch, um die Reinheit der sortierten Zellpopulationen durch Durchflusszytometrie sicherzustellen, wie in den Schritten 2.1 bis 2.9 beschrieben. Alternativ kann die Reinheit der sortierten Zellen mit konventioneller Immunfluoreszenz gegen humane BAMBI- und MFGE8-Expression untersucht werden, wenn die Anzahl der gesammelten Zellen zu gering ist.
3. Charakterisierungder BAMBI high MFGE8 high MSCs
- Züchten Sie die sortierten BAMBIhighMFGE8high MSCs in einer 12-Well-Platte, untersuchen Sie ihre Zellmorphologie unter dem Mikroskop und vergleichen Sie sie mit der von unsortierten MSCs.
HINWEIS: Im Allgemeinen wachsen BAMBI-Zellenmit hohem MFGE8-Gehalt schneller als unsortierte UC-MSCs. - Wenn die Zellen zu etwa 90 % in der 12-Well-Platte konfluiert sind, aspirieren Sie das Zellkulturmedium, waschen Sie die Zellen einmal mit 1x PBS und geben Sie 500 μl RNA-Extraktionsreagenz zu den Zellen. Schütteln Sie die Platte langsam bei Raumtemperatur (RT) für 5 min.
- Pipettieren Sie das Gemisch und geben Sie es in ein RNase- und DNase-freies Röhrchen. Fügen Sie 100 μl Chloroform hinzu, verschließen Sie das Röhrchen und schütteln Sie die Mischung kräftig, indem Sie sie 15 s lang vortexen. Lassen Sie die Röhre dann 3 Minuten lang bei RT stehen.
- Das Röhrchen 15 min lang bei 11.000 × g und 4 °C zentrifugieren.
- Übertragen Sie ca. 200 μl der oberen wässrigen Schicht in ein neues Röhrchen. Geben Sie die gleiche Menge Isopropanol hinzu und pipettieren Sie mehrmals gründlich auf und ab. Lassen Sie die Mischung dann 10 Minuten bei RT stehen.
- 15 min bei 11.000 × g und 4 °C zentrifugieren. Entsorgen Sie den Überstand.
- Geben Sie 500 μl 75%iges Ethanol in das Pellet in der Tube und drehen Sie die Tube mehrmals vorsichtig um.
- Das Röhrchen 5 min lang bei 6.000 × g und 4 °C zentrifugieren. Entsorgen Sie den Überstand. Wiederholen Sie die Zentrifugation einmal für 10 s bei 6.000 × g, saugen Sie die restliche Flüssigkeit vorsichtig mit einer Pipette ab und trocknen Sie das Röhrchen bei RT.
- Fügen Sie 10 μl RNase-freies Wasser hinzu, um das RNA-Pellet aufzulösen, und messen Sie die RNA-Konzentration mit einem Spektralphotometer.
- Befolgen Sie die Anweisungen des Herstellers, um Erststrang-cDNA aus bis zu 1 μg Gesamt-RNA zu synthetisieren.
- Verwenden Sie ein qPCR-Kit, um die Genexpression gemäß den Anweisungen des Herstellers nachzuweisen und zu quantifizieren.
HINWEIS: Die Sequenzen der verwendeten DNA-Primer sind in Tabelle 1 aufgeführt.
Ergebnisse
Abbildung 1 zeigt die Expressionsprofile der Zelloberflächenmarker von humanen UC-MSCs. Kultivierte MSCs waren stark positiv für die CD44-, CD73-, CD90- und CD105-Expression und negativ für die CD14-, CD34-, CD45-, CD79- und HLA-DR-Expression. Die BAMBI-hohen MFGE8-hohen MSCs wurden aus kultivierten humanen UC-MSCs sortiert und ihre BAMBI- und MFGE8-Expression wurde nach einer Expansion über 3-4 Passagen mittels Durchflusszytometrie erneut analysiert (Abbildung 2). Dabei schwankte die Häufigkeit von BAMBI-hohenMFGE8-MSCs je nach Donator- und Dissoziationsmethode (Abbildung 3 und Abbildung 4). Abbildung 5 zeigt eine Reihe von hochexprimierten Signaturgenen inden BAMBI-hohen MFGE8-hohen MSCs im Vergleich zu den unsortierten MSCs, die mittels RT-qPCR bestimmt wurden.
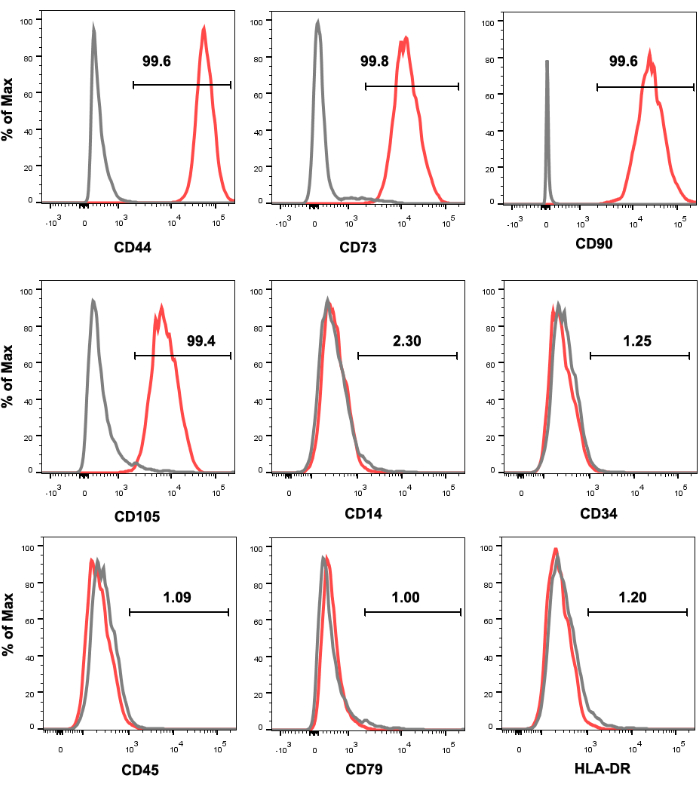
Abbildung 1: Immunphänotypisierung von UC-MSCs, die durch durchflusszytometrische Analyse identifiziert wurden. UC-MSCs sind positiv für CD44, CD73, CD90 und CD105 und negativ für CD14, CD34, CD45, CD79 und HLA-DR. Das schwarze Histogramm stellt die Kontrolle des Antikörper-Isotyps dar, und das rote Histogramm stellt das Antikörpersignal dar. Abkürzungen: UC-MSCs = aus der Nabelschnur gewonnene mesenchymale Stroma-/Stammzellen; HLA-DR = humanes Leukozyten-Antigen-DR. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Reinheit von BAMBI-hohen MFGE8-hohen MSCs nach Sortierung durch durchflusszytometrische Analyse. Dargestellt sind die Ergebnisse der durchflusszytometrischen Analyse von UC-MSCs ohne Antikörperfärbung (oben links) und mit MFGE8- und BAMBI-Färbung vor (oben Mitte) und nach der Zellsortierung (oben rechts). Die Ergebnisse der einzelnen MFGE8- (unten links) und BAMBI-Färbung (unten rechts) sind ebenfalls dargestellt. Abkürzungen: BAMBI = bone morphogenic protein and activin membrane-bound inhibitor; MFGE8 = Milchfettkügelchen epidermaler Wachstumsfaktor 8; MSCs = mesenchymale Stroma-/Stammzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
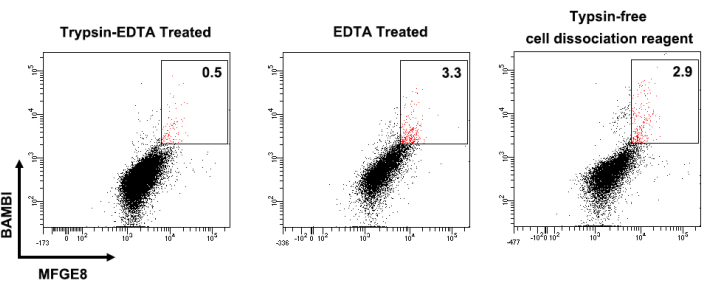
Abbildung 3: Unterschiedliche Häufigkeiten von BAMBIhochMFGE8hoch MSCs, die mit unterschiedlichen Methoden dissoziiert wurden. Die Ergebnisse der durchflusszytometrischen Analyse von UC-MSCs desselben Spenders, die einer Trypsin-EDTA-Dissoziation (links), einer EDTA-Behandlung (Mitte) und einem Reagenz für die Trypsin-freie Zelldissoziation (rechts) unterzogen wurden, sind dargestellt. Abkürzungen: BAMBI = bone morphogenic protein and activin membrane-bound inhibitor; MFGE8 = Milchfettkügelchen epidermaler Wachstumsfaktor 8; MSCs = mesenchymale Stroma-/Stammzellen; TE = Trypsin-EDTA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Die Häufigkeit von BAMBI-hohen MFGE8-hohen MSCs von verschiedenen Spendern. Die Häufigkeitenvon BAMBI-hohen MFGE8-hohen MSCs variieren zwischen den Spenderproben 1 (links), 2 (Mitte) und 3 (rechts). Abkürzungen: BAMBI = bone morphogenic protein and activin membrane-bound inhibitor; MFGE8 = Milchfettkügelchen epidermaler Wachstumsfaktor 8; MSCs = mesenchymale Stroma-/Stammzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
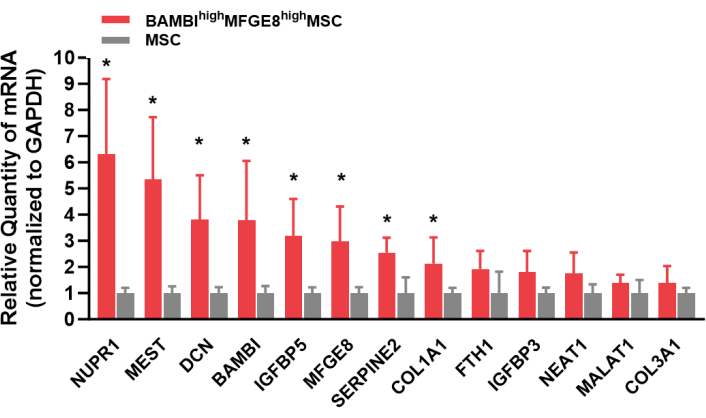
Abbildung 5: Hochexprimierte Signaturgene in den BAMBI-hohen MFGE8-hohen MSCs, die mittels RT-qPCR untersucht wurden. Abkürzungen: BAMBI = bone morphogenic protein and activin membrane-bound inhibitor; MFGE8 = Milchfettkügelchen epidermaler Wachstumsfaktor 8; MSCs = mesenchymale Stroma-/Stammzellen; RT-qPCR = Reverse-Transkription-quantitative Polymerase-Kettenreaktion. Der t-Test des Schülers. *, S<0.05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Fibel | Sequenz vorwärts (5'-3') | Sequenz rückwärts (5'-3') |
| BAMBI | CGCCACTCCAGCTACATCTT | CAGTGGGCAGCATCACAGTA |
| COL1A1 | CAAAGAAGGCGGCAAAGGTC | CACGCTGTCCAGCAATACCT |
| COL3A1 | CCTTCGACTTCTCTCCAGCC | TTTCGTGCAACCATCCTCCA |
| DCN | GGCTGGACCGTTTCAACAGA | GATGGCATTGACAGCGGAAG |
| NEAT1 | CACAGGCAGGGGAAATGTCT | TGCTGCGTATGCAAGTCTGA |
| FTH1 | AGCTCTACGCCTCCTACGTT | CCTGAAGGAAGATTCGGCCA |
| IGFBP3 | GCCAGCGCTACAAAGTTGAC | ATGTGTACACCCCTGGGACT |
| IGFBP5 | TCCCCACGTGTGTTCATCTG | AAATGGGATGGACTGAGGCG |
| MALAT1 | TGGGGGAGTTTCGTACTGAG | TCTCCAGGACTTGGCAGTCT |
| MEST | TGGGAGCTCTTGCCTCTGTA | AGAATCGACACTGTGGACCG |
| MFGE8 | TGTCTTCCCCTCGTACACCT | AGAAGGTCACACGCACAGAC |
| SERPINE2 | GTCCTCGTCAACGCAGTGTA | GTCCTCGTCAACGCAGTGTA |
| NUPR1 | CCTTCCCACCAGCAACCAG | GGTAGGAATGGGCCAGGCTA |
| GAPDH | TCAGTGGTGGACCTGACCTGACCTG | TGCTGTAGCCAAATTCGTTG |
Tabelle 1: Sequenzen der DNA-Primer, die in diesem Protokoll verwendet werden.
Diskussion
Dieses Protokoll beschreibt, wie die BAMBI-Subpopulationmit hohemMFGE8-Gehalt aus humanen UC-MSCs isoliert und angereichert werden kann. Die Methode ist wichtig für die weitere Untersuchung der Morphologie, des Wachstums und der Funktion dieser MSC-Untergruppe. Einige Schritte sind entscheidend für die erfolgreiche Isolierung und hohe Ausbeute von BAMBI-Zellenmit hohemMFGE8-Gehalt.
Erstens, der kritischste technische Aspekt, der zu berücksichtigen ist, ist die Verwendung einer geeigneten Zelldissoziationslösung in dem vorliegenden Protokoll. Obwohl herkömmliches 0,25%iges Trypsin-EDTA zur Dissoziation von MSCs für die Passage verwendet wird, ist es besser, eine enzymfreie EDTA-Lösung für die Sortierung der Untergruppe BAMBImit hohemMFGE8-hohen MFGE8-Gehalt zuverwenden, da die Trypsinbehandlung die Ausbeutean BAMBI-hohen MFGE8-hohen MSCs beim Sortieren reduziert (Abbildung 3). Ein möglicher Grund könnte sein, dass Trypsin die Verteilung der Transmembranproteine MFGE8 und BAMBI auf der Zelloberfläche beeinflusst, wie es bei anderen Proteinen12 der Fall ist. Im Gegensatz dazu hat die Verwendung von EDTA-Lösung nur einen geringen Einfluss auf die Zelloberflächenexpression von MFGE8 und BAMBI. Zweitens beschreibt das Zellsortierprotokoll die Parametereinstellungen für die Auswahl der BAMBIhighMFGE8high MSCs. Es ist notwendig, eine Blindprobe und einzelne Antikörper-markierte Proben zu etablieren, um die exaktenBAMBI highMFGE8 high MSCs für die FACS-Sortierung genau zu bestimmen.
Im Gegensatz zur Trypsinisierung wird die Ablösung von humanen UC-MSCs durch EDTA für die Sortierungder BAMBI highMFGE8 high MSCs in diesem Protokoll empfohlen. Andere Modifikationen, die milde Zelldissoziationsmethoden beinhalten, wie z. B. Dispase und Tryple E13,14, können jedoch auch für die Erntevon BAMBI-hohen MFGE8-hohen MSCs anwendbar sein, müssen jedoch überprüft werden. Insbesondere sollte eine langfristige Dissoziation von UC-MSCs vermieden werden, da eine übermäßige Dissoziation dazu neigt, die Lebensfähigkeit der Zellen zu verringern. Darüber hinaus können ROCK-Inhibitoren (z. B. Y-27632 bei 10 μM), die die Zellapoptose15 verhindern, dem Zellkulturmedium zugesetzt werden, um das Überleben von sortierten BAMBI-hohen MFGE8-hohen MSCs zu erhöhen, indem ihr Apoptosegrad verringert wird. Darüber hinaus wird empfohlen, die Reinheit von BAMBI-MSCsmit hohemMFGE8-Gehalt bei regelmäßiger Expansion nach der Sortierung neu zu bewerten, um sicherzustellen, dass sie ihre primäre Identität behalten, insbesondere bevor weitere funktionelle Assay-Tests durchgeführt werden.
Obwohl es keine Korrelation zwischen dem BAMBIhighMFGE8high MSC Verhältnis und dem Geschlecht gab, wurden die Verhältnisse von BAMBIhighMFGE8high UC-MSCs von verschiedenen Spendern erworben (Abbildung 4). Insbesondere kann der Anteil der Subpopulation mitBAMBI-hoherMFGE8-hoher Präpopulation je nach verschiedenen Passagen oder Kulturbedingungen variieren. Wenn der Anteil derBAMBI-Zellen mit hohemMFGE8-Gehalt in der UC-MSC-Population extrem gering ist, ist das derzeitige Protokoll nicht gut anwendbar. Zu den weiteren Einschränkungen dieses Protokolls gehören relativ schwere Zellschäden, die durch die FACS-Sortiermethode verursacht werden und nach der Zellsortierung leicht zum Zelltod eines Teilsder BAMBI-hohen MFGE8-MSCs führen. Darüber hinaus nehmen die derzeitigen zweistufigen Methoden der primären und sekundären Antikörpersortierung mehr Zeit in Anspruch und sind weniger effizient für die Zellsortierung. Zukünftige Anwendungen von BAMBI- und MFGE8-Antikörpern, die direkt mit Fluoreszenz konjugiert sind, sind vorzuziehen, um die Sortiereffizienzvon BAMBI-hohen MFGE8-hohen MSCs zu erhöhen.
Die Isolierung jeder Subpopulation gemischter MSCs ist unerlässlich, um ihre authentischen Funktionen und zugrunde liegenden Mechanismen bei der Behandlung von Krankheiten aufzudecken. Daher bietet die vorliegende Methode ein grundlegendes und wichtiges Werkzeug für die Bündelung und weitere Untersuchungvon BAMBI-hohen MFGE8-hohen UC-MSCs, um deren Natur vollständig zu verstehen. Die zukünftige Optimierung der BAMBI-Hoch-MFGE8-Zellkulturbedingungen wird eine große Anzahl dieser Zellen in der Industrie für die Stammzelltherapie für bestimmte Patienten in der Klinik produzieren.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (Grant Nr. 82271843) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tube | Corning | Axygen MCT-060-A | |
| 1.5 mL microcentrifuge tubes | Beijing Labgic Technology | MCT-001-150 | |
| 100 mm cell culture dish | Beijing Labgic Technology | 12311 | |
| 12 well plate | Beijing Labgic Technology | 11210 | |
| 15 mL centrifuge tube | Nanjing Vazyme Material Technology | TCF00115 | |
| 24 well plate | Beijing Labgic Technology | 11310 | |
| 50 mL centrifuge tube | Nanjing Vazyme Material Technology | TCF00150 | |
| 5 mL Round-Bottom Tubes | Corning | FALCON 352003 | |
| 70 μm cell strainer | Falcon | 352350 | Dilution: 1:1000 |
| APC anti-human CD79a (Igα) Antibody | BioLegend | 333505 | 581 Dilution: 1:200 |
| APC/Cyanine7 anti-human CD73 (Ecto-5'-nucleotidase) Antibody | BioLegend | 344022 | G46-6 Dilution: 1:200 |
| APC-Cy7 Mouse IgG1, κ Isotype Control | BD Bioscience | 557873 | MOPC-31C (Isotype Control) Dilution: 1:200 |
| BAMBI antibody | Bioss | bs-12418R | |
| Brilliant Violet 510 anti-mouse/human CD44 Antibody | BioLegend | 103044 | 5E10 Dilution: 1:200 |
| Brilliant Violet 510 Rat IgG2b, κ Isotype Ctrl Antibody | BioLegend | 400646 | MOPC-21 (Isotype Control) Dilution: 1:200 |
| CD105 (Endoglin) Monoclonal Antibody APC | eBioscience | 17-1057-42 | HM47 Dilution: 1:200 |
| Cell Counting Chamber Slides | Shanghai QIUJING | XB-K-25 | |
| Centrifuge | Beijing BAIYANG | BY-320C | |
| ChamQ Universal SYBR qPCR Master Mix | Vazyme | Q711-02 | |
| Chloroform | XILONG Scientific | 13700908 | |
| DMEM/F-12 (1:1) basic (1x) | Gibco | C11330500BT | |
| EDTA (0.5 M), pH 8.0, Rnase free | Invitrogen | AM9260G | Dilution: 1:1000 |
| Ethanol | XILONG Scientific | 12803405 | |
| Fetal Bovine Serum (FBS) | Gibco | 10099-141C | |
| FITC Mouse Anti-Human CD34 | BD Bioscience | 555821 | IM7 Dilution: 1:200 |
| FITC Mouse Anti-Human CD45 | BD Bioscience | 555482 | AD2 Dilution: 1:200 |
| FITC Mouse Anti-Human HLA-DR | BD Bioscience | 555811 | SN6 Dilution: 1:200 |
| Flow Cytometer | BD Bioscience | FACSAria™ III Cell SorterAria | |
| Flowjo | BD Bioscience | V10 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | abcam | ab150113 | HI30 Dilution: 1:200 |
| Goat Anti-Rabbit IgG H&L (AlexaFluor 594) | abcam | ab150080 | Dilution: 1:1000 |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | R223-01 | |
| Inverted Microscopes | Nikon | ECLIPSE Ts2 | |
| Isopropyl Alcohol | XILONG Scientific | 12802505 | |
| MFGE8 antibody | Biorbyt | orb388429 | Dilution: 1:100 |
| Microcentrifuge | Thermo Fisher Scientific | FRESCO 21 | |
| Mouse IgG1 kappa Isotype Control APC | eBioscience | 17-4714-42 | P3.6.2.8.1 (Isotype Control) Dilution: 1:200 |
| Mouse IgG1 kappa Isotype Control FITC | eBioscience | 11-4714-42 | eBMG2b (Isotype Control) Dilution: 1:200 |
| Mouse IgG2b kappa Isotype Control FITC | eBioscience | 11-4732-42 | RTK4530 (Isotype Control) Dilution: 1:200 |
| PBS (10x) | Sangon Biotech (Shanghai) | E607016-0500 | |
| PE-Cy5 Mouse Anti-Human CD90 | BD Bioscience | 555597 | P3.6.2.8.1 (Isotype Control) Dilution: 1:200 |
| PE-Cy5 Mouse IgG1 κ Isotype Control | BD Bioscience | 550618 | |
| Penicillin-Streptomycin 100x | Cytiva | SV30010 | Dilution: 1:100 |
| Real-Time PCR System | Applied Biosystems byThermo Fisher Scientific | Q6 | |
| RNase-free water | QIAGEN | 129112 | |
| Spectrophotometer | Thermo Fisher Scientific | NanoDrop One(840-317400) | |
| Sterile micropipette tips | Beijing Labgic Technology | Dilution: 1:100 | |
| T75 cell culture flask | Beijing Labgic Technology | 13212A | |
| Thermal Cycler | Applied Biosystems byThermo Fisher Scientific | Veriti | |
| Tri reagent | Sigma Aldrich | T9424 | |
| Typsin-EDTA Solution | Bio-Channel Biotechnology | BC-CE-005 | |
| Water-Jacketed CO2 Incubator | Thermo Fisher Scientific | 3111 |
Referenzen
- Liechty, K. W., et al. Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat Med. 6 (11), 1282-1286 (2000).
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. J Hematol Oncol. 14 (1), 24 (2021).
- Xie, Z., et al. Tnf-alpha-mediated m(6)a modification of elmo1 triggers directional migration of mesenchymal stem cell in ankylosing spondylitis. Nat Commun. 12 (1), 5373 (2021).
- Mcguire, J. J., et al. Mesenchymal stem cell-derived interleukin-28 drives the selection of apoptosis resistant bone metastatic prostate cancer. Nat Commun. 12 (1), 723 (2021).
- Yuan, X., et al. Mesenchymal stem cell therapy induces flt3l and cd1c(+) dendritic cells in systemic lupus erythematosus patients. Nat Commun. 10 (1), 2498 (2019).
- Wang, D., et al. Umbilical cord mesenchymal stem cell transplantation in active and refractory systemic lupus erythematosus: A multicenter clinical study. Arthritis Res Ther. 16 (2), R79 (2014).
- Ortiz, L. A., et al. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects. Proc Natl Acad Sci U S A. 100 (14), 8407-8411 (2003).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: Implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Wang, Z., et al. Single-cell transcriptome atlas of human mesenchymal stem cells exploring cellular heterogeneity. Clin Transl Med. 11 (12), e650 (2021).
- Chen, P., et al. Single-cell and spatial transcriptomics decodes wharton's jelly-derived mesenchymal stem cells heterogeneity and a subpopulation with wound repair signatures. Adv Sci (Weinh). 10 (4), e2204786 (2023).
- Chen, H., et al. Dissecting heterogeneity reveals a unique bambi(high) mfge8(high) subpopulation of human uc-mscs. Adv Sci (Weinh). 10 (1), e2202510 (2022).
- Tsuji, K., et al. Effects of different cell-detaching methods on the viability and cell surface antigen expression of synovial mesenchymal stem cells. Cell Transplant. 26 (6), 1089-1102 (2017).
- Lai, T. Y., et al. Different methods of detaching adherent cells and their effects on the cell surface expression of fas receptor and fas ligand. Sci Rep. 12 (1), 5713 (2022).
- Avinash, K., Malaippan, S., Dooraiswamy, J. N. Methods of isolation and characterization of stem cells from different regions of oral cavity using markers: A systematic review. Int J Stem Cells. 10 (1), 12-20 (2017).
- Galvao, I., et al. Rock inhibition drives resolution of acute inflammation by enhancing neutrophil apoptosis. Cells. 8 (9), 964 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten