Method Article
Valutazione ecocardiografica mediante esame solo subxifoide per pazienti ipotesi
In questo articolo
Riepilogo
Il protocollo fornisce un approccio rapido, basato sul fenotipo, per la valutazione ecografica focalizzata del paziente ipoteso, utilizzando immagini sottocostali della vena cava inferiore e del cuore, con viste aggiuntive dei polmoni superiori e degli spazi pleurici.
Abstract
L'ecografia point-of-care, o POCUS, ha suscitato un notevole interesse come strumento per aumentare il processo decisionale clinico nella cura dei pazienti acuti. I pazienti con instabilità emodinamica, in particolare, richiedono un intervento immediato e sono ad alto rischio di ulteriore scompenso cardiovascolare e/o respiratorio. L'esame POCUS di questi pazienti, quindi, richiede un protocollo che sia sufficiente a rispondere alle domande dei medici pur mantenendo un'adeguata brevità per essere fattibile in un breve periodo di tempo al letto del paziente. Qui, dimostriamo un protocollo per ottenere tali informazioni mediante la valutazione ecocardiografica utilizzando solo la pressione arteriosa media subxifoide, o esame EASy MAP, una valutazione ecografica mirata dei sistemi cardiovascolare e respiratorio. La parte cardiovascolare dell'esame utilizza la finestra sottocostale per ottenere viste del cuore e della vena cava inferiore (IVC); Questo è poi integrato da viste pleuriche anteriori del polmone superiore e posterolaterali diaframmatiche per la parte respiratoria. Tutte e sei le viste (cardiaca, IVC, polmone superiore anteriore sinistro e destro e pleurico posterolaterale sinistro e destro) sono ottenute utilizzando un trasduttore phased array a bassa frequenza. Discutiamo alcune delle insidie comuni incontrate nell'ottenere queste immagini e le basi dell'interpretazione dei risultati più comuni; Viene anche descritta una scala a 12 punti per valutare la qualità delle immagini ottenute dalla vista cardiaca e un piccolo numero di viste supplementari che possono essere prese in considerazione quando clinicamente rilevanti.
Introduzione
Negli ultimi anni, l'aumento della disponibilità, della qualità e della portabilità delle apparecchiature ecografiche ha portato a una rapida espansione nel campo dell'ecografia point-of-care (POCUS). La POCUS è definita come un esame ecografico che viene eseguito per indicazioni cliniche ben definite e viene interpretato dal medico curante primario del paziente, con i risultati immediatamente incorporati nel piano di trattamento 1,2. Ciò è in contrasto con l'ecografia consultiva, che si riferisce a un esame ecografico richiesto dal medico curante primario di un paziente ma eseguito da un team di specialisti separato3. Poiché gli esami consultivi devono essere trasmessi a un esperto di lettura dopo l'acquisizione delle immagini, potrebbe esserci un ritardo significativo tra l'identificazione dell'indicazione clinica e la disponibilità dello studio per il processo decisionale clinico. Dato che gli esami consultivi richiedono molto tempo per acquisire tutte le immagini e richiedono la disponibilità sia di un ecografista dedicato che di un medico che legge4, tali esami non possono sempre essere eseguiti e letti sulle scale temporali richieste dai pazienti acutamente instabili (spesso minuti) e non sono fattibili in tutti i contesti clinici, specialmente durante le ore di riposo (ad esempio, sera, notte, fine settimana e festivi). Al contrario, gli ecografi portatili possono essere opportunamente portati al letto del paziente dai medici curanti, consentendo agli esami POCUS di fornire informazioni utili per un processo decisionale clinico immediato. Ad esempio, POCUS può fornire una finestra immediata sullo stato emodinamico di un paziente 5,6,7, aumentando gli strumenti clinici più tradizionali come l'esame fisico, la gestalt clinica e altre tecniche di monitoraggio emodinamico. Mentre la POCUS cardiaca utilizza la stessa tecnologia ecografica di base delle valutazioni più complete degli studi ecocardiografici cardiologici consultivi, gli esami POCUS hanno le loro indicazioni cliniche specifiche e possono essere ottenuti in una gamma molto più ampia di situazioni di emergenza (reparto traumatologico, sala operatoria, stabilizzazione acuta nell'unità di cura post-anestesia, ecc.) e in un breve lasso di tempo8 per un processo decisionale clinico immediato. Fondamentalmente, gli studi POCUS sono ottenuti allo scopo di rispondere a una specifica domanda clinica, la cui risposta guiderà la gestione immediata del paziente.
In precedenza sono state condotte ricerche significative sull'uso di POCUS per la valutazione dello stato del volume; la dimensione e la collassabilità della vena cava inferiore (IVC) sono state spesso studiate come proxy per determinare il precarico del cuore destro, che, per alcune popolazioni di pazienti, è un utile stimatore dello stato di volume 9,10,11. Tuttavia, l'utilità della sola valutazione IVC come predittore della risposta alla rianimazione con fluidi è di valore meno certo nei pazienti con shock indifferenziato, con sostanziale eterogeneità tra studi e popolazioni di pazienti 12,13,14,15; molti pazienti critici ricevono anche ventilazione a pressione positiva, il che può confondere i tentativi di stimare la pressione venosa centrale tramite la sola ecografia IVC16. Inoltre, dato che il ritorno venoso comprende solo uno dei molti fattori necessari per un'adeguata gittata cardiaca e perfusione d'organo, è probabile che un approccio sistematico al paziente con instabilità clinica acuta (come ipotensione o insufficienza respiratoria) richieda un quadro più completo dello stato cardiovascolare e respiratorio, rendendo necessaria l'introduzione di ulteriori viste ecografiche. I pazienti con sepsi, ad esempio, possono presentare un'ampia gamma di fenotipi cardiaci17, il che significa che un approccio basato solo sull'IVC mancherebbe di una significativa eterogeneità emodinamica.
Qui, descriviamo un metodo per valutare rapidamente il paziente acutamente ipoteso mediante l'acquisizione di un esame POCUS abbreviato: la valutazione ecocardiografica utilizzando solo Subxiphoid - Mean Arterial Pressure, o esame EASy MAP18. L'esame EASy MAP è un esame conciso per la determinazione immediata dello stato cardiovascolare e cardiorespiratorio, che consiste in viste sottocostali del cuore e IVC più viste ecografiche polmonari anteriori e posterolaterali. All'interno del protocollo EASy MAP, la valutazione IVC non è destinata a funzionare in modo isolato, ma piuttosto come un elemento di un quadro più ampio che include la valutazione della funzione cardiaca, l'ecografia polmonare e il contesto clinico. Le immagini risultanti possono quindi essere interpretate utilizzando un semplice riconoscimento di pattern, con i pazienti che generalmente rientrano in uno dei diversi fenotipi cardiovascolari e polmonari; Queste informazioni possono poi essere utilizzate per la gestione immediata del paziente ipoteso. Questo approccio integrato cerca di sfruttare il riconoscimento dei modelli per identificare i risultati clinici utilizzabili, riconoscendo al contempo i limiti intrinseci di ogni singola metrica ecografica. Semplificando i passaggi necessari per ottenere immagini ed estrarre risultati clinicamente utilizzabili, l'obiettivo è quello di ampliare la gamma di medici che sono in grado di utilizzare POCUS al letto del paziente e di semplificare il processo di trasferimento delle conoscenze e il tempo necessario per raggiungere la competenza18. Questi esami vengono eseguiti con la consapevolezza che potrebbero ancora essere necessarie misurazioni quantitative, innescando il follow-up con studi ecocardiografici consultivi, soprattutto se durante l'esame EASy MAP vengono identificati segni di malattia cronica. Ci sono molte circostanze in cui sia la valutazione EASy MAP che gli esami consultivi saranno appropriati, con EASy MAP che viene eseguito come la valutazione più immediata e la rivalutazione a circuito chiuso della risposta alla terapia.
Ai fini di questo esame e protocollo, definiamo l'ipotensione come una pressione arteriosa media (MAP) inferiore a 65 mmHg 19,20,21,22,23, esclusi i pazienti in arresto cardiaco. Descriviamo un protocollo per l'acquisizione delle immagini (in accordo con le tecniche ecografiche precedentemente stabilite24,25). Descriviamo anche le insidie comuni nell'acquisizione delle immagini e i metodi per l'identificazione dell'anatomia pertinente. Forniamo anche un sistema di punteggio standardizzato a 12 punti per la valutazione della qualità delle immagini cardiache. L'obiettivo di questo protocollo è quello di consentire ai medici di ottenere informazioni immediate sull'eziologia dell'ipotensione del paziente in modo che il piano di trattamento possa essere adattato per affrontare al meglio le condizioni del paziente.
La fattibilità del protocollo EASy MAP come esame POCUS entry-level è stata precedentemente convalidata in un certo numero di popolazioni di pazienti in un piccolo studio di coorte18,26, ecografisti alle prime armi con un solo giorno di formazione didattica in un protocollo EASy simile sono stati in grado di acquisire un'immagine clinicamente utilizzabile in 55 su 63 esami totali (87%; Figura 1). In 100 pazienti ipotesi con sepsi, le immagini dell'esame EASy erano di qualità sufficiente per guidare la gestione del paziente nel 75% dei casi8 e i fenotipi riconosciuti dall'esame EASy erano associati a differenze significative nella gestione del paziente.

Figura 1: Successo degli esami EASy eseguiti dai tirocinanti dopo una didattica di 1 giorno. Un totale di 63 esami sono stati eseguiti su 14 pazienti unici nel corso di 12 giorni. Questa cifra è stata modificata da18. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutte le procedure eseguite negli studi che hanno coinvolto partecipanti umani sono state conformi agli standard etici del comitato di ricerca istituzionale dell'Albany Medical Center e alla Dichiarazione di Helsinki del 1964 e ai suoi successivi emendamenti o standard etici comparabili. Tutti i video che dimostrano il processo di esecuzione degli esami EASy MAP e tutti gli esempi di immagini ecografiche normali (cioè non patologiche) ritraggono gli autori stessi o, in alcuni casi, volontari sani che hanno dato il consenso scritto al coinvolgimento nel processo di ripresa. Il protocollo descritto in questa pubblicazione è stato sviluppato per la valutazione di pazienti adulti con ipotensione arteriosa in un contesto di terapia intensiva; Il suo uso nelle popolazioni pediatriche non è stato studiato attentamente.
1. Selezione del paziente
- Criteri di inclusione
- Esamina i segni vitali del paziente. Se la pressione arteriosa media (MAP) è inferiore a 65 mmHg, assicurarsi che non si siano verificati errori nella misurazione.
- Se il paziente è confermato come ipoteso (MAP < 65 mmHg), eseguire l'esame EASy POCUS per la valutazione dell'ipotensione del paziente.
NOTA: Questa pubblicazione e il protocollo non coprono i pazienti in arresto cardiaco che sono attivamente sottoposti a compressioni toraciche. Inoltre, potrebbero esserci situazioni specifiche in cui il medico può scegliere di utilizzare un valore limite della pressione sanguigna diverso, ma queste esulano dall'ambito di questo protocollo.
- Criteri di esclusione
- Se il paziente non è in grado di sdraiarsi o non è in grado di tollerare la pressione sulla regione sottocostale, prendere in considerazione mezzi alternativi di valutazione emodinamica.
- Se il paziente ha un habitus corporeo che può comportare un significativo degrado della qualità dell'immagine ecografica (ad esempio, obesità estrema), prendere in considerazione mezzi alternativi di valutazione emodinamica.
2. Sicurezza clinica
- Osservare le precauzioni standard secondo il protocollo istituzionale e locale per il controllo delle infezioni e indossare tutti i DPI pertinenti.
- Se il paziente è a rischio elevato di infezioni invasive della cavità toracica o addominale, prendere in considerazione l'applicazione di un coperchio della sonda sterile e l'utilizzo di gel per ultrasuoni sterile caso per caso.
3. Selezione della sonda
- Selezionare una sonda a settori lineari (comunemente indicata come cardiaca o phased array) per tutte le parti degli esami.
NOTA: L'esame può essere condotto anche utilizzando una sonda curvilinea, che offre una maggiore penetrazione al costo di un ingombro maggiore e di una risoluzione temporale (di movimento) significativamente inferiore. La sonda a schieramento di settori fornisce un'adeguata penetrazione dei tessuti e il profilo più piccolo della sonda consente l'imaging degli organi toracici senza un'eccessiva ombreggiatura delle costole. Dato che molte altre sonde ecografiche utilizzano la fasatura per il controllo del fascio27, preferiamo riferirci per evitare di riferirsi alla sonda cardiaca o a sector array come sonda phased array in contesti formali. - Assicurarsi che la sonda sia pulita e priva di contaminanti. Se è contaminato da residui di gel, pulirlo con una salvietta detergente antimicrobica prima di eseguire l'esame.
4. Preimpostazioni della macchina e orientamento dell'immagine
NOTA: Molte indicazioni in questo manoscritto relative ai pulsanti e ai comandi su schermo sono relativamente specifiche per ogni modello di ecografo da comodino. Abbiamo usato il linguaggio per un modello specifico qui; L'esatta sequenza di pulsanti sullo schermo, comandi, nomi preimpostati, ecc., varierà a seconda della produzione e del modello.
- Toccare il pulsante di accensione per accendere la macchina. Toccare il pulsante Sonda in basso a sinistra dello schermo e selezionare Cardiaco adulto per la preimpostazione della sonda. Assicurarsi che B sia selezionato sulla destra dello schermo per l'imaging in modalità B; se non è evidenziato, toccarlo per accedere alla modalità B.
- Dopo aver inserito la preimpostazione Cardiaco per adulti, assicurarsi che l'indicatore del marcatore aderisca alla convenzione cardiologica, ovvero appaia nella parte superiore destra dello schermo.
- Usa il cursore a destra dello schermo per regolare la profondità a 21 cm.
- Toccare il pulsante Qualità immagine a sinistra dello schermo, se presente, e assicurarsi che la frequenza sia impostata sulla frequenza più bassa della sonda (in genere 2 MHz).
- Toccare il pulsante TGC e assicurarsi che la compensazione del guadagno di tempo sia attivata; Aumentare il guadagno lontano per migliorare l'immagine nel campo lontano.
NOTA: Le immagini principali vengono acquisite principalmente come immagini in scala di grigi 2D in modalità B e sono queste immagini descritte nel protocollo qui. In alcuni casi, può essere opportuno eseguire ulteriori step d'esame ad hoc al di fuori del protocollo base utilizzando strumenti come il color Doppler o l'M-mode; Questi sono al di fuori del protocollo principale e devono essere eseguiti a discrezione del medico esaminatore.
5. Acquisizione delle immagini
- Applicare il gel per ultrasuoni sul trasduttore. Posizionare il paziente in posizione supina, se tollerato e pratico.
NOTA: L'intero esame può essere eseguito anche quando il paziente si trova in una posizione non ottimale (es. seduto, non sdraiato, ecc.). Tuttavia, in questi casi è necessario prestare attenzione nell'interpretazione dei risultati dell'IVC. - Eseguire l'acquisizione della vista cardiaca sottocostale a quattro camere come descritto di seguito24.
- Posizionare la sonda 2 cm più in basso rispetto al processo xifoideo (Figura 2, posizione A) con il marcatore rivolto verso la sinistra del paziente (ore 3); Questo viene eseguito al meglio utilizzando una presa a rovescio.
- Intrappolare una piccola piega cutanea con la sonda per garantire un buon contatto tra la sonda e la pelle; Potrebbe essere necessaria una pressione significativa verso l'interno per una qualità dell'immagine soddisfacente. Per i pazienti coscienti o leggermente sedati, prestare attenzione al comfort del paziente secondo necessità.
- Per allineare meglio la sonda con la posizione del cuore, inclinare17 la coda della sonda caudalmente e verso la destra del paziente, spostandosi leggermente fuori dal piano assiale per dirigere il fascio di ultrasuoni cefalico e verso la sinistra del paziente. Questa tecnica in genere sfrutta il lobo sinistro del fegato per migliorare la trasmissione del raggio, quindi un segmento del fegato dovrebbe apparire nella parte superficiale dell'immagine.
- Se necessario, aumenta la profondità utilizzando il cursore a destra dello schermo per catturare l'intero cuore. La vista dovrebbe estendersi leggermente oltre la parete posteriore del ventricolo sinistro (Figura 3, immagine a sinistra) per garantire che l'intero pericardio sia incluso.
- Regolare il guadagno utilizzando il cursore del guadagno in modo che il sangue che riempie le camere appaia nero. Un certo flusso turbolento visibile è accettabile.
NOTA: In alcuni casi, come stati di flusso estremamente bassi o supporto circolatorio meccanico con uscita nativa minima, possono verificarsi coagulazione intraventricolare e/o aggregazione cellulare, con conseguente ecogenicità vorticosa ed eterogenea all'interno dei ventricoli. - Valuta la qualità dell'immagine. L'immagine correttamente acquisita visualizzerà entrambi i ventricoli, entrambi gli atri, e le valvole tricuspide e mitrale, ma non il tratto di efflusso ventricolare sinistro.
- Una volta che il cuore è stato adeguatamente visualizzato, premere Salva clip sullo schermo dell'ecografia per acquisire un video clip di 4 secondi.
NOTA: La durata di 4 s è la lunghezza predefinita tipica della clip per l'apparecchiatura utilizzata per i video che accompagnano questa pubblicazione e questa lunghezza consente generalmente l'acquisizione di più cicli cardiaci alla maggior parte delle frequenze cardiache. Se l'attrezzatura lo consente, l'esaminatore può prendere in considerazione l'utilizzo di una clip di lunghezza maggiore in alcuni casi, ad esempio se la frequenza ventricolare è < 30 bpm.
- Eseguire l'acquisizione della vista IVC sottocostale come descritto di seguito24.
- Rimuovere completamente la sonda dall'area sottocostale (Figura 2, Posizione B) e ruotarla in modo che il marcatore punti cefalica (verso le ore 12). Riposizionare la sonda sull'area sottocostale nella stessa posizione utilizzata per le viste cardiache, ma con un nuovo orientamento per visualizzare l'IVC (Figura 3, immagine a destra). In questa visione, l'IVC sarà all'interno del fegato e può essere tipicamente visto drenare nell'atrio destro del cuore in direzione cefalica.
NOTA: La rimozione completa della sonda dal torace del paziente aiuta a prevenire lo scambio tra la vena epatica destra e l'IVC. Sia le impugnature subdole che quelle overhand sono adatte a questa vista. - Inclinare la sonda per dirigere il raggio leggermente verso la sinistra del paziente (coda della sonda angolata verso la destra del paziente) per localizzare l'aorta. L'aorta sarà immediatamente alla sinistra del paziente dell'IVC e viceversa. Poiché l'aorta addominale e l'IVC sono adiacenti e hanno aspetti ecografici simili, è fondamentale identificare positivamente entrambe le strutture per evitare di confondere l'aorta con un IVC non collassante.
NOTA: L'identificazione della vena epatica che drena nell'IVC dal parenchima epatico può essere utilizzata anche come metodo di identificazione dell'IVC; Tuttavia, preferiamo l'identificazione positiva dell'aorta, dato che questa può essere eseguita in modo affidabile praticamente in tutti i pazienti. - Una volta che l'IVC è stato identificato e adeguatamente visualizzato, prendere nota delle dimensioni massime (cioè del diametro) e della collassabilità inspiratoria (o distensibilità per il paziente in ventilazione a pressione positiva). Le misurazioni manuali sono lo standard preferito, ma può essere utilizzato anche lo strumento di analisi IVC automatizzato dell'ecografo.
- Premere Salva clip sullo schermo dell'ecografia per acquisire un video clip di 4 secondi dell'IVC.
- Premere Salva clip sullo schermo dell'ecografia per acquisire un video clip di 4 secondi dell'aorta.
NOTA: Oltre al protocollo di base, è possibile ottenere ulteriori visualizzazioni opzionali dopo aver identificato l'aorta. L'oscillazione della coda della sonda inferiormente consente la visualizzazione della valvola aortica mentre la si fa oscillare inferiormente e la si inclina verso la destra del paziente, con rotazione verso la spalla sinistra del paziente, rivelando la vista dell'asse corto mediopapillare. Se è necessaria una valutazione del volume gastrico o dello stato di digiuno, l'antro gastrico può essere visualizzato facendo oscillare la coda della sonda cefalica dall'aorta.
- Rimuovere completamente la sonda dall'area sottocostale (Figura 2, Posizione B) e ruotarla in modo che il marcatore punti cefalica (verso le ore 12). Riposizionare la sonda sull'area sottocostale nella stessa posizione utilizzata per le viste cardiache, ma con un nuovo orientamento per visualizzare l'IVC (Figura 3, immagine a destra). In questa visione, l'IVC sarà all'interno del fegato e può essere tipicamente visto drenare nell'atrio destro del cuore in direzione cefalica.
- Acquisizione delle viste ecografiche del polmone superiore
- Rimuovere la sonda dalla posizione sottocostale; Riapplicare il gel per ultrasuoni se necessario. Rimuovere il gel in eccesso dall'addome del paziente.
- Posizionare la sonda nel 2° spazio intercostale sulla linea medioclavicolare destra, con il marcatore della sonda in posizione ore 12 (Figura 4 immagine a sinistra).
- Applicare una leggera pressione sulla sonda e/o far scorrere verticalmente la sonda secondo necessità per ridurre al minimo il grado in cui la vista è oscurata dall'ombreggiatura delle nervature, che appare come ombre acustiche verticali create dalla densa corteccia delle nervature.
- La pleura, che funge da riflettore speculare degli ultrasuoni, è meglio visualizzata quando il fascio di ultrasuoni è perpendicolare alla sua superficie. Per ottimizzare questa operazione, inclinare leggermente lateralmente la coda della sonda per tenere conto della curvatura naturale della parete toracica.
- Regolare il guadagno in modo che gli spazi aerei del parenchima polmonare appaiano neri (Figura 5 a destra).
- Se la qualità dell'immagine è scarsa, toccare il pulsante Sonda in basso a sinistra dello schermo e selezionare Polmone adulto per la preimpostazione della sonda. Ripetere 5.4.5 secondo necessità.
NOTA: Il passaggio da una preimpostazione per ecografia cardiaca a una preimpostazione per ecografia polmonare sposta l'indicatore del marcatore della sonda sul lato sinistro dello schermo e inverte l'orientamento dell'immagine. - Una volta ottenuta una visuale soddisfacente tra le nervature, premere il pulsante Salva clip sullo schermo per ottenere un video clip per un'analisi successiva.
- Ripetere il processo (5.4.2-5.4.4) con il polmone superiore sinistro, posizionando la sonda nel 2°spazio intercostale in corrispondenza della linea medioclavicolare sinistra (Figura 2 posizione D).
- Acquisizione delle viste ecografiche pleuriche
- Rimuovere il gel in eccesso dalla parte anteriore del torace. Riapplicare il gel sulla sonda secondo necessità.
- Posizionare la sonda sulla linea medioascellare destra (Figura 5 , immagine a destra) sullo stesso piano orizzontale della vista cardiaca subxifoidea. Orientare la sonda con l'indicatore a ore 12 (cioè diretto superiormente).
- Identificare il fegato (Figura 5 immagine a sinistra), quindi inclinare la sonda per dirigere il fascio in una direzione più cefalica e identificare il diaframma, che dovrebbe essere visto come una banda iperecogena curva immediatamente cefalica al fegato. In alcuni casi, può essere necessario far scorrere la sonda più posteriormente per migliorare la finestra di trasmissione del fascio attraverso il parenchima epatico.
- Inclinare la coda della sonda in direzione anteriore per identificare la superficie anteriore della colonna vertebrale, visibile nella parte inferiore dello schermo. Poiché il fascio di ultrasuoni non può penetrare efficacemente l'osso, la colonna vertebrale apparirà come una linea iperecogena con ombre scure al di là di essa.
- Identifica il polmone, che dovrebbe spazzare una grande ombra acustica sullo schermo (da sinistra a destra) con l'ispirazione.
- Una volta che il fegato, il diaframma, la colonna vertebrale e il polmone sono stati visualizzati contemporaneamente, premere Salva clip sullo schermo dell'ecografia per acquisire un video clip per un'analisi successiva.
- Riposizionare la sonda sulla linea ascellare posteriore sinistra, sullo stesso piano orizzontale della vista cardiaca sottocostale, con il marcatore nella posizione delle ore 12 (Figura 6 immagine a destra).
- Identificare la milza (Figura 6 , immagine a sinistra). Se c'è difficoltà a visualizzare la milza a causa dell'aria gastrica o dell'anatomia del paziente, può essere utile far scorrere la sonda posteriormente (nella misura in cui il lettino da visita e la parete toracica del paziente lo consentono) e identificare il rene sinistro, che generalmente si trova inferiore alla milza.
- Identificare l'emidiaframma sinistro superiore alla milza. Come a destra, dovrebbe apparire come una linea iperecogena luminosa.
- Identificare la colonna vertebrale e il polmone, come nei punti 5.5.3 e 5.5.5. Una volta che la milza, il diaframma, la colonna vertebrale e il polmone sono stati visualizzati contemporaneamente, premere il pulsante Video , quindi premere Salva clip sul touchscreen dell'ecografia per acquisire un video clip per un'analisi successiva.
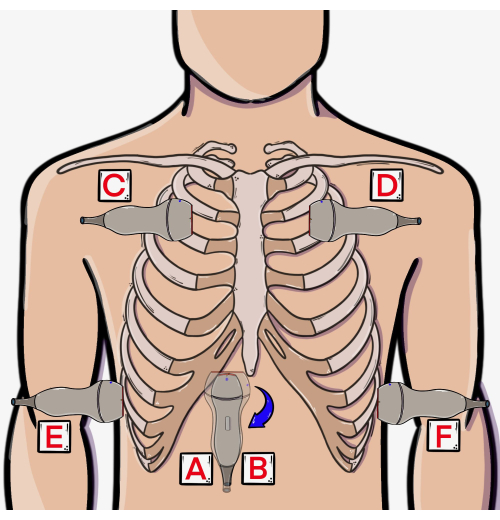
Figura 2: Posizioni approssimative della sonda per le fasi del protocollo EASy. (A) Vista cardiaca sottocostale, (B) IVC sottocostale, (C, D) polmone e (E, F) vista pleurica. Abbreviazioni: RUL = lobo superiore destro, LUL = lobo superiore sinistro, RML = lobo medio destro, RLL = lobo inferiore destro, LLL = lobo inferiore sinistro. Questa cifra è stata modificata da36. Clicca qui per visualizzare una versione più grande di questa figura.
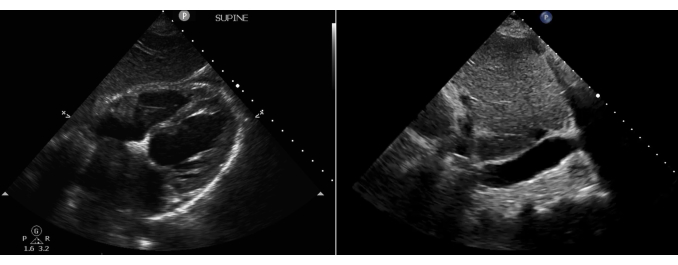
Figura 3: Cuore normale in vista cardiaca sottocostale a 4 camere (a sinistra) e IVC normale visto in vista IVC sottocostale (a destra). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Normale vista ecografica del polmone superiore destro e posizione della sonda. La figura mostra la vista ecografica (a sinistra) e la posizione della sonda (a destra). Abbreviazioni: RUL = lobo superiore destro, LUL = lobo superiore sinistro, RML = lobo medio destro, RLL = lobo inferiore destro, LLL = lobo inferiore sinistro. Questa cifra è stata modificata da36. Clicca qui per visualizzare una versione più grande di questa figura.
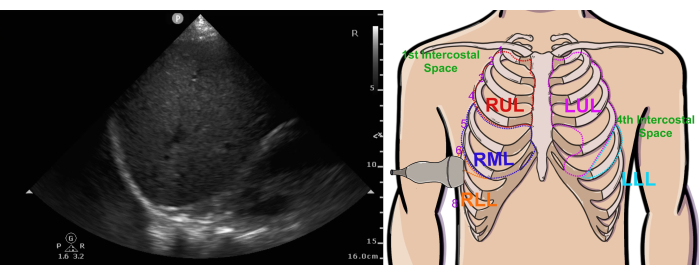
Figura 5: Vista normale dell'ecografia pleurica destra e posizione della sonda. La figura mostra la vista ecografica (a sinistra) e la posizione della sonda (a destra). Abbreviazioni: RUL = lobo superiore destro, LUL = lobo superiore sinistro, RML = lobo medio destro, RLL = lobo inferiore destro, LLL = lobo inferiore sinistro. Questa cifra è stata modificata da36. Clicca qui per visualizzare una versione più grande di questa figura.
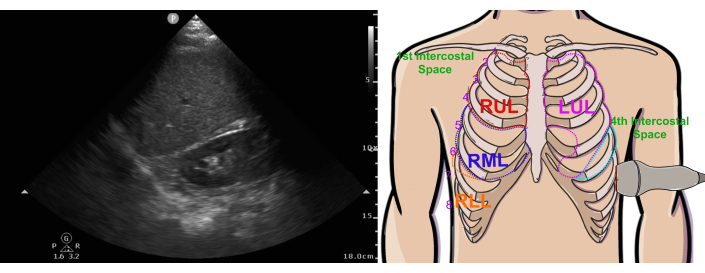
Figura 6: Ecografia pleurica sinistra normale. Abbreviazioni: RUL = lobo superiore destro, LUL = lobo superiore sinistro, RML = lobo medio destro, RLL = lobo inferiore destro. Questa cifra è stata modificata da36. Clicca qui per visualizzare una versione più grande di questa figura.
6. Interpretazione delle immagini
- Interpretazione delle immagini IVC
- Valuta l'IVC in base a due criteri principali: diametro e collassabilità inspiratoria.
NOTA: Ai fini del presente protocollo, un diametro normale di IVC è definito come 0,9-2,1 cm di diametro, misurato durante l'espirazione; un IVC disteso è definito come > 2,1 cm e un IVC piatto < 0,9 cm 24,28,29. L'IVC di un paziente è descritto come collassabile se mostra > collasso del 50% durante l'inspirazione; un IVC che ha < collasso del 50% è descritto come pletorico. Questi criteri richiedono che il paziente respiri spontaneamente, senza l'uso della ventilazione a pressione positiva. Questi cutoff numerici sono destinati a un paziente che non riceve ventilazione a pressione positiva (PPV). La PPV può confondere in modo significativo la valutazione dell'IVC a causa dell'aumento della pressione intratoracica, che riduce la variabilità delle dimensioni. Un cutoff di variabilità del diametro del 15% (piuttosto che del 50%) può essere preso in considerazione per i pazienti in PPV quando si considera il giusto precarico cardiaco e la reattività al volume del paziente 16,30,31,32. - Sulla base di queste due caratteristiche, suddividere i pazienti in una delle tre categorie: scarso ritorno venoso (IVC piatto e pieghevole), scarso flusso in avanti (IVC allungato, pletorico) o nessuna delle precedenti (IVC non soddisfa nessuno dei due criteri precedenti e quindi è grossolanamente normale).
NOTA: L'interpretazione e la gestione diagnostica complessiva dipenderanno dallo scenario clinico del paziente e dalle informazioni ottenute dalle altre opinioni.
- Valuta l'IVC in base a due criteri principali: diametro e collassabilità inspiratoria.
- Interpretazione delle immagini cardiache sottocostali
- Registrare la qualità complessiva delle immagini cardiache assegnando a ciascuno dei sei elementi cardinali (pericardio, dimensioni del ventricolo destro, funzione del ventricolo destro, setto interventricolare, dimensione del ventricolo sinistro, funzione del ventricolo sinistro) un punteggio di 0, 1 o 2.
- Assegnare un punteggio pari a 0 se le rispettive caratteristiche non possono essere valutate dalle immagini ottenute o se la struttura non è stata visualizzata affatto; assegnare un punteggio di 1 per immagini non ottimali ma utilizzabili, che richiedono ulteriori viste cardiache per ottenere un quadro clinico soddisfacente; e un punteggio di 2 per le immagini di alta qualità che forniscono una chiara valutazione delle rispettive strutture.
- Sommare i punteggi di tutti e 6 gli elementi cardinali del cuore (pericardio, dimensione del ventricolo destro, funzione del ventricolo destro, setto interventricolare, dimensione del ventricolo sinistro, funzione del ventricolo sinistro) per ottenere il punteggio totale. Si consideri un punteggio totale di 10-12 una visione cardiaca di alta qualità, 7-9 adeguata e 6 o meno un'immagine di scarsa qualità.
NOTA: è improbabile che le immagini classificate come scarse siano utilizzabili per il processo decisionale clinico, sebbene gli altri elementi dell'esame (ad es. IVC, polmoni, pleura) possano comunque essere perseguibili. - Valutare il cuore in modo sistematico, utilizzando un ordinamento standardizzato delle strutture e identificando modelli specifici (fenotipi).
- Pericardio: valutare la presenza di liquido pericardico non banale, definito in questo protocollo come versamento >10 mm visibile in tutta la sistole e la diastole. Il pattern del tamponamento cardiaco (fenotipo 8) è una diagnosi clinica, supportata da segni ecografici di elevata pressione intrapericardica, come il collasso atriale durante la sistole o il collasso ventricolare durante la diastole33.
- Ventricolo destro: valutare le dimensioni e la funzione del ventricolo destro (RV). Una riduzione minima delle dimensioni della cavità del ventricolo destro durante la sistole e il movimento anulare della tricuspide depresso indicano una compromissione della funzione sistolica del ventricolo destro. Se il ventricolo destro è gravemente dilatato (rapporto tra dimensioni ventricolari > 1), valutare la presenza di segni di disfunzione cronica sottostante, come lo spessore della parete del ventricolo destro durante la diastole superiore a 1 cm o l'allargamento visibile dell'atrio destro. (Fenotipi 6 e 7, Figura 7).
- Setto interventricolare: Valutare lo spessore del setto interventricolare durante la diastole, verificando la presenza di assottigliamento, rottura o ipertrofia. Se si osserva una dilatazione del ventricolo destro, valutare lo spostamento del setto interventricolare verso il ventricolo sinistro.
- Ventricolo sinistro: valutare le dimensioni e la funzione del ventricolo sinistro (LV), identificando eventuali dilatazioni gravi (fenotipi 4 e 5, Figura 7) o ispessimenti significativi della parete (fenotipo 3). Valutare la funzione sistolica gravemente ridotta, concentrandosi sulle anomalie visive evidenti in questa fase del protocollo. La grave disfunzione sistolica è indicata da una riduzione minima o nulla delle dimensioni della cavità ventricolare sinistra durante la sistole, da una marcata riduzione dell'anulus della valvola mitrale e dal movimento anteriore del lembo della valvola mitrale.
NOTA: Un forte aumento dello spessore della parete (ipertrofia concentrica) può confondere la valutazione dell'ipovolemia a causa della diminuzione delle dimensioni della cavità. L'esaminatore può facoltativamente eseguire valutazioni quantitative della funzione sistolica e diastolica, ma queste esulano dall'ambito di questo particolare protocollo.
- Dopo aver esaminato le immagini cardiache, integrare questi dati con le informazioni sulle condizioni di precarico (dall'esame IVC), sulla tolleranza al volume (ad esempio, presenza o assenza di linee B sull'ecografia del polmone superiore) e sul contesto clinico del paziente. Questa valutazione combinata aiuta a determinare lo stato cardiovascolare generale e guida la successiva gestione. Sulla base di questi risultati, classificare i pazienti in specifici fenotipi cardiovascolari (Figura 7).
- Per valutare un pattern emodinamico distributivo (fenotipo 2), verificare l'adeguata area telediastolica del ventricolo sinistro e del ventricolo destro, la funzione sistolica ipercontrattile o iperdinamica sia nel ventricolo destro che nel ventricolo sinistro (riduzione del >50% delle dimensioni della cavità ventricolare durante la sistole), il normale ispessimento sistolico (>30%) e il movimento robusto dell'anulus della valvola mitrale e del lembo anteriore della valvola mitrale. Altre caratteristiche includono un diametro normale dell'IVC con un'appropriata variabilità respiratoria e un profilo A sull'ecografia polmonare.
- Controllare i seguenti indicatori per un pattern emodinamico ipovolemico (fenotipo 1 della MH): le aree telediastoliche del ventricolo sinistro e del ventricolo destro sono piccole, spesso accompagnate da un IVC piatto.
- Se le immagini cardiache sottocostali indicano una malattia cardiovascolare cronica (ad esempio, aumento dello spessore della parete, ingrossamento atriale, malattia valvolare significativa o ipocinesi), ottenere un ecocardiogramma consultivo formale il prima possibile.
- Registrare la qualità complessiva delle immagini cardiache assegnando a ciascuno dei sei elementi cardinali (pericardio, dimensioni del ventricolo destro, funzione del ventricolo destro, setto interventricolare, dimensione del ventricolo sinistro, funzione del ventricolo sinistro) un punteggio di 0, 1 o 2.
- Interpretazione delle immagini del polmone superiore25
- Determinare la presenza di linee A e/o linee B nei polmoni destro e sinistro. Se non si vedono né le linee A né le linee B, ricontrollare l'orientamento della sonda e la qualità dell'immagine. La mancanza di linee A o B suggerisce che la sonda non è orientata all'angolo corretto rispetto alle pleure.
- Valutare la presenza di scivolamento polmonare. Lo scivolamento polmonare è visto come il movimento laterale dei due strati pleurici l'uno rispetto all'altro durante il ciclo respiratorio34.
- Interpretazione delle immagini pleuriche
- Valutare la presenza di versamento pleurico (o altro liquido pleurico in eccesso, come l'emotorace nei pazienti traumatizzati) nei polmoni destro e sinistro. Se è presente versamento, prendere nota di eventuali loculazioni.
- Valutare la presenza di eventuali consolidamenti, che possono essere osservati direttamente (ad esempio, come irregolarità iperecogena all'interno del parenchima polmonare) o più indirettamente (ad esempio, attraverso un segno della colonna vertebrale o la perdita della cortina dello spazio aereo)35.
7. Eziologie comuni dell'ipotensione e risultati dell'esame EASy
- Monitoraggio e contesto clinico
- Considerare i segni vitali del paziente e tutti i dati elettrocardiografici, come i tracciati del monitor o gli ECG formali, valutando la presenza di qualsiasi nuova insorgenza di tachicardia grave, bradicardia o aritmia.
- Se si nota una nuova insorgenza di grave bradicardia o aritmia come tachicardia ventricolare, tachicardia da rientro atrioventricolare o fibrillazione atriale con risposta ventricolare rapida, considerarli prima di considerare altre cause di ipotensione.
- Considerare la storia clinica, la natura della malattia attuale e qualsiasi intervento chirurgico recente o altre procedure quando si interpretano le immagini e si valuta l'eziologia dell'ipotensione. Sebbene ci siano più casi limite di quelli che possono essere ragionevolmente descritti in un singolo protocollo, è necessario prestare particolare attenzione a qualsiasi storia di lesioni traumatiche recenti, interventi chirurgici addominali, pelvici o toracici o gravi malattie polmonari, poiché questi possono influenzare in modo significativo il ritorno venoso e la resistenza vascolare polmonare.
- Valutazione della gittata sistolica
- Se la valutazione ecografica rivela un pattern emodinamico di IVC (scarso ritorno venoso) piatto e collassante e un cuore iperdinamico con piccole cavità ventricolari (coerente con il fenotipo 1 della MH nella Figura 7), considerare questo come un basso volume sistolico dovuto all'ipovolemia.
- Si noti che in alcuni casi, uno scarso ritorno venoso avrà eziologie diverse dalla deplezione di volume intravascolare di per sé; Nei pazienti con aumento della pressione intra-addominale, ad esempio da un utero gravido, sindrome compartimentale addominale o eccessiva insufflazione durante la chirurgia laparoscopica o robotica, considerare la fisiologia ostruttiva intra-addominale come una potenziale causa di bassa gittata sistolica e ipotensione. Verificare la presenza di linee A polmonari, che supporteranno ulteriormente la diagnosi di ipovolemia.
- Se la valutazione ecografica ha rivelato un IVC pletorico dilatato (scarso flusso in avanti) e un ventricolo sinistro dilatato e gravemente ipocinetico, fare una diagnosi presuntiva di shock cardiogeno (insufficienza della pompa). Verificare la presenza della linea B all'esame polmonare e/o del versamento pleurico semplice, che supporterà ulteriormente questa diagnosi; vedi Fenotipi del Cluster 2 nella Figura 7.
- Se la valutazione ecografica ha rivelato una IVC pletorica senza evidente dilatazione del ventricolo sinistro, valutare rapidamente ed escludere potenziali cause ostruttive intratoraciche di ipotensione. Questi possono includere tamponamento pericardico, cuore polmonare acuto o acuto su cronico, grave malattia valvolare, pneumotorace da tensione, auto-PEEP o versamento pleurico o emotorace di grandi dimensioni (vedere Figura 7 e Figura 8).
NOTA: Molte delle diagnosi di cui sopra possono essere associate a risultati di supporto sulle porzioni polmonari e pleuriche dell'esame, come il rilevamento di grandi quantità di liquido pleurico o la mancanza di scivolamento polmonare nello pneumotorace da tensione. Le cause ostruttive di shock e ipotensione possono influire in modo significativo sul diametro massimo e sulla variazione dell'IVC, indipendentemente dallo stato del volume intravascolare.
- Se la valutazione ecografica rivela un pattern emodinamico di IVC (scarso ritorno venoso) piatto e collassante e un cuore iperdinamico con piccole cavità ventricolari (coerente con il fenotipo 1 della MH nella Figura 7), considerare questo come un basso volume sistolico dovuto all'ipovolemia.
- Stato vasodilatatore/tono vascolare
- Se l'esame EASy MAP non rivela risultati ecografici evidentemente anomali, ma il paziente rimane ipoteso, considerare uno stato vasodilatatore arterioso come potenziale diagnosi (Figura 7, Fenotipo 2).
- Se l'unico reperto anomalo identificato nell'esame EASy MAP è un IVC dilatato senza insufficienza della pompa e sono state escluse cause di ostruzione intratoracica, prendere in considerazione una diagnosi di vasodilatazione. L'IVC può anche essere dilatato in pazienti con una storia recente di posizionamento di shunt portosistemico.

Figura 7: Uno schema di diversi IVC/fenotipi cardiaci comuni e processi patologici/scenari clinici associati. Questa cifra è stata modificata da6. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Fenotipi non comuni identificati meno frequentemente. Questa cifra è stata modificata da6. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Quando il protocollo EASy viene utilizzato per valutare il paziente con ipotensione, un esame di successo è ampiamente definito come un esame che chiarisce il quadro diagnostico (in questo caso, l'eziologia sottostante dell'ipotensione) in misura sufficiente a guidare immediatamente la gestione del paziente. Al contrario, un esame non superato è un esame che non è utile per guidare la gestione e non fornisce informazioni sufficienti per portare a raccomandazioni attuabili. L'imaging di alta qualità è essenziale per il successo di un esame EASy MAP, con esempi rappresentativi mostrati in Figura 3, Figura 4, Figura 5, Figura 6 e Figura 7. Al contrario, è improbabile che un esame di bassa qualità (ad esempio, un punteggio di qualità < 6) fornisca una guida affidabile per la gestione e dovrebbe essere considerato un esame EASy MAP non riuscito.
Sia gli esami EASy riusciti che quelli non riusciti possono essere seguiti da un ulteriore esame ecocardiografico. Ad esempio, in una piccola coorte di terapia intensiva di 14 pazienti, il 43% dei pazienti con esame EASy riuscito è risultato avere caratteristiche ecografiche di malattia cardiovascolare cronica come l'ipertrofia ventricolare18. In definitiva, l'utilità dell'esame EASy MAP per la cura di un singolo paziente dipenderà da molti fattori, come la qualità delle immagini ottenute, la presenza di una malattia cardiaca cronica sottostante e il grado di dubbio clinico sull'eziologia dell'ipotensione.
Discussione
Il protocollo EASy MAP è solo uno dei numerosi protocolli ecografici che possono essere clinicamente utili nella valutazione di un paziente con instabilità emodinamica acuta37,38. A differenza di molti esami più complessi, tuttavia, il cuore dell'esame EASy è la sua brevità e semplicità, che consente all'utente di identificare rapidamente molte patologie comuni al letto del paziente attraverso il riconoscimento di modelli18. L'enfasi sul riconoscimento dei modelli consente un trasferimento semplificato delle conoscenze durante l'esecuzione della formazione iniziale degli ecografisti alle prime armi; EASy MAP ha anche meno passaggi per l'acquisizione rispetto ad altri esami, come l'ecocardiografia transtoracica con valutazione del focus (FATE)37, che riduce la barriera tecnica per i nuovi ecografisti e il tempo per l'acquisizione.
L'obiettivo di questo protocollo, quindi, è quello di consentire a un'ampia gamma di operatori di generare informazioni diagnostiche immediatamente fruibili e sufficienti per informare il piano di trattamento sui tempi di stabilizzazione acuta. I dati osservazionali preliminari 8,39,40 con un totale di 100 pazienti suggeriscono che il completamento del protocollo EASy MAP comporta cambiamenti nella gestione nella maggior parte dei casi nei pazienti con sepsi ipotensiva. Tuttavia, in questi pazienti, la visione cardiaca sottocostale non era ottenibile nel 13% dei pazienti e l'IVC non è stata visualizzata nel 9% dei pazienti. In tali pazienti, è tipicamente necessaria un'ulteriore valutazione - mediante protocollo POCUS alternativo o eco consultiva formale- 6. Allo stesso modo, circa la metà (52%) di questa popolazione di pazienti è risultata avere segni significativi di malattia cronica, che dovrebbero innescare una valutazione consultiva dopo la stabilizzazione acuta.
Quando si esegue l'esame, è importante considerare alcune insidie di base. Per molti esaminatori alle prime armi, la bassa qualità dell'immagine è il risultato di una scarsa tecnica ecografica; L'esaminatore deve assicurarsi che la quantità di gel per ultrasuoni sia sufficiente e che venga applicata una pressione sufficiente con la mano della sonda. Gli esaminatori alle prime armi possono anche afferrare la sonda troppo lontano dall'emettitore o troppo strettamente, compromettendo la capacità di manipolare la sonda per l'ottimizzazione dell'immagine. Più fondamentalmente, la vista cardiaca sottocostale può occasionalmente sottostimare le dimensioni del ventricolo destro e può non riuscire a catturare completamente il segmento medio cardiaco e l'apice; In un confronto testa a testa tra esami sottocostali e esami più completi eseguiti da ecografisti alle prime armi, ad esempio, la sola vista sottocostale non è riuscita a rilevare circa il 9% e il 5,5% dei casi di dilatazione del ventricolo destro e disfunzione sistolica del ventricolo sinistro, rispettivamente40. Se la sensibilità è di fondamentale importanza clinica, l'esaminatore può prendere in considerazione l'aggiunta di ulteriori visualizzazioni (e quindi discostarsi dal protocollo EASy MAP in quanto tale).
In particolare, il protocollo EASy MAP non è progettato per valutazioni quantitative o complete, né è destinato all'uso in pazienti non ipotesi. Gli esaminatori che desiderano valutare la patologia cardiovascolare o respiratoria in modo più dettagliato (ad esempio, la valutazione della patologia della valvola aortica o le misurazioni quantitative della gittata cardiaca) devono aspettarsi di aggiungere ulteriori punti di vista al di fuori dell'ambito di questo protocollo e/o un ecocardiogramma consultivo. È importante sottolineare che il protocollo non ha lo scopo di sostituire altri esami ecografici o il giudizio clinico, ma di aumentare il processo decisionale in scenari che altrimenti si baserebbero esclusivamente sull'esame fisico o sulla gestalt clinica. Ad esempio, in ambienti preospedalieri o austeri in cui le informazioni disponibili sono limitate, EASy MAP fornisce un quadro sistematico per identificare le patologie comuni e guidare la gestione iniziale. Tuttavia, come sempre, il contesto clinico rimane critico e considerazioni come la differenziazione dell'ipovolemia dalla sindrome compartimentale addominale sottolineano la necessità di una valutazione olistica.
Se l'esame EASy MAP rimane insufficiente nonostante l'ottimizzazione della tecnica d'esame, ad esempio in presenza di fattori non modificabili come l'habitus corporeo del paziente, le idiosincrasie anatomiche o la qualità dell'ecografo, possono essere utili ulteriori visualizzazioni cardiache8. L'esaminatore può prendere in considerazione l'annidamento del protocollo EASy all'interno di un esame più completo (ad esempio, STARS6), che può essere utilizzato come test di riflessione se l'EASy da solo è insufficiente. In pratica, l'asse corto sottocostale, le quattro e cinque camere apicali e le viste lunghe e corte parasternali vengono spesso aggiunte durante la parte cardiaca dell'esame se vengono identificati segni di cardiopatia cronica o, in alcuni casi, se la qualità della vista sottocostale a 4 camere è scarsa o si ritiene non rivelatrice. Al contrario, in alcuni casi, si noterà un'anomalia evidente prima che il protocollo sia completo; ciò comporta il rischio di una chiusura prematura della diagnosi e, di conseguenza, è importante evitare di fare una diagnosi prima del completamento di tutte le visualizzazioni nel protocollo EASy, poiché le ulteriori visualizzazioni IVC e polmonari possono rivelare ulteriori informazioni che modificano la diagnosi presuntiva.
Divulgazioni
Gli autori non hanno divulgazioni rilevanti.
Riconoscimenti
Gli autori desiderano riconoscere la leadership dell'Albany Medical College per il loro sostegno agli studenti che lavorano sotto gli auspici della Summer Research Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Phased Array Ultraosund Probe | Mindray | P4-2S | Probe used for all components of exam |
| Portable Ultrasound System | Mindray | TE7 | Portable/bedside POCUS unit |
| Ultrasound Gel | Aquasonic | PLI 01-08 | Aqueous sonographic conduction gel |
Riferimenti
- Bronshteyn, Y. S., Blitz, J., Hashmi, N., Krishnan, S. Logistics of perioperative diagnostic point-of-care ultrasound: Nomenclature, scope of practice, training, credentialing/privileging, and billing. Int Anesthesiol Clin. 60 (3), 1-7 (2022).
- Diaz-Gomez, J. L., Mayo, P. H., Koenig, S. J. Point-of-care ultrasonography. N Engl J Med. 385 (17), 1593-1602 (2021).
- Kirkpatrick, J. N., et al. Recommendations for cardiac point-of-care ultrasound nomenclature. J Am Soc Echocardiogr. 11 (24), (2024).
- Picard, M. H., et al. American society of echocardiography recommendations for quality echocardiography laboratory operations. J Am Soc Echocardiogr. 24 (1), 1-10 (2011).
- Bughrara, N., Diaz-Gomez, J. L., Pustavoitau, A. Perioperative management of patients with sepsis and septic shock, part ii: Ultrasound support for resuscitation. Anesthesiol Clin. 38 (1), 123-134 (2020).
- Nikravan, S., et al. An echocardiographic approach for the management of shock: The subcostal to apical, respiratory to parasternal-cardiac to respiratory, aortic to stomach protocol. Semin Ultrasound CT MR. 45 (1), 74-83 (2024).
- Nikravan, S., Song, P., Bughrara, N., Diaz-Gomez, J. L. Focused ultrasonography for septic shock resuscitation. Curr Opin Crit Care. 26 (3), 296-302 (2020).
- Bughrara, N., et al. 1479: Rapid ultrasound evaluation of patients with sepsis-associated hypotension using pattern recognition. Crit Care Med. 52 (S), S710(2024).
- Caplan, M., et al. Measurement site of inferior vena cava diameter affects the accuracy with which fluid responsiveness can be predicted in spontaneously breathing patients: A post hoc analysis of two prospective cohorts. Ann Intensive Care. 10 (1), 168(2020).
- Ginghina, C., Beladan, C. C., Iancu, M., Calin, A., Popescu, B. A. Respiratory maneuvers in echocardiography: A review of clinical applications. Cardiovasc Ultrasound. 7, 42(2009).
- Griffin, M., et al. Inferior vena cava diameter measurement provides distinct and complementary information to right atrial pressure in acute decompensated heart failure. J Card Fail. 28 (7), 1217-1221 (2022).
- Long, E., Oakley, E., Duke, T., Babl, F. E. Paediatric Research in Emergency Departments International, C. Does respiratory variation in inferior vena cava diameter predict fluid responsiveness: A systematic review and meta-analysis. Shock. 47 (5), 550-559 (2017).
- Orso, D., et al. Accuracy of ultrasonographic measurements of inferior vena cava to determine fluid responsiveness: A systematic review and meta-analysis. J Intensive Care Med. 35 (4), 354-363 (2020).
- Preau, S., et al. Diagnostic accuracy of the inferior vena cava collapsibility to predict fluid responsiveness in spontaneously breathing patients with sepsis and acute circulatory failure. Crit Care Med. 45 (3), e290-e297 (2017).
- Yao, B., Liu, J. Y., Sun, Y. B., Zhao, Y. X., Li, L. D. The value of the inferior vena cava area distensibility index and its diameter ratio for predicting fluid responsiveness in mechanically ventilated patients. Shock. 52 (1), 37-42 (2019).
- Vignon, P., et al. Comparison of echocardiographic indices used to predict fluid responsiveness in ventilated patients. Am J Respir Crit Care Med. 195 (8), 1022-1032 (2017).
- Geri, G., et al. Cardiovascular clusters in septic shock combining clinical and echocardiographic parameters: A post hoc analysis. Intensive Care Med. 45 (5), 657-667 (2019).
- Bughrara, N. F., et al. Is 1 day of focused training in echocardiographic assessment using subxiphoid-only (easy) examination enough? A tertiary hospital response to the COVID-19 crisis and the use of the easy examination to support unit-wide image acquisition. Crit Care Explor. 6 (3), e1038(2024).
- Evans, L., et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 47 (11), 1181-1247 (2021).
- Maheshwari, K., et al. The relationship between ICU hypotension and in-hospital mortality and morbidity in septic patients. Intensive Care Med. 44 (6), 857-867 (2018).
- Sarkar, S., Singh, S., Rout, A. Mean arterial pressure goal in critically ill patients: A meta-analysis of randomized controlled trials. J Clin Med Res. 14 (5), 196-201 (2022).
- Schenk, J., et al. Definition and incidence of hypotension in intensive care unit patients, an international survey of the European society of intensive care medicine. J Crit Care. 65, 142-148 (2021).
- Asfar, P., et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med. 370 (17), 1583-1593 (2014).
- Mitchell, C., et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: Recommendations from the American society of echocardiography. J Am Soc Echocardiogr. 32 (1), 1-64 (2019).
- Pereira, R. O. L., et al. Point-of-care lung ultrasound in adults: Image acquisition. J Vis Exp. (193), e64722(2023).
- Bughrara, N., Quaranta, N., Pustavoitau, A., Shah, Q. Preintubation echocardiographic assessment using subcostal-only view (easy) exam: A case series. Crit Care Med. 50 (1), 696-696 (2022).
- Fischetti, A. J., Scott, R. C. Basic ultrasound beam formation and instrumentation. Clin Tech Small Anim Pract. 22 (3), 90-92 (2007).
- Di Nicolo, P., Tavazzi, G., Nannoni, L., Corradi, F. Inferior vena cava ultrasonography for volume status evaluation: An intriguing promise never fulfilled. J Clin Med. 12 (6), 2217(2023).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the american society of echocardiography and the european association of cardiovascular imaging. J Am Soc Echocardiogr. 28 (1), 1-39.e14 (2015).
- Feissel, M., Michard, F., Faller, J. P., Teboul, J. L. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med. 30 (9), 1834-1837 (2004).
- Levitov, A., et al. Guidelines for the appropriate use of bedside general and cardiac ultrasonography in the evaluation of critically ill patients-part ii: Cardiac ultrasonography. Crit Care Med. 44 (6), 1206-1227 (2016).
- Schefold, J. C., et al. Inferior vena cava diameter correlates with invasive hemodynamic measures in mechanically ventilated intensive care unit patients with sepsis. J Emerg Med. 38 (5), 632-637 (2010).
- Klein, A. L., et al. American society of echocardiography clinical recommendations for multimodality cardiovascular imaging of patients with pericardial disease: Endorsed by the society for cardiovascular magnetic resonance and society of cardiovascular computed tomography. J Am Soc Echocardiogr. 26 (9), 965-1012.e15 (2013).
- Bhoil, R., Ahluwalia, A., Chopra, R., Surya, M., Bhoil, S. Signs and lines in lung ultrasound. J Ultrason. 21 (86), e225-e233 (2021).
- Fox, W. C., Krishnamoorthy, V., Hashmi, N., Bronshteyn, Y. S. Pneumonia: Hiding in plain (film) sight. J Cardiothorac Vasc Anesth. 34 (11), 3154-3157 (2020).
- Master the Machines. , masterthemachines.com (2024).
- Nagre, A. S. Focus-assessed transthoracic echocardiography: Implications in perioperative and intensive care. Ann Card Anaesth. 22 (3), 302-308 (2019).
- Richards, J. R., Mcgahan, J. P. Focused assessment with sonography in trauma (fast) in 2017: What radiologists can learn. Radiology. 283 (1), 30-48 (2017).
- Sanfilippo, F., La Via, L., Flower, L., Madhivathanan, P., Astuto, M. The value of subcostal echocardiographic assessment, and directions for future research. Can J Anaesth. 69 (5), 676-677 (2022).
- Bughrara, N., et al. Comparison of qualitative information obtained with the echocardiographic assessment using subcostal-only view and focused transthoracic echocardiography examinations: A prospective observational study. Can J Anaesth. 69 (2), 196-204 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon