Method Article
Effetti del Desmodium caudatum sugli ormoni gastrointestinali e sulla flora intestinale nei ratti con gastrite
In questo articolo
Riepilogo
Il presente protocollo descrive il metodo per l'analisi della flora intestinale utilizzando il sequenziamento del gene rRNA 16S basato su Illumina e fornisce un quadro per valutare l'efficacia dei decotti a base di erbe.
Abstract
Al fine di esplorare preliminarmente gli effetti del Desmodium caudatum sulla gastrite e sulla flora intestinale nei ratti, è stato stabilito un modello di ratto con gastrite cronica utilizzando il classico metodo del salicilato di sodio. Diciotto ratti SPF sono stati divisi in tre gruppi: il gruppo di controllo (Gruppo C), il gruppo modello (Gruppo M) e il gruppo di trattamento (Gruppo T). Sezioni patologiche della parete gastrica sono state prelevate dai ratti di ciascun gruppo. Inoltre, le concentrazioni di gastrina e malondialdeide nel siero dei ratti di ciascun gruppo sono state determinate mediante ELISA. Inoltre, gli effetti di D. caudatum sulla flora intestinale dei ratti con gastrite sono stati esplorati attraverso un confronto dettagliato delle comunità batteriche intestinali nei tre gruppi, impiegando il sequenziamento del gene rRNA 16S basato su Illumina. I risultati hanno indicato che il decotto di D. caudatum potrebbe ridurre il contenuto di malondialdeide e aumentare il contenuto di gastrina. Inoltre, è stato scoperto che il decotto di D. caudatum migliora la diversità e l'abbondanza della flora intestinale, esercitando un impatto positivo sul trattamento della gastrite regolando e ripristinando la flora intestinale.
Introduzione
La gastrite cronica (CG), una delle malattie cliniche più comuni, è caratterizzata da alterazioni infiammatorie croniche e persistenti dell'epitelio della mucosa gastrica, che viene frequentemente e ripetutamente attaccato da vari fattori patogeni1. Il tasso di incidenza della CG è al primo posto tra tutti i tipi di malattie dello stomaco, rappresentando dal 40% al 60% del tasso di servizio ambulatoriale nel Dipartimento di Gastroenterologia2. Inoltre, il tasso di incidenza aumenta generalmente con l'età, soprattutto nei soggetti di mezza età e più anziani3. Indubbiamente, la CG riduce significativamente la qualità della vita delle persone, sottolineando la necessità critica di scoprire nuovi agenti terapeutici.
Numerosi studi hanno riportato che l'insorgenza e lo sviluppo di CG sono legati alla secrezione di ormoni gastrointestinali, come la gastrina (GAS)4,5. Il GAS, un comune ormone peptidico gastrointestinale nel tratto digestivo, stimola le cellule a secernere acido gastrico promuovendo il rilascio di istamina dagli eosinofili. Inoltre, migliora la nutrizione e l'afflusso di sangue della mucosa gastrica, favorendo la proliferazione della mucosa gastrica e delle cellule parietali6. Pertanto, la gastrina può essere utilizzata come indicatore per valutare il livello di sviluppo della CG. Inoltre, i prodotti di perossidazione lipidica innescati dagli ossidi reattivi possono attivare le cellule infiammatorie, portando alla CG. La malondialdeide (MDA), un marcatore della perossidazione lipidica, è un indicatore comunemente usato per misurare il grado di stress ossidativo. Riflette in una certa misura il livello di radicali liberi nella mucosa gastrica. Il livello di MDA può indicare l'attacco di acidi grassi insaturi nella mucosa gastrica locale causato dai radicali liberi 7,8.
La microecologia intestinale è costituita da milioni di microrganismi che risiedono nell'intestino dell'ospite, svolgendo un ruolo fondamentale nel mantenimento della salute dell'ospite e nella regolazione dell'immunità dell'ospite. Una flora intestinale sana, caratterizzata da un'elevata ricchezza, diversità e funzione stabile del microbiota, funge da barriera protettiva contro l'invasione di microrganismi patogeni partecipando al metabolismo. I disturbi della flora intestinale rendono gli individui più suscettibili alle malattie gastrointestinali acute e croniche 9,10. Negli ultimi anni, la terapia del microbiota per le malattie gastrointestinali è progredita rapidamente e ha dimostrato un'efficacia significativa11. In sintesi, la considerazione della flora intestinale è fondamentale per comprendere e affrontare le malattie gastrointestinali.
Come componente indispensabile del tesoro della medicina tradizionale cinese, i materiali medicinali popolari hanno un grande significato per la pratica clinica e la modernizzazione della medicina nazionale. Le radici e le parti intere di Desmodium caudatum (Thunb.) DC. è stato ampiamente utilizzato per alleviare il disagio allo stomaco nell'area di Beichuan Qiang della città di Mianyang per un periodo prolungato. Alcuni articoli indicano le basi scientifiche per il trattamento delle malattie gastrointestinali con D. caudatum, citando i suoi effetti come l'emostasi, l'antiossidazione e la protezione gastrointestinale 12,13,14. Tuttavia, a causa della mancanza di ricerche approfondite, non è stato stabilito alcun meccanismo di farmacodinamica clinica. Questo articolo si propone di studiare gli effetti di D. caudatum nel trattamento della gastrite sulla base degli ormoni gastrointestinali e della flora intestinale, fornendo una base per la sua applicazione clinica razionale.
Protocollo
Le procedure per la cura e l'uso degli animali sono state approvate dal Comitato Etico dell'Università Normale di Mianyang e sono state seguite rigorosamente tutte le normative istituzionali e governative pertinenti riguardanti l'uso etico degli animali. Per il presente studio sono stati utilizzati ratti SPF (specie Kunming, sia maschi che femmine, del peso di 180-220 g). Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali). Tutti gli animali sono stati alloggiati in un ambiente privo di agenti patogeni e hanno avuto accesso al cibo ad libitum .
1. Preparazione dei reagenti
- Preparare una soluzione di salicilato di sodio al 5% pesando 2,5 g di polvere di salicilato di sodio (vedere Tabella dei materiali) con una bilancia elettronica. Sciogliere la polvere in una piccola quantità di acqua distillata e diluirla fino a un volume totale di 50 ml.
- Preparare il decotto di D. caudatum (12,8 g/kg). Pesare 128 g di D. caudatum (vedi Tabella dei materiali), metterlo in un matraccio a fondo tondo contenente 1000 ml di acqua distillata di laboratorio e concentrarlo fino a un volume finale di 100 ml.
2. Raggruppamento e amministrazione
- Dividere i ratti in diversi gruppi e somministrare per via intragastrica le soluzioni richieste.
NOTA: Per il presente studio, 18 ratti (9 maschi, 9 femmine) sono stati divisi in tre gruppi: il gruppo di controllo (Gruppo C), il gruppo modello (Gruppo M) e il gruppo di trattamento (Gruppo T), con 6 ratti in ciascun gruppo. Il gruppo di controllo ha ricevuto una soluzione salina e il gruppo modello ha ricevuto una soluzione di salicilato di sodio al 5% per 5 settimane alla dose di 10 ml/kg/die15. Il gruppo di trattamento è stato pretrattato con una soluzione di salicilato di sodio al 5% per 5 settimane alla dose di 10 ml/kg/die, seguita dalla somministrazione del decotto di D. caudatum alla dose di 1 ml/100 g per 10 giorni15,16. - Raccogliere le feci dei ratti in provette da microcentrifuga asciutte e sterili utilizzando il metodo di trasporto della coda17 l'ultimo giorno dell'esperimento e congelarle in un congelatore ad azoto liquido a bassissima temperatura.
- Al termine del prelievo, sacrificare i ratti mediante lussazione cervicale (seguendo i protocolli istituzionalmente approvati). Aprire la cavità addominale con le forbici per esporre l'aorta addominale.
- Inserire l'ago (23-25 G) quasi parallelamente nell'aorta addominale, raccogliere il siero e conservarlo in un congelatore a bassissima temperatura. Estrarre lo stomaco dalla cavità addominale16 e immergerlo in una soluzione di formalina al 10% per la conservazione.
NOTA: Nel gruppo M, il modello di gastrite cronica è considerato efficace se la mucosa gastrica è dilatata e congestionata con una morfologia ghiandolare regolare15, osservando una piccola quantità di infiltrazione di cellule infiammatorie nella lamina propria.
- Inserire l'ago (23-25 G) quasi parallelamente nell'aorta addominale, raccogliere il siero e conservarlo in un congelatore a bassissima temperatura. Estrarre lo stomaco dalla cavità addominale16 e immergerlo in una soluzione di formalina al 10% per la conservazione.
3. Sezione patologica della parete gastrica
- Prelevare i campioni della parete gastrica dai ratti di ciascun gruppo per le sezioni patologiche. Successivamente, eseguire la colorazione di routine con ematossilina-eosina per osservare e analizzare i cambiamenti patologici18.
4. Determinazione degli ormoni gastrointestinali sierici
- Nel campione di siero, rilevare il contenuto di gastrina (GAS) e malondialdeide (MDA)19 utilizzando ELISA seguendo le istruzioni del produttore (vedere Tabella dei materiali). Utilizzare un lettore di micropiastre per l'analisi.
5. Estrazione del DNA totale fecale e amplificazione e purificazione PCR
- Eseguire l'estrazione del DNA microbico utilizzando il kit di isolamento del DNA disponibile in commercio (vedere la tabella dei materiali) e determinare la concentrazione e la purezza utilizzando lo spettrofotometro UV-Vis16. Successivamente, valutare l'integrità del DNA attraverso l'elettroforesi su gel di agarosioall'1% 18.
- Amplificare il gene rRNA 16S dei batteri con primer 338F (5′-ACT, CCT, ACG, GGA, GGC, AGC, AGC, AG-3′) e 806R (5′-GAC, TAC, HVG, GGG, GTW, TCT, AT-3′) utilizzando un sistema PCR termociclatore17. I primer sono ottenuti da fonti commerciali (vedi Tabella dei Materiali).
NOTA: Seguire il programma PCR: denaturazione (3 min, 95 °C), seguita da 27 cicli (30 s, 95 °C; 30 s, 55 °C; 45 s, 72 °C) e un'estensione finale (10 min, 72 °C). Condurre reazioni di PCR con i seguenti componenti: 4 μL di tampone DNA polimerasi al 5×, 2 μL di dNTP da 2,5 mM, 0,8 μL di ciascun primer (5 μM), 0,4 μL di DNA polimerasi e 10 ng di DNA stampo (vedi Tabella dei materiali). - Estrarre, purificare e quantificare i prodotti PCR in sequenza utilizzando rispettivamente gel di agarosio al 2%, kit di estrazione di gel di DNA disponibile in commercio e fluorimetro17.
6. Sequenziamento
NOTA: I passaggi 6 e 7 vengono eseguiti seguendo i metodi20,21 pubblicati in precedenza.
- Utilizza la piattaforma Illumina per il sequenziamento.
NOTA: Un'estremità del frammento di DNA completa la base del connettore incorporato nel chip, fissandolo al chip. L'altra estremità completa in modo casuale la base di un altro giunto sepolto adiacente, formando un "ponte". - Eseguire l'amplificazione PCR per generare cluster di DNA. Linearizzare gli amplificatori del DNA in singoli filamenti.
- Introdurre una DNA polimerasi alterata insieme ai desossiribonucleotidi trifosfati (dNTP) con quattro distinti marcatori fluorescenti. Sintetizzare una sola base per ciclo.
- Utilizzare un laser per scansionare la superficie della piastra di reazione e determinare i tipi di nucleotidi polimerizzati durante la reazione iniziale di ciascuna sequenza stampo.
- Scindere chimicamente il "gruppo di fluorescenza" e il "gruppo di terminazione" per ristabilire l'estremità appiccicosa da 3'. Successivamente, si passa alla polimerizzazione del secondo nucleotide.
- Ottenere la sequenza dei frammenti di DNA stampo analizzando i risultati del segnale di fluorescenza raccolti in ogni round.
7. Trattamento dei dati di sequenziamento
- Inizialmente, tagliare le letture dei dati fastq grezzi in qualsiasi sito con un punteggio < Q20 ed eliminare le letture con basi incerte. Inoltre, consente due discrepanze in primer abbinati con precisione. Successivamente, unire le sequenze con una sovrapposizione >10 bp.
- Raggruppare le unità tassonomiche operative (OTU) con una somiglianza del 97% utilizzando UPARSE e rimuovere le sequenze chimeriche con UCHIME20,21.
- Utilizzare l'algoritmo RDP Classifier per analizzare la tassonomia di ciascuna sequenza genica dell'rRNA 16S rispetto al database dell'rRNA 16S Silva (SSU123), utilizzando una soglia di confidenza del 70%.
- Eseguire l'analisi della diversità alfa e l'analisi della diversità beta utilizzando rispettivamente Mothur e Qiime (vedere la tabella dei materiali).
8. Analisi statistica
- Analizzare i dati di questo studio utilizzando un software di analisi statistica (vedi Tabella dei materiali). Impiega l'analisi unidirezionale della varianza (ANOVA) per i confronti tra più gruppi e utilizza il test della differenza minima significativa (LSD) per i confronti tra due gruppi.
- Si consideri P < 0,05 come statisticamente significativo in tutti i confronti. P < 0,01 è considerato estremamente significativo.
Risultati
I risultati della sezione patologica della parete dello stomaco sono illustrati nella Figura 1. Rispetto al gruppo C, il gruppo M ha mostrato una lieve atrofia della parete gastrica e una lieve infiammazione. Tuttavia, rispetto al gruppo M, il gruppo T non ha mostrato infiammazioni, metaplasie intestinali o atrofia evidenti. Ciò suggerisce che il decotto di D. caudatum può migliorare efficacemente la gastrite.
I risultati del dosaggio dell'ormone gastrointestinale sierico sono presentati nella Figura 2. Il contenuto di malondialdeide (MDA) era significativamente più alto nel gruppo M rispetto al gruppo C. Dopo il trattamento con decotto di D. caudatum , è stato significativamente ridotto. Per quanto riguarda il contenuto di gastrina (GAS), il gruppo M ha mostrato livelli significativamente inferiori rispetto al gruppo C, ma il gruppo T ha mostrato un aumento significativo. Questi risultati indicano che il decotto di D. caudatum può regolare il livello di ormoni gastrointestinali per trattare la gastrite.
L'analisi della diversità alfa, come mostrato nella Tabella 1 e nella Figura 3, rivela una differenza significativa tra le comunità del Gruppo M e del Gruppo T. Il numero di batteri nel gruppo C e nel gruppo T è superiore a quello del gruppo M, suggerendo che il numero e i tipi di batteri intestinali nei ratti tendono gradualmente a un livello normale dopo il trattamento.
Analisi della composizione delle specie
Secondo la Figura 4A, il barplot di comunità illustra che Lactobacillus e norank_f__Muribaculaceae rappresentano la percentuale maggiore nel gruppo C. Il gruppo M contiene una maggiore abbondanza di Clostridium_sensu_stricto_1 e alcuni Helicobacter. La composizione della comunità del Gruppo T è più simile a quella del Gruppo C, con componenti importanti che sono Lactobacillus e Romboutsia. Inoltre, la mappa di calore di correlazione di Spearman (Figura 4B) combinata con il diagramma circos (Figura 4C) rivela differenze significative nella composizione della flora tra il gruppo C e il gruppo M, con variazioni distinte nella flora dominante. Dopo il trattamento, il gruppo T tende a tornare a uno stato normale della flora. Inoltre, la Figura 5 indica differenze estreme nella composizione della comunità tra il gruppo M e il gruppo C, con cambiamenti significativi che si verificano nella struttura e nella composizione della flora intestinale nei ratti con gastrite. Dopo il trattamento, ci sono somiglianze nella composizione della flora tra il gruppo C e il gruppo T, così come alcune somiglianze tra il gruppo T e il gruppo M. Questi risultati indicano che il decotto di D. caudatum potrebbe ripristinare la flora intestinale dei ratti con gastrite a uno stato normale o quasi normale.
Analisi delle differenze di specie
Dall'istogramma di confronto multispecie nella Figura 6A, si può osservare che Norank_f_Muribaculaceae è abbondante nel Gruppo C e differisce significativamente dal Gruppo M e dal Gruppo T. Dopo il trattamento, il numero di Norank_f_Muribaculaceae nel gruppo T mostra una tendenza all'aumento. Inoltre, Clostridium_sensu_stricto_1, abbondante nel Gruppo M, mostra resilienza in ambienti difficili. Dopo il trattamento, il numero diminuisce in modo significativo, suggerendo che il decotto di D. caudatum migliora in una certa misura l'ambiente di sopravvivenza della flora intestinale. D'altra parte, l'analisi dell'albero della gerarchia delle specie multilivello LEfSe nella Figura 6B indica 44 specie con differenze significative tra i gruppi. Norank_f_muribaculaceae, Clostridium_sensu_stricto_1 e Romboutsia sono risultati abbondanti rispettivamente nel Gruppo C, nel Gruppo M e nel Gruppo T.
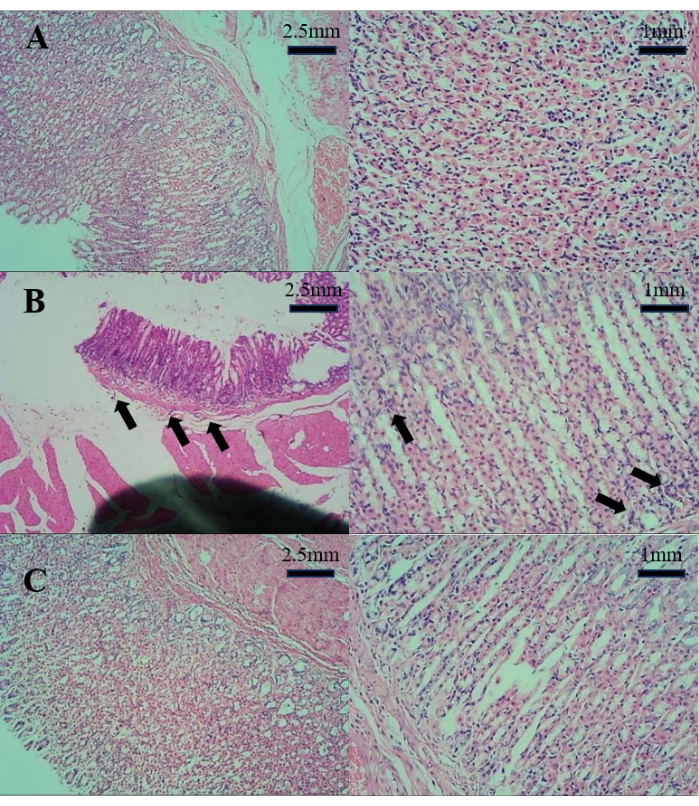
Figura 1: I risultati della sezione patologica della parete dello stomaco. (A) Sezione patologica dello stomaco nel gruppo C. (B) Sezione patologica dello stomaco nel gruppo M. (C) Sezione patologica dello stomaco nel gruppo T. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Il contenuto degli ormoni gastrointestinali sierici. (A) Grafico di analisi a barre dei risultati della determinazione dell'MDA (malondialdeide). (B) Grafico di analisi a barre dei risultati della determinazione del GAS. *P < 0,05, **P < 0,01. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Grammo colonna dell'indice di diversità T. La barra rossa rappresenta il Gruppo C, la blu rappresenta il Gruppo T, mentre la verde rappresenta il Gruppo M.*P < 0,05, **P < 0,01. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Analisi della composizione comunitaria. (A) Analisi dell'istogramma comunitario. (B) Analisi della mappa di calore della comunità a livello di genere. (C) Analisi del diagramma di Circos della relazione tra campioni e specie. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Analisi PLS-DA a livello di Genere. Il rosso rappresenta il gruppo C, il blu rappresenta il gruppo T e il verde rappresenta il gruppo M. Fare clic qui per visualizzare una versione più grande di questa figura.
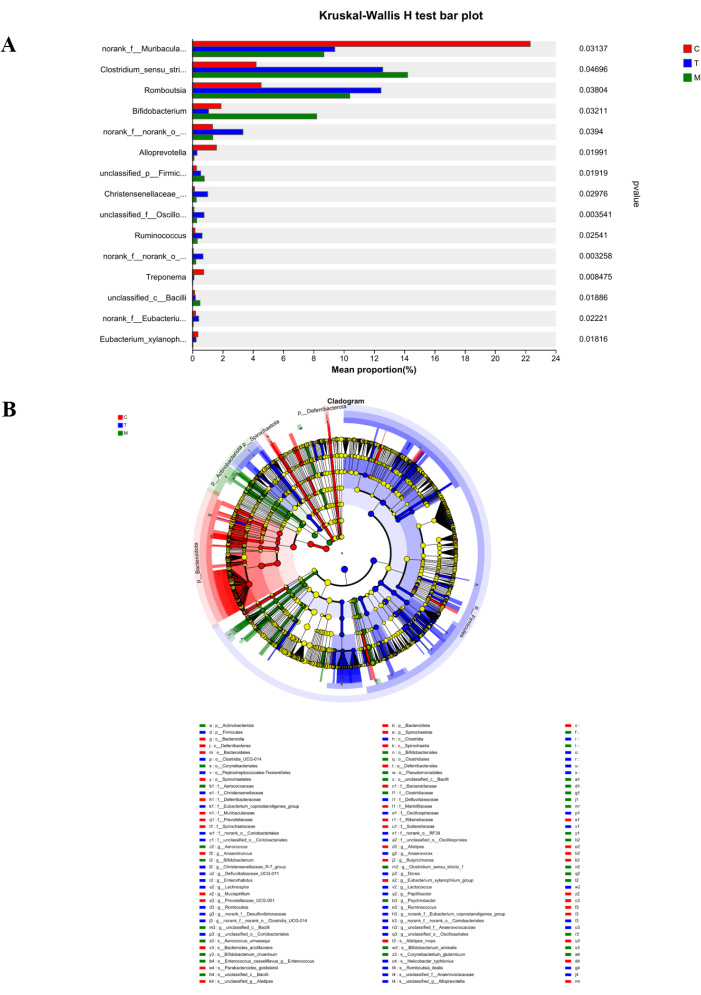
Figura 6: Analisi delle differenze tra specie. (A) Grafico a barre di prova di Kruskal-Wallis H. (B) Mappa arborea delle specie multilivello LefSe. Il rosso rappresenta il gruppo C, il blu rappresenta il gruppo T e il verde rappresenta il gruppo M. Fare clic qui per visualizzare una versione più grande di questa figura.
| Gruppo | Valore medio | Deviazione standard |
| C | 3.5201 | 0.63641 |
| M | 3.2755 | 0.28494 |
| T | 3.5388 | 0.29945 |
Tabella 1: Risultati dell'indice di diversità alfa.
Discussione
D. caudatum, una medicina popolare comunemente usata dalla nazionalità Qiang12, ha mostrato un'efficacia significativa nel trattamento delle malattie gastrointestinali. Con il progresso della moderna ricerca farmacologica, lo squilibrio della flora derivante dallo squilibrio della microecologia gastrointestinale è identificato come un fattore chiave nelle malattie gastrointestinali acute e croniche22,23. Alcuni microrganismi nel tratto intestinale svolgono un ruolo cruciale nel mantenimento dell'equilibrio dinamico nel corpo e gli ormoni nel siero riflettono lo stato fisiologico e patologico del corpo. Pertanto, lo studio si concentra sulla flora intestinale e sugli ormoni gastrointestinali.
Il sequenziamento genico ad alto rendimento dell'rRNA 16S è un metodo primario per rilevare i microrganismi intestinali. Consente di rilevare i tipi e le funzioni dei microrganismi nei campioni raccolti, consentendo un'analisi accurata e quantitativa di ogni specie di microrganismi intestinali. Negli ultimi anni, il sequenziamento genico ad alto rendimento dell'rRNA 16S si è rapidamente sviluppato ed è stato ampiamente utilizzato per l'analisi della diversità microbica in vari ambienti ecologici 24,25,26.
Gli effetti di D. caudatum sulla flora intestinale dei ratti con gastrite sono stati studiati attraverso un confronto dettagliato delle comunità batteriche intestinali in tre gruppi basato sul sequenziamento del gene rRNA 16S basato su Illumina. La moderna ricerca scientifica indica che Lactobacillus, norank_f__Muribaculaceae, Romboutsia e Bifidobacterium sono probiotici, ciascuno con specifici benefici per la salute come la riduzione del rischio di tumori maligni multipli, la produzione di vitamina K con potenziale antinfiammatorio, la promozione del metabolismo dei polisaccaridi e il miglioramento della diarrea e della stitichezza 27,28,29. Clostridium_sensu_stricto_1, un batterio patogeno nelle lesioni intestinali, può causare infiammazione e batteriemia ed è strettamente legato ai tumori del sangue e gastrointestinali30. La gastrite cronica e la gastrite atrofica contribuiscono in modo significativo ai tumori gastrici31.
L'analisi beta indica cambiamenti significativi nel contenuto di Lactobacillus, norank_f__Muribaculaceae, Romboutsia, Bifidobacterium e Clostridium_sensu_stricto_1 dopo il trattamento. Il contenuto di Lactobacillus, norank_f__Muribaculaceae e Romboutsia è aumentato in modo significativo, mentre Bifidobacterium e Clostridium_sensu_stricto_1 è diminuito significativamente dopo il trattamento con D. caudatum . Inoltre, il barplot della comunità suggerisce che la composizione della comunità del Gruppo T è più simile a quella del Gruppo C. Questi risultati indicano che D. caudatum potrebbe migliorare la prevalenza della gastrite nei ratti. Tuttavia, i meccanismi specifici alla base della riduzione del contenuto del probiotico Bifidobacterium da parte di D. caudatum richiedono ulteriori ricerche.
Il metodo del kit ELISA possiede un'elevata sensibilità, una forte specificità, semplicità di funzionamento e idoneità per campioni di piccole dimensioni32. In questo studio, è stato utilizzato per rilevare il contenuto di malondialdeide (MDA) e gastrina (GAS) nel siero di ratto. L'MDA riflette il grado di perossidazione lipidica, indicando indirettamente l'entità del danno cellulare. Nei ratti con gastrite, il livello di MDA era significativamente più alto di quello nei ratti normali, suggerendo un danno alle cellule parietali gastriche. Il trattamento con D. caudatum ha ridotto significativamente il livello di MDA, indicando il suo potenziale nel trattamento della gastrite. Al contrario, D. caudatum ha aumentato il livello ridotto di GAS, contribuendo alla riparazione o al trattamento della gastrite.
Tuttavia, ci sono limitazioni sia al sequenziamento del gene ad alto rendimento dell'rRNA 16S che al metodo del kit ELISA. Nel sequenziamento genico ad alto rendimento dell'rRNA 16S, la bassa risoluzione può rendere difficile distinguere ceppi o generi con sequenze molto simili, portando a difficoltà nella classificazione a livelli tassonomici più elevati come genere, famiglia o phylum33. Per il metodo del kit ELISA, sono solitamente necessarie fasi di pretrattamento del campione come la diluizione e il lavaggio, introducendo potenziali errori e variabilità34.
Questo studio suggerisce che D. caudatum può trattare la gastrite regolando gli ormoni gastrointestinali e la flora intestinale, fornendo approfondimenti sulle sue ampie applicazioni cliniche. Tuttavia, la ricerca futura dovrebbe approfondire altri ormoni gastrointestinali, i meccanismi di regolazione della flora intestinale e le sostanze chimiche efficaci coinvolte.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dai progetti chiave di ricerca e sviluppo del Dipartimento di scienza e tecnologia della provincia di Sichuan (2020YFS0539).
Materiali
| Name | Company | Catalog Number | Comments |
| Alpha diversity analysis | Mothur 1.30.2 | ||
| AxyPrep deoxyribonucleic acid (DNA) gel extraction kit | Axygen Biosciences | AP-GX-50 | |
| Beta diversity analysis | Qiime 1.9.1 | ||
| Cryogenic refrigerator | Forma-86C ULT freezer | ||
| Desmodium caudatum | The Traditional Chinese Medicine Hospital of Beichuan Qiang Autonomous County | ||
| E.Z.N.A. soil kit | Omega Bio-tek | D5625-01 | |
| Illumina MiSeq Platform | Illumina Miseq PE300/NovaSeq PE250 | ||
| Multiskan Spectrum | spectraMax i3 | ||
| OTU clustering | Uparse 7.0.1090 | ||
| OTU statistics | Usearch 7.0 | ||
| PCR instrument | TransGen AP221-02 | ||
| PCR instrument | ABI GeneAmp 9700 | ||
| QuantiFluor-ST double-stranded DNA (dsDNA) system | Promega Corp. | ||
| Sequence classification annotation | RDP Classifier 2.11 | ||
| Sodium salicylate | Sichuan Xilong Chemical Co., Ltd | 54-21-7 | |
| SPF rats | Chengdu Dashuo Experimental Animal Co., Ltd | ||
| SPSS 18.0 | IBM |
Riferimenti
- Marginean, C. M., et al. The importance of accurate early diagnosis and eradication in Helicobacter pylori infection: pictorial summary review in children and adults. Antibiotics (Basel). 12 (1), 60 (2022).
- Sipponen, P., Maaroos, H. I. Chronic gastritis. Scandinavian Journal of Gastroenterology. 50 (6), 657-667 (2015).
- Wang, D. J. Methodological quality and reporting quality evaluation of chinese medicine diagnosis and treatment guidelines for chronic gastritis in China. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology. 24 (7), 2776-2783 (2022).
- Burkitt, M. D., Varro, A., Pritchard, D. M. Importance of gastrin in the pathogenesis and treatment of gastric tumors. World Journal of Gastroenterology. 15 (1), 1-16 (2009).
- Hayakawa, Y., Chang, W., Jin, G., Wang, T. C. Gastrin and upper GI cancers. Current Opinion in Pharmacology. 31, 31-37 (2016).
- Zhang, C. Z., He, M. X., Jin, L. W., Liu, W. D. Effect of aluminum phosphate gel combined with atropine on patients with acute gastritis and its effect on serum gastrin and malondialdehyde levels. International Journal of Digestive Diseases. 40 (2), 137-140 (2020).
- Wang, Y. K., et al. Levels of malondialdehyde in the gastric juice: its association with Helicobacter pylori infection and stomach diseases. Helicobacter. 23 (2), e12460 (2018).
- Turkkan, E., et al. Does Helicobacter pylori-induced inflammation of gastric mucosa determine the severity of symptoms in functional dyspepsia. Journal of Gastroenterology. 44 (1), 66-70 (2009).
- Liu, Y., Cai, C., Qin, X. Regulation of gut microbiota of Astragali Radix in treating for chronic atrophic gastritis rats based on metabolomics coupled with 16S rRNA gene sequencing. Chemico-Biological Interactions. 365, 110063 (2022).
- Gai, X., et al. Heptadecanoic acid and pentadecanoic acid crosstalk with fecal-derived gut microbiota are potential non-invasive biomarkers for chronic atrophic gastritis. Frontiers in Cellular and Infection Microbiology. 12, 1064737 (2023).
- Sgambato, D., et al. Gut microbiota and gastric disease. Minerva Gastroenterologica e Dietologica. 63 (4), 345-354 (2017).
- Li, J., et al. Pharmacogenetic study of Desmodium caudatum. Anais Da Academia Brasileira De Ciencias. 91 (2), e20180637 (2019).
- Xu, Q. N., et al. Phenolic glycosides and flavonoids with antioxidant and anticancer activities from Desmodium caudatum. Natural Product Research. 35 (22), 4534-4541 (2021).
- Li, W., et al. Anti-inflammatory and antioxidant activities of phenolic compounds from Desmodium caudatum leaves and stems. Archives of Pharmacal Research. 37 (6), 721-727 (2014).
- Shao, X. H., Wang, J. G. Establishment of chronic atrophic gastritis in a rat model. Journal of Zhangjiakou Medical Collage. 19 (2), 11-13 (2002).
- Yu, C., et al. Dysbiosis of gut microbiota is associated with gastric carcinogenesis in rats. Biomedicine & Pharmacotherapy. 126, 110036 (2020).
- Chen, R., et al. Fecal metabolomics combined with 16S rRNA gene sequencing to analyze the changes of gut microbiota in rats with kidney-yang deficiency syndrome and the intervention effect of You-gui pill. Journal of Ethnopharmacology. 224, 112139 (2019).
- Li, Q., et al. Magnetic anchoring and guidance-assisted endoscopic irreversible electroporation for gastric mucosal ablation: a preclinical study in canine model. Surgical Endoscopy. 35 (10), 5665-5674 (2021).
- Xu, H., et al. Therapeutic assessment of fractions of Gastrodiae Rhizoma on chronic atrophic gastritis by 1H NMR-based metabolomics. Journal of Ethnopharmacology. 254, 112403 (2020).
- Zhang, B. N., et al. Effects of Atractylodes lancea extracts on intestinal flora and serum metabolites in mice with intestinal dysbacteriosis. Proteome Science. 21 (1), 5 (2023).
- Tian, H., et al. The therapeutic effects of Magnolia officinalis extraction on an antibiotics-induced intestinal dysbacteriosis in mice. Current Microbiology. 77 (9), 2413-2421 (2020).
- Wang, J., et al. Tumor and microecology committee of China anti-cancer association. Chinese expert consensus on intestinal microecology and management of digestive tract complications related to tumor treatment (version 2022). Journal of Cancer Research and Therapeutics. 18 (7), 1835-1844 (2022).
- Xu, W., Xu, L., Xu, C. Relationship between Helicobacter pylori infection and gastrointestinal microecology. Frontiers in Cellular and Infection Microbiology. 12, 938608 (2022).
- Johnson, J. S., et al. Evaluation of 16S rRNA gene sequencing for species and strain-level microbiome analysis. Nature Communications. 10 (1), 5029 (2019).
- Callahan, B. J., et al. High-throughput amplicon sequencing of the full-length 16S rRNA gene with single-nucleotide resolution. Nucleic Acids Research. 47 (18), e103 (2019).
- Langille, M. G., et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology. 31 (9), 814-821 (2013).
- Huang, D., et al. Characteristics of intestinal flora in patients with gastric cancer based on high throughput sequencing technology. Chinese Journal of Clinical Research. 35 (3), 303-306 (2022).
- Shi, Y., Luo, J., Narbad, A., Chen, Q. Advances in lactobacillus restoration for β-lactam antibiotic-induced dysbiosis: a system review in intestinal microbiota and immune homeostasis. Microorganisms. 11 (1), 179 (2023).
- Grigor'eva, I. N. Gallstone disease, obesity and the Firmicutes/Bacteroidetes ratio as a possible biomarker of gut dysbiosis. Journal of Personalized Medicine. 11 (1), 13 (2020).
- Thorne, G. M. Diagnosis of infectious diarrheal diseases. Infectious Disease Clinics of North America. 2 (3), 747-748 (1988).
- Banks, M., et al. British society of gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma. Gut. 68 (9), 1545-1575 (2019).
- Roy-Lachapelle, A., et al. Evaluation of ELISA-based method for total anabaenopeptins determination and comparative analysis with on-line SPE-UHPLC-HRMS in freshwater cyanobacterial blooms. Talanta. 223, 121802 (2021).
- Shahi, S. K., et al. Microbiota analysis using two-step PCR and next-generation 16S rRNA gene sequencing. Journal of Visualized Experiments. (152), e59980 (2019).
- Huang, R., et al. Blocking-free ELISA using a gold nanoparticle layer coated commercial microwell plate. Sensors (Basel). 18 (10), 3537 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon