Method Article
Effets de Desmodium caudatum sur les hormones gastro-intestinales et la flore intestinale chez les rats atteints de gastrite
Dans cet article
Résumé
Le présent protocole décrit la méthode d’analyse de la flore intestinale à l’aide du séquençage du gène de l’ARNr 16S à base d’Illumina et fournit un cadre pour évaluer l’efficacité des décoctions à base de plantes.
Résumé
Afin d’explorer de manière préliminaire les effets de Desmodium caudatum sur la gastrite et la flore intestinale chez le rat, un modèle de rat de gastrite chronique a été établi en utilisant la méthode classique du salicylate de sodium. Dix-huit rats SPF ont été divisés en trois groupes : le groupe témoin (groupe C), le groupe modèle (groupe M) et le groupe de traitement (groupe T). Des coupes pathologiques de la paroi gastrique ont été prélevées sur des rats de chaque groupe. De plus, les concentrations de gastrine et de malondialdéhyde dans le sérum des rats de chaque groupe ont été déterminées par ELISA. De plus, les effets de D. caudatum sur la flore intestinale des rats atteints de gastrite ont été explorés grâce à une comparaison détaillée des communautés bactériennes intestinales dans les trois groupes, en utilisant le séquençage du gène de l’ARNr 16S basé sur Illumina. Les résultats ont indiqué que la décoction de D. caudatum pouvait réduire la teneur en malondialdéhyde et augmenter la teneur en gastrine. De plus, la décoction de D. caudatum s’est avérée améliorer la diversité et l’abondance de la flore intestinale, exerçant un impact positif sur le traitement de la gastrite en régulant et en restaurant la flore intestinale.
Introduction
La gastrite chronique (CG), l’une des maladies cliniques les plus courantes, se caractérise par des modifications inflammatoires chroniques et persistantes de l’épithélium de la muqueuse gastrique, qui est fréquemment et de manière répétée attaquée par divers facteurs pathogènes1. Le taux d’incidence de la CG se classe au premier rang parmi tous les types de maladies de l’estomac, représentant 40 % à 60 % du taux de services ambulatoires du département de gastroentérologie2. De plus, le taux d’incidence augmente généralement avec l’âge, en particulier chez les personnes d’âge moyen et plus âgées3. Il ne fait aucun doute que les images de synthèse réduisent considérablement la qualité de vie des gens, soulignant le besoin critique de découvrir de nouveaux agents thérapeutiques.
De nombreuses études ont rapporté que l’apparition et le développement de CG sont liés à la sécrétion d’hormones gastro-intestinales, telles que la gastrine (GAS)4,5. Le SGA, une hormone peptidique gastro-intestinale courante dans le tube digestif, stimule les cellules à sécréter de l’acide gastrique en favorisant la libération d’histamine par les éosinophiles. De plus, il améliore la nutrition et l’apport sanguin de la muqueuse gastrique, favorisant la prolifération de la muqueuse gastrique et des cellules pariétales6. Par conséquent, la gastrine peut être utilisée comme indicateur pour évaluer le niveau de développement du CG. De plus, les produits de peroxydation lipidique déclenchés par des oxydes réactifs peuvent activer les cellules inflammatoires, conduisant à la CG. Le malondialdéhyde (MDA), un marqueur de la peroxydation lipidique, est un indicateur couramment utilisé pour mesurer le degré de stress oxydatif. Il reflète dans une certaine mesure le niveau de radicaux libres dans la muqueuse gastrique. Le taux de MDA peut indiquer l’attaque des acides gras insaturés dans la muqueuse gastrique locale causée par les radicaux libres 7,8.
La microécologie intestinale se compose de millions de micro-organismes résidant dans l’intestin de l’hôte, jouant un rôle essentiel dans le maintien de la santé de l’hôte et la régulation de l’immunité de l’hôte. Une flore intestinale saine, caractérisée par une grande richesse, une grande diversité et une fonction stable du microbiote, agit comme une barrière protectrice contre l’invasion de micro-organismes pathogènes en participant au métabolisme. Les perturbations de la flore intestinale rendent les individus plus sensibles aux maladies gastro-intestinales aiguës et chroniques 9,10. Ces dernières années, la thérapie par microbiote pour les maladies gastro-intestinales a progressé rapidement et a démontré une efficacité significative11. En résumé, la prise en compte de la flore intestinale est cruciale pour comprendre et traiter les maladies gastro-intestinales.
En tant que composant indispensable du trésor de la médecine traditionnelle chinoise, les matériaux médicinaux traditionnels ont une grande importance pour la pratique clinique et la modernisation de la médecine nationale. Les racines et les parties entières de Desmodium caudatum (Thunb.) DC. a été largement utilisé pour soulager les maux d’estomac dans la région de Beichuan Qiang de la ville de Mianyang pendant une période prolongée. Certains articles indiquent la base scientifique du traitement des maladies gastro-intestinales avec D. caudatum, citant ses effets tels que l’hémostase, l’anti-oxydation et la protection gastro-intestinale 12,13,14. Cependant, en raison du manque de recherches approfondies, aucun mécanisme de pharmacodynamique clinique n’a été établi. Cet article vise à étudier les effets de D. caudatum dans le traitement de la gastrite en se basant sur les hormones gastro-intestinales et la flore intestinale, fournissant une base pour son application clinique rationnelle.
Protocole
Les procédures de soins et d’utilisation des animaux ont été approuvées par le Comité d’éthique de l’Université normale de Mianyang, et toutes les réglementations institutionnelles et gouvernementales pertinentes concernant l’utilisation éthique des animaux ont été strictement suivies. Pour la présente étude, des rats SPF (espèces Kunming, mâles et femelles, pesant de 180 à 220 g) ont été utilisés. Les animaux ont été obtenus d’une source commerciale (voir la Table des matières). Tous les animaux ont été logés dans un environnement exempt d’agents pathogènes et ont eu un accès ad libitum à la nourriture.
1. Préparation des réactifs
- Préparez une solution de salicylate de sodium à 5 % en pesant 2,5 g de poudre de salicylate de sodium (voir le tableau des matériaux) à l’aide d’une balance électronique. Dissoudre la poudre dans une petite quantité d’eau distillée et la diluer à un volume total de 50 ml.
- Préparez la décoction de D. caudatum (12,8 g/kg). Peser 128 g de D. caudatum (voir le tableau des matières), le placer dans une fiole à fond rond contenant 1000 mL d’eau distillée de laboratoire et le concentrer jusqu’à un volume final de 100 mL.
2. Regroupement et administration
- Divisez les rats en différents groupes et administrez par voie intragastrique les solutions requises.
NOTE : Pour la présente étude, 18 rats (9 mâles, 9 femelles) ont été divisés en trois groupes : le groupe témoin (groupe C), le groupe modèle (groupe M) et le groupe de traitement (groupe T), avec 6 rats dans chaque groupe. Le groupe témoin a reçu une solution saline et le groupe modèle a reçu une solution de salicylate de sodium à 5 % pendant 5 semaines à une dose de 10 mL/kg/jour15. Le groupe de traitement a été prétraité avec une solution de salicylate de sodium à 5 % pendant 5 semaines à une dose de 10 mL/kg/jour, suivi de l’administration de la décoction de D. caudatum à une dose de 1 mL/100 g pendant 10 jours15,16. - Prélever les excréments des rats dans des tubes de microcentrifugation secs et stériles en utilisant la méthode de transport de la queue17 le dernier jour de l’expérience et les congeler dans un congélateur à ultra-basse température à l’azote liquide.
- Après la fin de l’échantillonnage, sacrifiez les rats par luxation cervicale (en suivant les protocoles approuvés par l’institution). Ouvrez la cavité abdominale avec des ciseaux pour exposer l’aorte abdominale.
- Insérez l’aiguille (23-25 G) presque parallèlement dans l’aorte abdominale, récupérez le sérum et conservez-le dans un congélateur à ultra-basse température. Sortez les estomacs de la cavité abdominale16 et faites-les tremper dans une solution de formol à 10 % pour la conservation.
REMARQUE : Dans le groupe M, le modèle de gastrite chronique est considéré comme réussi si la muqueuse gastrique est dilatée et congestionnée avec une morphologie glandulaire régulière15, tout en observant une petite quantité d’infiltration de cellules inflammatoires dans la lamina propria.
- Insérez l’aiguille (23-25 G) presque parallèlement dans l’aorte abdominale, récupérez le sérum et conservez-le dans un congélateur à ultra-basse température. Sortez les estomacs de la cavité abdominale16 et faites-les tremper dans une solution de formol à 10 % pour la conservation.
3. Coupe pathologique de la paroi gastrique
- Prélevez les échantillons de la paroi gastrique des rats de chaque groupe pour les coupes pathologiques. Par la suite, effectuez une coloration de routine à l’hématoxyline-éosine pour observer et analyser les changements pathologiques18.
4. Détermination des hormones gastro-intestinales sériques
- Dans l’échantillon de sérum, détecter le contenu de la gastrine (GAS) et du malondialdéhyde (MDA)19 à l’aide d’un test ELISA en suivant les instructions du fabricant (voir la table des matières). Utilisez un lecteur de microplaques pour l’analyse.
5. Extraction de l’ADN total fécal et amplification et purification par PCR
- Effectuer l’extraction de l’ADN microbien à l’aide de la trousse d’isolement de l’ADN disponible dans le commerce (voir le tableau des matériaux) et déterminer la concentration et la pureté à l’aide du spectrophotomètre UV-Vis16. Par la suite, évaluer l’intégrité de l’ADN par électrophorèse sur gel d’agarose à 1 %18.
- Amplifier le gène de l’ARNr 16S de la bactérie avec les amorces 338F (5′-ACT CCT, ACG, GGA GGC, AGC AGC, AG-3′) et 806R (5′-GAC TAC, HVG, GGG, GTW, TCT AT-3′) à l’aide d’un système de PCR thermocycleur17. Les amorces sont obtenues auprès de sources commerciales (voir la Table des matières).
REMARQUE : Suivre le programme de PCR : dénaturation (3 min, 95 °C), suivie de 27 cycles (30 s, 95 °C ; 30 s, 55 °C ; 45 s, 72 °C) et d’une extension finale (10 min, 72 °C). Effectuer des réactions de PCR avec les composants suivants : 4 μL de tampon d’ADN polymérase 5×, 2 μL de 2,5 mM de dNTP, 0,8 μL de chaque amorce (5 μM), 0,4 μL d’ADN polymérase et 10 ng d’ADN matrice (voir Tableau des matériaux). - Extraire, purifier et quantifier les produits PCR de manière séquentielle à l’aide d’un gel d’agarose à 2 %, d’un kit d’extraction de gel d’ADN disponible dans le commerce et d’un fluorimètre, respectivement17.
6. Séquençage
REMARQUE : Les étapes 6 et 7 sont effectuées selon les méthodes20,21 publiées précédemment.
- Utilisez la plateforme Illumina pour le séquençage.
REMARQUE : Une extrémité du fragment d’ADN complète la base du connecteur intégré dans la puce, le fixant à la puce. L’autre extrémité complète de manière aléatoire la base d’un autre joint enterré adjacent, formant un « pont ». - Effectuer une amplification par PCR pour générer des clusters d’ADN. Linéariser les amplificateurs d’ADN en brins simples.
- Introduire une ADN polymérase altérée aux côtés de désoxyribonucléotides triphosphates (dNTP) avec quatre marqueurs fluorescents distincts. Synthétisez une seule base par cycle.
- Utilisez un laser pour balayer la surface de la plaque de réaction et déterminer les types de nucléotides polymérisés au cours de la réaction initiale de chaque séquence de matrice.
- Cliver chimiquement le « groupe de fluorescence » et le « groupe de terminaison » pour rétablir l’extrémité collante de 3'. Par la suite, passez à la polymérisation du deuxième nucléotide.
- Obtenez la séquence des fragments d’ADN matriciel en analysant les résultats du signal de fluorescence collectés à chaque tour.
7. Traitement des données de séquençage
- Dans un premier temps, réduisez les lectures des données brutes fastq sur n’importe quel site avec un score < Q20 et éliminez les lectures avec des bases incertaines. De plus, autorisez deux discordances dans des amorces parfaitement appariées. Par la suite, fusionner les séquences avec un chevauchement >10 pb.
- Regroupez les unités taxonomiques opérationnelles (UTO) avec une similitude de 97 % à l’aide d’UPARSE, et supprimez les séquences chimériques avec UCHIME20,21.
- Utilisez l’algorithme RDP Classifier pour analyser la taxonomie de chaque séquence de gène de l’ARNr 16S par rapport à la base de données d’ARNr 16S de Silva (SSU123), en utilisant un seuil de confiance de 70 %.
- Effectuez une analyse de diversité Alpha et une analyse de diversité Bêta à l’aide de Mothur et Qiime, respectivement (voir Tableau des matériaux).
8. Analyse statistique
- Analysez les données de cette étude à l’aide d’un logiciel d’analyse statistique (voir Tableau des matières). Utiliser l’analyse de variance à un facteur (ANOVA) pour les comparaisons entre plusieurs groupes et utiliser le test de la différence la moins significative (LSD) pour les comparaisons entre deux groupes.
- Considérez que P < 0,05 comme statistiquement significatif dans toutes les comparaisons. P < 0,01 est considéré comme extrêmement significatif.
Résultats
Les résultats de la coupe pathologique de la paroi de l’estomac sont illustrés à la figure 1. Par rapport au groupe C, le groupe M présentait une légère atrophie de la paroi gastrique et une légère inflammation. Cependant, par rapport au groupe M, le groupe T ne présentait aucune inflammation, métaplasie intestinale ou atrophie évidente. Cela suggère que la décoction de D. caudatum peut améliorer efficacement la gastrite.
Les résultats du test d’hormones gastro-intestinales sériques sont présentés à la figure 2. La teneur en malondialdéhyde (MDA) était significativement plus élevée dans le groupe M que dans le groupe C. Après traitement par décoction de D. caudatum , il a été considérablement réduit. En ce qui concerne la teneur en gastrine (GAS), le groupe M a montré des niveaux significativement inférieurs à ceux du groupe C, mais le groupe T a montré une augmentation significative. Ces résultats indiquent que la décoction de D. caudatum peut réguler le taux d’hormones gastro-intestinales pour traiter la gastrite.
L’analyse de la diversité alpha, comme le montrent le tableau 1 et la figure 3, révèle une différence significative entre les communautés du groupe M et du groupe T. Le nombre de bactéries dans les groupes C et T est plus élevé que celui du groupe M, ce qui suggère que le nombre et les types de bactéries intestinales chez les rats tendent progressivement à un niveau normal après le traitement.
Analyse de la composition des espèces
Selon la figure 4A, le diagramme à barres communautaire montre que les Lactobacillus et les norank_f__Muribaculaceae représentent la plus grande proportion dans le groupe C. Le groupe M contient une plus grande abondance de Clostridium_sensu_stricto_1 et un peu d’Helicobacter. La composition communautaire du groupe T est plus similaire à celle du groupe C, les composantes importantes étant Lactobacillus et Romboutsia. De plus, la carte thermique de corrélation de Spearman (figure 4B) combinée au diagramme de circos (figure 4C) révèle des différences significatives dans la composition de la flore entre le groupe C et le groupe M, avec des variations distinctes dans la flore dominante. Après le traitement, le groupe T a tendance à revenir à un état de flore normal. De plus, la figure 5 indique des différences extrêmes dans la composition de la communauté entre le groupe M et le groupe C, avec des changements importants dans la structure et la composition de la flore intestinale chez les rats atteints de gastrite. Après traitement, il existe des similitudes dans la composition de la flore entre le groupe C et le groupe T, ainsi que certaines similitudes entre le groupe T et le groupe M. Ces résultats indiquent que la décoction de D. caudatum pourrait restaurer la flore intestinale des rats atteints de gastrite à un état normal ou proche de la normale.
Analyse des différences entre les espèces
D’après l’histogramme de comparaison multi-espèces de la figure 6A, on peut observer que Norank_f_Muribaculaceae est abondant dans le groupe C et diffère considérablement du groupe M et du groupe T. Après le traitement, le nombre de Norank_f_Muribaculaceae dans le groupe T montre une tendance à la hausse. De plus, Clostridium_sensu_stricto_1, abondant dans le groupe M, fait preuve de résilience dans des environnements difficiles. Après le traitement, le nombre diminue considérablement, ce qui suggère que la décoction de D. caudatum améliore dans une certaine mesure l’environnement de survie de la flore intestinale. D’autre part, l’analyse de l’arbre hiérarchique des espèces multi-niveaux LEfSe de la figure 6B indique 44 espèces avec des différences significatives entre les groupes. Norank_f_muribaculaceae, Clostridium_sensu_stricto_1 et Romboutsia se sont avérés abondants dans les groupes C, M et T, respectivement.
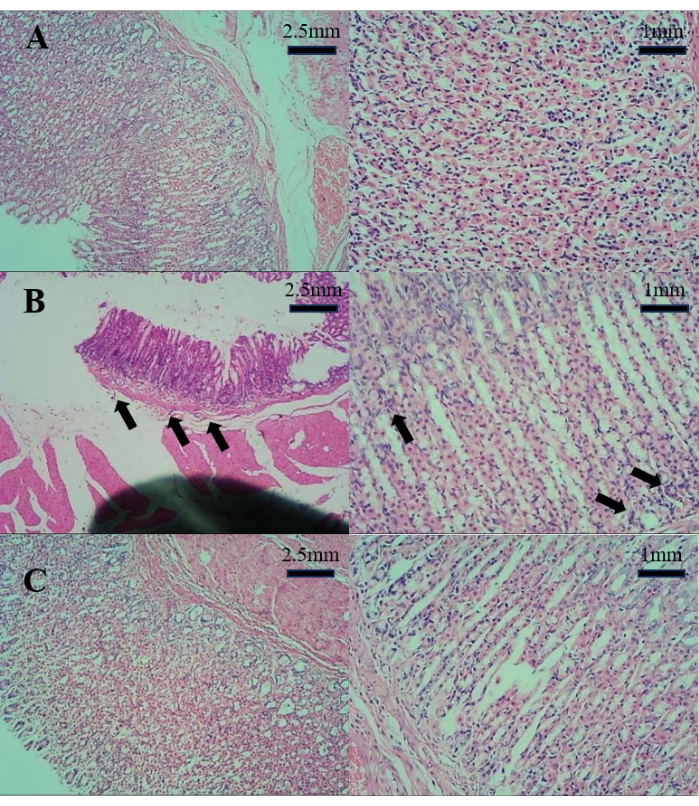
Figure 1 : Les résultats de la coupe pathologique de la paroi de l’estomac. (A) Coupe pathologique de l’estomac dans le groupe C. (B) Coupe pathologique de l’estomac dans le groupe M. (C) Coupe pathologique de l’estomac dans le groupe T. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Le contenu des hormones gastro-intestinales sériques. (A) Tableau d’analyse à barres des résultats de détermination du MDA (malondialdéhyde). (B) Tableau d’analyse à barres des résultats de détermination du GAS. *P < 0,05, **P < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Colonne gramme de l’indice de diversité T. La barre rouge représente le groupe C, la bleue représente le groupe T, tandis que la verte représente le groupe M.*P < 0,05, **P < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Analyse de la composition de la communauté. (A) Analyse de l’histogramme de la communauté. (B) Analyse de la carte thermique communautaire au niveau du genre. (C) Analyse par diagramme de Circos de la relation entre les échantillons et les espèces. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Analyse PLS-DA au niveau du genre. Le rouge représente le groupe C, le bleu représente le groupe T et le vert représente le groupe M. Veuillez cliquer ici pour voir une version agrandie de cette figure.
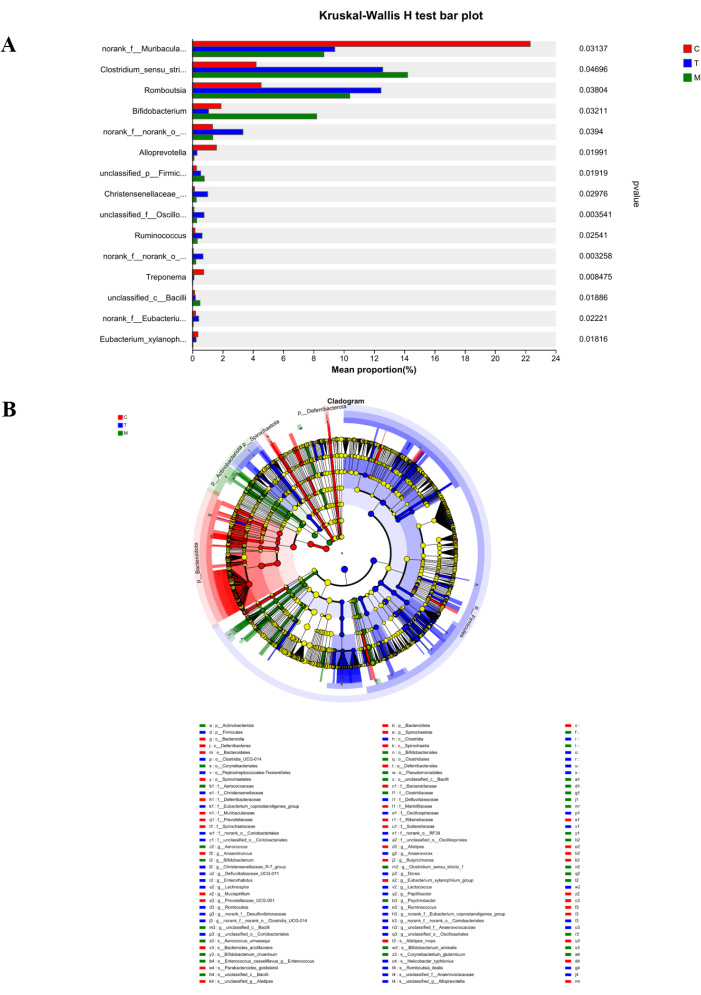
Figure 6 : Analyse des différences entre les espèces. (A) Diagramme à barres d’essai de Kruskal-Wallis H. (B) Carte arborescente des espèces à plusieurs niveaux de LefSe. Le rouge représente le groupe C, le bleu représente le groupe T et le vert représente le groupe M. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Groupe | Valeur moyenne | Écart type |
| C | 3.5201 | 0.63641 |
| M | 3.2755 | 0.28494 |
| T | 3.5388 | 0.29945 |
Tableau 1 : Résultats de l’indice de diversité alpha.
Discussion
D. caudatum, un médicament populaire couramment utilisé par la nationalité Qiang12, a montré une efficacité significative dans le traitement des maladies gastro-intestinales. Avec les progrès de la recherche pharmacologique moderne, le déséquilibre de la flore résultant du déséquilibre de la microécologie gastro-intestinale est identifié comme un facteur clé des maladies gastro-intestinales aiguës et chroniques22,23. Certains micro-organismes du tractus intestinal jouent un rôle crucial dans le maintien de l’équilibre dynamique du corps, et les hormones contenues dans le sérum reflètent l’état physiologique et pathologique du corps. Par conséquent, l’étude se concentre sur la flore intestinale et les hormones gastro-intestinales.
Le séquençage du gène à haut débit de l’ARNr 16S est une méthode primaire de détection des micro-organismes intestinaux. Il permet de détecter les types et les fonctions des micro-organismes dans les échantillons collectés, ce qui permet une analyse précise et quantitative de chaque espèce de micro-organismes intestinaux. Ces dernières années, le séquençage des gènes à haut débit de l’ARNr 16S s’est rapidement développé et a été largement utilisé pour l’analyse de la diversité microbienne dans divers environnements écologiques 24,25,26.
Les effets de D. caudatum sur la flore intestinale de rats atteints de gastrite ont été étudiés par une comparaison détaillée des communautés bactériennes intestinales dans trois groupes basée sur le séquençage du gène de l’ARNr 16S à base d’Illumina. La recherche scientifique moderne indique que Lactobacillus, norank_f__Muribaculaceae, Romboutsia et Bifidobacterium sont des probiotiques, chacun ayant des avantages spécifiques pour la santé tels que la réduction du risque de tumeurs malignes multiples, la production de vitamine K avec un potentiel anti-inflammatoire, la promotion du métabolisme des polysaccharides et l’amélioration de la diarrhée et de la constipation 27,28,29. Clostridium_sensu_stricto_1, une bactérie pathogène dans les lésions intestinales, peut provoquer une inflammation et une bactériémie et est étroitement liée aux tumeurs sanguines et gastro-intestinales30. La gastrite chronique et la gastrite atrophique contribuent de manière significative aux tumeurs gastriques31.
L’analyse bêta indique des changements significatifs dans les teneurs en Lactobacillus, norank_f__Muribaculaceae, Romboutsia, Bifidobacterium et Clostridium_sensu_stricto_1 après le traitement. Les teneurs en Lactobacillus, norank_f__Muribaculaceae et Romboutsia ont augmenté de manière significative, tandis que Bifidobacterium et Clostridium_sensu_stricto_1 ont diminué de manière significative après le traitement par D. caudatum . De plus, le diagramme à barres de la communauté suggère que la composition de la communauté du groupe T est plus similaire à celle du groupe C. Ces résultats indiquent que D. caudatum pourrait améliorer la prévalence de la gastrite chez le rat. Cependant, les mécanismes spécifiques à l’origine de la réduction de la teneur en probiotique Bifidobacterium par D. caudatum nécessitent des recherches supplémentaires.
La méthode du kit ELISA possède une sensibilité élevée, une forte spécificité, une simplicité d’utilisation et une adaptation aux échantillons de petite taille32. Dans cette étude, il a été utilisé pour détecter le contenu du malondialdéhyde (MDA) et de la gastrine (GAS) dans le sérum de rat. La MDA reflète le degré de peroxydation lipidique, indiquant indirectement l’étendue des dommages cellulaires. Chez les rats atteints de gastrite, le taux de MDA était significativement plus élevé que chez les rats normaux, ce qui suggère des dommages aux cellules pariétales gastriques. Le traitement par D. caudatum a considérablement diminué le taux de MDA, ce qui indique son potentiel dans le traitement de la gastrite. À l’inverse, D. caudatum a augmenté le taux réduit de SGA, contribuant à la réparation ou au traitement de la gastrite.
Cependant, il existe des limites au séquençage des gènes à haut débit de l’ARNr 16S et à la méthode du kit ELISA. Dans le séquençage des gènes à haut débit de l’ARNr 16S, une faible résolution peut rendre difficile la distinction de souches ou de genres avec des séquences très similaires, ce qui entraîne des difficultés de classification à des niveaux taxonomiques plus élevés tels que le genre, la famille ou l’embranchement33. Pour la méthode du kit ELISA, des étapes de prétraitement des échantillons telles que la dilution et le lavage sont généralement nécessaires, ce qui introduit des erreurs potentielles et une variabilité34.
Cette étude suggère que D. caudatum peut traiter la gastrite en régulant les hormones gastro-intestinales et la flore intestinale, ce qui donne un aperçu de ses vastes applications cliniques. Cependant, les recherches futures devraient se pencher sur d’autres hormones gastro-intestinales, les mécanismes de régulation de la flore intestinale et les produits chimiques efficaces impliqués.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par les principaux projets de R&D du Département des sciences et de la technologie de la province du Sichuan (2020YFS0539).
matériels
| Name | Company | Catalog Number | Comments |
| Alpha diversity analysis | Mothur 1.30.2 | ||
| AxyPrep deoxyribonucleic acid (DNA) gel extraction kit | Axygen Biosciences | AP-GX-50 | |
| Beta diversity analysis | Qiime 1.9.1 | ||
| Cryogenic refrigerator | Forma-86C ULT freezer | ||
| Desmodium caudatum | The Traditional Chinese Medicine Hospital of Beichuan Qiang Autonomous County | ||
| E.Z.N.A. soil kit | Omega Bio-tek | D5625-01 | |
| Illumina MiSeq Platform | Illumina Miseq PE300/NovaSeq PE250 | ||
| Multiskan Spectrum | spectraMax i3 | ||
| OTU clustering | Uparse 7.0.1090 | ||
| OTU statistics | Usearch 7.0 | ||
| PCR instrument | TransGen AP221-02 | ||
| PCR instrument | ABI GeneAmp 9700 | ||
| QuantiFluor-ST double-stranded DNA (dsDNA) system | Promega Corp. | ||
| Sequence classification annotation | RDP Classifier 2.11 | ||
| Sodium salicylate | Sichuan Xilong Chemical Co., Ltd | 54-21-7 | |
| SPF rats | Chengdu Dashuo Experimental Animal Co., Ltd | ||
| SPSS 18.0 | IBM |
Références
- Marginean, C. M., et al. The importance of accurate early diagnosis and eradication in Helicobacter pylori infection: pictorial summary review in children and adults. Antibiotics (Basel). 12 (1), 60 (2022).
- Sipponen, P., Maaroos, H. I. Chronic gastritis. Scandinavian Journal of Gastroenterology. 50 (6), 657-667 (2015).
- Wang, D. J. Methodological quality and reporting quality evaluation of chinese medicine diagnosis and treatment guidelines for chronic gastritis in China. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology. 24 (7), 2776-2783 (2022).
- Burkitt, M. D., Varro, A., Pritchard, D. M. Importance of gastrin in the pathogenesis and treatment of gastric tumors. World Journal of Gastroenterology. 15 (1), 1-16 (2009).
- Hayakawa, Y., Chang, W., Jin, G., Wang, T. C. Gastrin and upper GI cancers. Current Opinion in Pharmacology. 31, 31-37 (2016).
- Zhang, C. Z., He, M. X., Jin, L. W., Liu, W. D. Effect of aluminum phosphate gel combined with atropine on patients with acute gastritis and its effect on serum gastrin and malondialdehyde levels. International Journal of Digestive Diseases. 40 (2), 137-140 (2020).
- Wang, Y. K., et al. Levels of malondialdehyde in the gastric juice: its association with Helicobacter pylori infection and stomach diseases. Helicobacter. 23 (2), e12460 (2018).
- Turkkan, E., et al. Does Helicobacter pylori-induced inflammation of gastric mucosa determine the severity of symptoms in functional dyspepsia. Journal of Gastroenterology. 44 (1), 66-70 (2009).
- Liu, Y., Cai, C., Qin, X. Regulation of gut microbiota of Astragali Radix in treating for chronic atrophic gastritis rats based on metabolomics coupled with 16S rRNA gene sequencing. Chemico-Biological Interactions. 365, 110063 (2022).
- Gai, X., et al. Heptadecanoic acid and pentadecanoic acid crosstalk with fecal-derived gut microbiota are potential non-invasive biomarkers for chronic atrophic gastritis. Frontiers in Cellular and Infection Microbiology. 12, 1064737 (2023).
- Sgambato, D., et al. Gut microbiota and gastric disease. Minerva Gastroenterologica e Dietologica. 63 (4), 345-354 (2017).
- Li, J., et al. Pharmacogenetic study of Desmodium caudatum. Anais Da Academia Brasileira De Ciencias. 91 (2), e20180637 (2019).
- Xu, Q. N., et al. Phenolic glycosides and flavonoids with antioxidant and anticancer activities from Desmodium caudatum. Natural Product Research. 35 (22), 4534-4541 (2021).
- Li, W., et al. Anti-inflammatory and antioxidant activities of phenolic compounds from Desmodium caudatum leaves and stems. Archives of Pharmacal Research. 37 (6), 721-727 (2014).
- Shao, X. H., Wang, J. G. Establishment of chronic atrophic gastritis in a rat model. Journal of Zhangjiakou Medical Collage. 19 (2), 11-13 (2002).
- Yu, C., et al. Dysbiosis of gut microbiota is associated with gastric carcinogenesis in rats. Biomedicine & Pharmacotherapy. 126, 110036 (2020).
- Chen, R., et al. Fecal metabolomics combined with 16S rRNA gene sequencing to analyze the changes of gut microbiota in rats with kidney-yang deficiency syndrome and the intervention effect of You-gui pill. Journal of Ethnopharmacology. 224, 112139 (2019).
- Li, Q., et al. Magnetic anchoring and guidance-assisted endoscopic irreversible electroporation for gastric mucosal ablation: a preclinical study in canine model. Surgical Endoscopy. 35 (10), 5665-5674 (2021).
- Xu, H., et al. Therapeutic assessment of fractions of Gastrodiae Rhizoma on chronic atrophic gastritis by 1H NMR-based metabolomics. Journal of Ethnopharmacology. 254, 112403 (2020).
- Zhang, B. N., et al. Effects of Atractylodes lancea extracts on intestinal flora and serum metabolites in mice with intestinal dysbacteriosis. Proteome Science. 21 (1), 5 (2023).
- Tian, H., et al. The therapeutic effects of Magnolia officinalis extraction on an antibiotics-induced intestinal dysbacteriosis in mice. Current Microbiology. 77 (9), 2413-2421 (2020).
- Wang, J., et al. Tumor and microecology committee of China anti-cancer association. Chinese expert consensus on intestinal microecology and management of digestive tract complications related to tumor treatment (version 2022). Journal of Cancer Research and Therapeutics. 18 (7), 1835-1844 (2022).
- Xu, W., Xu, L., Xu, C. Relationship between Helicobacter pylori infection and gastrointestinal microecology. Frontiers in Cellular and Infection Microbiology. 12, 938608 (2022).
- Johnson, J. S., et al. Evaluation of 16S rRNA gene sequencing for species and strain-level microbiome analysis. Nature Communications. 10 (1), 5029 (2019).
- Callahan, B. J., et al. High-throughput amplicon sequencing of the full-length 16S rRNA gene with single-nucleotide resolution. Nucleic Acids Research. 47 (18), e103 (2019).
- Langille, M. G., et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology. 31 (9), 814-821 (2013).
- Huang, D., et al. Characteristics of intestinal flora in patients with gastric cancer based on high throughput sequencing technology. Chinese Journal of Clinical Research. 35 (3), 303-306 (2022).
- Shi, Y., Luo, J., Narbad, A., Chen, Q. Advances in lactobacillus restoration for β-lactam antibiotic-induced dysbiosis: a system review in intestinal microbiota and immune homeostasis. Microorganisms. 11 (1), 179 (2023).
- Grigor'eva, I. N. Gallstone disease, obesity and the Firmicutes/Bacteroidetes ratio as a possible biomarker of gut dysbiosis. Journal of Personalized Medicine. 11 (1), 13 (2020).
- Thorne, G. M. Diagnosis of infectious diarrheal diseases. Infectious Disease Clinics of North America. 2 (3), 747-748 (1988).
- Banks, M., et al. British society of gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma. Gut. 68 (9), 1545-1575 (2019).
- Roy-Lachapelle, A., et al. Evaluation of ELISA-based method for total anabaenopeptins determination and comparative analysis with on-line SPE-UHPLC-HRMS in freshwater cyanobacterial blooms. Talanta. 223, 121802 (2021).
- Shahi, S. K., et al. Microbiota analysis using two-step PCR and next-generation 16S rRNA gene sequencing. Journal of Visualized Experiments. (152), e59980 (2019).
- Huang, R., et al. Blocking-free ELISA using a gold nanoparticle layer coated commercial microwell plate. Sensors (Basel). 18 (10), 3537 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon