Method Article
Elaborazione di cellule staminali mesenchimali umane per applicazioni cliniche utilizzando un flusso di lavoro semi-automatizzato chiuso
In questo articolo
Riepilogo
Qui presentiamo un protocollo per raccogliere cellule aderenti da palloni multistrato in modo semi-automatico chiuso utilizzando un sistema di centrifugazione controcorrente. Questo protocollo può essere applicato per la raccolta di celle aderenti e in sospensione da altre piattaforme di espansione cellulare con poche modifiche ai passaggi esistenti.
Abstract
Le cellule staminali mesenchimali umane (hMSC) sono attualmente in fase di studio come promettente modalità terapeutica basata su cellule per varie malattie, con ulteriori approvazioni di mercato per uso clinico previste nei prossimi anni. Per facilitare questa transizione, è fondamentale affrontare i colli di bottiglia di scala, riproducibilità da lotto a lotto, costi, conformità normativa e controllo della qualità. Queste sfide possono essere affrontate chiudendo il processo e adottando piattaforme di produzione automatizzate. In questo studio, abbiamo sviluppato un processo chiuso e semi-automatizzato per il passaggio e la raccolta delle hMSC derivate dalla gelatina di Wharton (WJ) (WJ-hMSC) da palloni multistrato utilizzando la centrifugazione controcorrente. Le WJ-hMSC sono state espanse utilizzando un mezzo privo di siero privo di siero (SFM XF) conforme alle normative e hanno mostrato proliferazione cellulare (raddoppio della popolazione) e morfologia comparabili alle WJ-hMSC espanse nei classici mezzi contenenti siero. Il nostro protocollo di raccolta semi-automatico chiuso ha dimostrato un elevato recupero cellulare (~ 98%) e vitalità (~ 99%). Le cellule lavate e concentrate mediante centrifugazione controcorrente hanno mantenuto l'espressione del marcatore di superficie WJ-hMSC, le unità formanti colonie (CFU-F), il potenziale di differenziazione del trilineaggio e i profili di secrezione di citochine. Il protocollo di raccolta delle celle semi-automatizzato sviluppato nello studio può essere facilmente applicato per l'elaborazione su piccola e media scala di varie celle aderenti e in sospensione collegandosi direttamente a diverse piattaforme di espansione cellulare per eseguire la riduzione del volume, il lavaggio e la raccolta con un basso volume di output.
Introduzione
Le cellule staminali mesenchimali umane (hMSCs) sono un ottimo candidato per applicazioni cliniche, sia nell'ingegneria tissutale che nelle terapie cellulari, dato il loro potenziale terapeutico e l'elevato potenziale di auto-rinnovamento per crescere in vitro, che sono fondamentali per generare dosaggi clinicamente rilevanti delle cellule 1,2,3. Secondo ClinicalTrials.gov, ci sono oltre 1.000 studi clinici attualmente in fase di indagine per varie condizioni di malattia4. Dato il contesto di crescente interesse per l'uso di hMSC, ulteriori studi clinici e approvazioni di mercato sono imminenti nel prossimo futuro 5,6. Tuttavia, la produzione di hMSC presenta molte sfide intrinseche in termini di variabilità da lotto a lotto, l'uso di materie prime ad alto rischio, preoccupazioni relative alla contaminazione dovuta a molti processi aperti e manuali, poiché la produzione comporta operazioni di unità multiple, costi di manodopera più elevati, costi di scalabilità orizzontale o verticale e ostacoli normativi 6,7,8,9,10, 11,12. Questi problemi rimangono un ostacolo significativo all'accesso al mercato attuale e futuro.
Lo sviluppo di soluzioni di produzione chiuse, modulari e automatizzate e l'utilizzo di reagenti ausiliari a basso rischio affronterebbero queste sfide. Ciò garantirebbe anche una qualità costante del prodotto, ridurrebbe la probabilità di guasti dei lotti dovuti a errori umani, ridurrebbe i costi di manodopera e migliorerebbe la standardizzazione dei processi e la conformità normativa, ad esempio in termini di registrazione digitale dei lotti 8,12,13,14. Per essere in grado di ottenere un dosaggio clinicamente rilevante delle cellule, sia esso autologo o allogenico, è fondamentale una produzione semplificata che comporti l'espansione cellulare a monte e l'elaborazione a valle in modo chiuso e automatizzato.
Per l'espansione hMSC upstream, i due metodi di produzione più comuni attualmente utilizzati sono scale-out (monostrato 2D) e scale-up (sistema di sospensione basato su microcarrier 3D)15,16,17,18. Il metodo più tradizionale e ampiamente adottato per l'espansione hMSC è la coltura 2D basata su monostrato a causa del basso costo di produzione e della facilità di configurazione19.
I palloni multistrato composti da vassoi a superficie piatta impilati all'interno di un recipiente di coltura sono comunemente utilizzati per scalare la produzione hMSC. Questi sistemi sono tipicamente disponibili in recipienti di coltura da 1 a 40 strati20 e vengono gestiti manualmente all'interno di armadi di biosicurezza. Le fasi di lavorazione durante il passaggio e la raccolta delle celle comportano l'erogazione e la decantazione manuale del mezzo di espansione, del reagente di dissociazione e del tampone di lavaggio mediante pipettaggio o inclinazione fisica dell'intero serbatoio. Inoltre, la gestione di più unità è impegnativa e richiede tempo a causa delle loro dimensioni e del loro peso.
Successivamente, la post-raccolta da matraccio multistrato, la centrifugazione per lo scambio di supporti, il lavaggio delle cellule e la riduzione del volume sono passaggi essenziali nell'intero flusso di lavoro di produzione delle celle21. La centrifugazione convenzionale da banco è un processo per lo più aperto e manuale che comporta una moltitudine di passaggi, come il trasferimento della sospensione cellulare in tubi o bottiglie tappati all'interno di un armadio di biosicurezza, la rotazione delle cellule, l'aspirazione manuale del surnatante, la risospensione cellulare con il tampone e ripetuti lavaggi cellulari. Ciò aumenta drasticamente sia il rischio di contaminazione dovuto all'apertura e alla chiusura dei tappi sia le possibilità di perdere il pellet cellulare durante il processo manuale di aspirazione/pipettaggio22. Nel contesto della gestione di sistemi di coltura multistrato per cellule aderenti come le hMSC, l'operatore dovrebbe passare ripetutamente attraverso un laborioso processo di spola tra la centrifuga e l'armadio di biosicurezza e maneggiare contemporaneamente un'unità pesante. Queste fasi manuali sono laboriose, comportano rischi in termini di errori umani e contaminazione e devono essere condotte in un ambiente di camera bianca di classe B, che è costoso23. Inoltre, il processo di centrifugazione manuale convenzionale non è scalabile e potrebbe causare taglio cellulare e stress; Pertanto, massimizzare il recupero cellulare, la vitalità e l'efficienza di wash-out delle impurità residue sono altre importanti sfide22. La produzione commerciale su scala cGMP di terapie cellulari richiede soluzioni di automazione chiuse e modulari per ridurre il rischio di contaminazione, garantire una qualità costante del prodotto, ridurre i costi di manodopera e produzione e aumentare l'affidabilità del processo24,25. I palloni multistrato possono essere gestiti come un sistema chiuso avendo un filtro sterile da 0,2 μm in una delle porte per facilitare lo scambio di gas sterile e una seconda porta collegata asetticamente tramite connettori o saldati a tubi direttamente a uno strumento automatizzato per il trattamento delle celle per la raccolta delle cellule. Abbiamo lavorato per chiudere e automatizzare la maggior parte delle fasi di passaggio e raccolta WJ-hMSC valutando un'innovativa centrifuga chiusa in controcorrente destinata alla produzione di prodotti a base di cellule, geni o tessuti. Questa centrifuga controcorrente ha anche la flessibilità di eseguire una varietà di applicazioni di lavorazione cellulare, come la separazione cellulare in base alle dimensioni, allo scambio di mezzi/tamponi, alla concentrazione e alla raccolta per una varietà di tipi di cellule 8,26,27,28. Lo strumento utilizza un kit monouso chiuso che può essere collegato sterile utilizzando saldatura di tubi o connettori asettici per trasferire i sacchi o può essere collegato direttamente a qualsiasi piattaforma di espansione scelta.
In questo studio, abbiamo progettato un gruppo di tubi personalizzato per consentire connessioni sterili chiuse tra il kit di centrifugazione controcorrente monouso e il pallone multistrato. Abbiamo ottimizzato un protocollo per staccare, lavare e raccogliere enzimaticamente le WJ-MSC dal pallone multistrato in modo completamente chiuso e semi-automatizzato all'interno di un singolo ciclo. Le WJ-hMSC raccolte sono state caratterizzate per purezza (analisi dei marcatori di superficie) e potenza (CFU-F, differenziazione del trilineaggio e profili di secrezione di citochine) per garantire che il prodotto finale soddisfacesse gli attributi critici di qualità (CQA) per il rilascio del lotto.
Protocollo
1. Preparazione dei terreni di coltura e rivestimento dei recipienti di coltura
- Preparazione dei supporti
- Composizione del classico mezzo contenente siero: preparare il classico mezzo contenente siero mescolando αMEM (445 ml), siero fetale bovino (FBS) (50 ml) e 100 volte penicillina-streptomicina (5 ml).
- Preparare il supporto SFM XF completo.
- Preparare un flacone da 500 mL aggiungendo asetticamente 5 mL di supplemento SFM XF (100x) e 5 mL di L-alanil-L-glutammina 100x (vedere Tabelle dei materiali) al mezzo basale SFM XF (500 ml).
- Preparare una sacca da 2 L aggiungendo asetticamente 20 ml di supplemento personalizzato MSC SFM XF (100x) e 20 mL di L-alanil-L-glutammina 100x (vedere Tabelle dei materiali) alla sacca media basale SFM XF (2 L) collegando una siringa da 50 mL alla porta appropriata della borsa.
NOTA: Prima dell'uso in coltura, aggiungere fattori di crescita o citochine (non forniti con il substrato) al mezzo SF XF completo: PDGF-BB (20 ng / mL), FGF basico (4 ng / mL) e TGFβ (0,5 ng / mL).
- Rivestimento dei vasi di coltura cellulare con vitronectina per l'uso con terreni privi di siero
- Scongelare una scorta di vitronectina (VTN-N; 0,9 mg/ml) a 4 °C.
- Utilizzare soluzione salina tamponata di Dulbecco sterile senza calcio e magnesio (DPBS) per diluire il VTN-N scongelato a una concentrazione operativa di 5 μg/ml.
NOTA: Diluire il VTN-N immediatamente prima dell'uso e non conservare la soluzione diluita di vitronectina. - Aggiungere 1 mL/10 cm2 della soluzione diluita di VTN-N al recipiente di coltura corrispondente; La concentrazione finale è di 0,5 μg/cm2. Ad esempio, aggiungere 7,5 ml di soluzione VTN-N diluita a un matraccio T-75 (75 cm2); aggiungere 17,5 mL di soluzione diluita di VTN-N a un matraccio T-175 (175 cm2); aggiungere 250 mL di soluzione VTN-N diluita a un matraccio standard multistrato a quattro strati (2,528 cm2); e aggiungere 630 mL di soluzione diluita di VTN-N a un matraccio multistrato a 10 strati (6.320 cm2).
- In condizioni sterili, incubare i vasi per 1 ora a temperatura ambiente (RT).
NOTA: Il recipiente di coltura rivestito può essere conservato a 4 °C per un massimo di 1 settimana. Avvolgere il recipiente di coltura con pellicola di laboratorio per evitare che si secchi. Prima dell'uso, preriscaldare il recipiente di coltura a temperatura ambiente per almeno 1 ora. - Aspirare la soluzione VTN-N, scartare e aggiungere immediatamente un volume sufficiente di terreno di coltura per evitare che la superficie del recipiente rivestito si asciughi.
NOTA: non è necessario risciacquare il recipiente di coltura dopo la rimozione del VTN-N.
2. Espansione WJ-hMSC
- Scongelare rapidamente le WJ-hMSCs (p2) ponendo il crioviale in un bagno d'acqua a 37 °C; Ruotare lentamente il flaconcino fino a quando il contenuto inizia a scongelarsi.
- Dopo lo scongelamento, seminare le WJ-hMSC a 5.000 cellule/cm2 in un matraccio T-175 (senza rivestimento VTN-N) e incubare nel classico mezzo contenente siero a 37 °C in un'atmosfera umidificata di CO2 al 5% per l'espansione cellulare. Dopo due passaggi (p4), depositare le cellule espanse nel mezzo di crioconservazione desiderato come banca di cellule di lavoro (WCB).
- Eseguire il conteggio delle cellule utilizzando un contatore automatico delle cellule seguendo il metodo di vitalità e conteggio delle cellule per determinare il conteggio totale delle cellule, la vitalità cellulare e la dimensione delle cellule29.
- Da p4, coltivare i WJ-hMSC a 5.000 cellule/cm2 in flaconi T-75 in mezzo contenente siero classico o mezzo SFM XF (utilizzare palloni rivestiti VTN-N con mezzo SFM XF).
- Mantenere le cellule in entrambi i terreni di coltura per un totale di tre passaggi (12 giorni) e misurare l'espansione cellulare (aumento di piega) ad ogni passaggio dividendo il numero di cellule vitali contate alla fine della coltura di ciascun passaggio per il numero di cellule vitali all'inizio della coltura (giorno della semina cellulare).
3. Espansione scale-out del treno di semi
- Espansione WJ-hMSC in un pallone T-175
- Scongelare rapidamente le WJ-hMSCs a p4 ponendo il crioviale in un bagno d'acqua a 37 °C; Ruotare lentamente il flaconcino fino a quando la soluzione inizia a scongelarsi.
- Seminare 5.000 cellule/cm2 in un matraccio T-175 rivestito con VTN-N. Lasciare che le cellule crescano in un incubatore a 37 °C con il 5% di CO2.
- Sostituire il terreno di coltura esaurito ogni 2-3 giorni con un mezzo SFM XF completo preriscaldato appena preparato per prestazioni ottimali e crescita cellulare.
- Manipolazione dei palloni multistrato (figura 1A, B)
- Tutte le connessioni asettiche devono essere eseguite in un ambiente sterile.
- Disimballare il matraccio multistrato all'interno di un armadio di sicurezza biologica.
- Collegare il filtro dell'aria pre-sterilizzato (0,2 μm) a una porta per consentire il rilascio della pressione durante il trasferimento del fluido utilizzando la centrifuga controcorrente.
- Montare il connettore del pallone multistrato dal set di tubi personalizzato nell'altra porta (Figura 1B).
- Saldare la linea in PVC del set di tubi personalizzati al sacchetto di trasferimento in PVC da 2 litri contenente il mezzo SFM XF completo.
NOTA: Mescolare completamente il sacchetto medio prima di aggiungerlo al sistema multistrato per flusso per gravità. Assicurarsi che il sacchetto di trasferimento in PVC sia appeso più in alto del pallone multistrato. - Posizionare il matraccio multistrato sul lato lungo, con il filtro dell'aria in alto (figura 1B).
- Aprire il morsetto sul tubo in PVC per iniziare a riempire il pallone multistrato. Assicurarsi che il mezzo sia a livello tra i vassoi durante il riempimento.
- Una volta che il mezzo si è completamente livellato in tutti i vassoi, ruotare il pallone multistrato sul lato corto con le porte in posizione verticale.
- Chiudere il morsetto sulla linea in PVC e rimuovere il sacchetto di trasferimento sostituendo il collegamento del tubo con il tappo di chiusura blu MPC.
NOTA: Non rimuovere il filtro dell'aria, in quanto ciò consente lo scambio di gas durante l'espansione della cella. - Trasformare il matraccio multistrato nella posizione di incubazione.
NOTA: il filtro e la connessione del tubo devono essere rivolti verso l'alto. - Svuotare il matraccio multistrato collegandolo a un flacone dell'aspiratore; Posizionalo sopra il flacone dell'aspiratore e il liquido fuoriuscirà.
NOTA: Inclinare il pallone multistrato su un lato per drenare completamente il mezzo esaurito per gravità. In alternativa, il mezzo esaurito può essere versato in una bottiglia di scarto utilizzando un gruppo di tubi personalizzato. - Ripetere i passaggi 3.2.5-3.2.11 per reintegrare il terreno fresco.
- Sottocultura di WJ-hMSCs nel pallone multistrato (T-175 > 4 strati > 10 strati)
- Reagente di dissociazione cellulare pre-caldo (TrypLE) e mezzo SFM XF completo all'interno di un incubatore a 37 °C prima dell'uso.
- Aspirare il mezzo esaurito dal pallone T-175 e gettarlo.
- Lavare il monostrato cellulare con DPBS preriscaldato, aspirare e scartare.
- Aggiungere TrypLE a ciascun pallone, assicurare una copertura completa del monostrato cellulare e incubare per 5-10 minuti a 37 °C.
- Trasferire la sospensione in un tubo conico sterile da 50 ml.
- Centrifugare il tubo a 100-200 x g per 5 minuti a RT. Aspirare e scartare il DPBS e fare attenzione a non disturbare il pellet cellulare.
- Risospendere il pellet cellulare in un volume minimo (10 ml) di mezzo SFM XF completo pre-caldo per il conteggio delle cellule.
- Riempire un recipiente di coltura a quattro strati rivestito VTN-N con circa 800 ml di mezzo SFM XF completo, come indicato nella sezione 2 sopra. Aggiungere 5.000 celle/cm2 (cioè 1,26 x 107 celle/fiaschetta vitali). Ruotare delicatamente la sospensione cellulare per garantire una distribuzione uniforme.
- Incubare in un incubatore a 37 °C con il 5% di CO2 in atmosfera umidificata.
- Sostituire il terreno di coltura esaurito ogni 2-3 giorni con un mezzo SFM XF completo fresco e preriscaldato per una crescita cellulare ottimale fino a quando le cellule raggiungono il 60% -80% di confluenza o sono pronte per essere sub-coltivate nel pallone multistrato a 10 strati.
- Riempire un matraccio multistrato a 10 strati rivestito con VTN-N con circa 2 L di mezzo SFM XF completo, come indicato nella sezione 2. Aggiungere 5.000 celle/cm2 (cioè 3,1 x 107 celle/pallone). Ruotare delicatamente la sospensione cellulare per garantire una distribuzione uniforme.
- Incubare in un incubatore a 37 °C con il 5% di CO2 in atmosfera umidificata.
- Sostituire il terreno di coltura esaurito ogni 2-3 giorni con un terreno SFM XF completo fresco e preriscaldato per una crescita cellulare ottimale fino a quando le cellule raggiungono il 60% -80% di confluenza o sono pronte per essere raccolte.
4. Dissociazione e raccolta semiautomatica chiusa WJ-hMSC mediante centrifugazione chiusa in controcorrente
- Assemblaggio kit di centrifugazione controcorrente monouso
- Collegare il kit monouso con i sacchetti di trasferimento in PVC monouso tramite saldatura a tubo, simile alla configurazione mostrata nella Figura 1A.
NOTA: La portata predefinita del kit monouso è 30-165 ml/min. - Collegare un pallone multistrato a 10 strati contenente WJ-hMSC confluenti al gruppo di tubi personalizzato all'interno di un armadio di biosicurezza.
- Trasferire il recipiente di coltura a 10 strati collegato con il gruppo di tubi personalizzato su un banco e saldarlo alla linea E (3/32 in PVC ID) del kit monouso, come mostrato nella Figura 1B.
- Assicurarsi di saldare una porta campione sterile alla linea G del kit monouso ad alto flusso.
- Quindi, collegare la linea H di raccolta a un Luer sterile dotato di una siringa da 50 ml.
NOTA: In tutti i passaggi precedenti, assicurarsi che i morsetti manuali siano chiusi per fissare il fluido in ogni sacchetto del kit.
- Collegare il kit monouso con i sacchetti di trasferimento in PVC monouso tramite saldatura a tubo, simile alla configurazione mostrata nella Figura 1A.
- Impostazione della corsa dello strumento
- Accendere lo strumento " ON" accendendo l'interruttore a levetta sul retro dello strumento.
- Collegare il laptop alla porta USB-C dello strumento utilizzando il cavo USB-C in dotazione (Figura 1B).
- Eseguire il software dell'interfaccia utente grafica (GUI) della centrifuga controcorrente dal desktop o dal menu di avvio.
- Dopo aver effettuato l'accesso, carica il protocollo facendo clic sul pulsante Seleziona un protocollo nella pagina di benvenuto principale.
NOTA: il protocollo di raccolta della centrifugazione controcorrente (Tabella 1) è stato creato utilizzando il software Protocol Builder e memorizzato localmente. - Premere il pulsante blu di sblocco sullo strumento e aprire la porta a vetri.
- Caricare il kit monouso assemblato sul sistema di centrifugazione controcorrente.
- Inizia appendendo i sacchetti sospesi ai ganci appendiabiti in un ordine che li allinea al meglio con le porte del tubo sulle strisce del sensore a bolle, con il pallone multistrato a 10 strati posizionato ad angolo, come mostrato nella Figura 1B.
- Allineare il kit con i due pulsanti di posizione del kit, allungare il tubo della pompa attorno alla pompa peristaltica e premere il connettore bianco a forma di bulbo in posizione.
NOTA: assicurarsi che il tubo sopra il sensore di pressione sia posizionato correttamente nella traccia del tubo. - Collegare la camera della centrifuga sollevando la leva d'argento del supporto della camera della centrifuga controcorrente e fissandola riportando la leva in posizione verticale.
- Premere il tubo da ciascuna porta del kit nei binari lungo le strisce del sensore di bolle.
NOTA: assicurarsi che i sacchetti non siano aggrovigliati in modo che il processo di protocollo possa essere facilmente seguito. - Chiudere la porta premendo verso il basso sul chiavistello della porta.
NOTA: il braccio del morsetto della pompa si chiude, la camera della centrifuga girerà e le valvole si chiuderanno. Senza chiudere la porta, il sistema non sarà in grado di avviare ed eseguire il protocollo. - Premi il pulsante Avvia sulla GUI. Apparirà una lista di controllo; I primi quattro elementi sono controlli strumentali e gli ultimi due elementi sono controlli utente (assicurarsi che le borse e le connessioni corrispondano all'immagine del kit e assicurarsi che i morsetti manuali siano aperti).
NOTA: per i controlli degli strumenti, vengono mostrate X rosse anziché segni di spunta blu se qualcosa non è corretto. - Premere Conferma per visualizzare la schermata degli input del protocollo.
- Impostare il valore della finestra di dialogo Immissione dati (Volume raccolto) su 45 ml e premere Conferma.
NOTA: la schermata di input del protocollo verrà visualizzata se nel protocollo creato dall'utente sono impostati input di dati variabili. Il volume di raccolta è impostato come variabile in questo protocollo e l'utente può scegliere di testare volumi diversi a seconda dei requisiti finali di densità cellulare. Il volume minimo di raccolta consentito dal sistema è di 5 ml. Il sistema consente di impostare un massimo di quattro variabili di dati per ciascun protocollo.
- Esecuzione del protocollo
- Fare clic su Avvia sulla GUI e premere il pulsante verde Start sullo strumento per avviare l'esecuzione del protocollo (fare riferimento alla Tabella 1).
NOTA: Il sistema avvierà i passaggi secondo il protocollo a partire dalla sequenza di adescamento sostituendo l'aria nel sistema con un buffer. - Una volta completato l'adescamento (Tabella 1, fase 8) assicurarsi che il mezzo esaurito sia completamente pompato nel sacco dei rifiuti.
NOTA: Una volta che il pallone multistrato a 10 strati è vuoto, il sistema chiederà all'utente nella GUI di confermare se il recipiente è vuoto. Premere il pulsante "Salta" sullo strumento se la nave è vuota; in caso contrario, premere il pulsante verde "Riproduci / Pausa" per continuare a scaricare eventuali liquidi residui dal recipiente. - Nei punti di pausa 15, 19 e 22 (Tabella 1) assicurarsi di sollevare il matraccio multistrato e agitare per distribuire equamente il tampone su tutti i vassoi. Una volta completato, riposizionare il matraccio multistrato a 10 strati nella posizione di estrazione originale per i passaggi successivi.
NOTA: Solo per il punto 19 della Tabella 1 , dopo aver agitato, assicurarsi di posizionare il matraccio multistrato piatto e incubare per 10-15 minuti a RT per dissociare le cellule. - Nella fase 20 e nella fase 23 (Tabella 1), assicurarsi che le cellule tripsinaizzate siano trasferite completamente nella sacca intermedia.
- Mescolare bene manualmente il sacchetto intermedio al punto 25 (Tabella 1).
- Al punto 26 (Tabella 1), utilizzare una siringa Luer da 2 mL per campionare attraverso la porta di campionamento.
NOTA: Si raccomanda di campionare almeno tre volte per un conteggio accurato delle cellule. - Nella fase 29 e nella fase 30 (Tabella 1), controllare la formazione stabile del letto cellulare fluidizzato; dovrebbe essere simile al letto cellulare fluidizzato come mostrato nella Figura 1C.
NOTA: Se il letto cellulare fluidizzato stabile non si forma in modo simile a quello mostrato nella Figura 1C, l'ottimizzazione del rapporto tra la forza g e la portata (G/F) è fondamentale per ottenere un letto cellulare fluidizzato stabile (elevato recupero cellulare) nella camera durante le fasi di carico e lavaggio della cella. Il rapporto G/F dipende dalla dimensione delle celle e dalla densità del mezzo. Un elevato rapporto G/F è necessario per un tampone campione/lavaggio ad alta densità, mentre un basso rapporto G/F può essere utilizzato per un tampone campione/lavaggio a bassa densità. - La corsa è completa nella fase Ramp to Stop (passo 35 nella Tabella 1) e tutti i valori di pizzicamento sul sistema di centrifugazione controcorrente si chiuderanno automaticamente.
NOTA: Infine, assicurarsi che i morsetti manuali siano chiusi per fissare il fluido in ogni sacchetto del kit prima di aprire lo sportello. - Al termine dell'esecuzione del protocollo, premere il pulsante blu di sblocco sullo strumento e aprire lo sportello a vetri. Estrarre dallo strumento il kit monouso con il concentrato raccolto.
- Sigillare asetticamente la linea di raccolta utilizzando una sigillatrice per tubi trasportata a mano. Trasferire con cautela la siringa sigillata riempita con il prelievo di cellule concentrate nell'armadio di sicurezza biologica per il conteggio delle cellule e la crioconservazione.
- Staccare nuovamente la camera utilizzando la leva, estrarre il connettore della lampadina dal raccordo e sollevare con cautela il kit e smaltirlo in un sacchetto a rischio biologico.
- Pulire lo strumento con salviette a etanolo e assicurarsi di chiudere la porta.
- Chiudere l'applicazione GUI prima di spegnere l'interruttore sul retro dello strumento.
NOTA: Il protocollo di prelievo cellulare è stato testato in triplicati biologici (n = 3).
- Fare clic su Avvia sulla GUI e premere il pulsante verde Start sullo strumento per avviare l'esecuzione del protocollo (fare riferimento alla Tabella 1).
5. Valutazione degli attributi critici di qualità (CQA)
- Marcatori di superficie dell'identità cellulare (CD73, CD90 e CD105) e marcatori non stromali (CD34 e CD45)
- Diluire la sospensione di cellule WJ-hMSC prelevata a una concentrazione di 1 x 106 cellule vitali/ml aggiungendo un volume appropriato di tampone citometrico a flusso (DPBS con 1% BSA o 2% FBS).
- Aggiungere 100 μL della sospensione cellulare a ciascun tubo di microcentrifuga o piastra a 96 pozzetti. Assicurarsi che siano presenti almeno 0,1 x 106 cellule per 100 μL di sospensione cellulare.
- Aggiungere l'anticorpo coniugato con fluorofori al campione ad una diluizione appropriata, come raccomandato dal fornitore dell'anticorpo.
- Incubare per 20 minuti al buio.
- Dopo l'incubazione, aggiungere 100 μL di tampone citometrico a flusso per lavare i campioni mediante centrifugazione a 380 x g per 3 minuti.
- Scartare il surnatante, lasciando dietro di sé il pellet.
- Risospendere il pellet cellulare in 200 μL di tampone citometrico a flusso e sottoposto ad analisi di citometria a flusso30.
- Unità formanti colonie saggio fibroblastico (CFU-F)
- Diluire la sospensione cellulare ad una concentrazione di 1.000 cellule vitali/ml di terreno di coltura completo.
- Piastra ~ 500 cellule per pozzetto in una piastra di coltura tissutale a 6 pozzetti in terreno di coltura completo.
- Incubare per 10-14 giorni a 37 °C in CO2 umidificata al 5%, lavare con PBS e colorare con viola cristallino allo 0,5% in metanolo per 30 minuti a RT.
- Enumerare le colonie in ogni pozzo.
- Calcolare l'efficienza CFU-F: dividere il numero di colonie formate dal numero di semina originale per ottenere l'efficienza percentuale di formazione delle colonie ed esprimerla in percentuale.
- Potenziale di differenziazione del trilignaggio
- Seminare 5 x 103 cellule/cm2 in osteogenesi e mezzo di differenziazione dell'adipogenesi in piastre a 12 pozzetti secondo il protocollo del produttore. Per la condrogenesi, preparare 1,6 x 107 cellule vitali / ml e generare colture di micro massa seminando 5 μL di goccioline della soluzione cellulare nei centri dei pozzetti di piastre a 96 pozzetti, secondo il protocollo del produttore.
- Durante la differenziazione, apportare modifiche complete al mezzo ogni 3-4 giorni.
- Dopo 14 giorni (per l'adipogenesi) o 21 giorni (per l'osteogenesi e la condrogenesi), monitorare le colture per la differenziazione utilizzando coloranti biologici specifici del lignaggio secondo il protocollo del produttore. Per la differenziazione adipogenica, colorare le colture con una soluzione di olio rosso O allo 0,5%. Per l'osteogenesi, eseguire la colorazione utilizzando una soluzione di Alizarin Red S al 2%. Per la differenziazione condrogena, colorare i pellet di micro massa con l'1% di Alcian Blue.
- Profili di secrezione di citochine
- Scongelare le cellule crioconservate raccolte manualmente o utilizzando il sistema di centrifugazione controcorrente e seminare 5.000 cellule/cm2 in un pallone T-175 con mezzo SFM XF.
- Dopo 4 giorni, raccogliere il terreno di coltura esaurito e conservarlo a -80 °C fino all'analisi.
- Quantificare l'espressione delle citochine utilizzando un kit di pannelli 19-plex dei profili di espressione delle citochine su un lettore multiplex.
- Eseguire i test immunologici multiplex secondo le raccomandazioni del produttore.
Risultati
La banca di cellule master (MCB) WJ-hMSC dopo lo scongelamento è stata mantenuta per tre passaggi successivi (p1-p4) nel classico mezzo contenente siero per produrre abbastanza banche di cellule funzionanti (WCB) per gli esperimenti. I WCB p4 sono stati scongelati ed espansi sia nel mezzo contenente siero che nel mezzo SFM XF per altri tre passaggi (p4-p7) nei palloni T-175. Le WJ-MSC si sono adattate bene quando espanse nel mezzo SFM XF e sono state in grado di mantenere una proliferazione stabile simile a quella nel mezzo contenente siero (Figura 2A). Tuttavia, le cellule espanse nel mezzo SFM XF hanno mostrato una morfologia a forma di fuso simile a un fibroblasto leggermente più lunga, risultando in una dimensione cellulare leggermente più grande (Figura 2B) di una media di ~ 17 μm rispetto a ~ 15 μm nel mezzo contenente siero. In entrambe le condizioni medie attraverso i tre passaggi, le WJ-hMSCs hanno costantemente raggiunto la loro massima densità cellulare di ~2,3 x 104 cellule/cm2 e un tempo di raddoppio della popolazione di ~34 h (Figura 2C,D).
Per l'espansione WJ-hMSC su larga scala in un sistema chiuso, abbiamo effettuato un'espansione del treno di semi di WJ-hMSC prima in un pallone a 4 strati e, successivamente, in un matraccio multistrato a 10 strati. A circa l'80% -90% di confluenza dopo 4 giorni di coltura, abbiamo raccolto 9,6 x 10 7 ± 0,9 x 107 e 2,3 x 10 8 ± 0,2 x 108 celle rispettivamente per le pile a 4 e 10 strati. È stata raggiunta una densità cellulare più elevata di 3,6 x 10 4-3,8 x 104 celle / cm2 rispetto ai palloni T-175, il che significa che le pile hanno permesso una migliore espansione delle celle fino a sette volte.
Inoltre, i WJ-hMSC espansi in recipienti di coltura a 10 strati sono stati raccolti direttamente utilizzando la centrifugazione controcorrente. Il collegamento sterile al kit monouso è stato facile da stabilire per il trasferimento diretto del fluido a una portata massima di 165 ml / min utilizzando la pompa peristaltica dello strumento. Il processo di prelievo semi-automatico delle cellule è stato ottenuto raccogliendo prima le cellule utilizzando la dissociazione enzimatica, caricando le cellule nella camera di controcorrente per la riduzione del volume e la concentrazione, quindi lavando con tampone di lavaggio, che era circa 3 volte il volume della camera di centrifugazione controcorrente. Inoltre, le cellule lavate sono state poi concentrate e raccolte al volume di raccolta desiderato preimpostato nel protocollo. Le fasi di lavorazione utilizzate per l'elaborazione semi-automatica delle celle sono state progettate per emulare il flusso di lavoro di raccolta manuale. Abbiamo ottenuto una riduzione del volume di 10 volte, con conseguente generazione di concentrazioni cellulari fino a 5,3 milioni di cellule / ml. Il protocollo è stato in grado di ottenere un elevato recupero cellulare a ~ 98% e un'elevata vitalità cellulare a ~ 99% in modo coerente per tutte e tre le esecuzioni indipendenti (Figura 3A-C).
Abbiamo effettuato ampi saggi di caratterizzazione cellulare per determinare gli attributi critici di qualità del prelievo cellulare utilizzando la centrifugazione controcorrente rispetto alla centrifugazione manuale. Per testare l'identità delle WJ-hMSCs, i marcatori della superficie cellulare sono stati analizzati mediante citometria a flusso. Come mostrato nella Figura 4A, le WJ-hMSC raccolte utilizzando entrambi i metodi hanno mostrato profili marcatori superficiali caratteristici secondo le normative ISCT, espressione positiva di CD73, CD90 e CD105, nonché espressione negativa di CD34 e CD45. Successivamente, per valutare il potenziale clonogenico delle WJ-hMSCs, sono stati effettuati saggi CFU-F. Come mostrato nella Figura 4B, le celle raccolte dalla centrifugazione controcorrente hanno mostrato un potenziale CFU-F simile rispetto alle cellule raccolte mediante centrifugazione manuale (21% ± 1% vs. 20% ± 1%, rispettivamente). Inoltre, come mostrato nella Figura 4C, le cellule raccolte con centrifugazione post-controcorrente hanno mantenuto la capacità di differenziarsi in adipociti, osteoblasti e condrociti simili alle cellule nel metodo di centrifugazione manuale. Infine, abbiamo studiato 18 diversi profili di secrezione di citochine delle cellule utilizzando saggi immunologici multiplex. Come mostrato nella Figura 4D, le cellule lavate e concentrate utilizzando la centrifugazione post-controcorrente hanno mantenuto profili di secrezione di citochine e i profili erano paragonabili a quelli del campione prelevato prima di lavare/concentrare le cellule (centrifugazione pre-controcorrente).
Nel complesso, abbiamo dimostrato un'espansione efficiente di hMSC in un sistema di coltura SFM XF e le cellule lavate e concentrate utilizzando il sistema di centrifugazione controcorrente chiuso e automatizzato hanno prodotto un elevato recupero cellulare e vitalità post-lavaggio e hanno potuto mantenere il loro fenotipo e funzionalità. Il processo semi-automatizzato chiuso sviluppato in questo studio può fornire coerenza qualitativa del prodotto in termini di recupero finale WJ-MSC, come evidenziato da tre cicli indipendenti.

Figura 1: Configurazione e assemblaggio del kit monouso ad alto flusso per la raccolta, il lavaggio e la concentrazione delle hMSC. (A) Schema del kit dopo che i sacchi sono stati collegati in linea con i rispettivi tubi. (B) Il pallone multistrato a 10 strati collegato al kit monouso ad alto flusso con il gruppo di tubi personalizzato. (C) Visualizzazione del letto cellulare fluidizzato stabile formatosi nella camera controcorrente tramite la funzione telecamera abilitata nell'interfaccia utente grafica del software di centrifugazione controcorrente. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Confronto della morfologia cellulare e dell'espansione delle hMSCs nel mezzo contenente siero e nel mezzo SFM XF. (A) La morfologia cellulare rappresentativa delle hMSCs nel siero classico e nel mezzo SFM XF. Le cellule espanse SFM XF mostravano una morfologia più lunga, a forma di fuso, caratteristica simile ai fibroblasti, mentre le cellule cresciute in mezzo contenente siero mostravano una morfologia più appiattita. (B) La dimensione media MSC tra il mezzo contenente siero e il mezzo SFM XF, misurata da un contatore automatico di celle (n = 3). È chiaro che le cellule espanse SFM XF erano generalmente più grandi delle cellule espanse con siero in diversi passaggi. La resa cellulare totale in diversi passaggi (n = 3) (C) in termini di cellule per superficie di coltura e (D) livelli di raddoppio della popolazione. Livelli simili di resa cellulare sono stati ottenuti tra il mezzo SFM XF e il mezzo contenente siero attraverso diversi passaggi. I dati sono espressi come media ± deviazione standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Caratterizzazione delle celle trattate mediante il sistema di centrifugazione controcorrente . (A) Totale delle cellule vitali prima e dopo il lavaggio e la concentrazione. (B) Una riduzione di volume di 10 volte è stata ottenuta dopo il processo di centrifugazione controcorrente. (C) Recupero totale e vitalità delle cellule. I dati sono mediati su tre repliche biologiche (n = 3) di cicli di lavaggio e concentrazione. I dati sono espressi come media ± deviazione standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.
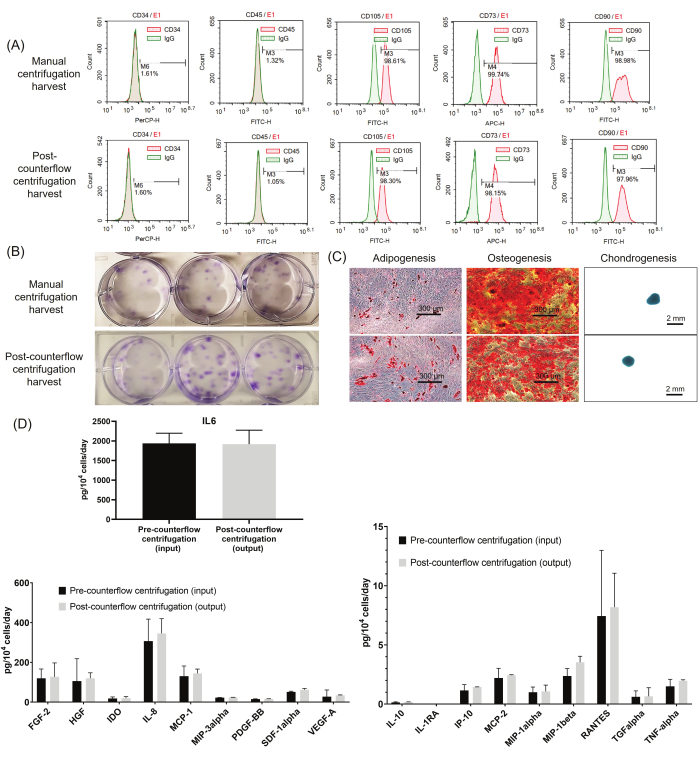
Figura 4: Analisi degli attributi critici di qualità . (A) Dati rappresentativi dalla citometria a flusso. (B) Immagini rappresentative che mostrano il totale delle CFU. (C) Immagini microscopiche rappresentative della differenziazione del trilineaggio. (D) Risultati dell'analisi dell'espressione delle citochine prima e dopo il trattamento delle cellule sul sistema di centrifugazione controcorrente (n = 3). I dati sono espressi come media ± deviazione standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Sequenza della raccolta hMSC mediante tripsinizzazione, lavaggio e protocollo di concentrazione sul sistema di centrifugazione controcorrente, comprese le fasi iniziali di adescamento. Clicca qui per scaricare questa tabella.
Discussione
In questo lavoro, abbiamo dimostrato la capacità di chiudere e semi-automatizzare la dissociazione hMSC e il lavaggio e la raccolta sul banco utilizzando uno strumento di centrifugazione controcorrente. Uno dei passaggi critici nell'intero flusso di lavoro è assicurarsi che i tubi siano collegati secondo il protocollo preimpostato definito nel generatore di protocolli del sistema di centrifugazione controcorrente. La configurazione e il funzionamento sono semplici e il tempo necessario per elaborare circa 2 litri di coltura da un pallone a 10 strati dall'assemblaggio del kit alla raccolta delle celle è stato di circa 60 minuti. Uno dei passaggi limitanti di questo flusso di lavoro è il trasferimento del fluido dal pallone multistrato ai sacchi di trasferimento collegati allo strumento di centrifugazione controcorrente. Il kit monouso ad alto flusso può essere utilizzato solo a una portata massima di 165 ml/min, e questo potrebbe essere difficile per la lavorazione, ad esempio, di un pallone a 40 strati. Per accelerare il processo di trasferimento del fluido, è possibile utilizzare pompe esterne ad alta portata per trasferire prima il contenuto tripsinizzato in un sacco di trasferimento, quindi lavare/concentrare e raccogliere le celle dal sacco di trasferimento utilizzando il sistema di centrifugazione controcorrente. Inoltre, questo protocollo può essere applicato anche per il passaggio di celle da matraccio multistrato a 4 strati a 10 strati. Più a monte, il sistema di centrifugazione controcorrente potrebbe anche essere ottimizzato per il lavaggio di hMSC scongelate e la raccolta diretta e la formulazione del terreno in palloni multistrato per avviare il treno di semi. Va notato che il numero minimo di celle necessarie per formare il letto fluidizzato nella camera di centrifugazione controcorrente è di circa 30 milioni di celle e il volume massimo raccomandato per il trattamento per lotto è di 20 L.
Attualmente, il fissaggio del gruppo di tubi personalizzati al pallone multistrato nell'armadio di biosicurezza e l'autoclave delle parti dei componenti non sono desiderabili in un ambiente cGMP. In alternativa, un gruppo di tubi personalizzato sterilizzato con raggi gamma potrebbe essere esternalizzato ai fornitori. I fornitori che forniscono palloni multistrato offrono anche la possibilità di pre-montare i palloni con i gruppi di tubi desiderati, incluso un filtro da 0,2 μm e la sterilizzazione gamma dell'intero equipaggiamento. Ciò garantirebbe che i palloni multistrato e i tubi collegati siano veramente chiusi, il che significa che il processo potrebbe essere completato sul banco in una camera bianca di Classe C.
Questo processo che utilizza il sistema di centrifugazione controcorrente non è limitato alle cellule in coltura a base aderente in un recipiente multistrato e potrebbe essere adattato a piattaforme di espansione cellulare basate su sospensioni dinamiche (serbatoio agitato o ad onda) e statiche (permeabili ai gas). In particolare, per le hMSC espanse in colture di microcarrier 3D, i protocolli possono essere ottimizzati sul sistema di centrifugazione controcorrente per raccogliere, lavare e formulare le hMSC dissociate dai microcarrier.
Nel complesso, il crescente interesse per lo sviluppo di terapie cellulari traslazionali con maggiore robustezza e affidabilità del processo ha portato allo sviluppo di piattaforme di elaborazione cellulare chiuse e automatizzate. Questi sistemi sono fondamentali, in quanto riducono il numero di fasi di movimentazione, prevengono potenziali contaminazioni da connessioni sterili e riducono i costi di produzione riducendo la manodopera e migliorando l'uso efficace dello spazio della camera bianca21. In linea con questo, molti degli sviluppatori di prodotti per terapia cellulare che stanno cercando l'approvazione normativa per tradurre le loro terapie sono consapevoli dell'importanza di chiudere il processo e implementare l'automazione completa o semi-automazione già nella fase di sviluppo del processo 14,31,32.
Con l'uso di un mezzo SFM XF conforme alle normative e insieme a reagenti ausiliari conformi alle 21 CFR GMP Part 11 e alle linee guida internazionali sulla qualità, questo processo semi-automatizzato sarebbe facilmente adatto per la produzione clinica. Abbiamo dimostrato la riproducibilità del processo chiuso e il mantenimento della qualità delle WJ-MSC. Migliorare l'efficienza e la sicurezza della coltura di cellule aderenti in flaconi multistrato andrebbe a beneficio non solo del campo della terapia hMSC, ma anche delle aziende nel settore bancario delle linee cellulari e nella produzione di virus aderenti.
Divulgazioni
P.J., A.B., R.L. e J.N. sono dipendenti di Thermo Fisher Scientific. A.L. e S.O. non hanno conflitti di interesse.
Riconoscimenti
Gli autori desiderano riconoscere il sostegno del finanziamento Industry Alignment Fund Pre-Positioning (IAF-PP) (H18/01/a0/021 e H18/AH/a0/001) di A * STAR, Singapore.
Materiali
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
Riferimenti
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24(2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664(2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320(2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565(2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472(2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20(2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811(2020).
- Chen, A. K. -L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A. Engineering Strategies for Regenerative Medicine. Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. , Academic Press. Cambridge, MA. 33-71 (2020).
- Tsai, A. -C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96(2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654(2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921(2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465(2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, Supplement 101(2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423(2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34(2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon