Method Article
Traitement des cellules souches mésenchymateuses humaines pour des applications cliniques à l’aide d’un flux de travail semi-automatisé fermé
Dans cet article
Résumé
Ici, nous présentons un protocole pour récolter les cellules adhérentes des flacons multicouches de manière semi-automatisée fermée à l’aide d’un système de centrifugation à contre-courant. Ce protocole peut être appliqué pour récolter à la fois des cellules adhérentes et des cellules en suspension à partir d’autres plates-formes d’expansion cellulaire avec peu de modifications aux étapes existantes.
Résumé
Les cellules souches mésenchymateuses humaines (CSMh) sont actuellement explorées en tant que modalité thérapeutique cellulaire prometteuse pour diverses maladies, avec d’autres approbations de mise sur le marché pour une utilisation clinique attendues au cours des prochaines années. Pour faciliter cette transition, il est essentiel de s’attaquer aux goulots d’étranglement liés à l’échelle, à la reproductibilité d’un lot à l’autre, au coût, à la conformité réglementaire et au contrôle de la qualité. Ces défis peuvent être relevés en fermant le processus et en adoptant des plates-formes de fabrication automatisées. Dans cette étude, nous avons développé un processus fermé et semi-automatisé pour le passage et la récolte des hMSC dérivés de la gelée de Wharton (WJ-hMSC) à partir de flacons multicouches à l’aide de la centrifugation à contre-courant. Les CSMhMS WJ ont été étendues en utilisant un milieu sans sérum sans sérum (SFM XF) conforme à la réglementation, et elles ont montré une prolifération cellulaire (doublement de la population) et une morphologie comparables à celles des CSE-WJ développées dans des milieux contenant du sérum classiques. Notre protocole de récolte semi-automatisé fermé a démontré une récupération cellulaire élevée (~98%) et une viabilité (~99%). Les cellules lavées et concentrées par centrifugation à contre-flux ont maintenu l’expression du marqueur de surface WJ-hMSC, les unités formant colonie (UFC-F), le potentiel de différenciation trilignée et les profils de sécrétion de cytokines. Le protocole de récolte de cellules semi-automatisé développé dans l’étude peut être facilement appliqué pour le traitement à petite et moyenne échelle de diverses cellules adhérentes et en suspension en se connectant directement à différentes plates-formes d’expansion cellulaire pour effectuer une réduction de volume, un lavage et une récolte avec un faible volume de sortie.
Introduction
Les cellules souches mésenchymateuses humaines (CSMh) sont un excellent candidat pour des applications cliniques, à la fois en génie tissulaire et en thérapies cellulaires, compte tenu de leur potentiel thérapeutique et de leur potentiel élevé d’auto-renouvellement pour se développer in vitro, qui sont essentiels pour générer des doses cliniquement pertinentes de cellules 1,2,3. Selon ClinicalTrials.gov, plus de 1 000 essais cliniques sont actuellement à l’étude pour diverses affectionspathologiques 4. Compte tenu de l’intérêt croissant pour l’utilisation des CSMh, davantage d’essais cliniques et d’autorisations de mise sur le marché sont imminents dans un avenir proche 5,6. Cependant, la fabrication des CSMh présente de nombreux défis inhérents en termes de variabilité d’un lot à l’autre, d’utilisation de matières premières à haut risque, de préoccupations concernant la contamination due à de nombreux processus ouverts et manuels, car la fabrication implique des opérations à unités multiples, des coûts de main-d’œuvre plus élevés, le coût de la mise à l’échelle ou de la mise à l’échelle, et les obstacles réglementaires 6,7,8,9,10, 11,12. Ces questions demeurent un obstacle important à l’accès actuel et futur aux marchés.
Le développement de solutions de fabrication fermées, modulaires et automatisées et l’utilisation de réactifs auxiliaires à faible risque permettraient de relever ces défis. Cela garantirait également une qualité constante des produits, réduirait la probabilité de défaillances des lots dues à une erreur humaine, réduirait les coûts de main-d’œuvre et améliorerait la normalisation des processus et la conformité réglementaire, par exemple en termes de tenue de registres numériques des lots 8,12,13,14. Pour pouvoir obtenir un dosage cliniquement pertinent de cellules, qu’il s’agisse d’une fabrication autologue ou allogénique, une fabrication rationalisée impliquant une expansion cellulaire en amont et un traitement en aval de manière fermée et automatisée est cruciale.
Pour l’expansion des hMSC en amont, les deux méthodes de fabrication les plus couramment utilisées actuellement sont le scale-out (monocouche 2D) et le scale-up (système de suspension 3D à base de microporteur)15,16,17,18. La méthode la plus traditionnelle et la plus largement adoptée pour l’expansion hMSC est la culture monocouche 2D en raison du faible coût de production et de la facilité de configuration19.
Des flacons multicouches composés de plateaux à surface plane empilés dans un récipient de culture sont couramment utilisés pour augmenter la production de hMSC. Ces systèmes sont généralement livrés dans des récipients de culture de 1 à 40 couches20 et sont manipulés manuellement à l’intérieur des armoires de biosécurité. Les étapes de traitement pendant le passage et la récolte des cellules impliquent la distribution et la décantation manuelles du milieu d’expansion, du réactif de dissociation et du tampon de lavage par pipetage ou inclinaison physique de l’ensemble du récipient. En outre, la manipulation de plusieurs unités est difficile et prend beaucoup de temps en raison de leur taille et de leur poids.
Par la suite, la post-récolte à partir de flacons multicouches, la centrifugation pour l’échange de fluides, le lavage des cellules et la réduction du volume sont des étapes essentielles tout au long du flux de travail de fabricationdes cellules 21. La centrifugation conventionnelle de paillasse est un processus principalement ouvert et manuel qui implique une multitude d’étapes, telles que le transfert de la suspension cellulaire dans des tubes ou des bouteilles coiffés à l’intérieur d’une armoire de biosécurité, la rotation des cellules, l’aspiration manuelle du surnageant, la remise en suspension des cellules avec le tampon et les lavages répétés des cellules. Cela augmente considérablement à la fois le risque de contamination due à l’ouverture et à la fermeture des bouchons et les risques de perte de la pastille cellulaire pendant le processus d’aspiration manuelle / pipetage22. Dans le contexte de la manipulation de systèmes de culture multicouches pour les cellules à base d’adhérents telles que les CSMh, l’opérateur devrait passer par un processus laborieux de navette entre la centrifugeuse et l’armoire de biosécurité à plusieurs reprises et de manipulation simultanée d’une unité lourde. Ces étapes manuelles sont laborieuses, présentent des risques en termes d’erreurs humaines et de contamination, et doivent être effectuées dans un environnement de salle blanche de classe B, ce qui est coûteux23. De plus, le processus de centrifugation manuelle conventionnel n’est pas évolutif et pourrait provoquer un cisaillement cellulaire et un stress; Ainsi, maximiser la récupération cellulaire, la viabilité et l’efficacité de lavage des impuretés résiduelles sont d’autres défis majeurs22. La fabrication commerciale de thérapies cellulaires à l’échelle cGMP nécessite des solutions d’automatisation modulaires fermées pour réduire le risque de contamination, assurer une qualité constante des produits, réduire les coûts de main-d’œuvre et de production et augmenter la fiabilité des processus24,25. Les flacons multicouches peuvent être manipulés comme un système fermé en ayant un filtre stérile de 0,2 μm dans l’un des orifices pour faciliter l’échange de gaz stérile et un deuxième orifice connecté de manière aseptique via des connecteurs ou soudé directement à un instrument de traitement automatisé des cellules pour la récolte des cellules. Nous avons travaillé à la fermeture et à l’automatisation de la plupart des étapes du passage et de la récolte WJ-hMSC en évaluant une centrifugeuse à contre-courant fermée innovante destinée à la fabrication de produits à base de cellules, de gènes ou de tissus. Cette centrifugeuse à contre-courant a également la flexibilité nécessaire pour effectuer une variété d’applications de traitement cellulaire, telles que la séparation cellulaire basée sur la taille, l’échange milieu/tampon, la concentration et la récolte pour une variété de types cellulaires 8,26,27,28. L’instrument utilise un kit fermé à usage unique qui peut être connecté stérile à l’aide de soudage de tubes ou de connecteurs aseptiques pour transférer des sacs ou peut être connecté directement à n’importe quelle plate-forme d’expansion de votre choix.
Dans cette étude, nous avons conçu un ensemble de tubes sur mesure pour permettre des connexions stériles fermées entre le kit de centrifugation à contre-courant à usage unique et le ballon multicouche. Nous avons optimisé un protocole pour détacher, laver et récolter par voie enzymatique les CME-WJ du flacon multicouche de manière entièrement fermée et semi-automatisée en une seule fois. Les CSE-WJ-hMSC récoltées ont été caractérisées pour leur pureté (analyse des marqueurs de surface) et leur puissance (UFC-F, différenciation trilignée et profils de sécrétion de cytokines) afin de s’assurer que le produit final répondait aux attributs de qualité critiques (AQC) pour la libération des lots.
Protocole
1. Préparation des milieux de culture et revêtement des récipients de culture
- Préparation des médias
- Composition du milieu contenant du sérum classique : Préparer le milieu contenant du sérum classique en mélangeant de l’αMEM (445 mL), du sérum fœtal bovin (FBS) (50 mL) et 100x de la pénicilline-streptomycine (5 mL).
- Préparez le support SFM XF complet.
- Fabriquer une bouteille de 500 mL en ajoutant de façon aseptique 5 mL de supplément SFM XF (100x) et 5 mL de 100x de L-alanyl-L-glutamine (voir Tableaux des matières) au milieu basal SFM XF (500 mL).
- Fabriquez un sac média de 2 L en ajoutant de façon aseptique 20 mL de supplément personnalisé MSC SFM XF (100x) et 20 mL de 100x de L-alanyl-L-glutamine (voir les tableaux des matières) au sac moyen basal SFM XF (2 L) en connectant une seringue de 50 ml au port approprié du sac.
REMARQUE: Avant d’utiliser en culture, ajouter des facteurs de croissance ou des cytokines (non fournis avec le milieu) au milieu SF XF complet: PDGF-BB (20 ng / mL), FGF basique (4 ng / mL) et TGFβ (0,5 ng / mL).
- Enrobage des vaisseaux de culture cellulaire avec de la vitronectine pour une utilisation avec des milieux sans sérum
- Décongeler un stock de vitronectine (VTN-N; 0,9 mg/mL) à 4 °C.
- Utilisez la solution saline tamponnée stérile de Dulbecco sans calcium ni magnésium (DPBS) pour diluer le VTN-N décongelé à une concentration de travail de 5 μg/mL.
NOTE: Diluer le VTN-N immédiatement avant utilisation et ne pas conserver la solution de vitronectine diluée. - Ajouter 1 mL/10cm2 de la solution diluée de VTN-N dans le récipient de culture correspondant; La concentration finale est de 0,5 μg/cm2. Par exemple, ajouter 7,5 mL de solution de VTN-N diluée dans une fiole de T-75 (75 cm2); ajouter 17,5 mL de solution de VTN-N diluée dans une fiole de T-175 (175cm2); ajouter 250 mL de solution de VTN-N diluée dans une fiole multicouche étalon à quatre couches (2 528cm2); et ajouter 630 mL de solution de VTN-N diluée dans une fiole multicouche à 10 couches (6 320cm2).
- Dans des conditions stériles, incuber les récipients pendant 1 h à température ambiante (RT).
NOTE: Le récipient de culture enrobé peut être conservé à 4 ° C jusqu’à 1 semaine. Enveloppez le récipient de culture avec un film de laboratoire pour éviter qu’il ne se dessèche. Avant utilisation, préchauffer le récipient de culture à température ambiante pendant au moins 1 h. - Aspirer la solution de VTN-N, jeter et ajouter immédiatement un volume suffisant de milieu de culture pour empêcher la surface du récipient revêtu de sécher.
REMARQUE : Il n’est pas nécessaire de rincer le récipient de culture après le retrait du VTN-N.
2. Expansion WJ-hMSC
- Décongeler rapidement les CSE-WJ (p2) en plaçant le cryovial dans un bain-marie à 37 °C; Remuer lentement le flacon jusqu’à ce que le contenu commence à décongeler.
- Après décongélation, ensemencer les CSMh-WJ à 5 000 cellules/cm2 dans une fiole T-175 (sans revêtement VTN-N) et incuber dans le milieu contenant du sérum classique à 37 °C dans une atmosphère humidifiée de 5 % de CO2 pour la dilatation cellulaire. Après deux passages (p4), mettre en banque les cellules expansées dans le milieu de cryoconservation souhaité en tant que banque de cellules de travail (WCB).
- Effectuer le comptage des cellules à l’aide d’un compteur de cellules automatisé suivant la méthode de viabilité et de comptage des cellules pour déterminer le nombre total de cellules, la viabilité cellulaire et la tailledes cellules 29.
- À partir de p4, cultiver les CSMh WJ-à 5 000 cellules/cm2 dans des flacons T-75 dans un milieu contenant du sérum classique ou un milieu SFM XF (utiliser des flacons revêtus de VTN-N avec un milieu SFM XF).
- Maintenir les cellules dans les deux milieux de culture pendant un total de trois passages (12 jours) et mesurer l’expansion cellulaire (augmentation du pli) à chaque passage en divisant le nombre de cellules viables comptées à la fin de la culture de chaque passage par le nombre de cellules viables au début de la culture (jour de l’ensemencement cellulaire).
3. Expansion de la mise à l’échelle du train de démarrage
- Expansion WJ-hMSC dans une fiole T-175
- Décongeler rapidement les CSMh-WJ à p4 en plaçant le cryovial dans un bain-marie à 37 °C; Remuer lentement le flacon jusqu’à ce que la solution commence à décongeler.
- Ensemencer 5 000 cellules/cm2 dans une fiole de T-175 revêtue de VTN-N. Laisser les cellules se développer dans un incubateur à 37 °C avec 5% de CO2.
- Remplacez le milieu de culture usé tous les 2-3 jours par un milieu SFM XF complet préchauffé fraîchement préparé pour une performance et une croissance cellulaire optimales.
- Manipulation des flacons multicouches (Figure 1A, B)
- Toutes les connexions aseptiques doivent être effectuées dans un environnement stérile.
- Déballez la fiole multicouche dans une enceinte de sécurité biologique.
- Connectez le filtre à air préstérilisé (0,2 μm) à un orifice pour permettre la libération de la pression pendant le transfert de fluide à l’aide de la centrifugeuse à contre-courant.
- Placez le connecteur de flacon multicouche du jeu de tubes personnalisé dans l’autre orifice (Figure 1B).
- Souder la ligne PVC du tubing personnalisé au sac de transfert en PVC de 2 L contenant le milieu SFM XF complet.
REMARQUE: Mélangez complètement le sac moyen avant de l’ajouter au système multicouche par gravité. Assurez-vous que le sac de transfert en PVC est suspendu plus haut que le flacon multicouche. - Placer la fiole multicouche sur son côté long, avec le filtre à air en haut (figure 1B).
- Ouvrez la pince sur le tube en PVC pour commencer à remplir le ballon multicouche. Assurez-vous que le milieu est de niveau entre les plateaux pendant le remplissage.
- Une fois que le milieu s’est complètement stabilisé dans tous les plateaux, tournez le ballon multicouche sur son côté court avec les orifices à la verticale.
- Fermez la pince sur la ligne en PVC et retirez le sac de transfert en remplaçant le raccord du tube par le bouchon de fermeture bleu MPC.
REMARQUE: Ne retirez pas le filtre à air, car cela permet l’échange de gaz pendant l’expansion de la cellule. - Tourner la fiole multicouche en position d’incubation.
REMARQUE: Le filtre et le raccord de tuyauterie doivent être orientés vers le haut. - Vider la fiole multicouche en la connectant à un flacon d’aspirateur; Placez-le au-dessus du flacon de l’aspirateur et le liquide s’écoulera.
NOTA: Incliner la fiole multicouche sur le côté pour vider complètement le milieu usé par gravité. Alternativement, le milieu usé peut être versé dans une bouteille de déchets à l’aide d’un ensemble de tubes personnalisé. - Répétez les étapes 3.2.5-3.2.11 pour reconstituer le milieu frais.
- Sous-culture des CSM-WJ dans le ballon multicouche (T-175 > 4 couches > 10 couches)
- Réactif de dissociation cellulaire pré-chaud (TrypLE) et milieu SFM XF complet dans un incubateur à 37 °C avant utilisation.
- Aspirer le milieu usagé du ballon T-175 et le jeter.
- Lavez la monocouche cellulaire avec du DPBS préchauffé, aspirez et jetez-la.
- Ajouter TrypLE à chaque fiole, assurer une couverture complète de la monocouche cellulaire et incuber pendant 5 à 10 minutes à 37 °C.
- Transférer la suspension dans un tube conique stérile de 50 mL.
- Centrifuger le tube à 100-200 x g pendant 5 min à TA. Aspirer et jeter le DPBS, et faire attention à ne pas déranger la pastille de cellule.
- Resuspendre la pastille de cellule dans un volume minimal (10 mL) de milieu SFM XF complet préchauffé pour le comptage des cellules.
- Remplir un récipient de culture à quatre couches revêtu de VTN-N avec environ 800 mL de milieu SFM XF complet, tel que mentionné à la section 2 ci-dessus. Ajouter 5 000 cellules/cm2 (c.-à-d. 1,26 x 107 cellules viables/fiole). Remuez doucement la suspension cellulaire pour assurer une répartition uniforme.
- Incuber dans un incubateur à 37 °C avec 5% de CO2 dans une atmosphère humidifiée.
- Remplacer le milieu de culture usé tous les 2-3 jours par un milieu SFM XF complet frais et préchauffé pour une croissance cellulaire optimale jusqu’à ce que les cellules atteignent une confluence de 60 % à 80 % ou soient prêtes à être sous-cultivées dans le flacon multicouche à 10 couches.
- Remplir une fiole multicouche à 10 couches revêtue de VTN-N avec environ 2 L de milieu SFM XF complet, comme mentionné au point 2. Ajouter 5 000 cellules/cm2 (c.-à-d. 3,1 x 107 cellules/fiole). Remuez doucement la suspension cellulaire pour assurer une répartition uniforme.
- Incuber dans un incubateur à 37 °C avec 5% de CO2 dans une atmosphère humidifiée.
- Remplacez le milieu de culture usé tous les 2-3 jours par un milieu SFM XF complet frais et préchauffé pour une croissance cellulaire optimale jusqu’à ce que les cellules atteignent 60%-80% de confluence ou soient prêtes à être récoltées.
4. Dissociation et récolte WJ-hMSC semi-automatisées fermées à l’aide d’une centrifugation à contre-courant fermée
- Ensemble kit de centrifugation à contre-courant à usage unique
- Connectez le kit à usage unique aux sacs de transfert en PVC à usage unique par soudage de tubes, similaire à la configuration illustrée à la figure 1A.
REMARQUE : Le débit par défaut de la trousse à usage unique est de 30 à 165 mL/min. - Fixer une fiole multicouche à 10 couches contenant des CSMh WJ confluentes à l’ensemble de tubes personnalisés à l’intérieur d’une enceinte de biosécurité.
- Transférer le récipient de culture à 10 couches attaché avec l’ensemble de tubes personnalisés sur un banc et souder à la ligne E (3/32 po en PVC ID) du kit à usage unique, comme illustré à la figure 1B.
- Assurez-vous de souder un orifice d’échantillonnage stérile à la ligne G de la trousse à usage unique à haut débit.
- Ensuite, connectez la ligne H de récolte à un Luer stérile muni d’une seringue de 50 mL.
REMARQUE: Dans toutes les étapes ci-dessus, assurez-vous que les pinces manuelles sont fermées pour sécuriser le liquide dans chaque sac de kit.
- Connectez le kit à usage unique aux sacs de transfert en PVC à usage unique par soudage de tubes, similaire à la configuration illustrée à la figure 1A.
- Configuration de la course de l’instrument
- Allumez l’instrument en allumant l’interrupteur à bascule à l’arrière de l’instrument.
- Connectez l’ordinateur portable au port USB-C de l’instrument à l’aide du câble USB-C fourni (Figure 1B).
- Exécutez le logiciel d’interface utilisateur graphique (GUI) de la centrifugeuse à contre-courant à partir du bureau ou du menu Démarrer.
- Après vous être connecté, chargez le protocole en cliquant sur le bouton Sélectionner un protocole sur la page d’accueil principale.
REMARQUE : Le protocole de collecte par centrifugation à contre-courant (Tableau 1) a été créé à l’aide du logiciel Protocol Builder et stocké localement. - Appuyez sur le bouton de déverrouillage bleu de l’instrument et ouvrez la porte vitrée.
- Chargez le kit à usage unique assemblé sur le système de centrifugation à contre-courant.
- Commencez par suspendre les sacs suspendus à des crochets de suspension dans l’ordre qui les aligne le mieux avec les orifices de tube sur les bandes de capteurs à bulles, avec le flacon multicouche à 10 couches placé à un angle, comme illustré à la figure 1B.
- Alignez le kit avec les deux boutons d’emplacement du kit, étirez le tube de pompe autour de la pompe péristaltique et appuyez sur le connecteur blanc en forme d’ampoule .
REMARQUE: Assurez-vous que le tuyau au-dessus du capteur de pression est correctement placé dans le rail de tuyauterie. - Fixez la chambre de centrifugation en soulevant le levier argenté du support de la chambre de centrifugeuse à contre-courant et en le fixant en remettant le levier en position verticale.
- Appuyez sur le tube de chaque port du kit dans les rails le long des bandes de capteur à bulles.
REMARQUE: Assurez-vous que les sacs ne sont pas emmêlés afin que le processus de protocole puisse être facilement suivi. - Fermez la porte en appuyant sur le loquet de la porte.
REMARQUE: Le bras de serrage de la pompe se fermera, la chambre de centrifugeuse tournera et les vannes se fermeront. Sans fermer la porte, le système ne sera pas en mesure de lancer et d’exécuter le protocole. - Appuyez sur le bouton Initier de l’interface graphique. Une liste de contrôle apparaîtra; Les quatre premiers éléments sont des vérifications d’instruments, et les deux derniers éléments sont des vérifications de l’utilisateur (assurez-vous que les sacs et les connexions correspondent à l’image du kit et que les pinces manuelles sont ouvertes).
REMARQUE: Pour les vérifications d’instruments, des X rouges au lieu de coches bleues sont affichés si quelque chose ne va pas. - Appuyez sur Confirmer pour afficher l’écran des entrées de protocole.
- Définissez la valeur de la boîte de dialogue Saisie de données (Volume de récolte) sur 45 mL, puis appuyez sur Confirmer.
Remarque : L’écran d’entrée de protocole sera invité si des entrées de données variables sont définies dans le protocole créé par l’utilisateur. Le volume de récolte est défini comme une variable dans ce protocole, et l’utilisateur peut choisir de tester différents volumes en fonction des exigences finales en matière de densité cellulaire. Le volume minimum de récolte autorisé par le système est de 5 mL. Le système permet de définir un maximum de seulement quatre variables de données pour chaque protocole.
- Exécution du protocole
- Cliquez sur Lancer dans l’interface graphique et appuyez sur le bouton vert Start de l’instrument pour démarrer l’exécution du protocole ( reportez-vous au Tableau 1).
REMARQUE: Le système lancera les étapes selon le protocole en commençant par la séquence d’amorçage en remplaçant l’air dans le système par un tampon. - Une fois l’amorçage terminé (tableau 1, étape 8), assurez-vous que le milieu usé est complètement pompé dans le sac à déchets.
REMARQUE : Une fois que le flacon multicouche à 10 couches est vide, le système invite l’utilisateur dans l’interface graphique à confirmer si le récipient est vide. Appuyez sur le bouton « Skip » de l’instrument si le navire est vide; sinon, appuyez sur le bouton vert « Lecture/Pause » pour continuer à évacuer les liquides résiduels du récipient. - Lors des étapes 15, 19 et 22 de la pause (tableau 1), assurez-vous de soulever le ballon multicouche et de le secouer pour répartir le tampon de manière égale sur tous les plateaux. Une fois terminé, remettre le ballon multicouche à 10 couches dans sa position de tirage initiale pour les étapes suivantes.
NOTA : Pour l’étape 19 du tableau 1 seulement, après agitation, assurez-vous de placer la fiole multicouche à plat et d’incuber pendant 10 à 15 minutes à TA pour dissocier les cellules. - Aux étapes 20 et 23 (tableau 1), assurez-vous que les cellules trypsinisées sont complètement transférées dans le sac intermédiaire.
- Bien mélanger le sac intermédiaire manuellement à l’étape 25 (tableau 1).
- À l’étape 26 (tableau 1), utilisez une seringue Luer de 2 mL pour prélever des échantillons à travers l’orifice d’échantillonnage.
REMARQUE: Il est recommandé d’échantillonner au moins trois fois pour un nombre de cellules précis. - Aux étapes 29 et 30 (tableau 1), vérifier la formation stable du lit cellulaire fluidisé; il devrait être semblable au lit cellulaire fluidisé, comme le montre la figure 1C.
REMARQUE : Si le lit cellulaire fluidisé stable n’est pas formé de manière similaire à celle illustrée à la figure 1C, il est essentiel d’optimiser le rapport entre la force g et le débit (G/F) pour obtenir un lit cellulaire fluidisé stable (récupération élevée des cellules) dans la chambre pendant les étapes de chargement et de lavage de la cellule. Le rapport G/F dépend de la taille des cellules et de la densité du milieu. Un rapport G/F élevé est nécessaire pour un tampon d’échantillon/lavage à haute densité, tandis qu’un faible rapport G/F peut être utilisé pour un tampon d’échantillon/lavage à faible densité. - L’exécution est terminée à l’étape Ramp to Stop (étape 35 dans le tableau 1) et toutes les valeurs de pincement sur le système de centrifugation à contre-courant se fermeront automatiquement.
REMARQUE: Enfin, assurez-vous que les pinces manuelles sont fermées pour sécuriser le liquide dans chaque sac de kit avant d’ouvrir la porte. - Une fois l’exécution du protocole terminée, appuyez sur le bouton de déverrouillage bleu de l’instrument et ouvrez la porte vitrée. Sortez de l’instrument le kit à usage unique contenant le concentré récolté.
- Sceller de manière aseptique la chaîne de récolte à l’aide d’un scellant tubulaire à main. Transférez soigneusement la seringue scellée remplie de la récolte de cellules concentrées dans l’enceinte de sécurité biologique pour le comptage et la cryoconservation des cellules.
- Détachez à nouveau la chambre à l’aide du levier, retirez le connecteur de l’ampoule de son raccord et soulevez délicatement le kit et jetez-le dans un sac contre les risques biologiques.
- Nettoyez l’instrument à l’aide de lingettes à l’éthanol et assurez-vous de fermer la porte.
- Fermez d’abord l’application GUI avant d’éteindre l’interrupteur à l’arrière de l’instrument.
REMARQUE : Le protocole de prélèvement cellulaire a été testé en triple exemplaire biologique (n = 3).
- Cliquez sur Lancer dans l’interface graphique et appuyez sur le bouton vert Start de l’instrument pour démarrer l’exécution du protocole ( reportez-vous au Tableau 1).
5. Évaluation des attributs de qualité critiques (AQC)
- Marqueurs de surface de l’identité cellulaire (CD73, CD90 et CD105) et marqueurs non stromaux (CD34 et CD45)
- Diluer la suspension cellulaire WJ-hMSC récoltée à une concentration de 1 x 106 cellules viables/mL en ajoutant un volume approprié de tampon de cytométrie en flux (DPBS avec 1% BSA ou FBS 2%).
- Ajouter 100 μL de suspension cellulaire à chaque tube de microcentrifugation ou plaque de 96 puits. Assurez-vous qu’un minimum de 0,1 x 106 cellules sont présentes par 100 μL de suspension cellulaire.
- Ajouter l’anticorps conjugué au fluorophore à l’échantillon à une dilution appropriée, tel que recommandé par le fournisseur d’anticorps.
- Incuber pendant 20 min dans l’obscurité.
- Après l’incubation, ajouter 100 μL de tampon de cytométrie en flux pour laver les échantillons par centrifugation à 380 x g pendant 3 min.
- Jetez le surnageant, en laissant la pastille derrière.
- Resuspendre la pastille cellulaire dans 200 μL de tampon de cytométrie en flux, et sous réserve d’une analyse de cytométrie en flux30.
- Dosage fibroblastique des unités formant colonies (UFC-F)
- Diluer la suspension cellulaire à une concentration de 1 000 cellules viables/mL de milieu de culture complet.
- Plaque ~500 cellules par puits dans une plaque de culture tissulaire à 6 puits dans un milieu de culture complet.
- Incuber pendant 10 à 14 jours à 37 °C dans du CO2 humidifié à 5 %, laver avec du PBS et colorer avec du violet cristallin à 0,5 % dans du méthanol pendant 30 min à TA.
- Énumérez les colonies dans chaque puits.
- Calculer l’efficacité de l’UFC-F : Divisez le nombre de colonies formées par le nombre d’ensemencement initial pour obtenir le pourcentage d’efficacité de la formation des colonies et exprimez-le en pourcentage.
- Potentiel de différenciation de la trilignée
- Ensemencer 5 x 103 cellules/cm2 dans un milieu de différenciation de l’ostéogenèse et de l’adipogenèse dans des plaques à12 puits, conformément au protocole du fabricant. Pour la chondrogenèse, préparer 1,6 x 107 cellules viables/mL et générer des cultures de micromasse en ensemençant 5 μL de gouttelettes de la solution cellulaire au centre des puits de plaques de 96 puits, conformément au protocole du fabricant.
- Pendant la différenciation, effectuez des changements de milieu complets tous les 3-4 jours.
- Après 14 jours (pour l’adipogenèse) ou 21 jours (pour l’ostéogenèse et la chondrogenèse), surveiller les cultures pour la différenciation en utilisant des colorations biologiques spécifiques à la lignée conformément au protocole du fabricant. Pour la différenciation adipogénique, colorer les cultures avec une solution d’Oil Red O à 0,5%. Pour l’ostéogenèse, effectuer une coloration en utilisant une solution de rouge d’alizarine à 2%. Pour la différenciation chondrogénique, colorer les granulés de micromasse avec 1% de bleu d’Alcian.
- Profils de sécrétion de cytokines
- Décongeler les cellules cryoconservées récoltées manuellement ou à l’aide du système de centrifugation à contre-courant, et ensemencer 5 000 cellules/cm2 dans une fiole T-175 avec un milieu SFM XF.
- Après 4 jours, prélever le milieu de culture usé et le conserver à −80 °C jusqu’à analyse.
- Quantifier l’expression des cytokines à l’aide d’un kit de panel 19-plex profils d’expression de cytokines sur un lecteur multiplex.
- Effectuer les immunoessais multiplex conformément aux recommandations du fabricant.
Résultats
La banque de cellules maîtresses (MCB) WJ-hMSC après décongélation a été maintenue pendant trois passages successifs (p1-p4) dans un milieu classique contenant du sérum pour produire suffisamment de banques de cellules fonctionnelles (CAT) pour les expériences. Les WCB p4 ont été décongelées et dilatées dans un milieu contenant du sérum et dans un milieu SFM XF pour trois autres passages (p4-p7) dans les flacons T-175. Les CSM-WJ se sont bien adaptées lorsqu’elles ont été étendues en milieu SFM XF et ont pu maintenir une prolifération stable similaire à celle en milieu contenant du sérum (Figure 2A). Cependant, les cellules dilatées dans le milieu SFM XF présentaient une morphologie en forme de fuseau légèrement plus longue en forme de fibroblaste, ce qui a entraîné une taille de cellule légèrement plus grande (Figure 2B) d’une moyenne de ~17 μm par rapport à ~15 μm dans un milieu contenant du sérum. Dans les deux conditions moyennes sur les trois passages, les CSE-WJ-hMSC ont systématiquement atteint leur densité cellulaire maximale de ~2,3 x 104 cellules/cm2 et un temps de doublement de la population de ~34 h (Figure 2C,D).
Pour le développement à grande échelle des CSW-hMSC dans un système fermé, nous avons effectué une expansion du train de semences de CSW-hMSC d’abord dans une fiole à 4 couches, puis dans une fiole multicouche à 10 couches. À environ 80%-90% de confluence après 4 jours de culture, nous avons récolté 9,6 x 10 7 ± 0,9 x 107 et 2,3 x 10 8± 0,2 x 108 cellules pour les piles à 4 couches et 10 couches, respectivement. Une densité cellulaire plus élevée de 3,6 x 10 4-3,8 x 104 cellules/cm2 a été atteinte par rapport aux flacons T-175, ce qui signifie que les piles ont permis une meilleure expansion cellulaire jusqu’à sept fois.
De plus, les WJ-hMSC élargis dans des récipients de culture à 10 couches ont été récoltés directement par centrifugation à contre-courant. La connexion stérile au kit à usage unique a été facile à établir pour le transfert direct de fluide à un débit maximal de 165 mL/min à l’aide de la pompe péristaltique de l’instrument. Le processus de récolte de cellules semi-automatisé a été réalisé en récoltant d’abord les cellules par dissociation enzymatique, en chargeant les cellules dans la chambre à contre-courant pour la réduction du volume et la concentration, puis en les lavant avec un tampon de lavage, qui était environ 3 fois le volume de la chambre de centrifugation à contre-courant. De plus, les cellules lavées ont ensuite été concentrées et récoltées au volume de récolte souhaité prédéfini dans le protocole. Les étapes de traitement utilisées pour le traitement semi-automatisé des cellules ont été conçues pour émuler le flux de travail de récolte manuelle. Nous avons réussi à diviser par 10 le volume, ce qui a permis de générer des concentrations cellulaires pouvant atteindre 5,3 millions de cellules/mL. Le protocole a permis d’atteindre une récupération cellulaire élevée à ~98% et une viabilité cellulaire élevée à ~99% de manière constante pour les trois exécutions indépendantes (Figure 3A-C).
Nous avons effectué des tests approfondis de caractérisation cellulaire pour déterminer les attributs de qualité critiques de la récolte cellulaire en utilisant la centrifugation à contre-flux par rapport à la centrifugation manuelle. Pour tester l’identité des WJ-hMSCs, les marqueurs de surface cellulaire ont été analysés par cytométrie en flux. Comme le montre la figure 4A, les CSM-WJ récoltées à l’aide des deux méthodes présentaient des profils de marqueurs de surface caractéristiques selon la réglementation ISCT, une expression positive de CD73, CD90 et CD105, ainsi qu’une expression négative de CD34 et CD45. Ensuite, pour évaluer le potentiel clonogène des CSM-WJ, des dosages CFU-F ont été effectués. Comme le montre la figure 4B, les cellules prélevées par centrifugation à contre-courant présentaient un potentiel UFC-F similaire à celui des cellules récoltées par centrifugation manuelle (21 % ± 1 % contre 20 % ± 1 %, respectivement). De plus, comme le montre la figure 4C, les cellules récoltées par centrifugation post-contre-flux ont conservé la capacité de se différencier en adipocytes, ostéoblastes et chondrocytes similaires aux cellules de la méthode de centrifugation manuelle. Enfin, nous avons étudié 18 profils de sécrétion de cytokines différents des cellules à l’aide d’immunoessais multiplex. Comme le montre la figure 4D, les cellules lavées et concentrées à l’aide de la centrifugation post-contre-flux ont maintenu les profils de sécrétion de cytokines, et les profils étaient comparables à ceux de l’échantillon prélevé avant le lavage/concentration des cellules (centrifugation pré-contre-flux).
Dans l’ensemble, nous avons démontré une expansion efficace de hMSC dans un système de culture SFM XF, et les cellules lavées et concentrées à l’aide du système de centrifugation à contre-courant automatisé fermé ont permis une récupération cellulaire et une viabilité élevées après le lavage et pourraient maintenir leur phénotype et leur fonctionnalité. Le processus semi-automatisé fermé développé dans cette étude peut fournir une uniformité de la qualité du produit en termes de récupération finale WJ-MSC, comme en témoignent trois essais indépendants.

Figure 1 : Configuration et assemblage de kits à usage unique à haut débit pour la récolte, le lavage et la concentration des CSM. (A) Schéma du kit une fois que les sacs ont été connectés conformément aux tubes respectifs. (B) Le ballon multicouche à 10 couches relié au kit à usage unique à haut débit avec l’ensemble de tubes personnalisés. (C) Visualisation du lit cellulaire fluidisé stable formé dans la chambre à contre-courant à l’aide de la fonction caméra activée dans l’interface utilisateur graphique du logiciel de centrifugation à contre-courant. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Comparaison de la morphologie cellulaire et de l’expansion des CSMh en milieu contenant du sérum et en milieu SFM XF. (A) La morphologie cellulaire représentative des CSMh en milieu sérique classique et en milieu SFM XF. Les cellules expansées SFM XF présentaient une morphologie plus longue, en forme de fuseau, caractéristique semblable à celle d’un fibroblaste, tandis que les cellules cultivées dans un milieu contenant du sérum présentaient une morphologie plus aplatie. (B) La taille moyenne des CSM entre le milieu contenant du sérum et le milieu SFM XF, mesurée par un compteur de cellules automatisé (n = 3). Il est clair que les cellules expansées SFM XF étaient généralement plus grandes que les cellules expansées au sérum à travers différents passages. Le rendement cellulaire total dans différents passages (n = 3) (C) en termes de cellules par surface de culture et (D) niveaux de doublement de la population. Des niveaux similaires de rendement cellulaire ont été obtenus entre le milieu SFM XF et le milieu contenant du sérum à travers différents passages. Les données sont exprimées sous forme de moyenne ± écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Caractérisation des cellules traitées à l’aide du système de centrifugation à contre-courant. (A) Total des cellules viables avant et après le lavage et concentration. (B) Une réduction de volume de 10 fois a été obtenue après le traitement par centrifugation à contre-courant. (C) Récupération totale et viabilité des cellules. La moyenne des données est calculée sur trois répétitions biologiques (n = 3) des cycles de lavage et de concentration. Les données sont exprimées sous forme de moyenne ± d’écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
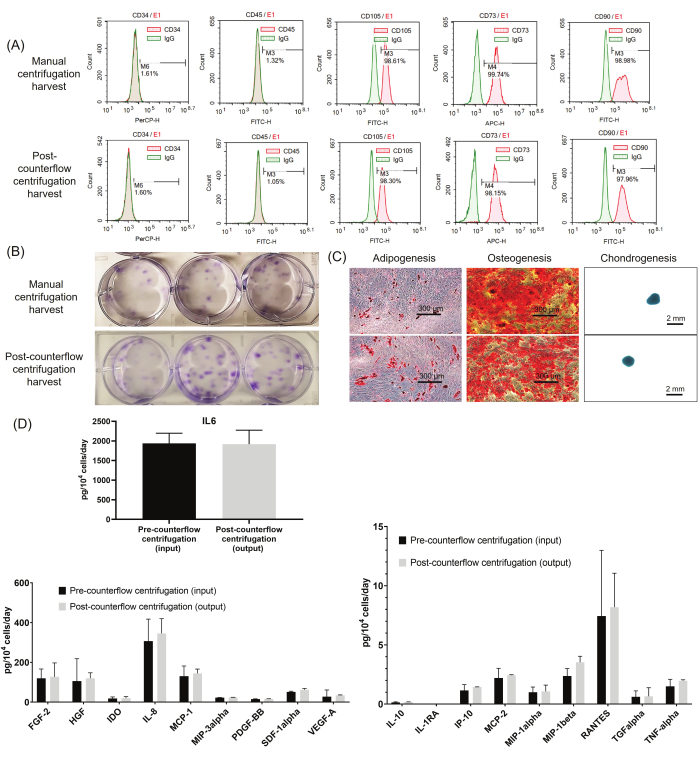
Figure 4 : Analyse des attributs de qualité critiques. (A) Données représentatives de la cytométrie en flux. (B) Images représentatives montrant l’UFC totale. (C) Images microscopiques représentatives de la différenciation trilignée. (D) Résultats de l’analyse de l’expression des cytokines avant et après le traitement des cellules sur le système de centrifugation à contre-courant (n = 3). Les données sont exprimées sous forme de moyenne ± d’écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Séquence de la récolte de hMSC par trypsinisation, lavage et protocole de concentration sur le système de centrifugation à contre-courant, y compris les étapes initiales d’amorçage. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Dans ce travail, nous avons montré la capacité de fermer et de semi-automatiser la dissociation hMSC et de laver et récolter sur le banc à l’aide d’un instrument de centrifugation à contre-courant. L’une des étapes critiques de l’ensemble du flux de travail consiste à s’assurer que les tubes sont connectés conformément au protocole prédéfini défini dans le générateur de protocole du système de centrifugation à contre-courant. La configuration et le fonctionnement sont simples, et le temps nécessaire pour traiter environ 2 L de culture à partir d’un ballon à 10 couches, de l’assemblage du kit à la récolte cellulaire, était d’environ 60 min. L’une des étapes limitantes de ce flux de travail est le transfert de fluide du ballon multicouche aux sacs de transfert connectés à l’instrument de centrifugation à contre-courant. La trousse à usage unique à haut débit ne peut fonctionner qu’à un débit maximal de 165 mL/min, ce qui peut être difficile pour le traitement, par exemple, d’un ballon à 40 couches. Pour accélérer le processus de transfert de fluide, des pompes externes à haut débit peuvent être utilisées pour transférer d’abord le contenu trypsinisé dans un sac de transfert, puis pour laver/concentrer et récolter les cellules du sac de transfert à l’aide du système de centrifugation à contre-courant. De plus, ce protocole peut également être appliqué pour les cellules passagères de flacons multicouches à 4 couches à 10 couches. Plus en amont, le système de centrifugation à contre-courant pourrait également être optimisé pour le lavage des hMSC décongelés et la récolte directe et la formulation moyenne dans des flacons multicouches pour démarrer le train de semences. Il convient de noter que le nombre minimum de cellules nécessaires pour former le lit fluidisé dans la chambre de centrifugation à contre-courant est d’environ 30 millions de cellules, et le volume maximal recommandé à traiter par lot est de 20 L.
À l’heure actuelle, la fixation de l’ensemble de tubes sur mesure au ballon multicouche de l’enceinte de biosécurité et l’autoclavage des parties des composants ne sont pas souhaitables dans un cadre cGMP. Comme alternative, un ensemble de tubes stérilisés aux rayons gamma sur mesure pourrait être sous-traité à des fournisseurs. Les fournisseurs fournissant des flacons multicouches offrent également la possibilité de pré-ajuster les flacons avec les assemblages de tubes souhaités, y compris un filtre de 0,2 μm, et la stérilisation gamma de l’ensemble de l’équipement. Cela garantirait que les flacons multicouches et les tubes fixés sont vraiment fermés, ce qui signifie que le processus pourrait être complété sur le banc dans une salle blanche de classe C.
Ce procédé utilisant le système de centrifugation à contre-courant ne se limite pas aux cellules cultivées à base d’adhérents dans un récipient multicouche et pourrait être adapté aux plates-formes d’expansion de cellules dynamiques (réservoirs agités ou à vagues) et statiques (perméables aux gaz). Plus précisément, pour les hMSC étendus dans des cultures de microporteurs 3D, les protocoles peuvent être optimisés sur le système de centrifugation à contre-courant pour récolter, laver et formuler les hMSC dissociés des microporteurs.
Dans l’ensemble, l’intérêt croissant pour le développement de thérapies cellulaires translationnelles avec une robustesse et une fiabilité de processus améliorées a conduit au développement de plates-formes de traitement cellulaire fermées et automatisées. Ces systèmes sont impératifs, car ils réduisent le nombre d’étapes de manipulation, préviennent la contamination potentielle par des connexions stériles et réduisent les coûts de fabrication en réduisant la main-d’œuvre et en améliorant l’utilisation efficace de l’espace des salles blanches21. Dans cette optique, de nombreux développeurs de produits de thérapie cellulaire qui cherchent à obtenir l’approbation réglementaire pour traduire leurs thérapies sont conscients de l’importance de fermer le processus et de mettre en œuvre une automatisation complète ou une semi-automatisation dès l’étape de développement du processus 14,31,32.
Avec l’utilisation d’un milieu SFM XF respectueux de la réglementation, et avec des réactifs auxiliaires conformes à 21 CFR GMP Part 11 et aux directives internationales de qualité, ce processus semi-automatisé serait facilement adapté à la fabrication clinique. Nous avons montré la reproductibilité du processus fermé et le maintien de la qualité des WJ-MSC. L’amélioration de l’efficacité et de la sécurité de la culture de cellules à base d’adhérents dans des flacons multicouches profiterait non seulement au domaine de la thérapie hMSC, mais aussi aux entreprises de la banque de lignées cellulaires et de la production de virus adhérents.
Déclarations de divulgation
P.J., A.B., R.L. et J.N. sont des employés de Thermo Fisher Scientific. A.L. et S.O. n’ont aucun conflit d’intérêts.
Remerciements
Les auteurs tiennent à remercier le soutien du financement du Fonds d’alignement de l’industrie (IAF-PP) (H18/01/a0/021 et H18/AH/a0/001) de A*STAR, Singapour.
matériels
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
Références
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24(2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664(2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320(2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565(2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472(2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20(2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811(2020).
- Chen, A. K. -L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A. Engineering Strategies for Regenerative Medicine. Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. , Academic Press. Cambridge, MA. 33-71 (2020).
- Tsai, A. -C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96(2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654(2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921(2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465(2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, Supplement 101(2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423(2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34(2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon